莱克多巴胺(ractopamine,RAC)是一种人工合成的肾上腺受体激动剂,在医学上用来治疗心力衰竭症、肌肉萎缩症或者减少脂肪蓄积,并对胎儿和新生儿生长有一定的益处。在动物饲养中能减少动物脂肪累积,使瘦肉增加,改善肉质,同时还使得动物饲料利用率和蛋白质含量得到提高[1-2]。但摄入过量的RAC,人体会出现不同程度的中毒反应,其中毒症状表现为肌肉震颤、四肢麻痹、心动过速、心律失常、腹痛、肌肉疼痛、恶心眩晕等,重者可引发高血压、心脏病甚至危及生命[3-6]。2002年,我国农业部、原卫生部、原国家药品监督管理局联合发布《禁止在饲料和动物饮用水中使用的药物品种目录》(农业部公告第176号)禁止RAC在动物养殖中的使用RAC。俄罗斯和欧洲国家也都禁止RAC作为食品添加剂[7],所以建立RAC的快速测定是非常必要的。
目前,常用于测定RAC的方法主要有气相色谱法(GC)[8],液相色谱法(HPLC)[9-10],气相色谱-质谱联用法(GC-MS)[11-12],液相色谱-质谱联用法(GC-MS)[13-14]、酶联免疫吸附测定法(ELISA)[15-16]以及分子印迹法[2,17]。然而,这些方法中有些方法需要昂贵的仪器、熟练的操作人员和制备大量的样品;有些试验中存在试剂稳定性差和需要进行动物试验,导致其对食品样品中RAC的现场检测和快速检测的适用性有限的缺陷。而电化学方法稳定、灵敏、成本低,特别是在药物和食品分析方面得以广泛应用。有些电化学传感器已经应用于RAC的检测[18-24]。氨基酸聚合膜修饰电极具有稳定性好、选择性好、检测的灵敏度高和使用寿命长等特点,被广泛用于化学修饰电极的制备[25]。聚γ-氨基丁酸(γ-ABA)具有良好的电催化特性,是一种优良的电极的修饰材料,在电化学领域应用前景非常广泛,聚γ-ABA修饰电极(P-γ-ABA/GCE)已经应用于一些电化学活性物质的检测,表现出了优良的催化活性[26-28]。但据我们所知,P-γ-ABA/GCE测定RAC还未见报道。本文采用在P-γ-ABA/GCE对RAC进行测定,电极表现出了较好的稳定性及抗干扰能力,催化了RAC的氧化反应,能够用于实际样品的检测。
1 材料与方法
1.1 仪器与试剂
电化学工作站CHI660D型,上海辰华仪器有限公司;三电极体系,饱和Ag/AgCl电极为参比电极、铂丝电极为辅助电极、玻碳电极(GCE)或P-γ-ABA/GCE为工作电极;KQ-100型超声波清洗器,昆山禾创超声仪器有限公司;石英亚沸高纯水蒸馏器SYZ-550,金坛市江南仪器厂。
γ-ABA,阿拉丁试剂有限公司;RAC标准品,农业部环境保护科研监测所;猪肉,购买于当地超市;0.2 mol/L的缓冲溶液(PBS)由Na2HPO4和NaH2PO4配制;试验用水均为二次蒸馏水。
1.2 P-γ-ABA/GCE的制备
将玻碳电极在麂皮上用氧化铝粉末的糊状液抛光,然后分别在硝酸、乙醇和水中分别超声清洗30 s,再用二次蒸馏水冲洗干净晾干备用。将预处理后的玻碳电极放置于含有0.1 mol/L KNO3的5.0 mmol/L K3[Fe(CN)]6溶液中,使用循环伏安法(CV)扫描,当峰电流不再变化且趋于稳定,即电极清洗和活化过程完成。将电极置于1.0×10-3mol/L的γ-ABA溶液中,在-1.4~2.2 V电位范围内以40 mV/s的扫描速率循环扫描8段,取出电极清洗待用。
1.3 电化学分析试验方法
将三电极体系放置于一定量的RAC标准溶液(pH=6.8的PBS配制)与PBS中,用CV或差分脉冲伏安法(DPV)扫描,观察并记录在GCE或P-γ—ABA/GCE电化学行为。
2 结果与分析
2.1 RAC的电化学行为
由图1可知,浓度为1.00×10-6 mol/L的RAC溶液在P-γ-ABA/GCE上的氧化峰电流(3)相对于在裸电极(2)上的氧化峰明显增大,可以看出,γ-ABA增大了检测灵敏度。说明P-γ-ABA对RAC氧化具有催化作用,加速了RAC的电子转移速率。
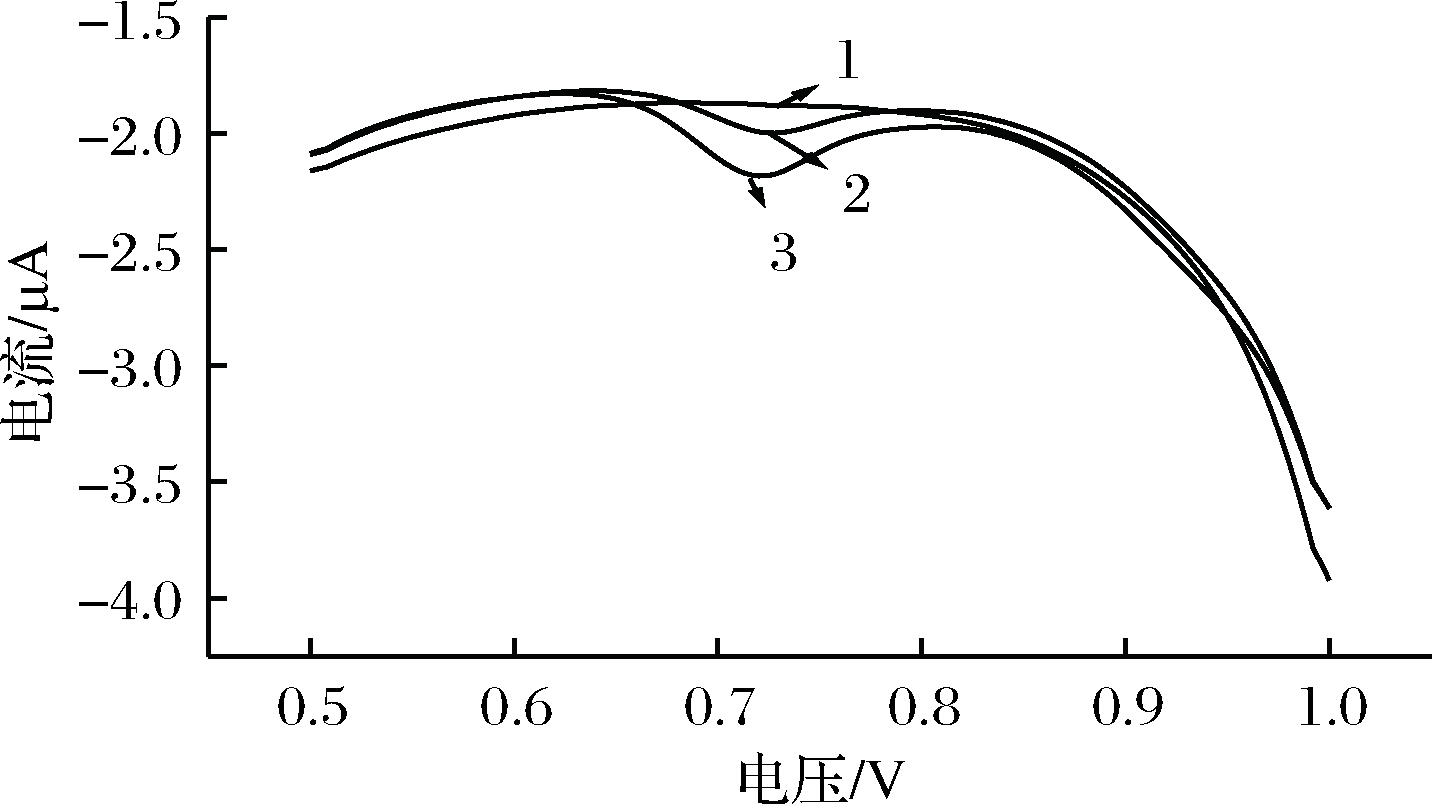
1-γ-ABA/GCE测定空白溶液 (0.2 mol/L, pH=6.8);2-裸电极测定1.0×10-6 mol/L RAC;3-P-γ-ABA/GCE测定1.0×10-6 mol/L RAC
图1 不同电极测定的DPV图
Fig.1 DPV curves of different electrode measurement
2.2 最佳电化学聚合条件
2.2.1 P-γ-ABA/GCE聚合溶液的pH
聚合溶液pH影响了电极的性能。为了确定最佳聚合溶液的pH,固定电位于-1.4~2.2 V, 40 mV/s的扫描速率下,仅改变聚合溶液的pH。试验表明:当pH达到6.5时,RAC在聚P-γ-ABA/GCE上的氧化峰电流达到最大值(图2),因此,在本试验中选择含有γ-ABA的pH=6.5的缓冲溶液作为修饰溶液。
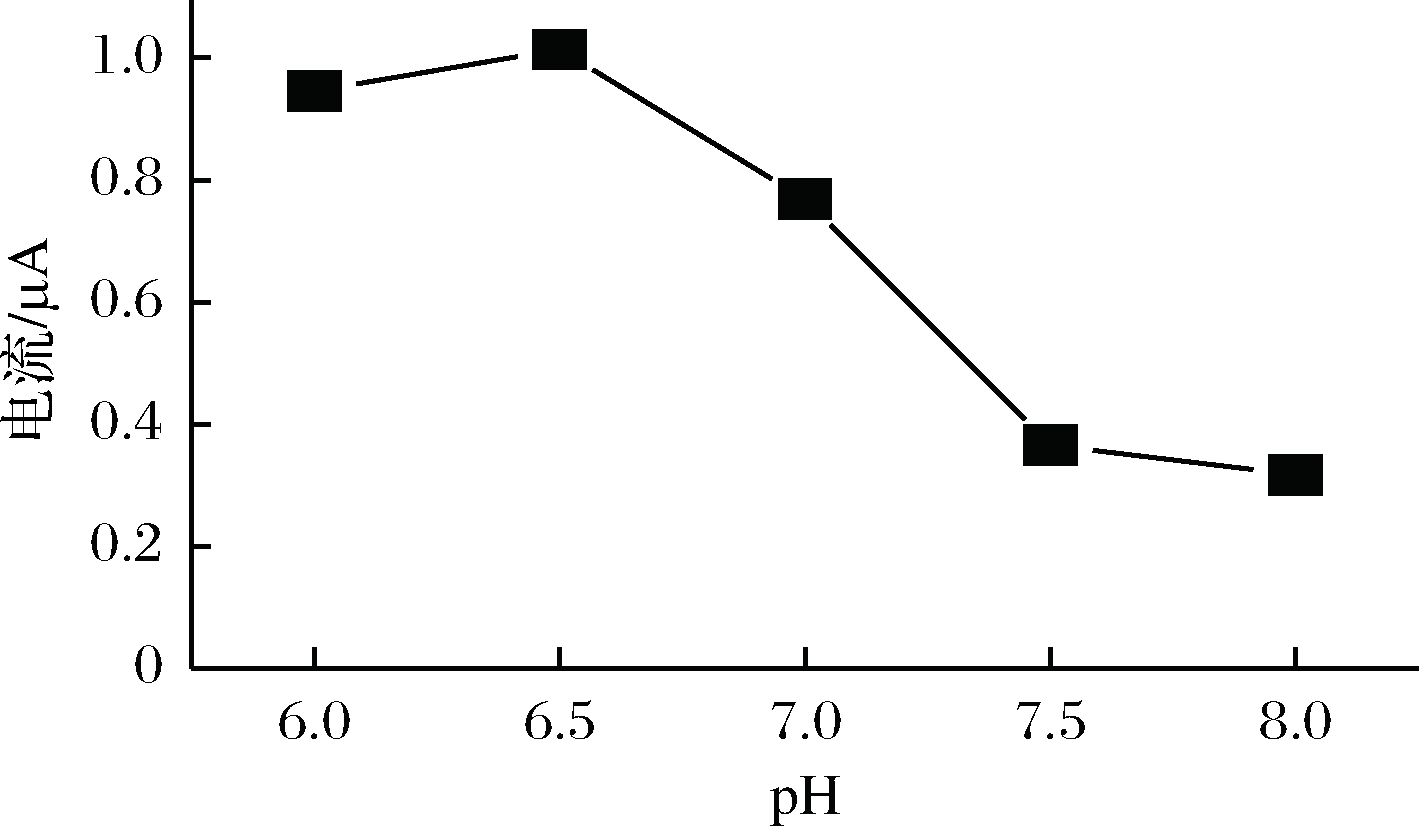
图2 P-γ-ABA/GCE聚合液最佳pH
Fig.2 Optimization of the pH of the polymer stocksolution of P-γ-ABA/GCE
2.2.2 P-γ-ABA/GCE扫描段数(n)的优化
试验中讨论了n对聚合物修饰电极的影响。通过改变n聚合得到的修饰电极来测定RAC,试验结果表明(图3),聚合过程中n达到8段时,RAC在P-γ-ABA/GCE上的氧化峰电流值达到最大。因此,聚合最佳n是8段。
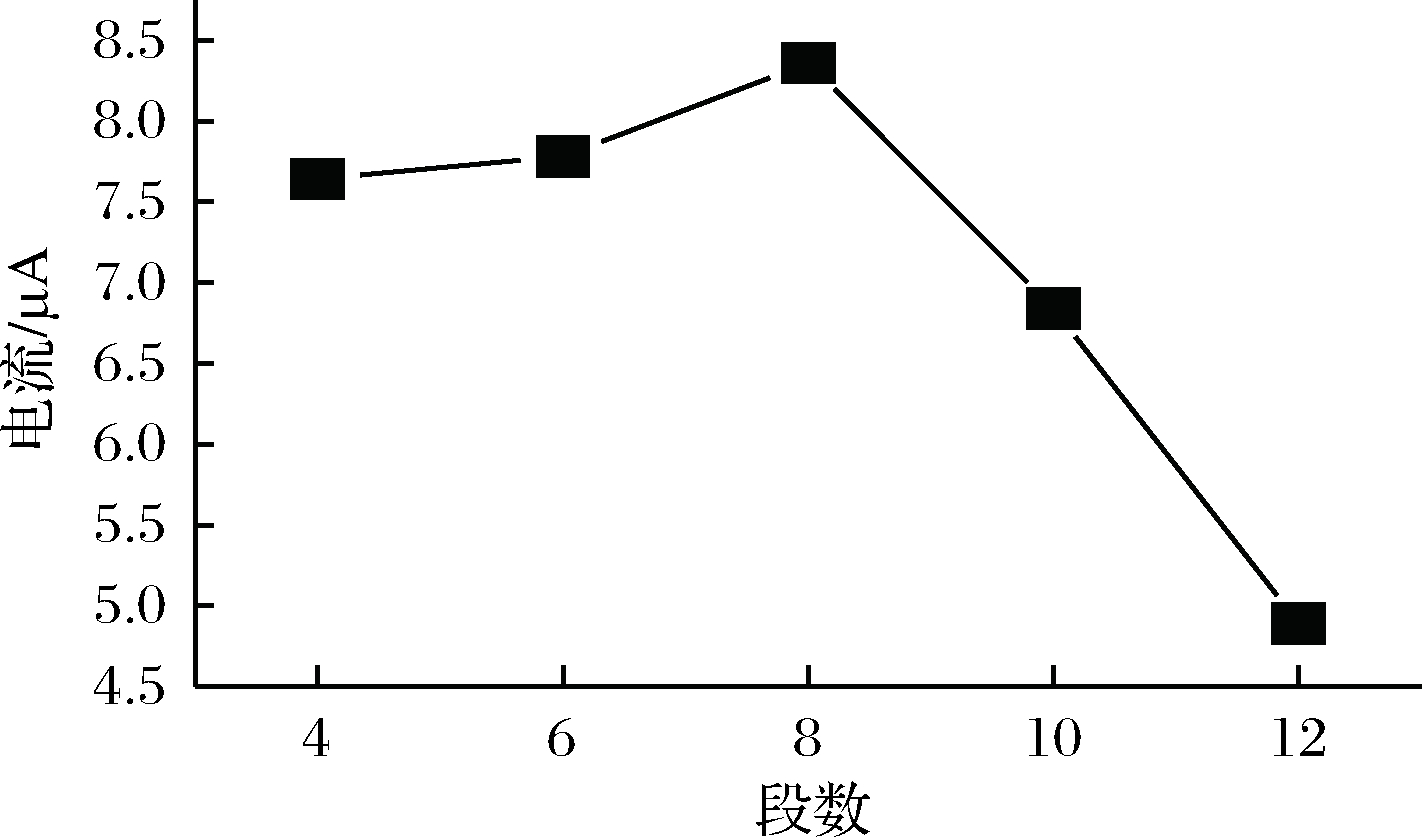
图3 P-γ-ABA/GCE最佳聚合段数(n)
Fig.3 Optimization of the number ofelectropolymerization cycles (n) of P-γ-ABA/GCE
2.2.3 P-γ-ABA/GCE聚合扫描速率的优化
聚合扫描速率对修饰电极也起到较大的影响。通过改变扫描速率来观察氧化峰电流的电流变化。试验结果显示,当修饰电极上扫描速率是40 mV/s,RAC的氧化峰电流值达到最大(图4)。所以,最佳聚合扫描速率选用40 mV/s。
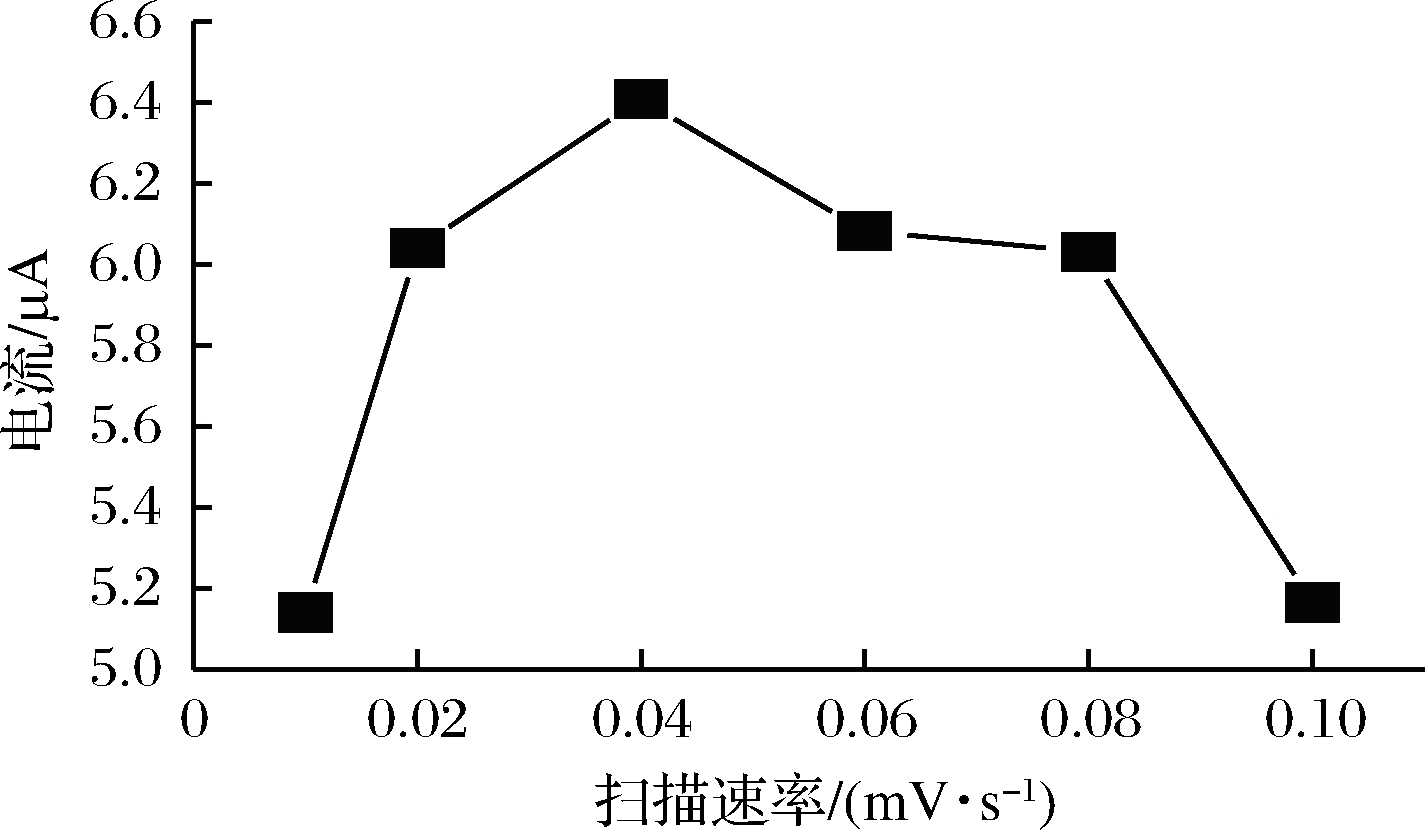
图4 P-γ-ABA/GCE最佳聚合扫描速率
Fig.4 Optimization of the scanning rate of P-γ-ABA/GCE
2.2.4 P-γ-ABA/GCE聚合高电位、低电位的优化
P-γ-ABA/GCE电极的制备中,聚合高、低电位能够在一定程度上影响电极的检测灵敏度。首先固定低电位为-1.0 V,改变聚合高电位进行试验。最佳高电位为2.2 V。然后固定高电位,最佳低电位为-1.4 V。此时,RAC在修饰电极上的响应氧化峰电流达到了最大值(图5)。所以聚合电位为-1.4~2.2 V。
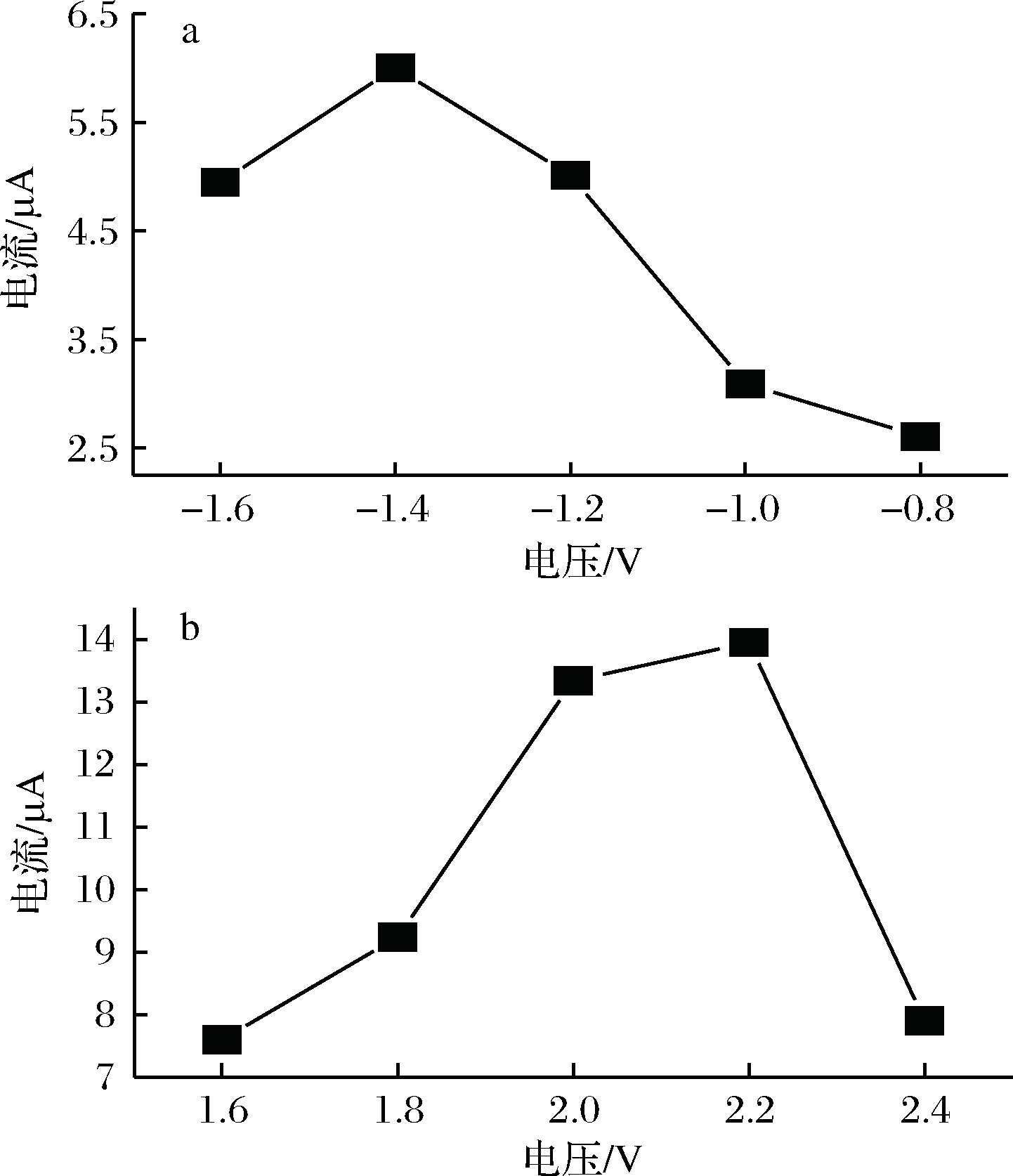
a-低电位聚合;b-高电位聚合
图5 P-γ-ABA/GCE最佳聚合电位
Fig.5 Optimization of the potential of P-γ-ABA/GCE
2.2.5 优化条件下P-γ-ABA/GCE电极聚合曲线
在上述最佳聚合条件下,用循环伏安法得到了P-γ-ABA/GCE电极的聚合曲线。γ-ABA在电极表面发生了氧化还原反应,通过电化学氧化还原反应制备了聚合物膜。
聚合条件:1.0×10-3mol/L的ABA;聚合电位:-1.4~2.2 V;聚合扫描段数:8段;扫描速率:40 mV/s。
2.3 RAC最佳测定条件的选择
2.3.1 测定溶液最佳pH
电极反应受到测定溶液pH的影响。为了考察测定过程中测定溶液pH的影响,在0.2~1.0 V的电位范围内,改变测定底液的pH。在pH为6.0到8.0之间,RAC在P-γ-ABA/GCE上氧化峰电流变化如图6所示。当pH=6.8时,RAC在P-γ-ABA/GCE上的氧化峰电流达到最大值。因此,在该试验中选择pH=6.8的PBS为测定底液。另外,由图6插图可以看出,RAC氧化电位与pH值成线性相关;pH在6.0~8.0,氧化峰电位(Epa)随pH值的增加而降低,线性回归方程为:Epa=1.05-0.053 pH,R=0.996 3,其线性方程的斜率为0.053 V,接近0.059 V,故质子转移数等于电子转移数,由此可说明RAC在氧化过程中涉及质子的参与。
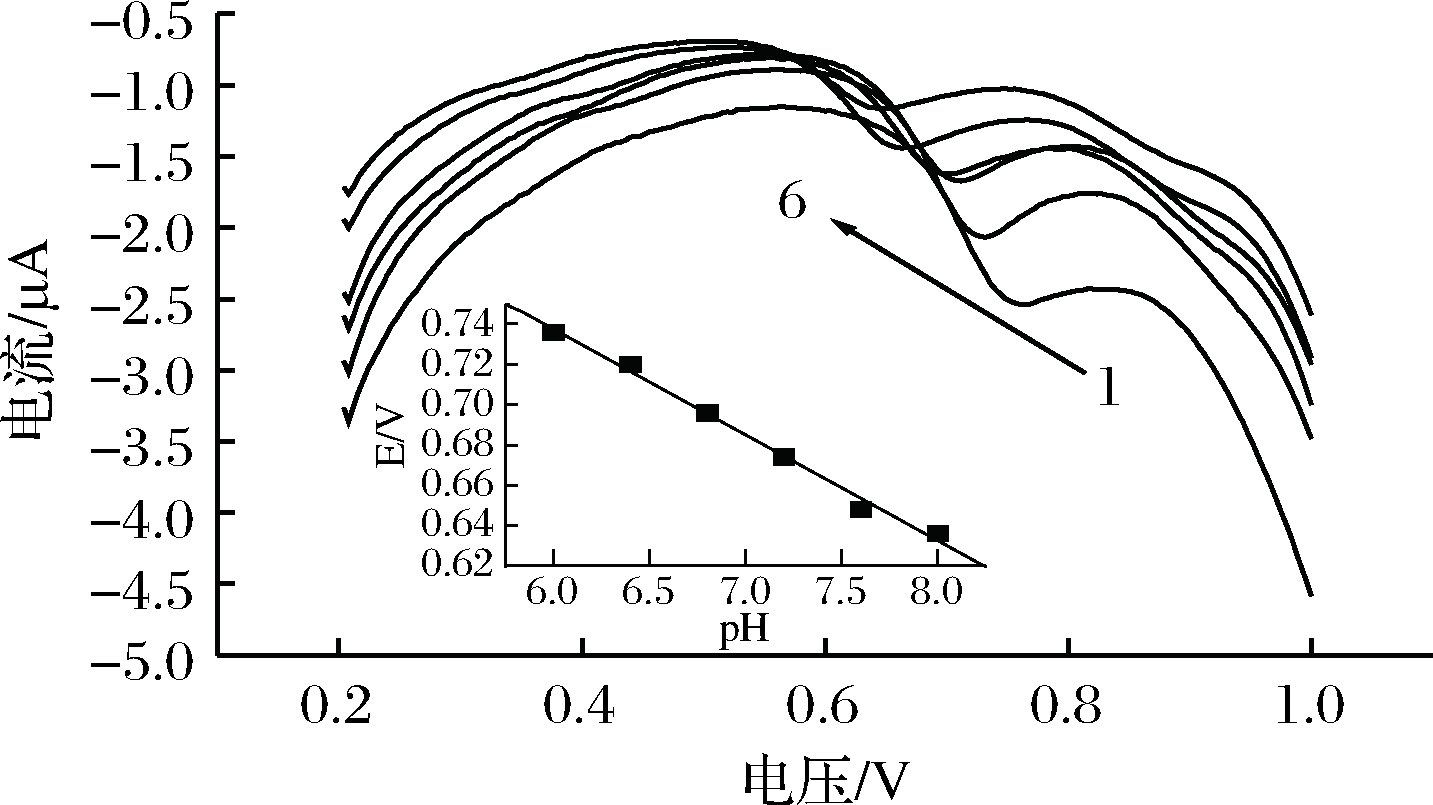
1~6 (pH)-6.0, 6.4, 6.8, 7.2, 7.6, 8.0
图6 不同pH下的1.0×10-6 mol/L的RAC在P-γ-ABA/GCE上的差分脉冲图
Fig.6 DPV curves (DPVs) of 1.0×10-6 mol/L RAC atthe P-γ-ABA/GCE
2.3.2 扫描速率的影响
设置电位范围为0.2~1.2 V,选择1.0×10-6mol/L的RAC溶液,选择pH=6.8的PBS,用循环伏安法研究扫描速率的变化规律(图7)。

1~14-20,40,60,80,100,120,140,160,180,200,220,240 mV/s
图7 不同扫速下的CV图
Fig.7 Cyclic voltammograms at deferent scan rate
试验结果证明,在20~240 mV/s的速率,氧化峰电流值随着扫描速率的增加而增大,并且氧化峰电流与扫描速率ν1/2成线性关系,线性方程ipa=4.03×10-7+1.57×10-9ν1/2 (mV/s),相关系数R2=0.994 1,说明RAC在聚氨基丁酸修饰电极上的反应过程为扩散过程。
2.4 线性范围
在最佳的试验条件下,使用差分脉冲伏安法测定RAC(DPV曲线如图8所示)。在6.0×10-8~1.0×10-5mol/L,OX电流与其浓度成相对比较好的线性正相关(如图8插图所示),线性回归方程为:ipa=1.09×10-7+0.26c(mol/L),R2=0.998 8。RAC的最低检出浓度为8.0×10-9mol/L。
2.5 样品的测定
2.5.1 样品处理
称取10.000 0 g生猪肉,用大约20 mL的无水乙醇将样品浸泡,静置10 min,用真空泵抽滤,滤渣用乙醇萃取3次,合并滤液,取适量倒入离心试管,放入离心泵离心10 min,取上层上清液定容于10 mL容量瓶中配制成猪肉样品待测液。
2.5.2 样品回收率测定
在优化的试验条件下,取猪肉样品待测液0.5、1和2 mL,用标准加入法向猪肉样品待测液中加RAC溶液,回收率在98.0%~102%,计算结果如表1。
2.6 电极的抗干扰能力、稳定性与重复性
用P-γ-ABA/GCE测定浓度为6.00×10-6 mol/L的RAC(pH=6.8)进行干扰试验,评估了可能干扰修饰电极响应的几种物质。试验结果表明,在允许相对误差±5.0%以内,100倍的葡萄糖(Glc)和半乳糖(Fru),50倍的甘氨酸(Gly)和尿酸(UA),20倍的抗坏血酸(AA),加入到6.00×10-6 mol/L的RAC中,在此体系中只检测到UA到相对微弱的氧化峰,其他物质未检测到峰,并且没有影响RAC氧化峰电流的大小,所以该方法具有较好的选择性。
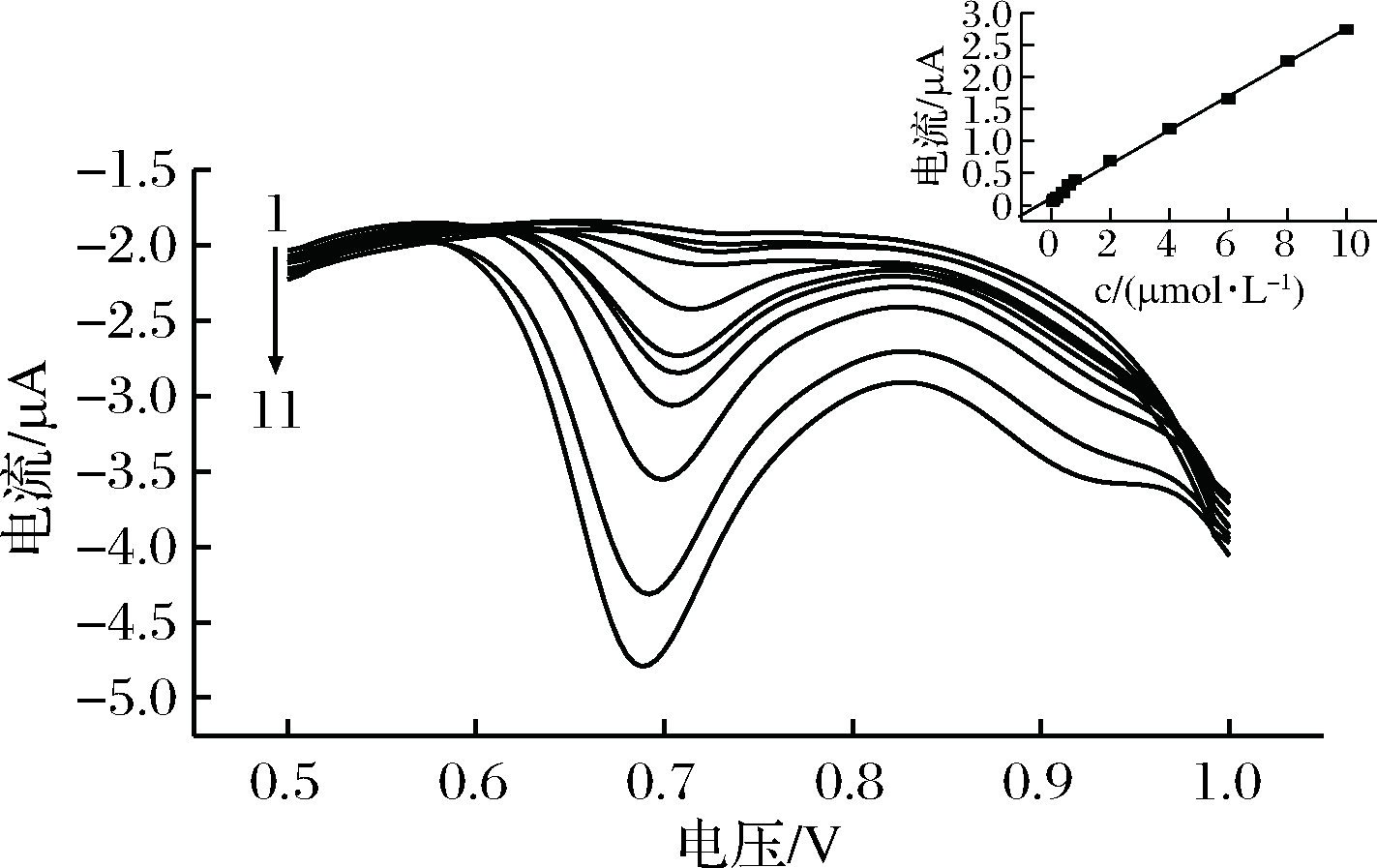
1~11-0.06, 0.08, 0.2, 0.4, 0.6, 0.8, 2.0,4.0, 6.0, 8.0,10 μmol/L
图8 P-γ-ABA/GCE上不同浓度的RAC在最佳试验条件下的DPV图
Fig.8 DPV curves of different concentrations of RACat the P-γ-ABA/GCE
表1 猪肉样品中RAC的回收率的测定(n=6)
Table 1 Results of tests for recovery
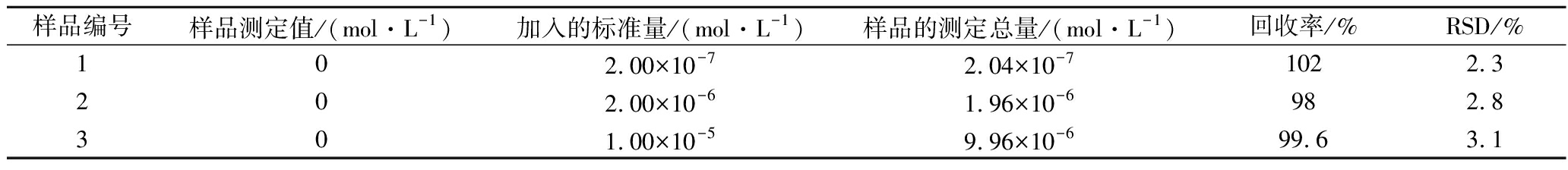
样品编号样品测定值/(mol·L-1)加入的标准量/(mol·L-1)样品的测定总量/(mol·L-1)回收率/%RSD/%102.00×10-72.04×10-71022.3202.00×10-61.96×10-6982.8301.00×10-59.96×10-699.63.1
将制备好的电极连续扫描6次,电流响应仅下降1.5%。然后将其置-4℃避光保存,7 d后响应电流变化率不超过5.0%,表明该传感器的稳定性较好。分别制备同一批次3支电极对RAC进行检测电流变化率不超过3.9%,表明该电极有较好重复性。
3 结论
本试验制备了P-γ-ABA/GCE,用于测定RAC,该方法操作简单,灵敏度高,有较好的稳定性、重现性及抗干扰能力,试验中用于实际样品的检测,结果满意。因此,该方法在食品中RAC的检测方面有较好的应用前景。
[1] RICHARD J W,WIEGAND B R, POMPEU D,et al.The effect of corn distiller's dried grains with solubles, ractopamine,and conjugated linoleic acid on the carcass performance,meat quality,and shelf-life characteristics of fresh pork following three different storage methods[J].Meat Science, 2012, 90(3):643-652.
[2] 何资颖,宋小云,王琤韡.莱克多巴胺的危害及防范措施[J].江西饲料, 2017(5):15-17.
[3] HALSEY C H C,WEBER P S, REITER S, et al.The effect of ractopamine hydrochloride on gene expression in adipose tissues of finishing pigs[J].Journal of Animal Science, 2011,89 (4):1 011-1 019.
[4] 王文珺,李阳,叶云锋,等.生物样本中莱克多巴胺检测方法的研究进展[J].中国畜牧兽医, 2015, 42(1): 140-146.
[5] 张洪才,刘国艳,商璟,等.多壁碳纳米管和分子印迹膜修饰电极检测猪尿液中莱克多巴胺[J].分析化学,2012, 40(1): 95-100.
[6] 张媛媛,王瑞鑫,李秋薇,等.基于多壁碳纳米管免疫传感器法快速测定食品中的莱克多巴胺[J].食品科学2016,37(8):170-175.
[7] NIELEN M W F, LASAROMS J J P, ESSERS M L,et al. Multiresidue analysis of β- agonists in bovine and porcine urine,feed and hair using liquid chromatography electrospray ionisation tandem mass spectrometry[J]. Analyical and Bioanalyical Chemistry, 2008, 391(1):199-210.
[8] AMELIN V G,KOROLEV D S, TRET’YAKOV A V. QuEChERS sample preparation in the simultaneous determination of diethylstilbestrol and ractopamine in food by gas_liquid chromatography[J].Journal of Analytical Chemistry, 2015,70,(4):419-423.
[9] DU W,ZHANG S R,FU Q,et al. Combined solid-phase microextraction and high-performance liquid chromatography with ultraviolet detection for simultaneous analysis of clenbuterol, salbutamol and ractopamine in pig samples[J].Biomedical chromato graphy,2013,27(12):1 775-1 782.
[10] FREIRE E F, BORGESK B, TANIMOTO H,et al. Monitoring of ractopamine in the mixture of this feed additive with vitamin mineral complex and with swine feed by HPLC[J].Additives & Contaminants A, 2013,30(5):796-803.
[11] HE L M, SU Y J, ZENG Z L.Determination of ractopamine and clenbuterol in feeds by gas chromatography-mass spectrometry[J]. Animal Feed Science and Techology,2007,132(3):316-323.
[12] BIAN K, LIN T, LIU M,et al.Matrix effects in analysis of three β-agonist residues in pig edible tissues using gas chromatography-mass spectrometry [J].Chinese Journal of Chromatography, 2014, 32(2):162- 168.
[13] WU J L, LIU X Y, PENG Y P.Determination of ractopamine in pig hair using liquid chromatography with tandem mass spectrometric detection[J]. Journal of Pharmacoloical and Toxicoloical Methods, 2014,69(3):211-216.
[14] LIN Q B,ZHAO X T,SONG H,et al.Immunoaffinity charomatography purification and ultra-high-performance liquid charomatography-tandem mass spectrometry determination of β- agonists in beef[J]. Food Additives & Contaminants A,2012,29(6):935-941.
[15] JIANG X F,ZHU Y H,LIU X Y.Identification of ractopamine glucuronides and determination of bioactive ractopamine residues and its metabolites in food animal urine by ELISA, LC-MS/MS and GCMS[J].Food Additives & Contaminants A,2014,31(1):29-38.
[16] LIU L, KUANG H, PENG C,et al.Fragment-based hapten design and screening of a highly sensitive and specific monoclonal antibody for ractopamine[J].Analytical Methods, 2014,6(1):229-234.
[17] TAND Y W,LI M,GAO Z Y,et al.Upconversion nanoparticles capped with molecularly imprinted polymer as fluorescence probe for the determination of ractopamine in water and pork[J].Food Analytical Methods, 2017,10:2 964-2 973.
[18] LIU Z,ZHOU Y K,WANG Y Y, et al. Enhanced oxidation and detection of toxic ractopamine using carbon nan-otube film-modified electrode[J].Electrochim Acta,2012,74:139 -144.
[19] 谢晶磊,曹小妹,寻艳,等.一种检测莱克多巴胺的复合碳纳米材料修饰电化学传感器[J].化学传感器,2014,32(2):40-45.
[20] WU C,SUN D,LI Q,et al. Electrochemical sensor for toxic ractopamine and clenbuterol based on the enhancement effect of graphene oxide[J].Sensors and Actuators B,2012,168:178-184.
[21] DUAN J H,HE D W,WANG W S,et al.The fabrication of nanochain structure of gold nanoparticles and its application in ractopamine sensing [J].Talanta, 2013,115:992-998.
[22] ZHOU Y, WANG P L, SU X O,et al. Sensitive immunoassay for the β-agonist ractopamine based on glassy carbon electrode modified with gold nanoparticles and multi-walled carbon nanotubes in a film of poly-arginine[J]. Microchim Acta,2014,181:1 973-1 979.
[23] 张翠忠,张贞发,连欢,等.CuNPs/PAA/GR纳米新材料修饰玻碳电极检测猪肉中的莱克多巴胺[J].分析测试学报,2017,36(2):247-251.
[24] CHEN C, ZHANG M X, LI C Y,et al. Switched voltammetric determination of ractopamine by using a temperature-responsive sensing film[J].Microchimica Acta,2018,185:155-163.
[25] 田宏.纳米材料/氨基酸修饰电极的制备及在食用合成色素分析中的应用[D].沈阳:沈阳师范大学,2018.
[26] 张雷,林祥钦.单分子层7-氨基丁酸共价修饰玻碳电极同时测定多巴胺、尿酸和抗坏血酸[J].高等学校化学学报,2003,24(4):591-594.
[27] 郑新宇,周学酬,郑舒燕,等.聚4-氨基丁酸修饰碳纳米管掺杂碳糊电极的制备及其对多巴胺的测定[J].传感技术学报, 2013,26(1):7-11.
[28] 郑新宇,周学酬,苏妍,等.4-氨基丁酸修饰电极的制备及其对多巴胺的测定[J].分析试验室,2013,32(5):25-28.