小米是谷子脱壳后的产物,又称粟,各营养素比例适宜且消化率高,是良好的营养源[1],具有健胃安神、降低血清甘油三酯等多种功能[2],而且不含麸质,在食品和饮料行业有着广泛的应用[3]。
小米含有丰富的蛋白质(平均含量约为9.73%(质量分数)[4]),是一种良好的植物蛋白来源。国内外相关研究表明,以小米蛋白为原料,经蛋白酶酶解或微生物发酵等方法可制得具有生物活性的小米蛋白肽。据目前报道,小米蛋白肽的生物活性主要有抗氧化(清除自由基等)、抗菌、调节免疫、降血压、抑制淀粉酶活性等。
近年来,小米蛋白肽受到相关研究人员的持续关注,国内外针对小米蛋白肽的研究内容和方向较为多样化。本文重点从小米蛋白肽的制备、分离纯化及其生物活性等方面的研究进展进行综述和总结,为小米蛋白肽进一步的研究、开发和应用提供一定参考。
1 小米及小米蛋白的特点
小米,又称粟、粱、狗尾草、黄粟、粟米等,为一年生谷类作物,隶属于禾本科、狗尾草属。小米中的蛋白、脂肪以及维生素等营养成分含量较高,除可食用外,还能作为药物使用,具有多种功效如清热、解渴、促进小便、治疗水泻等,长期食用后有利于滋补人体消化系统。
小米蛋白主要分布在小米胚和胚乳中,小米胚乳同时含有半透明(玻璃质)及不透明部分,不透明的胚乳中含有空气间隙和球形淀粉粒,而半透明的胚乳中无空气间隙,在蛋白质中间充填着多边形的淀粉粒[5]。由透射电镜图可见小米蛋白的内部结构。
小米蛋白中的谷氨酸含量最高,然后依次为亮氨酸、天冬氨酸、丙氨酸、苯丙氨酸、缬氨酸、脯氨酸,赖氨酸含量较低[5-6]。必需氨基酸的组成达到42%,是一种优良的植物蛋白来源。
小米蛋白主要有4种:清蛋白、球蛋白、醇溶蛋白和碱溶蛋白。其中醇溶蛋白和碱溶蛋白(又称“谷蛋白”)为小米蛋白的两大主要成分,尤其醇溶蛋白含量最多,占总蛋白的50%以上[7],研究[8]发现,小米醇溶蛋白的二级结构几乎全为α螺旋结构,分子质量集中分布在11~25 kDa,而谷蛋白的二级结构较为杂乱无序,大部分为β结构和无规则卷曲,且分子质量范围分布较广(11~180 kDa)。由此可见,小米醇溶蛋白和碱溶蛋白的结构相差较大,可以根据2种蛋白在不同溶剂体系中的溶解度不同,分别进行提取研究。此外,利用超声波辅助等方法能够提升小米蛋白的提取效率[9]。
2 小米蛋白肽的制备方法
肽的制作和生产方法多种多样,总体来说,大致分为酸碱水解法、酶水解法以及微生物发酵法。其中,酸碱水解法工艺最简易,但无法避免出现氨基酸缺损、水解程度及产物肽的氨基酸序列等难以掌控的问题,现已被人们逐渐摒弃;相对而言,酶水解法和微生物发酵法的工艺条件较为温和,同时产物中不会混入有害化学物质,因而得到了广泛的应用[10]。
2.1 蛋白酶水解法
酶水解是最高效、安全且便于把控的蛋白肽制备手段,但各蛋白酶水解蛋白的作用位点不一定相同,同种蛋白质经不同的蛋白酶水解后,会产生不同氨基酸序列和不同分子质量的多肽,表现出不同的生物活性[11]。另一方面,蛋白酶水解制备多肽时,还会因为某些植物蛋白中可能含有酶抑制剂而发生竞争性抑制,酶促反应速度不仅不会提高,反而会迅速下降[12]。因此酶法制备多肽时,酶的种类、用量、底物浓度、温度、pH、时间等参数都是酶法制备活性肽工艺的研究重点。
刘剑利等[13]采用碱性蛋白酶alcalase水解小米蛋白,以二苯代苦味肼基(DPPH)自由基清除率为指标,确定了小米多肽最优制备工艺参数:pH 8.5、酶占底物5%(质量分数)、酶解温度40 ℃、酶解时间3.5 h,所制得的活性肽对超氧阴离子自由基![]() 自由基和羟自由基(·OH)的清除率较高,具有较好的抗氧化能力。其试验结果还显示,底物的水解度与小米多肽对自由基的清除能力之间无线性关系,仅在某些水解度的范围内,所制备多肽的自由基清除能力最强,水解度不在这一范围时,产物的活性则会减弱。HIMANI等[14]应用猪胰蛋白酶水解小米碱溶蛋白制备的抗氧化活性肽具有较好的DPPH自由基、羟自由基、2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)自由基清除能力及螯合金属等生理活性。
自由基和羟自由基(·OH)的清除率较高,具有较好的抗氧化能力。其试验结果还显示,底物的水解度与小米多肽对自由基的清除能力之间无线性关系,仅在某些水解度的范围内,所制备多肽的自由基清除能力最强,水解度不在这一范围时,产物的活性则会减弱。HIMANI等[14]应用猪胰蛋白酶水解小米碱溶蛋白制备的抗氧化活性肽具有较好的DPPH自由基、羟自由基、2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)自由基清除能力及螯合金属等生理活性。
由于酶反应的专一性,单酶作用范围局限,水解效率较低,如果使用多酶进行水解,利用不同酶对蛋白质的酶解特异性,可起到协同增效作用。已有研究[15-17]表明,蛋白质经多酶复合水解的产物活性明显高于相对应的单酶水解产物,而目前国内外多以单酶水解小米蛋白进行研究,关于复合酶水解小米蛋白制备活性肽还有待进一步研究。
2.2 微生物发酵法
微生物发酵法制备生物活性肽,是指某些能够代谢产生蛋白酶的微生物来生产活性肽的方法。某些微生物具有非常高效的蛋白酶表达功能,它们能够利用这些酶系水解蛋白原料生产各种活性肽,然后在发酵阶段将这些肽持续排放到体系中,具有这种功效的微生物有枯草芽孢杆菌、保加利亚乳杆菌、植物乳杆菌、嗜酸乳杆菌、嗜热链球菌等,例如,郭丽娜等[18]利用枯草芽孢杆菌(NattoD-3)发酵小米糠(最佳发酵时间72 h),成功制备了抗氧化活性肽。这些微生物拥有高效的蛋白质水解体系且有助于生物活性肽的释放,此外,微生物发酵法所生产的活性肽能够直接进入人体内消化系统,更容易被人体吸收,因此更加安全,应用潜力巨大[19]。李慧娟等[20]以枯草芽孢杆菌(Bacillus subtilis J3) 和植物乳杆菌(Lactobacillus plantarum JNX) 组成混合菌株固态发酵豆粕制备了具有ABTS自由基较强清除活性的大豆肽。
关于采用微生物发酵法制备小米活性肽的研究较少,何署剑[21]利用枯草芽孢杆菌发酵小米蛋白,获得了具有较强自由基清除能力的活性肽。AMADOU等[22]利用副干酪乳杆菌Fn032发酵小米粉制备活性肽产物具有较强的抗氧化及抑制大肠杆菌的活性,CHEN等[23]利用根霉菌R.oryzae发酵制备的小米肽具有降低大鼠血压等功效。以上研究仅为单一菌种发酵,而利用混合菌种发酵制备小米活性肽有待研究。但是微生物发酵法也存在某些不足之处,如微生物发酵及代谢过程复杂,产物难以控制,另外,发酵体系中的原辅料成分较多(必须为微生物提供氮源、碳源等条件),造成产物的分离纯化较为困难等问题,未来可考虑研发精确发酵控制技术,精简发酵过程,从而实现目标肽的高效、精确制备。
3 小米活性肽的分离纯化及结构鉴定
肽的分离纯化技术主要有超滤和色谱分离技术等,根据分离原理的不同,分离方法也不同。如超滤、凝胶色谱是根据肽的分子质量大小分别进行粗分离和精分离,而离子交换色谱和高效逆流色谱等则分别利用样品带电性以及在两相中分配系数的不同而实现分离。经过分离纯化得到的多肽通常可由质谱方法来测定氨基酸序列。
生物活性肽常见的分离纯化方法有以下几种:反相高效液相色谱(reverse phase high-performance liquid chromatograp,RP-HPLC)、亲和色谱法、离子交换色谱法(ion exchange chromatography,IEC)、等电聚焦电泳(isoelectric focusing,IEF)、分子排阻色谱(molecular exclusion chromatography,SEC)、超高压液相色谱(ultra performance high liquid chromatography,UHPLC)、亲水作用色谱(hydrophilic interaction liquid chromatography,HILIC)等,以上方法的分离纯化机理各不相同,同时也存在不同的优缺点[24],在实际操作过程中,应根据待分离活性肽的物理、化学特性来选择最合适的分离纯化手段,从而实现活性肽的高效分离。
对于小米活性肽的分离纯化主要有以下研究。王帅等[25]利用Sephadex G-25凝胶色谱和DEAE-32离子交换层析对小米多肽进行纯化,纯度达到了电泳纯。2016年,HIMANI等[14]首先利用Sephadex G-25凝胶色谱分离了小米碱溶蛋白酶解产物,然后针对具有最强抗氧化活性的组分利用反相超流液相色谱法(RP-UFLC)进一步分离纯化,最后应用基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption ionization-time of flight mass spectrometry,MALDI-TOF/TOF MS)测定了活性肽的氨基酸序列,其氨基酸序列为SDRDLLGPNNQYLPK,分子质量为1 729.2 Da,拥有16个氨基酸。该多肽含有多个疏水性氨基酸如Gly、Leu及Pro,能够提升在脂肪体系中的溶解性,更好地与自由基结合并进行反应,发挥其抗氧化作用。有报道[26]称,含有重复氨基酸残基的肽(如结构式中的Leu-Leu和Asn-Asn结构)相比游离氨基酸的生理活性更强,且能更快速地被吸收。2019年,AGRAWAL等[27]从小米蛋白酶解产物中分离纯化得到了2种抗氧化肽:TSSSLNMAVRGGLTR和STTVGLGISMRSASVR,通过分子对接模拟的方法发现,这2种肽的抗氧化活性与其中的丝氨酸和苏氨酸残基密切相关。AMADOU等[22]利用类似方法从小米粉发酵产物中分离纯化出3种具有抗氧化活性的多肽,并鉴定其氨基酸序列,分别为SGYYMH,LGTFQN,LHALLL。以上3种肽含有自由基清除能力较强的氨基酸如Gly、His、Leu等。
4 小米蛋白肽的生物活性
目前,越来越多的研究发现小米蛋白肽具有抗氧化、调节免疫、抑菌、降血压等多种生物活性,如表1所示。
表1 小米蛋白肽的生物活性
Table 1 Bioactivities of millet peptides
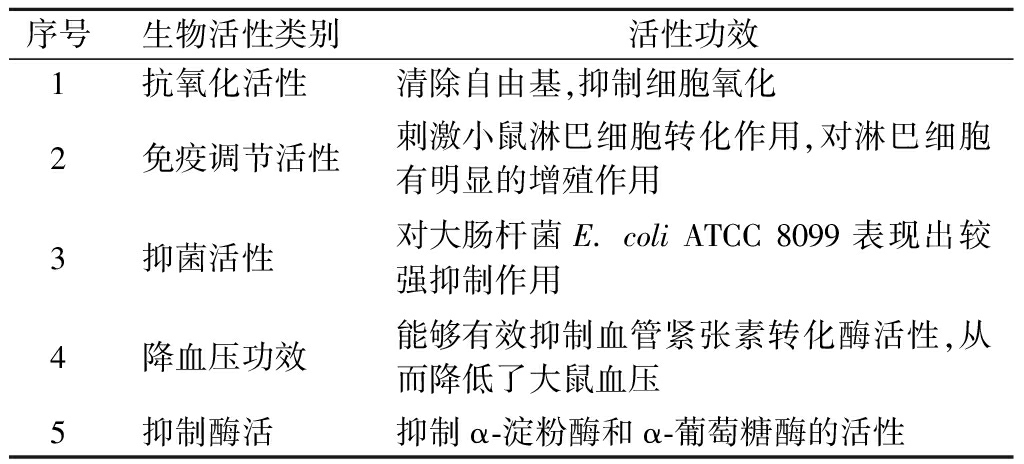
序号生物活性类别活性功效1抗氧化活性清除自由基,抑制细胞氧化2免疫调节活性刺激小鼠淋巴细胞转化作用,对淋巴细胞有明显的增殖作用3抑菌活性对大肠杆菌E. coli ATCC 8099表现出较强抑制作用4降血压功效能够有效抑制血管紧张素转化酶活性,从而降低了大鼠血压5抑制酶活抑制α-淀粉酶和α-葡萄糖酶的活性
4.1 抗氧化活性
4.1.1 清除自由基能力
众多研究[28-29]发现,活性氧自由基造成的氧化损伤被看作是造成机体衰老、细胞及组织损伤和细胞发生癌变的一个重要起因。另外,某些自由基(如![]() 自身就是一种毒性物质,且通过生化反应而形成的产物自由基(如·OH)同样会给细胞或组织带来氧化损伤,故探索并发现能够有效清除自由基的天然无害的抗氧化剂在保障机体健康、延缓衰老等方面具有重大价值。
自身就是一种毒性物质,且通过生化反应而形成的产物自由基(如·OH)同样会给细胞或组织带来氧化损伤,故探索并发现能够有效清除自由基的天然无害的抗氧化剂在保障机体健康、延缓衰老等方面具有重大价值。
目前,已有研究报道表明小米蛋白肽具有较强的自由基清除能力。HIMANI等[14]研究发现小米肽在1 g/L 时,DPPH自由基和ABTS自由基清除率分别为67.66%,78.81%。另外,同样在1 g/L下,小米肽的Fe2+螯合能力(51.20 %)要远高于BHT(10.59%),表明其含有能有效结合金属离子的氨基酸残基。相比而言,采用微生物发酵法制备的小米肽的自由基清除能力较弱,在5 g/L下DPPH自由基清除率不到50%[22]。王帅等[25]利用碱性蛋白酶制备的小米多肽对超氧阴离子自由基、羟基自由基和DPPH自由基都可以实现高效清除,清除率与小米多肽浓度呈正相关关系,当小米多肽质量浓度为50 μg/mL时对以上自由基的清除率分别为(62.71±3.86)%,(73.56±4.51)%和(82.62±5.25)%。通过对比发现,其自由基清除活性相比AGRAWAL等[14]所制备的肽更强,由此,不同制备方法及分离纯化条件所得到小米肽的抗氧化活性差别较大。
4.1.2 抑制H2O2诱导的胰岛细胞氧化应激作用
研究发现[24],小米多肽对H2O2诱导的红细胞氧化溶血能够起到显著抑制作用(P<0.01,最低质量浓度水平20 g/L),有效地保护了红细胞结构的完整性,能有效抑制H2O2诱导损伤的大鼠胰岛素瘤细胞(INS-1)损伤和凋亡,增加INS-1细胞的存活率;用50 μg/mL小米多肽处理时,细胞的存活率达到(96.30±5.21)%,且细胞内活性氧簇(reactive oxygen species,ROS)的产生明显减少,缓解了INS-1细胞氧化应激。以上小米多肽的作用机制据推测或与超氧化物歧化酶Ⅰ、过氧化氢酶、谷胱甘肽巯基转移酶、醌氧化还原酶Ⅰ等抗氧化酶系的过表达相关,从而减轻了H2O2引起的细胞损伤[30-31]。但小米肽在动物机体内的抗氧化功效和作用机理有待进一步探究。
4.2 免疫调节作用
研究表明,某些生物活性肽或蛋白酶解物能够起到免疫调节作用(细胞免疫为主),包括淋巴细胞增殖、抗体合成及细胞因子调节作用。这些免疫调节肽具有调节人类淋巴细胞的增殖、刺激巨噬细胞的吞噬活性、抑制某些细胞因子产生的作用[31-33]。
刘剑利等[34]将小米多肽分为高、中、低剂量组喂饲小鼠,通过淋巴细胞转化试验、半数溶血值(HC50)等指标研究小米多肽对小鼠免疫调节作用。结果表明,不同剂量的小米多肽有明显的刺激淋巴细胞转化作用,对小鼠淋巴细胞有明显的增殖作用,增强了细胞免疫作用,小鼠巨噬细胞的吞噬功能及脾脏指数显著提升(P<0.05),小米活性肽可通过非特异性免疫来增强动物机体的免疫功能。
4.3 抑菌活性
目前,具有抑菌功效的生物活性肽成为人们的研究热点之一。抗菌肽是指具有抑菌功效的生物活性肽,大多带正电荷,且为两亲性,由于分子质量小,故能够快速进入到感染的区域[35],从而有效地抑制菌体的生长。以富含蛋白质的动植物原料(如花生、鲫鱼鱼鳞、辣椒籽等)制备的抗菌肽对于金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌、黄曲霉菌、沙门氏菌等均具有较好的抑菌活性[36-38]。此外,某些微生物在自身代谢过程中会产生特定的抗菌肽,例如,白杰等[39]在枯草芽孢杆菌B3菌株(Bacillus subtilis B3) 液态发酵产物中发现了具有抑制大肠杆菌和沙门氏菌活性的抗菌肽,且经进一步研究发现,该抗菌肽具有较强的耐热性、耐酸碱性和光照稳定性。故抗菌肽在食品或医药产品开发方面具有广阔的应用前景[40-42]。
研究[20]发现,发酵法制备的小米多肽在40 μg/mL下对大肠杆菌E. coli ATCC 8099表现出较强抑制作用,此结果也验证了含有Gly和Leu残基的多肽能够有效抑制革兰氏阴性菌的生长的结论[43]。而小米多肽对于其他细菌的抑制活性及其抑菌机理尚缺乏深入全面研究。虽然国外已有研究[44]认为生物活性肽的抑菌作用与净正电荷和疏水性密切相关,但确切机制还有待于进一步验证。
4.4 抑制ACE、α-淀粉酶和α-葡萄糖酶活性
CHEN等[23]研究发现,持续4周喂食自发高血压大鼠(剂量为200 mg肽/kg体重)小米蛋白酶解物、挤压小米蛋白酶解物及发酵小米蛋白酶解物,均能有效抑制血清ACE活性,并降低血管紧张素Ⅱ水平,从而降低大鼠血压,同时未发现有其他不良反应。但其中的定量构效关系(quantitative structure-activity relationship,QSAR)需进一步研究。
KARAS等[45]研究分子质量低于3 kDa的小米蛋白酶解物对不同温度热处理后的抑制ACE、α-淀粉酶和α-葡萄糖酶的活性的影响,发现醇溶蛋白水解物抑制ACE及α-淀粉酶的IC50值分别为0.42,0.11 mg/mL,经100 ℃处理后的ACE及α-葡萄糖酶的IC50值分别为0.33、0.12 g/L;经65 ℃处理后的11s球蛋白酶解产物的ACE及α-葡萄糖酶的IC50值分别为0.38、0.05 g/L。由此可见,以上几种酶解产物的活性较高,质谱分析结果表明其氨基酸序列分别为GEHGGAGMGGGQFQPV、EQG-FLPGPEESGR、RLARAGLAQ、YGNPVGGVGH、GNPVGGVGHGTTGT。
5 结论及展望
由于所具备的特殊功能,生物活性肽可以被用作某些药物替代品或者食品添加剂[46-47]。生物活性肽的来源颇为广泛,可从自然界的各种动植物、微生物蛋白中制备获取。目前,针对植物来源的生物活性肽制备、纯化及生物活性等方面的研究已经取得了较多进展,但主要集中于大豆、花生、大米、玉米、小麦等农作物,而对于小米这一重要杂粮作物中蛋白肽的研究仍然较少,且主要局限于利用小米中的碱溶蛋白制备活性肽,对于小米中其他蛋白如含量最高的醇溶蛋白的研究却尚未见报道,可能是由于醇溶蛋白不溶于水相,因而限制了相关研究的开展,未来可考虑采用微波、超声波、热处理等技术手段对其改性,改变其结构(二级结构)和基本特性(如溶解性、起泡性等),然后再进一步采用合适的技术方法制备活性肽。另一方面,有关小米蛋白肽在动物机体中的某些生物活性评价(如抗氧化活性等)、活性肽的稳定性及风味特征等方面有待进一步明确。
小米蛋白是一种营养价值较高的植物蛋白,具有成本低、安全性好等优势,未来充分利用这一蛋白资源,开发制备具有特定生理活性的小米蛋白肽,对于提升小米精深加工利用水平和功能食品开发等具有重要意义。
[1] 薛月圆,李鹏,林勤保.小米的化学成分及物理性质的研究进展[J].中国粮油学报, 2008, 23(3): 199-203.
[2] LEE S H, CHUNG I M, CHA Y S, et al. Millet consumption decreased serum concentration of triglyceride and C-reactive protein but not oxidative status in hyperlipidemic rats[J]. Nutrition Research, 2010, 30(4): 290-296.
[3] AMADOU I, GBADAMOSI O S, LE G W. Millet-based traditional processed foods and beverages: A review[J]. Cereal Foods World, 2011, 56(3):115-121.
[4] 何勇林,刘丹,王帅,等.小米营养成分制备方法研究进展[J].食品安全质量检测学报, 2017, 8(6): 2 041-2 046.
[5] 周惠明. 谷物科学原理[M]. 北京:中国轻工业出版社,2003.
[6] 赵学伟,魏益民,王章存,等.小米蛋白质的理化特性研究[J].粮食与饲料工业, 2011, 12(7): 34-37.
[7] KUMAR K K, PARAMESWARAN K P. Characterisation of storage protein from selected varieties of foxtail millet italic (Setaria italica (L)Beauv)[J]. Journal of the Science of Food and Agriculture, 1998, 77(4): 535-542.
[8] 姬中伟,戴甜甜,毛健.小米谷蛋白及醇溶蛋白结构特征[J].食品与机械, 2018, 34(6): 1-4.
[9] 杨桦,刘振春,刘想,等.响应面优化超声波辅助酶法提取小米蛋白工艺[J].吉林农业大学学报, 2017, 39(4): 477-482; 487.
[10] 于洋,祁艳霞,靳艳,等.乳源生物活性肽研究进展[J].食品与发酵工业, 2017, 43(9): 259-266.
[11] 阮晓慧,韩军岐,张润光,等.食源性生物活性肽制备工艺、功能特性及应用研究进展[J].食品与发酵工业, 2016,42(6):248-253.
[12] 郑明洋,王元秀,张桂香,等.响应面法优化玉米黄粉蛋白的酶解工艺[J].食品科学, 2012, 33(4): 71-76.
[13] 刘剑利,曹向宇.小米多肽的制备及其抗氧化功能研究[J].食品科学, 2009, 30(8): 64-67.
[14] AGRAWAL H, JOSHI R, GUPTA M. Isolation, purification and characterization of antioxidative peptide of pearl millet (Pennisetum glaucum) protein hydrolysate[J]. Food Chemistry, 2016, 204: 365-372.
[15] 帖余,刘军,李丽,等. 两步法制备菜粕肽及提高蛋白溶解度工艺研究[J].食品与发酵工业, 2019, 45(16):144-148.
[16] 成希飞,杨沙,陈果,等. 两种酶水解制备丝素肽的抗菌性及对人胚肾细胞的毒性分析[J].食品与发酵工业, 2019, 45(6): 119-125.
[17] 黄金梅,胡居吾,高红,等.米渣肽双酶两步水解法制备过程中物化特性与结构变化[J].食品与发酵工业, 2019, 45(16): 32-39.
[18] 郭利娜,朱玉,刁明明,等.枯草芽孢杆菌发酵小米糠对其抗氧化肽含量与抗氧化活性的影响[J]. 食品科学, 2015, 36(13): 196-201.
[19] HER NNDEZ-LEDESMA B, DEL MAR CONTRERAS M, RECIO I. Antihypertensive peptides: Production, bioavailability and incorporation into foods[J]. Advances in Colloid and Interface Science, 2011, 165(1): 23-35.
NNDEZ-LEDESMA B, DEL MAR CONTRERAS M, RECIO I. Antihypertensive peptides: Production, bioavailability and incorporation into foods[J]. Advances in Colloid and Interface Science, 2011, 165(1): 23-35.
[20] 李慧娟,孙云鹏,丁鹏程,等. 混合菌固态发酵豆粕制备大豆活性肽[J]. 食品与发酵工业, 2014,40(11): 121-126.
[21] 何署剑. 粟米蛋白发酵制备活性肽及粟米糠油生物学功能研究[D].合肥:合肥工业大学,2016:19-30.
[22] AMADOU I, LE G W, AMZA T, et al. Purification and characterization of foxtail millet-derived peptides with antioxidant and antimicrobial activities[J]. Food Research International, 2013, 51(1): 422-428.
[23] CHEN Jing, DUAN Wei, REN Xin, et al.Effect of foxtail millet protein hydrolysates on lowering blood pressure in spontaneously hypertensive rats[J]. European Journal of Nutrition, 2017, 56(6): 2 129-2 138.
[24] 刘铭,刘玉环,王允圃,等. 制备、纯化和鉴定生物活性肽的研究进展及应用[J].食品与发酵工业, 2016, 42(4): 244-251.
[25] 王帅,刘剑利,霍雅鹏,等.小米抗氧化肽的纯化及抑制H2O2诱导的胰岛细胞氧化应激作用研究[J].食品科学, 2018, 39(19): 176-181.
[26] SIOW H L, GAN C Y. Extraction of antioxidative and antihypertensive bioactive peptides from Parkia speciosa seeds[J]. Food Chemistry, 2013, 141(4): 3 435-3 442.
[27] AGRAWAL H,JOSHI R,GUPTA M. Purification, identification and characterization of two novel antioxidant peptides from finger millet (Eleusine coracana) protein hydrolysate[J]. Food research international, 2019,120:697-707.
[28] MORITA M, NAITO Y, NIKI E, et al. Antioxidant action of fermented grain food supplement: Scavenging of peroxyl radicals and inhibition of plasma lipid oxidation induced by multiple oxidants[J]. Food Chemistry, 2017, 237(15): 574-580.
[29] TAHERI A, FARVIN K H S, JACOBSEN C, et al. Antioxidant activities and functional properties of protein and peptide fractions isolated from salted herring brine[J]. Food Chemistry, 2014, 142: 318-326.
[30] ZHU Chao, DONG Yuchen, LIU Haile, et al. Hesperetin protects against H2O2-triggered oxidative damage via upregulation of the Keap1-Nrf2/HO-1 signal pathway in ARPE-19 cells[J]. Biomedicine & Pharmacotherapy, 2017, 88: 124-133.
[31] MA Tianju, CHEN Tingjun, LI Peng, et al. Heme oxygenase-1 (HO-1) protects human lens epithelial cells (SRA01/04) against hydrogen peroxide (H2O2)-induced oxidative stress and apoptosis[J]. Experimental Eye Research, 2016, 146: 318-329.
[32] 陈彩霞,苏秀兰,韩瑞兰. 生物活性肽调节免疫功能的研究现状[J]. 现代预防医学, 2016,43(15):2 798-2 801.
[33] PARK Y W,NAM M S. Bioactive peptides in milk and dairy products: A review [J]. Korean Journal for Food Science of Animal Resources,2015,35(6): 831- 840.
[34] 刘剑利,曹向宇,李其久,等.小米多肽对小鼠免疫调节作用[J].中国公共卫生, 2012, 28(1): 44-45.
[35] 袁慧坤,袁文华,刁新平.抗菌肽的分离纯化研究进展[J].乡村科技, 2016(36): 43-44.
[36] 于丽娜,齐宏涛,张初署,等.响应面法优化超声波辅助酶解制备花生蛋白抗菌肽[J]. 核农学报, 2018, 32(4): 740-750.
[37] 顾晨涛,黄洒,王雪燕,等.鲫鱼鱼鳞抗菌多肽的制备纯化及其抑菌活性研究[J].食品科学, 2019, http://kns.cnki.net/kcms/detail/11.2206.TS.20190110.1258.004.html
[38] 韩玉竹,曾兵,孟醒,等. 辣椒籽抗菌肽对黄曲霉的抑制作用[J]. 食品与发酵工业, 2019, 45(6): 110-114.
[39] 白杰,贠建民,祝发明,等. 枯草芽孢杆菌菌株B3抗菌肽的分离纯化与鉴定[J].食品与发酵工业, 2018,44(8): 78-85.
[40] SEO J K, LEE M J, NAM B H, et al. Cg Molluscidin, a novel dibasic residue repeat rich antimicrobial peptide, purified from the gill of the Pacific oyster, Crassostrea gigas[J]. Fish & Shellfish Immunology, 2013, 35(2): 480-488.
[41] WANG Shuai, ZENG Xiangfang, YANG Qing, et al. Antimicrobial peptides as potential alternatives to antibiotics in food animal industry[J]. International Journal of Molecular Sciences, 2016, 17(5): 603.
[42] DA COSTA J P, COVA M, FERREIRA R, et al. Antimicrobial peptides: an alternative for innovative medicines?[J]. Applied Microbiology& Biotechnology, 2015, 99(5): 2 023-2 040.
[43] SOUSA J C, BERTO R F, GOIS E A, et al. Leptoglycin: A new Glycine/Leucine-rich antimicrobial peptide isolated from the skin secretion of the South American frog Leptodactylus pentadactylus(Leptodactylidae)[J]. Toxicon, 2009, 54(1): 23-32.
[44] ROSENFELD Y, LEV N, SHAI Y. Effect of the hydrophobicity to net positive charge ratio on antibacterial and anti-endotoxin activities of structurally similar antimicrobial peptides[J]. Biochemistry, 2010, 49(5): 853-861.
![]() M, JAKUBCZYK A, SZYMANOWSKA U, et al.Different temperature treatments of millet grains affect the biological activity of protein hydrolyzates and peptide fractions[J]. Nutrient, 2019, 11(3): 550-571.
M, JAKUBCZYK A, SZYMANOWSKA U, et al.Different temperature treatments of millet grains affect the biological activity of protein hydrolyzates and peptide fractions[J]. Nutrient, 2019, 11(3): 550-571.
[46] HONG Fang, LUO Ming, SHENG Yi, et al. The antihypertensive effect of peptides: A novel alternative to drugs [J]. Peptides, 2008, 29(6): 1 062-1 071.
[47] UHLIG T, KYPRIANOU T, MARTINELLI F G, et al. The emergence of peptides in the pharmaceutical business: From exploration to exploitation[J]. EuPA Open Proteomics, 2014, 4: 58-69.