黄曲霉毒素是由黄曲霉和寄生曲霉等真菌侵染食品产生的一类香豆素衍生物,目前已知的黄曲霉毒素有十几种,最常见的有黄曲霉毒素B1(aflatoxin B1, AFB1)、B2(aflatoxin B2, AFB2)、G1(aflatoxin G1, AFG1)、G2(aflatoxin G2, AFG2)、M1(aflatoxin M1, AFM1)、M2(aflatoxin M2, AFM2)六种,其中AFB1早在1993年就被世界卫生组织的癌症研究机构认定为I类致癌物质。黄曲霉毒素极易污染谷物、花生、玉米、粮油、饲料等食品和农产品,严重危害人畜安全。
食品污染物检测与分析是控制食品安全的重要方式,对保障食品安全发挥着重要作用。由于黄曲霉毒素具有稳定性强、不易清除、前端管控难等特点,因此,对食品和农产品中黄曲霉毒素进行检测与分析成为了控制毒素危害的主要措施之一,也一直是科学界研究的热点。目前,出版的黄曲霉毒素检测分析研究文献已经超过了2 000篇。常见的黄曲霉毒素检测方法有薄层色谱法、高效液相色谱法、液相色谱-质谱法、免疫层析法和酶联免疫吸附法等,这些方法各有利弊,如所需仪器昂贵、操作要求高、前处理复杂耗时等。电化学分析方法是继上述方法之后发展的一种分析方法,因操作简单、价格低廉、灵敏度高、响应快等优点,在食品检测分析领域特别是黄曲霉毒素检测分析中应用广泛[1-4]。随着纳米技术的不断发展,利用纳米材料的优良物理化学性能,将其整合进电化学分析中以提升检测灵敏度和稳定性,减少基质效应,成为近年来电化学分析研究的新趋势。碳纳米材料具有高比表面积,优异的电传输能力,良好的生物兼容性和易于官能化等优点,尤其受到分析研究领域科研工作者的青睐,在真菌毒素的电化学分析检测中发挥着越来越大的作用[5-6]。本文在简单概述了黄曲霉毒素检测方法和碳纳米材料在电化学分析应用中的主要功能作用的基础上,对基于碳纳米材料的黄曲霉毒素电化学检测方法做了详细介绍,并对其发展趋势进行了展望。
1 黄曲霉毒素检测方法
1.1 黄曲霉毒素传统检测方法
黄曲霉毒素是一类强致癌的生物毒素,由于其污染多种粮油作物和食品,且不易管控,世界各国均制定了严格的黄曲霉毒素限量标准,以保障人民的身体健康。我国国标(GB 2761—2017)规定谷物及其制品中AFB1限量在5.0~20 μg/kg,欧盟(EU)No165/2010规定坚果中AFB1的限量为2 μg/kg,黄曲霉毒素总量的限量值为4 μg/kg。日益严格的黄曲霉毒素限量规定,对其检测方法提出了更高的要求和更大的挑战。
薄层色谱法(thin-layer chromatography, TLC)是最早的黄曲霉毒素检测方法[7],其原理是:将黄曲霉毒素经过提取、浓缩、薄层分离后,在紫外光照射下观察其荧光特性,以产生的荧光信号强弱来对毒素的含量进行定性分析,方法的缺点是操作过程繁琐复杂、溶剂消耗大、对实验人员危害大、重现性差、灵敏度低。高效液相色谱法(high performance liquid chromatography, HPLC)[8]和液相色谱-质谱法(liquid chromatography-mass spectrometer, LC-MS)[9]是基于色谱原理的仪器分析方法,其优点是检出限低,一般检出限可达μg/kg,缺点是依赖大型仪器,成本高,前处理复杂。免疫层析法(immunochromatographic assay, ICA)[10]和酶联免疫吸附法(enzyme-linked immunosorbent assay, ELISA)[11]是基于抗体与检测物发生免疫反应而建立起来的免疫分析方法,优点是操作简单,缺点是受基质影响大,检测灵敏度和准确性不及仪器分析方法。
由于传统检测方法均有局限,因此探索环境友好、方便快捷、灵敏准确的黄曲霉毒素分析方法成为众多研究人员近年来努力的方向。
1.2 黄曲霉毒素电化学分析方法
电化学分析法是一种依据物质的电化学性质来测定物质组成及含量的分析方法。主要检测原理是将被测物与检测物发生的生物或化学反应所产生的信号经过换能器转变成相应的电信号,必要时经放大器将电信号再次放大并输出,以电信号的变化来间接分析待测物的浓度,常见检测物质有活性氧、酶、脱氧核糖核酸、葡萄糖等[12]。电化学分析方法自上世纪五六十年代起得到了较大的发展,作为生物、化学、物理、医学、电子技术等多学科互相渗透成长起来的交叉学科研究领域,因仪器简单、价格低廉、易于操作(通常不需要特殊的技术以及对前处理没有特别的要求)、灵敏度高、选择性好、稳定性高、响应快等优点在生命、环境、食品安全等多个领域得到了广泛应用[13-16]。1997年ANDREOU等首次将电化学分析方法用于脱脂牛奶中AFM1的检测[17],随后黄曲霉毒素的电化学分析方法研究逐渐发展成为当前黄曲霉毒素检测分析研究中最活跃的领域之一[1,4,13,18]。
根据检测的电信号的不同,黄曲霉毒素电化学分析法可以分为电流型、电导型、电位型和阻抗型等。电流型(又称安培型)的工作原理是在电压一定的情况下,通过检测待测物引发的响应电流,对待测物进行定量分析。谭芸[19]就构建了一种电流型的检测黄曲霉毒素的电化学分析方法:首先利用抗原抗体反应,将标记了辣根过氧化物酶(horse radish peroxidase,HRP)的抗体固定在电极表面,在HRP催化下,H2O2将对苯二酚氧化成对苯醌,对苯醌在电极上被还原,产生还原电流,以此来检测黄曲霉毒素。这类检测方法简单,成本低,但在固定材料、标记系统和电活性物质等方面还需改进。电导型的工作原理是基于待测物与检测物反应所引起的平行电极间电导变化来对待测物浓度进行测定的分析方法。LIU等[20]基于一种金微叉指电极和HRP建立了一种AFB1电化学免疫检测方法,该方法通过观察电解质电导的变化来测定AFB1的浓度。电导型分析方法易受待测物样品中的离子强度与缓冲液电容的变化影响,导致非特异性问题。电位型(又称电势型)的工作原理是基于测量电位变化来对待测物进行定量分析。LAROU等[21]基于生物电识别检测AFM1,该方法通过测量细胞膜上的电位变化来计算出待测样品中AFM1的含量。电位型检测方法成本低、反应快,但易受基质影响,在实际样品的检测中应用比电流型少。阻抗型的工作原理是以电子转移阻抗的变化值来反映被测物的量。OWINO等[22]在一种电合成聚苯胺的平台上构建了一种免疫阻抗响应的AFB1检测方法,将AFB1抗体固定在由聚苯胺和聚(苯乙烯磺酸)修饰的铂电极上,通过检测电子转移的情况来推导出AFB1的浓度。阻抗型检测方法的灵敏度较高、反应快,但体系成熟度不高,是当前主流类型中研究的热点。
虽然目前的电化学分析方法已经能够对黄曲霉毒素进行简便、快速、特异和灵敏的检测与分析,但在实际应用中仍会受到如基质效应、抗体固定、信号传输等不成熟的因素的影响。为了能构建更灵敏、更准确、更实用的新型电化学检测模式与方法,具有多种优良性能的纳米材料特别是碳纳米材料被引入到电化学分析中,并已展现出了巨大的潜在应用价值[23]。
2 碳纳米材料在电化学分析中的应用
碳纳米材料是指材料的三维尺度中至少有一维小于100 nm的碳材料。主要包括零维的碳量子点、富勒烯,一维的碳纳米管、碳纳米纤维,二维的石墨烯等及它们的衍生物。碳纳米材料不仅具有纳米效应,还有优异的电学性能(如较宽的电位窗口、快速的电子传输速度等)、强大的吸附性能、良好的化学稳定性和易于官能化的特性、良好的形状可控性和生物相容性等,为其在电化学分析中的应用奠定了基础[24]。
目前,碳纳米材料在黄曲霉毒素电化学分析应用中的主要作用有:充当生物分子的固载基体,提高电子传输速度,提升界面的电催化性能,吸附目标物和稳定体系等[25]。通常,碳纳米材料在电化学分析中的应用往往不仅仅局限于单一的作用与功能,大多时候是多功能的有效叠加来协同完成其对黄曲霉毒素分析性能的提升。如ARATI等[26]用纳米金(gold nanoparticles, AuNPs)修饰聚(3,4-乙烯二氧噻吩)(poly(2,3-dihydrothieno-1,4-dioxin), PEDOT)-氧化石墨烯(graphene oxide, GO)的纳米复合材料,构建了一种AFB1的电化学免疫分析方法。研究人员首先采用循环伏安法(cycle voltammetry, CV)和电化学阻抗谱法(electrochemical impedance spectroscopy, EIS)系统研究了被修饰的玻碳电极(glassy carbon electrode, GCE)的电催化行为,然后发现电流信号与磷酸缓冲液中的AFB1浓度在0.5~20 ng/mL和20~60 ng/mL两个区间内呈线性关系,由此构建的检测方法的灵敏度分别为0.989和0.397 μA/(ng/mL),检出限为0.109 ng/mL。该方法也被证实可以用于实际样品检测,在玉米的AFB1检测分析中的检出限为0.09 ng/mL。在这个方法的构建中GO不仅充当了抗体和纳米金颗粒的固载平台,同时为电子的快速传输提供了便利。GAN等[27]基于磁性氧化石墨烯萃取AFM1和抗体标记的碲化镉(CdTe)量子点(quantum dots,QDs)-碳纳米管纳米(carbon nanotubes, CNTs)复合材料构建了一种超灵敏的电化学发光(electrochemiluminescent, ECL)免疫分析方法检测牛奶中AFM1。该方法不仅利用了碳纳米材料的良好吸附特性,还证明了CNTs对ECL信号的放大作用。方法原理是将GO-Fe3O4磁性复合材料作为吸附剂提取牛奶中的AFM1,再将黄曲霉毒素M1抗体(AFM1-Ab1)与CdTe QDs-CNTs复合物结合形成信号标记物,并固定在丝网印刷碳电极(screen printed carbon electrode, SPCE)上,利用抗原抗体特异性识别反应形成的免疫复合物的电化学发光信号的强度来判定AFM1的含量。经过一系列的条件优化,AFM1在1.0~1.0×105 pg/mL对数与电化学发光信号呈现良好的线性关系,由此构建的分析方法检出限为0.3 pg/mL,远远高于ELISA方法。由此可见,碳纳米材料的多种优良特性已经被有效整合用于黄曲霉毒素的电化学分析中。
3 基于碳纳米材料的黄曲霉毒素电化学检测方法
3.1 石墨烯类纳米材料在黄曲霉毒素电化学检测分析中的应用
石墨烯(graphene, G)是由sp2杂化的碳原子组成的具有六角形蜂窝状结构的原子级厚度的二维纳米材料,是所有碳材料的基本组成单元。G具有快速的电子传递速率(200 000 cm2/(V·s))、优良的机械性能、高的热导率、大的比表面积(单层石墨烯的理论比表面积达2 630 m2/g)和良好的生物相容性[28],在电化学分析方法研究中应用广泛。GO是石墨烯片层被不同程度氧化后产生的一类石墨烯的衍生物,其制备通常由石墨氧化而成,比G获得更方便。GO因氧化程度不同,含氧官能团数量略有不同[29],由氧化而引起的丰富电化学缺陷与功能基团(羟基、羧基、羰基等)使其具有很强的耦合性,很容易与电化学活性物质、生物分子等物质偶联。含氧官能团的存在还使其具有良好的生物兼容性与亲水性,保证了偶联后的多种生物分子结构与活性不被破坏,为构建不同检测模式的黄曲霉毒素分析方法提供了便利。SRIVASTAVA等[30]将氧化石墨烯溶液均匀分散在金(Au)电极表面构建了GO/Au电极,通过偶联剂1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)与活化剂N-羟基琥珀酰亚胺(NHS)成功地将黄曲霉毒素抗体(anti-AFB1)固定在电极表面,并用牛血清蛋白(bull serum albumin, BSA)封闭电极表面非特异性位点构建了BSA/anti-AFB1/GO/Au免疫复合电极。采用EIS研究了该电极在含铁氰化钾的磷酸缓冲溶液中的电荷转移电阻(charge transfer resistance, Rct)与AFB1浓度的函数关系。结果表明,当AFB1在0.5~5 ng/mL,Rct与AFB1浓度呈良好的线性关系,检出限为0.23 ng/mL。
虽然GO易于偶联修饰,但是含氧官能团的存在也在一定程度上导致其导电性下降,限制了电信号传输速度。还原氧化石墨烯(reduced graphene oxide,rGO)是对GO片层的含氧官能团进行部分还原的石墨烯类纳米材料,结构与GO和G类似,但与GO相比,具有更快的电子传输速度,因此,在黄曲霉毒素的电化学分析中应用更为广泛。
SRIVASTAVA等[31]采用电泳沉积技术将rGO沉积在氧化铟锡(indium tin oxide, ITO)导电玻璃上,通过EDC/NHS法将黄曲霉毒素抗体(anti-AFB1)共价交联到rGO/ITO上,并运用CV和EIS研究了其电化学行为。当AFB1质量浓度在0.125~1.5 ng/mL时,阳极峰值电流与AFB1质量浓度呈线性关系,相关系数达0.99,检出限为0.15 ng/mL,灵敏度为68 μA/[(ng·mL-1)·cm2]。
近年来,科研人员又利用贵金属良好的电催化能力,将贵金属与石墨烯材料复合,建立了多种黄曲霉毒素电化学分析方法。SRIVASTAVA等[32]用金纳米粒子修饰的rGO沉积在ITO玻璃上构建了Au@rGO/ITO免疫电极,通过电流响应信号来检测AFB1,检测范围在0.1~12 ng/mL,检出限达0.1 ng/mL,比仅用rGO的检出限低。最近他们又利用水合肼将镍纳米粒子(Ni nanoparticles, Ni NPs)修饰在rGO上,再将复合材料沉积在ITO玻璃上构建了rGO-Ni NPs/ITO复合电极,用差分脉冲法(differential pulse voltammetry, DPV)检测AFB1毒素,构建的方法在1~8 ng/mL灵敏度达129.6 μA/[(ng·mL-1)·cm2],高灵敏度主要归功于rGO和Ni NPs间的协同效应[33]。ALTHAGAFI等[34]将金纳米点修饰的rGO纳米材料沉积到ITO导电玻璃上,再将抗体固定到复合电极上,利用抗原抗体反应后导致的电流值的变化,采用CV的电化学检测技术构建了一种超灵敏的AFB1检测方法,检出限可达到6.9 pg/mL,并在检测低浓度AFB1的加标花生样品中取得了良好效果。最近,石墨烯量子点(graphene quantum dots,GQDs)也基于上述检测模式被用于黄曲霉毒素电化学检测分析中。SHADJOU等[35]发明了一种AFM1电化学分析方法,该方法将石墨烯量子点、α-环糊精(α-cyclodextrin, α-CD)和银纳米粒子(silver nanoparticles, AgNPs)依次沉积到GCE上,制备了一种三元复合薄膜,通过线性扫描伏安法(linear sweep voltammetry,LSV)建立了AFM1检测方法。在此方法中α-环糊精作为传导介质,GQDs作为稳定剂,AgNPs作为电催化剂,共同促成了检测信号放大的目标。在最优条件下,方法的检测范围为0.015~25 mmol/L,定量限为2 μmol/L,该方法可用于未经任何处理的牛奶中AFM1的检测。SHU等[36]将四苯基卟啉钴(cobalt tetraphenyl porphyrin, CoTPP)和铂纳米粒子(platinum nanoparticles, PtNPs)功能化的rGO与AFB1抗体复合,形成anti-AFB1/PtNPs/CoTPP/rGO复合物。利用复合物与偶联了AFB1-BSA的纳米金修饰的GCE发生免疫反应,以PtNPs/CoTPP/rGO纳米复合物催化H2O2的还原产生的还原电流为电化学信号,采用差分脉冲伏安法建立了一种基于竞争型免疫分析模式的AFB1电化学分析方法,检出限达1.5 pg/mL。
导电聚合物是近年来电化学研究的热点之一。离子液体具有较高的电导率,常作为电解液应用于电化学分析中。除了贵金属,导电聚合物和离子液体也常和石墨烯类纳米材料一起被用于黄曲霉毒素的检测分析中。王瑞鑫等[37]将壳聚糖(chitosan, CS)、石墨烯和1-丁基-3-甲基咪唑基四氟硼酸盐离子液体(1-butyl-3-methyl imidazolium tetrafluoroborate ionic liquid, IL)混合溶液通过缩合反应固定在GCE上,再将AFB1抗体包埋固定,构建一种可用于快速测定食品中的AFB1的电化学免疫分析方法。运用CV和DPV法研究免疫反应对电极响应电流的影响,优化条件后,通过峰电流的降低值和AFB1浓度对数的线性关系,建立了检测范围在0.1~8.1 ng/mL的检测方法,检出限为0.04 ng/mL。并将该方法成功用于花生和玉米油样品中AFB1的检测中,回收率在94.73%~104.41%。WANG等[38]将还原氧化石墨烯、聚吡咯(polypyrrole, PPy)和吡咯丙酸(pyrrole propanoic acid, PPa)的复合溶液采用恒电流聚合法一步制成PPy/PPa/rGO纳米复合物薄膜在GCE电极上,并通过共价偶联将抗体固定在PPy/PPa/rGO/GCE电极表面,用于AFB1的超灵敏检测。通过探究抗体修饰后的电极在测试待测物前后的Rct变化与待测物中AFB1浓度之间的对应关系,建立了一个灵敏的AFB1检测方法,该方法在10 fg/mL~10 pg/mL的检测范围对AFB1有很好的响应。该方法不仅灵敏度低(检出限10 fg/mL),还具有很好的特异性,在相同浓度水平下,对AFB2、AFG1和AFG2的交叉反应率分别为5.0%,30.6%和20.1%,对呕吐毒素和赭曲霉毒素的交叉反应率均低于1.0%。
随着石墨烯类纳米材料在黄曲霉毒素电化学分析中应用研究的不断深入,科研人员也尝试将贵金属、离子液体或导电聚合物与石墨烯类纳米材料三者有机结合来协同提升黄曲霉毒素电化学分析的性能。SHI等[39]用纳米金修饰聚苯胺(polyaniline, PANI)/石墨烯纳米复合材料,并将其固定在金电极上形成Au/PANI/G/Au电极的检测传感器,利用免疫反应和方波伏安法(square wave cyclic voltammetry, SWV)建立AFB1的电化学分析方法,检测范围在0.05~25 ng/mL,检出限为0.034 ng/mL。ZHOU等[40]将GO、导电聚合物(2,5-di-(2-thienyl)-1-pyrrole-1-(pbenzoic acid), DPB)和金纳米粒子依次电沉积到金电极表面,紧接着通过EDC/NHS将黄曲霉毒素的抗体共价偶联在导电聚合物膜上,最后又将含壳聚糖的离子液体修饰在电极表面制备了用于食品样品中AFB1的电化学阻抗免疫分析方法。其中,石墨烯和金纳米颗粒保证了电子的快速传输,离子液体为抗体提供了一个温和的微环境,电化学阻抗测试保障了检测的高灵敏度。建立的AFB1的检测方法在3.2×10-15~0.32×10-12 mol/L具有良好线性关系,检出限低至1.0×10-15 mol/L,且对花生、大米、牛奶、面粉、大豆等食品样品的加标回收率在96.3%~101.2%,具有良好的精密度和准确性。
石墨烯纳米材料除了可以用于基于抗原抗体免疫反应的电化学检测模式,也同样适用于适配体(aptamer, Apt)识别黄曲霉毒素的电化学检测模式。GOUD等[41]就基于功能化氧化石墨烯(functional graphene oxide, FGO)和适配体技术构建了一种可用于酒精饮料中AFB1的检测方法,FGO被沉积在了丝网印刷碳电极上(screen-printed carbon electrode, SPCE),己二胺(hexamethylenediamine, HMDA)通过EDC/NHS共价偶联在FGO上,形成了一个空间结构,再将可识别AFB1的标记有亚甲基蓝(methylene blue, MB)的适配体共价偶联到HMDA上,通过适配体识别AFB1产生的空间结构变化导致的亚甲基蓝电信号的变化来进行定量检测。FGO在其中不仅作为固定适配体的平台,同时能辅助电催化放大亚甲基蓝电化学信号。构建的方法在0.05~6 ng/mL具有很好的线性关系,检出限为0.05 ng/mL。
GELETA等[42]构建了一种基于还原氧化石墨烯/二硫化钼/聚苯胺纳米复合材料的黄曲霉毒素电化学分析方法,他们将合成的纳米复合材料与壳聚糖混合后包覆在玻碳电极表面,然后将纳米金和AFB1适配体依次修饰到电极上,利用毒素与适配体发生的空间结构变化导致的电子交换的阻滞引起的电流响应变化,通过DPV法建立了AFB1的检测方法,检测范围在1.0×10-17~1.0×10-15 g/mL,检出限为2×10-18 g/mL。该方法的选择性强,并已经成功用于酒中AFB1的检测。
KHOSHFETRAT等[43]开发了一种基于适配体技术和GO的用于牛奶中AFM1检测的电化学发光方法。首先,硫醇化的AFM1适配体固定在金纳米粒子覆盖的磁性纳米颗粒(gold-coated magnetic nanoparticles,GMNPs)上,形成Apt-GMNPs复合物。鲁米诺官能化的银纳米粒子修饰的氧化石墨烯(luminol-functionalized, silver nanoparticle-decorated, graphene oxide, GO-L-AgNPs)通过GO与适配体上未配对的碱基产生的π-π作用,成功与Apt-GMNPs结合,形成Apt-GMNPs-GO-L-AgNPs复合物。当AFM1存在时,适配体与毒素反应导致GO-L-AgNPs脱离,由此导致了电化学发光信号的变化。基于上述原理作者建立了一种AFM1的分析范围在5~150 ng/mL、检出限为0.01 ng/mL的分析方法,该方法已经成功地用于牛奶中AFM1的检测,且重现性可靠。
3.2 碳纳米管在黄曲霉毒素电化学检测分析中的应用
碳纳米管是由层状结构的石墨片层卷曲而成的一类碳纳米材料。按照管壁片层数分类,碳纳米管主要分为单壁碳纳米管(single-walled carbon nanotubes, SWCNTs)和多壁碳纳米管(multi-walled carbon nanotubes, MWCNTs)。碳纳米管中碳原子以sp2杂化为主,同时六角型网格结构存在一定程度的弯曲,形成空间拓扑结构,其中可形成一定的sp3杂化键,即形成的化学键同时具有sp2和sp3混合杂化状态,而这些p轨道彼此交叠在碳纳米管的片层外,形成高度离域化的大π键,碳纳米管外表面的大π键是碳纳米管与一些具有共轭性能的大分子以非共价键复合的化学基础。由于共轭效应显著,碳纳米管具有一些特殊的电学性能,它既具有金属性和半导体性,又具有较高的导电性和良好的电催化活性,因而成为一种优良的电子传输体,在电化学检测分析中能大大加快电子在电活性物质之间的传递[44]。
利用免疫反应建立检测模式,再利用碳纳米管的优异电化学特性,科研人员开发了不少黄曲霉毒素电化学免疫分析方法。SINGH等[45]将羧基化多壁碳纳米管(carboxylated multiwalled carbon nanotubes,c-MWCNTs)通过电泳技术一步沉积在ITO玻璃上制得c-MWCNTs/ITO复合电极。通过EDC和NHS将黄曲霉单克隆抗体(anti-AFB1)共价偶联在复合电极上,并用BSA封闭其非特异性活性位点,制备了BSA/anti-AFB1/MWCNTs/ITO免疫电极。此电极的缔合常数低至0.091 5 ng/mL,表明此电极对AFB1有很强的亲和力。利用循环伏安技术建立分析方法,结果表明,AFB1检测的线性范围在0.25~1.375 ng/mL,检出限为0.08 ng/mL,灵敏度高达95.2 μA/[(ng·mL-1)·cm2]。ZHANG等[46]设计了一种基于单壁碳纳米管/壳聚糖(SWCNTs/CS)的间接竞争型AFB1电化学免疫分析方法。首先,将SWCNTs/CS纳米复合物滴涂在玻碳电极表面,制得SWCNTs/CS/GCE电极;经EDC/NHS反应将AFB1-BSA固定在电极表面,用BSA封闭多余的位点。然后,利用AFB1抗体与固定在电极表面的AFB1-BSA和待测液中游离的AFB1竞争,将AFB1抗体固定在电极上之后,碱性磷酸酶(alkaline phosphatase, AP)标记的二抗(AP-anti-antibody)通过与一抗反应被选择性固定到电极表面。最后,复合电极被沉浸在含α-萘基磷酸(α-naphthyl Phosphate,α-NP)的二乙醇胺溶液中,通过碱性磷酸酶催化水解α-NP产生的电化学信号来达到间接检测AFB1浓度的目的。差分脉冲伏安测试结果表明,在0.01~100 ng/mL,电流密度随AFB1浓度的对数呈线性降低,检出限低至3.5 pg/mL。在实际玉米粉样品中对AFB1的检出限低至13.5 pg/mL,大大低于大多数国家设置的限量标准。
碳纳米管也常与具有电活性的物质(如离子液体)一起用于黄曲霉毒素的电化学检测分析中。YU等[47]将多壁碳纳米管、1-丁基-3-甲基咪唑六氟磷酸盐(1-butyl-3-methylimidazolium hexafluorophosphate,[BMIM]PF6)离子液体和黄曲霉毒素抗体组成的复合物修饰在GCE电极表面,通过与黄曲霉毒素发生特异性免疫反应,用免疫反应前后其电子传输电阻与AFB1浓度的线性关系来检测黄曲霉毒素,检测范围在0.1~10 ng/mL,检出限低至0.03 ng/mL,并成功用于橄榄油中黄曲霉毒素的检测。ZHANG等[48]将电活性物质聚二烯丙基二甲基氯化铵(poly(diallyl dimethyl ammonium chloride), PDDA)作为碳纳米管的分散剂和电荷调节剂,制备出碳纳米管/聚二烯丙基二甲基氯化铵/钯金纳米粒子(CNTs/PDDA/Pd-Au)复合物,将其修饰在金电极上,再将黄曲霉毒素抗体(anti-AFB1)和BSA依次固定在电极上,利用免疫反应和差分脉冲伏安法来对AFB1进行定量分析,构建的方法的检测范围在0.05~25 ng/mL,检出限达0.03 ng/mL,并成功用于污染大米的检测中。
贵金属能与多种生物分子兼容,且有良好的电催化活性,因此,与碳纳米管共同构建的黄曲霉毒素电化学分析方法也屡有报道。LI等[49]将黄曲霉毒素氧化酶(aflatoxin-oxidase, AFO)嵌入硅的溶胶-凝胶溶液中与多壁碳纳米管修饰的铂电极偶联,形成AFO sol-gel/MWCNT/Pt电极,用于催化氧化AFB1,通过计时电流法(chronoamperometry, I-t)建立了黄曲霉毒素电化学分析方法,该方法在AFB1浓度为3.2×10-9~721×10-9 mol/L呈良好线性,灵敏度为0.33×102 A/[(mol·L-1)·cm2],检出限为1.6×10-9 mol/L。WANG等[50]采用分步法构建了一种分子印迹的AFB1电化学检测方法。首先将Au/Pt双金属纳米粒子(Au/Pt bimetallic Nanoparticles, Au/PtNPs)电沉积在多壁碳纳米管修饰的玻碳电极上,然后将邻苯二胺(OPD)和AFB1电聚合在Au/PtNPs-MCNTs-GCE电极表面,最后用盐酸将印迹分子AFB1去除得到MIPOPD-Au/PtNPs-MCNTs-GCE电极。通过循环伏安技术、差分脉冲伏安技术和电化学阻抗谱考察了其电化学分析的性能。由差分脉冲伏安技术建立了AFB1电化学分析方法,检测范围在1×10-10~1×10-5 mol/L,检出限为0.03 nmol/L,并证实该方法可应用于地沟油中AFB1的检测。
3.3 其他碳纳米材料在黄曲霉毒素电化学检测分析中的应用
其他碳纳米材料如碳纳米角、介孔碳、碳量子点、碳纳米球等也因为其不同的微观结构和独特的物理化学特性,被用于电化学分析中。如介孔碳材料具有高电导率、物理化学稳定性和高比表面积等优点,被广泛应用于催化领域中,特别是用于电极材料和电催化剂等[51]。碳纳米球具有规则的几何外形、较高的比表面和良好的生物相容性,常被用于制备新型多酶标记物[52],用于放大信号提升分析的灵敏度。
近年来,也有其他的碳纳米材料被用于黄曲霉毒素的电化学分析检测。MONDAL等[53]采用静电纺丝技术和旋转涂布技术在硅晶片表面合成了聚甲基丙烯酸甲酯(poly(methyl methacrylate), PMMA)和聚丙烯腈(polyacrylonitrile, PAN)的两层复合膜,再经高温炭化分解去除聚PMMA纤维,制备出内嵌在PAN无定型碳电极上的微孔孔道,然后再采用热分解法将铂纳米粒子修饰在微孔孔道上,通过EDC/NHS将黄曲霉毒素单克隆抗体共价交联到PtNPs/微孔碳电极表面,通过免疫反应引起的阻抗变化建立了黄曲霉毒素分析方法,检测范围在1.0×10-12~0.1×10-6 g/mL,检出限为1.0×10-12 g/mL。微孔碳电极不仅为PtNPs的沉积和抗原抗体反应提供了一个微环境,而且使得电子传输速度提升,从而促进了电化学性能的提升。
XU等[54]构建了一种基于碳纳米角(carbon nanohorns, CNHs)和磁性纳米材料的AFB1电化学发光免疫分析方法。在磁性玻碳电极(magnetic glassy carbon electrode, MGCE)上依次修饰上CNHs和吸附了鲁米诺的Fe3O4磁性纤维(luminol-functionalized Fe3O4 nanofibers, L-Fe3O4-NFs),通过共价反应将黄曲霉毒素抗体偶联在L-Fe3O4-NFs/CNHs/MGCE复合电极,用BSA封闭非特异性位点,利用免疫反应和鲁米诺产生的电化学发光信号来建立AFB1检测方法。具有优良导电性、生物相容性、大比表面积和可变孔隙度的CNHs可以大大提升鲁米诺的电化学发光信号,Fe3O4纳米材料可以大量吸附信号材料鲁米诺,也是固定抗体的基底,并使得抗体能大量富集到MGCE表面。建立的AFB1的分析方法检出限可达0.02 ng/mL,检测范围在0.05~200 ng/mL。
4 结论与展望
食品安全与人类健康紧密相连,食品质量安全也是近年来人民和政府关注和重视的热点问题。电化学分析方法一直是环境、农业和食品检测领域的重要分析方法。随着材料科学和纳米技术的不断发展,电化学分析方法的性能与效率也在不断提高。目前,黄曲霉毒素电化学检测方法虽然较传统的酶联免疫吸附法和色谱法具有很多优势,但仍有很大的发展空间。
表1 碳纳米材料在黄曲霉毒素电化学分析中的应用
Table 1 Applications of carbon nanomaterials in analysis of aflatoxins with electrochemical techniques
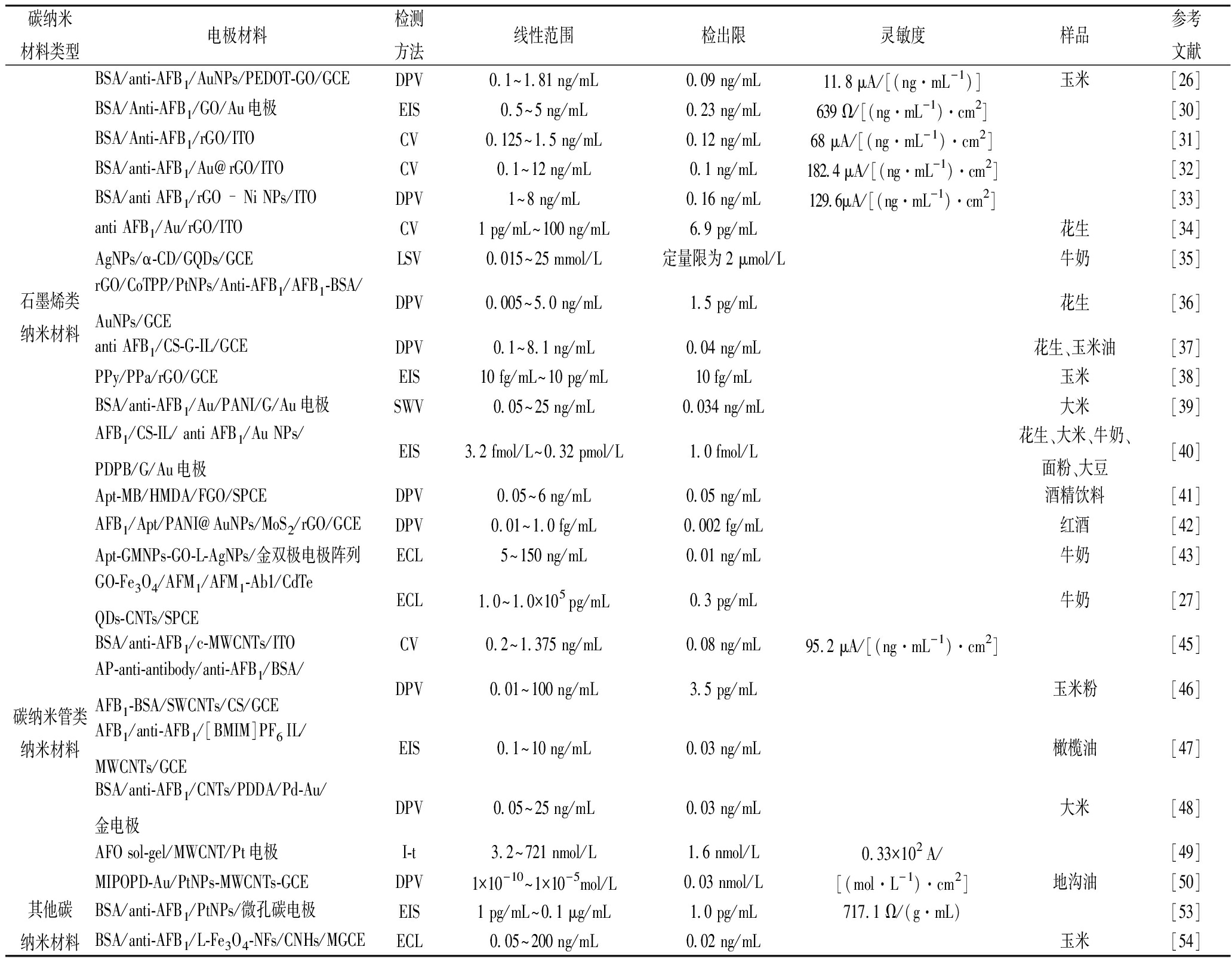
碳纳米材料类型电极材料检测方法线性范围检出限灵敏度样品参考文献石墨烯类纳米材料BSA/anti-AFB1/AuNPs/PEDOT-GO/GCEDPV0.1~1.81 ng/mL0.09 ng/mL11.8 μA/[(ng·mL-1)]玉米[26]BSA/Anti-AFB1/GO/Au电极EIS0.5~5 ng/mL0.23 ng/mL639 Ω/[(ng·mL-1)·cm2][30]BSA/Anti-AFB1/rGO/ITOCV0.125~1.5 ng/mL0.12 ng/mL68 μA/[(ng·mL-1)·cm2][31]BSA/anti-AFB1/Au@rGO/ITOCV0.1~12 ng/mL0.1 ng/mL182.4 μA/[(ng·mL-1)·cm2][32]BSA/anti AFB1/rGO-Ni NPs/ITODPV1~8 ng/mL0.16 ng/mL129.6μA/[(ng·mL-1)·cm2][33]anti AFB1/Au/rGO/ITOCV1 pg/mL~100 ng/mL6.9 pg/mL花生[34]AgNPs/α-CD/GQDs/GCELSV0.015~25 mmol/L定量限为2 μmol/L牛奶[35]rGO/CoTPP/PtNPs/Anti-AFB1/AFB1-BSA/AuNPs/GCEDPV0.005~5.0 ng/mL1.5 pg/mL花生[36]anti AFB1/CS-G-IL/GCEDPV0.1~8.1 ng/mL0.04 ng/mL花生、玉米油[37]PPy/PPa/rGO/GCEEIS10 fg/mL~10 pg/mL10 fg/mL玉米[38]BSA/anti-AFB1/Au/PANI/G/Au电极SWV0.05~25 ng/mL0.034 ng/mL大米[39]AFB1/CS-IL/ anti AFB1/Au NPs/PDPB/G/Au电极EIS3.2 fmol/L~0.32 pmol/L1.0 fmol/L花生、大米、牛奶、面粉、大豆[40]Apt-MB/HMDA/FGO/SPCEDPV0.05~6 ng/mL0.05 ng/mL酒精饮料[41]AFB1/Apt/PANI@AuNPs/MoS2/rGO/GCEDPV0.01~1.0 fg/mL0.002 fg/mL红酒[42]Apt-GMNPs-GO-L-AgNPs/金双极电极阵列ECL5~150 ng/mL0.01 ng/mL牛奶[43]碳纳米管类纳米材料GO-Fe3O4/AFM1/AFM1-Ab1/CdTeQDs-CNTs/SPCEECL1.0~1.0×105 pg/mL0.3 pg/mL牛奶[27]BSA/anti-AFB1/c-MWCNTs/ITOCV0.2~1.375 ng/mL0.08 ng/mL95.2 μA/[(ng·mL-1)·cm2][45]AP-anti-antibody/anti-AFB1/BSA/AFB1-BSA/SWCNTs/CS/GCEDPV0.01~100 ng/mL3.5 pg/mL玉米粉[46]AFB1/anti-AFB1/[BMIM]PF6 IL/MWCNTs/GCEEIS0.1~10 ng/mL0.03 ng/mL橄榄油[47]BSA/anti-AFB1/CNTs/PDDA/Pd-Au/金电极DPV0.05~25 ng/mL0.03 ng/mL大米[48]AFO sol-gel/MWCNT/Pt电极I-t3.2~721 nmol/L1.6 nmol/L0.33×102 A/[49]MIPOPD-Au/PtNPs-MWCNTs-GCEDPV1×10-10~1×10-5mol/L0.03 nmol/L[(mol·L-1)·cm2]地沟油[50]其他碳纳米材料BSA/anti-AFB1/PtNPs/微孔碳电极EIS1 pg/mL~0.1 μg/mL1.0 pg/mL717.1 Ω/(g·mL)[53]BSA/anti-AFB1/L-Fe3O4-NFs/CNHs/MGCEECL0.05~200 ng/mL0.02 ng/mL玉米[54]
注:电极材料和检测方法中的英文缩写均在正文中有注释。
(1)检测通量有待提高。目前大多数方法只能测定单一组分,这显然限制了其实际应用,发展可以同时检测多种黄曲霉毒素或生物毒素的方法,对保障食品安全意义重大。
(2)实用、便携、可重复使用、快速的检测方法及分析装置还有待进一步研究。目前,大部分用于黄曲霉毒素检测的电化学传感装置仍处于实验室研究阶段,很难像商业化试剂盒或血糖仪那样方便快捷的对样品进行实时检测。同时,大部分建立的黄曲霉毒素分析方法都是基于磷酸缓冲溶液中的毒素,对实际样品的检测效果就会受基质干扰而大打折扣,或实用性不强。因此,改进方法的实用性也将是未来科学研究努力的方向之一。
(3)研发新检测模式。现有方法的检测模式有许多,如识别技术有免疫方法、适配体技术、分子印迹等,碳纳米材料的功能使用上有利于吸附特性、结构特性、电学特性、光学特性等,目前的研究已经在多检测模式融合和碳纳米材料的多用途利用方面进行了不少大胆的尝试,相信这也将成为黄曲霉毒素电化学分析研究下一步的发展方向。采取多种检测模式联用技术有望在利用二者或多者间的协同作用,提升黄曲霉毒素的检测与分析性能。表1汇总了近年来碳纳米材料在黄曲霉毒素电化学分析中的应用情况。
(4)研发新材料。利用纳米材料,特别是碳纳米管、石墨烯、纳米金和磁性纳米粒子等,构建复合材料用于黄曲霉毒素检测的文献呈现逐年增加的趋势。因此,要想继续提升分析检测的灵敏度和准确度,还须从材料入手,探索具有更强亲和力和分子识别能力的识别材料以及可以放大电化学信号的信标材料。
[1] 马海华,张元,甄彤,等.电化学生物传感器在黄曲霉毒素检测中的研究进展[J].中国粮油学报,2016,31(2):132-140.
[2] CHAUHAN R,SINGH J,SACHDEV T,et al.Recent advances in mycotoxins detection[J].Biosensors and Bioelectronics,2016,81:532-545.
[3] CHEN L,JIANG J,SHEN G,et al. A label-free electrochemical impedance immunosensor for the sensitive detection of aflatoxin B1[J]. Analytical Methods, 2015,7 (6):2 354-2 359.
[4] 李庆川,曹立新,胡海峰,等.黄曲霉毒素电化学生物传感器[J].化学进展,2014,26(4):657-664.
[5] MALHOTRA B D,SRIVASTAVA S,ALI M A,et al.Nanomaterial-based biosensors for food toxin detection[J].Applied Biochemistry and Biotechnology,2014,174(3):880-896.
[6] CAMPAS M,GARIBO D,PRIETO-SIMON B. Novel nanobiotechnological concepts in electrochemical biosensors for the analysis of toxins[J].Analyst,2012,137(5):1 055-1 067.
[7] 李晓丹.真菌毒素检测技术研究概述[J].现代食品,2018,31(12):93-101.
[8] SOLEIMANY F,JINAP S,RAHMANI A,et al.Simultaneous detection of 12 mycotoxins in cereals using RP-HPLC-PDA-FLD with PHRED and a post-column derivatization system[J].Food Additives and Contaminants,2011,28(4):494-501.
[9] FAN S F,LI Q,SUN L,et al.Simultaneous determination of aflatoxin B1 and M1 in milk, fresh milk and milk powder by LC-MS/MS utilising online turbulent flow chromatography[J].Food Additives and Contaminants,2015,32(7):1 175-1 184.
[10] ZHANG D H,LI P W,YANG Y,et al.A high selective immunochromatographic assay for rapid detection of aflatoxin B1[J].Talanta,2011,85(1):736-742.
[11] XIONG Y,PEI K,WU Y Q,et al.Plasmonic ELISA based on enzyme-assisted etching of Au nanorods for the highly sensitive detection of aflatoxin B1 in corn samples[J].Sensors and Actuators B:Chemical,2018,267:320-327.
[12] 赵静.电化学传感器在黄曲霉产毒机制研究中的应用[D].重庆:西南大学,2017.
[13] CATANANTE G,RHOUATI A,HAYAT A,et al.An Overview of recent electrochemical immunosensing strategies for mycotoxins detection[J].Electroanalysis,2016,28(8):1 750-1 763.
[14] CORDEIRO T A R,GONCALVES M V C,FRANCO D L,et al.Label-free electrochemical impedance immunosensor based on modified screen-printed gold electrodes for the diagnosis of canine visceral leishmaniasis[J].Talanta,2019,195:327-332.
[15] LIEBERZEIT P A,DICKERT F L.Sensor technology and its application in environmental analysis[J].Analytical and Bioanalytical Chemistry,2007,387(1):237-247.
[16] FLAMPOURI E,IMAR S,OCONNELL K,et al.Spheroid-3D and monolayer-2D intestinal electrochemical biosensor for toxicity/viability testing: Applications in drug screening, food safety, and environmental pollutant analysis[J].American Chemical Society Sensor,2019,4(3):660-669.
[17] ANDREOU V G,NIKOLELIS D P.Electrochemical transduction of interactions of aflatoxin Ml with bilayer lipid membranes (BLMs) for the construction of one-shot sensors[J].Sensors and Actuators B:Chemical,1997,41(1-3):213-216.
[18] VIDAL J C,BONEL L,EZQUERRA A,et al.Electrochemical affinity biosensors for detection of mycotoxins: A review[J].Biosensors and Bioelectronics,2013,49:146-158.
[19] 谭芸.电化学免疫传感器用于黄曲霉毒素和蛋白质检测的研究[D].长沙:湖南大学,2009.
[20] LIU Y,QIN Z H,WU X F,et al.Immune-biosensor for aflatoxin B1 based bio-electrocatalytic reaction on micro-comb electrode[J].Biochemical Engineering Journal,2006,32(3):211-217.
[21] LAROU E,YIAKOUMETTIS I,KALTSAS G,et al.High throughput cellular biosensor for the ultra-sensitive, ultra-rapid detection of aflatoxin M1[J].Food Control,2013,29(1):208-212.
[22] OWINO J H O,IGNASZAK A,AL-AHMED A,et al.Modelling of the impedimetric responses of an aflatoxin B1 immunosensor prepared on an electrosynthetic polyaniline platform[J].Analytical and Bioanalytical Chemistry,2007,388(5-6):1 069-1 074.
[23] 刘亚青,林晓东,尹晋津,等.新型真菌毒素电化学传感器的研究进展[J].天津科技大学学报,2017,32(3):1-11.
[24] REVERTE L,PRIETO-SIMON B,CAMPAS M.New advances in electrochemical biosensors for the detection of toxins: Nanomaterials, magnetic beads and microfluidics systems. A review[J].Analytica Chimica Acta,2016,908:8-21.
[25] WANG X,NIESSNER R,TANG D,et al.Nanoparticle-based immunosensors and immunoassays for aflatoxins[J].Analytica Chimica Acta,2016,912:10-23.
[26] SHAMA A,KUMAR A,KHAN R.A highly sensitive amperometric immunosensor probe based on gold nanoparticle functionalized poly (3, 4-ethylenedioxythiophene) doped with graphene oxide for efficient detection of aflatoxin B1[J].Synthetic Metals,2018,235:136-144.
[27] GAN N,ZHOU J,XIONG P,et al.An ultrasensitive electrochemiluminescent immunoassay for aflatoxin M1 in milk, based on extraction by magnetic graphene and detection by antibody-labeled CdTe quantumn dots-carbon nanotubes nanocomposite[J].Toxins,2013,5(5):865-883.
[28] 喻理,李培武,张奇,等.基于石墨烯的真菌毒素检测方法研究进展[J].分析测试学报,2013,32(12):1 515-1 522.
[29] 喻理,李培武,张奇,等.石墨烯吸附材料及其在真菌毒素检测中的应用[J].分析测试学报,2015,34(10):1 204-1 212.
[30] SRIVASTAVA S,ALI M A,UMRAO S,et al.Graphene oxide-based biosensor for food toxin detection[J].Applied Biochemistry and Biotechnology,2014,174(3):960-970.
[31] SRIVASTAVA S,KUMAR V,ALI M A,et al.Electrophoretically deposited reduced graphene oxide platform for food toxin detection[J].Nanoscale,2013,5(7):3 043-3 051.
[32] SRIVASTAVA S,ABRAHAM S,SINGH C,et al.Protein conjugated carboxylated gold@reduced graphene oxide for aflatoxin B1 detection[J].RSC Advances,2014,5(7):5 406-5 414.
[33] SRIVASTAVA S,KUMAR V,ARORA K,et al.Antibody conjugated metal nanoparticle decorated graphene sheets for a mycotoxin sensor[J].RSC Advances,2016,6(61):56 518-56 526.
[34] ALTHAGAFI I I,AHMED S A,EI-SAID W A,et al.Fabrication of gold/graphene nanostructures modified ITO electrode as highly sensitive electrochemical detection of aflatoxin B1[J].Plos One,2019,14(1):e0210652.
[35] SHADJOU R,HASANZADEH M,HEIDAR-POOR M,et al.Electrochemical monitoring of aflatoxin M1 in milk samples using silver nanoparticles dispersed on α-cyclodextrin-GQDs nanocomposite[J].Journal of Molecular Recognition,2018,31(6):e2699.
[36] SHU J,QIU Z L,WEI Q H,et al.Cobalt-porphyrin-platinum-functionalized reduced graphene oxide hybrid nanostructures: A novel peroxidase mimetic system for improved electrochemical immunoassay[J].Scientific Reports,2015,5:15 113.
[37] 王瑞鑫,冯亚净,李书国.基于石墨烯/离子液体构建免疫传感器快速测定食品中黄曲霉毒素B1[J].食品科学,2016,37(20):120-125.
[38] WANG D,HU W H,XIONG Y H,et al.Multifunctionalized reduced graphene oxide-doped polypyrrole/pyrrolepropylic acid nanocomposite impedimetric immunosensor to ultra-sensitively detect small molecular aflatoxin B1[J].Biosensors and Bioelectronics,2015,63:185-189.
[39] SHI L,WANG Z F,YANG G M,et al.Electrochemical immunosensor for aflatoxin B1 based on polyaniline/graphene nanohybrids decorated with Au Nanoparticle[J].Electrochemistry,2017,85(7):384-390.
[40] ZHOU L T,LI R Y,LI Z J,et al.An immunosensor for ultrasensitive detection of aflatoxin B1 with an enhanced electrochemical performance based on graphene/conducting polymer/gold nanoparticles/the ionic liquid composite film on modified gold electrode with electrodeposition[J].Sensors and Actuators B:Chemical,2012,174:359-365.
[41] GOUD K Y,HAYAT A,CATANANTE G,et al.An electrochemical aptasensor based on functionalized graphene oxide assisted electrocatalytic signal amplification of methylene blue for aflatoxin B1 detection[J].Electrochimica Acta,2017,244:96-103.
[42] GELETA G S, ZHAO Z, WANG Z X.A novel reduced graphene oxide/molybdenum disulfide/polyaniline nanocomposite-based electrochemical aptasensor for detection of aflatoxin B1[J].Analyst,2018,143:1 644-1 649.
[43] KHOSHFETRAT S M, BAGHERI H,MEHRGARDI M A,et al.Visual electrochemiluminescence biosensing of aflatoxin M1 based on luminol-functionalized, silver nanoparticle-decorated graphene oxide[J].Biosensors and Bioelectronics, 2018,100:382-388.
[44] 杜珩,李敏亮.改性碳纳米管专利技术综述[J].广东化工,2018,45(17):93-110.
[45] SINGH C,SRIVASTAVA S,ALI M A,et al.Carboxylated multiwalled carbon nanotubes based biosensor for aflatoxin detection[J].Sensors And Actuators B:Chemical,2013,185:258-264.
[46] ZHANG X,LI C R,WANG W C,et al.A novel electrochemical immunosensor for highly sensitive detection of aflatoxin B1 in corn using single-walled carbon nanotubes/chitosan[J].Food Chemistry,2016,192:197-202.
[47] YU L,ZHANG Y,HU C,et al.Highly sensitive electrochemical impedance spectroscopy immunosensor for the detection of AFB1 in olive oil[J].Food Chemistry,2015,176:22-26.
[48] ZHANG S B,SHEN Y M,SHEN G Y,et al.Electrochemical immunosensor based on Pd-Au nanoparticles supported on functionalized PDDA-MWCNT nanocomposites for aflatoxin B1 detection[J].Analytical Biochemistry,2016,494:10-15.
[49] LI S C,CHEN J H,CAO H,et al.Amperometric biosensor for aflatoxin B1 based on aflatoxin-oxidase immobilized on multiwalled carbon nanotubes[J].Food Control,2011,22(1):43-49.
[50] WANG Z H,LI J S,XU L J,et al.Electrochemical sensor for determination of aflatoxin B1 based on multiwalled carbon nanotubes-supported Au/Pt bimetallic nanoparticles[J].Journal of Solid State Electrochemistry,2014,18(9):2 487-2 496.
[51] 宋琵鹏.微孔聚合物及微孔碳材料负载金属催化剂在催化及电催化中的应用研究[D].武汉:华中科技大学,2016.
[52] 甘翠芬,何祖宇,孙子洪,等.新型碳纳米材料在电化学免疫传感器的应用[J].广东化工,2014,15(41):109-111.
[53] MONDAL K,ALI M A,SRIVASTAVA S,et al.Electrospun functional micro/nanochannels embedded in porous carbon electrodes for microfluidic biosensing[J].Sensors and Actuators B:Chemical,2016,229:82-91.
[54] XU G F,ZHANG S P,ZHANG Q R,et al.Magnetic functionalized electrospun nanofibers for magnetically controlled ultrasensitive label-free electrochemiluminescent immune detection of aflatoxin B1[J].Sensors and Actuators B:Chemical,2016,222:707-713.