目前,高血压已经成为世界范围内心、脑血管疾病发病和死亡的主要危险因素,常常还伴有肥胖、糖尿病及其他心、脑血管疾病等并发症。国务院新闻办发布的《中国居民营养与慢性病状况报告(2015)》[1]内容显示,2012年全国18岁及以上的成人高血压患病率达25.2%。随着国家经济发展和人民生活水平的提高,预防和控制高血压刻不容缓。血管紧张素转换酶抑制肽(angiotensin converting enzyme inhibitory peptides,ACE IPs),又称降血压肽(antihypertensive peptides),是一类能够降低血压的小分子肽的统称。研究表明,降血压肽适用于高血压伴心肌梗死和轻度肾功能损害的患者,具有降血压效果,且不会影响病人血糖和血脂的正常代谢[2]。其中,化学合成的降血压肽易引发咳嗽、喉咙肿痛等副作用,因此该类药物的使用率降低。研究人员针对于无副作用,且不影响正常血压的食源性降血压肽做了大量研究。目前研究者们已在球等金鞭藻[3]、罗非鱼[4]、绿豆[5]、番茄[6]、核桃[7]、面粉[8]、菜籽[9]等各类食物中制备出了降血压肽。
与陆生食源蛋白质不同,海洋藻类(marine algae)来源的蛋白质具有特殊的蛋白质组成和氨基酸序列,且海洋藻类中还富含氨基酸类、糖类等多种生物活性物质,因此被赋予多种功能活性,如抗氧化、抗病毒、降血压等[10-12]。全世界已知藻类有3万多种,可分为12门,其中有11门海生种类,目前研究利用较多的有红藻类、褐藻类、绿藻类、蓝藻类等。近年来,世界海藻养殖产量逐年增长,联合国粮农组织“2018年世界渔业和水产养殖状况”报告指出:2016年世界海藻养殖总量达3 120万t,而我国作为海藻养殖大国,同年海藻养殖总量占世界海藻养殖总量的47.9%。研究表明,海洋藻类可以为人类提供丰富的优质蛋白质,且海藻蛋白质中氨基酸组成良好,是制备降血压肽的良好来源。本文对海洋藻类ACE IPs的酶法制备及其降血压活性的评价模型进行了综述,以期为海洋藻类开发利用提供参考。
1 作用机制
血管紧张素转换酶(angiotensin converting enzyme,ACE)通过锌离子、氢键和带正电荷的残基结合位点等活性位点作用于血压调节系统种的血管紧张素(angiotensin,Ang)和舒缓激肽(bradykinin,BK),最终达到调节机体血压的目的。在肾素-血管紧张素系统(renin-angiotensin system,RAS)中,肾素促进Ang转化为Ang Ⅰ,而ACE酶切Ang Ⅰ的C端His-Leu,使其转化为Ang Ⅱ,刺激肾脏分泌盐皮质激素醛固酮,引起肾小管中K+排泄、Na+和Cl-再吸收,造成钠储留,还会引起交感神经活动,促使小动脉和毛细血管平滑肌收缩,导致血压升高[13]。在激肽释放酶-激肽系统(kallikrein-kinin system,KKS)中,激肽源由激肽释放酶催化转变为BK,BK可促进前列环素I2合成,舒张血管,最终起到降血压作用[14]。然而,ACE会酶切BK的C-端Phe-Arg,使其失活为缓释肽,导致KKS系统无法正常调节机体内血压。
食源性ACE IPs被应用于高血压的治疗中,主要是基于其可以抑制ACE的活性或使其失活,阻止Ang Ⅱ的形成,并避免BK失活,从而快速有效地使血压降低。最常见的ACE IPs类型是抑制剂类,包括竞争性、非竞争性、反竞争性8种抑制类型。在已有研究中,海洋藻类来源的ACE IPs大部分表现为非竞争性抑制类型,少数表现为竞争性抑制类型。有研究认为,ACE IPs可能是通过芳香侧链与ACE活性位点相结合从而抑制其活性[15]。但目前海洋藻类来源ACE IPs的相关研究较少,其对ACE活性位点的具体抑制原理尚不明确,有待深入研究。
2 ACE抑制肽的酶法制备
酶解法因其具有安全环保,条件温和、高效、专一、副产物少等优点而成为海洋藻类来源ACE IPs的最常用的制备方法。酶解法一般可分为单酶水解法和复合酶水解法。
2.1 单酶水解法
由于作用方式不同,蛋白酶可分为外切蛋白酶和内切蛋白酶;外切蛋白酶从肽链的任意一端开始作用,酶切蛋白后产生单个氨基酸;内切蛋白酶的酶切位点位于肽链内侧,作用后产生肽段[16]。过多游离氨基酸影响ACE抑制活性,在ACE IPs的制备中更多地选用内切蛋白酶为商业用酶,如胰蛋白酶、木瓜蛋白酶、中性蛋白酶、风味蛋白酶等。比较单酶水解海洋藻类蛋白源制备ACE IPs的相关研究,分析酶的切割位点及酶解产物活性的关系如表1所示。
碱性蛋白酶与胰蛋白酶的活性位点十分广泛,作用后产生的肽段中C端含Pro和Tyr、Met等疏水性氨基酸,且由于胰蛋白酶的活性部位含丝氨酸残基,通常酶切蛋白后产生C末端带正电荷的氨基酸,如酶切球等金鞭藻蛋白获得C端为Lys的肽段Tyr-Met-Gly-Leu-Asp-Leu-Lys[3]。由于胃蛋白酶的活性部位含2个羧基,其特异性酶切位点偏向于R2为苯丙氨酸残基的部位,其作用后产生的肽段的C端氨基酸为Pro或其他疏水性氨基酸,N端氨基酸为疏水性氨基酸或芳香族氨基酸。以上结构均符合ACE IPs的结构模型假说[17],该假说认为N端区域含疏水性氨基酸、中间部位含带正电荷的氨基酸残基和C端含芳香族氨基酸的肽段具有较高ACE抑制活性。也有研究认为,N端含有疏水氨基酸,C端三肽序列中含有Trp,可能有助于提高ACE的抑制活性[18],而MINORU等[19]使用蛋白酶S水解裙带菜蛋白得到的4种活性较高的肽段C端氨基酸均为Trp,为该理论供了证据。
表1 海洋藻类蛋白源ACE IPs
Table 1 ACE inhibitory peptides derived from marine algae proteins
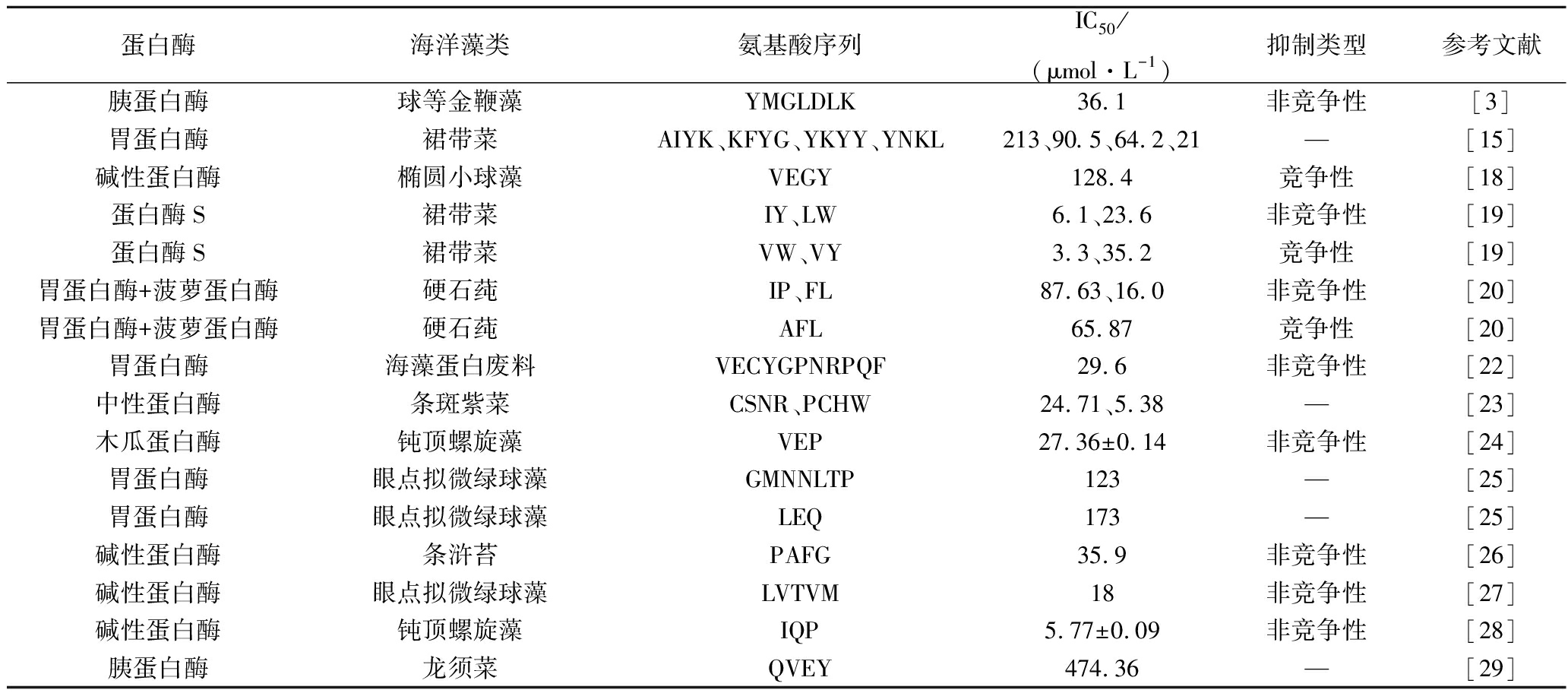
蛋白酶海洋藻类氨基酸序列IC50/(μmol·L-1)抑制类型参考文献胰蛋白酶球等金鞭藻YMGLDLK36.1非竞争性[3]胃蛋白酶裙带菜AIYK、KFYG、YKYY、YNKL213、90.5、64.2、21—[15]碱性蛋白酶椭圆小球藻VEGY128.4竞争性[18]蛋白酶S裙带菜IY、LW6.1、23.6非竞争性[19]蛋白酶S裙带菜VW、VY3.3、35.2竞争性[19]胃蛋白酶+菠萝蛋白酶硬石莼IP、FL87.63、16.0非竞争性[20]胃蛋白酶+菠萝蛋白酶硬石莼AFL65.87竞争性[20]胃蛋白酶海藻蛋白废料VECYGPNRPQF29.6非竞争性[22]中性蛋白酶条斑紫菜CSNR、PCHW24.71、5.38—[23] 木瓜蛋白酶钝顶螺旋藻VEP27.36±0.14非竞争性[24]胃蛋白酶眼点拟微绿球藻GMNNLTP123—[25]胃蛋白酶眼点拟微绿球藻LEQ173—[25]碱性蛋白酶条浒苔PAFG35.9非竞争性[26]碱性蛋白酶眼点拟微绿球藻LVTVM18非竞争性[27]碱性蛋白酶钝顶螺旋藻IQP5.77±0.09非竞争性[28]胰蛋白酶龙须菜QVEY474.36—[29]
注:“—”表示所引文献的研究中未描述抑制类型。
原料蛋白的一级结构未知性和蛋白酶的酶切位点差异性共同造成了ACE IPs的结构和活性的差异。一般来说,蛋白的水解程度不同,得到的肽段长短、氨基酸组成、排序方式和ACE抑制活性也不尽相同。在SAMARAKOON等[21]的研究中,采用胃蛋白酶、α-胰凝乳蛋白酶、胰蛋白酶、碱性蛋白酶、木瓜蛋白酶和中性蛋白酶分别水解眼点拟微绿球藻蛋白,产物ACE抑制活性从高到低。SHEIH等[22]酶解制备小球藻蛋白源ACE IPs时,胃蛋白酶和碱性蛋白酶的水解产物ACE抑制率高于风味蛋白酶和木瓜蛋白酶。
2.2 复合酶水解法
复合酶水解法制备ACE IPs常采用2种或多种酶酶解,可能会因酶切位点交叉而获得新的高活性肽段,弥补单酶水解的不足,提高制备效率和肽段质量。采用复合酶解法水解蛋白质时,可同时加入不同蛋白酶进行水解,但酶解条件不同的2种酶共同加入时可能会相互干扰,降低制备效率。雷桂洁等[30]将胰蛋白酶分别组合6种不同蛋白酶同时水解紫菜匀浆,水解效果均明显弱于胰蛋白酶单独水解的效果。另外,也可进行顺序水解,此时酶的加入顺序也会影响蛋白水解度和产物ACE抑制率,且蛋白被水解程度与水解产物ACE抑制活性的强弱并不成正相关。眼点拟微绿球藻蛋白副产物经碱性蛋白酶和胰蛋白酶依次水解后水解度为(64.3±19)%,ACE抑制率为(35.6±3.0)%,而调换两酶顺序后水解度降低至(48.3±0.5)%,但ACE抑制率却提高至(38.1±1.8)%[31]。这可能是由于碱性蛋白酶是丝氨酸内切酶,肽段经胰蛋白酶作用后,碱性蛋白酶可作用的特异性位点减少了,也可能是碱性蛋白酶将胰蛋白酶酶解产生的有活性的肽段进一步酶解后导致其活性丧失。
3 评价模型
多肽的实际降血压效果对其是否能作为天然降血压肽应用于医药及保健品行业十分关键,因此,有必要对其降血压效果进行评估测定。目前常用评价方法包括体外化学法、细胞生物法和体内动物实验法。
3.1 体外化学法
3.1.1 评价原理
ACE IPs的体外活性测定是基于分子水平的评价方式。与Ang Ⅰ结构相似的模拟物能与ACE反应,并生成具有特征吸收峰的马尿酸(hippuric acid,Hip)或N-(3-[2-呋喃]丙烯)-苯丙氨酸(N-3(2-furyl) acryloyl)-(phenylalanine,FAP)。反应式如下:
马尿酰-组氨酰-亮氨酸(N-Hippuryl-His-Leu,HHL)+ ACE→组氨酰-亮氨酸+Hip;
马尿酰-双甘肽(Hippuryl-glycine-glycosyl,HGG)+ ACE→甘氨酰-甘氨酸+Hip;
N-(3-[2-呋喃]丙烯)-苯丙氨肽(FAPGG)+ ACE→甘氨酰-甘氨酸+FAP。
基于以上原理,根据Hip或FAP含量变化即可判断ACE抑制活性的强弱。在酶解蛋白的步骤中,一般以水解度为响应值,以ACE抑制率为指标来考察酶对蛋白的水解效果。但抑制率会受抑制剂浓度的影响而发生变化,因此,在水解产物的分离纯化过程中应采用半数抑制浓度(IC50)来准确分析ACE抑制活性。IC50越低表示肽的ACE抑制活性越强。
3.1.2 测定方法
一般采用体外化学法来初步判断多肽的ACE抑制活性。ACE抑制活性的测定方法主要有分光光度法、高效液相色谱法、毛细管电泳法等,其他方法如薄层色谱法、荧光分光光度法等较为少见。紫外分光光度法由CUSHMAN和CHEUNG等[32]创立,经研究优化后沿用至今。CAO等[29]用分光光度法测定FAP在340 nm波长处的吸光度值,得出龙须菜蛋白源ACE IPs的ACE抑制率IC50为0.255 g/L-1。但分光光度法操作步骤繁琐、耗时长,且Hip中易混有HHL,容易产生较大误差。为降低试验操作要求、提高检测效率,有学者建立了高效液相色谱法,此方法中降低的Hip或FAP的峰面积百分比可反映ACE抑制率。LIN等[33]采用高效液相色谱法不仅能很好分地离HHL和马尿酸,还准确得出胃蛋白酶、风味蛋白酶和碱性蛋白酶等酶水解小叶蕨藻蛋白的产物ACE抑制率IC50分别为0.20、29.74和31.71 g/L。长期实践证明高效液相色谱法灵敏度高、检测效率高,能定量测定ACE抑制率IC50,但检测过程中需要重复大量ACE抑制反应,且难以实现高通量和快速筛选大量水解产物的ACE抑制活性。毛细管电泳法能弥补这种不足,且能在较短时间内分析和收集系统数据,实现ACE抑制活性测定和样品筛选的全自动化。HE等[34]使用4种不同蛋白酶水解12种海洋蛋白材料,采用毛细管电泳法快速测得了48种水解产物的ACE抑制率IC50。
3.2 细胞生物法
以往研究中通过构建人脐静脉内皮细胞(HUVECs)或人胚胎肺成纤维细胞系(MRC-5)模型,检验ACE IPs的细胞毒性,评估其是否具有用于未来治疗高血压的潜力。一般采用MTT法通过评估线粒体性能预测代谢能力,检测相对细胞活力,考察ACE抑制肽对人脐静脉内皮细胞存活率的影响。QIAN等[27]分别用浓度为18.75~150 μmol/L的肽段Leu-Val-Thr-Val-Met处理MRC-5细胞,检测细胞活力在94.7%~102.4%,存活率高。此外,考虑到NO是血压的调节剂,其浓度升高可导致血管周围的平滑肌细胞松弛而降低血压,且细胞内NO分泌异常时容易引起动脉粥样硬化的形成,试验中还会采用硝酸还原酶法检测细胞培养液中NO的水平,研究ACE IPs对细胞系中NO产生量的影响。若肽段的存在会引起细胞内NO生成量下降或细胞活力下降,则表明该肽段存在细胞毒性。SAMARAKOON等[25]从眼点拟微绿球藻中获得的ACE IPs可显著提高HUVECs的NO生产水平,且经不同浓度肽段处理后的细胞存活率都很高。
3.3 体内动物实验法
在体外环境中被证明具有ACE抑制活性的肽并不一定能在体内环境中发挥实际降血压作用。经口服摄入后,多肽的生物利用率是影响其体内活性的重要因素,为了使ACE IPs在体内发挥降血压作用,它们应完整到达作用部位,因此采用体内动物实验法验证其在机体内的降血压活性是十分必要的。一般体内动物实验法可分为动物试验法和临床试验法。
3.3.1 动物试验法
天然海藻来源ACE IPs具有良好的临床应用前景,能否在机体内部发挥实际降血压功能成为其应用的限制条件,需经过动物和临床试验来验证。动物试验选择自发性高血压大鼠(spontaneously hypertensive rats,SHR)模型,进行短期或长期给药试验。给药方式包括口服给药和皮下注射两种,不同给药方式实验组都需要以卡托普利、伊那普利等降压药物为阳性对照组,并设置无剂量对照组、低剂量组、中剂量组、高剂量组等实验组。为检验肽对血压正常的大鼠是否产生不良影响,还应同时对同源正常血压的京都Wister大鼠(wistar kyoto rats,WKY)进行给药试验,试验包括口服空白组和口服肽组,或皮下注射空白组和皮下注射肽组。通过比较给药前后不同时间点大鼠血压(收缩压)变化情况来评价肽的降血压功能。在王茵等[35]的动物实验中,SHR和WKY口服卡托普利后血压均显著下降,而紫菜降血压肽仅对SHR有降压作用。KO等[18]从椭圆小球藻中制备得到的ACE IPs能明显降低SHR收缩压,且降压活性维持6 h后收缩压回升至正常水平。利用裙带菜蛋白源的小肽Tyr-His、Lys-Tyr、Phe-Tyr和Ile-Tyr对SHR喂食(10 mg/(d·kg体重)) 1周后,收缩压在第1周分别显著降低了34、26、34和25mmHg,降压效果均可持续3~8周[36]。
3.3.2 临床试验法
只有人类临床试验结果才可作为宣称肽具有实际安全性的证据,基于这一点,ACE IPs在投入降压药物的生产应用前必须通过临床研究来探索其疗效程度和剂量范围,并确认不良反应。探索性试验和确证性试验过程中需考虑对肽进行有效性和安全性评价,评价指标包括血压变化、对靶器官的保护或损伤作用、对心血管并发症的影响等。另外,合理选择试验人群、设计试验和研究周期、分析联合用药情况等都是临床试验中需要特别注意的问题。但鉴于临床试验开展难度大,且关于海藻来源ACE IPs的活性研究还未成熟,海藻降血压肽的相关研究还未进入临床阶段。目前已有牦牛乳酪蛋白降血压肽[37]、大豆低聚肽[38]、醋豆降压肽[39]等食源性降血压肽的临床研究情况已被公布,且目前没有出现负面报道。
4 展望
海洋藻类富含优质蛋白,其资源未被充分开发和利用,因此有待对海藻资源进行高效利用,并探索海藻蛋白源ACE IPs对ACE活性的抑制原理及其体内消化吸收机制。部分研究者运用分子对接模拟方式来确定食源性ACE IPs在ACE酶的活性位点内的结合方式,预测肽的一级结构并评估ACE IPs活性[40-42]。但分子对接等研究是基于配体连接酶活性位点的竞争性结合机制,非竞争性ACE IPs并不适合该模型,其抑制机制与结构之间的关系尚不清楚。在ACE IPs制备中,酶工程得到了广泛应用,但由于海洋藻类蛋白的特殊性,导致陆生酶制剂无法高效水解海洋藻类蛋白质,因此需要开发和筛选适用于酶解海洋藻类蛋白的高效蛋白酶原。另外,由于ACE IPs存在分离纯化工艺繁琐、产量低等问题,因此ACE IPs的生产难以形成产业链。为解决这一难题,已有学者利用BIOPEP、Pepsite2和PeptideRanker等数据库,将计算机模拟分析应用于模拟复合酶水解蛋白[25,34]、电子筛选ACE抑制肽和电子模拟肽的消化环境稳定性[35,37]等方面。虽然相关数据库也需要进一步探索和完善,但计算机模拟方式在ACE IPs的研究中应用前景可观,可能推动实现ACE IPs的大规模生产进程。
[1] 顾景范.《中国居民营养与慢性病状况报告(2015)》解读[J].营养学报,2016,38(6):525-529.
[2] 李外,魏宇宁. 我院2005—2008年干部诊疗科降血压药应用分析[J]. 中国药业, 2011, 20(5): 54-55.
[3] WU H, XU N, SUN X, et al. Hydrolysis and purification of ACE inhibitory peptides from the marine microalga Isochrysis galbana[J]. Journal of Applied Phycology, 2015, 27 (1): 351-361.
[4] 陈胜军,李来好,曾名勇,等. 罗非鱼鱼皮胶原蛋白降血压酶解液的制备与活性研究[J]. 食品科学, 2005, 26 (8): 229-233.
[5] HANAFI M A, HASHIM S N, CHAY S Y, et al. High angiotensin-I converting enzyme (ACE) inhibitory activity of Alcalase-digested green soybean (Glycine max) hydrolysates [J]. Food Research International, 2018, 106: 589-597.
[6] MOAYEDI A, MORA L, ARISTOY M C, et al. Peptidomic analysis of antioxidant and ACE-inhibitory peptides obtained from tomato waste proteins fermented using Bacillus subtilis[J]. Food Chemistry, 2018, 250: 180-187.
[7] WANG C, TU M, WU D, et al. Identification of an ACE-inhibitory peptide from walnut protein and its evaluation of the inhibitory mechanism[J]. Food Chemistry, 2018, 19 (4): 1 156.
[8] BHASKAR B, ANANTHANARAYAN L, JAMDAR S. Purification, identification, and characterization of novel angiotensin I-converting enzyme (ACE) inhibitory peptides from alcalase digested horse gram flour [J]. LWT-Food Science and Techology, 2019, 103: 155-161.
[9] HE R, WANG Y, YANG Y, et al. Rapeseed protein-derived ACE inhibitory peptides LY, RALP and GHS show antioxidant and anti-inflammatory effects on spontaneously hypertensive rats [J]. Journal of Functional Foods, 2019, 55: 211-219.
[10] HARNEDY P A, FITZGERALD R J. In vitro assessment of the cardioprotective, anti-diabetic and antioxidant potential of Palmaria palmata protein hydrolysates [J]. Journal of Applied Phycology, 2013, 25 (6): 1 793-1 803.
[11] DE SOUZA BARROS C, GOMES M W L, GOMES R S P, et al. Acute toxicity evaluation of ethanol extract of red algae, Osmundaria obtusiloba, in BALB/c mice [J]. Journal of Medicinal Plants Research, 2018, 12 (17): 217-221.
[12] 马军,侯萍,陈燕,等. 几种海藻多糖抗氧化活性及体外抗脂质过氧化作用的研究[J]. 南方水产科学, 2017, 13 (6): 97-104.
[13] WU J, LIAO W, UDENIGWE C C. Revisiting the mechanisms of ACE inhibitory peptides from food proteins[J].Trends in Food Science & Technology,2017, 69: 214-219.
[14] 陈胜军,李来好,曾名勇,等. 水产品中血管紧张素转换酶抑制肽的研究进展[J]. 南方水产科学, 2006, 2 (5): 69-73.
[15] SUETSUNA K, NAKANO T. Identification of an antihypertensive peptide from peptic digest of wakame(Undaria pinnatifida) [J]. The Journal of Nutritional Biochemisty, 2000, 11 (9): 450-454.
[16] MAO X Y, NI J R, SUN W L, et al. Value-added utilization of yak milk casein for the production of angiotensin-I-converting enzyme inhibitory peptides [J]. Food Chemistry, 2007, 103 (4): 1 282-1 287.
[17] WU J, ALUKO R E, NAKAI S. Structural requirements of angiotensin I-converting enzyme inhibitory peptides: Quantitative structure-activity relationship study of di-and tripeptides [J]. Joumal of Agriculture and Food Chemistey, 2006, 54 (3): 732-738.
[18] KO S C, KANG N, KIM E A, et al. A novel angiotensin I-converting enzyme (ACE) inhibitory peptide from a marine Chlorella ellipsoidea and its antihypertensive effect in spontaneously hypertensive rats [J]. Process biochemistry, 2012, 47 (12): 2 005-2 011.
[19] SATO M, HOSOKAWA T, YAMABUCHI T, et al. Angiotensin I-converting enzyme inhibitory peptides derived from wakame (Undaria pinnatifida) and their antihypertensive effect in spontaneously hypertensive rats [J].Journal of Agriculture and Food Chemisty, 2002, 50 (21): 6 245-6 252.
[20] PAIVA L, LIMA E, NETO A I, et al. Isolation and characterization of angiotensin I-converting enzyme (ACE) inhibitory peptides from Ulva rigida C. Agardh protein hydrolysate [J]. Journal of Functional Foods, 2016, 26: 65-76.
[21] SAMARAKOON K W, KWON O N, KO J Y, et al. Purification and identification of novel angiotensin-I converting enzyme (ACE) inhibitory peptides from cultured marine microalgae (Nannochloropsis oculata) protein hydrolysate [J]. Journal of Applied Phycology, 2013, 25 (5): 1 595-1 606.
[22] SHEIH I C, FANG T J, WU T K. Isolation and characterisation of a novel angiotensin I-converting enzyme (ACE) inhibitory peptide from the algae protein waste [J]. Food Chemsitry, 2009, 115 (1): 279-284.
[23] 何荣海,马海乐. 条斑紫菜ACEI肽结构鉴定与性能试验[J]. 江苏大学学报(自然科学版), 2012, 33 (4): 430-434.
[24] 鲁军,任迪峰,王建中,等. 螺旋藻源血管紧张素转化酶抑制肽的纯化和鉴定[J]. 生物化学与生物物理进展, 2010, 37 (5): 568-574.
[25] SAMARAKOON K W, WISHVAJITH K, KO J Y, et al. Purification and identification of novel angiotensin-I converting enzyme (ACE) inhibitory peptides from cultured marine microalgae (Nannochloropsis oculata) protein hydrolysate [J]. Jourmal of Applied Phycology, 2013, 25 (5): 1 595-1 606.
[26] PAN S, WANG S, JING L, et al. Purification and characterisation of a novel angiotensin-I converting enzyme (ACE)-inhibitory peptide derived from the enzymatic hydrolysate of Enteromorpha clathrata protein [J]. Food Chemistry, 2016, 211: 423-430.
[27] QIAN Z J, HEO S J, OH C H, et al. Angiotensin I-converting fnzyme (ACE) inhibitory peptide isolated from biodiesel byproducts of marine microalgae, Nannochloropsis Oculata[J]. Journal of Biobased Materials and Bioenergy, 2013, 7 (1): 135-142.
[28] LU J, REN D F, XUE Y L, et al. Isolation of an antihypertensive peptide from alcalase digest of spirulina platensis[J]. Journal of Agriculture and Food Chemistry,2010, 58 (12): 7 166-7 171.
[29] CAO D, LYU X, XU X, et al. Purification and identification of a novel ACE inhibitory peptide from marine alga Gracilariopsis lemaneiformis protein hydrolysate [J]. European Food Research and Techology, 2017, 243 (10): 1 829-1 837.
[30] 雷桂洁,苏国成,江晓颖,等. 复合酶二次酶解法制备紫菜多肽原液及其ACE抑制活性的研究[J]. 食品工业科技, 2016, 37 (11): 141-146.
[31] CIAN R E, MART NEZ-AUGUSTIN O, DRAGO S R. Bioactive properties of peptides obtained by enzymatic hydrolysis from protein byproducts of Porphyra columbina[J]. Food Research International, 2012, 49 (1): 364-372.
NEZ-AUGUSTIN O, DRAGO S R. Bioactive properties of peptides obtained by enzymatic hydrolysis from protein byproducts of Porphyra columbina[J]. Food Research International, 2012, 49 (1): 364-372.
[32] CUSHMAN D W,CHEUNG H S.Spectrophotometric assay and properites of the angiotensin-converting enzyme of rabbitlung[J].Biochemical Pharmacology,1971,20(7):1 637-1 648.
[33] LIN H C, CHOU S T, CHUANG M Y, et al. The effects of Caulerpa microphysa enzyme-digested extracts on ACE-inhibitory activity and in vitro anti-tumour properties [J]. Food chemistry, 2012, 134 (4): 2 235-2 241.
[34] HE H L, CHEN X L, WU H, et al. High throughput and rapid screening of marine protein hydrolysates enriched in peptides with angiotensin-I-converting enzyme inhibitory activity by capillary electrophoresis[J]. Bioresource Technology, 2007, 98 (18): 3 499-3 505.
[35] 王茵,刘淑集,苏永昌,等. 紫菜降血压肽大鼠体内降压效果研究[J]. 中国海洋药物, 2010, 29 (3): 17-21.
[36] SUETSUNA K, MAEKAWA K, CHEN J R. Antihypertensive effects of Undaria pinnatifida (wakame) peptide on blood pressure in spontaneously hypertensive rats [J]. The Journal of Nutritional Biochemistry, 2004, 15(5): 267-272.
[37] 冯玉萍,张福梅,陈诚,等. 牦牛乳酪蛋白降血压肽对高血压大鼠体内降压效果研究[J]. 中兽医医药杂志, 2014(3): 50-54.
[38] 汤健,温绍君,王佐广,等. 动物与临床试验--评价大豆低聚肽的降血压效果[J]. 食品与发酵工业, 2006, 32 (3): 11-13.
[39] 张月圆. 醋豆降压肽的制备及其降压活性研究[D].北京:北京中医药大学, 2018.
[40] KO S C, JANG J, YE B R, et al. Purification and molecular docking study of angiotensin I-converting enzyme (ACE) inhibitory peptides from hydrolysates of marine sponge Stylotella aurantium[J]. Process Biochemistry, 2017, 54: 180-187.
[41] LIN K, ZHANG L, HAN X, et al. Novel angiotensin I-converting enzyme inhibitory peptides from protease hydrolysates of Qula casein: Quantitative structure-activity relationship modeling and molecular docking study [J]. Journal of Functional Foods, 2017, 32: 266-277.
[42] PANYAYAI T, SANGSAWAD P, PACHARAWONGSAKDA E, et al. The potential peptides against angiotensin-I converting enzyme through a virtual tripeptide-constructing library [J]. Computational biology and Chemistry, 2018, 77: 207-213.