杨梅(Myrica rubra)原产于我国东南部地区,是一种具有观赏价值及食用和药用价值的亚热带常绿果树[1]。杨梅果实富含维生素、蛋白质、果胶、纤维素、矿物元素等,果鲜汁旺、营养丰富、风味独特,具有抗氧化、抗衰老等多种生理功效[2]。但是杨梅果肉不易储存与保鲜,货架期非常短。因此,将杨梅深加工为杨梅酒是杨梅产业可持续发展的重要途经和方向之一[3]。
目前,市场上的杨梅酒多为杨梅发酵酒或杨梅浸泡酒等。关于杨梅发酵酒已有较多研究,如唐正江等[4]采用建立数学模型方法模拟建立杨梅发酵酒发酵的最优条件,并被苏龙等[5]验证结论有效,杜婧等[6]发现优条件与上述基本吻合。高娟等发现常用的降酸剂(酒石酸,CaCO3,K2CO3等)均会对酒产生不良影响。杨梅发酵酒的花色苷不稳定,色泽易发生改变[7],邢建荣等通过在酿造后添加天然色素来维持货架期短时间内杨梅发酵酒的色泽[8]。但是,目前杨梅发酵酒尚存在酸度过高、口感不佳的问题,现有的手段无法获得低酸度下澄清透明又不损害杨梅的香气物质及营养成分的杨梅发酵酒[9],而杨梅浸泡酒也未解决其变色及沉淀问题[10]。利口酒是主要以蒸馏酒、发酵酒、清香型白酒等为基酒,经过精心调配而形成的具有天然水果香味、酸度适中、柔和适饮的时尚饮品[11],也是开发利用杨梅资源,提高杨梅产品附加值的重要途径之一。
本课题以杨梅果汁为主要原料,研究食用酒精、清香型白酒、杨梅蒸馏酒3种基酒对杨梅利口酒品质的影响,分别利用全二维气相色谱飞行时间质谱联用(gas chromatography with time-of-flight mass spectrometry,GC×GC-TOFMS)和超高效液相色谱(ultra-high performance liquid chromatography,UPLC)对其挥发性成分、主要单体酚展开研究,同时采用感官分析方法对其感官喜好度进行分析,以期进一步开发及优化杨梅利口的酒酿造工艺,为杨梅深加工提供理论依据和指导。
1 材料与方法
1.1 材料与试剂
“荸荠”种杨梅:无锡马山;某53°小曲清香型白酒:实验室提供;95%食用酒精(瓜干原料酒精,符合GB 10343—2018要求);酵母D254、果胶酶EX-V:法国LAFFORT。
2-辛醇(色谱纯):美国Sigma-Aldrich公司;DNS、NaCl、NaOH、KH2PO4、邻苯二甲酸氢钾、酒石酸氢钾、酒石酸、CuSO4、H2SO3、KCl、HCl、乙酸钠(分析纯):上海国药集团试剂有限公司。
1.2 仪器与设备
酶标仪,美国Thermo Scientific公司; WFZUV-2802H紫外分光光度计,优尼柯(上海)仪器有限责任公司; pH计、PL2002电子天平,METTLER TOLEDO;超高效液相色谱,美国Waters公司;全二维气相色谱飞行时间质谱联用仪,美国Agilent公司。
1.3 试验方法
1.3.1 利口酒的研制
杨梅蒸馏酒的制作方法:
参照文献方法[12-15]并做改进,将杨梅压破碎后连果核加入已灭菌的发酵罐中,添加果胶酶12 h后,加入酵母及酵母助剂并搅拌匀,25 ℃控温发酵,每日定时搅拌发酵罐使悬浮物充分浸渍。实时测定糖度,待悬浮物逐渐沉降,糖度降为3 g/L以下,发酵罐内不产出大量气体时,外观不再有明显变化时视为发酵结束,停止发酵(约10 d)。澄清过滤并避光隔氧保存。将上述杨梅发酵酒用蒸馏设备蒸馏得到杨梅蒸馏酒,杨梅蒸馏酒最终的乙醇体积分数为53%。
杨梅利口酒的制作方法:
将小曲清香白酒、杨梅蒸馏酒、食用酒精和纯杨梅果汁按照表1配比进行混合调配,目标酒精度为18%vol,调整糖度并进行稳定性处理,过滤澄清最终得到3款杨梅利口酒。
表1 杨梅利口酒配料比
Table 1 Bayberry Liquor ingredients ratio

组别添加成分配料比A杨梅果汁+食用酒精 4.26∶1B杨梅果汁+小曲清香白酒1.94∶1C杨梅果汁+杨梅蒸馏酒 1.94∶1
1.3.2 理化指标的测定
总糖、总酸、酒精度的测定参照GB 15038—2006[16]进行。
1.3.3 总酚的测定
采用福林法测定杨梅利口酒中总酚含量[17-18]。以吸光度为纵坐标,总酚含量为横坐标绘制标准曲线(y=0.062 7x+0.006 5,R2=0.994)。
1.3.4 总花色苷测定:pH示差法
分别取0.1~0.2 mL酒样于2支试管中,分别加入pH 1.0 KCl和pH 4.5 CH3CO2Na·3H2O缓冲液,定容至5 mL,避光稳定15~20 min,于分光光度计520、700 nm下于23~40 min测定吸光度[19]。计算方法如公式(1)、(2)所示:
A=(A520-A700)pH 1.0-(A520-A700)pH 4.5
(1)
(2)
式中:A为吸光度值;W为葡萄酒中花色苷含量,mg/L;MW为二甲花翠素葡萄糖苷分子质量,493.5;DF为稀释倍数(0.5 mL稀释到10 mL稀释倍数为20);ε为二甲花翠素葡萄糖苷的消光系数,28 000。
1.3.5 单体酚的测定
采用实验室已建立的方法[20],利用UPLC对杨梅利口酒中的主要单体酚进行检测分析,样品经过 0.22 μm滤膜过滤后直接进样。
分别称取约10~50 mg丁香酸、阿魏酸、咖啡酸、水杨酸、没食子酸、原儿茶酸、p-羟基苯甲酸、绿原酸、芥子酸、EGC、CAT、EC、芦丁、槲皮素,槲皮苷,桑黄素标准品,用色谱级甲醇定容于10 mL容量瓶中,配成混合溶液,将此溶液稀释成8个浓度梯度的标准溶液,于-20 ℃下保存备用作为外标使用。以浓度y为纵坐标,峰面积x为横坐标,计算得到16条标准曲线。由表2中可知,16种单体酚标准品的溶液浓度和峰面积呈现出良好的线性关系,说明此方法的准确度高,可行性好,符合实验对于定量要求。
表2 九种酚酸、3种黄烷醇4种黄酮醇的标准曲线及相关参数(n=8)
Table 2 Calibration curves of 9 phenolic acids,3flavan-3-ols,4 flavonols and their relevant parameters
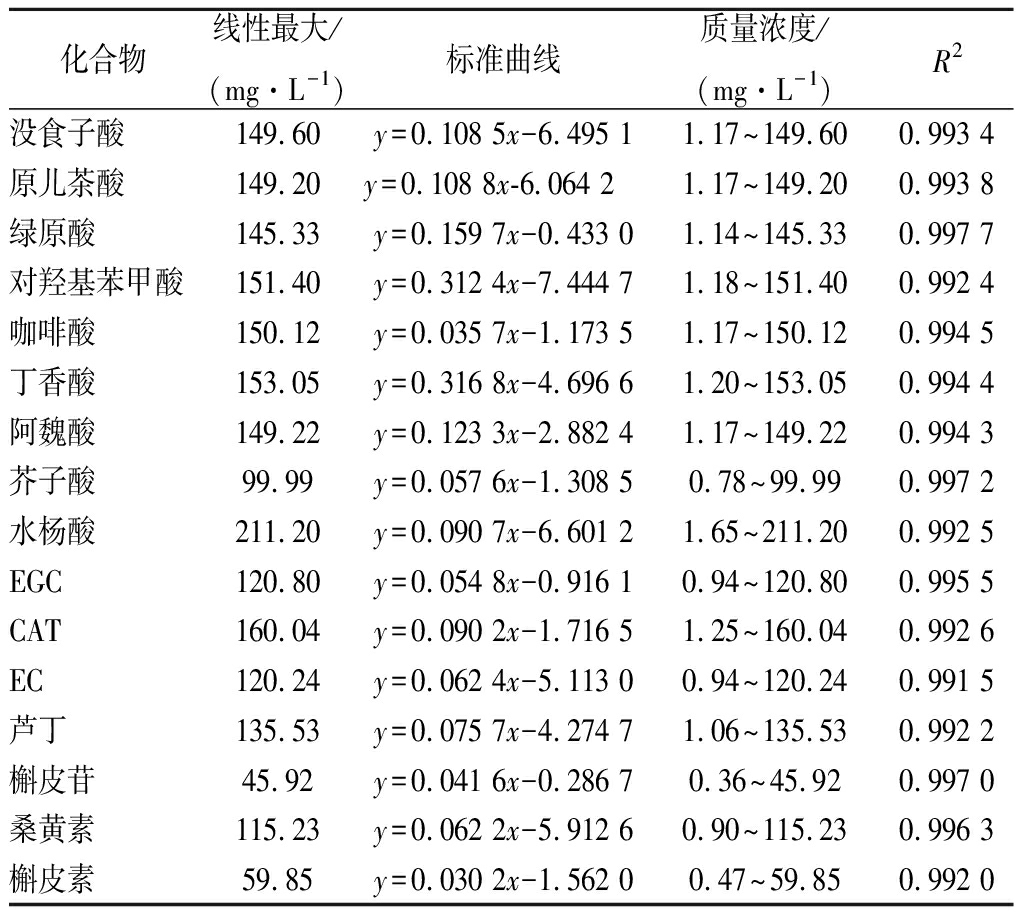
化合物线性最大/(mg·L-1)标准曲线质量浓度/(mg·L-1)R2没食子酸149.60y=0.108 5x-6.495 11.17~149.600.993 4原儿茶酸149.20y=0.108 8x-6.064 2 1.17~149.200.993 8绿原酸145.33y=0.159 7x-0.433 01.14~145.330.997 7对羟基苯甲酸151.40y=0.312 4x-7.444 71.18~151.400.992 4咖啡酸150.12y=0.035 7x-1.173 51.17~150.120.994 5丁香酸153.05y=0.316 8x-4.696 61.20~153.050.994 4阿魏酸149.22y=0.123 3x-2.882 41.17~149.220.994 3芥子酸99.99y=0.057 6x-1.308 50.78~99.990.997 2水杨酸211.20y=0.090 7x-6.601 21.65~211.200.992 5EGC120.80y=0.054 8x-0.916 10.94~120.800.995 5CAT160.04y=0.090 2x-1.716 51.25~160.040.992 6EC120.24y=0.062 4x-5.113 00.94~120.240.991 5芦丁135.53y=0.075 7x-4.274 71.06~135.530.992 2槲皮苷45.92y=0.041 6x-0.286 70.36~45.920.997 0桑黄素115.23y=0.062 2x-5.912 60.90~115.230.996 3槲皮素59.85y=0.030 2x-1.562 00.47~59.850.992 0
1.3.6 挥发性成分的GC×GC-TOFMS分析
参考HUANG等[21]的方法,并略作修改。在20 mL的顶空瓶中准确称量8 mL稀释酒样,加3 g NaCl饱和溶液,三相萃取头(DVB/CAR/PDMS,50/30 μm)进行萃取。
气相色谱条件:一维色谱柱DB-FFAP(60 m×0.25 mm ID,0.25 μm),二维色谱柱Rxi-17Sil MS(1.1 m×0.25mm ID,0.25 μm)。进样口温度250 ℃,不分流模式进样。一维柱温箱升温程序:起始温度45 ℃,保持2 min,以4 ℃/min的速率升温至230 ℃并保持15 min。调制器调制时间4 s,热调制时间为1 s,调制补偿温度为20 ℃。二维柱温箱升温程序:起始温度40 ℃保持2 min,以5 ℃/min升温至250 ℃并保持5 min。以高纯氦气(>99.999 5%)作为载气,恒流模式,流速1 mL/min。
飞行时间质谱条件: EI离子源,离子源温度 230 ℃,传输线温度280 ℃,电压控制70 eV。检测器采集质量数范围35~400 amu,采集频率100 spectrum/s,电压控制1 430 V。数据由Pegasus 4D工作站采集。
定性方法:利用ChormaTOF软件对采集的数据进行解析,色谱峰的峰宽分别设为24和0.2 s,自动识别信噪比>200的色谱峰后进行自动积分解卷积和质谱库(mainlib,Wiley 9和replib)比对,并通过保留指数(保留指数根据C5-C30计算得出)定性,剔除烷烃类等无明显风味贡献及胺类等主要呈味的化合物,选择相似度及反相似度≥800的化合物作为最终定性结果。
定量方法:以2-辛醇为内标进行半定量。通过化合物与内标物的峰面积比算出最终的浓度比,计算香气化合物的相对浓度[22]。
1.3.7 感官评定
采用国标GB/T12315—2008[23]进行偏好检验,将3款杨梅利口酒进行计算机3位随机编号并由50位江南大学生物工程学院青年学生(20~25岁)对杨梅利口酒整体印象进行排序,给出每个样品的序位。用秩序和来衡量对酒样的喜好度。
1.3.8 数据处理
使用Microsoft Excel 2013和MassLynx 4.1软件进行统计分析。
2 结果与分析
2.1 理化指标分析
对3款杨梅利口酒进行糖、酸及酒精度的检测,由表3可以看出,在相同酒精度下,由于杨梅果汁加95%食用酒精组调配时加入杨梅果汁的量最多,因此其酸度也最高,而杨梅果汁加杨梅蒸馏酒和加小曲清香白酒的酸度则近似。
表3 三种杨梅利口酒的理化指标
Table 3 Physical and chemical indicators of three kinds of bayberry liqueur

组别总酸/(g·L-1)总糖/(g·L-1)乙醇体积分数/%A7.1641.6218B5.7041.5018C5.7240.5518
2.2 酚类物质分析结果
2.2.1 基酒对单体酚的影响
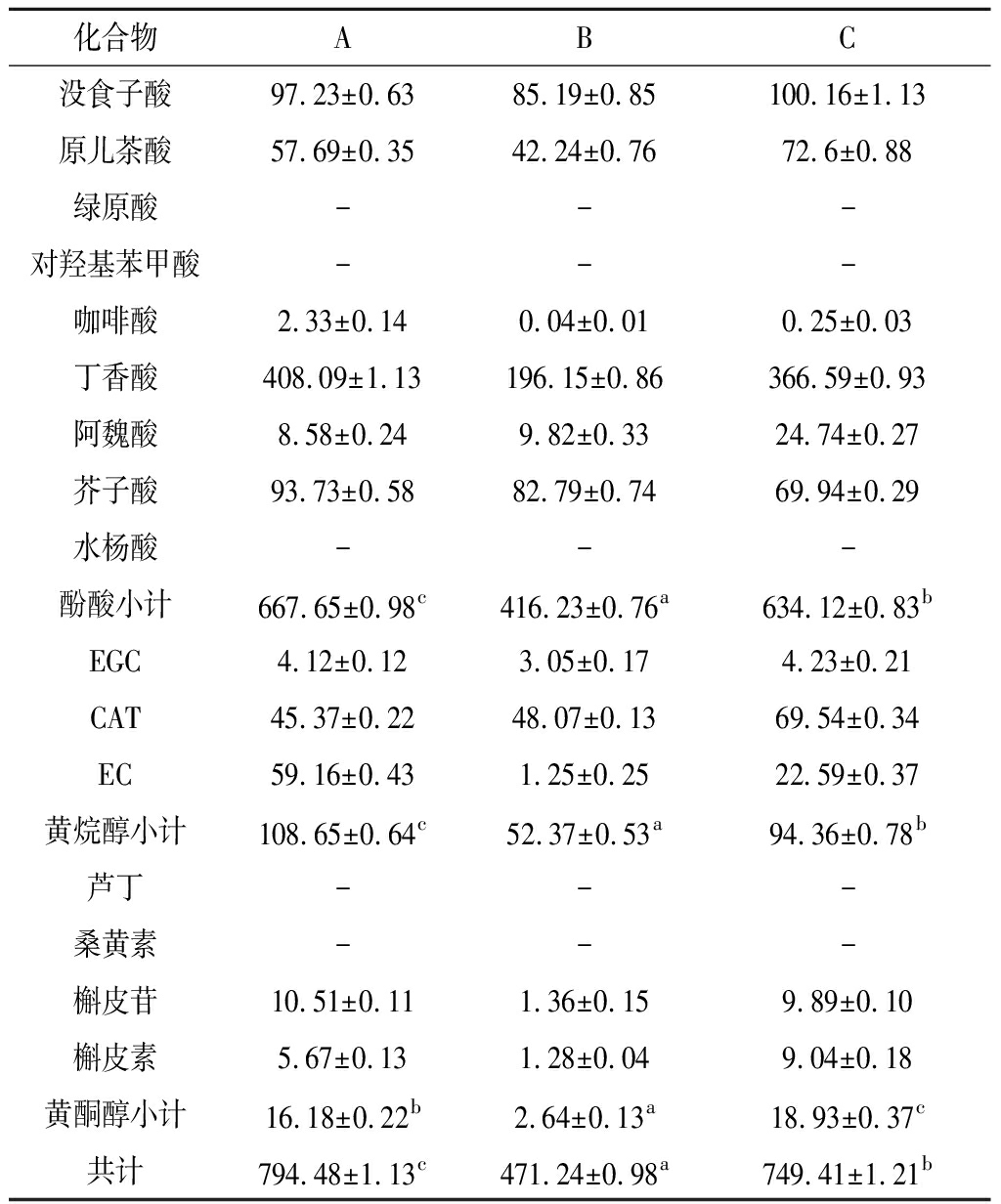
表4是16种主要单体酚的检测结果,可以看出,在这3款杨梅利口酒中均检测到除绿原酸、对羟基苯甲酸、水杨酸、芦丁及桑黄素外的11种单体酚,其中丁香酸的含量最高,在196.15~408.09 mg/L,其次是没食子酸、芥子酸、原儿茶酸。酚酸中的咖啡酸与在几款酒中的含量都相对较小。其中果汁加食用酒精处理与果汁加杨梅蒸馏酒处理的利口酒单体酚总量均较高,分别为794.48和749.41 mg/L,果汁加小曲清香白酒单体酚含量最低,仅为471.24 mg/L。方差分析结果表明,除黄酮醇,酚酸与黄烷醇均为果汁加食用酒精显著高于果汁加杨梅蒸馏酒,果汁加小曲清香则显著低于其余2种利口酒。单体酚总含量与酚酸、黄烷醇趋势一致。
表4 杨梅利口酒中主要单体酚的含量 单位:mg/L
Table 4 Contents of mono-phenols in Bayberry Liquor
化合物ABC没食子酸97.23±0.6385.19±0.85100.16±1.13原儿茶酸57.69±0.3542.24±0.7672.6±0.88绿原酸---对羟基苯甲酸---咖啡酸2.33±0.140.04±0.010.25±0.03丁香酸408.09±1.13196.15±0.86366.59±0.93阿魏酸8.58±0.249.82±0.3324.74±0.27芥子酸93.73±0.5882.79±0.7469.94±0.29水杨酸---酚酸小计667.65±0.98c416.23±0.76a634.12±0.83bEGC4.12±0.123.05±0.174.23±0.21CAT45.37±0.2248.07±0.1369.54±0.34EC59.16±0.431.25±0.2522.59±0.37黄烷醇小计108.65±0.64c52.37±0.53a94.36±0.78b芦丁---桑黄素---槲皮苷10.51±0.111.36±0.159.89±0.10槲皮素5.67±0.131.28±0.049.04±0.18黄酮醇小计16.18±0.22b2.64±0.13a18.93±0.37c共计794.48±1.13c471.24±0.98a749.41±1.21b
注:-表示未检测到;表中不同字母代表差异显著(P<0.05)。下同。
2.2.2 基酒对总酚及总花色苷的影响
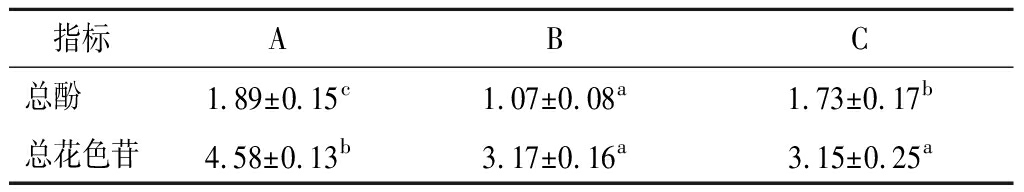
多酚物质对人体健康非常有利,多酚物质大多数都为强抗氧化剂,有着抗衰老,预防癌症,减缓心脑血管疾病等作用[24],由表5可知,3款酒中的总酚含量与单体酚趋势相似,同样是果汁加食用酒精最高,其次是果汁加杨梅蒸馏酒,而果汁加小曲清香白酒最低。此外,由果汁加食用酒精调配的利口酒中总花色苷要显著高于其他2款利口酒,主要由于其调配过程中添加了更多的果汁所致。
表5 杨梅利口酒总酚及总花色苷测定 单位:g/L
Table 5 Determination of total phenolics and anthocyanins in bayberry liquor
指标ABC总酚 1.89±0.15c1.07±0.08a1.73±0.17b总花色苷4.58±0.13b3.17±0.16a3.15±0.25a
2.3 挥发性香气分析
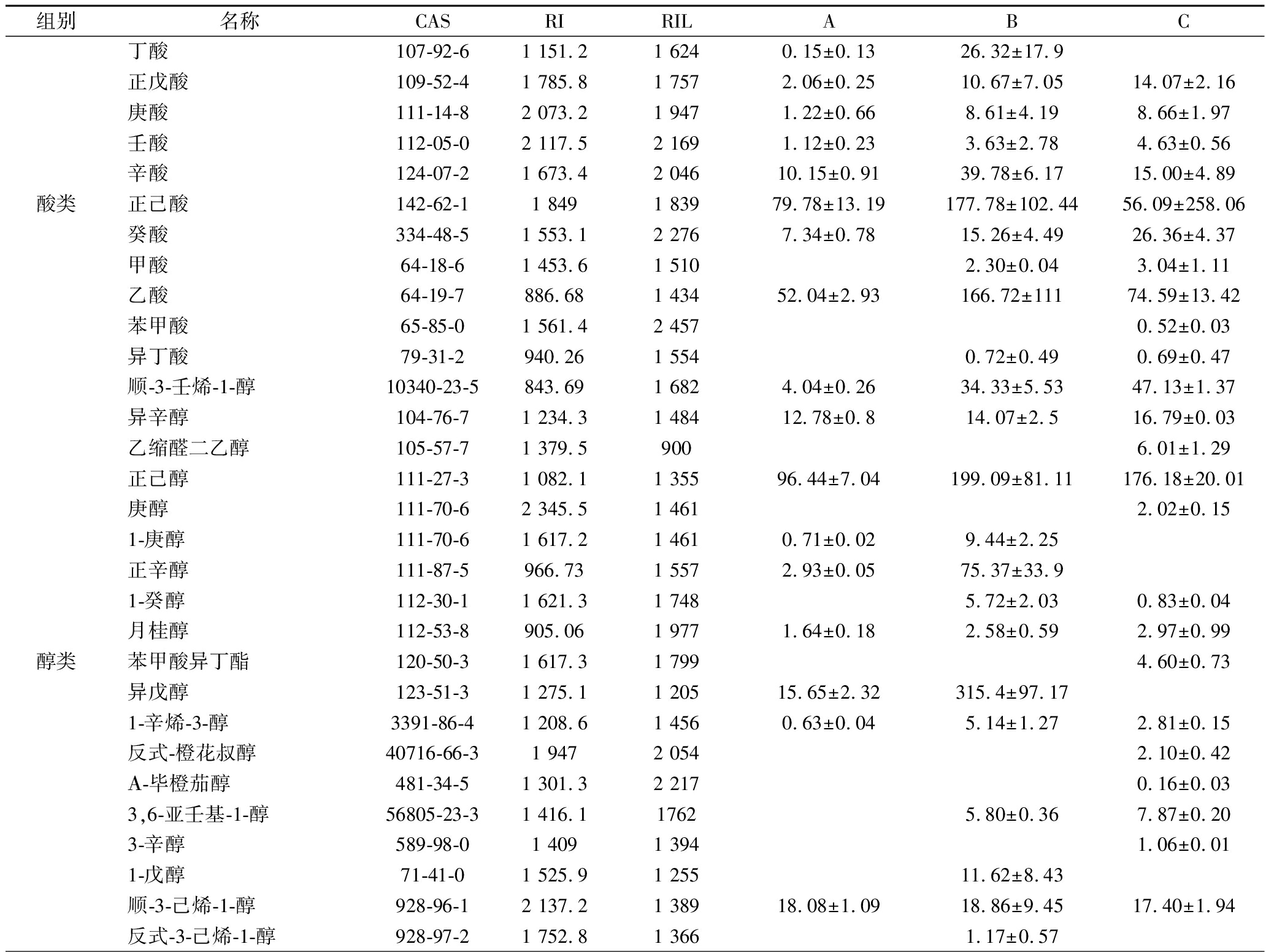
结合顶空固相微萃取及GC×GC-TOFMS法对3款杨梅利口酒中挥发性成分进行解析,并以2-辛醇为内标,对定性到的挥发性物质进行半定量分析(表6)。经过质谱库及保留指数比对,在3款杨梅利口酒中共检测出106种香气物质,香气种类包括11种酸,19种醇,6种醛,23种酯类物质,24种芳香类物质及8种萜烯类物质等。李洁莹等采用一维GC-MS在无醇杨梅果酒中检测到了33种香气成分[25],而本研究选用GC×GC-TOFMS检测到了106种香气成分,远远高于之前研究结果。全二维由于自身高灵敏、高分辨的特点,可以更加全面的评估样品香气组分。在3种不同处理的利口酒中,果汁加杨梅蒸馏酒中检测到的香气化合物最多,共计88种,其次是果汁加小曲清香白酒,共检测到60种,果汁加食用酒精最小,只检测到45种香气化合物。由此可见,杨梅蒸馏酒作为基酒,可以带入更多的香气成分,从而使杨梅利口酒的香气更加饱满、丰富。
表6 三款杨梅利口酒挥发性香气含量 单位:mg/L
Table 6 The concentration of volatile compounds in three kinds of bayberry liquor
组别名称CASRIRILABC酸类丁酸107-92-61 151.21 6240.15±0.1326.32±17.9正戊酸109-52-41 785.81 7572.06±0.2510.67±7.0514.07±2.16庚酸111-14-82 073.21 9471.22±0.668.61±4.198.66±1.97壬酸112-05-02 117.52 1691.12±0.233.63±2.784.63±0.56辛酸124-07-21 673.42 04610.15±0.9139.78±6.1715.00±4.89正己酸142-62-11 8491 83979.78±13.19177.78±102.4456.09±258.06癸酸334-48-51 553.12 2767.34±0.7815.26±4.4926.36±4.37甲酸64-18-61 453.61 5102.30±0.043.04±1.11乙酸64-19-7886.681 43452.04±2.93166.72±11174.59±13.42苯甲酸65-85-01 561.42 4570.52±0.03异丁酸79-31-2940.261 5540.72±0.490.69±0.47醇类顺-3-壬烯-1-醇10340-23-5843.691 6824.04±0.2634.33±5.5347.13±1.37异辛醇104-76-71 234.31 48412.78±0.814.07±2.516.79±0.03乙缩醛二乙醇105-57-71 379.59006.01±1.29正己醇111-27-31 082.11 35596.44±7.04199.09±81.11176.18±20.01庚醇111-70-62 345.51 4612.02±0.151-庚醇111-70-61 617.21 4610.71±0.029.44±2.25正辛醇111-87-5966.731 5572.93±0.0575.37±33.91-癸醇112-30-11 621.31 7485.72±2.030.83±0.04月桂醇112-53-8905.061 9771.64±0.182.58±0.592.97±0.99苯甲酸异丁酯120-50-31 617.31 7994.60±0.73异戊醇123-51-31 275.11 20515.65±2.32315.4±97.171-辛烯-3-醇3391-86-41 208.61 4560.63±0.045.14±1.272.81±0.15反式-橙花叔醇40716-66-31 9472 0542.10±0.42Α-毕橙茄醇481-34-51 301.32 2170.16±0.033,6-亚壬基-1-醇56805-23-31 416.117625.80±0.367.87±0.203-辛醇589-98-01 4091 3941.06±0.011-戊醇71-41-01 525.91 25511.62±8.43顺-3-己烯-1-醇928-96-12 137.21 38918.08±1.0918.86±9.4517.40±1.94反式-3-己烯-1-醇928-97-21 752.81 3661.17±0.57
续表6
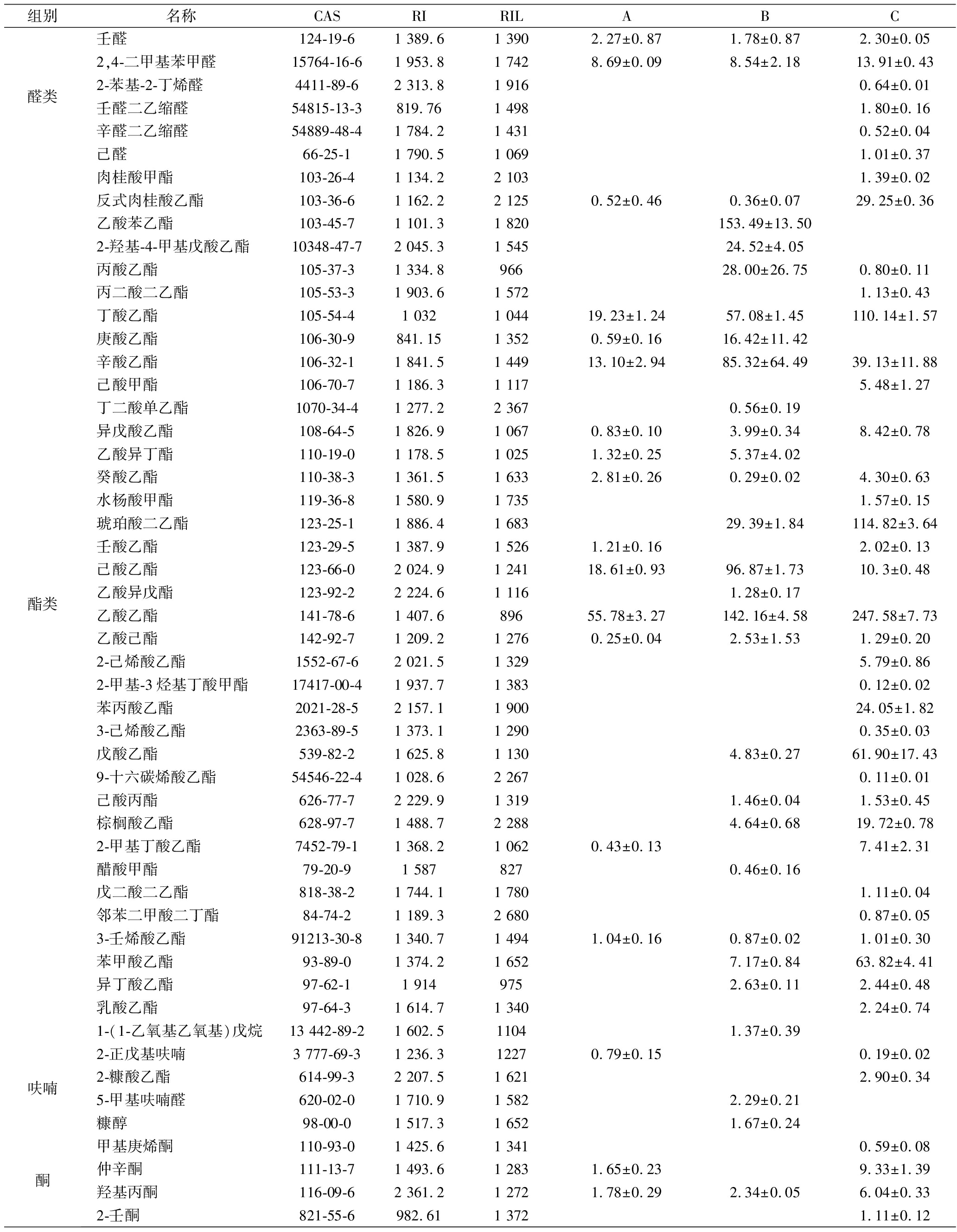
组别名称CASRIRILABC醛类壬醛124-19-61 389.61 3902.27±0.871.78±0.872.30±0.052,4-二甲基苯甲醛15764-16-61 953.81 7428.69±0.098.54±2.1813.91±0.432-苯基-2-丁烯醛4411-89-62 313.81 9160.64±0.01壬醛二乙缩醛54815-13-3819.761 4981.80±0.16辛醛二乙缩醛54889-48-41 784.21 4310.52±0.04己醛66-25-11 790.51 0691.01±0.37酯类肉桂酸甲酯103-26-41 134.22 1031.39±0.02反式肉桂酸乙酯103-36-61 162.22 1250.52±0.460.36±0.0729.25±0.36乙酸苯乙酯103-45-71 101.31 820153.49±13.502-羟基-4-甲基戊酸乙酯10348-47-72 045.31 54524.52±4.05丙酸乙酯105-37-31 334.896628.00±26.750.80±0.11丙二酸二乙酯105-53-31 903.61 5721.13±0.43丁酸乙酯105-54-41 0321 04419.23±1.2457.08±1.45110.14±1.57庚酸乙酯106-30-9841.151 3520.59±0.1616.42±11.42辛酸乙酯106-32-11 841.51 44913.10±2.9485.32±64.4939.13±11.88己酸甲酯106-70-71 186.31 1175.48±1.27丁二酸单乙酯1070-34-41 277.22 3670.56±0.19异戊酸乙酯108-64-51 826.91 0670.83±0.103.99±0.348.42±0.78乙酸异丁酯110-19-01 178.51 0251.32±0.255.37±4.02癸酸乙酯110-38-31 361.51 6332.81±0.260.29±0.024.30±0.63水杨酸甲酯119-36-81 580.91 7351.57±0.15琥珀酸二乙酯123-25-11 886.41 68329.39±1.84114.82±3.64壬酸乙酯123-29-51 387.91 5261.21±0.162.02±0.13己酸乙酯123-66-02 024.91 24118.61±0.9396.87±1.7310.3±0.48乙酸异戊酯123-92-22 224.61 1161.28±0.17乙酸乙酯141-78-61 407.689655.78±3.27142.16±4.58247.58±7.73乙酸己酯142-92-71 209.21 2760.25±0.042.53±1.531.29±0.202-己烯酸乙酯1552-67-62 021.51 3295.79±0.862-甲基-3烃基丁酸甲酯17417-00-41 937.71 3830.12±0.02苯丙酸乙酯2021-28-52 157.11 90024.05±1.823-己烯酸乙酯2363-89-51 373.11 2900.35±0.03戊酸乙酯539-82-21 625.81 1304.83±0.2761.90±17.439-十六碳烯酸乙酯54546-22-41 028.62 2670.11±0.01己酸丙酯626-77-72 229.91 3191.46±0.041.53±0.45棕榈酸乙酯628-97-71 488.72 2884.64±0.6819.72±0.782-甲基丁酸乙酯7452-79-11 368.21 0620.43±0.137.41±2.31醋酸甲酯79-20-91 5878270.46±0.16戊二酸二乙酯818-38-21 744.11 7801.11±0.04邻苯二甲酸二丁酯84-74-21 189.32 6800.87±0.053-壬烯酸乙酯91213-30-81 340.71 4941.04±0.160.87±0.021.01±0.30苯甲酸乙酯93-89-01 374.21 6527.17±0.8463.82±4.41异丁酸乙酯97-62-11 9149752.63±0.112.44±0.48乳酸乙酯97-64-31 614.71 3402.24±0.741-(1-乙氧基乙氧基)戊烷13 442-89-21 602.511041.37±0.39呋喃2-正戊基呋喃3 777-69-31 236.312270.79±0.150.19±0.022-糠酸乙酯614-99-32 207.51 6212.90±0.345-甲基呋喃醛620-02-01 710.91 5822.29±0.21糠醇98-00-01 517.31 6521.67±0.24酮甲基庚烯酮110-93-01 425.61 3410.59±0.08仲辛酮111-13-71 493.61 2831.65±0.239.33±1.39羟基丙酮116-09-62 361.21 2721.78±0.292.34±0.056.04±0.332-壬酮 821-55-6982.611 3721.11±0.12
续表6

组别名称CASRIRILABC芳香类苯乙酸乙酯101-97-31 223.21 76329.82±1.571-异丙烯基-3-甲基苯 1124-20-5953.181 4561.49±0.17对乙基苯酚123-07-91 512.52 2100.56±0.067.51±0.312,6-二叔丁基对甲酚128-37-08541 9203.31±0.81异丁醛二乙基乙缩醛 1741-41-91 551.89771.83±0.314-乙基愈创木酚2785-89-91 7772 0028.55±0.401,2,3,4-四甲基苯488-23-31 3321 4304.21±0.461.82±0.05苯乙醇60-12-82 5091 9528.09±0.29128.34±6.33146.74±0.66(2,2-二乙氧基乙基)-苯6 314-97-21 467.417111.61±0.095-甲基茚烷874-35-11 567.91 4803.29±1.21α-甲基萘90-12-01 899.41 9151.40±0.63萘91-20-31 747.71 70730.06±3.0118.08±1.5234.74±1.461,2,4,5-四甲基 -苯95-93-21 559.71 447.314.27±0.979.76±0.892,4-二叔丁基苯酚96-76-41 339.22 32127.94±0.7334.85±10.1422.01±16.31对伞花烃99-87-61 3481 2891.27±0.140.90±0.11苯乙烯100-42-51 663.21 2540.44±0.1215.59±1.77萜烯类4-萜品醇20126-76-51 386.71 5939.24±1.17薄荷醇491-01-02 254.71 5570.58±0.040.64±0.07石竹素1139-30-62 150.31 9881.26±0.11α-异松油烯586-62-91 6691 2800.47±0.08石竹烯87-44-51 5011 6041.18±0.134-萜烯醇562-74-3890.711 6005.14±4.3310.21±1.43葡萄螺烷65416-59-31 300.31 5050.55±0.020.34±0.03里那醇78-70-61 689.31 5521.55±0.191.74±0.652.63±0.14
在杨梅利口酒中共检测到正戊酸、正己酸、乙酸、壬酸等11种挥发酸。这些有机酸可能会给带来不良的风味。这几种酸在以小曲清香为基酒的杨梅利口酒中含量要高于其他2种利口酒,特别是己酸和乙酸,可能会影响此款酒的酸度及口感。
酯类中共检测到乙酸乙酯、辛酸乙酯、己酸乙酯、丁酸乙酯等23种,其中3种利口酒共有酯类物质有9种。由食用酒精制成的杨梅利口酒较其他酒相比含香气酯类物质的浓度较低,其中乙酸乙酯在除了以食用酒精为基酒的杨梅利口酒之外的杨梅利口酒中含量都较高,这可以解释为由食用酒精调配而成的杨梅利口酒果香味较弱。
醇类中正己醇、正辛醇、异戊醇、顺-3-己烯-1-醇含量较高,其主要呈现醇香,从而为利口酒增添醇厚清新的香气。其中果汁加小曲清香的醇类物质含量相比于其他更高,给这款酒带来了更重的醇香。
萜烯类的物质在果汁加杨梅蒸馏酒这种利口酒中表现最好,无论是检出个数还是相对含量都相比于其他2种利口酒更高。萜烯类物质通常都具有令人愉悦的香气特征,比如果香、花香等,而且该类物质阈值也相对较低,对酒有重要的香气贡献,也具有重要的生理活性及营养价值[26]。
此外,在芳香族化合物中,苯乙醇在果汁加蒸馏酒和果汁加小曲清香白酒中含量要远远高于果汁加食用酒精,苯乙醇通常也是酒精饮料中一种重要的香气化合物,主要带来玫瑰花香的香气特征[27]。
综上所述,在3种利口酒中,果汁加杨梅蒸馏酒香气化合物检出数量要远远高于其他2种利口酒,并且一些重要的香气化合物如萜烯类等,其相对含量也高于其他2种利口酒,从而可能带来更为浓郁、饱满的香气特征。
2.4 感官分析
杨梅利口酒的偏好分析结果为:果汁加食用酒精的秩序和为98,果汁加小曲清香白酒的秩序和为112,果汁加杨梅蒸馏酒的秩序和为90。从结果来看,针对于青年学生群体,果汁加杨梅蒸馏酒最受欢迎,要优于果汁加食用酒精,而果汁加小曲清香白酒受欢迎度最低,这可能是因为杨梅蒸馏酒的果香更加浓郁,香气更加怡人,并且杨梅蒸馏酒来源于杨梅的香气与杨梅果汁的香气更容易融合在一起。不过本研究仅仅是针对高校青年学生群体进行偏好性分析,后续还应扩大人群以得到更为全面的偏好结果。
3 结论
采用顶空固相微萃取及GC×GC-TOFMS对杨梅利口酒中挥发性成分进行解析,在3款杨梅利口酒中共检测出106种香气物质,其中果汁加杨梅蒸馏酒香气化合物检出数量要远远高于其他2种利口酒,为酒体带来更浓醇的香气。
单体酚的检测结果表明,在这3款`杨梅利口酒中均检测到除绿原酸、对羟基苯甲酸、水杨酸、芦丁及桑黄素外的11种单体酚,其中果汁加食用酒精处理与果汁加杨梅蒸馏酒处理的利口酒单体酚总量均较高,果汁加小曲清香白酒单体酚含量最低。总酚含量与单体酚趋势相似,同样是果汁加食用酒精最高,其次是果汁加杨梅蒸馏酒,而果汁加小曲清香白酒最低。此外,由果汁加食用酒精调配的利口酒中总花色苷要高于其他2款利口酒。
感官分析结果则表明,在高校青年学生群体中,对果汁加蒸馏酒的喜好度要优于加食用酒精和小曲清香型白酒。
[1] 刘银兰,赵慧宇,杨桂玲,等. 杨梅采前防落果药剂筛选[J]. 浙江农业科学, 2018, 59(9):1 680-1 682;1 686.
[2] 邹秀琴,孙钧,张林,等. 东魁杨梅2种山地设施避雨栽培的研究及应用[J]. 浙江农业科学, 2018, 59(9):1 694-1 699.
[3] 林雨晴,秦丹. 杨梅果酒加工工艺的研究进展[J]. 农产品加工, 2018(11):59-61.
[4] 唐正江,汤飞,刘国庆. 响应面法优化杨梅干红生产工艺的研究[J]. 包装与食品机械, 2015, 33(2):17-20;24.
[5] 苏龙,吕凤丹,王雪儒,等. 响应面优化杨梅果酒发酵工艺及其抗氧化性[J]. 食品工业科技, 2017, 38(20):146-151;170.
[6] DU J, HAN F, YU P, et al. Optimization of fermentation conditions for Chinese bayberry wine by response surface methodology and its qualities [J]. Journal of the institute of brewing, 2016, 122(4):763-771.
[7] ZHANG Z W, LI J Y, FAN L P. Evaluation of the composition of Chinese bayberry wine and its effects on the color changes during storage [J]. Food Chemistry, 2019, 276(3):451-457.
[8] 邢建荣,杨颖,夏其乐,等. 全果发酵生产杨梅果酒工艺条件及品质的研究[J]. 浙江农业学报, 2012, 24(6):1 111-1 116.
[9] 高娟,张雪林,杨性民,等. 杨梅果酒的澄清与降酸工艺研究[J]. 浙江万里学院学报, 2015, 28(4):91-97.
[10] 侍崇娟,吕钰凤,杜晶,等. 杨梅酒发酵工艺及其风味变化[J]. 食品工业科技, 2015, 36(6):166-170.
[11] 王洪,罗惠波,廖玉琴,等. 野生猕猴桃鸭梨利口酒工艺的研究[J]. 食品研究与开发, 2017, 38(22):110-115.
[12] 冯紫慧,赵超,庄志发,等. 2种发酵鸭梨酒的研制[J]. 中国酿造,2008(5):131-132.
[13] 邱怡筠,杜婧,高本杰,等. 桑葚草莓复合果酒制作工艺的研究[J]. 轻工科技, 2016, 32(9):8-10.
[14] 唐柯,王茜,周霞,等. 石榴酒发酵过程中香气动态变化规律[J]. 食品与发酵工业, 2019, 45(6):197-202.
[15] 吕建垚. 浸泡型杨梅酒工艺改良和发酵型杨梅酒工艺研究[D]. 南昌:南昌大学, 2014.
[16] 中华人民公共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 15038—2006 葡萄酒、果酒通用分析方法[S].2006.
[17] FOLIN O, DENIS W. A colorimetric estimation of phenol and phenol and derivatives in urine [J]. Journal of Biological Chemistry, 22 (1 915): 305-308.
[18] SINGLETON V L, ROSSI J A, Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents [J]. American Journal of Enology and Viticulture, 1965(16):144-158.
[19] 裴云逸,陆星星,武翠芳,等. 花生衣中原花青素及多酚物质含量分析研究[J]. 食品研究与开发, 2017, 38(17):143-147.
[20] TANG K, LI J M, WANG B, et al. Evaluation of nonvolatile flavor compounds in Vidal icewine from China [J]. American Journal of Enology and Viticulture, 2013, 64 (1): 110-117.
[21] HUANG L, MA Y, TIAN X, et al. Chemosensory characteristics of regional Vidal icewines from China and Canada [J]. Food Chemistry, 2018, 261: 66-74.
[22] 易承学,曹杰,徐虹,等. 丹皮酚GC-MS测定方法的建立及应用[J].实用药物与临床, 2018(9):1 052-1 055
[23] 中华人民公共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 12315—2008 感官分析方法学排序法[S].2008.
[24] 李岳珍. 发酵前处理对桑椹紫酒多酚物质含量影响的研究[D]. 呼和浩特:内蒙古农业大学, 2012.
[25] 李洁莹,杜晶, 韩飞, 等. 无醇杨梅果酒发酵工艺优化及其品质分析[J]. 食品与发酵工业, 2016, 42 (12):76-82.
[26] CARMEN G B, RAQUEL R O, BEATRIZ C G, et al. Wine aroma compounds in grapes: A critical review [J]. Critical Reviews in Food Science and Nutrition, 2015, 55(2): 202-218.
[27] MA Y, TANG K, XU Y, et al. Characterization of the key aroma compounds in chinese Vidal icewine by gas chromatography-olfactometry, quantitative measurements, aroma recombination and omission test [J]. Journal of Agricultural and Food Chemistry, 2017, 65(2): 394-401.