南美白对虾腐败过程分为内源性和外源性2个阶段,前一阶段内源酶类水解作用占主导,后期微生物分解产生三甲胺等腐败物质。针对水产品的腐败问题,目前水产品市场的低温贮藏主要分四类:冷藏(4 ℃)、冰藏(0 ℃)、微冻(低于冰点1~2 ℃)、冻藏(-18 ℃)。微冻(super-chilling,sub-chilling,partial freezing)是一种让食物中水分部分冻结的方法,通常是指低于食物初始冰点的1~2 ℃,导致产品中5%~30%的自由水形成冰晶[1]。与冻藏相比,微冻能够减少冻结过程中冰晶对产品造成的机械损伤,减少解冻过程中的汁液流失率,保持食品原有的鲜度,降低能耗。MAGNUSSEN等[2]认为,微冻条件下产品货架期与冷藏相比,延长1.4~5倍。在冷藏过程中,产品表面不会冻结,因此对于较厚产品来说,导热系数低,内部传热缓慢,在工业生产中非常耗时。KAALE等[3]认为,微冻过程中食品表面从内部吸收热量,在表面会形成一层1~3 mm的冻结层。能够在冷链运输或贮藏过程中保持一定的热负荷存于物料内部,维持物料温度平衡,同时避免温度波动过大引起重结晶现象。李卫东等[4]通过对南美白对虾微冻条件下的品质的研究,发现在-3 ℃条件下,K值被抑制,第18天仅为23.5%,且细菌总数一直呈较小幅度的增加,样品保质期达26 d。
目前,微冻对虾仁品质的影响仍存在一些争议,大多数关于微冻的研究主要集中于感官分析和微生物腐败等方面,对于蛋白质和结构变化及水分迁移等特性研究较少。本文通过对虾仁在微冻条件下的新鲜度、持水力、水分迁移、肌原纤维蛋白、微观结构等几个方面进行研究。旨在为虾仁微冻贮藏提供理论基础。
1 材料与方法
1.1 材料与试剂
活体南美白对虾:购于上海市南汇新城芦潮港农贸市场,挑选同一批次且规格大小一致的产品,单个重约(15±0.8) g;用碎冰猝死后,在低温条件下,进行剥壳,去头,挑虾线处理。处理好的样品经真空包装后,贮藏于(-3±0.5)℃的恒温恒湿箱内。
试剂:改良型Bradford蛋白浓度测定试剂盒;二甲苯、无水乙醇、10%福尔马林、苏木精-伊红染液。三磷酸腺苷(adenosine triphosphate,ATP)、二磷酸腺苷(adenosine diphosphate,ADP)、腺苷一磷酸(adenosine monophosphate,AMP)、肌苷单磷酸(inosine monophosphate,IMP)、次黄嘌呤核苷(hypoxanthine riboside,HxR)、次黄嘌呤(hypoxanthine,Hx)标准品(纯度均不小于 99%)、氨基酸混合标准溶液等美国Sigma-Aldrich 公司。
1.2 仪器与设备
高效液相色谱仪(Waters 600 Controller pump、Waters 2487紫外检测器、Millenium 32数据处理软件),Waters公司;DS-5M 型Nikon数码相机,日本Nikon公司;BX41 型Olympus光学显微镜,日本Olympus光学仪器有限公司;Kjeltec 2300凯氏定氮仪,丹麦福斯公司;UV 1102紫外可见分光光度计,上海天美仪器有限公司。
1.3 方法
1.3.1 虾仁冰点测定
称取1 cm×10 cm的虾仁,温度采集仪的热电偶固定于虾仁体表下约0.5 cm处,放入-18℃冰箱,采集间隔10 s,历时3 h,3组平行,取平均值绘制冻结曲线。
1.3.2 挥发性盐基氮(TVBN)测定
采用凯氏定氮仪,参照半微量定氮法原理,测定虾仁TVBN含量变化,平行3次。
1.3.3 菌落总数(total viable count,TVC)测定
参考GB 4789.2—2016 [5-7]《食品微生物学检验菌落总数测定》方法,每个稀释度2个平行。
1.3.4 K值测定
样品处理参考LI等[8]方法略有改动。称5 g虾肉,加入10%高氯酸(预冷)10 mL,均质,在10 000 r/min,4 ℃条件下,离心15 min。10 mL 5%高氯酸沉淀再次离心(条件同上),过程重复2次,合并上清液,6 mol/L KOH调pH为6.5,静置30 min,取上清液定容至50 mL,经0.22 μm滤膜过滤后,2 mL注射器打入1.5 mL进样瓶。
参数设置:ODS-3色谱柱:(4.6 ID×250 mm);流动相:A为甲醇溶液,B为0.02 mol/L磷酸缓冲溶液溶液(pH 6.5),等梯度洗脱;柱温28 ℃;进样10 μL;流速1 mL/min;检测波长254 nm。
(1)
式中:M1,ATP含量,mg/100 g;M2,ADP含量,mg/100 g;M3,AMP含量,mg/100 g;M4,IMP含量,mg/100 g;M5,Hx含量,mg/100 g;M6,HxR含量,mg/100 g。
1.3.5 肌原纤维蛋白含量的测定
参考NIU等[9]方法略改动,称取2 g样品,加入18 mL蒸馏水,均质后冷冻离心(10 000 r/min,4 ℃)10 min,过滤后获取沉淀,再加入18 mL,30 g/l%的NaCl溶液,同上,离心后取得上清液。采用改良型Bradford蛋白浓度试剂盒染色后,酶标仪进行测定,平行3次。
1.3.6 持水率测定
参照LAKSHMANAN等[10]方法略改动。称取5 g样品,双层滤纸包裹后,(1 500 r/min,10 min)条件下离心。干燥法测量水分含量。持水力计算如式(2)所示。
持水力![]()
(2)
式中:W2,样品离心后的质量,g;W1,样品离心前的质量,g。
1.3.7 低场核磁共振分析(Low field nuclear magnetic resonance, NMR))
NMR横向弛豫时间T2用CPMG(carr-purcell-meiboom-gill sequence)序列测量。参数设置:SW=200 kHz,RG1=20,P1=18.00 s,DRG1=3,TD =399 950,PRG=2,TW=2 500 ms,NS=8,P2=37.00 s,TE=0.250,NECH=8 000。参照CAO等[11]方法略改动。称取2 mm×2 mm×1 mm的立方体样品,擦干表面水分,保鲜膜包裹后,将其置于LF-NMR直径为70 mm的检测管内,弛豫时间T2通过MultiExp Inv分析软件获得。
1.3.8 核磁成像分析(magnetic resonance imaging, MRI)
参考LIU等[12-13]方法略改动,将样品保鲜膜包裹后放入直径70 mm的核磁管内,随后通过核磁共振成像软件测定虾肉的质子密度图谱。参数设置:TR=500 ms,TE=18.2 ms。由拉莫尔定律选择成像层面,调节信噪比及图像清晰度,8次扫描重复累加得到的成像图谱。随后进行统一映射和伪彩处理。
1.3.9 光学显微镜观察(light microscopy observation)
参考文献[14-15]方法。样品切成3 mm×5 mm×5 mm的小块,放入质量分数为5%的福尔马林溶液中固定24 h,用乙醇溶液梯度洗脱(间隔1 h),乙醇体积分数依次为70%、80%、90%、95%、100%。二甲苯透明处理后,石蜡包埋,切成厚度为10 μm的切片,伊红-苏木精染色,经乙醇和二甲苯进行洗脱处理后,光学显微镜倍数10×10进行观测,拍照保存。
2 结果与分析
2.1 虾仁冰点的测定
虾仁冻结曲线如图1所示。冰点为-2.1 ℃,冰温带范围0~2.1℃,虾仁贮藏在微冻条件下,恒温恒湿箱温度应低于冰点1~2 ℃,设为(-3±0.5)℃。
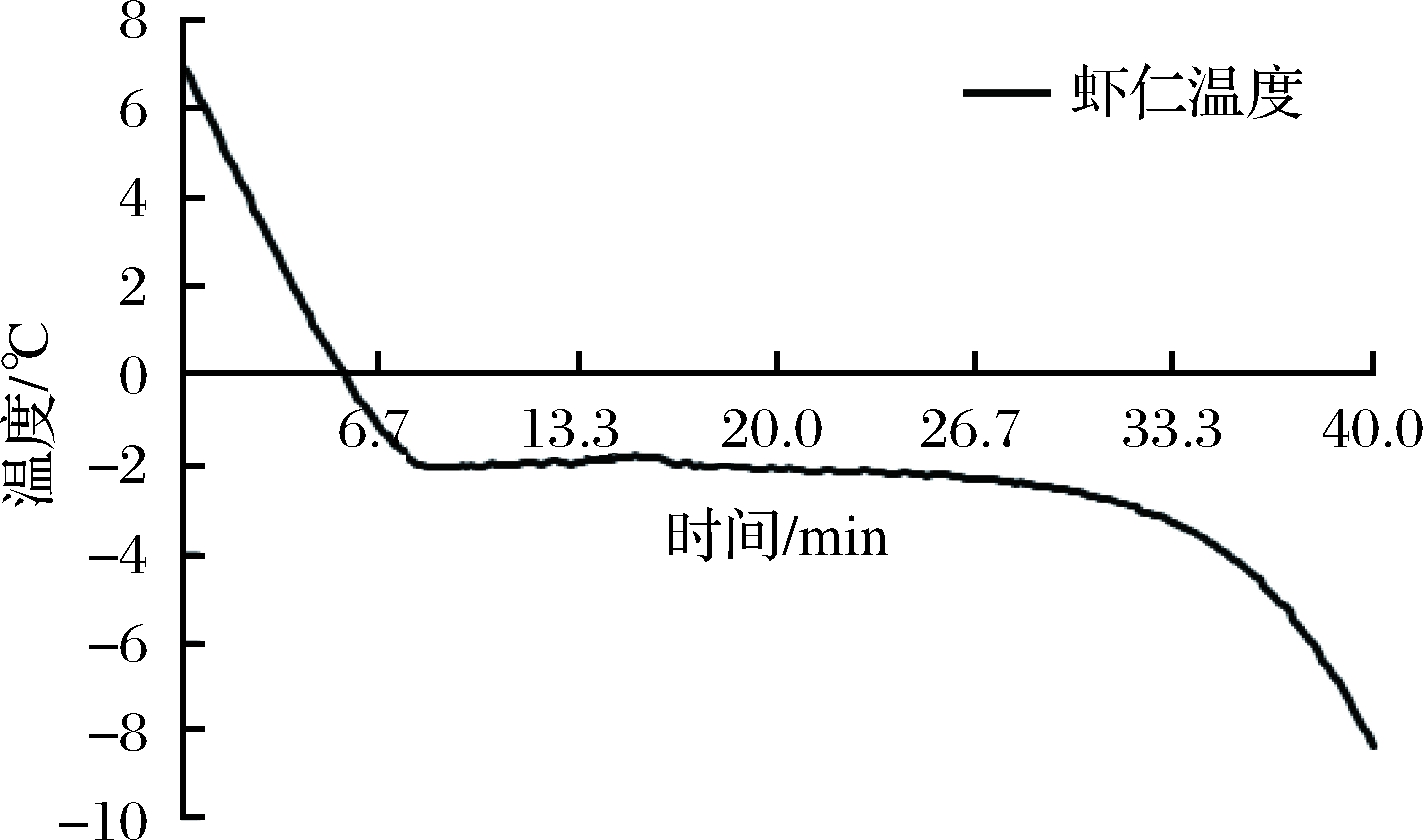
图1 虾仁冻结曲线
Fig.1 Freezing curve of shrimp
2.2 TVBN的变化
随着贮藏时间的延长,虾仁在内源酶和微生物的作用下会分解产生胺类等碱性化合物。通过对TVBN含量的测定能够反映水产品的新鲜程度。图2显示,新鲜虾仁的初始TVBN为6.01 mg/100 g左右,TVBN含量总体呈现上升趋势。从第5天开始,TVBN增长速度缓慢,稳定在11.98 mg/100 g左右。可能是因为在微冻条件下,虾仁表面形成一层约1 mm厚的冰层,表层微生物细胞内水分被部分冻结,微生物生长活动被抑制,酶活性降低,产生的胺类物质减少[16]。在第24天时,虾仁TVBN含量为21.32 mg/100 g,超出国标[17]规定的淡水虾TVBN上限(TVBN≤20 kg/100 g)。
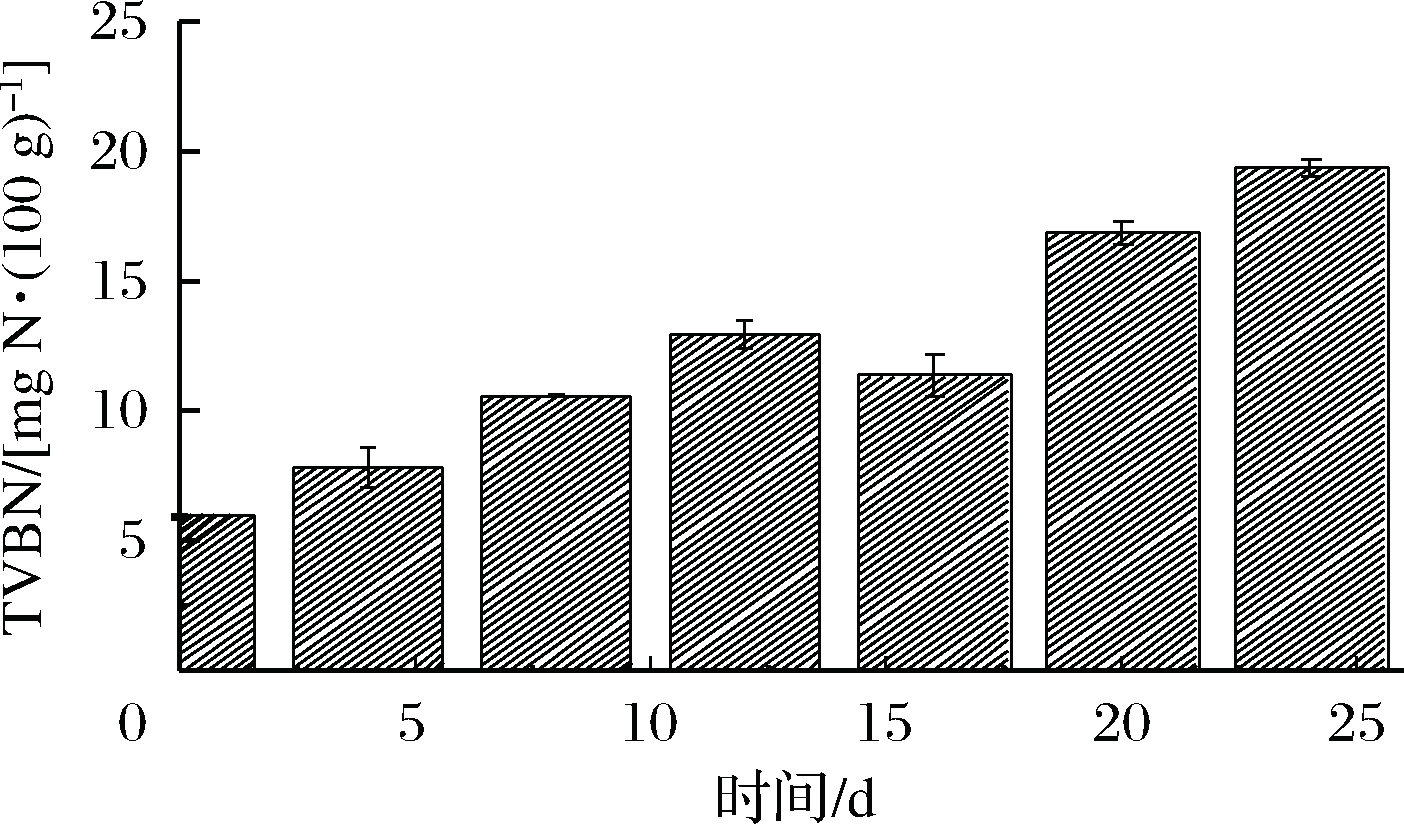
图2 虾仁微冻贮藏过程中TVBN含量变化
Fig.2 Changes in TVBN content of shrimpduring superchilling storage
2.3 菌落总数变化
微生物分解作用是水产品腐败的重要原因,一般鲜虾的初始菌落总数在4~5 lg CFU/g[18]。由图3可知,鲜虾仁初始细菌总数(TVC)为(4.04±0.05)lg CFU/g,菌落总数呈缓慢增长趋势。是因为在低温条件下,大部分微生物活动被抑制,嗜冷菌(革兰氏阴性菌,假单胞菌等)成为优势菌属,利用蛋白质,氨基酸等肌肉组织分解成分进行增殖。在贮藏至24 d时,菌落总数为(6.89±0.04)lg CFU/g,并未达到腐败的标准107 CFU/g。这一研究结果与李卫东等[4]一致,微冻贮藏26 d时,细菌总数达6.2 lg CFU/g,并未达到腐败标准。可能是由于微冻形成的表面冻膜,有效组织了微生物的入侵。
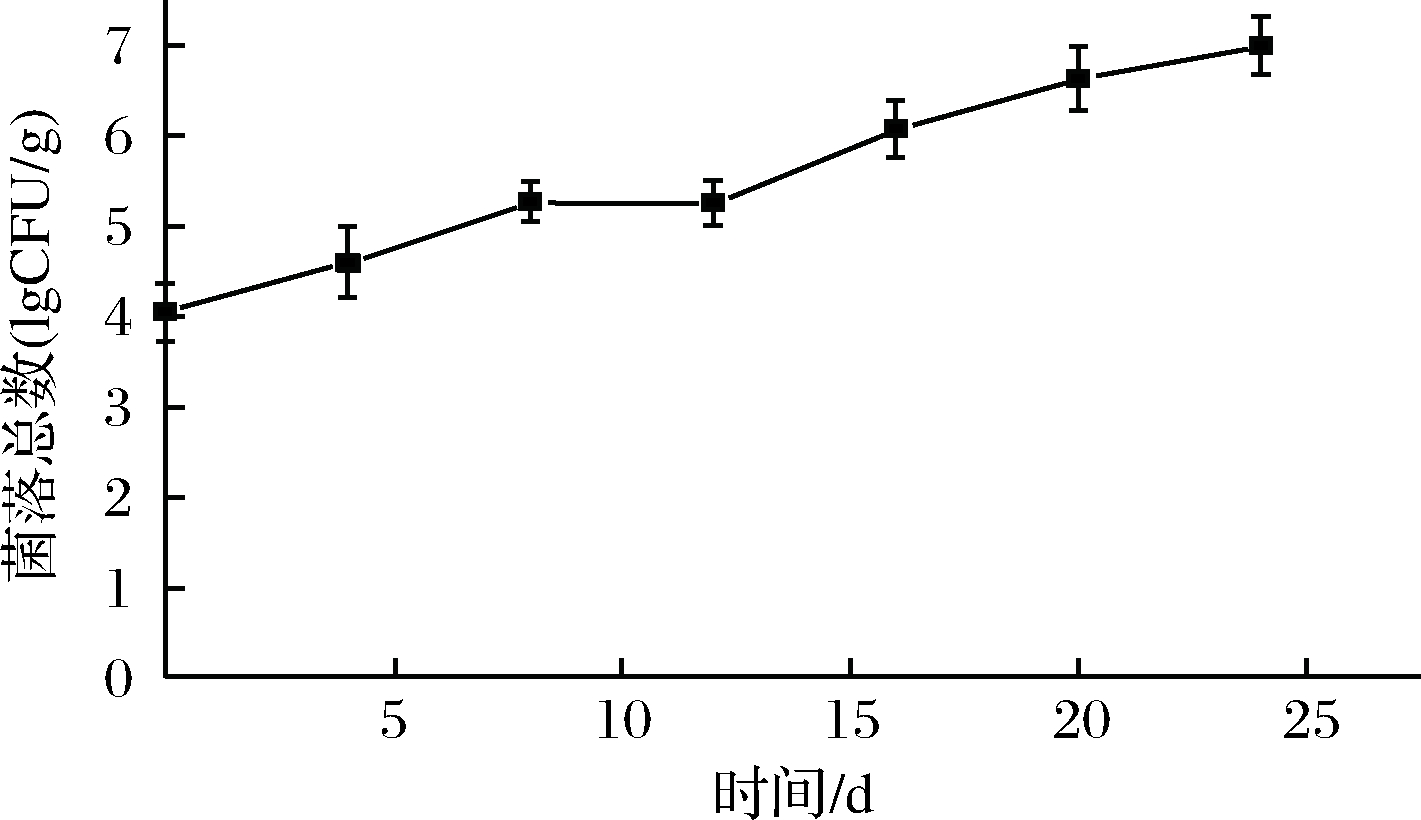
图3 虾仁微冻贮藏过程中菌落总数的变化
Fig.3 Changes in TVC of shrimp during superchilling storage
2.4 K值变化
微冻贮藏过程中,肌肉细胞内ATP的水解是维持肌节松弛与收缩的一个重要生化过程。随着糖酵解的进行,糖原水平下降,ATP在内源酶类作用下,迅速降解为ADP,AMP和IMP。随后IMP在酸性磷酸酶(acid phosphatase,ACP)作用下分解为HxR和Hx,ATP浓度降低。肌束开始在一定程度上缩短,一旦肌肉内ATP严重不足,肌球蛋白便开始与肌动蛋白永久性地结合,形成肌动蛋白复合物,导致肌肉失去伸展能力,肌丝间水分流失,样品逐渐自溶,最终腐败变质。因此,K值是判断水产品鲜度的一个重要指标。
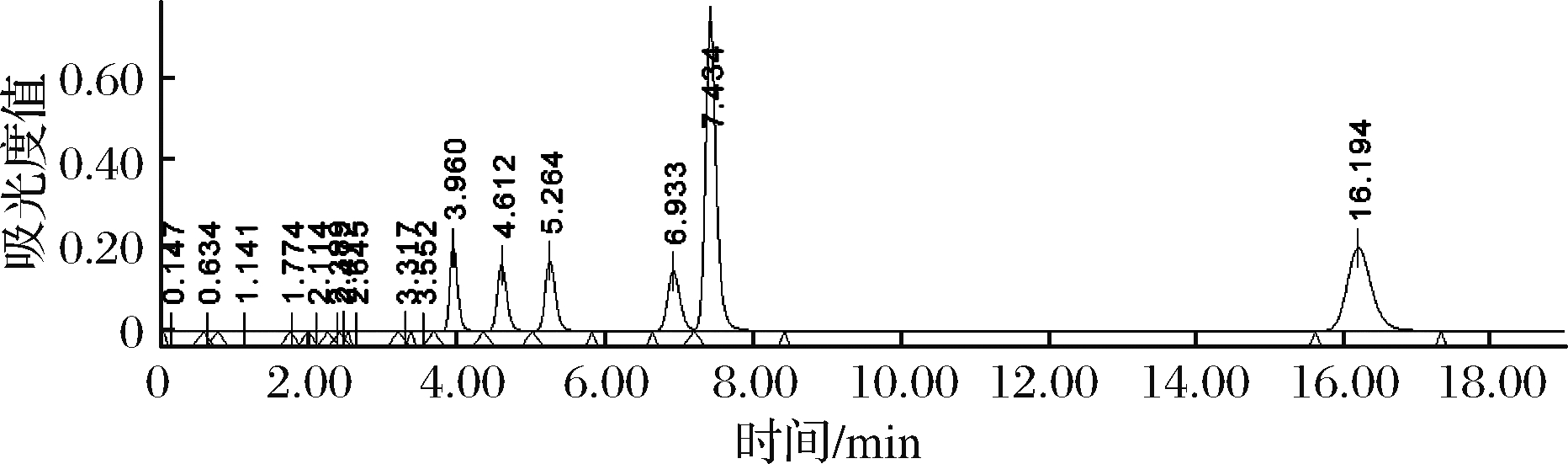
图4 K值标准品峰图
Fig.4 K value standard peak spectrum
图4为6种核苷酸混合标准品浓度为200 μmol/g生成的图谱,且出峰顺序依次为:IMP(3.960 min),ATP(4.612 min), ADP(5.264 min),AMP(6.933 min),Hx(7.434 min),HxR(16.194 min)。
由图5可知,鲜虾仁的K值为6.71%,贮藏前期(0~15 d),K值增长缓慢,处于平稳状态。ANDO等[19]研究表明,日本对虾在5 ℃和0 ℃条件下, K 值达到一级鲜(20%),分别需要4 d和12 d,贮藏期相对微冻较短。本实验在-3 ℃微冻条件下,在18 d左右超出一级鲜度。且在腐败期(24 d),K值为47.53%,并未达到腐败的标准(K>60%)。吴依蒙等[20]通过研究牙鲆ATP降解物,提出鱼类在低温贮藏过程中IMP含量下降,是肌体内源性AMP-脱氨酶(AMP-deaminase,ADA)和微生物源的ADA降解酶叠加作用的结果,且在贮藏后期,微生物是影响ATP降解的重要因素。这一研究解释了K值前期含量较低的现象,因为在微冻条件下,微生物没有达到最适生长环境,体内的ACP活性被抑制,IMP的降解速度下降,导致K值的增长速度比较缓慢,延长了虾仁贮藏期[19-20]。由图3可知,在贮藏后期,菌落总数接近腐败水平时, K值含量也随之增加。因此,微生物与K值含量呈正相关(P<0.05)。
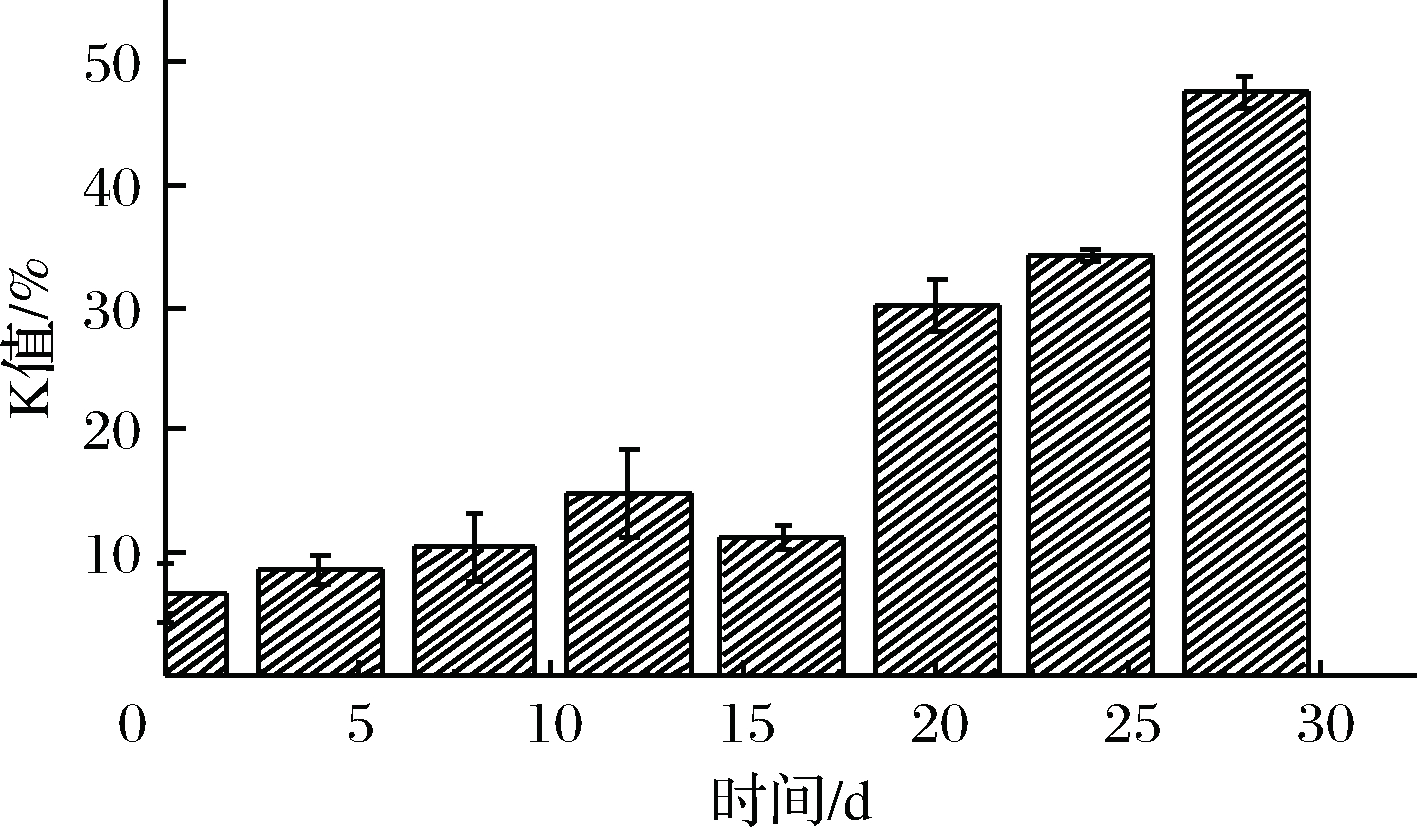
图5 虾仁微冻贮藏过程中K值变化
Fig.5 Changes in K value of shrimp duringsuper-chilling storage
2.5 持水力变化
持水力能够反映肌肉对水分的维系能力,经干燥法测得,鲜虾仁初始含水率为79.8%。由图6可知,微冻条件下,虾仁的持水力呈下降趋势。在整个贮藏过程中,虾仁持水率下降了4%左右。可能因为在微冻(-3 ℃)条件下,样品对温度波动比较敏感,微小的温度变化可能导致重结晶现象。当产品中一些水分部分结晶后,未冷冻的溶液中溶质浓度增加,引起酶活性增加,肌肉蛋白质变性,细胞膜结构损伤,导致肌肉持水力下降[16]。
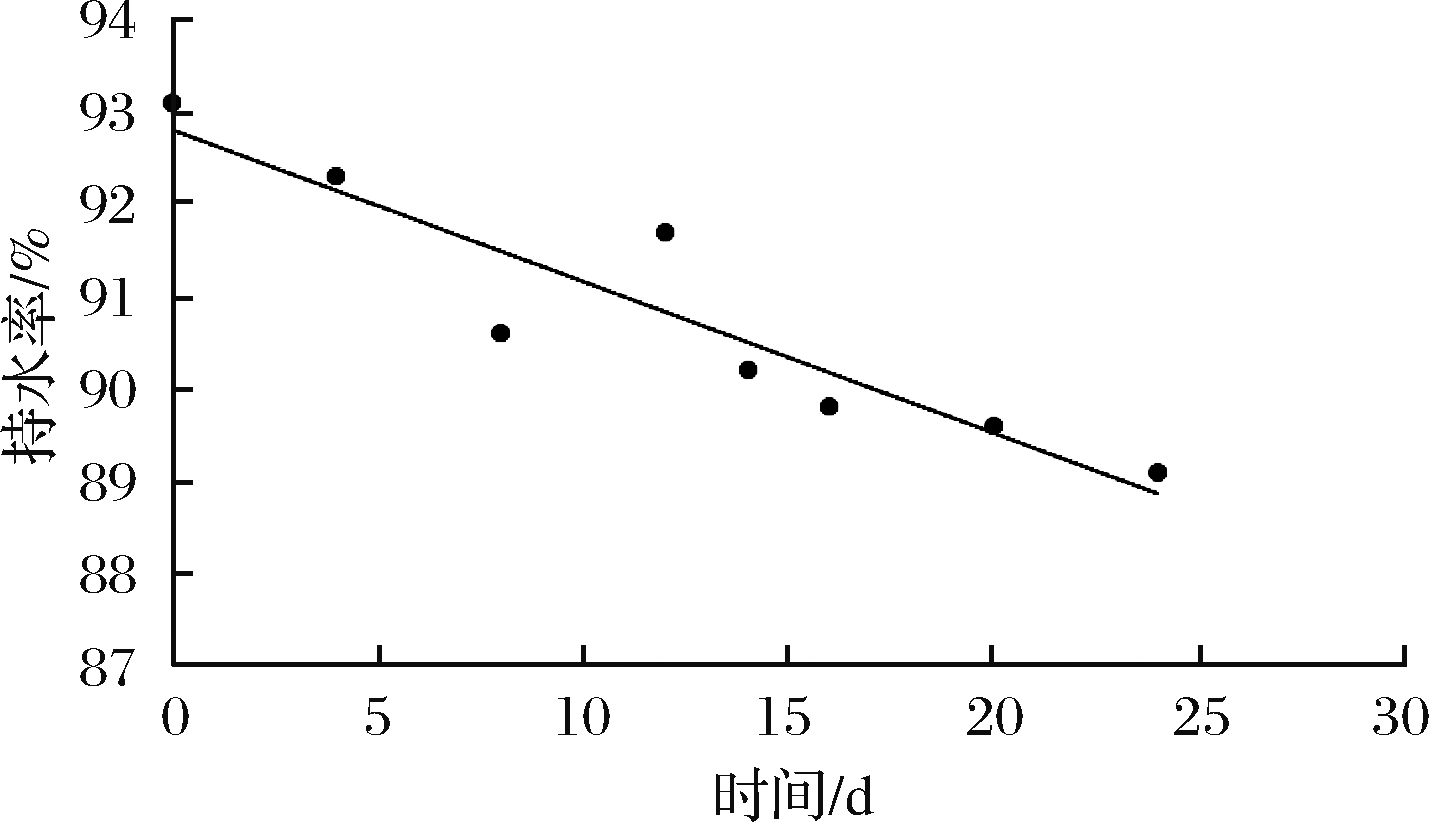
图6 虾仁微冻贮藏过程中持水率变化
Fig.6 Changes in water holding capacity of shrimp duringsuper-chilling storage
2.6 微冻对南美白对虾水分迁移的影响
低场核磁共振技术(low field nuclear magnetic resonance, LF-NMR)能够直接提供蛋白质中的水质子和可交换质子之间的相互作用信息,从而快速且非破坏性地提供样品中水的理化状态。LF-NMR T2弛豫时间已成功用于研究猪肉,虾,鳕鱼和鲑鱼等在冷藏和冻藏期间的水分分布与流动特性。NMR弛豫时间测量过程,即排列在磁场中的原子核被射频脉冲从平衡状态被扰乱至脉冲停止返回的过程[21]。弛豫时间越长说明底物与水分结合程度越松散,水分越自由。T21(0~2 ms)位于肌原纤维内肌浆中与蛋白质分子紧密结合的结合水;T22 (2~20 ms)表示位于肌原纤维粗丝和细丝之间的不易流动水;弛豫时间最慢的T23(20~1 000 ms)表示位于肌原纤维外部的自由水,这部分水对食品品质保持起决定性的作用,可用于微生物生长活动,可溶性溶质溶解以及酶促反应的发生[22]。由图7可知,随着贮藏期的延长,结合水(T21)信号强度和峰面积几乎保持不变。这一结果与PEARCE等[21]的观点一致。这种蛋白质结合水通常一般与周围水分子(包括不易流动水在内)进行交换,具有非常低的迁移率,即使在施加外力(例如冷冻和加热)的条件下,也不会移动到其他区域,并保持紧密结合状态。在贮藏前期(0~5 d),T22 所代表的不易流动水信号强度增加,随后又逐渐保持稳定。在整个微冻条件下,T23 自由水的含量一直在下降,自由水所占比例,从初始的1.08%,降至0.17%。且弛豫时间也逐渐延迟,表明自由水的迁移率高。肌原纤维结构碎片化程度越深,虾仁中水分流失越严重。

图7 虾仁在微冻贮藏过程中弛豫时间T2的变化
Fig.7 Changes in T2 relaxation time of shrimpduring super-chilling storage
2.7 微冻虾仁的核磁成像分析
核磁共振图像(magnetic resonance imaging, MRI)通过呈现二维的质子密度图,能够直观地检测到肌体内水分的空间分布状态。样品不同区域的信号强度与水分子含量成正比,一般来说,图像中颜色越亮(即MRI质子密度加权成像伪彩图颜色趋近于红色),代表此区域的水质子信号越强,表明虾仁体内的水分含量就越高[23]。在初期阶段(0~6 d)虾仁质子密度图整体色泽呈红色,表明虾仁体内水分含量较多,且分布均匀。在第10 天,虾仁表面颜色变暗,呈现与底色相近的蓝色,是因为微冻在虾仁表面形成一层冰层,冰晶破坏了原生质和细胞膜结构,导致虾仁表面失水。此外,也可能是因为部分水结冰,导致未冷冻溶液溶质浓度增加,导致酶活性增加,肌肉蛋白质变性,细胞膜结构被破坏,保水性下降[24]。在贮藏后期,虾仁整体颜色逐渐偏暗(伪彩图红色减少,蓝色增多接近底色),表明虾仁体内水分流失严重,结构被严重破坏,品质发生严重的劣变。
2.8 肌原纤维蛋白含量变化
水产品中肌肉蛋白质的主要成分是盐溶性的肌原纤维蛋白。研究表明,对虾体内肌原纤维蛋白的含量占总蛋白含量的52.07%,肌原纤维蛋白主要包括肌球蛋白(由2条分子质量为220 kDa的重链和2条130 kDa的小亚基轻链组成的大蛋白,是肌原纤维粗丝的主要成分)和肌动蛋白(肌原纤维细丝的主要成分)[25]。由图8可知,新鲜虾的肌原纤维蛋白的含量最高417.28 μg/mL,在整个贮藏(-3 ℃条件下)过程中,肌原纤维蛋白含量变化呈下降趋势,其中肌原纤维蛋白含量在前期(2~10 d)保持缓慢下降趋势,随后(10~15 d)呈明显较快的下降趋势。在整个贮藏过程中,肌原纤维蛋白含量与初始值相比下降了89.92%。肌原纤维蛋白溶解性下降有如下3种解释[26-27]:(1)肌原纤维蛋白质变性后产生碱溶性蛋白质,该蛋白在高离子强度下不能溶出,导致肌动球蛋白溶解度降低;(2)微冻条件下,肌原纤维蛋白中的部分结合水形成冰晶,肌动球蛋白分子间相互作用形成疏水键和氢键等非共价键,聚合成不溶性凝聚物,导致盐溶性蛋白溶解度降低;(3)巯基残基和其他硼氢化合物聚合形成不稳定的共价键,降低盐溶性蛋白的溶解性[25]。
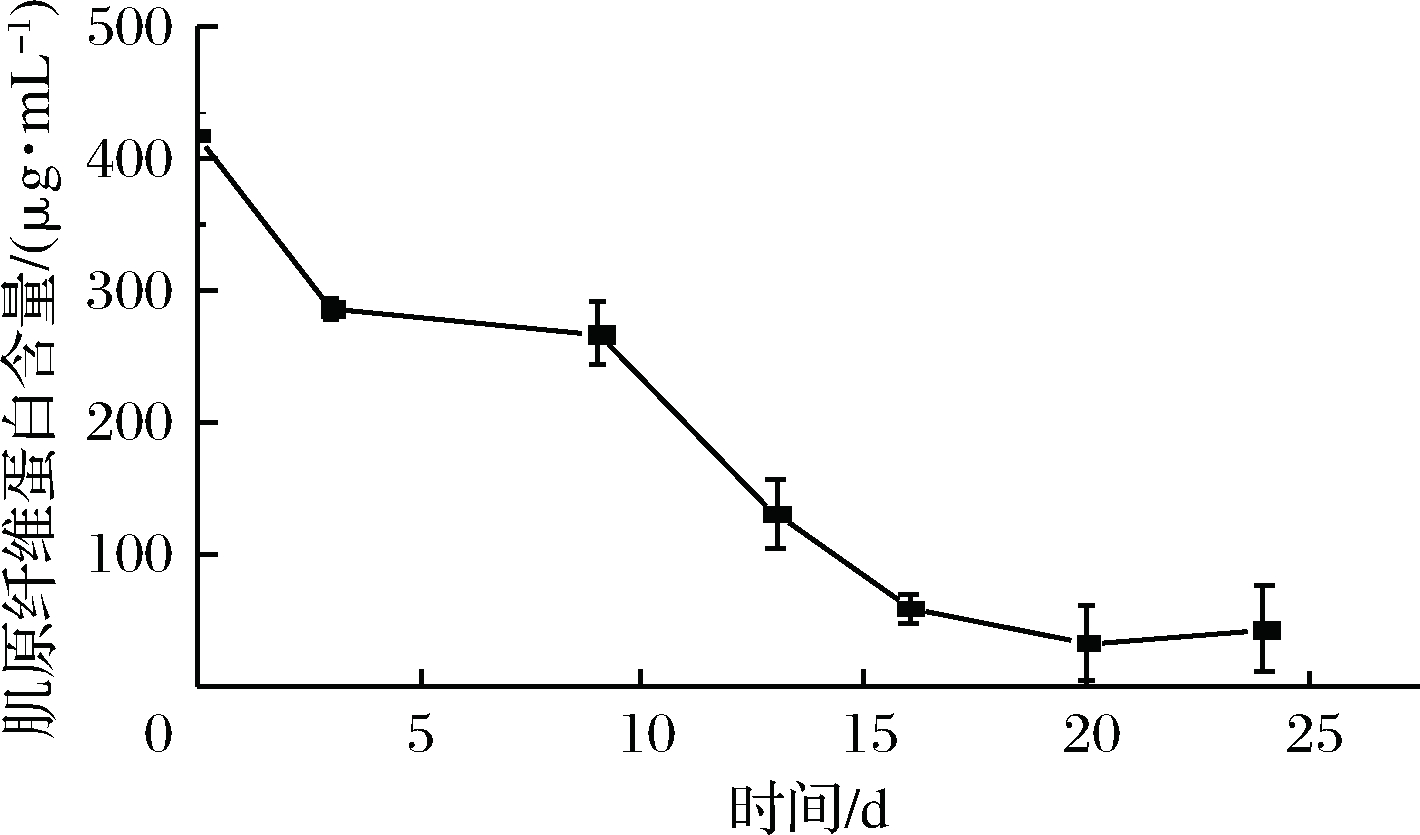
图8 虾仁在微冻贮藏过程中肌原纤维蛋白含量的变化
Fig.8 Changes of myofibrillar protein content in shrimpduring super-chilling storage
2.9 微观结构
虾仁的微观结构能够比较直观地反映肌肉组织细胞结构的完整性。虾仁通过光学显微镜观察到的肌肉组织纵向切面结构的变化如图9所示。第10天,新鲜虾仁的肌束呈纵向排列,肌纤维排列致密,肌节丰满,仅有少量间隙,肌内膜完整,没有出现肌原纤维断裂的情况,肌肉组织结构完整。到第9天,可明显地观察到虾仁肌肉细胞的完整性逐渐丧失,肌肉结构出现部分断裂。第10天的核磁成像图能够解释验证这一现象,在微冻条件下,虾仁的表面产生的冰晶冻层,破坏了细胞组织结构,造成了虾仁表面水分的流失。这一结果与DUY等[28-31]研究微冻三文鱼理论相一致。微冻条件下,冰晶首先在细胞间产生,当温度低于物料冰点时,细胞内的水也会结晶,细胞内外压力差过大,产生膨胀,会对细胞造成机械损伤。在贮藏后期,随着纤维结构不断地断裂和小片化,肌原纤维束间空隙逐渐增大,肌纤维结构更加稀疏。在腐败阶段(第24天),肌原纤维和细胞外基质中的结构蛋白以及肌原纤维连接至肌膜质的Z-盘相关结构被不断降解,肌原纤维的损伤更加严重,成碎片化状态,肌肉组织结构完整性完全丧失。

图9 虾仁在微冻贮藏过程中肌肉微观组织结构的变化
Fig.9 Changes of muscle microstructure in shrimpduring super-chilling storage
2.10 相关性分析
由表11可看出,各个指标之间存在着一定的相关性。虾仁的TVBN和K值等指标与菌落总数显著相关,表明微生物活动产生的腐败胺类物质是水产品腐败的重要原因。肌原纤维蛋白含量与持水力显著相关,表明随着肌原纤维蛋白含量与水分含量关系密切,肌原纤维蛋白降解导致虾仁组织结构被破坏,虾仁的持水力随之降低,造成严重的水分流失现象。
3 结论
本文通过对虾仁在微冻条件下的新鲜度、水分迁移、肌原纤维蛋白、微观结构等几个方面进行研究。结果表明,微冻能够明显抑制虾仁TVBN、K值、菌落总数的增长速度。在-3℃条件下,虾仁表面形成一层冻结层,抑制了微生物内IMP酶的活性,延缓了腐败胺类物质的产生速度。通过LF-NMR技术能够准确分辨虾仁在微冻条件下的水分迁移状态,横向弛豫时间T21 结合水的含量相对稳定,T22不易流动水含量先增加后减少,T23自由水的含量呈持续下降趋势。核磁成像水分质子密度图也能明显看出水分的分布状态,虾仁表面由于冰晶的影响水分最先流失,后期随着贮藏时间的延长,虾仁成像颜色逐渐变暗(接近底色蓝色),表明后期虾仁水分流失严重,持水力下降。从虾仁微观组织结构图直观地观察到,随着肌原纤维蛋白含量的降低,虾仁组织结构逐渐断裂,成碎片化,肌肉间隙增大,直至腐败变质。表明低场核磁共振,核磁成像和微观组织切片能够很好地观测到微冻条件下虾仁的品质变化情况,为虾仁微冻贮藏保鲜提供了一定的理论基础。
表11 南美白对虾流化冰贮藏各指标间相关性分析
Table 11 Correlation analysis between different indexes of shrimps under slurry ice storage
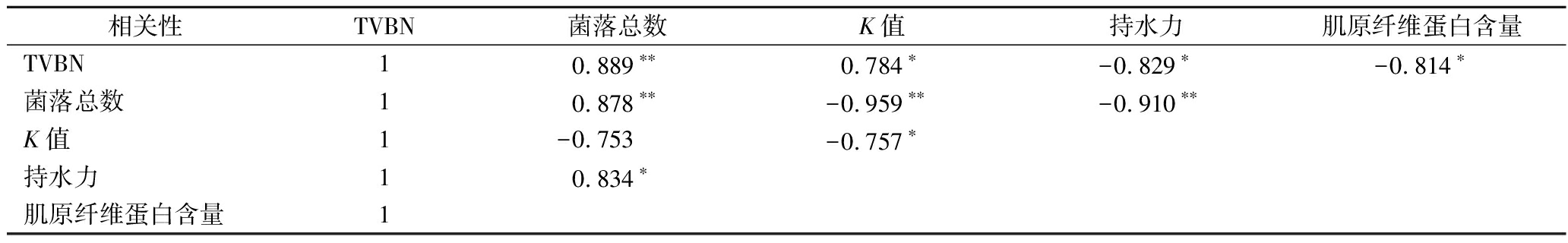
相关性TVBN菌落总数K值持水力肌原纤维蛋白含量TVBN10.889∗∗0.784∗-0.829∗-0.814∗菌落总数10.878∗∗-0.959∗∗-0.910∗∗K值1-0.753-0.757∗持水力10.834∗肌原纤维蛋白含量1
注: **表示在0.01 水平(双侧)上显著相关; *表示在 0.05 水平(双侧)上显著相关。
[1] ELIASSON S, ARASON S, MARGEIRSSON B, et al. The effects of superchilling on shelf-life and quality indicators of whole Atlantic cod and fillets[J].Food Science and Technology, 2019,100: 426-434.
[2] MAGNUSSEN O M.Advances in superchilling of food-Process characteristics and product quality[J]. Trends in Food Science & Technology, 2008, 19 (8): 418-424.
[3] KAALE L D.The development of ice crystals in food products during the superchilling process and following storage, a review[J]. Trends in Food Science & Technology, 2014, 39 (2): 91-103.
[4] 李卫东,陶妍,袁骐,等.南美白对虾在微冻保藏期间的鲜度变化[J].食品与发酵工业, 2008, 34 (11):48-52.
[5] 蔡青文,谢晶. 微冻保鲜技术研究进展[J].食品与机械, 2013,29(6):248-252.
[6] 阙婷婷,郑家闻,陈士国,等.微冻保鲜与冻藏保鲜对乌鳢品质的影响[J].中国食品学报,2015,15(6):136-147.
[7] GB/T4789.2—2016 食品安全国家标准——食品微生物学检验菌落总数测定[S]. 北京: 中国标准出版社,2017.
[8] LI Q, ZHANG L, LU H, et al. Comparison of postmortem changes in ATP-related compounds, protein degradation and endogenous enzyme activity of white muscle and dark muscle from common carp (Cyprinus carpio) stored at 4 ℃[J]. LWT - Food Science and Technology, 2017, 78:317-324.
[9] NIU L, RASCO B A, TANG J, et al. Relationship of changes in quality attributes and protein solubility of ground beef under pasteurization conditions[J]. LET-Food Science and Technology, 2015, 61(1):19-24.
[10] LAKSHMANAN R, PARKINSON J A, PIGGOTT J R. High-pressure processing and water-holding capacity of fresh and cold-smoked salmon (Salmo salar)[J]. LWT - Food Science and Technology, 2007, 40(3):544-551.
[11] CAO M,CAO A,WANG J, et al. Effect of magnetic nanoparticles plus microwave or far-infrared thawing on protein conformation changes and moisture migration of red seabream (Pagrus Major) fillets[J]. Food Chemistry, 2018, 266:498-507.
[12] LIU Jinjin,ZHU Kunkun,YE Ting,et al.Influence of konjac glucomannan on gelling properties and water state in egg white protein gel[J]. Food Research International, 2013, 51(2): 437-443.
[13] 王硕,谢晶,杨凯. 三文鱼冷链流通过程中质构、鲜度及感官品质变化规律与水分迁移相关性[J]. 中国食品学报, 2018,18(5):178-189.
[14] JIANG Qingqing, JIA Ru, NAKAZAWA N, et al. Changes in protein properties and tissue histology of tuna meat as affected by salting and subsequent freezing[J]. Food Chemistry, 2019,15(271):550-560.
[15] LIU D, LIANG L, XIA W, et al. Biochemical and physical changes of grass carp (Ctenopharyngodon idella) fillets stored at -3 and 0 ℃[J]. Food Chemistry, 2013, 140(1-2):105-114.
[16] DUNN A S, RUSTAD T. Quality changes during superchilled storage of cod (Gadus morhua) fillets[J]. Food Chemistry, 2007, 105(3):1 067-1 075.
[17] GB 2733—2015食品安全国家标准鲜、冻动物性水产品[S].北京:中国标准出版社,2015.
[18] LALITHA K V,SURENDRAN P K. Microbiological changes in farm reared freshwater prawn (Macrobrachium rosenbergii de Man) in ice[J].Food Control, 2006,17(10):802-807.
[19] ANDO M NAKAMURA H HARADA R,et al.Effect of super chilling storage on maintenance of freshness of kuruma prawn[J]. Food Science and Technology Research, 2004, 10 (1): 25-31.
[20] 吴依蒙,陈舜胜,今野久仁彦.牙鲆在保藏过程中影响ATP关联化合物降解的因素[J].水产学报,2016,40(7):1 114-1 122.
[21] PEARCE K L, ROSENVOLD K,ANDERSEN H J, et al.Water distribution and mobility in meat during the conversion of muscle to meat and ageing and the impacts on fresh meat quality attributes-A review[J]. Meat Science,2011, 89 (2): 111-124.
[22] QIN N, ZHANG L, ZHANG J, et al. Influence of lightly salting and sugaring on the quality and water distribution of grass carp (Ctenopharyngodon idellus) during super-chilled storage[J]. Journal of Food Engineering, 2017,215:104-112.
[23] MARCONE M F, WANG S, ALBABISH W, et al. Diverse food-based applications of nuclear magnetic resonance (NMR) technology[J]. Food Research International, 2013, 51(2):729-747.
[24] MIKLOS R, MORA-GALLEGO H, LARSEN F H, et al. Influence of lipid type on water and fat mobility in fermented sausages studied by low-field NMR[J]. Meat Science, 2014, 96(1):617-622.
[25] DUUN A S, RUSTAD T. Quality of superchilled vacuum packed Atlantic salmon (Salmo salar) fillets stored at -1.4 and -3.6 ℃[J]. Food Chemistry, 2008, 106(1):122-131.
[26] 李学鹏. 中国对虾冷藏过程中品质评价及新鲜度指示蛋白研究[D]. 杭州:浙江工商大学, 2012.
[27] LIM H K, HAARD N F. Proteins insolubilization in frozen Greenland halibut (Reinhardtius hippoglossoides) [J]. Journal of Food Science, 1984, 8:163-187.
[28] DUY B H N, ARASON S, THORARINSD HORARINSD- TTIR K A. Effects of dry ice and superchilling on the quality and shelf life of arctic charr (Salvelinus alpinus) fillets[J].International Journal of Food Engineering, 2007, 3 (3):1-29.
TTIR K A. Effects of dry ice and superchilling on the quality and shelf life of arctic charr (Salvelinus alpinus) fillets[J].International Journal of Food Engineering, 2007, 3 (3):1-29.
[29] 胡玥,杨水兵,余海霞,等.微冻保鲜方法对带鱼品质及组织结构的影响[J].食品科学.2016,37(18):290-297.
[30] 陈思名,郜佳雁,李宏吉,等. 微冻保鲜对南美白对虾品质的影响研究[J]. 食品研究与开发, 2014,35(3):100-103.
[31] BARROSVELAZQUEZ J, MIRANDA J M, LOSADA V, et al. Development of different damage pathways in Norway lobster (Nephrops norvegicus) stored under different chilling systems[J]. Journal of the Science of Food & Agriculture, 2010, 86(10):1 552-1 558.