瓦伦西亚烯及圆柚酮均属于倍半萜类化合物。瓦伦西亚烯分子式为C15H24,淡黄色澄清液体,具有甜橙油特征香气。一直是推动消费者偏好众多产品的关键因素,产品包括食品、饮料、香水个人护理和家人护理用品[1-2]。同时,瓦伦西亚烯也是生产圆柚酮的重要前体。圆柚酮,分子式C15H22O,它是葡萄柚和柑橘衍生的气味香气成分的主要贡献者,具有相对较低的香味阈值,通常在柑橘类冷榨油或精油中经提纯得到[3]。目前已被FDA和EPA批准,可以用于调配橙子、圆柚、热带水果等实用香精和烟用香精。因为圆柚酮具有很好的挥发性,并且它对人体无害,所以圆柚酮还被公认为环境友好型的杀虫剂[4-6]。故 2014年,CDC正式批准两家公司可以生产圆柚酮类杀虫剂。近年来研究发现圆柚酮不仅具有抑制癌细胞增生和抗血小板凝集的效果[7],还可以防止因空气污染引起的呼吸系统疾病[8]。
圆柚酮的生产方法主要有3种:植物提取法、化学合成法和生物催化转化法[7, 9]。萜类化合物在植物中的含量通常都很低,植物提取法对野生植物资源易造成严重破坏,且其作物的种植加工受到气候、环境、运输等诸多因素的影响,使得圆柚酮香料在产量、质量、价格方面存在不可控的变化,经济可行性较差。目前,工业上常常通过直接氧化价格相对便宜的前体物质瓦伦西亚烯来获得圆柚酮。但是,该反应过程通常涉及一些非环境友好的氧化剂,如三氧化铬等重金属盐类[10],相比之下,生物催化转化方法不受原料的限制、生产过程绿色清洁,具有很大的优势[11]。
综上所述,在微生物体内重构瓦伦西亚烯及其衍生物圆柚酮的生物合成途径,以获得高产瓦伦西亚烯及圆柚酮的菌株极具现实意义。2011年,CANKAR等在酿酒酵母WAT11中异源表达来源于黄扁柏的瓦伦西亚烯合成酶,获得1.36 mg/L的瓦伦西亚烯[12]。EMMERSTORFER等通过在酿酒酵母W303中异源表达圆柚酮生物合成途径中的几个关键酶,总萜产量达31 mg/L[13]。2018年,GUO等利用解酯耶式酵母作为宿主菌株,5 d后瓦伦西亚烯和圆柚酮的产量分别达22.8、0.98 mg/L[9]。基于酿酒酵母被公认为安全的模式生物,本研究在酿酒酵母PK2-1Ca中引入圆柚酮的生物合成途径,结合代谢工程策略,优化代谢通路,旨在进一步提高瓦伦西亚烯及其衍生物的产量,为利用酿酒酵母规模化生产瓦伦西亚烯及其衍生物奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 质粒和菌种
质粒和菌种如表1、表2所示,本实验用到的出发菌株包括购于英潍捷基的E.coli DH5(F-φ80 lacZ ΔM15 Δ(lacZYA-argF) U169 recA1 endA1 hsdR17 (rK-, mK+) phoA supE44 λ-thi-1 gyrA96 relA1),购于ATCC® MYA-1108TM的CEN.PK2-1Ca(MATa trp1-289 leu2-3 leu2-112 ura3-52 his3Δ1)及实验室保存的CEN.PK2-1Ca-M(MATa trp1-289 leu2-3 leu2-112 ura3-52 his3Δ1erg9::Δ-220—176 rox1::mut)。
表1 试验所用质粒
Table 1 Plasmids that used in this study

质粒描述来源YEp352-PGAL1-GFP-TCYC1YEp352 derived, containing PGAL1- GFP -TCYC1试验室保存YEp352-PGAL1-HPO-TCYC1YEp352 derived, containing PGAL1-HPO-TCYC1本研究构建YEp352-PGAL1-CnVO-TCYC1YEp352 derived, containing PGAL1-HPO-TCYC1本研究构建YEplac181 YEplac181空载试验室保存YEp181-PTEF1-TCYC1YEplac181 derived, containing PTEF1-TADH1试验室保存YEp181-PTDH3-TADH1YEplac181 derived, containing PTDH3-TADH1试验室保存p181-HPOYEplac181 derived, containing PGAL1-HPO-TCYC1本研究构建p181-mHPOYEplac181 derived, containing PGAL1-mHPO-TCYC1本研究构建p181-CnVOYEplac181 derived, containing PGAL1-CnVO-TCYC1本研究构建p181-CnVO-3YEplac181 derived, containing PGAL1-CnVO-3-TCYC1本研究构建p181-CnVO-4YEplac181 derived, containing PGAL1-CnVO-4-TCYC1本研究构建p181-CnVO-34YEplac181 derived, containing PGAL1-CnVO-34-TCYC1本研究构建p352-CPRYEp352 derived, containing PGAL1-AtCPR-TCYC1本研究构建p352-A1mHCYEp352 derived, containing PTDH3-ADH1-TADH1, PGAL1-mHPO-TCYC1 and PGAL1-AtCPR-TCYC1本研究构建p181-V1YEplac181 derived, containing PTDH3-VS-TADH1本研究构建p181-V2YEplac181 derived, containing PTEF1-VS-TADH1本研究构建p181-V1V2YEplac181 derived, containing PTDH3-VS-TADH1 and PTEF1-VS-TADH1本研究构建p181-V1HYEplac181 derived, containing PTDH3-VS-TADH1 and PTDH3-tHMG1-TADH1本研究构建p181-V2HYEplac181 derived, containing PTEF1-VS-TADH1 and PTDH3-tHMG1-TADH1本研究构建p181-V1HV2YEplac181 derived, containing PTEF1-VS-TADH1,PTDH3-tHMG1-TADH1 and PTEF1-VS-TADH1本研究构建
表2 试验所用菌株
Table 2 Strains that used in this study
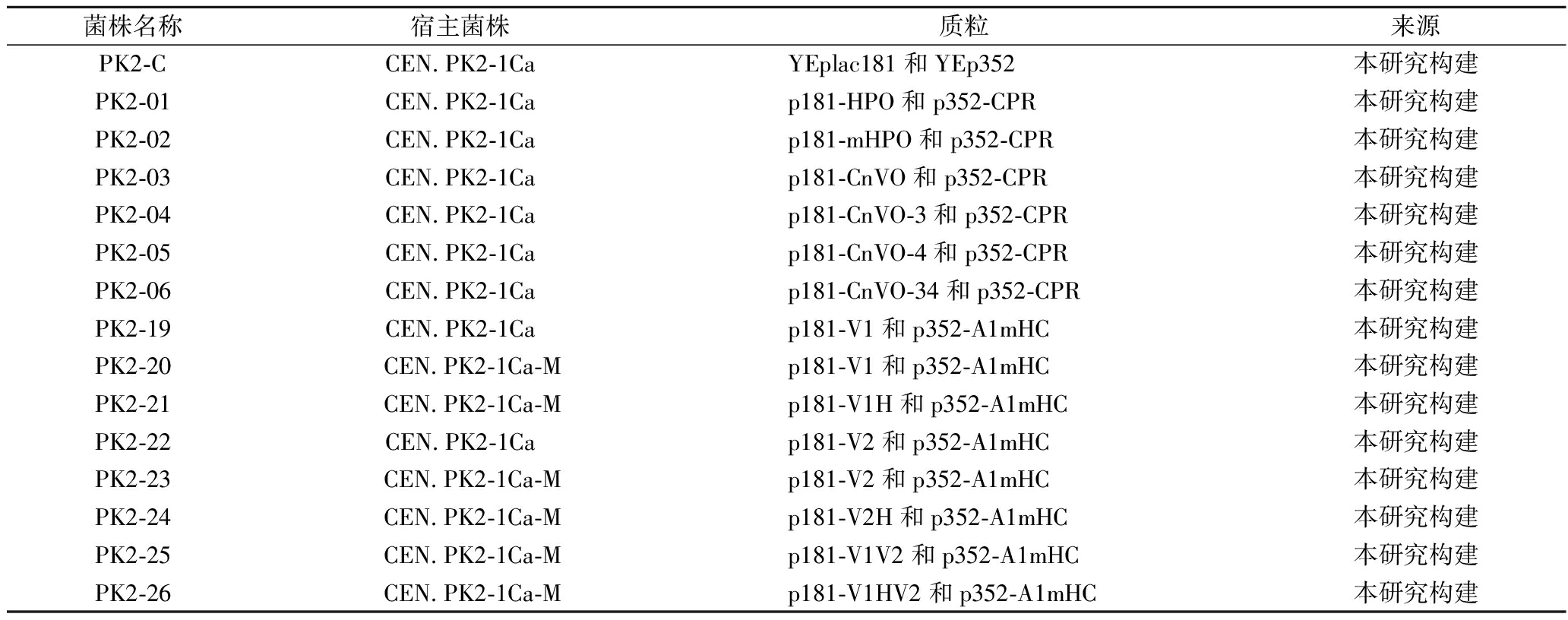
菌株名称宿主菌株质粒来源PK2-CCEN.PK2-1CaYEplac181和YEp352本研究构建PK2-01CEN.PK2-1Cap181-HPO和p352-CPR本研究构建PK2-02CEN.PK2-1Cap181-mHPO和p352-CPR本研究构建PK2-03CEN.PK2-1Cap181-CnVO和p352-CPR本研究构建PK2-04CEN.PK2-1Cap181-CnVO-3和p352-CPR本研究构建PK2-05CEN.PK2-1Cap181-CnVO-4和p352-CPR本研究构建PK2-06CEN.PK2-1Cap181-CnVO-34和p352-CPR本研究构建PK2-19CEN.PK2-1Cap181-V1和p352-A1mHC本研究构建PK2-20 CEN.PK2-1Ca-Mp181-V1和p352-A1mHC本研究构建PK2-21 CEN.PK2-1Ca-Mp181-V1H和p352-A1mHC本研究构建PK2-22CEN.PK2-1Cap181-V2和p352-A1mHC本研究构建PK2-23 CEN.PK2-1Ca-Mp181-V2和p352-A1mHC本研究构建PK2-24 CEN.PK2-1Ca-Mp181-V2H和p352-A1mHC本研究构建PK2-25 CEN.PK2-1Ca-Mp181-V1V2和p352-A1mHC本研究构建PK2-26 CEN.PK2-1Ca-Mp181-V1HV2和p352-A1mHC本研究构建
1.1.2 主要试剂
本文重组表达载体构建过程中所用到的各种限制性内切酶、DNA marker、2×PrimerSTAR Max Premix:Takara公司;2×DreamTaq Green PCR Master Mix:上海Thermo Fisher Scientific公司;T4 DNA ligase:NEB公司;KOD FX:日本TOYOBO公司;快速质粒小提试剂盒:天根(北京)股份有限公司;Cycle-Pure Kit:Omega股份有限公司;酵母转化试剂盒:英潍捷基;基因、引物合成及测序:由生工生物工程股份有限公司完成;瓦伦西亚烯、圆柚醇、圆柚酮标准品:上海梯希爱化成工业发展有限公司。
1.1.3 培养基
LB液体培养基(g/L):NaCl 5,酵母提取物5,蛋白胨10。LB/Amp+抗性培养基:以体积比1∶1 000加入氨苄青霉素(100 g/L)。YPD液体培养基(g/L):酵母提取物10,葡萄糖20,蛋白胨20。SD液体培养基(g/L):无水葡萄糖20,体积比1∶10加入10×酵母氮源(YNB)贮液和10×DO添加剂贮液。按需要添加相应的氨基酸。SG液体培养基(g/L):半乳糖20,体积比1∶10加入10×酵母氮源(YNB)贮液和10×DO添加剂贮液。根据需要按体积比1∶100添加相应的100×氨基酸贮液。固体培养基则在此基础上添加2%(质量分数)琼脂粉。
1.1.4 仪器与设备
PCR基因扩增仪,美国Bio-Rad公司;小型高速离心机,美国Thermo公司;UV-2100型分光光度计,UNICO公司;生化培养箱,上海精密科学仪器有限公司;恒温摇床,上海苏坤实业有限公司;超低温冰箱,美国Thermo公司;水平型电泳槽,上海天能科技有限公司;超微量分光光度计,美国GE Nano Vue公司。
1.2 试验方法
1.2.1 目的基因扩增
细胞色素P450单加氧酶HPO (Hyoscyamus muticus,GenBank:EF569601.1)、瓦伦西亚烯氧化酶CnVO(Callitropsis nootkatensis,GenBank:JX518290)、CYP450还原酶AtCPR (Arabidopsis thaliana, GenBank:NM_118585.3),瓦伦西亚烯合成酶CnVS(Callitropsis nootkatensis,GenBank:JX040471),由上海生工生物工程有限公司经密码子优化后合成。以公司合成的基因为扩增模板,用引物对HPO-U/D,CnVO-U/D,AtCPR-F/R,VS-U/D分别扩增出HPO,CnVO,AtCPR,CnVS四个基因片段,引入酶切位点Sma I、BamH I。以酵母基因组为模板,ADH1-U/D,tHMG1-U/D为扩增引物对,从酵母基因组扩增得到ADH1和tHMG1,试验所需引物如表3所示。
1.2.2 表达载体的构建
基于课题组前期构建好的表达载体YEp352-PGAL1-GFP-TCYC1,用BamH I和Sma I双酶切该载体和经PCR扩增得到的目的基因片段HPO、AtCPR、CnVO,经切胶回收,纯化,16 ℃过夜连接。转化至感受态细胞E.coli DH5中,成功构建3个表达载体。基于YEp352-PGAL1-HPO-TCYC1的成功构建,以YEp352-PGAL1-HPO-TCYC1为模板,GAL1-F1/ GAL1-R1为引物,PCR扩增出具有酶切位点EcoR I和Pst I的PGAL1-HPO-TCYC1基因表达盒,然后用EcoR I和Pst I对PGAL1-HPO-TCYC1基因片段及YEplac181空载进行双酶切。纯化后连接,构建YEp181-PGAL1-HPO-TCYC1的重组表达载体。同理可以构建YEp181-PGAL1-CnVO-TCYC1的重组表达载体。基于此,利用重叠延伸PCR技术构建了对应的4个突变体,分别为mHPO,CnVO-3,CnVO-4,CnVO-34。
表3 试验所用引物
Table 3 Primers used in this study

引物名称序列(5′-3′)GAL1-F1GTTACCGAATTCTTTACCGTCGACAGTACGGATTAGAAGCCGCCGAL1-R1GTTACCCTGCAGTTTACCCTCGAGGCAAATTAAAGCCTTCGAGCGTVS-UGTTACCGAGCTCGTTACCGGATCCATGGCTGAAATGTTCAACGGAVS-DGAGCGATCTAGAGAGCGACCCGGGTTAGGGAATAATCGGTTCGACCnVO-UGTTACCGGATCCATGGACATGTCAACGATATGGTCnVO-DGAGCGACCCGGGTTATTCATATAAGTTGGGATATAACAHPO-UGTTACCGGATCCATGCAGTTCTTCTCACTGGTTHPO-DGAGCGACCCGGGTTATTCACGGGAGGGTTGATAAtCPR-FGTTACCGAGCTCGTTACCGGATCCATGACTTCTGCCTTGTATGCCAtCPR-RGAGCGATCTAGAGAGCGACCCGGGTCACCAGACATCTCTCAAGTAtHMG1-UGTTACCGAGCTCGTTACCGGATCCATGGACCAATTGGTGAAAACTGAAtHMG1-DGAGCGATCTAGAGAGCGACCCGGGTTAGGATTTAATGCAGGTGACADH1-UGTTACCGAGCTCGTTACCGGATCCATGTCTATCCCAGAAACTCAAAADH1-DGAGCGATCTAGAGAGCGACCCGGGTTATTTAGAAGTGTCAACAACGTAHPO-482UMGAATTAGTTGGCATTACAATTGCCAGGAAATCCGAHPO-482DMTCGGATTTCCTGGCAATTGTAATGCCAACTAATTCCnVO-366UMTTGAGGTTGCACCCGCCTGTTCCCTTACTAGCTCCCnVO-366DMGGAGCTAGTAAGGGAACAGGCGGGTGCAACCTCAACnVO-477UMAACATGGATGAGTTAGTTGGGATTACAATACGTAAAGCGGTACCnVO-477DMGTACCGCTTTACGTATTGTAATCCCAACTAACTCATCCATGTTTTDH3-FGAGCGAGTCGACACAGTTTATTCCTGGCATCCADH1T-RTTTACACTCGAGCATAGGGTAGGGGAATTTCGA
注:下划线部分为酶切位点。
基于课题组前期构建好的表达载体YEp181-PTDH3-TADH1和YEp181-PTEF1-TCYC1,用BamH I和Sma I双酶切上述两载体及目的基因片段CnVS,16 ℃过夜连接,分别得到YEp181-PTDH3-VS-TADH1和YEp181-PTEF1-VS-TCYC1重组表达载体。同样的,得到YEp181-PTDH3- tHMG1-TADH1 和YEp181-PTDH3- ADH1-TADH1两个表达载体。最后利用Sal I,Xho I同尾酶的性质,运用biobrick的方法,实现多基因串联表达在同一表达载体上。
1.2.3 培养方法
将构建好的重组表达载体,利用酵母转化试剂盒转入相应的酵母感受态细胞中,得到重组酵母菌株。
静息细胞试验细胞培养方法:(1)接种:挑转化子接种于5 mL SD-(Leu-(Ura液体培养基中,培养22~24 h,OD600为1~3。(2)扩大培养:准备数个灭菌的250 mL的带挡板的摇瓶。每瓶分装50 mL SD-ΔLeu-ΔUra,接种种子液,使发酵初始OD600为0.1。30 ℃,200 r/min培养20~22 h,OD600为3.5~4.0。(3)诱导培养:1 060×g离心收集菌体,弃尽上清,50 mL SG-ΔLeu-ΔUra诱导培养基重悬菌体,30 ℃,200 r/min诱导8 h。(4)1 062×g离心,收集150 OD600单位的诱导后细胞,1 mL、50 mmol/L K3PO4溶液(pH 7.4)重悬,装至催化小瓶,添加20 μL、100 mmol/L瓦伦西亚烯(溶于DMSO且含1%(体积分数) Triton X-100),盖子旋松,30 ℃、200 r/min催化 18 h。(5)制样:加入1 mL乙酸乙酯,室温条件下用VXR basic Vibrax®最大转速振荡30 min、2 720×g离心15 min,待分层后取有机相,500 μL的有机相加入500 μL的乙酸乙酯,再加入2 μL、25 mmol/L的异长叶烯,少量无水硫酸钠,除去可能存在的水分,用0.22 μm无菌有机相滤头过滤到干净的气相色谱瓶中,-20 ℃保存。
原位发酵培养方法:(1)活化的平板在30 ℃恒温培养箱培养2~3 d。(2)接种:挑单菌落接种于5 mL的SD-ΔLeu-ΔUra液体培养基中,30 ℃,200 r/min培养22~24 h,OD600长到1~3。(3)将种子液分别接种于含10 mL SD-ΔLeu-ΔUra的50 mL小摇瓶中,每株菌做3个平行,起始OD600为0.05,30 ℃培养14~16 h,OD600长到1。(4)1 062×g离心收集菌体,10 mL SG-ΔLeu-ΔUra重悬,并加入2 mL的正十二烷覆盖。30 ℃、200 r/min培养48 h。(5)取发酵液上层有机相500 μL,加入500 μL的乙酸乙酯,再加入2 μL、25 mmol/L的异长叶烯作为内标,用0.22 μm无菌有机相滤头过滤到干净的气相色谱瓶中。
补料分批发酵方法:发酵罐条件,通气量1 vvm,DO>30%,温度30 ℃,搅拌转速200~500 r/min,2 mol/L NaOH自动控制pH=5.5。发酵方式为间歇补料发酵,每隔48 h补料1次,每次50 mL、20倍的SG储液。补料次数3次。
(1)一级种子液培养:从活化的平板上挑取单菌落接种到接种于5 mL的SD-ΔLeu-ΔUra液体培养基中,30 ℃,200 r/min培养22~24 h,OD600长到 1~3。
二级种子液培养:将一级种子液接种到含有50 mL SD-ΔLeu-ΔUra液体培养基的250 mL挡板摇瓶中,使起始OD600为0.1,30 ℃,200 r/min培养24 h,OD600为3~5。
(2)发酵罐接种:超净工作台中,用50 mL离心管收集菌体,常温1 060×g离心收集菌体,弃尽上清,并在超净工作台用50 mL SG-ΔLeu-ΔUra重悬菌体。然后接种至装有950 mL SG-ΔLeu-ΔUra的发酵罐中,起始OD600为0.3~0.5。并覆盖200 mL的正十二烷,开始发酵。
(3)每隔12 h取1次样,每次取样控制在3~5 mL,12 000 r/min离心5 min。取上层有机相制备气相样。方法同摇瓶制样。
1.2.4 GC-FID及GC-MS检测分析产物
GC-FID:检测产物用到的是Hewlett-Packard 5890 Ⅱ 气相色谱仪,色谱柱为5% Ph-Me硅氧烷柱,规格为10 m×0.10 mm×0.10 μm,检测器为氢火焰检测器(flame ionization detector,FID),设置的程序如下:1 μL样品分流进样,分流比30∶1,进样口温度250 ℃,检测器温度320 ℃,流速为0.4 mL/min,柱温100 ℃保持10 min,再以10℃/min升温至200 ℃,200 ℃保持8 min,总时间为28 min。打开仪器及软件,编好序列,将样品瓶按顺序放到样品盘中,进样。
GC-MS:本试验用到的是Hewlett-Packard 5890 Ⅱ 气相色谱仪,色谱柱为石英毛细管柱,规格为30 m×0.25 mm×0.25 μm,检测器为质量选择检测器(mass selective detectors,MSD)。程序同GC-FID程序。质量扫描的方式:选择离子扫描。质谱条件:电子轰击(EI)电离源,电子能量70 eV。
2 结果与分析
2.1 酿酒酵母重组载体的构建
2.1.1 单基因表达载体的构建
以公司合成的基因为模板,引物对HPO-U/D、CnVO-U/D、AtCPR-F/R、CnVS-U/D分别扩增出具有酶切位点的HPO、CnVO、AtCPR、CnVS四个基因片段,长度分别为1 509、1 512、2 079、1 770 bp。扩增得到的PCR产物经1%(质量分数)琼脂糖凝胶电泳验证均符合预期大小,结果如图1所示。
以YEp181-PGAL1-mHPO-TCYC1载体的构建为例,分别以GAL1-F1/HPO-482DM、HPO-482UM/GAL1-R1为扩增引物对,以YEp352-PGAL1-HPO-TCYC1为模板,扩增出上下游2个小的基因片段,大小分别为2 023和376 bp,将纯化后的两片段混合,使其互为模板和引物,然后加入dNTP及引物GAL1-F1/ GAL1-R1进行PCR扩增,得到已经定点突变的全长片段mHPO,长度为 2 364 bp,CnVO-3,CnVO-4和CnVO-34长度均为2 367 bp。然后利用限制性内切酶EcoR I和Pst I对该片段及载体YEplac181进行双酶切,将酶切后的载体与片段连接,得到YEp181-PGAL1-mHPO-TCYC1,同理得到YEp181-PGAL1-CnVO-3-TCYC1,YEp181-PGAL1-CnVO-4-TCYC1, YEp181-PGAL1-CnVO-34-TCYC1 3个重组表达载体。酶切验证如图2所示,大小符合预期,测序结果正确。
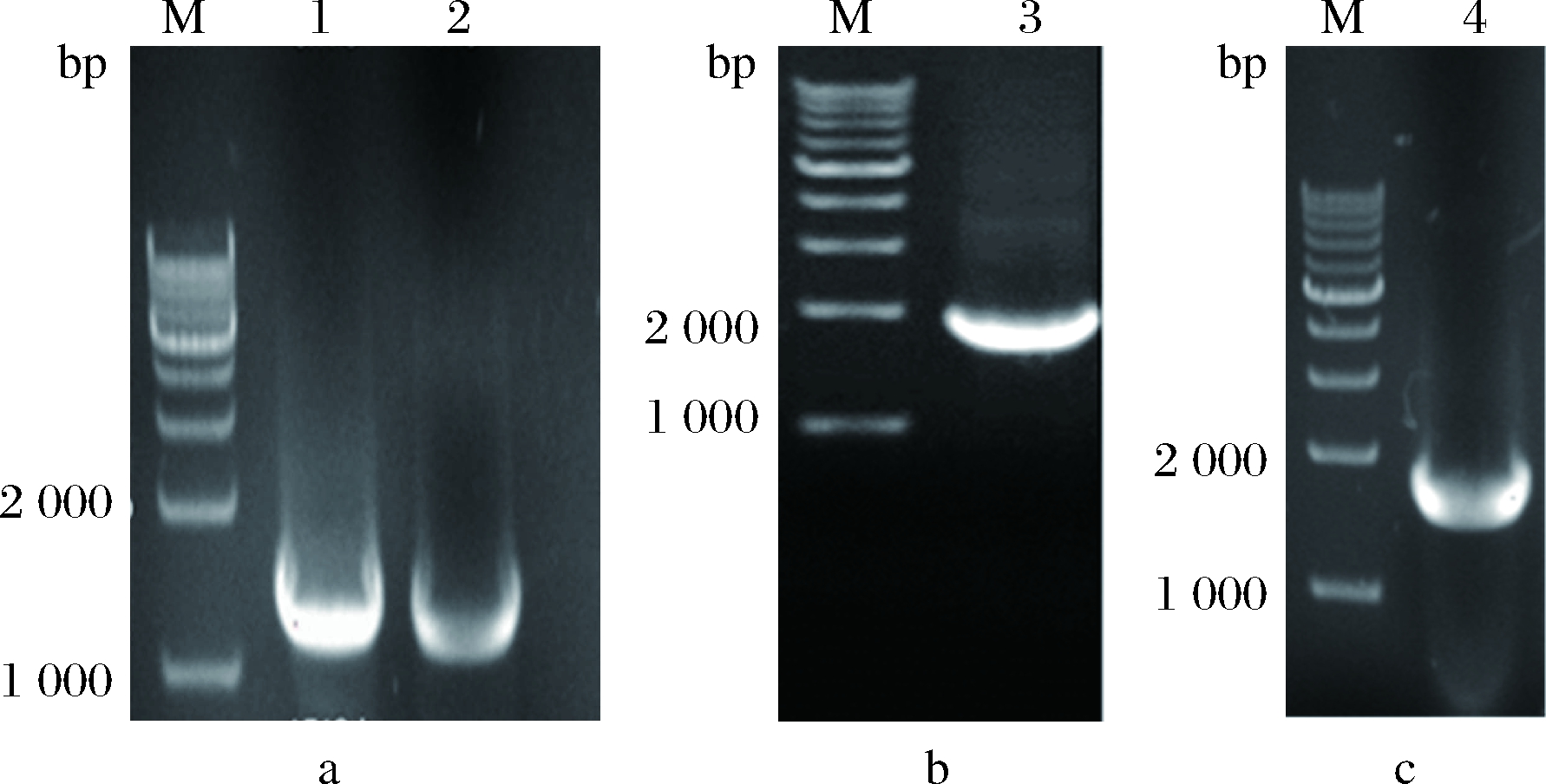
M-DL10 000 DNA marker;1-CnVO;2-HPO;3-AtCPR;4-CnVSa-CnVO和HPO的PCR产物;b-AtCPR的PCR产物;c-CnVS的PCR产物
图1 HPO,CnVO,AtCPR,CnVS四个基因片段琼脂糖凝胶电泳图
Fig.1 The agarose gel electrophoresis of HPO, CnVO,AtCPR, CnVS four gene fragments
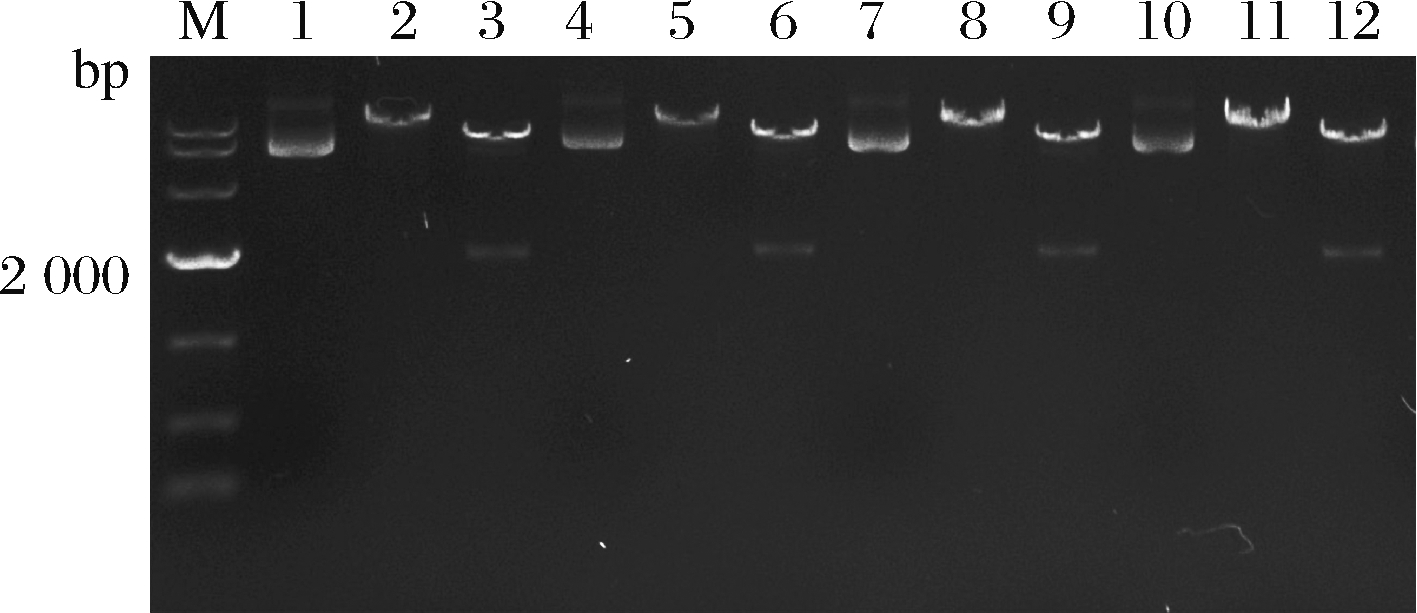
M-DL10 000 DNA Marker;1~3-YEp181-PGAL1-mHPO -TCYC1质粒,质粒单切,质粒双切;4~6-YEp181-PGAL1-CnVO-3 -TCYC1,质粒单切,质粒双切;7~9-YEp181-PGAL1-CnVO-4-TCYC1质粒,质粒单切,质粒双切;10~12-YEp181-PGAL1-CnVO-34 -TCYC1
图2 突变体酶切验证琼脂糖凝胶电泳图
Fig.2 The agarose gel electrophoresis of the mutantsenzyme digestion
用BamH I和Sma I双酶切YEp181-PTDH3-TADH1和YEp181-PTEF1-TCYC1及扩增得到的CnVS基因片段,连接转化获得YEp181-PTDH3-VS-TADH1和YEp181-PTEF1-VS-T CYC1重组表达载体。从NCBI上获得ADH1, tHMG1基因序列,以试剂盒提取的酿酒酵母PK2-1Ca的基因组为模板,引物对ADH1-U/D, tHMG1-U/D扩增出目的基因片段,经酶切连接转化,得到YEp181-PTDH3-ADH1-TADH1, YEp181-PTDH3- tHMG1-TADH1,上述载体酶切验证如图3所示,切下的目的片段大小分别为1 770,2 492,1 047和1 578 bp,大小符合预期。
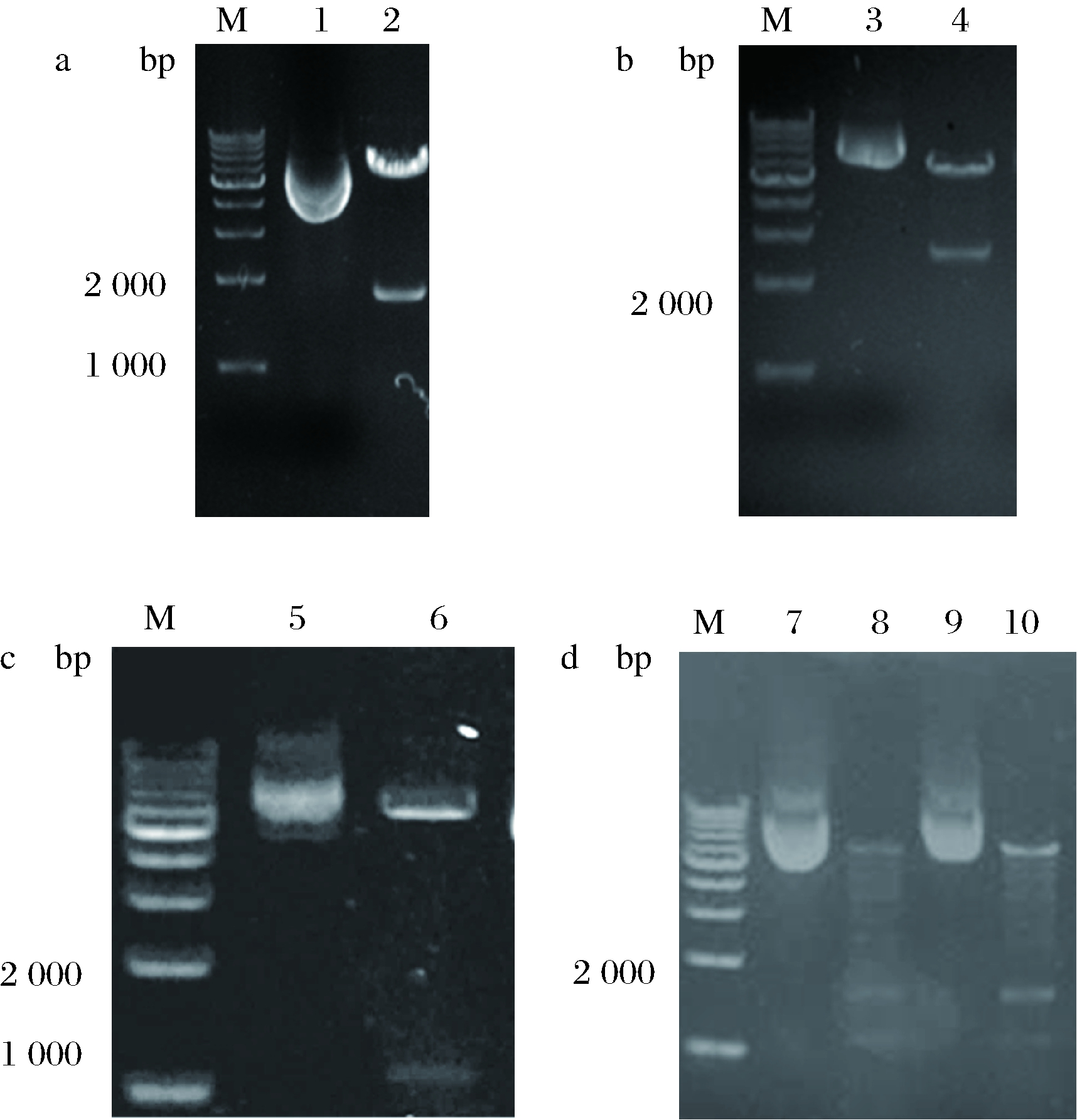
M-DL10000 DNA Marker;1~2-YEp181-PTDH3-VS-TADH1质粒,BamH I和Sma I双酶切;3~4 YEp181-PTEF1-VS -TCYC1质粒,EcoR I和Pst I双酶切;5~6-YEp181-PTDH3- ADH1-TADH1质粒,BamH I和Sma I双酶切;7~9-YEp181-PTDH3- tHMG1-TADH1质粒;8~10-YEp181-PTDH3- tHMG1-TADH1质粒BamH I和Sma I双酶切a-YEp181-PIDH3-VS-TADH1质粒;b-YEp181-PTEF1-VS-TCYC1质粒;c-YEP181-PTDH3-ADH-TADH1质粒;d-YEP181-PTDH3-tHMG1-TAOH1质粒
图3 质粒酶切验证琼脂糖凝胶电泳图
Fig.3 The agarose gel electrophoresis of plasmids enzyme digestion
2.1.2 多基因串联表达载体的构建
考虑到圆柚酮生物合成途径涉及的关键酶基因较多,本研究将多个基因串联表达在同一表达载体上,得到p181-V1H,p181-V2H,p181-V1V2,p181-V1HV2, p352-A1mHC 5个多基因重组表达载体。部分载体酶切验证结果如图4所示。

M-DL15000 DNA Marker;1、3-p352-A1mHC质粒;2、4-酶切(1 953、2 322、8 043bp); 5~7-p181-V1HV2原质粒,单切(13 498 bp),双切(2 661、10 837 bp)a-p552-AlmHC质粒;b-P181-V1HV2质粒
图4 p352-A1mHC质粒和p181-V1HV2质粒酶切验证琼脂糖凝胶电泳图
Fig.4 The agarose gel electrophoresis of enzyme digestionof p352-A1mHC and p181-V1HV2
2.2 CYP450的筛选
各重组菌株静息催化瓦伦西亚烯生成圆柚醇和圆柚酮的产量如图5所示。对照菌株PK2-C中没有检测到圆柚醇和圆柚酮。PK2-01检测到48.36 mg/L的圆柚醇和10.93 mg/L的圆柚酮,该菌株对底物瓦伦西亚烯的转化率可达10.73%。而之前报道称HPO不能在酿酒酵母细胞中转化瓦伦西亚烯生成圆柚酮[14]。故推测S. cerevisiae PK2-1Ca体内存在脱氢酶将中间产物圆柚醇转化生成了圆柚酮。显然,PK2-02中圆柚醇和圆柚酮的产量与PK2-01相比,没有明显的差别。之前文献报道突变体mHPO对瓦伦西亚烯的转化率提高了15倍[14],然而这是基于体外检测的结果。本试验的结果表明,在非生理条件下获得的酶动力学数据通常不符合代谢途径中体内酶动力学。如今开发了许多基于模拟各种生物细胞体内的条件测定酶动力学的方法[15]。此外对于CnVO及其对应的3个突变体(CnVO A366P/L377V、CnVO K477L/Y478V/V481T/L482I、CnVO A366P/L377V/K477L/Y478V/V481T/L482I)而言,圆柚醇和圆柚酮的产量较mHPO下降了10%~15%。故根据上述试验结果,选取mHPO作为后续试验的基础。
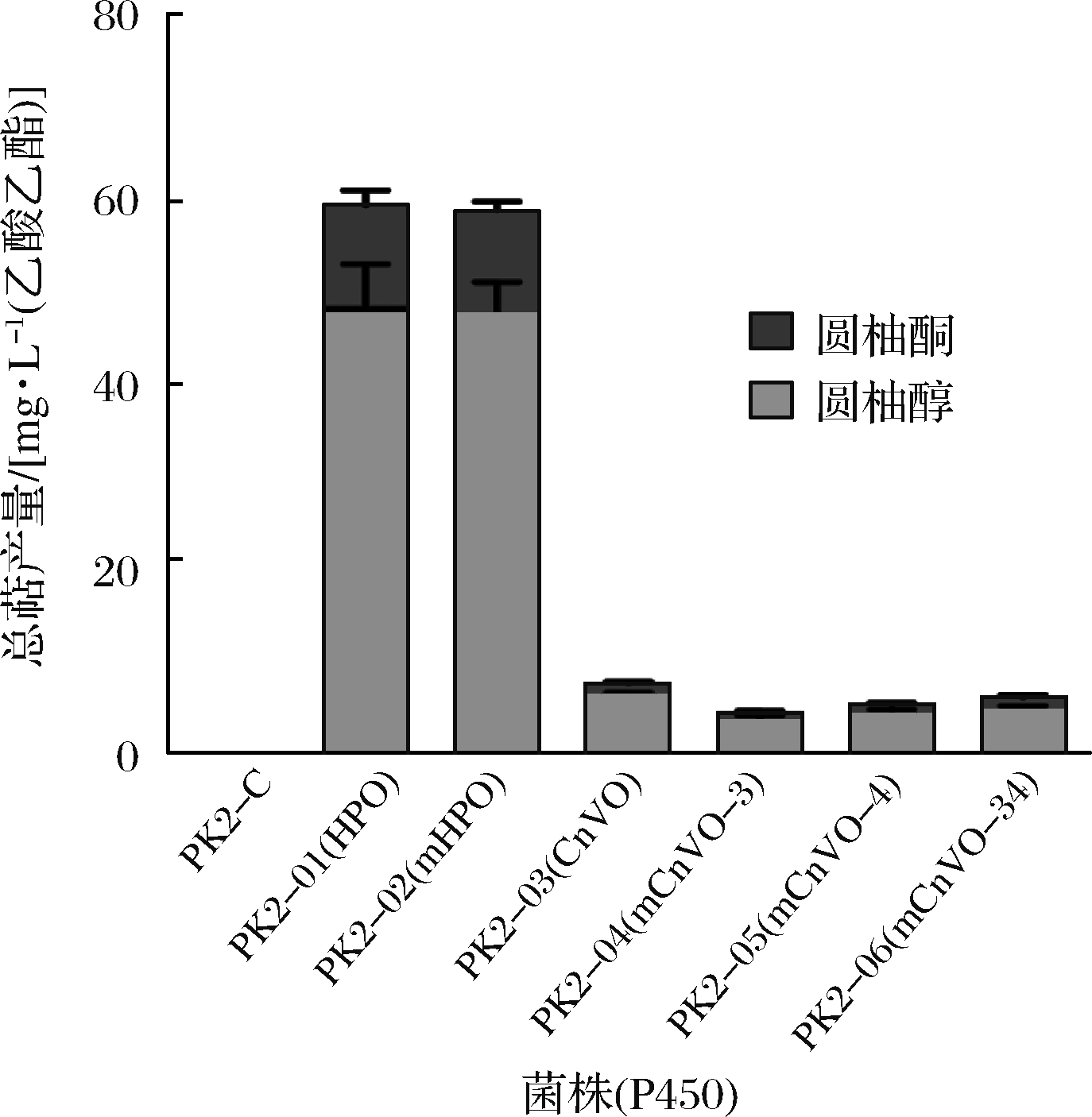
图5 不同菌株静息细胞试验圆柚醇和圆柚酮的产量
Fig.5 The yield of β-nootkatol and (+)-nootkatonein resting cell assays of different strains
2.3 重组酵母菌株产物产量分析
基于静息细胞试验筛选得到的P450氧化酶mHPO,构建了多株圆柚酮从头合成的重组酵母菌株。代谢途径如图6所示。
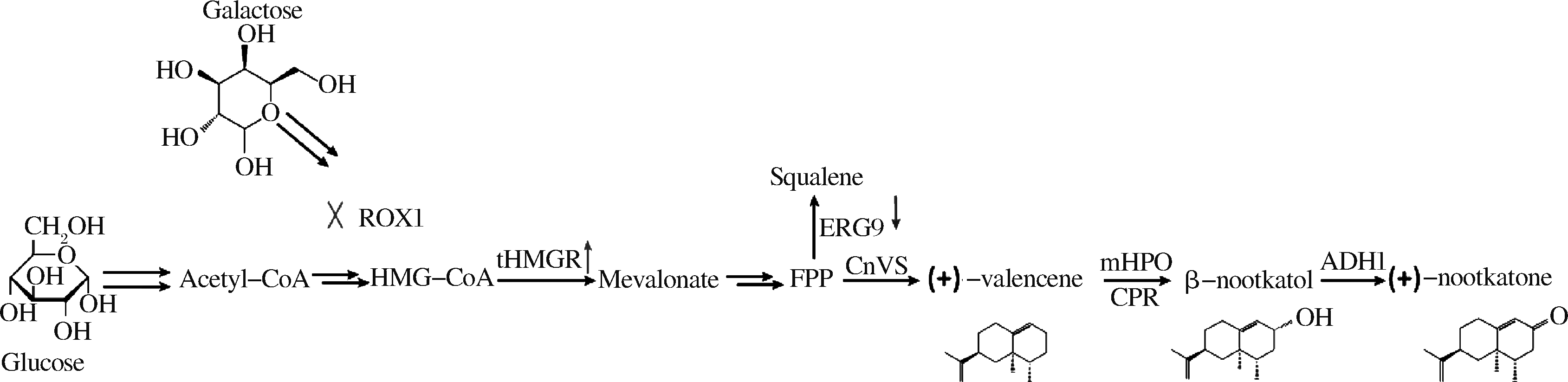
图6 酿酒酵母中圆柚酮的生物合成途径
Fig.6 The biosynthetic pathway of (+)-nootkatone in Saccharomyces cerevisiae
取各菌株发酵液的上层有机相制样,经GC-FID检测,各菌株产量如图7所示。(1)当宿主菌株为PK2-1Ca-M时,总萜产量相较于宿主菌株为野生型菌株PK2-1Ca时的2.79 mg/L,提高了3.92倍。故下调ERG9和敲除ROX1能够有效减少支流,促进法尼烯焦磷酸盐FPP的积累[16-18],从而增加瓦伦西亚烯和圆柚醇的产量。有文献报道,当宿主菌株为WAT11时,总萜产量仅为1.11 mg/L[19],研究表明,在酿酒酵母S. cerevisiae CEN.PK的菌株中,麦角固醇生物合成途径强于其他来源的菌株[20],比如S288c,这可能使得S. cerevisiae CEN.PK菌株体内法尼烯焦磷酸盐FPP的浓度比一般菌株要高,故总萜产量提高。(2)进一步过表达tHMG1,总萜产量提高了1.7倍,表明tHMG1在类异戊二烯合成途径中的关键地位[21-28]。(3)当CnVS的启动子由TDH3更换为TEF1时,总萜产量整体提高了2倍,达34.4 mg/L。说明启动子的适配性对目标产物的产量起着至关重要的作用[29-30],具体影响机制有待进一步研究。(4)增加CnVS的拷贝数时,PK2-26总萜产量显著下降至13.4 mg/L,即意味着增加CnVS的拷贝数不一定能增加产物瓦伦西亚烯的积累,曾有文献报道目的基因的拷贝数与目标产物的产量不一定呈正相关关系,即不是某目的基因拷贝数越高,相应的产物产量越高[31-32],LIAN等发现,当使用基于CEN/ARS的低拷贝数质粒时,纤维二糖利用途径表现出比高拷贝数质粒高得多的效率[33]。

图7 不同酵母工程菌株体内合成瓦伦西亚烯及圆柚醇的产量
Fig.7 The yield of (+)-valencene and β-nootkatolin vivo with different strains注:第一个“+、-”代表erg 9-rox为“+、-”;第二个“+、-”代表t HMG为“+、-”。
2.4 重组酵母菌株3L发酵罐发酵生产瓦伦西亚烯及其衍生物
根据摇瓶水平的结果,选定最佳组合菌株PK2-24,按照1.2.3中的方法,进行上罐发酵试验,希望进一步提高总萜的产量。如图8,在发酵的早期,消耗的半乳糖主要用于菌体的生长,瓦伦西亚烯和圆柚醇的积累比较缓慢,保持在较低的水平。48 h后,菌体生长进入平台期,但是产物的积累量仍不断提高,发酵158 h后,瓦伦西亚烯和圆柚醇的积累量分别达到264.6和46.3 mg/L。终OD600为6.8。可见重组酵母PK2-24生产总萜的能力(45.9 mg/L)是文献报道中毕赤酵母总萜的生产能力(0.7 mg/L)的65.6倍[7]。且是目前文献报道的酿酒酵母的最高产量(表4),说明该菌株已具备一定的生产优势。

图8 3L发酵罐中PK2-24菌株瓦伦西亚烯和圆柚醇的积累及菌株的生长曲线
Fig.8 The production of (+)-valencene and β-nootkanoland the growth curve of PK2-24 in a 3L fermentor
表4 酿酒酵母合成瓦伦西亚烯及其衍生物的比较
Table 4 Comparison of (+)-valencene and its related terpenoids production by recombinant Saccharomyces cerevisiae

宿主基因 (+)-valencene/(mg·L-1)β-nootkatol/(mg·L-1)(+)-nootkatone/(mg·L-1)总萜产量/(mg·L-1)参考文献S. cerevisiaeVSa1.36--1.36[12]WAT11VSa, P450 & CPRb0.150.920.041.11S. cerevisiaeW303VSa, P450 & CPRb, tHMG1, ICE21c30-31[13]S. cerevisiaeWAT11VSa, P4501.3050.1160.1441.565[34]S. cerevisiaeCEN.PK2-1CaVSa, P450/CPRb, ADH1, tHMG1, ΔROX1,down-regulated ERG9264.646.3-310.9本研究
注:a,来源于黄扁柏的瓦伦西亚烯合成酶;b,来源于拟南芥的细胞色素还原酶;c,从文献中的图片计算得到。
综上,重组酵母PK2-24上罐发酵过程中始终有大量的瓦伦西亚烯的积累,表明HPO和AtCPR的活性不足以将瓦伦西亚烯充分转化。无论是摇瓶水平还是发酵罐水平,工程菌株的终OD600 始终保持在 6.0~9.0的水平,菌体生物量偏低。遗憾的是,始终都没有检测到圆柚酮的生成,这与静息细胞试验不相符。其一可能是全细胞培养过程中,细胞内的其他代谢途径比较活跃,竞争中间体圆柚醇生成了其他副产物;其二可能由于有机相的覆盖,瓦伦西亚烯和圆柚醇被过早萃取至上层有机相,阻碍底物进出细胞,无法与酵母体内的酶充分接触;其三,生成的少量圆柚酮部分积累在细胞内膜上[35],没有充分释放到细胞外,故培养液中没有检测到圆柚酮。
3 结论
目前,利用微生物合成瓦伦西亚烯及其衍生物已见诸报道[7, 9, 11],但仍然面临着许多挑战,包括产量低,周期长,分离纯化困难等问题[36]。而酿酒酵母作为公认的食品安全微生物,具有其独特的优势。本文以酿酒酵母PK2-1Ca为宿主菌株,引入来源于植物的HPO、CnVO、CnVS及AtCPR,重构瓦伦西亚烯及其衍生物的生物合成途径。结合代谢工程策略,最终获得瓦伦西亚烯及其相关衍生物的高产重组酵母菌株,PK2-24,经3L发酵罐上进行补料分批发酵,瓦伦西亚烯及圆柚醇的产量分别达264.6和46.3 mg/L,为目前文献报道的最高产量,展现了酿酒酵母生产倍半萜类物质的应用前景。值得注意的是,试验中有大量的瓦伦西亚烯的积累,表明HPO和AtCPR的活性不足,与文献报道一致[13],故后续研究工作需进一步提高HPO和AtCPR的表达量及其稳定性或者挖掘更高效的CYP450,使瓦伦西亚烯充分转化。此外,还需提高菌体生长密度,促进产物积累及挖掘具有潜在应用价值的醇脱氢酶,最终获得终产物圆柚酮,为未来利用重组酿酒酵母规模化生产圆柚酮奠定基础。
[1] GIRHARD M, MACHIDA K, ITOH M, et al. Regioselective biooxidation of (+)-valencene by recombinant E. coli expressing CYP109B1 from Bacillus subtilis in a two-liquid-phase system[J]. Microb Cell Fact, 2009, 8(1): 36.
[2] BEEKWILDER J, VAN HOUWELINGEN A, CANKAR K, et al. Valencene synthase from the heartwood of Nootka cypress (Callitropsis nootkatensis) for biotechnological production of valencene[J]. Plant Biotechnol J, 2014, 12(2): 174-182.
[3] LEONHARDT R H, BERGER R G. Nootkatone[J]. Adv Biochem Eng Biotechnol, 2015, 148: 391-404.
[4] FURUSAWA M, HASHIMOTO T, NOMA Y, et al. Highly efficient production of nootkatone, the grapefruit aroma from valencene by biotransformation[J]. Chemical and Pharmaceutical Bulletin, 2006, 53(11): 1 513-1 514.
[5] HARING H G, RIJKENS F, BOELENS H, et al. Olfactory studies on enantiomeric eremophilane sesquiterpenoids[J]. Journal of Agricultural and Food Chemistry, 1972, 20(5): 1 018-1 021.
[6] ZHU B C R, HENDERSON G, SAUER A M, et al. Structure-activity of valencenoid derivatives and their repellence to the Formosan subterranean termite[J]. Journal of Chemical Ecology, 2003, 29(12): 2 695-2 701.
[7] WRIESSNEGGER T, AUGUSTIN P, ENGLEDER M, et al. Production of the sesquiterpenoid (+)-nootkatone by metabolic engineering of Pichia pastoris[J]. Metabolic Engineering, 2014, 24: 18-29.
[8] NEMMAR A, AL-SALAM S, BEEGAM S, et al.In vivo protective effects of nootkatone against particles-induced lung injury caused by diesel exhaust is mediated via the NF-κB pathway[J]. Nutrients, 2018, 10(3): 263.
[9] GUO X Y, SUN J, LI D, et al. Heterologous biosynthesis of (+)-nootkatone in unconventional yeast Yarrowia lipolytica[J]. Biochemical Engineering Journal, 2018, 137: 125-131.
[10] HONG B, LEBEUF R, DELBAERE S, et al. One-pot synthesis of (+)-nootkatone via dark singlet oxygenation of valencene: The triple role of the amphiphilic molybdate catalyst[J]. Catalysts, 2016, 6(12): 184-195.
[11] PALMER CARE O D M, RUTIAGA-QUI
O D M, RUTIAGA-QUI ONES O M, CALVO J R R V, et al. Screening of microorganisms for bioconversion of (+)-valencene to (+)-nootkatone[J]. LWT-Food Science and Technology, 2015, 64(2): 788-793.
ONES O M, CALVO J R R V, et al. Screening of microorganisms for bioconversion of (+)-valencene to (+)-nootkatone[J]. LWT-Food Science and Technology, 2015, 64(2): 788-793.
[12] CANKAR K, VAN HOUWELINGEN A, BOSCH D, et al. A chicory cytochrome P450 mono-oxygenase CYP71AV8 for the oxidation of (+)-valencene[J].FEBS Letter, 2011, 585(1): 178-182.
[13] EMMERSTORFER A, WIMMER-TEUBENBACHER M, WRIESSNEGGER T, et al. Over-expression of ICE2 stabilizes cytochrome P450 reductase in Saccharomyces cerevisiae and Pichia pastoris[J]. Biotechnol J, 2015, 10(4): 623-635.
[14] TAKAHASHI S, YEO Y S, ZHAO Y, et al. Functional characterization of premnaspirodiene oxygenase, a cytochrome P450 catalyzing regio- and stereo-specific hydroxylations of diverse sesquiterpene substrates[J]. Journal of Biological Chemistry, 2007, 282(43): 31 744-31 754.
[15] VAN EUNEN K, BAKKER B M. The importance and challenges of in vivo-like enzyme kinetics[J]. Perspectives in Science, 2014, 1(1): 126-130.
[16] HENRY K W, NICKELS J T, JOSEPH T, et al. ROX1 and ERG regulation in Saccharomyces cerevisiae: Implications for antifungal susceptibility[J]. Eukaryotic Cell, 2002, 1(6): 1 041-1 044.
[17] MONTA
 S F M, PASCUAL-AHUIR A, PROFT M. Repression of ergosterol biosynthesis is essential for stress resistance and is mediated by the Hog1 MAP kinase and the Mot3 and Rox1 transcription factors[J]. Mol Microbiol, 2011, 79(4): 1 008-1 023.
S F M, PASCUAL-AHUIR A, PROFT M. Repression of ergosterol biosynthesis is essential for stress resistance and is mediated by the Hog1 MAP kinase and the Mot3 and Rox1 transcription factors[J]. Mol Microbiol, 2011, 79(4): 1 008-1 023.
[18] SOUZA C M, SCHWABE T M E, PICHLER H, et al. A stable yeast strain efficiently producing cholesterol instead of ergosterol is functional for tryptophan uptake, but not weak organic acid resistance[J]. Metab Eng, 2011, 13(5): 555-569.
[19] SCHOLTMEIJER K, CANKAR K, BEEKWILDER J, et al. Production of (+)-valencene in the mushroom-forming fungus S. commune[J]. Appl Microbiol Biotechnol, 2014, 98(11): 5 059-5 068.
[20] URBAN P, MIGNOTTE C, KAZMAIER M, et al. Cloning, yeast expression, and characterization of the coupling of two distantly related Arabidopsis thaliana NADPH-cytochrome P450 reductases with P450 CYP73A5[J]. The Journal of Biological Chemistry, 1997, 272(31): 19 176-19 186.
[21] DING Mingzhu, YAN Huifang, LI Linfeng, et al. Biosynthesis of taxadiene in Saccharomyces cerevisiae: Selection of geranylgeranyl diphosphate synthase directed by a computer-aided docking strategy[J].. PLoS One, 2014, 9(10): e109 348.
[22] LI Qian, SUN Zhiqiang, LI Jing, et al. Enhancing beta-carotene production in Saccharomyces cerevisiae by metabolic engineering[J].. FEMS Microbiol Lett, 2013, 345(2): 94-101.
[23] FARHI M, MARHEVKA E, MASCI T, et al. Harnessing yeast subcellular compartments for the production of plant terpenoids[J]. Metab Eng, 2011, 13(5): 474-481.
[24] MA S M, GARCIA D E, REDDING-JOHANSON A M, et al. Optimization of a heterologous mevalonate pathway through the use of variant HMG-CoA reductases[J]. Metab Eng, 2011, 13(5): 588-597.
[25] XIE Wenping, LV Xiaomei, YE Lidan, et al. Construction of lycopene-overproducing Saccharomyces cerevisiae by combining directed evolution and metabolic engineering[J]. Metab Eng, 2015, 30: 69-78.
[26] SCALCINATI G, KNUF C, PARTOW S, et al. Dynamic control of gene expression in Saccharomyces cerevisiae engineered for the production of plant sesquitepene alpha-santalene in a fed-batch mode[J].. Metab Eng, 2012, 14(2): 91-103.
[27] ASADOLLAHI M A, MAURY J, SCHALK M, et al. Enhancement of farnesyl diphosphate pool as direct precursor of sesquiterpenes through metabolic engineering of the mevalonate pathway in Saccharomyces cerevisiae[J]. Biotechnol Bioeng, 2010, 106(1): 86-96.
[28] ENGELS B, DAHM P, JENNEWEIN S. Metabolic engineering of taxadiene biosynthesis in yeast as a first step towards Taxol (Paclitaxel) production[J]. Metab Eng, 2008, 3-4(10): 201-206.
[29] PARTOW S, SIEWERS V, JØRN S, et al. Characterization of different promoters for designing a new expression vector in Saccharomyces cerevisiae[J]. Yeast, 2010, 27(11): 955-964.
[30] XIONG L, ZENG Y, TANG R-Q, et al. Condition-specific promoter activities in Saccharomyces cerevisiae[J]. Microbial Cell Factories, 2018, 17(1): 58.
[31] LIAN J, MISHRA S, ZHAO H. Recent advances in metabolic engineering of Saccharomyces cerevisiae: New tools and their applications[J]. Metabolic Engineering, 2018, 50: 85-108.
[32] YAMADA R, TANAKA T, OGINO C, et al. Gene copy number and polyploidy on products formation in yeast[J]. Appl Microbiol Biotechnol, 2010, 88(4): 849-857.
[33] LIAN J, LI Y, HAMEDIRAD M,et al. Directed evolution of a cellodextrin transporter for improved biofuel production under anaerobic conditions in saccharomyces cerevisiae[J]. Biochemistry and Bioengineering, 2014,111(8):1 521-1 531.
[34] CANKAR K, VAN HOUWELINGEN A, GOEDBLOED M, et al. Valencene oxidase CYP706M1 from Alaska cedar (Callitropsis nootkatensis)[J]. FEBS Letters, 2014, 588(6): 1 001-1 007.
[35] GAVIRA C, H FER R, LESOT A, et al. Challenges and pitfalls of P450-dependent (+)-valencene bioconversion by Saccharomyces cerevisiae[J]. Metabolic Engineering, 2013, 18: 25-35.
FER R, LESOT A, et al. Challenges and pitfalls of P450-dependent (+)-valencene bioconversion by Saccharomyces cerevisiae[J]. Metabolic Engineering, 2013, 18: 25-35.
[36] KRIVORUCHKO A, NIELSEN J. Production of natural products through metabolic engineering of Saccharomyces cerevisiae[J]. Curr Opin Biotechnol, 2015, 35: 7-15.