美拉德反应是还原糖和氨基化合物如氨基酸、胺、肽和蛋白质之间的发生的复杂反应,广泛发生在食品加工与贮藏过程中,对加工食品风味物质的形成有重要贡献[1-6]。除了以模式反应体系研究美拉德反应途径和风味化合物形成机理外,众多研究者利用食品体系中本身存在的大量氨基酸、肽、蛋白质和蛋白水解物来制备各种风味的调味料,其中蛋白水解物是主要的氨基化合物来源[7-16]。在美拉德反应中,pH是影响反应的重要因素之一,不仅影响美拉德反应途径和反应效率,也会影响蛋白水解物的溶解性。另外,大部分的美拉德反应是在水系中完成的,反应所形成的美拉德反应产物(Maillard reaction products,MRPs)也主要应用于水系中,因此,蛋白水解物和MRPs在一定pH范围内必须具有良好的水溶解性。
在利用美拉德反应生产风味调味料时,蛋白水解物具有重要的作用,一是作为前体物质参与美拉德反应,形成风味物质,二是小肽和氨基酸作为风味增效剂,提供MRPs特有的滋味[17-22]。而游离氨基酸和肽中的氨基酸具有不同的美拉德反应活性[4],参与反应的氨基酸种类和数量不同,对MRPs风味的贡献也不同。
因此,本课题拟以牡蛎酶解液(oyster enzymatic hydrolysate,OEH)作为美拉德反应的氨基化合物,与葡萄糖进行美拉德反应,研究美拉德反应前后溶液溶解特性及氨基酸组成的变化,探讨美拉德反应中OEH中以不同形式存在的氨基酸的美拉德反应活性,为OEH和MRPs在食品工业中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
太平洋牡蛎(Crassostrea gigas):烟台振华量贩鲁东大学店;Protemax复合蛋白酶(酶活力 1.5 AU/g):诺维信忆诺联创生物科技(北京)有限公司;葡萄糖:天津市永大化学试剂有限公司;D-(+)-核糖、D-(+)-木糖:上海市蓝季生物有限公司;二甲基硅油:国药集团化学试剂有限公司。所用试剂均为分析纯。
1.2 仪器与设备
SH220石墨消解炉、K9840自动凯氏定氮仪、HD4020凯氏定氮滴定系统,济南海能仪器有限公司;DF-2集热式恒温磁力搅拌器(油浴锅),金坛市白塔金昌实验仪器厂;TDL-5-A离心机,上海安亭科学仪器厂;JJ-2B组织匀浆捣碎机,金坛市荣华仪器制造有限公司;PB-10普及型pH计,赛多利斯科学仪器(北京)有限公司。
1.3 方法
1.3.1 OEH的制备
按照刘海梅等[23]的方法,将复合蛋白酶按30 AU/kg的加酶量加入牡蛎肉匀浆(牡蛎肉与水按质量比1∶5混合捣碎)中,在自然pH下,于50 ℃下恒温酶解4 h,置于100 ℃沸水中灭酶15 min,酶解产物于5 000 r/min下离心15 min,所得上清液即为OEH。
1.3.2 粗蛋白含量的测定
采用GB/T 6432—2018[24]凯氏定氮法测定蛋白质含量。
1.3.3 MRPs的制备
按照刘海梅等[23]的方法,OEH中添加质量分数为8%的葡萄糖,在pH 7.0下,于110 ℃下加热90 min,冷却至室温,即为MRPs。
1.3.4 氮溶解指数(nitrogen solublility index,NSI)的测定
按照ADLER-NISSEN等[25]的方法,取一定量的样液,用1 mol/L的HCl或NaOH调节pH至所需pH,静置20 min后离心(4 000 r/min,20 min),测定上清液中总氮含量。按公式(1)计算,得到NSI值。
(1)
式中:N1,上清液中总氮量,g;N2,样液中总氮量,g。
1.3.5 三氯乙酸-氮溶解指数(trichloroacetic-nitrogen solublility index,TCA-NSI)的测定
按照谭斌等[26]的方法,取10 mL样液,与等体积的 20% TCA溶液混合,振荡均匀,静置 20 min,于4 000 r/min离心20 min,取上清液测定总氮量,则TCA-NSI值按公式(2)计算。
(2)
式中:N1,上清液中总氮量,g;N0,样液中总氮量,g。
1.3.6 游离氨基酸的制备
按照LAN等[6]的方法,20% TCA溶液与样液等体积混合振荡,沉淀肽或蛋白质,于室温下静置2 h,5 000 r/min下离心30 min,离心所得上清液即为游离氨基酸样液。
1.3.7 氨基酸组成的测定
样品用6 mol/L HCl或4.2 mol/L NaOH在110 ℃水解24 h,进样量20 μL,流速0.4 mL/min,在570、440 nm下用氨基酸自动分析仪测定氨基酸组成。
2 结果与分析
2.1 OEH的溶解特性分析
2.1.1 NSI测定
分别测定OEH在pH 3.5、4.0、4.5、5.0、6.0、7.0、8.0、9.0下的含氮量,计算NSI值,结果见图1。
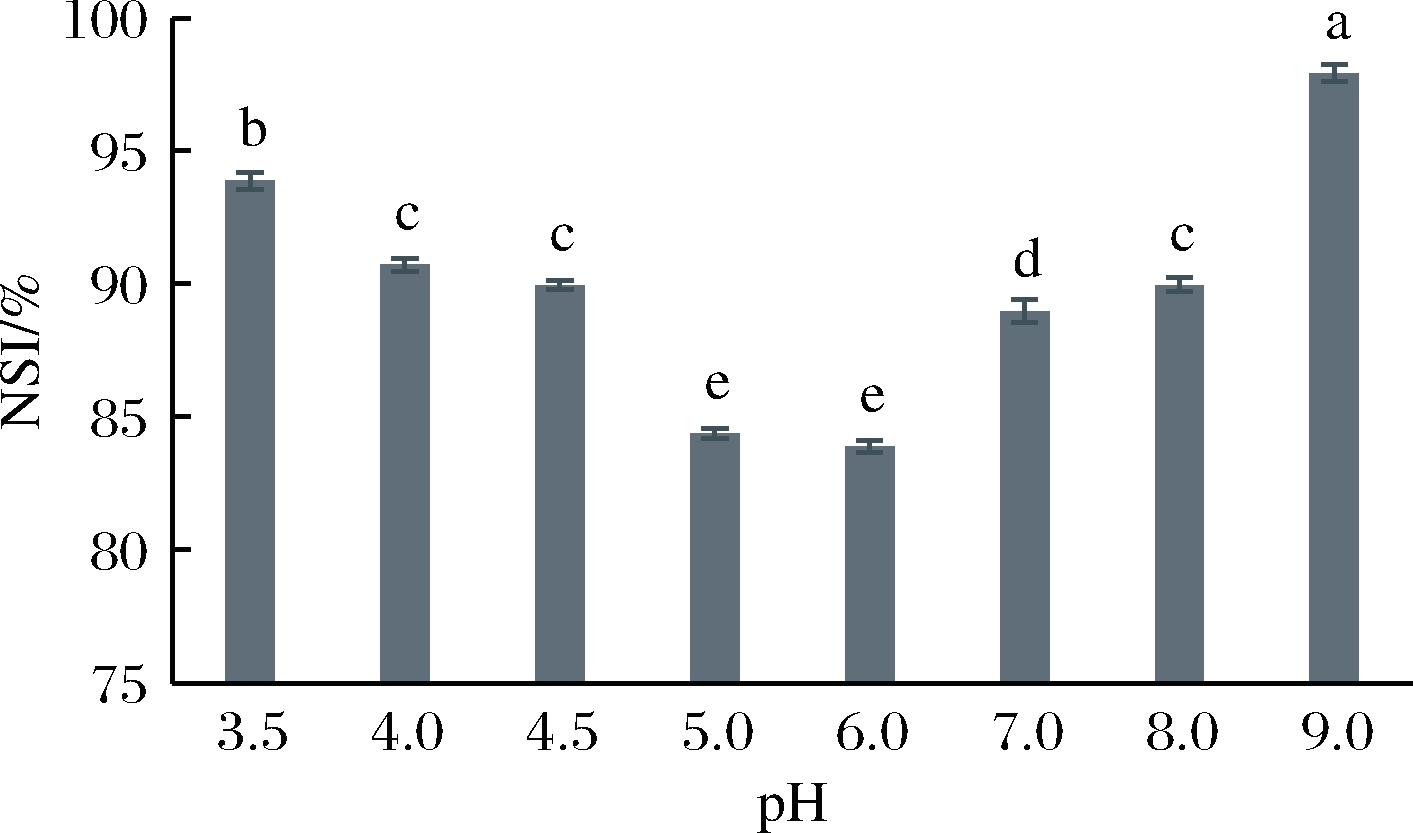
图1 不同pH下OEH的氮溶解指数
Fig.1 The nitrogen dissolution index of OEH in different pHs注:不同小写字母表示存在显著性差异(P<0.05)。下同
由图1可知,在不同pH下,OEH溶解性不同,NSI在pH 3.5~9.0呈先降低后增加又降低的趋势,在pH 5.0时达到最低值83.89%。牡蛎蛋白的等电点在pH 5.0附近[27],在pH 5.0时较低的NSI也表明此点是OEH的等电点,溶解度最小。在pH<等电点5.0时,pH值越小,NSI值越大,即其溶解度越大;pH>等电点5.0时,随着pH的升高其溶解度也显著增高(P<0.05),说明pH越远离等电点,OEH的溶解性越好。在食品pH 4.0~7.0,OEH的NSI值在83.89%~90.73%,OEH具有较高的溶解性,适宜在食品体系中添加使用。在所测pH范围内,NSI均>83.89%,也适宜应用于美拉德反应中。
2.1.2 TCA-NSI测定
测得OEH的TCA-NSI为86.40%,说明OEH中蛋白质主要以小分子肽和氨基酸的形式存在,但仍然存在13.6%的大分子肽。
2.2 MRPs的溶解特性分析
2.2.1 NSI测定
分别测定MRPs在pH 3.5、4.0、4.5、5.0、6.0、7.0、8.0、9.0下的含氮量,计算NSI值,结果见图2。
由图2可知,在等电点 5.0 附近,MRPs具有最小NSI值,为91.76%,此时溶解度最小。pH远离等电点时,NSI显著提高(P<0.05),pH值为9.0时,NSI为98.55%,达到最高值。在整个pH范围内,NSI在91.76%~98.55%,比OEH高出约10%。这说明OEH经美拉德反应后,溶解性显著变大(P<0.05),MRPs比OEH更适宜添加到食品体系中。
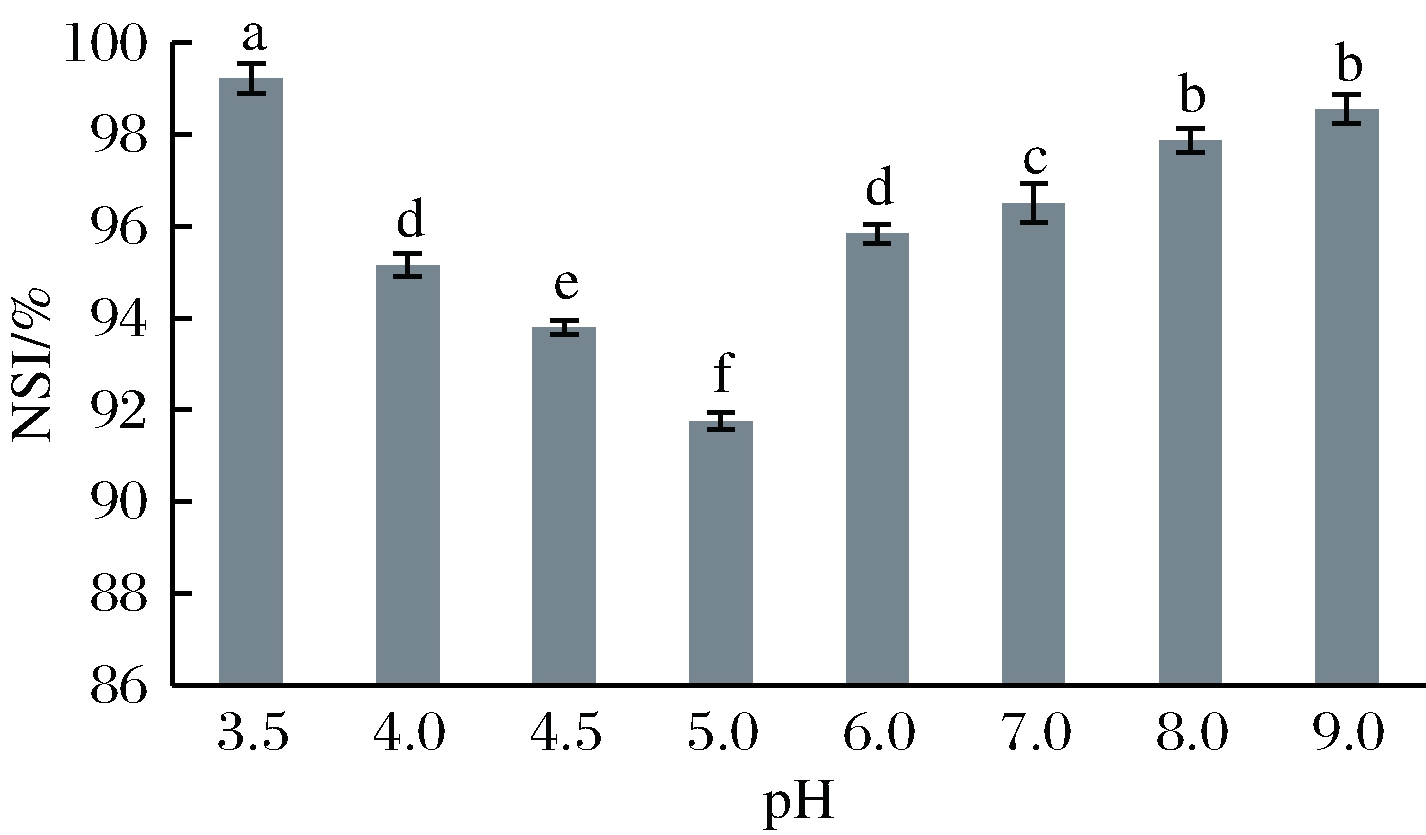
图2 不同pH下MRPs的氮溶解指数
Fig.2 The nitrogen solubility index of Maillard reactionproducts in different pHs
2.2.2 TCA-NSI测定
MRPs的TCA-NSI为94.73%,显著高于OEH(P<0.05),说明MRPs中大分子肽的含量少于OEH,MRPs中有94.73%蛋白质以游离氨基酸和小分子肽形式存在,仅有5.27%以大分子肽形式存在。对比OEH的TCA-NSI,MRPs的溶解性显著高于OEH的溶解性,可能与大分子肽的含量有关,大分子肽的溶解性易受pH的影响,当体系中电荷改变时,大分子肽会因静电相互作用发生聚集或排斥,改变其溶解性。
2.3 粗蛋白含量的分析
分别测定OEH、MRPs中的粗蛋白含量,结果见表1。
表1 粗蛋白含量
Table 1 Crude protein content
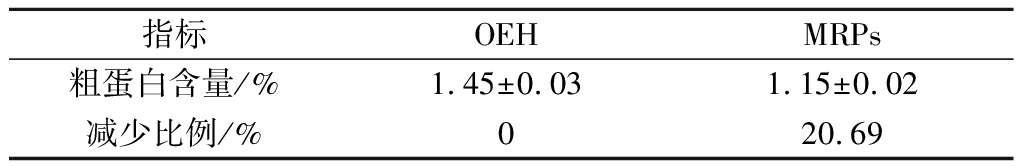
指标OEHMRPs粗蛋白含量/%1.45±0.031.15±0.02减少比例/%020.69
由表1可知,OEH的粗蛋白含量为1.45%,经美拉德反应后,MRPs中粗蛋白含量减少20.69%,可能是OEH中的肽、游离氨基酸参与美拉德反应[5-6,28-29],生成了大量含氮的挥发性化合物,从溶液中挥发出来,导致溶液中含氮量的减少,粗蛋白含量降低。
2.4 美拉德反应前后氨基酸组成变化
2.4.1 总氨基酸组成变化
在OEH和MRPs中氨基酸主要以游离氨基酸和小肽的形式存在,测定美拉德反应前后总氨基酸含量的变化,见表2。
表2 总氨基酸组成变化
Table 2 The change of total amino acids composition
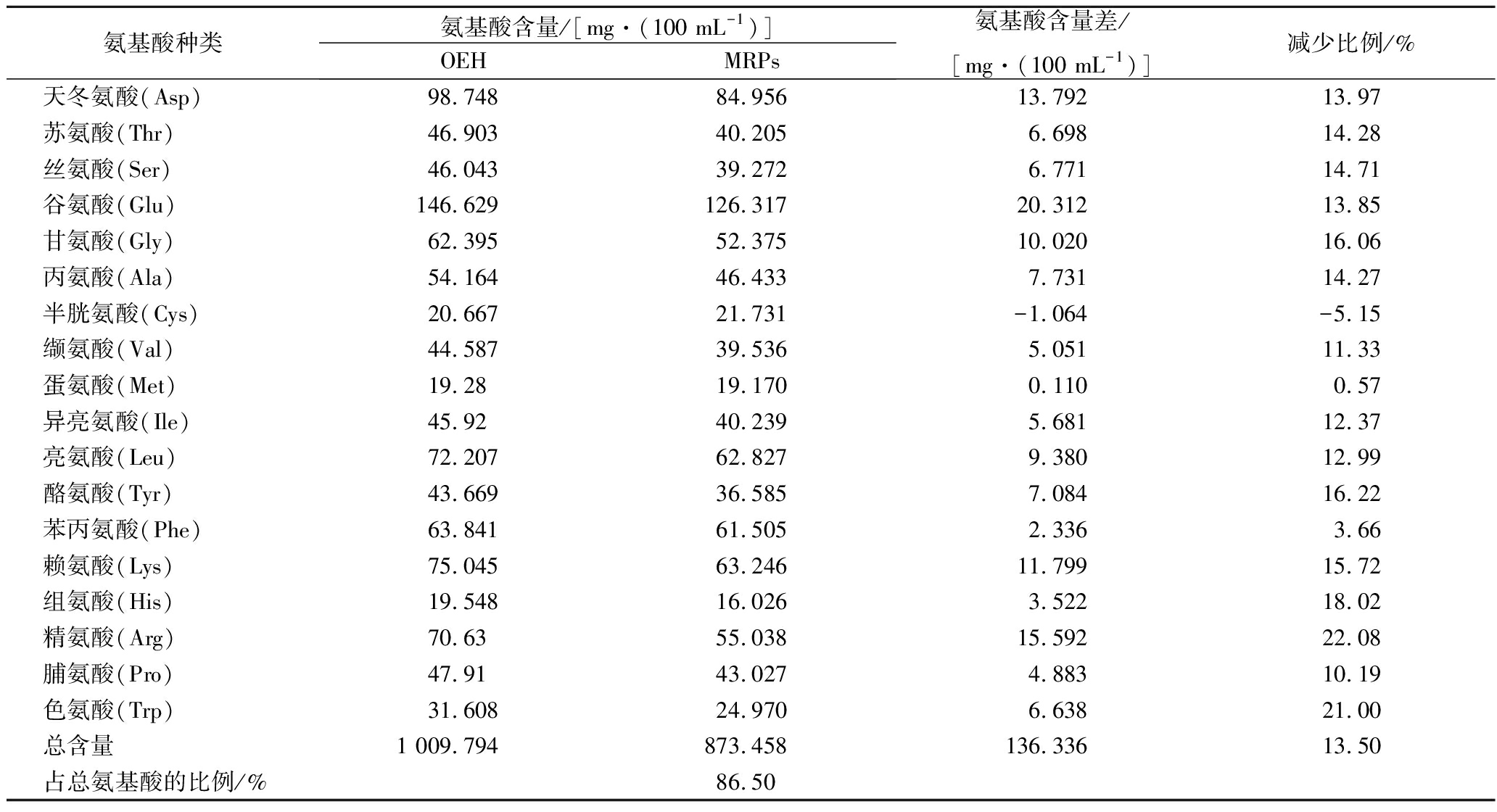
氨基酸种类氨基酸含量/[mg·(100 mL-1)]OEHMRPs氨基酸含量差/[mg·(100 mL-1)]减少比例/%天冬氨酸(Asp)98.74884.95613.79213.97苏氨酸(Thr)46.90340.2056.69814.28丝氨酸(Ser)46.04339.2726.77114.71谷氨酸(Glu)146.629126.31720.31213.85甘氨酸(Gly)62.39552.37510.02016.06丙氨酸(Ala)54.16446.4337.73114.27半胱氨酸(Cys)20.66721.731-1.064-5.15缬氨酸(Val)44.58739.5365.05111.33蛋氨酸(Met)19.2819.1700.1100.57异亮氨酸(Ile)45.9240.2395.68112.37亮氨酸(Leu)72.20762.8279.38012.99酪氨酸(Tyr)43.66936.5857.08416.22苯丙氨酸(Phe)63.84161.5052.3363.66赖氨酸(Lys)75.04563.24611.79915.72组氨酸(His)19.54816.0263.52218.02精氨酸(Arg)70.6355.03815.59222.08脯氨酸(Pro)47.9143.0274.88310.19色氨酸(Trp)31.60824.9706.63821.00总含量1 009.794873.458136.33613.50占总氨基酸的比例/%86.50
由表2可知,OEH与葡萄糖进行美拉德反应后,除Cys含量有少量增加外,其他氨基酸和总氨基酸含量均降低,与OEH相比,MRPs中总氨基酸含量降低了13.50%,这与粗蛋白含量的变化结果一致(表1),说明在美拉德反应过程中部分氨基酸作为美拉德前体物质参与了反应,引起其含量的降低。美拉德反应活性最高的是Arg,有22.08%参与了美拉德反应,其次为Trp,有21.00%参与了反应,His、Tyr、Gly、Lys、Thr、Ser、Ala等8种氨基酸参与美拉德反应比例15%~19%,Asp、Glu、Leu、Ile、Val、Pro等6种氨基酸参与美拉德反应的比例为10%~15%,而Phe、Met参与程度较低。由此可见,Arg、Trp、His、Tyr、Gly、Lys、Thr、Ser、Ala等10种氨基酸的美拉德反应较强,是参与美拉德反应的主要氨基酸组成。其中Arg、Trp、His这3种氨基酸为苦味氨基酸[20],它们的减少可以减弱美拉德反应产物的苦味。
2.4.2 游离氨基酸组成变化
由表3可知,经TCA沉淀后,OEH和MRPs中的氨基酸含量大幅度下降,分别减少了43.68%、41.19%,游离氨基酸含量分别占样液总氨基酸的56.32%、58.81%,说明总氨基酸中以游离氨基酸为主,肽含量次之。经美拉德反应后,游离氨基酸含量减少了55.033 mg/100 mL,减少比例达9.68%,低于总氨基酸的减少比例(13.50%)。美拉德反应产物中,游离氨基酸含量减少的现象与LAN等[6]的研究一致,他们发现木糖和大豆蛋白肽体系在不同温度下的美拉德反应过程中游离氨基酸总量均降低,且随温度的升高降低幅度不断增加。在总氨基酸(表2)中包含游离氨基酸和肽两部分,从游离氨基酸和总氨基酸的减少比例不同来看,说明肽和游离氨基酸均参与了美拉德反应,为美拉德反应的重要氨基化合物。游离氨基酸是美拉德反应的重要氨基化合物,小分子肽是美拉德反应的另一重要氨基化合物,赵谋明等[31]发现小分子寡肽具有较高的美拉德反应活性。
在所有游离氨基酸中,Val、Ala、Leu、Gly、His、Arg这6种氨基酸的美拉德反应活性较高,参与比例在15%以上,其中Val减少比例最高,达到25.83%;其次是Asp、Lys、Ile、Glu、Thr,参与比例在10%以上,低于10%的是Ser、Trp、Met和Phe这4种氨基酸。另外,Cys、Pro、Tyr含量出现增加的现象,具体机理有待进一步研究。可见,Val、Ala、Leu、Gly、His、Arg这6种氨基酸是参与美拉德反应的主要游离氨基酸种类。
表3 游离氨基酸组成变化
Table 3 The change of free amino acids composition
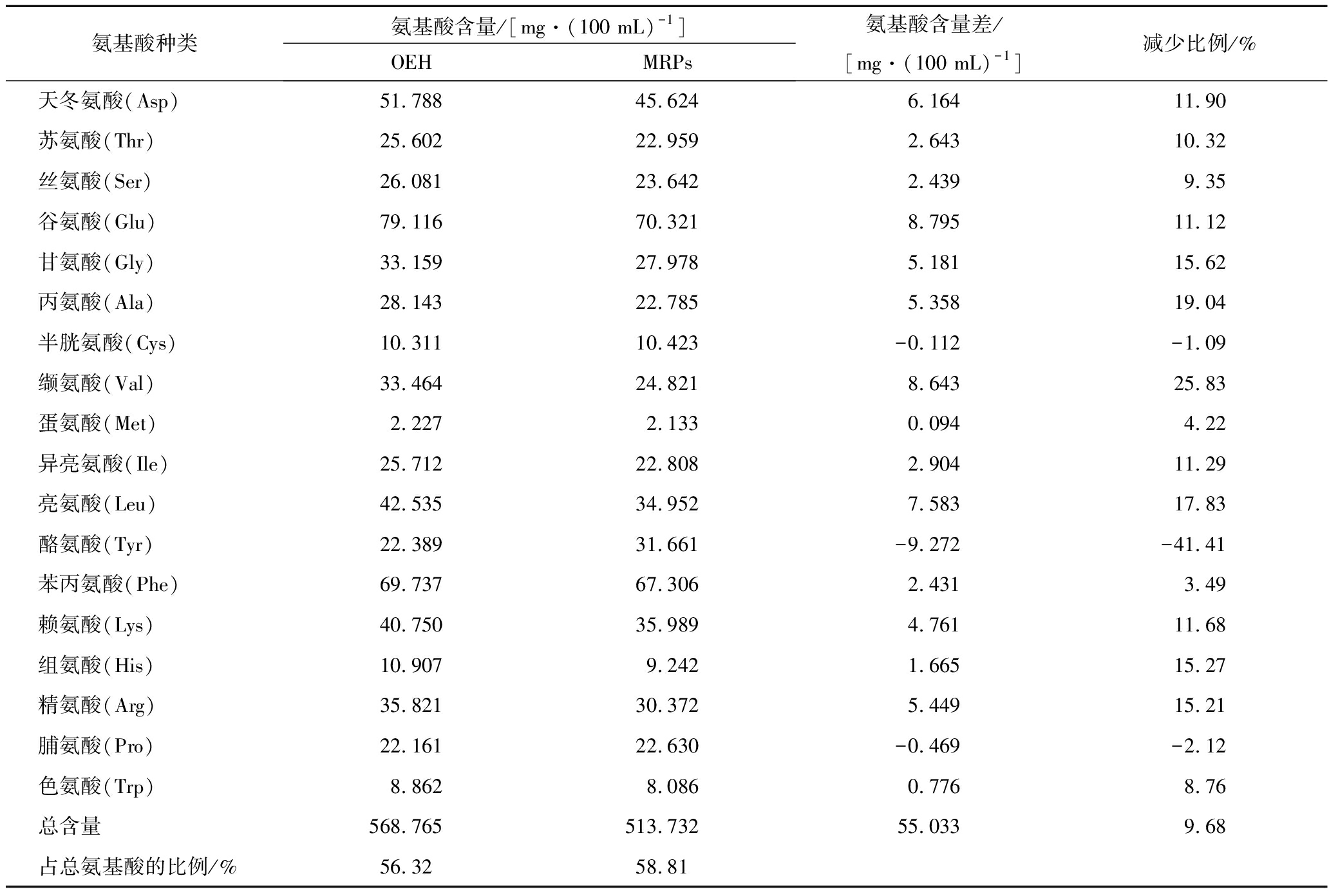
氨基酸种类氨基酸含量/[mg·(100 mL)-1]OEHMRPs氨基酸含量差/[mg·(100 mL)-1]减少比例/%天冬氨酸(Asp)51.78845.6246.16411.90苏氨酸(Thr)25.60222.9592.64310.32丝氨酸(Ser)26.08123.6422.4399.35谷氨酸(Glu)79.11670.3218.79511.12甘氨酸(Gly)33.15927.9785.18115.62丙氨酸(Ala)28.14322.7855.35819.04半胱氨酸(Cys)10.31110.423-0.112-1.09缬氨酸(Val)33.46424.8218.64325.83蛋氨酸(Met)2.2272.1330.0944.22异亮氨酸(Ile)25.71222.8082.90411.29亮氨酸(Leu)42.53534.9527.58317.83酪氨酸(Tyr)22.38931.661-9.272-41.41苯丙氨酸(Phe)69.73767.3062.4313.49赖氨酸(Lys)40.75035.9894.76111.68组氨酸(His)10.9079.2421.66515.27精氨酸(Arg)35.82130.3725.44915.21脯氨酸(Pro)22.16122.630-0.469-2.12色氨酸(Trp)8.8628.0860.7768.76总含量568.765513.73255.0339.68占总氨基酸的比例/%56.3258.81
2.4.3 肽组成变化
根据美拉德反应前后总氨基酸和游离氨基酸含量变化,计算反应前后以肽形式存在的氨基酸含量,结果见表4。
表4 肽中氨基酸组成变化
Table 4 The change of amino acids composition in peptides

氨基酸种类氨基酸含量/[mg·(100 mL)-1]OEHMRPs氨基酸含量差/[mg·(100 mL)-1]减少比例/%天冬氨酸(Asp)46.96039.3327.62816.24苏氨酸(Thr)21.30117.2464.05519.04丝氨酸(Ser)19.96215.6304.33221.70谷氨酸(Glu)67.51355.99611.51717.06甘氨酸(Gly)29.23624.3974.83916.55丙氨酸(Ala)26.02123.6482.3739.12半胱氨酸(Cys)10.35611.308-0.952-9.19缬氨酸(Val)11.12314.715-3.592-32.29蛋氨酸(Met)17.05317.0370.0160.09异亮氨酸(Ile)20.20817.4312.77713.74亮氨酸(Leu)29.67227.8751.7976.06酪氨酸(Tyr)21.2804.92416.35676.86苯丙氨酸(Phe)-5.896-5.801-0.0951.61赖氨酸(Lys)34.29527.2577.03820.52组氨酸(His)8.6416.7841.85721.49精氨酸(Arg)34.80924.66610.14329.14脯氨酸(Pro)25.74920.3975.35220.79色氨酸(Trp)22.74616.8845.86225.77总含量441.029359.72681.30318.43占总氨基酸的比例/%43.6841.19
由表4可知,OEH与MRPs中以肽形式存在的氨基酸分别占总氨基酸的比例为43.68%、41.19%,说明OEH和MRPs中以肽形式存在的氨基酸含量低于游离氨基酸的。OEH与葡萄糖进行美拉德反应后,以肽形式存在的氨基酸含量降低了18.43%,除了Cys、Val、Phe含量增加外,其他氨基酸含量均减少,说明在美拉德反应过程中,肽作为美拉德前体物质参与了美拉德反应,且以肽的形式参与美拉德反应的程度高于游离氨基酸的。不同分子质量肽具有不同的美拉德反应活性,寡肽的反应活性高于大分子多肽[29],LAN等[6]也认为分子质量低于1 000 Da的小肽比高分子量肽的美拉德反应活性强,当美拉德反应不断消耗游离氨基酸后,打破了肽和游离氨基酸之间的平衡,肽会向热降解方向进行,从而引发1 000 Da以下小肽的降解。另外,OEH-葡萄糖美拉德反应体系是在110 ℃的高温下进行的,LAN等[6]发现当温度高于100 ℃以后,5 000 Da以上分子质量肽会产生热降解反应,因此,此美拉德反应体系中,大分子质量肽也会在110 ℃的高温下发生热降解反应。这些肽降解方式,均会导致体系中游离氨基酸和寡肽或小分子肽的生成,从而给予美拉德反应充分的游离氨基酸和寡肽进行美拉德反应。
在所有以肽形式存在的氨基酸中,Tyr降低比例最高,为79.86%,是美拉德反应活性最高的氨基酸,其次是Arg、Trp、Ser、His、Pro、Lys6种氨基酸,降低比例20%~30%,Thr、Glu、Gly、Asp、Ile等5种氨基酸的降低比例在13%~20%,而Ala、Leu、Met降低比例在10%以下。而Cys和Val含量出现增加现象。在美拉德反应过程中,不仅会发生肽的热降解,游离氨基酸和大分子肽(分子质量1 000~5 000 Da和5 000 Da以上的)也会发生交联反应[6],两种氨基酸含量增加可能是由于游离氨基酸或肽交联形成更高分子量的新肽而引起的。在游离氨基酸(表3)中,Val含量降低幅度最大,减少了25.83%,而在肽(表4)中,Val含量的增加幅度最大,此现象也说明Val参与了肽的形成。Tyr在肽中含量降低幅度最大,而在游离氨基酸中其含量增加幅度最大,说明含Tyr的肽发生了热降解反应,生成了游离Tyr。Pro在肽中的含量下降了20.79%,而在游离氨基酸中含量增加了2.12%,也说明含Pro的肽发生了部分降解,生成了少量的游离Pro。
3 结论
OEH与葡萄糖发生美拉德反应后,所生成的MRPs溶解特性和氨基酸组成发生了明显的变化。MRPs的溶解特性远远高于OEH,OEH的NSI值在85.43%~88.54%,TCA-NSI值为86.40%,而MRPs的NSI值在95.15%~98.08%,TCA-NSI值为94.73%,在美拉德反应过程中,大分子肽发生了热降解,形成了含有94.73%游离氨基酸和小分子肽的蛋白质存在形式。OEH中的游离氨基酸和小分子肽均参与了美拉德反应,但是它们的美拉德反应活性不同,小分子肽的美拉德反应活性高于游离氨基酸的,且以不同形式存在的氨基酸参与美拉德反应的主要氨基酸种类存在差异。在OEH-葡萄糖的美拉德反应过程中,不仅发生了大分子肽的热降解,同时也形成了新的肽。
[1] AMES J M. Applications of the Maillard food industry[J]. Food Chemistry, 1998, 62(4): 431-439.
[2] VAN BOEKEL M A J S. Formation of flavour compounds in the Maillard reaction[J]. Biotechnology Advances, 2006, 24(2): 230-233.
[3] CALKINS C R, HODGEN J M. A fresh look at meat flavor[J]. Meat Science, 2007, 77(1): 63-80.
[4] XU Q, LIU J, SONG H, et al. Formation mechanism of volatile and non-volatile compounds in peptide-xylose Maillard reaction[J]. Food Research International, 2013, 54(1): 683-690.
[5] LIU J, LIU M, HE C, et al. Effect of thermal treatment on the flavor generation from Maillard reaction of xylose and chicken peptide[J]. LWT-Food Science and Technology, 2015, 64(1): 316-325.
[6] LAN X, LIU P, XIA S, et al. Temperature effect on the non-volatile compounds of Maillard reaction products derived from xylose-soybean peptide system: Further insights into thermal degradation and cross-linking[J]. Food Chemistry, 2010, 120(4): 967-972.
[7] 叶梦迪,唐宏刚,陈黎洪,等. 美拉德反应型蟹味香精制备条件优化及挥发性风味成分分析[J]. 食品工业科技, 2016, 37(24): 309-314.
[8] KARANGWA E. 基于葵花籽蛋白水解物美拉德反应产物制备的风味增强剂及其感官特性和抗氧化活性[D]. 无锡:江南大学, 2015.
[9] 吕广英. 白鲢鱼骨酶解浓汤的制备及风味增强技术研究[D].武汉:华中农业大学, 2012.
[10] 綦艳梅,孙金沅,陈海涛,等. 美拉德反应制备酱牛肉香精的挥发性成分分析[J]. 食品科学, 2012, 33(8): 199-202.
[11] 朱新鹏,姚敏,李美. 美拉德反应制备蛋糕香精及成分分析[J]. 食品工业科技, 2012, 33(2): 362-365.
[12] 解万翠,杨锡洪,陈昊林,等. 固相美拉德反应增香法制备虾风味料工艺及SPME-GC-MS测定[J]. 食品科学, 2010, 31(24): 199-205.
[13] 张陆霞,管于平,姜玮,等. 鳕鱼排蛋白水解及其营养风味型美拉德反应产物的制备[J]. 食品与发酵工业, 2010, 36(10): 70-74.
[14] 杨二刚. 酶解鸡肉制备热反应天然鸡肉香精的研究[D].无锡:江南大学, 2008.
[15] 宋焕禄,廖国洪. 鸡肉酶解物/酵母抽提取物-Maillard反应产生肉香味化合物的研究[J]. 食品科学, 2001, 22(10): 83-85.
[16] 刘通讯,李媛,王永江,等. 酶法水解鲢鱼蛋白及其水解液合成酱类香味料的研究[J]. 食品工业科技, 2004, 25(9): 86-88.
[17] AASLYNG M D, MARTENS M, POLL L, et al. Chemical and sensory characterization of hydrolyzed vegetable protein, a savory flavoring[J]. Journal of Agricultural and Food Chemistry, 1998, 46(2): 481-489.
[18] 张铭霞,陈思羽,李露,等. 食品中呈味肽类组分研究进展[J]. 中国食品学报, 2016,16(2): 209-217.
[19] 廖兰,赵谋明,崔春. 肽与氨基酸对食品滋味贡献的研究进展[J]. 食品与发酵工业, 2009, 35(12): 107-113.
[20] 张梅秀,王锡昌,刘源. 食品中的呈味肽及其呈味机理研究进展[J]. 食品科学, 2012, 33(7): 320-326.
[21] 吴婕,穆利霞,林光月,等. 呈味肽的制备及稳态化研究进展[J]. 农产品加工, 2016, (2): 62-64;68.
[22] 王丽华,王金鹏,金征宇,等. 呈味肽的风味及调控[J]. 食品与发酵工业, 2014, 40(6): 104-109.
[23] 刘海梅,安孝宇,陈静,等. 牡蛎酶解液美拉德反应体系优化及产物营养评价[J]. 食品科学, 2017, 38(16): 178-182.
[24] GB/T 6432—2018 饲料中粗蛋白的测定凯氏定氮法[S]. 北京:中国标准出版社, 2018.
[25] ADLER-NISSEN J. Enzymatic Hydrolysis of Food Proteins[M]. New York:Elseviers Applied Science Publishers, 1986.
[26] 谭斌,曾凡坤,吴永娴. 花生肽的酶法生产工艺研究[J]. 食品与机械, 2000(3): 14-17.
[27] 张晶晶. 牡蛎蛋白的组成及其功能特性的研究[D]. 湛江:广东海洋大学, 2014.
[28] YANG C, WANG R, SONG H. The mechanism of peptide bonds cleavage and volatile compounds generated from pentapeptide to heptapeptide via Maillard reaction[J]. Food Chemistry, 2012, 133(2): 373-382.
[29] 赵谋明,张佳男,吴长平,等大豆肽的制备及其美拉德反应产物特性研究[J]. 现代食品科技, 2015, 31(2): 138-144;279.