肌肉中的蛋白质分为可溶于浓盐溶液的蛋白质、可溶于水或稀盐溶液的蛋白质和不溶于浓盐溶液的蛋白质。其中含量最多的是盐溶性蛋白中的肌原纤维蛋白(myofibrillar protein,MP),其与肌肉的交联、流变和凝胶等性质密切相关[1]。肉制品在贮藏过程中通常伴随着蛋白质的氧化,这不仅会降低肌肉的营养价值,还会对蛋白质的功能性质产生影响,降低肉的加工品质。
延缓肉制品氧化的方法主要有低温、气调、添加生物化学制剂等。微冻保鲜属于低温保鲜方法中的一种,其原理是通过低温来抑制微生物的生长繁殖及酶的活力,延缓肌肉蛋白的氧化[2]。相比于冷藏,微冻能更好地延长产品的保鲜期[3]。此外,通过添加化学抗氧化剂和生物抗氧化剂来延缓蛋白质氧化也是目前的研究热点,但化学抗氧化剂有潜在的安全性问题。天然抗氧化剂多为植物提取物,其毒性远远低于化学抗氧化剂,具有广阔的应用前景。
孜然是一种安全的天然香辛料,人们已经对其有效成分的提取[4]、鉴定[5]、抗氧化活性[6]等方面开展了一些研究,但对其在肉制品的加工与保鲜中的应用还鲜见报道。本文以新鲜羊肉为原料,以人工合成抗氧化剂BHT和天然抗氧化剂TP为参照,从羊肉MP结构和功能性质两方面入手,考察不同浓度孜然精油在微冻贮藏过程中的抗氧化效果,探讨其抗氧化的机理,以期为羊肉的贮藏保鲜以及孜然资源的深度开发提供理论基础和应用依据。
1 材料与方法
1.1 材料与试剂
新鲜羊后腿肉,购于重庆市石柱县千野羊行,宰杀后用洗净的刀具将后腿肉取下,置于洁净的塑料袋中,用放有冰袋的保温箱(0~4 ℃)在6 h内运回实验室冷藏;孜然精油(食用级,超临界CO2萃取,深绿色油状澄明液体,纯度为100%,其中枯茗醛类≥50%),广州晶晶生物科技有限公司;茶多酚(食用级,纯度为99%,其中黄烷醇类≥60%),西安康之乐生物技术有限公司;BHT(分析纯),成都市科龙化工试剂厂;其他试剂均为分析纯。
1.2 仪器与设备
Avanti J-10高速冷冻离心机,美国贝克曼库尔特公司;XHF-D内切式匀浆机,宁波新芝生物科技股份有限公司;MCR302 流变仪,奥地利安东帕公司;DXR2拉曼光谱仪,美国Thermo Fisher Scientific;SYNERGYH1MG全波长酶标仪,美国基因公司。
1.3 方法
1.3.1 试样处理
用消毒过的砧板和刀具在无菌操作台上将羊肉分割成40 g(约5 cm×4 cm×2 cm)左右肉块,蒸馏水洗净后分别在8、12、16 mg/mL孜然精油,2 mg/mL TP、0.15 mg/mL BHT溶液中浸泡30 min,空白对照用体积分数80%乙醇溶液浸泡,沥干后置于聚酯托盘内,用PE膜包装后于-3 ℃贮藏备用。
1.3.2 羊肉冻结点的测定
冻结肌肉时,温度随时间的变化曲线叫做该肌肉的冻结曲线。将数显温度计的探针插入重约250 g的羊肉中心位置,肉块放在-30℃的冰柜中,每隔20 s记录温度变化。平台期时的温度即为羊肉的冻结点。
1.3.3 MP的提取及浓度的测定
参照WU等[7]的方法并修改。试样于4 ℃解冻后绞碎,称取一定量碎肉于离心管中,加入5倍体积磷酸盐缓冲液(内含0.1 mol/L NaCl、1 mmol/L EGTA,pH 7.0),高速匀浆60 s,纱布过滤去掉结缔组织,滤液离心(7 500 r/min, 15min, 4 ℃)后去掉上清液,所得沉淀重复上述操作3次,再用5倍体积0.1 mol/L NaCl匀浆离心3次,沉淀即为MP,4 ℃保存,并在48 h内用完。用双缩脲法测MP浓度,牛血清蛋白为标准蛋白。
1.3.4 MP分子结构指标的测定
1.3.4.1 羰基含量的测定
参照OLIVER等[8]的方法测定。
1.3.4.2 总巯基含量的测定
参照刘琴等[9]的方法并修改。取1 mL 5 mg/mL的MP溶液加入9 mL 0.2 mol/L的Tris-HCl缓冲液A(内含0.6 mol/L NaCl、10 mmol/L EDTA、质量分数2% SDS、8 mol/L尿素,pH 6.8)中,混匀后取4 mL加入0.4 mL 0.01 mol/L Tris-HCl缓冲液C(内含质量分数0.1% DTNB,pH 8.0),40 ℃保温30 min,在412 nm处测定吸光度,空白用磷酸盐缓冲液代替。MP的总巯基含量按公式(1)计算。
巯基含量/[nmol·(mg蛋白质)![]()
(1)
式中:A,吸光度;B,样品蛋白浓度,mg/mL;C,吸光度系数,为13 600 mol/(cm·L);D,稀释倍数,为11。
1.3.4.3 活性巯基含量的测定
参照1.3.4.2用0.2 mol/L Tris-HCl缓冲液B(内含0.6 mol/L NaCl、10 mmol/L EDTA、2%SDS,pH 6.8)替代缓冲液A,40 ℃保温30 min,在412 nm处测定吸光度,空白用磷酸盐缓冲液代替。MP的活性巯基含量按公式(1)计算。
1.3.4.4 MP表面疏水性的测定
参照CHELH等[10]的方法并修改。取1 mL 5 mg/mL的MP溶液加入200 μL溴酚蓝溶液(1 mg/mL)中,室温振荡10 min,使之混匀,离心(7 500 r/min,12 min,4 ℃)后取上清液稀释10倍,于595 nm处测定吸光度,空白用磷酸盐缓冲液代替。MP表面疏水性按公式(2)计算:
溴酚蓝结合量![]()
(2)
式中:A0,空白对照组的吸光度值;A1,MP溶液的吸光度值。
1.3.4.5 拉曼光谱的分析
羊肉MP冷冻干燥后用DXR2拉曼光谱仪测定,设定参数为:激发波长785 nm,分辨率6 cm-1,扫面范围100~3 300 cm-1。
1.3.5 MP功能特性指标的测定
1.3.5.1 MP溶解度的测定
参照AGYARE等[11]的方法并修改。用磷酸缓冲液(含0.6 mol/L NaCl,pH 6.25)配制MP质量浓度为2.5 mg/mL。将配好的MP溶液于4 ℃静置1 h,冷冻离心(5 000 r/min, 4 ℃,15 min)后取上清液,用双缩脲法测定其浓度,记为C1,空白用磷酸缓冲液代替。按公式(3)计算MP的溶解度。
溶解度![]()
(3)
式中:ρ1,离心后上清液中MP质量浓度,g/L;2.5,离心前混合液中MP的质量浓度,g/L。
1.3.5.2 乳化性质的测定
采用浊度法测定MP的乳化性[12]。
1.3.5.3 流变性质的测定
参照WU等[13]的方法并修改。配制MP质量浓度为40 mg/mL,用MCR302流变仪测定其流变学特征,上样后需用硅油密封。参数设置为:夹具40 mm,频率1 Hz,应变8 mg/mL,平行板间距1 mm,升温扫描范围20~80 ℃,升温速率2 ℃/min,80 ℃保持3 min,最后以5 ℃/min将温度降至20 ℃。
1.3.6 数据处理
每个实验重复3次,每次做3个平行样,用Excel处理数据,SPSS Statistics 20.0软件进行单因素方差分析,Origin 8.5绘图,结果以平均值±标准差(X±SD)形式表示。
2 结果与分析
2.1 新鲜羊肉的冻结曲线
从图1可以看出,整个过程没有出现明显过冷点,平台区出现在-1.3~-1.2 ℃左右,根据微冻贮藏的定义将-3 ℃作为羊肉微冻贮藏温度进行研究。
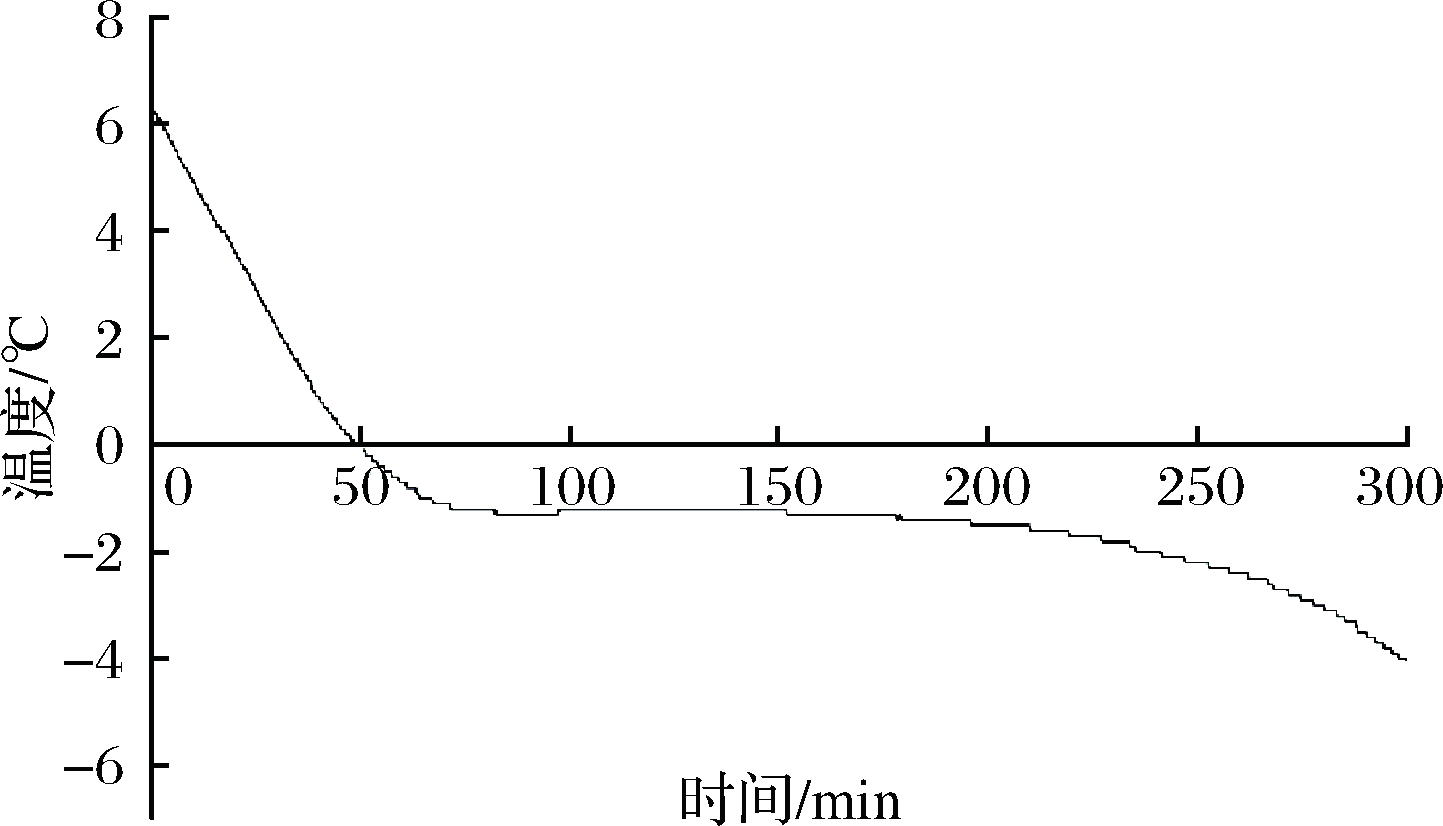
图1 羊肉的冻结曲线
Fig.1 Freezing curve of mutton
2.2 孜然精油对微冻羊肉MP结构的影响
2.2.1 羰基含量的变化
经不同处理后的羊肉在微冻贮藏过程中MP羰基含量的变化情况如图2所示。
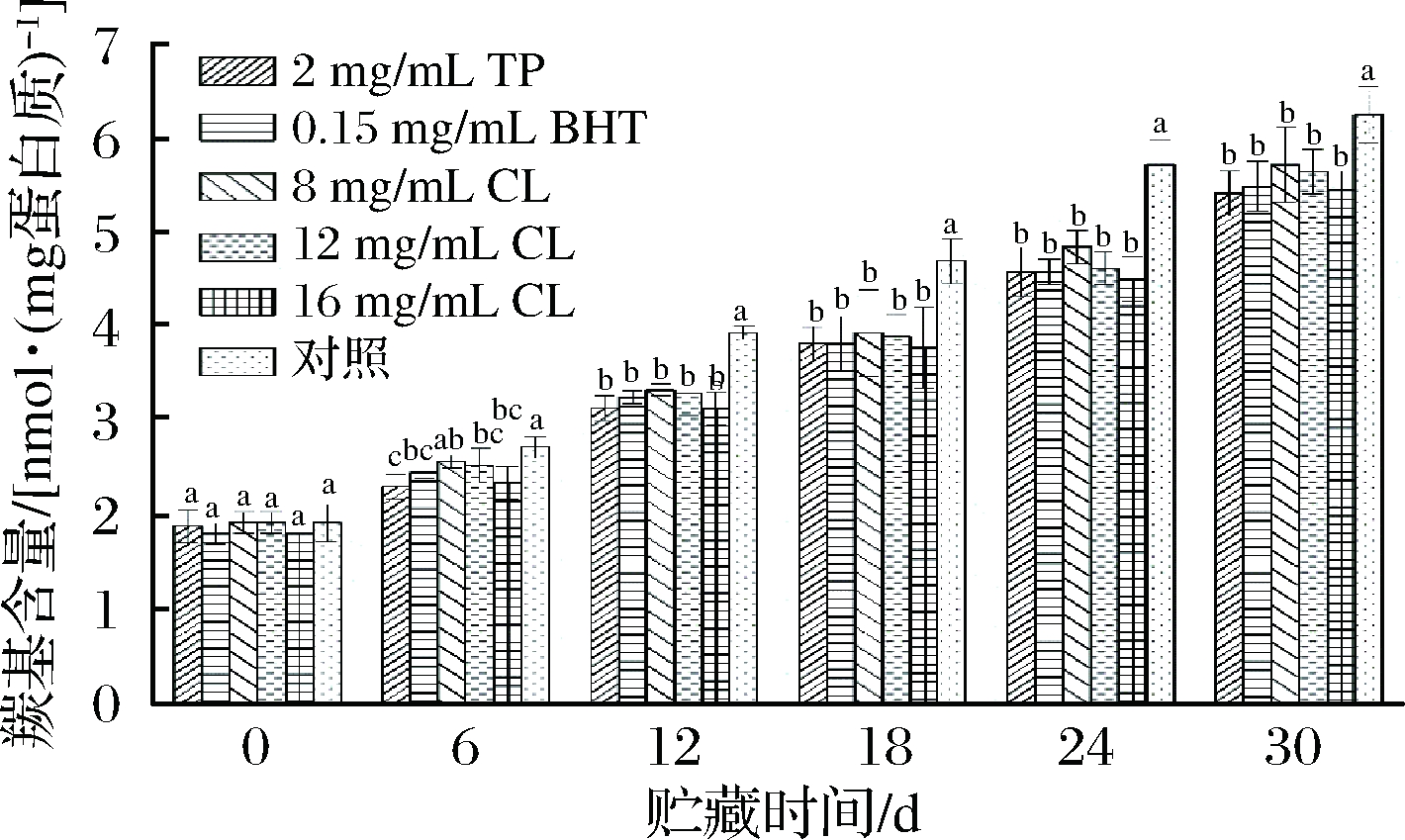
图2 微冻贮藏羊肉MP羰基含量的变化
Fig.2 Changes of carbonyl content in MP of mutton during superchilling storage
从图2可以看出,随着贮藏时间的延长,处理组和空白对照组羊肉MP的羰基含量均呈现出逐渐上升趋势,这可能是因为氨基酸侧链受到羟基自由基(·OH)的攻击氧化。TP组、BHT组、8 mg/mL CL组、12 mg/mL CL组、16 mg/mL CL组和空白对照组的初始羰基含量分别为1.89、1.82、1.93、1.93、1.82、1.93 nmol/mg蛋白质,贮藏24 d后,对照组的羰基含量达到了5.72 nmol/mg蛋白质,而TP组、BHT组、8 mg/mL CL组、12 mg/mL CL组、16 mg/mL CL组贮藏30 d后羰基含量分别为5.42、5.49、5.72、5.64、5.45 nmol/mg蛋白质,均不高于贮藏24 d时的对照组,表明处理组能显著抑制羊肉MP羰基的生成(P<0.05)。
蛋白质发生氧化后一个最显著的变化就是羰基的形成,因此常用其衡量蛋白质的氧化程度。蛋白质自身结构中并不含天然的羰基,其主要是通过直接氧化氨基酸侧链、与还原糖发生非酶糖化反应、与非蛋白糖基化合物结合和多肽链的氧化断裂等途径产生的[14]。从图2可以看出,处理组试样在贮藏过程中羰基含量增加速率较为缓慢,这表明孜然精油和茶多酚、BHT一样,都可以抑制MP的氧化,且16 mg/mL的孜然精油和茶多酚对羊肉MP的抑制效果最好,其次是BHT,12和8 mg/mL孜然精油不如前三者,但差异不显著(P>0.05)。
2.2.2 巯基含量的变化
经不同处理后的羊肉在微冻贮藏过程中总巯基含量与活性巯基含量的变化情况如图3所示。
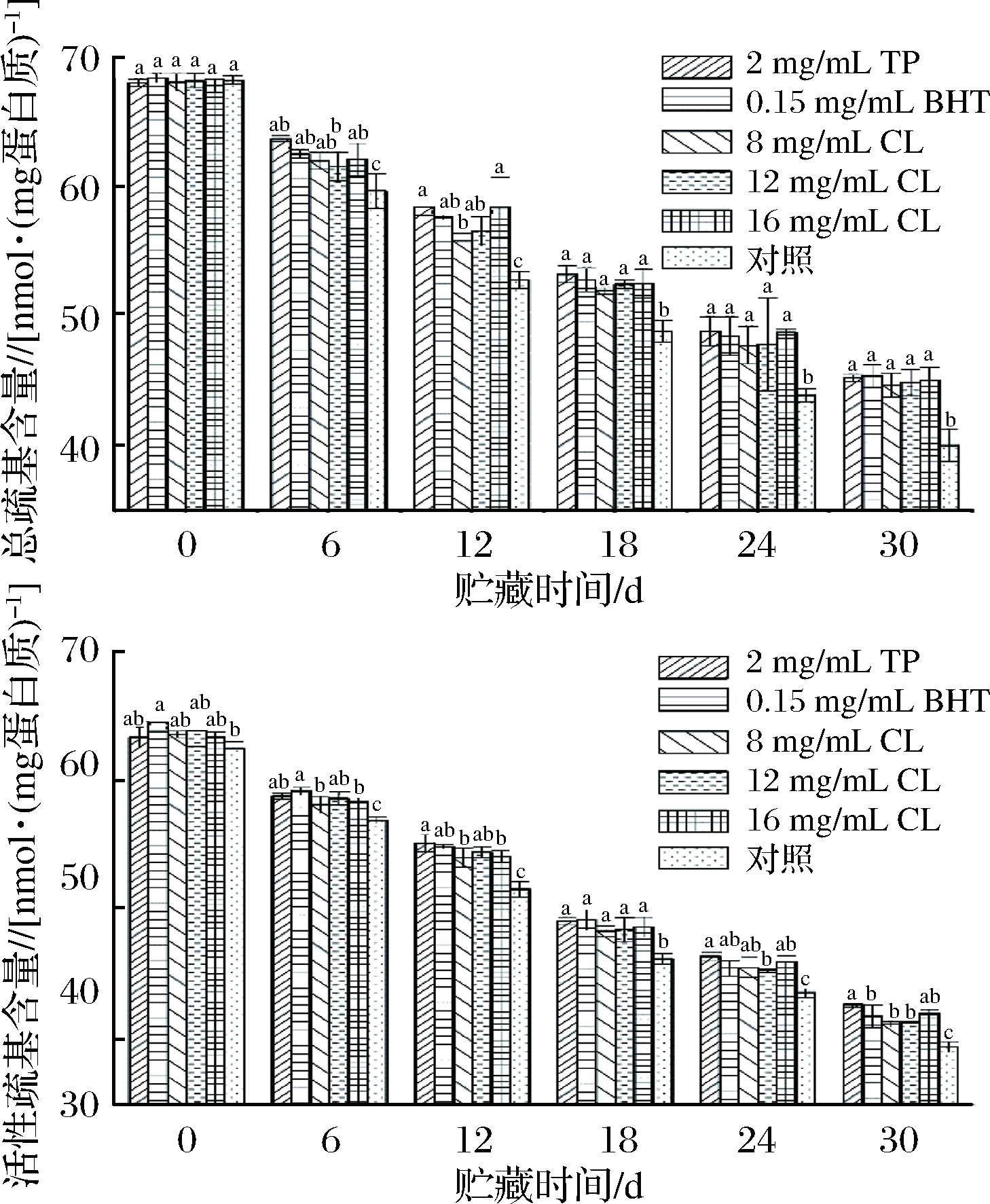
图3 微冻贮藏羊肉MP巯基含量的变化
Fig.3 Changes of sulfhydryl content in MP of mutton during superchilling storage
从图3可以看出,随着贮藏时间的延长,处理组和空白对照组羊肉总巯基含量与活性巯基含量均呈现出逐渐下降的趋势,这可能是由于巯基被氧化导致的。0 d时,TP组、BHT组、8 mg/mL CL组、12 mg/mL CL组、16 mg/mL CL组和空白对照组的总巯基含量分别为68.10、68.48、68.16、68.27、67.89、68.32 nmol/mg蛋白质,空白对照组在贮藏24 d时总巯基含量为43.89 nmol/mg蛋白质,TP组、BHT组、8 mg/mL CL组、12 mg/mL CL组、16 mg/mL CL组在贮藏了30 d后的值分别为45.24、45.40、44.70、44.86、45.08 nmol/mg蛋白质,均高于24 d时的空白对照组,活性巯基含量呈现类似的规律,这表明处理组显著抑制了巯基含量的下降(P<0.05)。
巯基(—SH)是MP中很活泼的功能基团,其含量变化能反映MP空间结构的稳定性。羊肉在微冻贮藏过程中常伴随着MP的变性,其结构会发生一定程度变化,从而导致巯基暴露,被氧化成为分子内或分子间的二硫键(—S—S—)[15]。对比各组发现处理组相较于空白对照组能显著减缓羊肉MP总巯基含量和活性巯基含量的下降速率(P<0.05),同时孜然精油(12、16 mg/mL)能较好抑制MP总巯基含量的下降,其效果与茶多酚、BHT处理组相当,优于8 mg/mL孜然精油处理组。茶多酚对活性巯基含量的抑制效果最佳,但与16 mg/mL孜然精油处理组差异不显著(P>0.05),与8、12 mg/mL孜然精油处理相比差异显著(P<0.05)。这表明孜然精油对羊肉MP巯基的抑制作用在一定范围内与浓度呈正相关。由于巯基含量的减少主要由MP的氧化引起,从这一点来看,孜然精油在抑制羊肉MP氧化方面可与茶多酚相当。
2.2.3 表面疏水性的变化
经不同处理后的羊肉在微冻贮藏过程中表面疏水性的变化情况如图4所示。
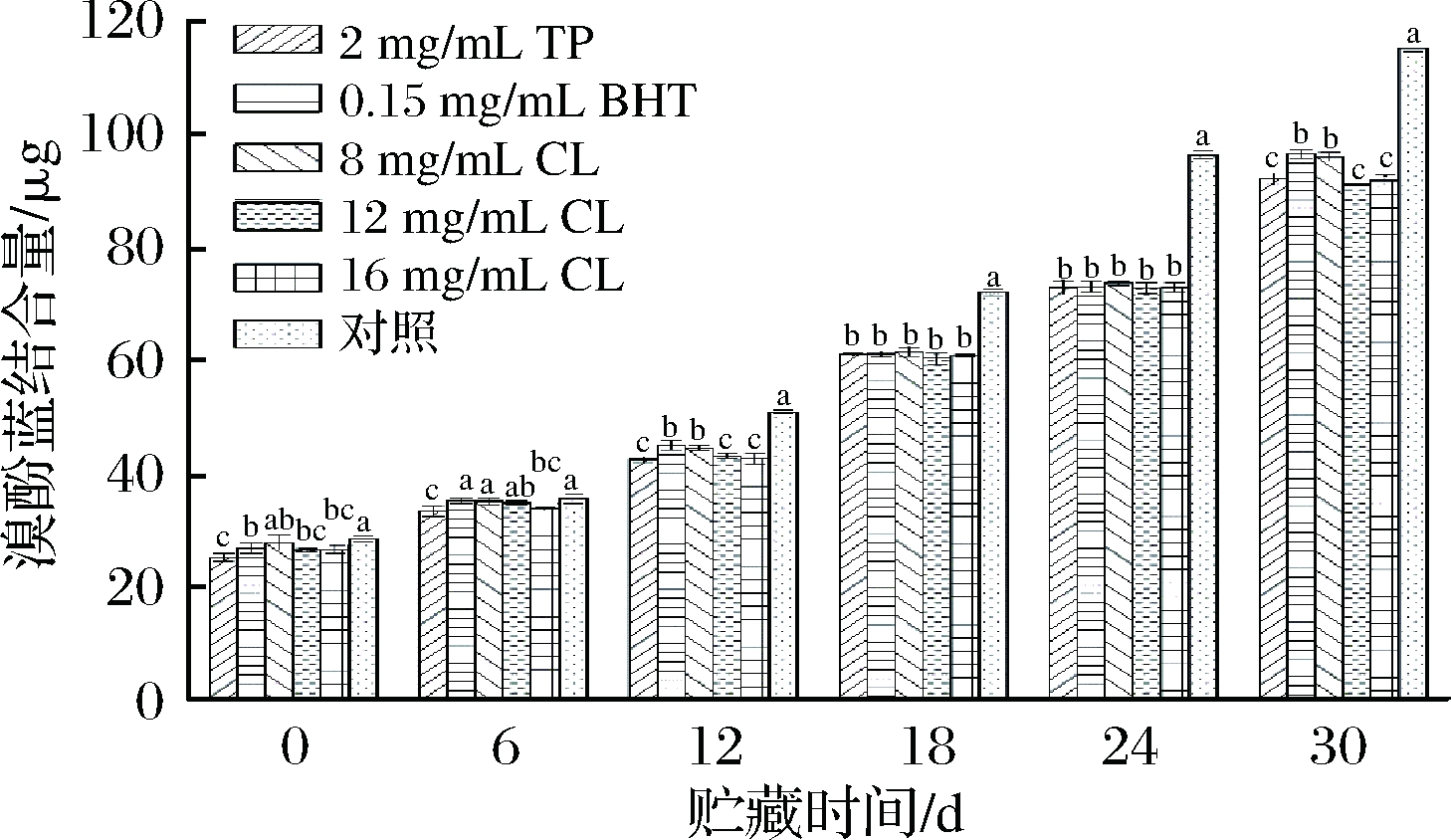
图4 微冻贮藏羊肉MP表面疏水性含量的变化
Fig.4 Changes of surface hydrophobicity in MP of mutton during superchilling storage
从图4可以看出,随着贮藏时间的延长,处理组和空白对照组羊肉MP的表面疏水性均呈现逐渐升高的趋势,且空白对照组相较于处理组而言上升速率更快(P<0.05)。空白对照组在贮藏24、30 d时羊肉MP与溴酚蓝结合量分别为96.24、115.13 μg,而TP组、BHT组、8 mg/mL CL组、12 mg/mL CL组、16 mg/mL CL组经过30 d贮藏后羊肉MP与溴酚蓝结合量分别达到92.06、96.46、96.46、95.92、90.99、91.74 μg,尤其12 mg/mL CL组和16 mg/mL CL组比空白对照组24 d时的值还低,这表明了处理组能延缓微冻贮藏羊肉MP的氧化速率,并且12 mg/mL和16 mg/mL的孜然精油的抑制效果优于茶多酚和BHT。
蛋白质的表面疏水性是指蛋白质分子与水分子间相互排斥的物理性质,是常用的衡量表面疏水性氨基酸的含有率和蛋白质变形程度的指标。蛋白质氧化会引起埋藏在蛋白质天然结构里的疏水性氨基酸残基暴露,导致其分子间产生聚集和交联,使其表面疏水作用增强。从图4可以看出,所有组羊肉MP的表面疏水性均随着贮藏时间的延长逐渐上升,LI等[16]研究肌球蛋白和闫春子[17]研究超高压对草鱼的保鲜作用时也发现了类似结果。
2.2.4 拉曼光谱分析
蛋白质的空间结构通常是指其二、三、四级结构,其中二级结构是其复杂空间构象的基础,通常包括α-螺旋、β-折叠等规则结构和γ-转角、无规则卷曲等不规则结构,主要通过氢键连接,范德华力、二硫键等作用力也有部分贡献[18],这些结构对蛋白质的功能特性起决定作用[19]。目前常用拉曼光谱、红外光谱、核磁共振技术等方法研究蛋白质的空间结构,其中拉曼光谱对分子振动非常灵敏,不仅可以通过酰胺键和C—C骨架振动谱带获得主链与侧链的构象来推测蛋白质的二级结构,还可以通过部分氨基酸功能基团的伸缩来推测蛋白质三级结构的变化,是研究蛋白质结构最常用的手段之一。
经不同处理后的羊肉在微冻贮藏前MP的拉曼图谱如图5所示。

图5 微冻贮藏羊肉MP初期拉曼光谱图
Fig.5 Changes in Raman spectra of MP of mutton during superchilling storage of sulfhydryl content in MP of mutton
从图5可以看出,位于1 645~1 685 cm-1范围的酰胺I带图谱较为突出,已有研究表明主要是由于C![]() O伸缩振动,用于表征蛋白质的二级结构,其中β-螺旋位于1 645~1 658 cm-1,α-折叠位于1 665~1 680 cm-1,无规则卷曲位于1 660~1 665 cm-1[20-21]]。由图6可以看出,在微冻贮藏过程中,羊肉MP图谱中位于1 650~1 658 cm-1处的特征峰向高波数迁移,这表明随着贮藏时间的延长,α-螺旋结构逐渐减少,无规则卷曲和β-折叠结构含量增加。任丽娜[22]、SANCHEZ等[23]和CARECHE等[24]的研究也得出了类似的结果。
O伸缩振动,用于表征蛋白质的二级结构,其中β-螺旋位于1 645~1 658 cm-1,α-折叠位于1 665~1 680 cm-1,无规则卷曲位于1 660~1 665 cm-1[20-21]]。由图6可以看出,在微冻贮藏过程中,羊肉MP图谱中位于1 650~1 658 cm-1处的特征峰向高波数迁移,这表明随着贮藏时间的延长,α-螺旋结构逐渐减少,无规则卷曲和β-折叠结构含量增加。任丽娜[22]、SANCHEZ等[23]和CARECHE等[24]的研究也得出了类似的结果。
通常用酪氨酸等氨基酸侧链来判断蛋白质的三级结构,酪氨酸残基在830和850 cm-1附近形成的费米共振双峰与该基团所处的微环境有关,I850/I830(强度比)是反应酪氨酸残基状态(“包埋”或“暴露”)的有效探针,当I850/I830值大于1.0时,表明酪氨酸残基暴露在蛋白质表面,可作为氢键供体或受体与溶剂水分子相互作用,当I850/I830值介于0.7~1.0之间,表明酪氨酸残基包埋在蛋白质分子内部疏水环境中,可作为氧键供体[25-26]]。表1展示了羊肉微冻贮藏过程中I850/I830的变化情况,贮藏初期TP组、BHT组、8 mg/mL CL组、12 mg/mL CL组、16 mg/mL CL组和空白对照组的比值分别为1.07、1.06、1.06、1.05、1.06和1.06,表明酪氨酸残基在MP表面是暴露的,处于极性环境中。随着微冻时间的延长,I850/I830呈现减小的趋势,至贮藏终点时分别到了0.91、0.89、0.88、0.90、0.90、0.87。表明随着贮藏时间的延长,MP发生了变性,分子间疏水作用增强使蛋白质发生凝集沉淀,导致部分表面裸露的酪氨酸残基又被包埋在蛋白质网络里。LEELAPONGWATTANA等[27]研究黑线鳕肌动球蛋白时也发现了类似结果。
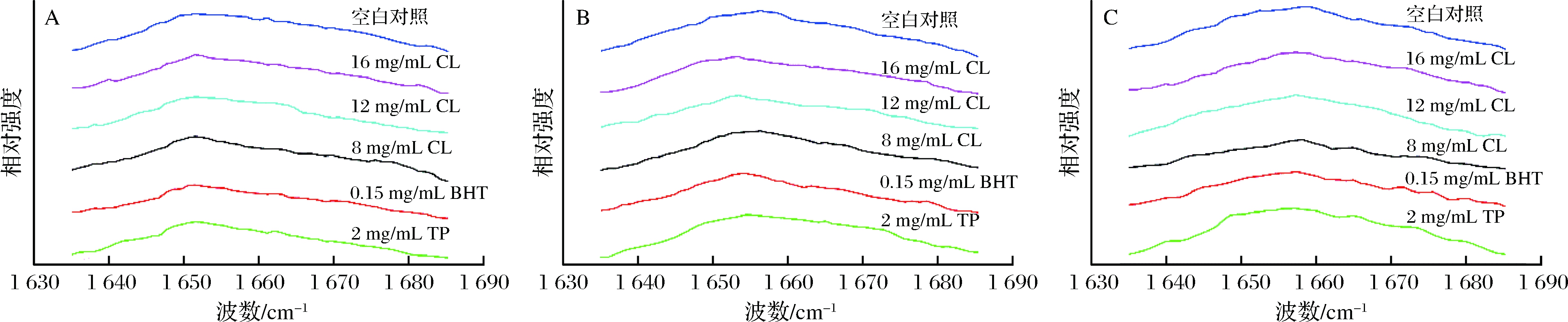
图6 微冻贮藏过程中羊肉MP拉曼光谱图
Fig.6 Changes in Raman spectra of MP of mutton during superchilling storage of sulfhydryl content in MP of mutton
注:图中A、B、C分别表示贮藏0、18、30 d的拉曼图谱
表1 微冻贮藏过程中羊肉MP I850/I830强度的变化
Table 1 Effect on tyrosine doublet ratio I850/I830 of MPof mutton during superchilling storage
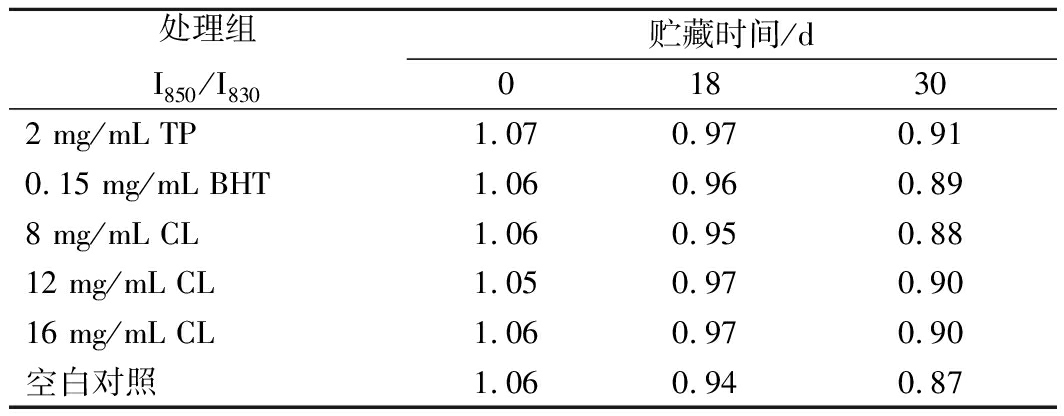
处理组I850/I830贮藏时间/d018302 mg/mL TP1.070.970.910.15 mg/mL BHT1.060.960.898 mg/mL CL1.060.950.8812 mg/mL CL1.050.970.9016 mg/mL CL1.060.970.90空白对照1.060.940.87
2.3 孜然精油对微冻羊肉MP功能性质的影响
2.3.1 溶解度的变化
不同处理的羊肉在微冻贮藏过程中溶解度的变化情况如图7所示,随着贮藏时间的延长,处理组和空白对照组羊肉溶解度均呈现逐渐下降的趋势,且处理组相较于空白对照组能显著减缓羊肉MP溶解度的下降速率(P<0.05)。最初TP组、BHT组、8 mg/mL CL组、12 mg/mL CL组、16 mg/mL CL组和空白对照组羊肉MP的溶解度分别为61.22%、61.64%、59.94%、61.22%、62.49%、61.22%,贮藏30 d后,分别下降了2.29、2.23、2.35、2.33、2.41和2.94倍。
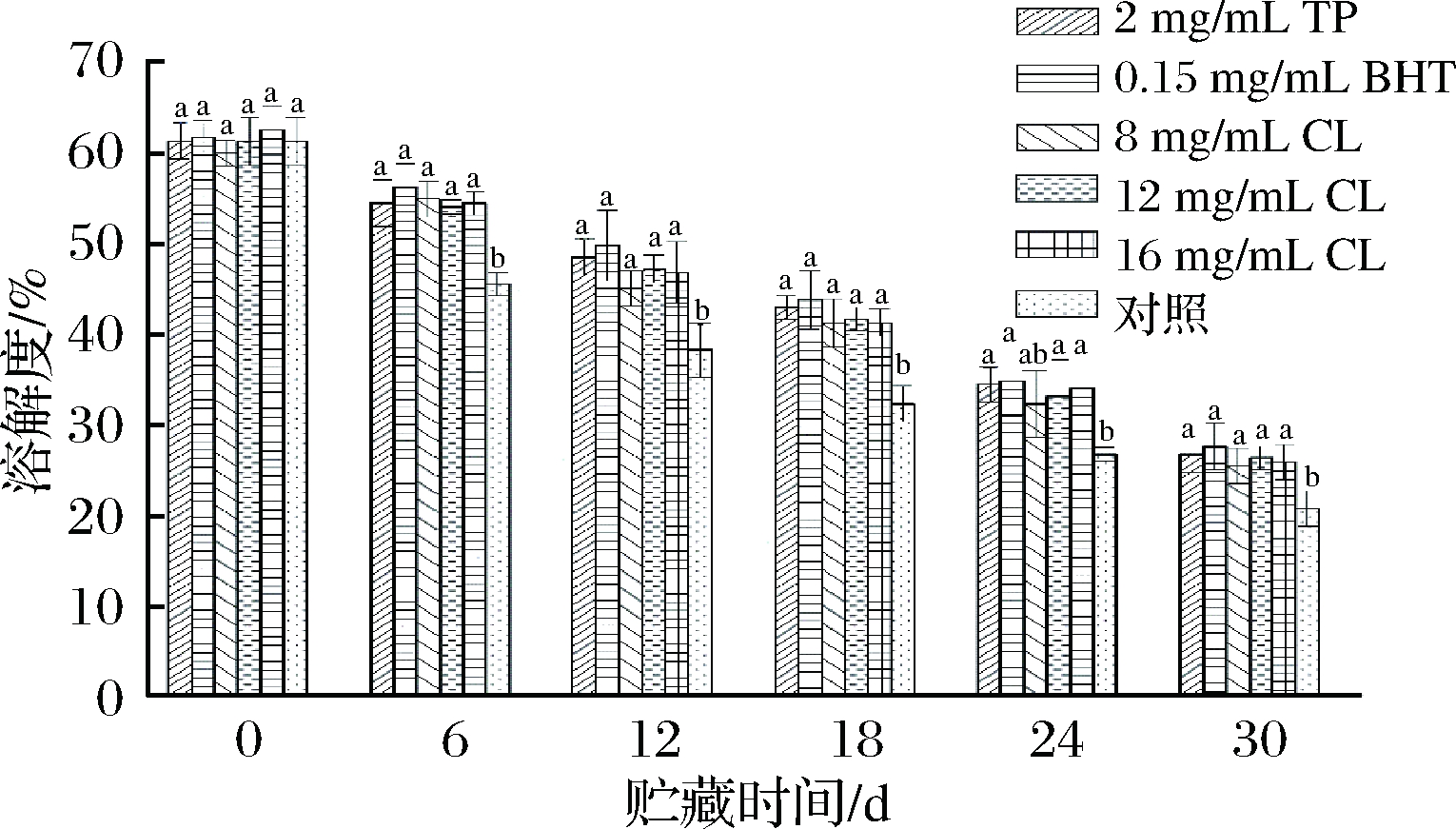
图7 微冻贮藏羊肉MP溶解度含量的变化
Fig.7 Changes of solubility in MP of mutton during
superchilling storage
蛋白质的溶解性是其基本物理性质之一,能直接反映蛋白质变性和聚集的情况[28]。从图7可以看出,羊肉微冻贮藏期间各组溶解度都有不同程度地降低,这可能是由于贮藏过程中MP变性和微环境的变化导致了不溶性的大分子量的蛋白质聚集体的形成,导致蛋白质溶解性降低;蛋白质的结构变化会使其疏水基团暴露,而疏水性相互作用会使MP发生凝聚,也使其溶解度降低[29]。图7显示,BHT组溶解度下降程度最小,TP组、12 mg/mL CL组和16 mg/mL CL组溶解度下降程度接近,表明孜然精油(12、16 mg/mL)能较好延缓MP的变性和聚集,在抑制微冻贮藏羊肉MP氧化方面和茶多酚相当,较BHT稍微差,但差异不显著(P>0.05)。
2.3.2 乳化性的变化
不同处理的羊肉在微冻贮藏过程中乳化活性和乳化稳定性的变化情况见图8,随着贮藏时间的延长,TP、BHT、CL处理组和空白对照组羊肉乳化活性和乳化稳定性均呈现出逐渐下降的趋势,且处理组相较于空白对照组能显著减缓羊肉MP乳化活性和乳化稳定性的下降速率。起初TP组、BHT组、8 mg/mL CL组、12 mg/mL CL组、16 mg/mL CL组、空白对照组的乳化活性和乳化稳定性分别为29.77、29.86、28.88、29.08、28.35、28.77和82.02%、81.62%、80.20%、80.20%、82.20%、81.32%,至贮藏终期分别为13.55、13.24、12.95、13.95、13.74、11.65和59.35%、58.99%、58.82%、60.00%、60.49%、55.75%。这可能是因为在微冻贮藏过程中,羊肉MP发生氧化变性,引起肌球蛋白交联程度的增加,导致蛋白质表面吸附脂肪颗粒的能力减弱,宏观表现为蛋白质乳化活性和乳化稳定性下降[30]。这与李学鹏等[31]研究大黄鱼冻藏过程中MP的乳化活性和乳化稳定性结果相似。
从图8看出羊肉在微冻贮藏0~18 d内乳化性质的下降速率比18~30 d更快,这可能是因为贮藏前期羊肉体内冰晶的生长对其肌肉的机械损伤程度更大,导致蛋白质变性速率更快。分析发现乳化活性在贮藏期内下降17.12 m2/g,乳化稳定性在贮藏期内下降了25.57%,而TP组和16 mg/mL CL组下降幅度分别为16.21、14.6 m2/g和22.28%、22.36%,均显著低于空白对照组,这可能是由于处理组在一定程度上延缓了羊肉MP的变性程度,从而表现为处理组乳化性质优于空白对照组,其中16 mg/mL的孜然精油处理组效果最好。
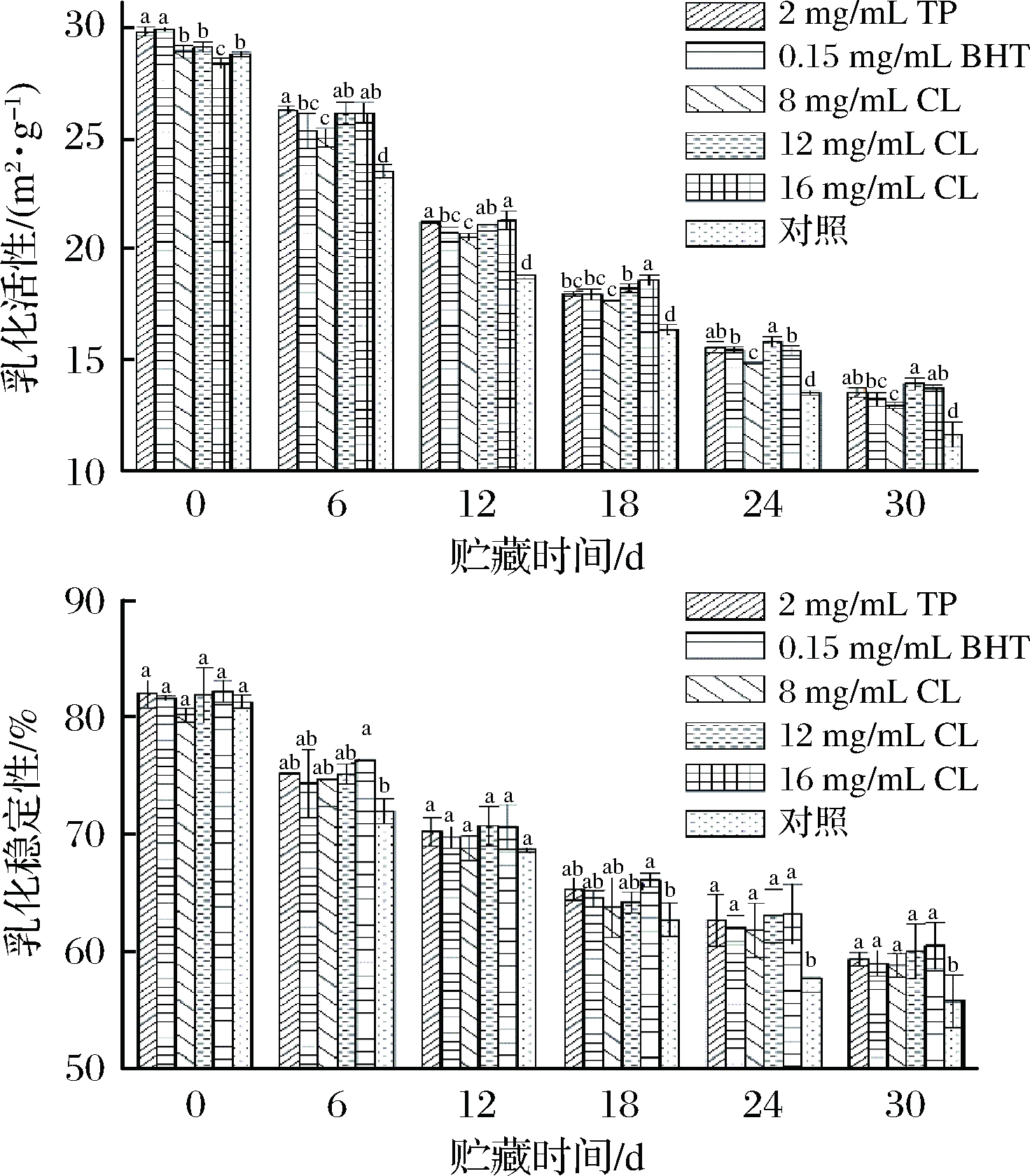
图8 微冻贮藏羊肉MP乳化性质的变化
Fig.8 Changes of emulsifying in MP of mutton under superchilling storage
2.3.3 流变分析
从流变学角度来说,MP凝胶是一种弹性特征的物质,随温度和时间的改变而改变。弹性模量(G′)表示MP弹性凝胶三维结构的形成速率,用于表征蛋白质结构的凝聚、折叠和打开情况[32]。经不同处理后的羊肉在微冻贮藏过程中G′的变化情况如图9所示。
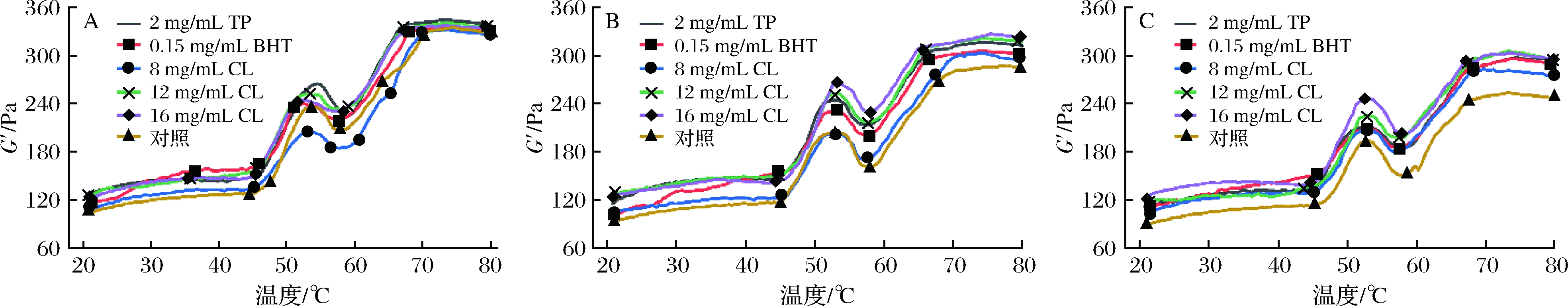
图9 微冻贮藏羊肉MP弹性模量的变化
Fig.9 Changes of elastic modulus in MP of mutton under superchilling storage
注:图中A、B、C分别表示贮藏时间0、18和30 d的弹性模量变化。
从图9可以看出,羊肉MP的G′随温度的升高变化趋势基本一致,分为上升-下降-上升3个阶段。在第一阶段,羊肉MP的G′表现为先缓慢上升后迅速升高,在54 ℃左右达到第1个峰值,这是因为此时肌球蛋白头部的α-螺旋开始打开,头部发生交联,开始形成较弱的三维网状结构[33]。之后G′开始下降,通常认为这是由于加热过程中氢键发生断裂,蛋白质变性引起的,其三维网状结构被破坏;此外,肌球蛋白尾部解螺旋使蛋白质流动性增加,蛋白质在内源蛋白酶的作用下发生水解也可能引起G′下降[34]。最后G′再次上升直至平稳,这是因为蛋白质随着温度的升高继续变性,更多的肌球蛋白分子螺旋结构被展开,在二硫化合物共价结合和疏水相互作用的共同作用下发生交联,最终形成了稳定、不可逆的三维网状结构[35-36]。
0 d时TP组、BHT组、8 mg/mL CL组、12 mg/mL CL组、16 mg/mL CL组和空白对照组羊肉MP的最大G′分别为344.97、335.99、331.94、340.49、337.26和334.93 Pa,至贮藏终点分别下降了13.69%、11.99%、15.32%、10.34%、10.17%和24.43%,各组试样的最大G′均随着冷藏时间的延长逐渐下降,流变学性质的总体变化趋势与张斌斌等[37]的研究相似。但对照组的G′下降幅度最大,16 mg/mL CL处理组下降幅度最小,12 mg/mL CL和16 mg/mL CL处理组下降幅度均低于TP和BHT处理组。流变学分析结果也表明,孜然精油能显著延缓微冻贮藏过程中肌原纤维蛋白凝胶特性的变化,且效果优于TP和BHT。
3 结论
随着贮藏时间的延长,羊肉MP会发生一定程度的氧化,蛋白质二级结构遭到一定程度的破坏。添加抗氧化剂能延缓MP结构的变化,且孜然精油处理液浓度达到12 mg/mL及以上时,其使用效果与适宜浓度的TP和BHT溶液相当。微冻贮藏过程中,羊肉MP的水合性、界面特性以及凝胶性能不断减弱,抗氧化处理能显著延缓MP功能特性的变化,且孜然精油质量浓度达到12 mg/mL及以上时,其效果优于适宜浓度的TP和BHT溶液。
孜然精油在羊肉微冻贮藏过程中能显著发挥其抗氧化作用,延缓MP的结构和功能特性变化,其以孜然精油进行浸泡处理的适宜质量浓度为12 mg/mL。
[1] LAWRIE R A, LEDWARD D A, 劳里,等. Lawrie′s肉品科学[M].周光宏,等.译.北京:中国农业大学出版社,2009.
[2] 胡玥, 吴春华, 姜晴晴, 等. 微冻技术在水产品保鲜中的研究进展[J]. 食品工业科技, 2015, 36(9): 384-390.
[3] DUUN A S, RUSTAND T. Quality changes during superchilled storage of cod (Gadus morhua) fillets[J]. Food Chemistry,2007,105(3):1 067-1 075.
[4] 薛文君,商飞飞,豆海港.孜然超声波辅助提取及其抗氧化性研究[J].中国调味品,2018,43(9):117-120;129.
[5] 权美平.国产孜然精油化学成分分析研究进展[J].中国调味品,2018,43(5):178-181.
[6] 李大强. 孜然精油的成分分析、抗菌和抗氧化活性[D].兰州:甘肃农业大学,2012.
[7] WU M G, XIONG Y L, CHEN J. Rheology and microstructure of myofibrillar protein-plant lipid composite gels: Effect of emulsion droplet size and membrane type[J]. Journal of Food Engineering, 2011, 106(4): 318-324.
[8] OLIVER C N, AHN B, MOERMAN E J, et al.Age-related changes in oxidized proteins[J].Journal of Biological Chemistry,1987,262(12):5 488-5 491.
[9] 刘琴.金枪鱼肌原纤维蛋白冻藏过程中生化及流变特性研究[D].上海:上海海洋大学,2013.
[10] CHELH I, GATELLIER P, SANT-LHOUTERIER V. Technical note: A simplified procedure for myofibril hydrophobicity determination[J].Meat Science,2006,74(4):681-683.
[11] AGYARE K K, XIONG Y L, ADDO K. Influence of salt and pH on the solubility and structural characteristics of transglutaminase-treated wheat gluten hydrolysate[J]. Food Chemistry, 2008, 107(3): 1 131-1 137.
[12] AGYARE K K, ADDO K, XIONG Y L. Emulsifying and foaming properties of transglutaminase-treated wheat gluten hydrolysate as influenced by pH, temperature and salt[J]. Food Hydrocolloids, 2009, 23(1): 72-81.
[13] WU M, XIONG Y L, CHEN J. Role of disulphide linkages between protein-coated lipid droplets and the protein matrix in the rheological properties of porcine myofibrillar protein peanut oil emulsion composite gels[J]. Meat Science. 2011, 88: 384-390.
[14] 崔旭海, 孔保华. 蛋白质氧化及其对乳蛋白结构与功能性的影响[J]. 中国乳品工业, 2008, 36(1): 44-47.
[15] 夏俪宁. 马鲛鱼肌原纤维蛋白氧化对胶特性影响[D].大连:大连工业大学,2018.
[16] LI S J, KING A J. Lipid oxidation and myosin denaturation in dark chicken meat[J]. Journal of Agricultural and Food Chemistry, 1996, 44(10): 3 080-3 084.
[17] 闫春子. 超高压处理对淡水鱼冷藏保鲜效果的影响[D].无锡:江南大学,2016.
[18] 张秋会,黄现青,李苗云,等.傅里叶红外光谱法研究肌肉蛋白质的二级结构[J].食品与发酵工业,2015,41(10):247-251.
[19] 马海建. 超高压处理对草鱼鱼肉和鱼糜制品品质的影响[D].上海:上海海洋大学,2016.
[20] CARECHE M, GARCIA M, HERRERO A, et al. Carmona. structural properties of aggregates from frozen stored hake muscle proteins[J]. Journal of Food Science, 2002, 67 (8): 2 827-2 832.
[21] HERRERO A M. Raman spectroscopy for monitoring protein structure in muscle food systems[J]. Critical Reviews in Food Science and Nutrition, 2008, 48(6): 512-523.
[22] 任丽娜. 白鲢鱼肉肌原纤维蛋白冷冻变性的研究[D].无锡:江南大学,2014.
[23] S NCHEZ-GONZ
NCHEZ-GONZ LEZ I. Protein and water structural changes in fish surimi during gelation as revealed by isotopic H/D exchange and raman spectroscopy[J]. Food Chemistry,2008,106(1): 56-64.
LEZ I. Protein and water structural changes in fish surimi during gelation as revealed by isotopic H/D exchange and raman spectroscopy[J]. Food Chemistry,2008,106(1): 56-64.
[24] CARECHE M,HERRERO A,RODRIGUEZ-CASADO A,et al. Structural changes of hake (Merluccius merluccius L.) fillets: effects of freezing and frozen storage[J]. Journal of Agricultural and Food Chemistry,1999(47): 952-959.
[25] LIN X P, YANG W G, XU D L, et al. Effect of electron irradiation and heat on the structure of hairtail surimi[J]. Radiation Physics and Chemistry, 2015, 114: 50-54.
[26] 邱春江. 超高压对鲢鱼中关键酶与结构蛋白质构影响的研究[D].无锡:江南大学,2014.
[27] LEELAPONGWATTANA K, BENJAKUL S,VISESSANGUAN W, et al. Raman spectroscopic analysis and rheological measurements on natural actomyosin from haddock (Melanogrammus aeglefinus) during refrigerated (4 ℃) and frozen (-10 ℃) storage in the presence of trimethylamine-N-oxide demethylase from kidney of lizardfish (Saurida tumbil)[J]. Food Chemistry,2008(106): 1 253-1 263.
[28] WU S J, PAN S K, WANG H B. Effect of trehalose on Lateolabrax japonicus myofibrillar protein during frozen storage[J]. Food Chemistry,2014,160:281-285.
[29] HERRERA J R, MACKIE I M. Cryoprotection of frozen-stored actomyosin of farmed rainbow trout (Oncorhynchus mykiss) by some sugars and polyols[J]. Food Chemistry, 2004, 84(1): 91-97.
[30] 何雪莹.冰温保鲜对鲤鱼鱼肉品质特性及其理化特性影响的研究[D]. 哈尔滨: 东北农业大学, 2012.
[31] 李学鹏,周明言,周凯,等.大黄鱼冻藏过程中肌原纤维蛋白氧化及其功能性质的变化[J].中国食品学报,2018,18(7):171-179.
[32] XIONG Y L, BLANCHARD S P. Myofibrillar protein gelation:viscoelastic changes related to heating procedures[J].Journal of Food Science,1994,59(4):734-738.
[33] LATIF T, CHEN Y C, JACEK J. Color improvement by titanium dioxide and its effect on gelationand texture of proteins recovered from whole fish using isoelectricsolubilization/precipitation[J].LWT-Food Science and Technology, 2010,43(3): 401-408.
[34] 于巍.草鱼盐溶蛋白的提取及凝胶保水性和流变性质的研究[D].武汉:武汉工业学院, 2008.
[35] XIONG Y L,SRINIVASAN S,LIU G. Modification of muscle protein functionality by antioxidants [J].Food Proteins and Lipids,1997,415:95-108.
[36] WU M,XIONG Y L,CHEN J,et al.Rheological and microstructural properties of porcine myofibrillar protein-lipid emulsion composite gels [J].Journal of Food Science,2009,74(4):E207-E217.
[37] 张斌斌,李兴艳,夏杨毅,等.兔肉宰后成熟过程中肌原纤维蛋白功能性质的变化[J].食品工业科技,2015,36(4):105-110;115.