柑橘是我国重要的经济作物之一,因其味道酸甜可口、风味浓郁且营养充分,深受消费者喜爱。然而柑橘经采摘后,随着时间的延长果实失去水分,风味逐渐变淡,通常还积累异味物质。乙醇是柑橘在贮藏期间积累的主要异味物质之一[1],果实产生褐斑、浮皮枯水和水肿等生理病害与其有密切联系[2],因此乙醇的积累是决定果实风味和品质好坏的重要因素之一。经研究表明,柑橘果实中乙醇的积累情况受果皮厚度[3]、贮藏温度[4]与涂膜处理[5]等因素的影响,同时这些因素也会使其他风味物质和果实基本品质发生变化。近些年来,学者们通过不同调控方式改善果实的风味与品质,这些研究已经在猕猴桃[6]、番茄[7]和梨[8]等果实上实现。
褪黑素(melatonin,MT)是一种吲哚胺类物质,是多数动植物体内合成的天然抗氧化剂,对人体有促进睡眠、镇痛、抗氧化、抗肿瘤、免疫调节等功效[9],在植物中其能调节植物的生长衰老,增强植物对胁迫的耐受性,提高果实的抗逆性[10]。目前褪黑素在果实生长调节[11]、贮藏品质[12]与抗性研究[13]方面已有一定进展,但是褪黑素对柑橘采后品质和风味的研究还比较少。
‘爱媛38号’是南香与西子香杂交选育出的新兴品种,成熟期较早,由于其果面光滑美观,口感细腻化渣、清香爽口、风味极佳,市场需求前景广阔[14]。本文通过研究褪黑素对柑橘果实品质与乙醇代谢的影响,为柑橘果实贮藏品质与风味调控提供理论依据和技术支持。
1 材料与方法
1.1 材料与试剂
选用‘爱媛38号’柑橘果实,于2018年10月30日采自四川资阳,采收时选择成熟度一致(八成熟)、大小一致并且无机械损伤的果实,采后将果实随机分成CK、MT 2组,MT组果实经质量浓度为1.0 g/L的褪黑素溶液浸泡10 min,CK组用清水浸泡作为对照组。晾干后单果薄膜套袋,置于6~8 ℃环境中贮藏。入库贮藏后分别于贮藏0、10、20、40、60 d时进行相关指标的测定分析。
2,4-二硝基苯肼,上海沪试;三氯乙酸(TCA),天津市光复精细化工研究所;二硫苏糖醇(dithiothreitol, DTT)、无水乙醇(色谱级)、乙醛(色谱级),Aladdin;交联聚乙烯吡咯烷酮(crosslinking polyvingypyrrolidone, PVPP)、2-吗啉乙磺酸、丙酮酸钠,Adamas;丙酮酸脱羧酶(PDC)ELISA试剂盒、乙醇脱氢酶(ADH)ELISA试剂盒,南京草本源生物科技有限公司;植物多糖多酚总RNA提取试剂盒、SYBR®Premix Ex TaqTM II (Tli RNaseH Plus)试剂,日本TaKaRa公司;草酸、NaCl、BaCl2、NaOH、酚酞、2,6-二氯靛酚钠等,成都市科龙化工试剂公司。
1.2 仪器与设备
Pocket Brix-Acidity Meter Master kit手持式折光仪,日本爱拓公司;CFX98TM Real-Time荧光定量仪,Bio-Rad ;TU-1901紫外分光光度计,北京普析通用仪器有限公司;H1850R台式高速冷冻离心机,长沙湘仪离心机仪器有限公司;Agilent 5977 MSD气相色谱-质谱联用仪,美国安捷伦公司;Varioskan LUX酶标仪,美国赛默飞公司。
1.3 指标测定与方法
1.3.1 感官评定
感官评价采用描述测试法,参考OBENLAND等[15]的方法,稍作改动。选择12名20~25岁的评定人员进行感官评价,12名评定人员分别为6男6女,评价项目与标准如表1所示。评定人员于相同评鉴环境不同品评间,对贮藏60 d后的果实进行评价。评价指标有新鲜度、水分含量、果面缺陷、气味和口感,记录各项目的评分值,收集评分表,进行统计分析。
表1 感官评价项目及评分标准
Table 1 Sensory evaluation items and scoring standards
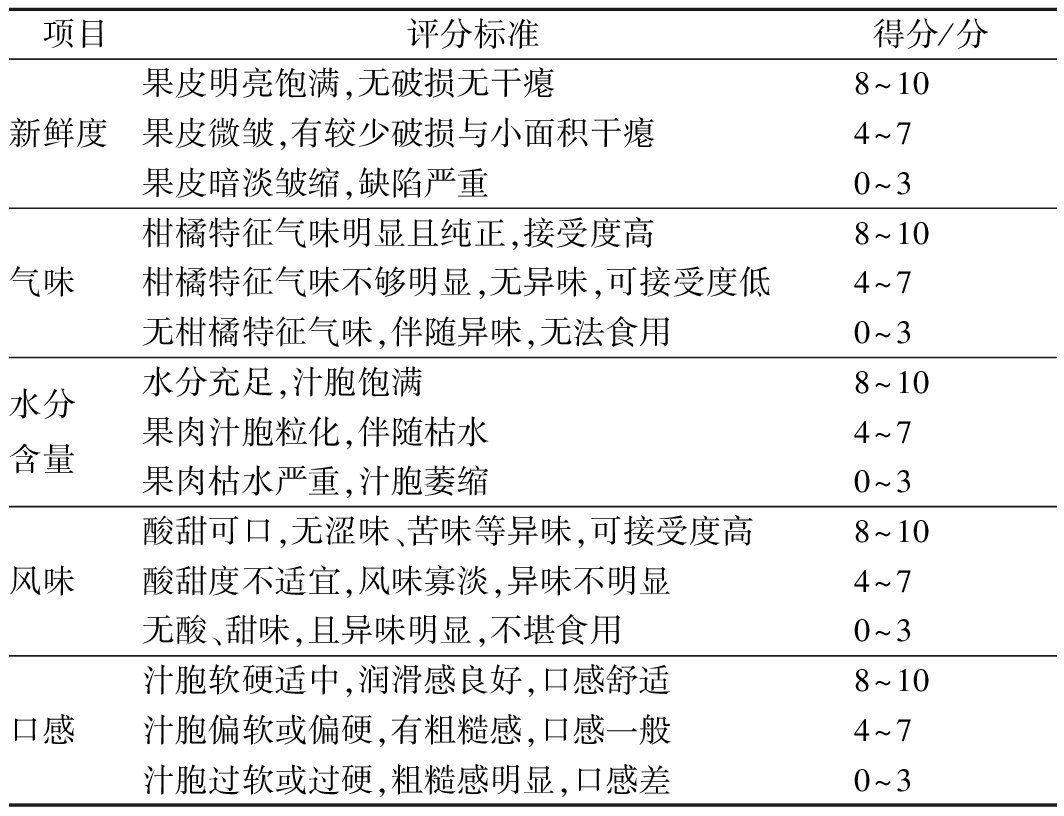
项目评分标准得分/分新鲜度果皮明亮饱满,无破损无干瘪8~10果皮微皱,有较少破损与小面积干瘪4~7果皮暗淡皱缩,缺陷严重0~3气味柑橘特征气味明显且纯正,接受度高8~10柑橘特征气味不够明显,无异味,可接受度低4~7无柑橘特征气味,伴随异味,无法食用0~3水分含量水分充足,汁胞饱满8~10果肉汁胞粒化,伴随枯水4~7果肉枯水严重,汁胞萎缩0~3风味酸甜可口,无涩味、苦味等异味,可接受度高8~10酸甜度不适宜,风味寡淡,异味不明显4~7无酸、甜味,且异味明显,不堪食用0~3口感汁胞软硬适中,润滑感良好,口感舒适8~10汁胞偏软或偏硬,有粗糙感,口感一般4~7汁胞过软或过硬,粗糙感明显,口感差0~3
1.3.2 可溶性固形物与可滴定酸含量测定
取10个果实榨汁后,用手持式折光仪测定可溶性固形物和可滴定酸含量,重复测定3次。
1.3.3 抗坏血酸含量测定
采用2,6-二氯靛酚滴定法[16],单位g/100 mL。取10个果实榨汁后,吸取5 mL原果汁用质量分数1%草酸定容至100 mL,取2 mL置于烧瓶中,用2,6-二氯靛酚滴定,使稀释果汁变成淡粉色,30 s不褪色为滴定终点,重复测定3次。
1.3.4 呼吸强度测定
采用静置碱液吸收法[17]。玻璃干燥器清洗干净,晾干后下面放入培养皿,用移液管吸取10 mL摩尔浓度0.4 mol/L NaOH标准液放入培养皿中,放置隔板,装入10个果子,盖好干燥器,于6~8 ℃下静置2 h,随后将碱液转移到三角瓶中(冲洗3次),加饱和BaCl2溶液5 mL和2滴酚酞指示剂,用摩尔浓度0.2 mol/L草酸标准溶液滴定,粉色沉淀变成白色为滴定终点,记录草酸用量,重复测定3次。
1.3.5 Real-time qRCR测定
果肉总RNA提取:参照植物多糖多酚总RNA提取试剂盒操作,然后检测其完整性和纯度。使用两步法进行cDNA合成。采用SYBR染料法测定乙醇代谢相关基因在不同贮藏期的转录水平,参照SYBR® Premix Ex TaqTM II (Tli RNaseH Plus)试剂盒操作,PCR扩增在实时荧光定量PCR仪上进行。每个样品设3次重复,以ddH2O为阴性对照,采用2-ΔΔct法进行相对定量分析。引物:ACTIN-F:CATCCCTCTCAGCACCTTCC,ACTIN-R:CCAACCTTAAGCACTTCTCC;ADH-F:GCTGGAGGGATTGTAGAAAGTGTAG,ADH-R:CCTGAGGAGGTCACACATATTGCTT;PDC-F:GC AAACGCAATGGGCTCAACGGGTC,PDC-R:CGGCTCCGCT ATGAGATGATCCAAG。
1.3.6 PDC、ADH酶活性检测
将果肉冻样用液氮研磨成粉末,称取8.00 g果肉后加入5 mL 0.1 mol/L MES-Tris提取缓冲液(含2 mmol/L DTT,4% PVPP,pH 6.5),冰浴研磨成匀浆,于10 000 r/min,4 ℃条件下离心30 min,收集上清液冰浴保存备用。PDC与ADH酶活性测定参照试剂盒操作,重复测定3次。
1.3.7 丙酮酸、乙醇、乙醛含量测定
丙酮酸含量采用2,4-二硝基苯肼法测定[18],略微改动:将果肉冻样用液氮研磨成粉末,称取8.00 g果肉后加入18 mL体积分数5%TCA,在冰上孵育20 min,随后于4 ℃,10 000 r/min离心15 min,上清液即为提取液。取酶提取物(400 μL)于试管中,加入2 mL DNPH(0.25 g 2,4-二硝基苯肼溶于1 mol/L HCl中)。将试管在37 ℃的水浴中温育10 min。然后加入2 mL 1.5 mol/L NaOH,通过涡旋混合,1 min后立即测定混合液在515 nm处的吸光度。
乙醇、乙醛含量参考OLIVEIRA[19]的方法测定,略有改动,取待测果肉用液氮研磨成粉末,精准称取3.00 g,加入2 mL饱和NaCl溶液,在40 ℃、200 r/min下温育10 min后,顶空萃取20 min(fibre:CAR/PDMS),上机分析。色谱柱:DB-WAX;进样温度240 ℃,氦气(He)流速1 mL/min,柱温30 ℃,保持7 min,以20 ℃/min升至200 ℃,保持5 min。质谱条件:EI,离子源温度230 ℃,四级杆温度150 ℃,质谱29~500 amu。
1.4 数据分析
采用Microsoft Excel 2016软件进行统计处理,采用SPSS 25.0软件的Duncan法进行显著性分析,采用Origin 8.0绘图。
2 结果与分析
2.1 外源褪黑素对‘爱媛38号’感官品质的影响
‘爱媛38号’果实在采摘后普遍果面明亮饱满、柑橘气味纯正、且酸甜可口、汁胞饱满、口感良好,经过60 d贮藏后,果实均明显出现果面微皱、果香减少、风味寡淡、口感下降、并伴随着枯水的现象。由表2可知,在贮藏结束时,MT组果实的新鲜度显著高于CK组(P<0.05),果实气味、水分含量、风味和口感与CK组无显著差异,其中MT组果实风味好于CK组。可见褪黑素处理‘爱媛38号’果实后,能够提高其风味并显著提高新鲜度,这可能是因为采后褪黑素处理延缓了果实的衰老[10]。
表2 贮藏结束时感官评价结果
Table 2 Sensory evaluation results at the end of storage
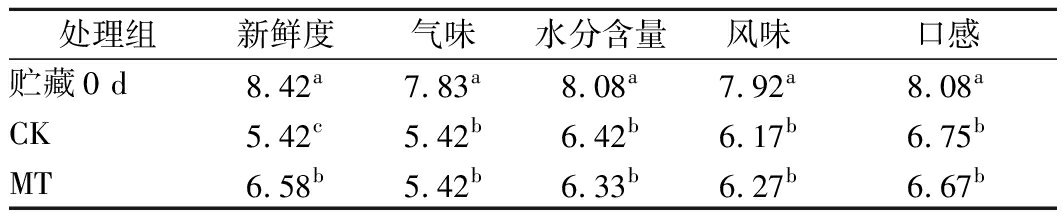
处理组新鲜度气味水分含量风味口感贮藏0 d8.42a7.83a8.08a7.92a8.08aCK5.42c5.42b6.42b6.17b6.75bMT6.58b5.42b6.33b6.27b6.67b
注:不同字母表示在P<0.05的水平上存在显著性差异。
2.2 外源褪黑素对‘爱媛38号’基本品质的影响
2.2.1 外源褪黑素对‘爱媛38号’可溶性固形物和可滴定酸的影响
可溶性固形物(total soluble solids,TSS)与可滴定酸(titratable acids,TA)是衡量果实风味和品质的重要指标之一[20]。如图1-A所示,在贮藏期间,果实TSS含量基本呈上升趋势,后期略有下调。CK组果实在贮藏前40 d时由初始8.9%上升至9.4%,在贮藏结束时降至9.05%。MT组果实在贮藏20 d时TSS含量最高,在贮藏20~60 d期间缓慢下降,贮藏60 d时,MT组果实的TSS含量为9.5%,在贮藏期间,MT组的TSS含量始终高于CK组,差异不显著(P>0.05)。
根据图1-B可知,果实的TA含量整体呈下降趋势。2组果实在贮藏10 d时的TA含量均有少许下降,随后在20 d时达到峰值后又逐渐降低。贮藏结束时,CK、MT组的TA含量分别为0.62%和0.56%,在整个贮藏期间,2组果实的TA含量变化趋势大致相同,且MT组的TA含量始终显著低于CK组。LIU等[21]用褪黑素营养液培育番茄后会提高番茄果实的TSS、TA含量,但在本次试验中外源褪黑素虽然可以提高‘爱媛38号’果实的TSS含量,TA含量却显著降低。杜天浩等[22]用褪黑素处理盐胁迫下的番茄后发现外源褪黑素可以显著提高果实TSS含量,但TA含量会因为褪黑素处理的浓度有所差异,可能是因为本试验中所用的褪黑素浓度不宜用于提高果实的TA含量。

图1 贮藏期间果实可溶性固形物含量(A)和可滴定酸含量(B)
Fig.1 Fruit soluble solid content (A) and titratable acid
content (B) during storage
注:不同字母表示在同一时期2组果实在P<0.05的水平上存在显著性差异。下同。
2.2.2 外源褪黑素对‘爱媛38号’Vc含量的影响
柑橘类水果是维生素C(Vitamin C,Vc)的重要供应来源,Vc能防止自由基的伤害,可提高人体免疫能力、防癌和机体应急能力,果实中的Vc含量是评价果实品质指标之一[23]。如图2所示,在贮藏期间Vc含量整体呈下降趋势,在贮藏10 d时,CK组的Vc含量高于MT组,随后CK组Vc含量迅速降低,而MT组缓慢增长,贮藏20 d时,CK组和MT组Vc含量为10.70、11.96 mg/100 mL。2组果实在贮藏40 d时Vc含量皆有所上升,在40~60 d时含量下降,至贮藏60 d时,CK组和MT组果实Vc含量分别为11.63、12.66 mg/100 mL,在贮藏20~60 d时,MT组果实显著高于CK组(P<0.05)。Vc是柑橘中主要的抗氧化物质之一[24-25],当果实内部氧化胁迫加强而Vc合成相关酶活性减弱时,Vc与活性氧离子发生反应后其含量也会有所下降,褪黑素同样具有清除活性氧自由基的作用[26]。所以推测可能是外源褪黑素参与了与活性氧之间的反应后减少了Vc的损耗,从而提高了果实的Vc含量。
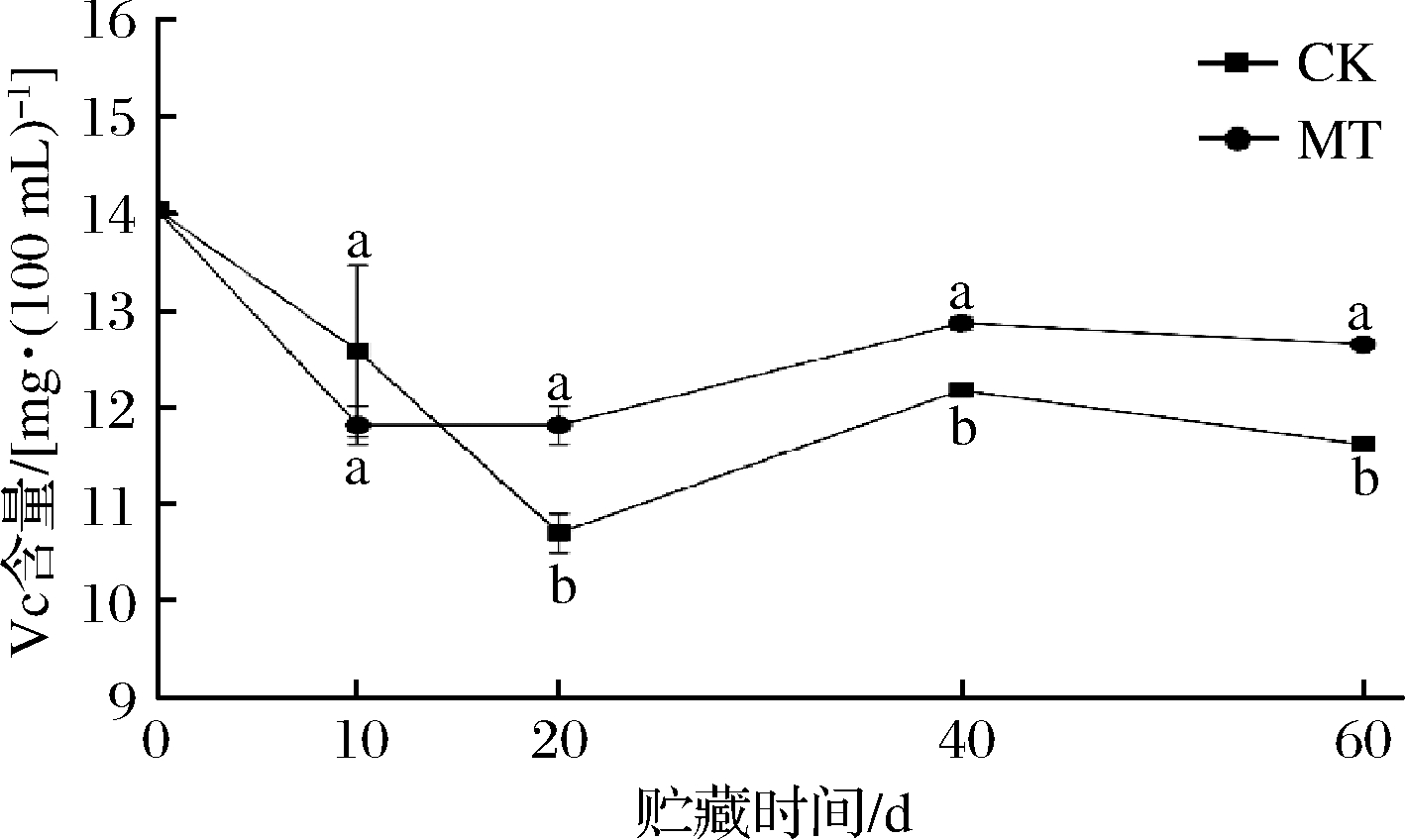
图2 贮藏期间果实Vc含量
Fig.2 Fruit ascorbic acid content during storage
2.2.3 外源褪黑素对‘爱媛38号’呼吸强度的影响
呼吸强度反映果实内部营养物质的消耗与果实整体的衰老情况,果实在贮藏期间呼吸强度随着时间延长而下降,并且果实的呼吸作用是影响柑橘风味劣变的原因之一[27]。如图3所示,果实呼吸强度整体呈下降趋势。在贮藏10 d时,果实呼吸强度下降明显,CK组果实呼吸强度低于MT组,贮藏20 d时,CK组果实呼吸强度上升至9.17 CO2 mg/(kg·h),MT组下降至8.69 CO2 mg/(kg·h),随着贮藏期的延长,果实呼吸强度在40 d时有1个明显的减弱,随后在60 d时趋向平缓,在贮藏20~60 d期间,MT组呼吸强度一直低于CK组,在贮藏结束时,果实呼吸强度最低,此时CK组、MT组果实呼吸强度分别为5.86、4.49 CO2·mg/(kg·h),贮藏期间2组果实的呼吸强度始终无明显差异(P>0.05)。辛丹丹等[28]报道了外源褪黑素处理可以抑制黄瓜贮藏过程中的呼吸速率,从而减少有机干物质的消耗,维护细胞膜的完整性,减缓了果实的衰老,褪黑素处理降低了‘爱媛38号’的呼吸强度,因此果实的衰老得以延缓,MT组果实在贮藏后仍维持了较好的新鲜度。
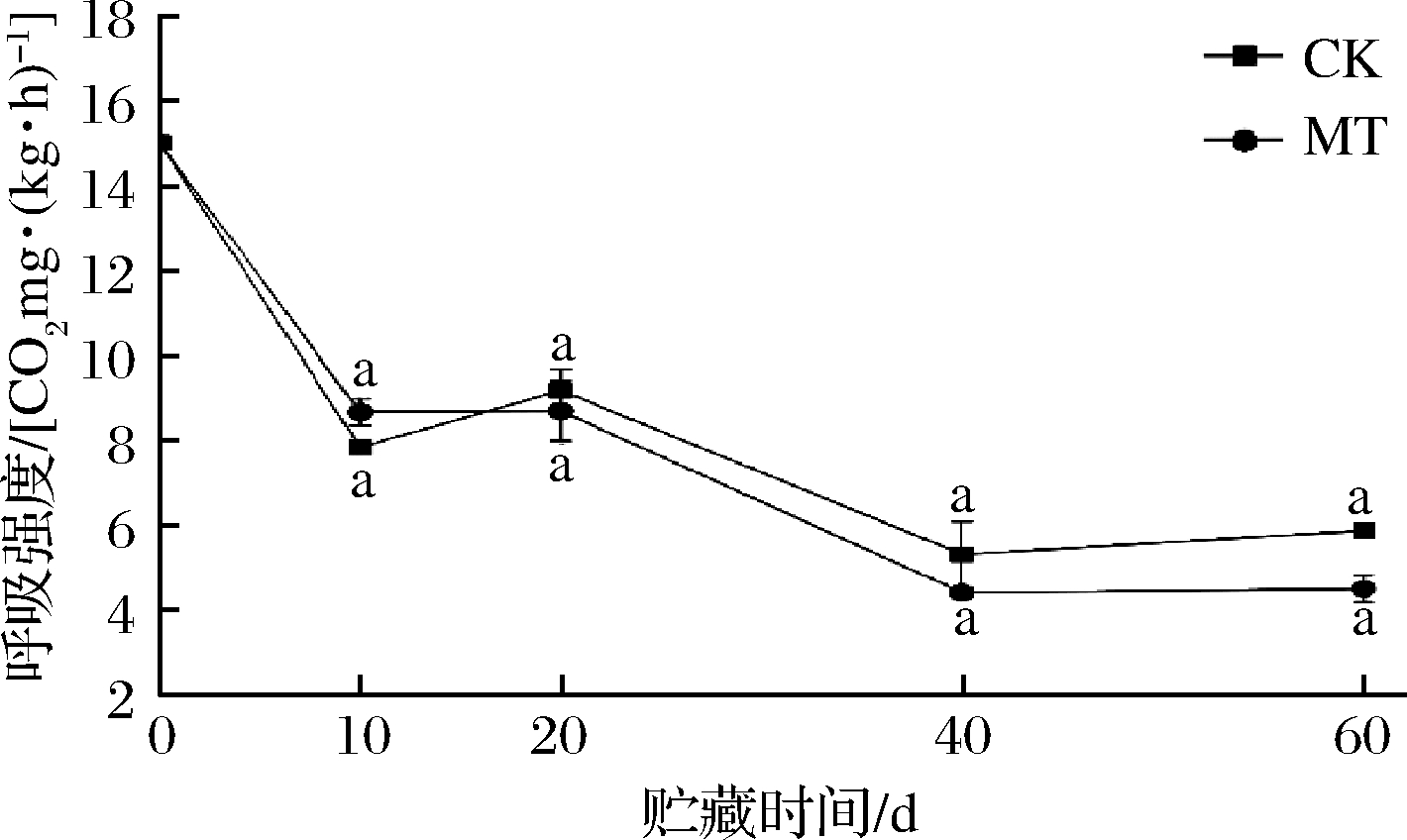
图3 贮藏期间果实呼吸强度
Fig.3 Fruit respiration intensity during storage
2.3 外源褪黑素对‘爱媛38号’乙醇代谢的影响
2.3.1 Real-Time qPCR测定
果实采后进行无氧呼吸时会促进内部乙醇的积累,乙醇生成的反应主要有两步[29]:丙酮酸作为底物经过丙酮酸脱羧酶(pyruvate decarboxylase,PDC)催化生成乙醛,乙醛再经过乙醇脱氢酶(alcohol dehydrogenase,ADH)催化生成乙醇[6]。当PDC、ADH的基因表达量比较低时,果实采后的乙醇、乙醛含量积累也会受到抑制[30]。由图4-A可知,在贮藏期间果实中PDC基因相对表达量呈上升趋势,CK组果实在贮藏前20 d时,PDC基因相对基因表达量趋于平稳状态,在贮藏20 d后CK组的PDC基因相对表达量开始上调,在60 d时CK组的PDC基因相对表达量是初始的2.70倍。而MT组在贮藏前40 d时的PDC基因相对表达量都比较稳定,在40 d时剧增,贮藏结束时MT组果实的PDC基因相对表达水平是初始的2.37倍,在40、60 d时,CK组的PDC基因相对表达水平显著高于MT组(P<0.05)。图4-B表明,在贮藏20 d时CK组果实ADH基因表达量最低,在20 d后ADH基因相对表达水平上调达到峰值,为初始的3.13倍,在贮藏结束时降至1.74倍。MT组果实在贮藏10 d时ADH基因相对表达量有所减少,随后在20 d时上升至1.05,显著高于CK组(P<0.05),而后波动性上升,60 d时ADH基因相对表达量为初始的1.35倍,在40、60 d时,MT组果实的ADH基因相对表达量显著低于CK组(P<0.05)。SUN等[31]报道了褪黑素在番茄的花青素合成期间会促进PDC基因表达与果实成熟,同时也有研究[32]表明番茄采后用50 μmol/L褪黑素处理会使ADH基因表达上调,这可能是由于褪黑素在植物不同阶段起的生长调节作用不同,同时推测不同植物对褪黑素的感受机制可能存在差异性。

图4 贮藏期间PDC(A)、ADH(B)的基因表达量
Fig.4 Relative expression of PDC(A) and
ADH (B) during storage
2.3.2 外源褪黑素对‘爱媛38号’PDC、ADH酶活性的影响
PDC、ADH的酶活性升高会促进乙醛、乙醇的生成[33]。由图5-A可知,果实的PDC酶活性在贮藏期间先下降后上升,在贮藏40 d后趋向平缓。在贮藏20 d时,CK组、MT组果实PDC酶活性最低,分别为9.02、8.08×10-3 U/(g·FW),随后二者酶活性差距逐渐缩小,在60 d时,PDC酶活性基本相同。贮藏期间,MT组果实PDC酶活性始终低于CK组,差异不显著。由图5-B可知,在贮藏期间CK组果实ADH酶活性呈波动性下降趋势,MT组果实在贮藏前20 d酶活性下降迅速,随后逐渐趋向平稳。在贮藏10 d时CK组果实ADH酶活性显著高于MT组,随后CK组和MT组果实ADH酶活性下降,在20 d时2组果实ADH酶活性最低。在20~60 d,CK组先上升随后下降,而MT组果实ADH酶活性缓慢上升,在贮藏期间CK组果实的ADH酶活性始终高于MT组,并在10、40 d时差异显著(P<0.05)。乙醛、乙醇积累时通常伴随着PDC、ADH酶活性的提高[34],而外源褪黑素处理可以使果实的PDC、ADH酶活性降低,可以抑制丙酮酸向乙醛、乙醇转化。

图5 贮藏期间PDC酶活性(A)、ADH酶活性(B)变化
Fig.5 Changes in PDC enzyme activity (A) and ADH enzyme activity (B) during storage
2.3.3 外源褪黑素对‘爱媛38号’丙酮酸、乙醛和乙醇含量的影响
植物在呼吸作用时会先通过糖酵解将糖氧化分解生成丙酮酸[35],在无氧呼吸作用下,丙酮酸会向乙醛、乙醇转化而减少其含量。由图6-A可知,2组果实的丙酮酸含量一直处于波动状态,并且在0~20 d时波动最大。CK组与MT组果实丙酮酸含量在贮藏10 d时最低,分别为31.08、33.04 μg/g,在20 d时剧烈增长至50.04、60.60 μg/g,此时果实丙酮酸含量达到最高值,2组间差异显著(P<0.05)。在20~60 d果实丙酮酸含量先减少后增加,40 d时MT组果实丙酮酸含量显著高于CK组(P<0.05),在贮藏结束时丙酮酸含量上调,2组间差异不显著,且贮藏期间MT组果实丙酮酸含量始终高于CK组。推测可能是因为PDC、ADH基因表达受到抑制后,酶活性降低,丙酮酸向乙醛、乙醇的转化受到抑制,导致丙酮酸含量上调。
果实内部的乙醇代谢直接影响乙醇和乙醛的积累水平,而且柑橘在贮藏期间,果实中的乙醇、乙醛浓度会随贮藏期延长而不断变化[36]。如图6-B可知,贮藏期间果实中的乙醛含量整体呈上升趋势。在10~20 d时CK组果实乙醛含量先上升后下降,在20 d时为0.03 mg/g,随后乙醛含量持续上升,至贮藏结束时,达到0.10 mg/g;贮藏前40 d时MT组果实乙醛含量一直增加,贮藏结束时缓慢降至0.06 mg/g,40 d时,MT组果实乙醛含量显著高于CK组(P<0.05),但CK组在贮藏后期增长剧烈,贮藏60 d时,CK组果实乙醛含量是MT组的1.58倍。如图6-C所示,贮藏期间果实的乙醇含量先上升随后下降,随后持续上升,总体呈波动上升的状态。贮藏10 d时,CK组、MT组果实乙醇含量分别0.47、0.28 mg/g,在20 d时下降至0.33、0.25 mg/g,在20~40 d时2组乙醇含量均增长了约0.1 mg/g,在贮藏40 d后,CK组果实乙醇含量增长剧烈,在贮藏结束时达到0.89 mg/g,约为MT组的2.09倍,在贮藏期间,2组果实间的乙醇含量均有显著差异(P<0.05)。研究表明,与常温贮藏相比,低温贮藏能够显著减少柑橘果实中乙醇的积累量[37],而在本研究中,采后褪黑素处理能够进一步减少柑橘在低温贮藏过程中乙醇的积累。

图6 贮藏期间果实的丙酮酸(A)、乙醛(B)和乙醇(C)含量
Fig.6 Contents of pyruvate (A), acetaldehyde (B) and ethanol (C) during storage time
3 结论
综合以上结果表明,‘爱媛38号’果实经过褪黑素处理后,能够显著提高贮藏期果实的新鲜度,果实风味也得到一定改善。在贮藏结束时,经褪黑素处理后的果实与对照组相比,可溶性固形物含量提高了0.45%,Vc含量提高了1.37 mg/100 mL,并且褪黑素处理果实后可以抑制果实的呼吸强度,减少可滴定酸含量从而提高果实的固酸比。测定发现‘爱媛38号’经褪黑素处理后果实中PDC、ADH的酶活性和基因相对表达量会受到抑制,导致丙酮酸含量累积,乙醛、乙醇含量减少。在贮藏60 d后,经褪黑素处理过的果实与对照组相比乙醇含量减少了52.21%,乙醛含量减少了36.85%。由此可见,使用质量浓度为1.0 g/L的褪黑素溶液处理‘爱媛38号’可以延缓果实衰老,提高果实贮藏期品质,并通过抑制PDC和ADH两个基因相对表达量进而降低酶活性,最终减少乙醛、乙醇的积累,延缓贮藏期间柑橘果实异味的产生。
[1] HAGENMAIER R D.The flavor of mandarin hybrids with different coatings[J].Postharvest Biology and Technology,2002,24(1):79-87.
[2] 张百超,陈秀伟,冯叙桥,等.柑桔果实采后主要生理病害的研究[J].中国果品研究,1992(3):5-7.
[3] UMMARAT N, ARPAIA M L, OBENLAND D,Physiological,biochemical and sensory characterization of the response to waxing and storage of two mandarin varieties differing in postharvest ethanol accumulation[J].Postharvest Biology and Technology, 2015, 109:82-96.
[4] TIETEL Z, LEWINSOHN E,FALLIK E,et al.Importance of storage temperatures in maintaining flavor and quality of mandarins[J].Postharvest Biology and Technology, 2011,64(1):175-182.
[5] RON PORAT,BATIA WEISS,LEA COHEN,et al.Effects of polyethylene wax content and composition on taste, quality, and emission of off-flavor volatiles in ‘Mor’ mandarins[J].Postharvest Biology and Technology,2005,38(3):262-268.
[6] 贾营.1-MCP处理对美味猕猴桃采后果实品质及乙醇代谢的影响[D].杭州:浙江工商大学,2018.
[7] ZOU Jian,CHEN Jing,TANG Ning,et al.Transcriptome analysis of aroma volatile metabolism change in tomato (Solanum lycopersicum) fruit under different storage temperatures and 1-MCP treatment[J].Postharvest Biology and Technology,2018,135:57-67.
[8] WEI Shuwei,QIN Gaihua,ZHANG Huping,et al.Calcium treatments promote the aroma volatiles emission of pear (Pyrus ussuriensis ‘Nanguoli’) fruit during post-harvest ripening process[J].Scientia Horticulturae,2017,215:102-111.
[9] 陶慧敏,董欣,万琪.褪黑素治疗原发性头痛的研究进展[J].临床神经病学杂志,2019,32(1):72-74.
[10] 滕梅芳,李红梅,林晓辉,等.褪黑素在园艺产品保鲜中的研究进展[J].仲恺农业工程学院学报,2018,31(4):61-64.
[11] WU Chunlai,TAN Dunxian,REITER, et al.Natural variation in banana varieties highlights the role of melatonin in postharvest ripening and quality[J].Journal of Agricultural and Food Chemistry,2017,65(46):9 987-9 994.
[12] LIU Changhong,ZHENG Huanhuan,SHENG Kangliang,et al. Effects of melatonin treatment on the postharvest quality of strawberry fruit[J].Postharvest Biology and Technology,2018,139:47-55.
[13] LIN Yunlong,FAN Liqin,XIA Xuehan,et al. Melatonin decreases resistance to postharvest green mold on citrus fruit by scavenging defense-related reactive oxygen species[J]. Postharvest Biology and Technology,2019,153:21-30.
[14] 欧阳翠兰,姚新玲.‘爱媛38号’杂柑在湘北地区的引种表现及优质栽培技术要点[J].湖南林业科技,2017,44(4):96-98.
[15] OBENLAND D,COLLIN S,MACKEY B,et al.Storage temperature and time influences sensory quality of mandarins by altering soluble solids, acidity and aroma volatile composition[J].Postharvest Biology and Technology, 2011, 59(2): 187-193.
[16] 食品安全国家标准食品中抗坏血酸的测定:GB 5009.86—2016[S].北京:中国标准出版社,2016.
[17] 张桂.果蔬采后呼吸强度的测定方法[J].理化检验(化学分册),2005(8):596-597.
[18] ANDREIA P, OLIVERIRA,LUIS R, et al.Determination of low molecular weight volatiles in Ficus carica using HS-SPME and GC/FID[J].Food Chemistry,2010,121(4):1 289-1 295.
[19] ZIPORA TIETEL,EFRAIM LEWINSOHN,ELAZAR FALLIK,et al.Importance of storage temperatures in maintaining flavor and quality of mandarins[J].Postharvest Biology and Technology,2011,64(1):175-182.
[20] DAVID OBENLAND,SUE COLLIN,BRUCE MACKEY,et al.Determinants of flavor acceptability during the maturation of navel oranges[J].Postharvest Biology and Technology,2009,52(2):156-163.
[21] LIU Jianlong,ZHANG Ruimin,SUN Yunkuo,et al.The beneficial effects of exogenous melatonin on tomato fruit properties[J].Scientia Horticulturae,2016,207:14-20.
[22] 杜天浩,周小婷,朱兰英,等.褪黑素处理对盐胁迫下番茄果实品质及挥发性物质的影响[J].食品科学,2016,37(15):69-76.
[23] 陈云,黄维妮,游嘉悦,等.不同浸泡方式对柠檬中维生素C含量的影响[J].海峡预防医学杂志,2019,25(1):14-16.
[24] 张越,胡文忠,管玉格,等.鲜切果蔬抗氧化物质生物合成机制的研究进展[J].食品与发酵工业,2019,45(4):236-241.
[25] NICHOLAS S, BOTANICAL B. The function and metabolism of ascorbic acid in plants[J]. Annals of Botany,1996,78(6):9.
[26] MICHAEL OSEI APPIAH,HE Beibei,LU Wenfa,et al.Antioxidative effect of melatonin on cryopreserved chicken semen[J].Cryobiology,2019,89:90-95.
[27] SHI Feng,SUH J H,GMITTER F G,et al.Differentiation between the flavors of sweet orange (Citrus sinensis) and mandarin (Citrus reticulata)[J].Journal of Agricultural and Food Chemistry,2017:acs.jafc.7b04968.
[28] 辛丹丹,司金金,张若曦,等.外源褪黑素处理对黄瓜采后冷藏期抗冷性的影响[J].西北农林科技大学学报(自然科学版),2018,46(9):108-114;120.
[29] TIETEL ZIPORA,LEWINSOHN EFRAIM,FALLIK ELAZAR,et al.Elucidating the roles of ethanol fermentation metabolism in causing off-flavors in mandarins.[J].Journal of Agricultural and Food Chemistry,2011,59(21):11 779-11 785.
[30] 李盼盼,钟雨,戚雯烨,等.美味猕猴桃‘布鲁诺’果实贮藏过程中乙醇代谢与挥发性成分的变化[J].果树学报,2016,33(7):865-873.
[31] SUN Qianqian,ZHANG Na,WANG Jinfang,et al.A label-free differential proteomics analysis reveals the effect of melatonin on promoting fruit ripening and anthocyanin accumulation upon postharvest in tomato.[J].Journal of Pineal Research,2016,61(2):138-153.
[32] SUN Qianqian,ZHANG Na,WANG Jinfang,et al.Melatonin promotes ripening and improves quality of tomato fruit during postharvest life[J].Journal of Experimental Botany,2015,66(3):657-668.
[33] 李会会,草莓和杨梅果实乙醇积累机理及腐烂预测模型研究[D].南京:南京农业大学,2012.
[34] EDNA P.The role of the anaerobic metabolites, acetaldehyde and ethanol, in fruit ripening, enhancement of fruit quality and fruit deterioration[J].Postharvest Biology and Technology,2005,37(1):1-19.
[35] 潘俨.库尔勒香梨果实发育及采后糖代谢与呼吸代谢关系的研究[D].新疆:新疆农业大学,2016.
[36] 何义仲,陈兆星,刘润生,等.不同贮藏方式对赣南纽荷尔脐橙果实品质的影响[J].中国农业科学,2014,47(4):736-748.
[37] DAVID O,SUE C,JAMES S,et al.Mandarin flavor and aroma volatile composition are strongly influenced by holding temperature[J].Postharvest Biology and Technology,2013,82:6-14.