橙汁因其独特的风味和丰富的营养深受消费者喜爱,据统计,2017-2018年度全球橙汁产量达到170万t,其销量为全球果汁销量的46%,中国在该年度生产橙汁4.4万t,同时进口橙汁5.5万t[1],因此,橙汁在中国具有巨大的发展空间。血橙因其含有丰富的花色苷而使果汁颜色鲜红,同时花色苷具有抗氧化、降血脂、预防心血管疾病、抗癌等保健功能[2-5],另外,血橙汁还含有丰富的维生素C(VC)、总酚、黄酮等营养成分,但这些物质都极不稳定,易受环境影响发生改变,进而影响橙汁色泽、风味、口感等,严重影响血橙汁的商品价值。因此,研究血橙汁在加工及贮藏中品质的变化对解决血橙汁加工难的问题具有重要意义。
杀菌是橙汁加工过程中必不可少的操作单元,不同的杀菌方式可造成血橙汁营养成分发生不同程度的改变,尤其是对血橙汁中那些具有保健作用但性质极不稳定的相关成分影响更为显著,因此,选择良好的杀菌方式对保证血橙汁的品质至关重要。目前橙汁主要采用热处理杀菌,但其加热温度高、时间长,对果蔬汁这类热敏性物质的色泽、香气及营养成分具有一定的破坏作用[6],而微波杀菌是热效应和非热效应共同作用的结果,与传统加热相比,其加热速度是传统加热方式的3~5倍,具有时间短、能耗低、低温、杀菌彻底的特点[7],因此,本文采用传统热杀菌和微波杀菌2种方式对血橙汁进行杀菌处理,研究血橙汁贮藏过程相关理化指标的变化规律及抗氧化成分与抗氧化能力之间的相关性,确定较佳的杀菌方式,为血橙汁加工工艺优化提供参考。
1 材料与方法
1.1 材料与试剂
供试血橙:采摘于重庆市农业科学院果树基地。
福林酚,合肥巴斯夫生物科技有限公司;橙皮苷标准品,南京森贝伽生物科技有限公司;ABTS,合肥博美生物科技有限责任公司;DPPH,天津西玛科技有限公司;没食子酸、甲醇、二甘醇、柠檬酸、NaOH、乙醇、过硫酸钾、KCl、HCl、醋酸钠等,成都市科龙化工试剂厂,且均为分析纯。
1.2 仪器与设备
EX324ZH型电子分析天平,上海上天精密仪器有限公司;GL-12A型高速冷冻离心机,山海菲恰尔分析仪器有限公司;紫外可见分光光度计,上海元析仪器有限公司;HH-4型电子恒温水浴锅,常州国华电器有限公司;2000E-4橙汁专用全自动榨汁机,南通荣慧机械有限公司;EG823EC3-NS1微波炉,美的微波电器制造有限公司;BCD-649WADV冰箱,青岛海尔股份有限公司。
1.3 实验方法
1.3.1 材料处理
血橙→清洗→晾干→榨汁(橙汁专用全自动榨汁机)→过滤(200目)→灌装(250 mL)→杀菌(80 ℃ 15 min、微波800 W、90 s)→冷却→ 4 ℃贮藏→指标测定
1.3.2 指标测定
可溶性固形物:采用手持糖度计直接测定。
还原糖:参照《GB/T 5009.7—2008》;
VC:参照《GB 5009.86—2016》;
可滴定酸:参照《GB/T 12456—2008》;
花色苷:采用pH示差法[8],KCl与HCl配制pH 1.0缓冲液,醋酸钠与HCl配制pH 4.5缓冲液。移取1 mL血橙汁样品,分别用pH 4.5和pH 1.0的缓冲液稀释4倍,平衡20 min后,以蒸馏水做空白分别测定510 nm和700 nm下的吸光度,计算公式如下。
A=(A510-A700)pH=1-(A510-A700)pH=4.5
(1)
花青素含量T=(A×MW×DF×1000)/ε×l
(2)
式中:吸光值;MW,矢车菊素-3-葡萄糖苷的相对分子质量449.2 g/moL;DF,稀释倍数;ε,矢车菊素-3-葡萄糖苷的摩尔消光系数值26900。
总黄酮测定:参照《NY/T 2010—2011》;
总酚测定:参考《GB/T 8313—2008》和朱玉昌[9]的方法:取2 mL果汁于带塞试管中,加5 mL含1.2 mol/L盐酸的V(甲醇)∶V(水)=1∶1提取,旋涡振荡后于90 ℃处理2 h,每0.5 h振荡1次,冷却后用甲醇稀释至10 mL,待测。分别取工作液、水(空白)各0.3 mL于刻度试管中,分别加入2.5 mL福林酚(10%体积分数),摇匀,加入2 mL 75 g/L NaCO3溶液,用水定容至10 mL,放置1 h后于760 nm下测定吸光度。
(3)
式中:C,从标准曲线查出并计算样液中的总多酚质量浓度,mg/mL;V1,测定取用样液体积,mL;V2,取用样液总体积,mL。
DPPH自由基清除率测定[10]:取稀释50倍的血橙汁2 mL和0.2 mmol/L DPPH溶液2 mL摇匀,避光放置30 min,于517 nm处测定吸光度Ai。同时测定稀释50倍的血橙汁与溶剂乙醇各2 mL混合后的吸光度Aj,以及溶剂乙醇与0.2 mmol/L DPPH溶液各2 mL混合后的吸光度Ac。以乙醇为空白对照。
DPPH清除率![]()
(4)
ABTS自由基清除率测定[10]:取140 mmol/L过硫酸钾溶液440 μL,加入到7 mmol/L 25 mL的ABTS+自由基溶液混合,制备ABTS+自由基储备液溶液,避光反应12~16 h。测定前用无水乙醇将ABTS+自由基储备液溶液稀释吸光值为0.700±0.002(734 nm)。取ABTS+自由基稀释液4.8 mL与1.2 mL稀释50倍的血橙汁混合均匀,在室温下反应10 min后,于734 nm波长下测定吸光值A1。取1.2 mL蒸馏水加4.8 mL ABTS+自由基稀释液测定吸光值A0为空白。
ABTS+清除率![]()
(5)
1.3.3 数据分析
数据处理使用Microsoft Excel 2010;采用SPSS 22.0做统计分析并进行数据显著性分析(P<0.05为显著);所有试验均做3次重复测定。
2 结果与分析
2.1 血橙汁贮藏过程品质变化规律研究
2.1.1 血橙汁相关指标变化规律
血橙汁在4 ℃贮藏条件下的相关物质含量变化如表1所示。
表1 血橙汁贮藏过程相关物质变化规律
Table 1 Changes of correlative substances in blood orange juice during storage

贮藏时间/w可溶性固形物pH可滴定酸还原糖80 ℃微波80 ℃微波80 ℃微波80 ℃微波010.23±0.05a10.20±0.00a3.92±0.00a3.92±0.00a0.58±0.00a0.59±0.00a4.43±0.02a4.41±0.02a110.20±0.00a10.23±0.05a3.83±0.01a3.86±0.00b0.59±0.00a0.58±0.00a4.33±0.02a4.42±0.01b210.17±0.05a10.20±0.00a3.85±0.00a3.85±0.00a0.59±0.00a0.59±0.00a4.37±0.02a4.41±0.04a310.33±0.12a10.20±0.08a3.86±0.00a3.86±0.00a0.59±0.00a0.58±0.00a4.25±0.01a4.25±0.04a410.20±0.00a10.20±0.08a3.87±0.00a3.88±0.00a0.59±0.00a0.58±0.00a4.09±0.02a4.08±0.04a510.20±0.08a10.20±0.00a3.85±0.01a3.86±0.00a0.58±0.00a0.58±0.00a4.07±0.03a4.07±0.04a610.20±0.00a10.23±0.05a3.85±0.00a3.86±0.00a0.59±0.00a0.59±0.00a4.04±0.03a4.04±0.03a
注:同行中不同小写字母表示2种方法处理之间有显著性差异P<0.05。
在整个贮藏期间,可溶性固形物含量变化较小,基本保持在10.1~10.3,且2种杀菌方式没有显著性差异(P>0.05);pH值在贮藏第1周时下降比较明显,这可能是由于血橙汁中还原糖与氨基态化合物发生美拉德反应而形成还原醛酮,它们极易氧化成酸性物质[11],贮藏2周后保持稳定,变化较小,且2种杀菌方式整体没有显著性差异(P>0.05);可滴定酸含量在整个贮藏期变化较小,在0.58~0.59之间,且2种杀菌方式没有显著性差异(P>0.05);还原糖在贮藏前2周含量基本保持稳定,2~4周时含量急速下降,4~6周时含量又保持缓慢下降趋势,在贮藏中期时还原糖下降较明显,可能是还原糖因为参与美拉德反应、焦糖反应等而降低的表现,整个贮藏期,2种杀菌方式基本没有显著性差异(P>0.05)。
2.1.2 总酚含量变化规律
血橙汁在4 ℃贮藏条件下的总酚含量变化如图1所示,在贮藏前期,总酚含量有所增加,可能是由于灭菌加热处理,使多酚与果汁中其他大分子结合的非共价键发生变化,促使酚类物质从结合态中游离出来,从而增加了含量[9,12]。随着贮藏时间的延长,总酚含量开始下降,这可能是由于样品中的溶解氧所致,这些氧气在贮藏期间通过形成氧自由基而使酚类物质发生氧化导致含量下降[13]。从图1中可明显看到微波灭菌处理时,总酚下降速度低于80 ℃处理,且在整个贮藏过程,微波处理组总酚含量在总体上高于80 ℃处理组,更有利于酚类物质的保留。
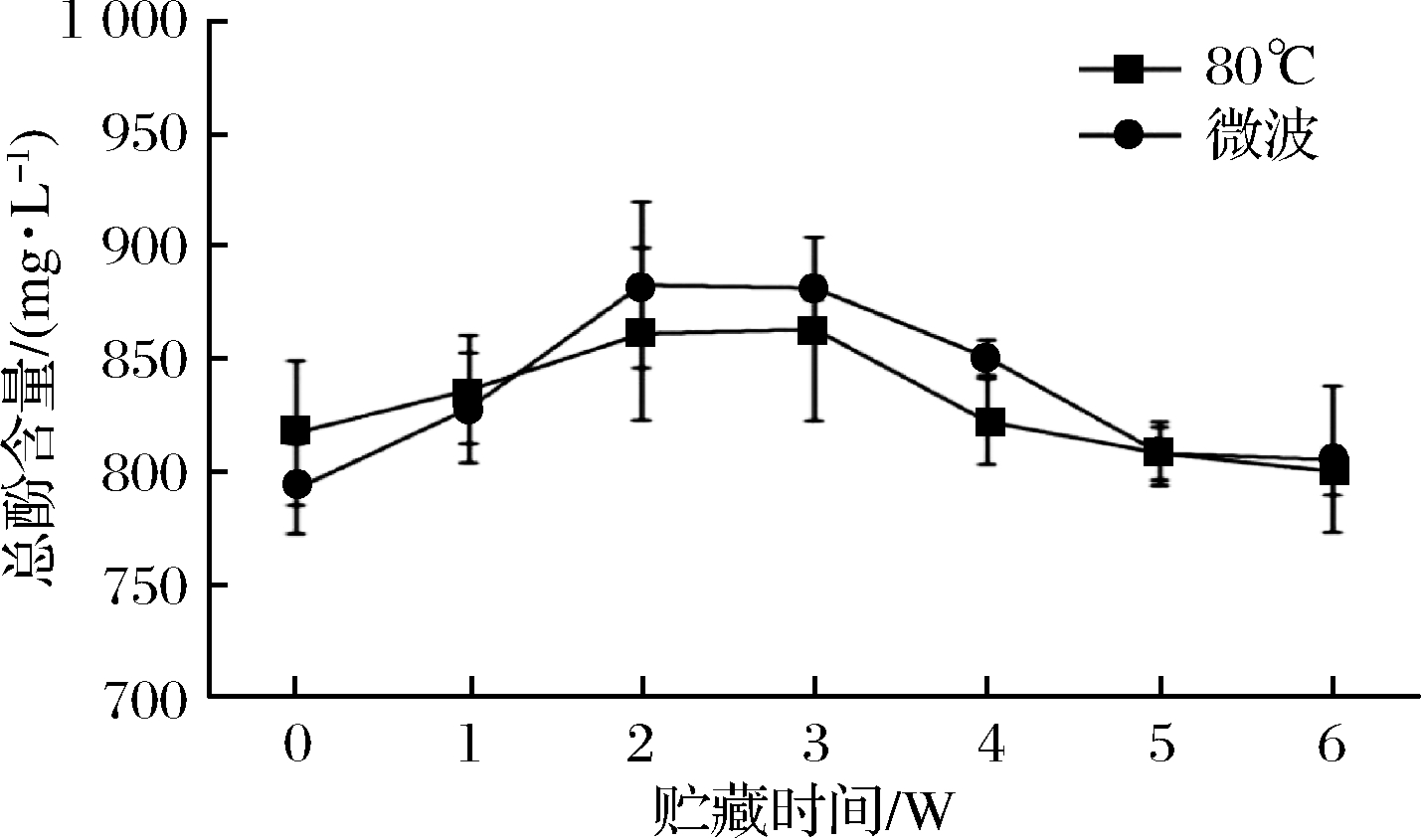
图1 贮藏过程总酚变化规律
Fig.1 Changes of total phenols during storage
2.1.3 总黄酮变化规律
在4 ℃贮藏条件下的血橙汁总黄酮含量变化如图2所示,总黄酮出现先降低后升高,再降低后再升高的现象,但总黄酮在整个贮藏期总体呈现出下降趋势。80 ℃处理时,总黄酮从贮藏初期到贮藏6 w时下降了5.80%,而微波处理时总黄酮下降了3.76%,更有利于总黄酮的保留。目前关于果蔬汁贮藏过程中总黄酮含量变化情况研究结论不一致,曾庆帅[14]对荔枝果汁研究表明在4 ℃贮藏条件下总黄酮含量总体下降2.9%,而25 ℃条件下先下降后升高,总体升高15.6%。刘晓辉等[15]研究甜玉米不同类型果汁总黄酮含量均呈现下降趋势。导致上述不同研究结果的原因可能是黄酮类物质之间的聚合及降解、物质相互转化,以及果蔬自身特性、加工方式、贮藏条件不同等,因此果蔬汁总黄酮含量及单体的变化规律及机理还有待进一步研究。
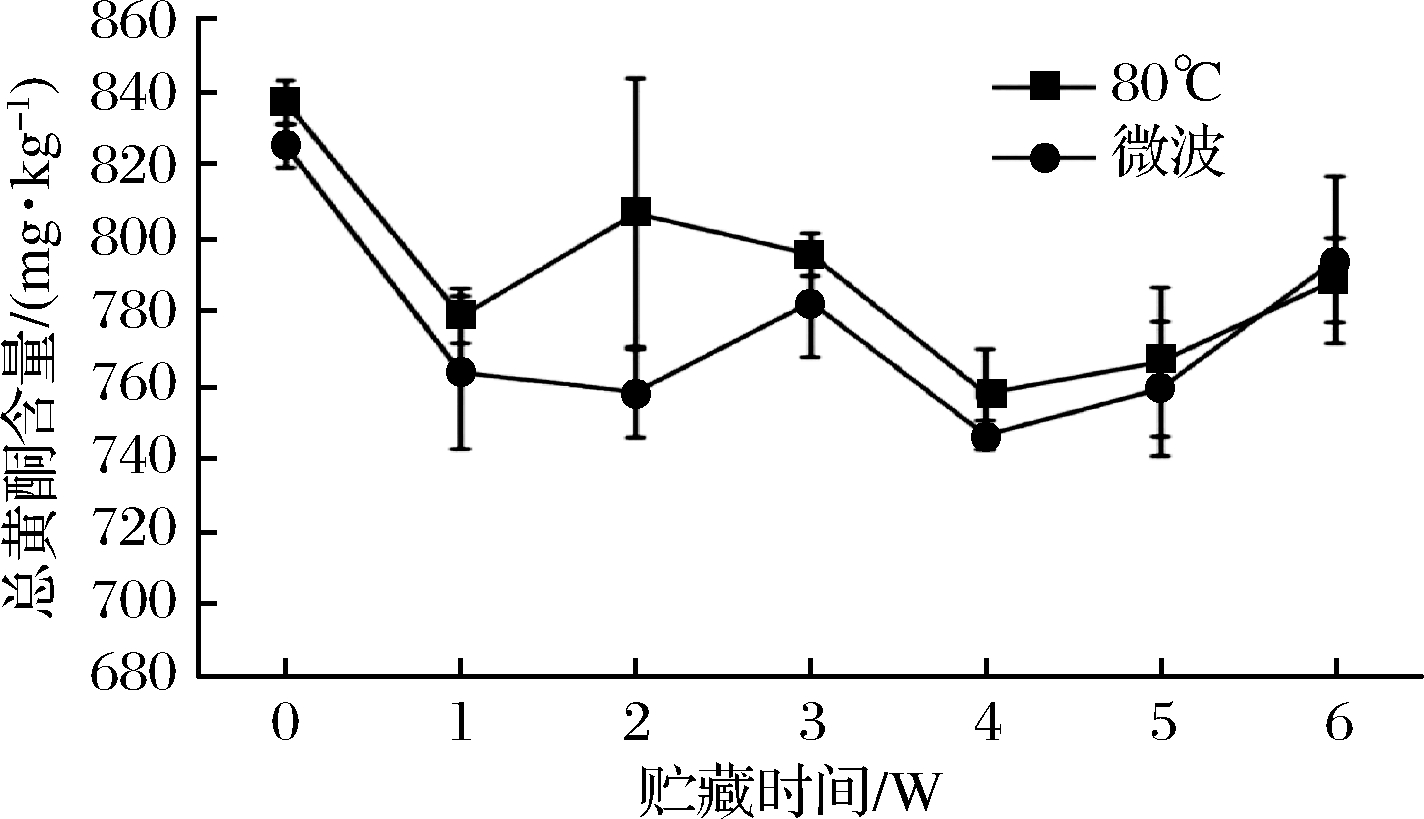
图2 贮藏过程总黄酮变化规律
Fig.2 Changes of total flavonoids during storage
2.1.4 花色苷变化规律
花色苷是血橙果肉呈色物质,是血橙独有的生物活性成分,也是决定血橙商品价值的关键因素,因此,花色苷是血橙鲜果及果汁产品质量控制的一个关键指标。但花色苷很不稳定,极易受温度、光照、pH、金属离子等影响而发生降解[16-17]。图3为4 ℃贮藏条件下花色苷含量变化趋势,在整个贮藏期间,花色苷呈现直线下降趋势,但微波处理组花色苷含量均高于80 ℃处理组,且差异显著(P<0.05)。贮藏6 w后,80 ℃处理组花色苷下降56.21%,微波处理组花色苷下降36.95%,说明在贮藏过程中花色苷损失严重,但微波损失程度小于80 ℃处理组,能更大限度的保留血橙汁中花色苷的含量。
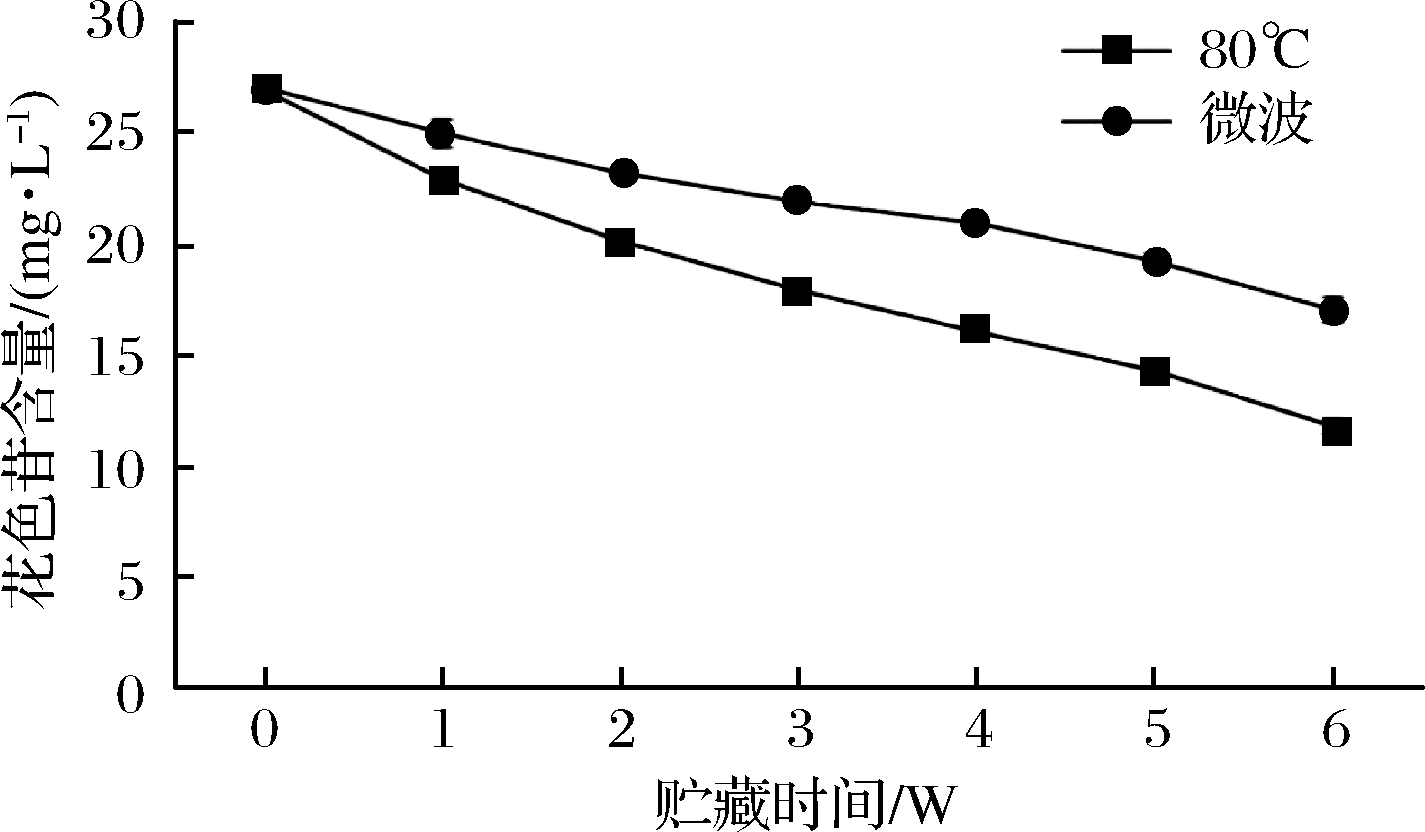
图3 贮藏过程花色苷变化规律
Fig.3 Changes of anthocyanins during storage
2.1.5 VC含量变化规律
VC是评价橙汁营养成分最主要的指标,其对不同的杀菌方式、贮藏时间、温度等都极为敏感,极易在加工贮藏环境下发生降解[18]。图4为不同杀菌方式下血橙汁在4 ℃贮藏条件下的VC含量变化,在整个贮藏期,VC含量呈直线下降趋势,且微波处理组VC含量一直高于80 ℃处理组,且差异显著(P<0.05)。在整个贮藏期间,80 ℃处理组VC含量下降了71.53%,而微波处理组VC含量下降了50.83%,说明在贮藏过程中VC极不稳定,损失严重,且高温长时热杀菌方法可加速VC损失,而微波损失程度小于80 ℃热杀菌,对VC降解有一定的抑制作用。
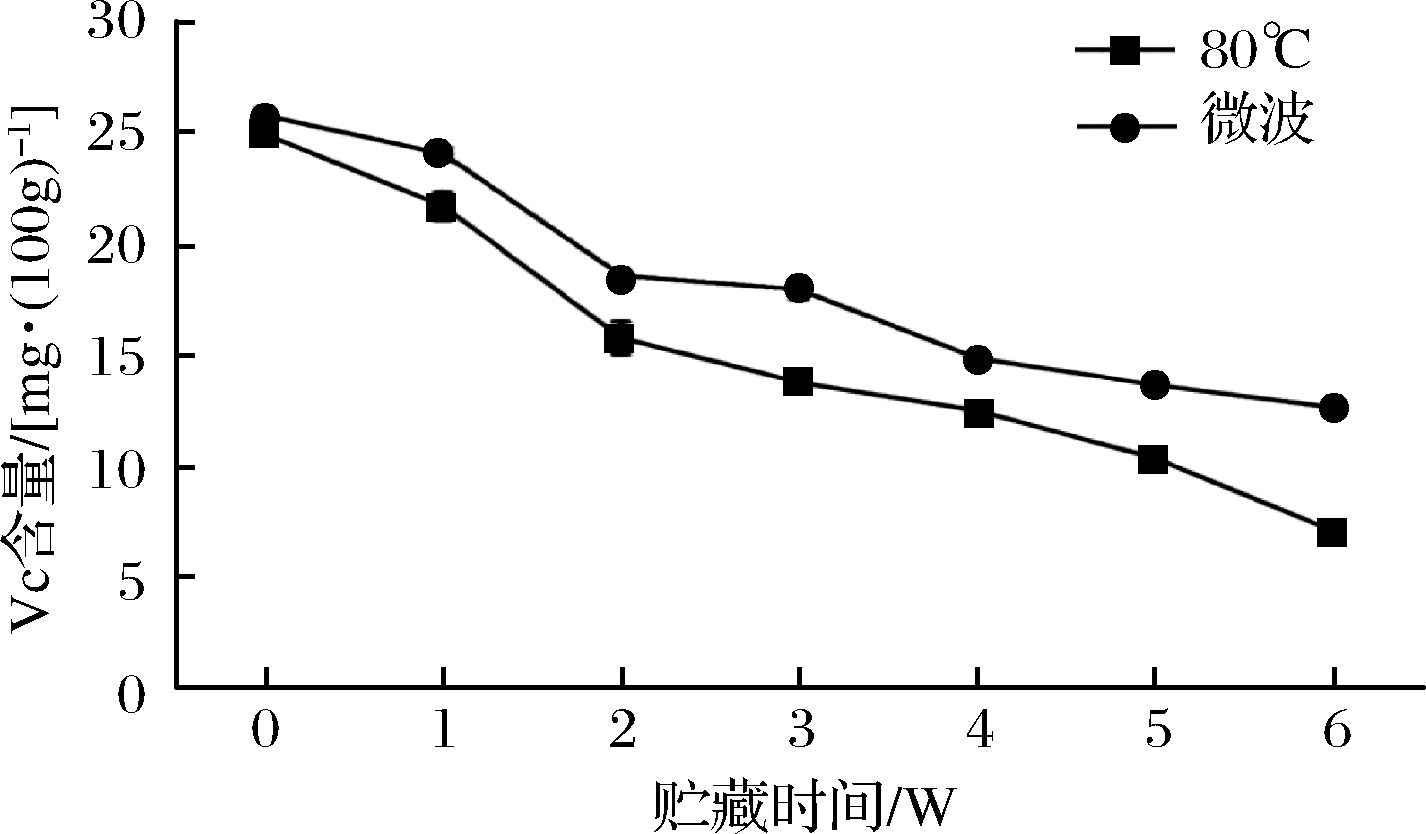
图4 贮藏过程维生素C变化规律
Fig.4 Changes of vitamin C during storage
2.2 血橙汁贮藏过程抗氧化能力的变化研究
血橙汁在4 ℃贮藏条件下的DPPH+和ABTS+抗氧化能力变化规律如图5所示。
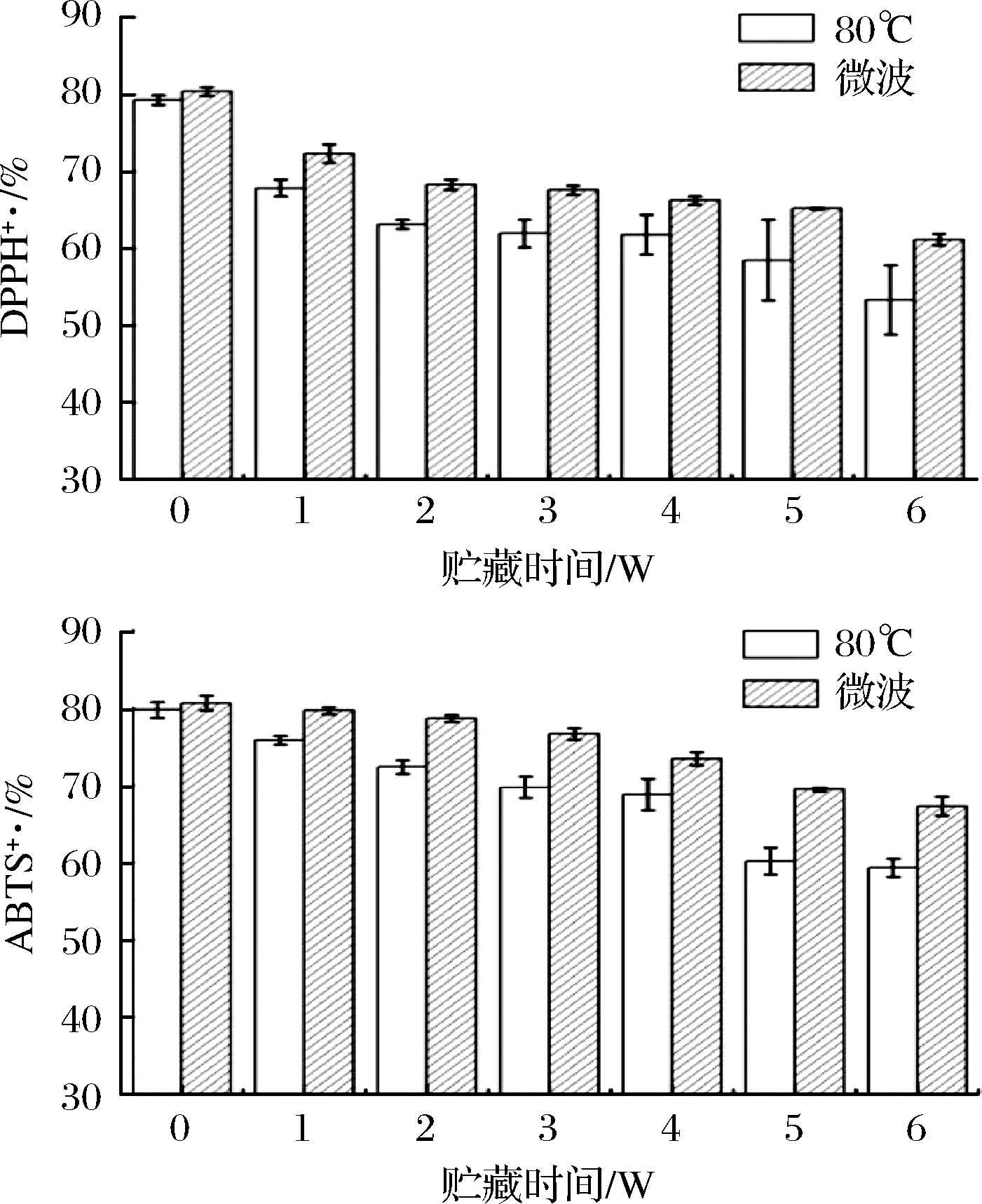
图5 贮藏过程DPPH+和ABTS+抗氧化能力变化规律
Fig.5 Changes of DPPH+ and ABTS+ antioxidant
activity during storage
在整个贮藏期间,80 ℃和微波2种杀菌处理中,DPPH+和ABTS+抗氧化能力都呈现出一直不断下降趋势,但整个贮藏期,微波杀菌处理组的抗氧化能力都高于80 ℃热处理组,可由图5分析得到,80 ℃、微波2组杀菌处理在整个贮藏期间DPPH+抗氧化能力分别下降32.73%、23.93%,ABTS+抗氧化能力分别下降25.60%、16.59%,2种抗氧化能力强弱顺序均为微波>80 ℃;表明微波杀菌对血橙汁中抗氧化成分破坏较小,抗氧化能力更强,杀菌效果优于80 ℃热处理。
2.3 抗氧化成分与坑氧化能力pearson相关性分析
由于血橙汁中的VC、总酚、黄酮、花色苷含量与抗氧化活性有关,进一步通过pearson相关系数分析,探究血橙汁中抗氧化成分与抗氧化活性之间的关系,结果如表2所示,不同杀菌条件下其相关的抗氧化活性成分与DPPH+、ABTS+抗氧化能力的相关性有一定差异。2种杀菌处理条件下,花色苷和VC的含量均与DPPH+、ABTS+抗氧化能力呈现出极显著的相关性,相关系数介于0.910~0.965之间,说明血橙汁中的花色苷和VC具有较强的抗氧化能力,对血橙汁抗氧化能力贡献较大;总酚和黄酮与DPPH+、ABTS+抗氧化能力也具有一定相关性,但相关性不显著。而国内外相关研究中,发现水果中的抗氧化能力与多酚含量呈现正相关[19-20],这与本研究结果不同,可能是水果及血橙汁中成分不同所造成,这有待进一步研究。
表2 抗氧化成分对ABTS+和DPPH+自由基清除率相关性分析
Table 2 Correlation analysis of free radical scavenging rate between ABTS+ and DPPH+ by antioxidant components
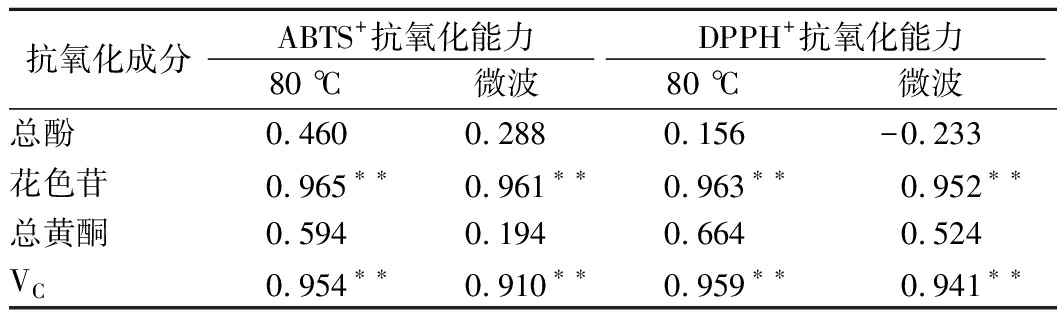
抗氧化成分ABTS+抗氧化能力DPPH+抗氧化能力80 ℃微波80 ℃微波总酚0.4600.2880.156-0.233花色苷0.965∗∗0.961∗∗0.963∗∗0.952∗∗总黄酮0.5940.1940.6640.524VC0.954∗∗0.910∗∗0.959∗∗0.941∗∗
注:*表示有显著性差异(P<0.05);**表示有极显著性差异(P<0.01)。
2.4 微波杀菌方式抗氧化成分与坑氧化能力通经分析
通过分析能够进一步找出自变量对因变量的直接影响和间接影响作用,比简单相关性分析更加深入的分析出自变量对因变量的实际作用效果[21],因此进一步采用通经分析微波杀菌方式下4种抗氧化成分,总酚、花色苷、总黄酮、VC分别对ABTS+和DPPH+自由基清除率的影响,结果见表3。
表3 抗氧化成分对ABTS+和DPPH+自由基清除率的通经分析
Table 3 DPS analysis of free radical scavenging rate between ABTS+ and DPPH+ by antioxidant components
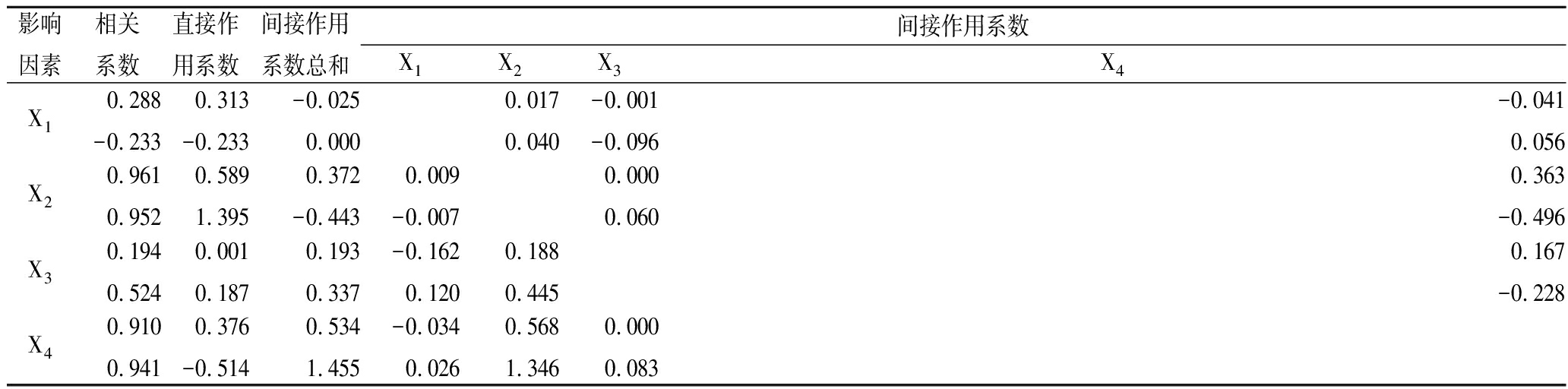
影响因素相关系数直接作用系数间接作用系数总和间接作用系数X1X2X3X4X10.288-0.2330.313-0.233-0.0250.0000.0170.040-0.001-0.096-0.0410.056X20.9610.9520.5891.3950.372-0.4430.009-0.0070.0000.0600.363-0.496X30.1940.5240.0010.1870.1930.337-0.1620.1200.1880.4450.167-0.228X40.9100.9410.376-0.5140.5341.455-0.0340.0260.5681.3460.0000.083
对直接通经的绝对值进行排序发现,对ABTS+和DPPH+两种抗氧化能力的顺序都是花色苷(X2)>VC(X4)>总酚(X1)>总黄酮(X3),从对ABTS+的通经分析系数看,X1表现为正效应,对ABTS+主要通过直接作用来表现;X2直接作用系数大于间接作用系数总和,主要通过直接作用来表现,也有部分是通过X4间接作用表现;X3直接作用系数远小于间接作用系数总和,主要是通过X2和X4间接作用表现;X4直接作用系数稍小于间接作用系数总和,说明X4主要通过直接作用表现和X2的间接作用来表现。对DPPH+的通经分析系数看,X1对DPPH+表现为负效应;X2对DPPH+的直接作用效应很大,远大于间接作用系数总和;X3对DPPH+为正效应,但还有很大部分通过X2的间接作用来表现;X4对DPPH+表现为负效应,直接作用系数远小于间接作用系数总和,且主要是通过X2的间接作用来表现。
3 结论
采用80 ℃热杀菌和微波杀菌技术对血橙汁进行比较分析可知,血橙汁中主要的抗氧化成分总酚、花色苷、黄酮、VC整体随着贮藏时间的延长呈现下降趋势,且微波处理组下降程度<热处理组,表明微波杀菌更有利于保持血橙汁营养成分;pearson相关性分析得出,花色苷和VC对ABTS+和DPPH+两种抗氧化能力均呈极显著的正相关;进一步对微波杀菌方式进行通经分析可知,对血橙汁抗氧化能力起直接作用的成分是花色苷,而总酚、黄酮、VC主要是通过花色苷的间接作用表现。
[1] 成传香, 王鹏旭,马亚琴,等.加工条件对橙汁香气物质的影响[J].食品与发酵工业,2019,45(6):262-268.
[2] KENT K, CHARLTON K E, NETZEL M, et al. Food-based anthocyanin intake and cognitive outcomes in human intervention trials:a systematic review[J]. Journal of Human Nutrition and Dietetics, 2017, 30(3): 260-274.
[3] DEVARAJ S, JIALAL I, VEGA-LOPEZ S.Plant sterol fortified orange juice effectively lowers cholesterol levels in mildly hypercholesterolemic healthy individuals[ J]. Arteriosclerosis Thrombosis and Vascular Biology,2004,24(3): E25-E28.
[4] THOMPSON K, PEDERICK W, SINGH I,et al.Anthocyanin supplementation in alleviating thrombogenesis in overweight and obese population: A randomized, double-blind, placebo-controlled study[J]. Journal of Functional Foods, 2017,32:131-138.
[5] 许胜, 屈达才,黄慧明,等. 花色素及其花色苷单体抗肿瘤活性研究进展[J]. 食品工业科技, 2016, 37(14):379-384.
[6] 李娅西, 邵先军,彭兆裕,等. 介质阻挡放电对橙汁灭菌及其品质的影响[J].高电压技术, 2012, 38(1):211-216.
[7] 樊伟伟, 黄惠华. 微波杀菌技术在食品工业中的应用[J]. 食品与机械, 2007, 23(1):143-147.
[8] 吕春玲, 姜绍通,沈鸿,等. 浓缩对桑葚汁营养品质的影响[J]. 饮料工业, 2015,18(5):8-13.
[9] 朱玉昌. 橙汁抗氧化活性成分及总抗氧化能力的研究[D].重庆:西南大学, 2006.
[10] 张碧莹, 唐玲,张静,等. 不同加工方式对甘薯汁品质及抗氧化活性的影响[J]. 食品与发酵工业, 2017,43(12):157-163.
[11] 曹少谦, 刘亮,潘思轶. 血橙果汁贮藏过程中品质变化研究[J]. 食品科学, 2011, 32(2):297-301.
[12] 田金辉, 许时婴,王璋. 热烫处理对黑莓果汁营养成分和多酚氧化酶活力的影响[J].食品与发酵工业, 2006, 32(4):133-137.
[13] 赵凤, 梅潇,张焱,等. 超高压和热杀菌对枸杞汁品质的影响[J].中国食品学报, 2018,18(3):169-178.
[14] 曾庆帅. 荔枝果汁加工和贮藏过程中酚类物质及抗氧化活性的变化[D].武汉:华中农业大学, 2011.
[15] 刘晓辉, 杨明,李芬飞. 甜玉米不同类型果汁活性物质动态研究[J]. 佛山科学技术学院学报(自然科学版), 2014,32(4):49-54.
[16] 曹少谦, 胡晓燕,潘思轶. 血橙花色苷稳定性研究[J]. 食品科技, 2010,35(12):242-249.
[17] MONDELLO L,COTRONEO A,ERRANTE G,et al. Determination of anthocyanins in blood orange juices by HPLC analysis [J].Journal of Pharmaceutical and Biomedical Analysis,2000, 23(1):191-195.
[18] 付陈梅. 杀菌贮藏过程中橙汁功能成分降解规律的研究进展[J]. 饮料工业, 2012, 15(6):11-14.
[19] PATRAS A, BRUNTON N, PIEVE S D, et al. Effect of thermal and high pressure processing on antioxidant activity and instrumental colour of tomato and carrot purées[J]. Innovative Food Science & Emerging Technologies, 2009, 10(1):0-22.
[20] LIU F, WANG Y, LI R,et al. Effects of high hydrostaticpressure and high temperature short time on antioxidant activity,antioxidant compounds and color of mango puree[J]. Innovative Food Science & Emerging Technologies,2014, 22(21):35-43.
[21] 季露, 郎娅,裘迪红,等. 不同柑橘品种果汁中抗氧化成分比较[J]. 宁波大学学报(理工版), 2016, 29(4):20-25.