在当今许多经济型干果树中,核桃具有良好持久的经济、社会和生态效益。核桃油生产占据了核桃加工产业的主要地位,但榨油后残余的核桃蛋白质利用率极低。在现有研究中指出,核桃仁含有丰富的核桃蛋白、脂肪酸、矿物质和维生素,具有延缓衰老、降低冠心病发病率、健脑益智、抑制炎症等作用。对核桃仁的营养分析得出,核桃仁含有约65%的油和18%~24%的蛋白质[1-2]。根据相关文献,核桃蛋白的蛋白质含量非常丰富,共有18种不同的氨基酸,其中谷氨酸含量最高,精氨酸次之[1]。而通过蛋白质水解得到的活性肽具有相对分子质量小、易吸收、无抗原性、避免耐药、经消化道进入人体后无副作用等优点。迄今,蛋白质水解后的多肽在功能特性与生物活性上都略胜一筹。例如溶解性、乳化性和起泡性都随着适宜水解逐渐增加。所以,各国科学家和政府对生物活性肽的研究也越来越重视[3],国内外对生物活性肽的研究发展进一步提升。
蛋白质的水解方式主要包括化学降解和酶法降解[4]。从100多年前就有学者提出化学降解这类研究办法,而化学法分为酸降解与碱降解,但酸碱反应条件较为剧烈。酸水解可破坏其中色氨酸,碱水解则使胱氨酸、半胱氨酸、精氨酸等受到损伤,还会引起氨基酸的外消旋化[5]。由此,酶法水解与化学法相比,具有效率高、条件温和等优点。在水解过程中,氨基酸的结构和构型保持不变,只破坏肽键,不产生有毒有害物质[6-7]。因此,采用酶解方法受到越来越多学者的青睐。
蛋白质水解度(degree of hydrolysis,DH)表示蛋白质分解即肽键断裂的程度,是破坏的肽键数目与底物中肽键总数的百分比[8]。蛋白质在水解过程中会酶解成多肽以及氨基酸,适度水解可保证多肽得率效果极佳,而过度水解则会增加氨基酸的生成量,可根据在水解过程中加入的NaOH量来计算,以保持水解过程中的pH恒定[9]。多肽含量测定针对蛋白质水解后溶液中多肽的生成量,常规测定方法主要有凯氏定氮法(Kjeldahl determination, KD) [10]、考马斯亮蓝(Bradford) 染色法[11]、双缩脲比色法(biuret assay, BA) [12]、Folin-酚试剂法(Lowry) [13]、紫外分光光度法(ultraviolet-spectrophotometric, UV-S)[14]。本研究采用双缩脲比色法进行测定。
响应面法(response surface method,RSM)将试验的目标响应值(如核桃多肽提取率)作为单个或多个试验因素(如酶解时间、酶解温度等)的目标函数,然后将上述函数关系通过多维图形进行表达,通过图形分析、函数求导等方式优化试验设计中的最佳条件[15]。响应面设计的最大优点是通过更少的实验次数和更佳的实验组合接近最优值。即采用响应面法对试验数据进行分析。
1 材料与方法
1.1 试验材料
核桃,四川省巴中市。
1.2 主要试剂
丁烷、NaOH、HCl、三氯乙酸(trichloroacetic acid, TCA)均为分析纯,成都市科龙化工试剂厂;胰蛋白酶、碱性蛋白酶、胃蛋白酶,上海瑞永生物科技有限公司。
1.3 仪器与设备
BT-423S分析天平,赛多利斯科学仪器(北京)有限公司;CBE-10L亚临界流体萃取设备,河南省亚临界生物技术有限公司;SHA-B振荡水浴锅,常州市金坛华伟仪器厂;101真空冷冻干燥机,上海跃进医疗机械厂;PHS-2C pH计,上海雷磁仪器公司;D-37520型高速冷冻离心机,美国Sigma公司;UV-1600型紫外分光光度计,北京瑞利分析仪器公司;ZN-200A高速中药粉碎机,长沙市岳麓区中南制药机械厂;移液枪,赛默飞世尔科技(中国)有限公司;HWS24恒温水浴锅,常州国华电器有限公司。
2 试验方法
2.1 核桃蛋白的制备
将核桃干燥后粉碎,采用亚临界丁烷萃取核桃油,重复3次,直至核桃油完全萃出,得到脱脂核桃粕。于4 ℃下低温冷藏备用。
将烘干的核桃脱脂粉按一定的的料液比分散在蒸馏水中,配制成质量分数为5%的核桃蛋白溶液。混合物用1 mol/L NaOH溶液调节至pH 8.5,55 ℃水浴搅拌2 h,8 000 r/min低温离心20 min,弃去沉淀,保留上清液,用1 mol/L HCl溶液调节pH 4.5,搅拌1 h,8 000 r/min低温离心20 min,沉淀用蒸馏水水洗至中性,调节pH至中性后,冷冻干燥24 h并储存在干燥器内备用。
2.2 核桃蛋白酶解液制备及预处理
查阅相关文献[16-18],按照各蛋白酶的最佳底物浓度称取一定量的核桃蛋白,加蒸馏水配制成相应浓度的蛋白溶液,于水浴锅中一定温度和时间预处理后,调至最适pH,加入一定量各蛋白酶,于各蛋白酶最适水解温度下反应一段时间,期间用1.0 mol/L的NaOH维持pH,酶解结束后放置于90 ℃水浴锅 10 min灭活终止反应,8 000 r/min低温离心20 min,保留上清液,测定水解度和多肽含量。
将上述试验方法作为基础,略作修改,得到木瓜蛋白酶、胰蛋白酶、碱性蛋白酶的最佳酶解条件如表1所示(%均表示为体积分数):
表1 每种蛋白酶的最佳酶解条件
Table 1 Optimal enzymatic hydrolysis conditions of each protease
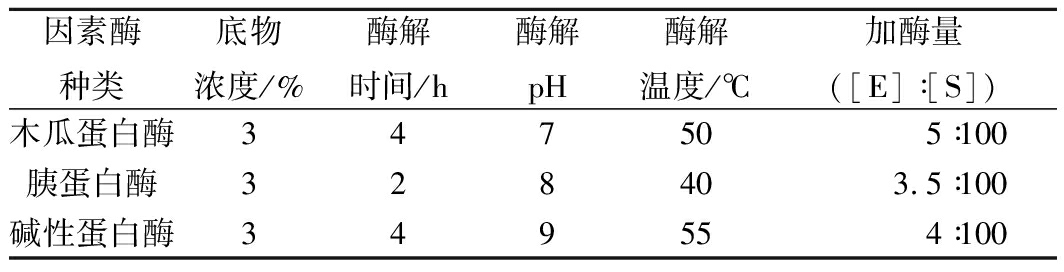
因素酶种类底物浓度/%酶解时间/h酶解pH酶解温度/℃加酶量([E]∶[S])木瓜蛋白酶347505∶100胰蛋白酶328403.5∶100碱性蛋白酶349554∶100
2.3 水解度的测定
采用pH-stat法测定核桃蛋白质的水解度,以滴定核桃蛋白所消耗标准NaOH溶液的体积计算水解度[19],如公式(1)所示。
(1)
式中:DH,水解度;B,最适pH时所消耗NaOH的体积,mL;Nb,标准NaOH浓度,mol/L;Mp,加入水解蛋白质含量,g;htot,蛋白质中肽键的总数,mmol/g蛋白,本文核桃蛋白的htot为8.0 mmol/g;α,水解过程中核桃蛋白中的α-氨基的解离度,计算如公式(2)所示:
(2)
式中:PK,水解过程中释放的氨基的平均离解值,取决于温度、肽链长度和末端氨基酸的性质。
2.4 多肽含量的测定
2.4.1 标准曲线的测定
依照相关试验方法[20-21],略作修改后测定蛋白水解液中多肽含量。准确量取体积分数5% TCA配制的0、0.2、0.4、0.6、0.8、1.0、1.2、1.4 mg/mL Gly-Gly-Tyr-Arg四肽标准溶液于6支10 mL容量瓶中,加水补至刻度线,取上述溶液各6 mL,然后加入双缩脲试剂4 mL,充分振荡摇匀后,室温孵育0.5 h,3 000 r/min离心5 min,于540 nm处测定吸光值。用第1支空白蛋白质溶液作为对照液。以蛋白质浓度为横坐标,吸光值为纵坐标,绘制标准曲线。
2.4.2 样品的测定
准确量取样品溶液2.5 mL,加入相同量的10% TCA水溶液,充分振荡均匀,室温孵育10 min,然后在3 000 r/min下离心15 min,将上清液用5% TCA水溶液定容至50 mL容量瓶中,充分振荡摇匀,后续操作按2.4.1进行,结果对照标准曲线求得样品溶液中的多肽含量(mg/mL)。
2.5 单因素试验设计
单因素分别选取酶解时间、酶解温度、酶浓度以及酶解pH,考察各因素对蛋白质水解度以及多肽含量的影响,确定碱性蛋白酶酶解核桃蛋白的最佳工艺。
2.5.1 酶解时间的影响
在酶解温度为50 ℃时,底物浓度为2%,酶解pH为7的条件下,探究酶解时间为2、3、4、5、6、7 h对蛋白质水解度以及多肽含量的影响。
2.5.2 酶解温度的影响
在酶解时间为5 h,底物浓度为2%,酶解pH为7的条件下,探究酶解温度为40、45、50、55、60、65 ℃对蛋白质水解度以及多肽含量的影响。
2.5.3 加酶量的影响
在酶解时间为5 h,酶解温度为50 ℃,酶解pH为7的条件下,探究加酶量为1%、1.5%、2%、2.5%、3%、3.5%对蛋白质水解度以及多肽含量的影响。
2.5.4 酶解pH的影响
在酶解时间为5 h,酶解温度为50 ℃,底物浓度为2%的条件下,探究酶解pH为4、5、6、7、8、9对蛋白质水解度以及多肽含量的影响。
2.6 响应面优化酶解工艺
在单因素试验中,酶解时间、加酶量、酶解温度以及酶解pH对多肽含量以及水解度影响较大,因此以单因素实验结果为根据,选取这4个因素进行响应面优化试验。以多肽含量为评价指标,确定响应面实验因素和水平,优化碱性蛋白酶酶解核桃蛋白的工艺条件,每组试验平行3次。按照Box-Behnken响应面试验设计原理确定最佳提取条件。试验设计中的因素水平编码见表2所示。
表2 响应面试验因素水平编码表
Table 2 Response surface test factor level coding table

水平因素加酶量/%酶解温度/℃酶解时间/h酶解pH-114536.0025047.0135558.0
2.7 数据处理
采用Design-Expert 9.0软件进行响应曲面分析,采用Origin 9.1软件进行线性回归分析及作图。
3 结果与分析
3.1 预处理测定结果
3.1.1 多肽标准曲线的绘制
以Gly-Gly-Tyr-Arg四肽的质量浓度为横坐标(mg/mL),其吸光度为纵坐标绘制标准工作曲线,得到Gly-Gly-Tyr-Arg四肽标准工作曲线如图1所示。线性回归方程为y=0.379 7x+0.017 4,相关系数R2为0.997 1,说明多肽质量浓度在0.02~1.6 mg/mL范围内与其吸光度呈良好的线性关系。
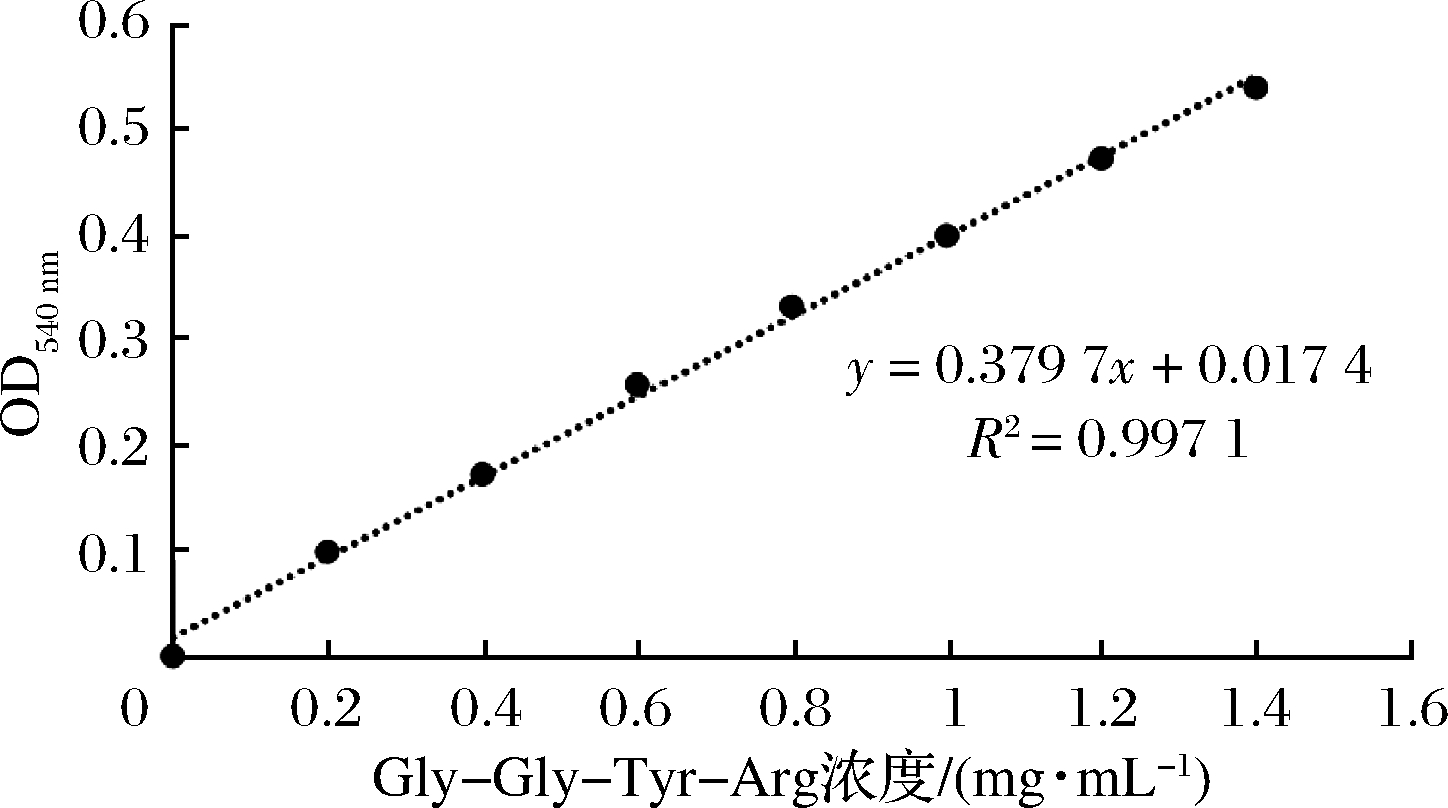
图1 Gly-Gly-Tyr-Arg四肽标准曲线
Fig.1 Gly-Tyr-Arg tetrapeptide standard curve
3.1.2 各蛋白酶水解度、多肽含量对比
木瓜蛋白酶归于巯基蛋白酶,它水解蛋白质和多肽中精氨酸和赖氨酸的羧基末端,优先水解肽键与肽键N端有2个羧基的氨基酸或芳香族L-氨基酸。根据图2、图3可知,碱性蛋白酶、中性蛋白酶和木瓜蛋白酶水解度分别为19.56%、11.70%和9.24%,多肽含量为2.210、1.936、1.812 mg/mL。在各蛋白酶的最佳作用条件下对比上述结果可知,碱性蛋白酶在水解度和多肽含量方面都略胜一筹,故选择其作为工艺优化的原料酶。
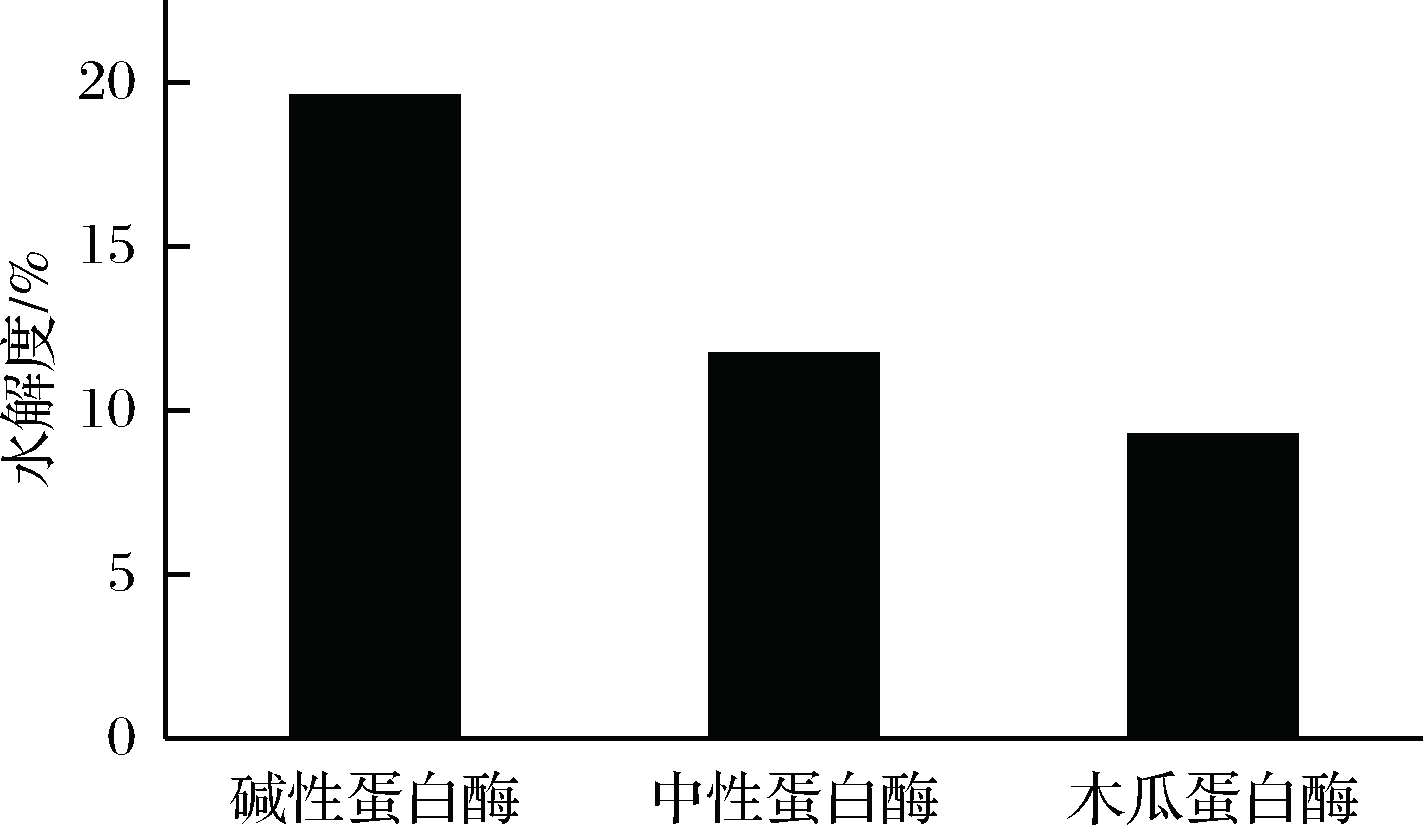
图2 各蛋白酶酶解核桃多肽水解度比较
Fig.2 Comparison of hydrolysis degree of walnut peptides hydrolyzed by proteases
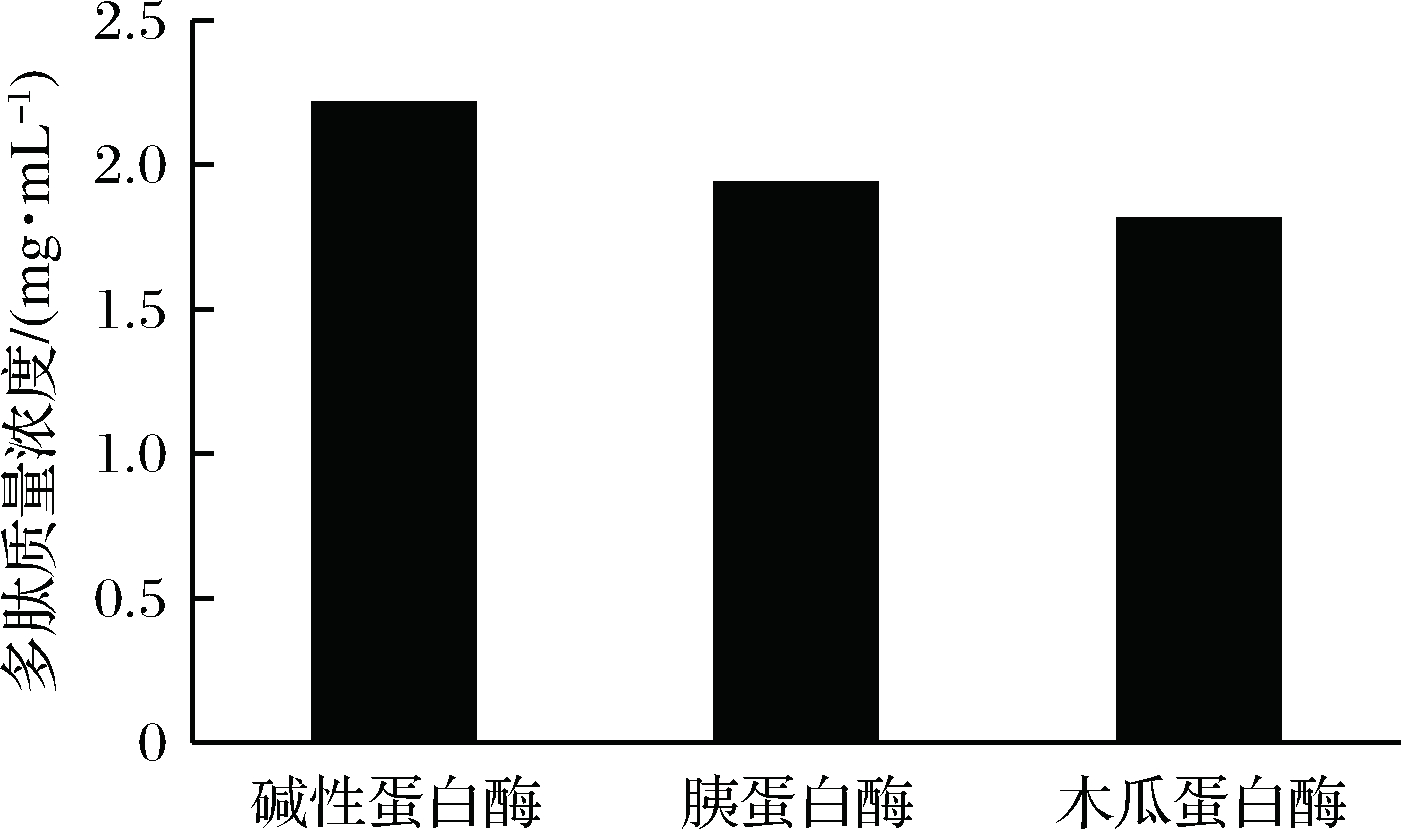
图3 各蛋白酶酶解核桃多肽含量比较
Fig. 3 Comparison of the contents of walnut peptides hydrolyzed by proteases
3.2 酶法提取核桃多肽含量单因素试验结果
3.2.1 加酶量对酶解反应的影响
将不同梯度碱性蛋白酶进行测定,得到不同加酶量条件下多肽质量浓度对比如图4所示。
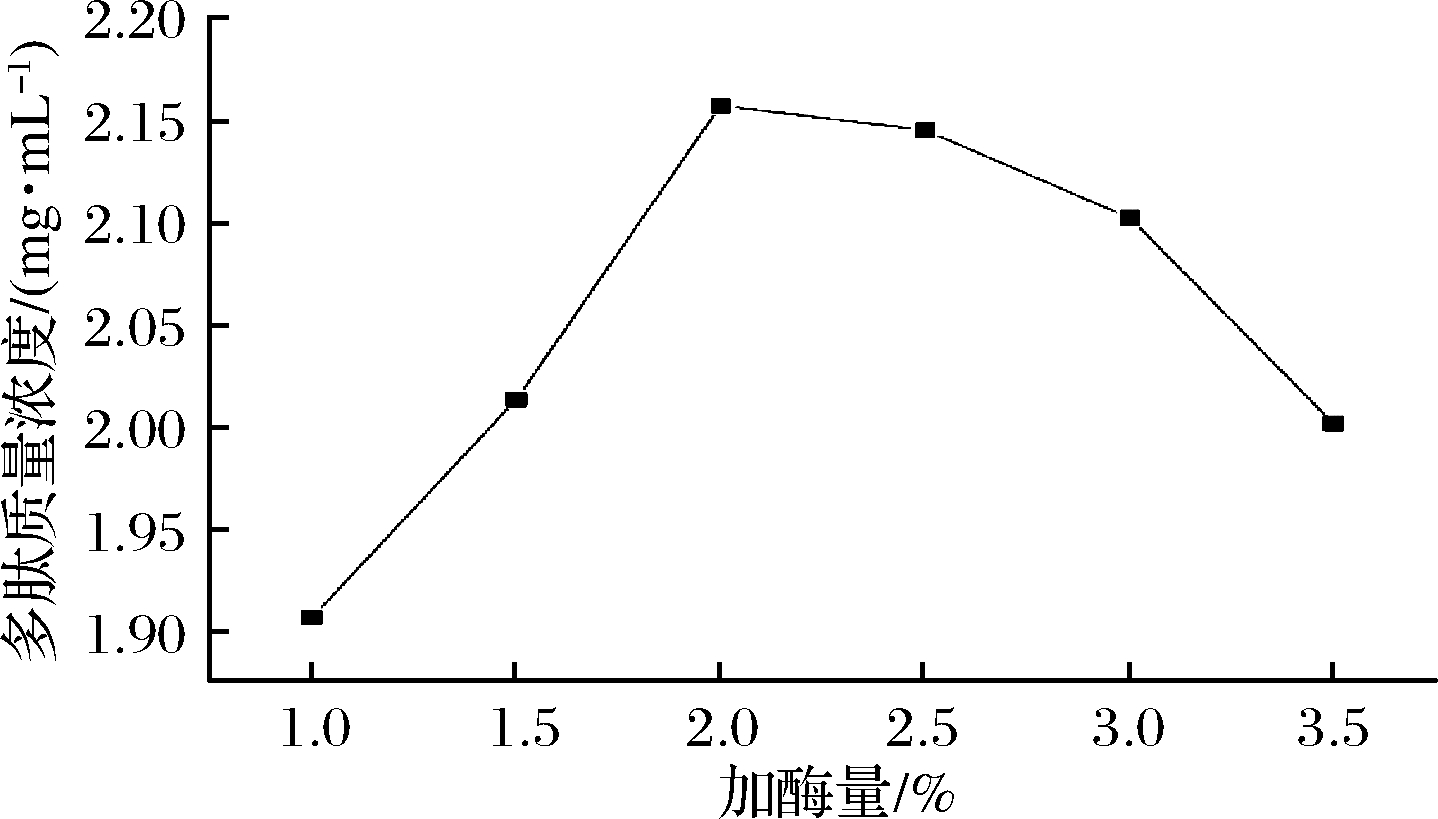
图4 加酶量对多肽浓度的影响
Fig.4 Effect of enzyme concentration on polypeptide concentration
由图4可知,碱性蛋白酶加酶量在1%~3.5%之间,随着加酶量的增加,核桃多肽含量增加,之后再增加酶量,其多肽含量逐渐降低。出现以上现象的原因可能是在核桃蛋白质酶解过程中,随着加酶量的增加,过多的酶分子抑制了中间产物向酶解反应终产物的转化。蛋白酶在一定范围内,随着加酶量的增加,酶与底物相互结合反应的能力随之加大,酶促反应速度迅速增加,多肽含量也随之快速增加。当酶量达到饱和后,过量的酶抑制酶解反应。以上现象说明不同的作用底物,其蛋白酶的最适添加量不同,人们一般选用酶最佳反应条件时,酶的利用率最高。
3.2.2 酶解时间对酶解反应的影响
将碱性蛋白酶不同酶解时间进行测定,得到不同酶解时间条件下多肽质量浓度对比如图5所示。
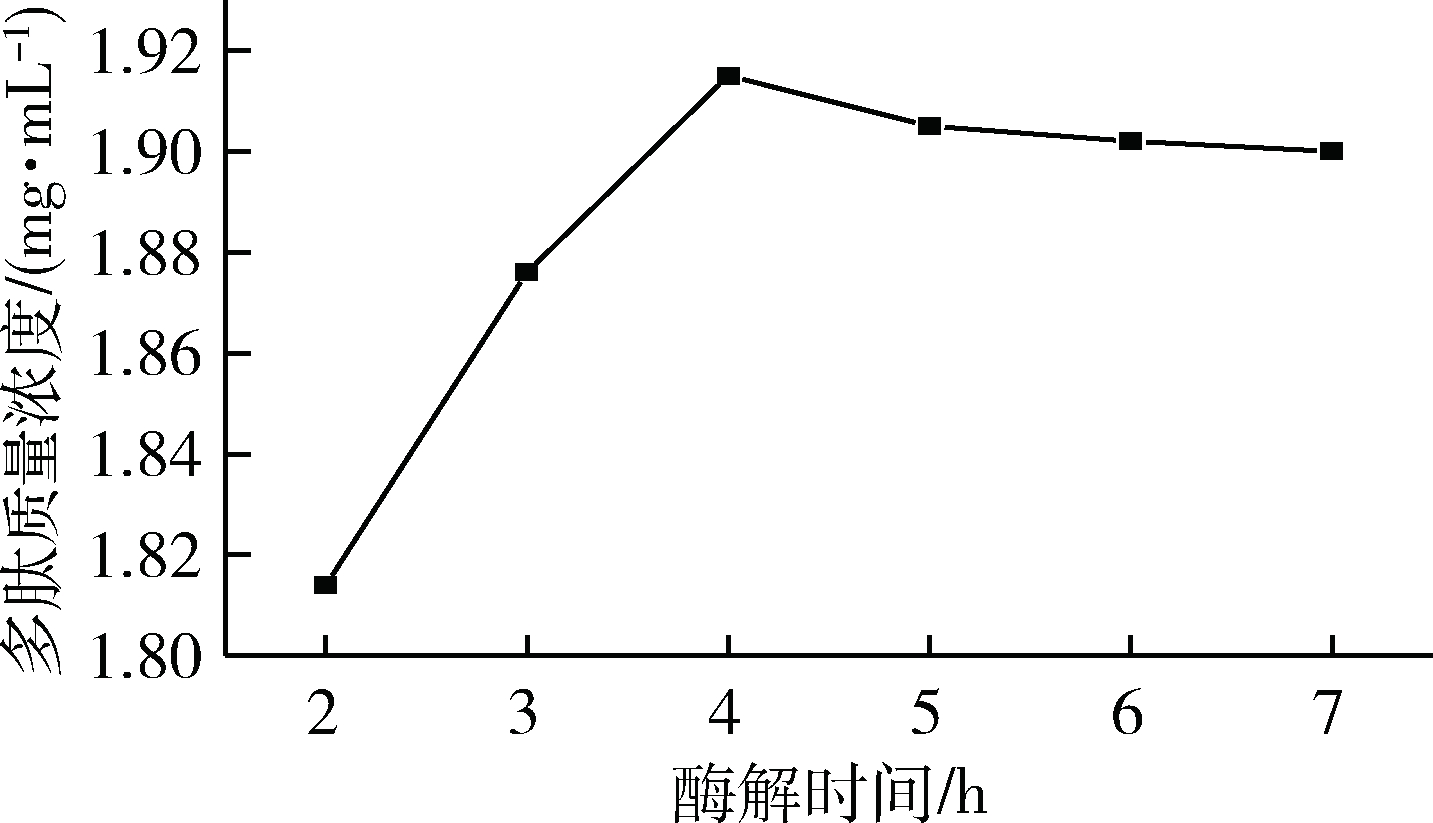
图5 酶解时间对多肽质量浓度的影响
Fig.5 Effect of enzymatic hydrolysis time on polypeptide concentration
由图5可以看出,适当的酶解时间有助于提高多肽质量浓度。在酶解时间2~4 h内,核桃多肽质量浓度随着时间增加而迅速上升,4 h之后,随着时间增加质量浓度反而呈下降的趋势。出现以上结果的原因可能是在较短时间内,底物与酶的接触反应时间较短,接触面积不够完全,整个溶液体系的流动性较小,限制了酶发挥作用,造成多肽并没有被充分酶解出来,而时间过长之后,底物与酶接触过大,溶液呈现过于饱和状态,酶解过度成为了寡肽。所以,选择pH 4作为最佳条件。
3.2.3 酶解pH对酶解反应的影响
将碱性蛋白酶按不同酶解pH进行测定,得到不同酶解pH条件下多肽质量浓度对比如图6所示。
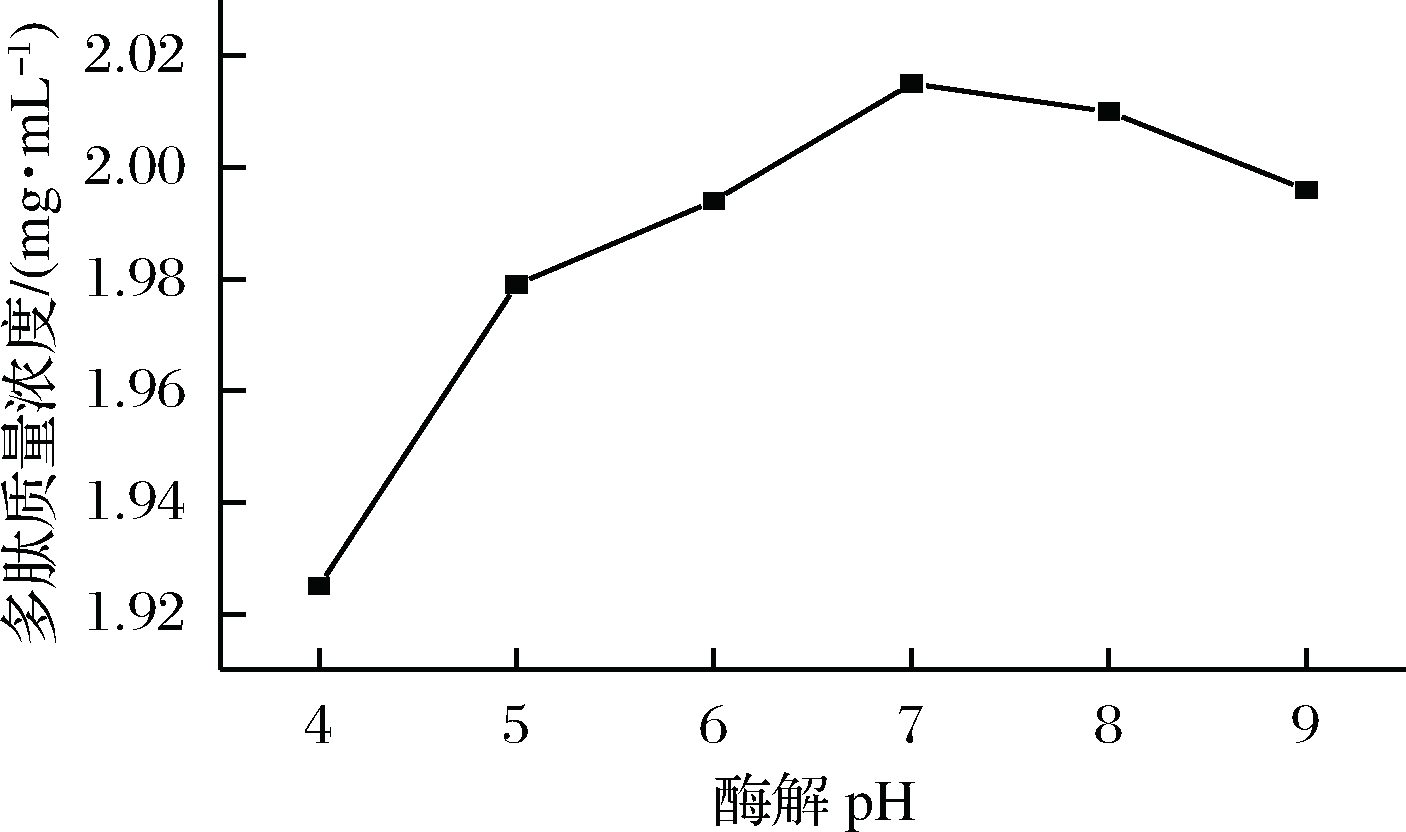
图6 酶解pH对多肽浓度的影响
Fig.6 Effect of enzymatic hydrolysis of pH on peptide concentration
根据图6的曲线走势可以看出,多肽浓度对于酶解pH是比较敏感的,多肽浓度最高的点位在pH 7。多肽浓度随着pH变化而变化,呈现先增大后减小的趋势,pH较高会使酶失活。酶自身的活性基团受酸碱值影响,pH的升降都会对其活性部位在酶解反应中产生的作用做出相应的改变。所以,综上,选择pH为7作为本实验最佳条件。
3.2.4 酶解温度对酶解反应的影响
将碱性蛋白酶按不同酶解温度进行测定,得到不同酶解温度条件下多肽质量浓度对比如图7所示。
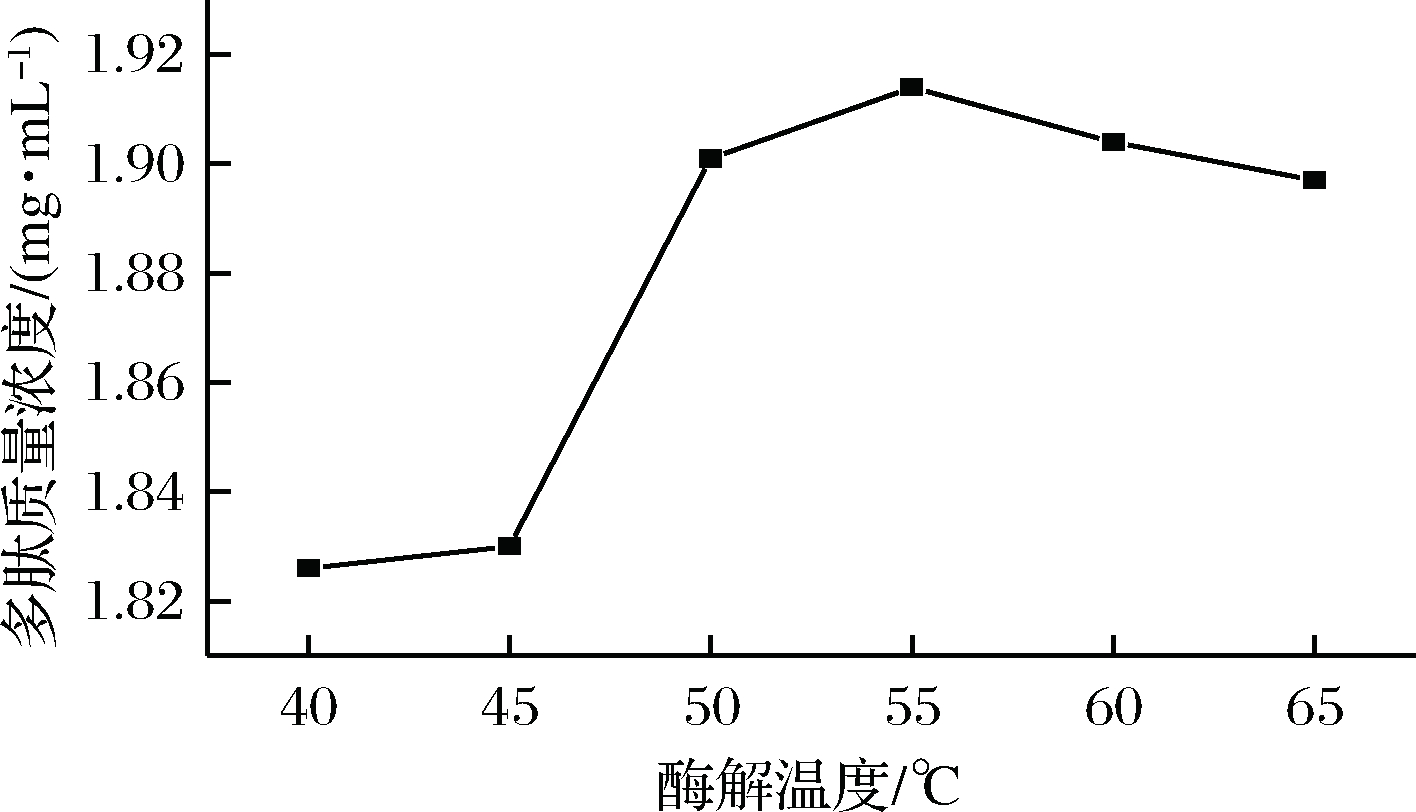
图7 酶解温度对多肽浓度的影响
Fig.7 Effect of enzymatic hydrolysis temperature on peptide concentration
当试验酶解温度从40 ℃开始逐渐增加时,溶液中多肽质量浓度也随之增加,在50 ℃~60 ℃之间,多肽的质量浓度无显著变化,但在55 ℃时多肽达到最高质量浓度。不同的酶作用的最适温度不同,过高或者过低都会降低酶解反应的效率,经试验,选择55 ℃作为最适温度。
3.3 响应面优化核桃多肽工艺
根据上述各单因素实验结果分析,选取四川薄皮核桃蛋白为实验材料,确定Box-Benhnken响应面优化实验因素水平。以加酶量(A)、酶解时间(B)、酶解温度(C)、酶解pH(D)为自变量,以反应过后所得多肽浓度为目标函数值,建立对应函数关系。采用Design-Expert 10统计软件进行响应面回归分析,回归方程的方差显著性检验分析结果见表3,响应面模型的方差分析见表4。
表3 响应面实验组合及结果
Table 3 Response surface experiment combination and results
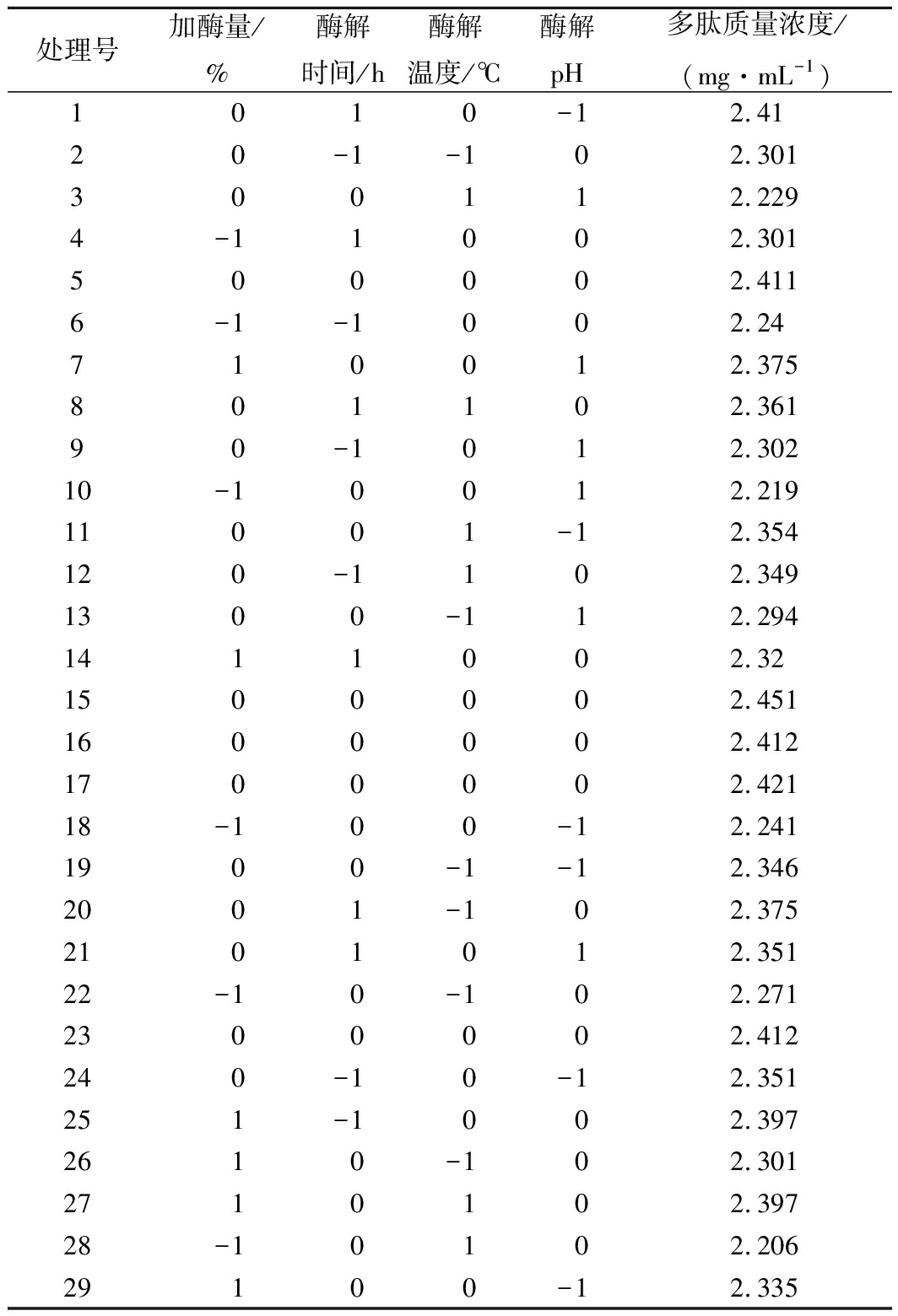
处理号加酶量/%酶解时间/h酶解温度/℃酶解pH多肽质量浓度/(mg·mL-1)1010-12.4120-1-102.301300112.2294-11002.301500002.4116-1-1002.24710012.375801102.36190-1012.30210-10012.21911001-12.354120-1102.3491300-112.2941411002.321500002.4511600002.4121700002.42118-100-12.2411900-1-12.3462001-102.3752101012.35122-10-102.2712300002.412240-10-12.351251-1002.3972610-102.3012710102.39728-10102.20629100-12.335
由表3的实验数据进行响应面分析,得到表4的方差分析表,并得到拟合方程
Y=2.42+0.054A+0.012B+4×10-3C-0.022D-0.035AB+0.040AC+0.016AD-5.5×10-3BC-2.5×10-3BD-0.018CD-0.076A2-0.025B2-0.059C2-0.051D2
表4 响应面模型的方差分析表
Table 4 Variance analysis table of response surface model
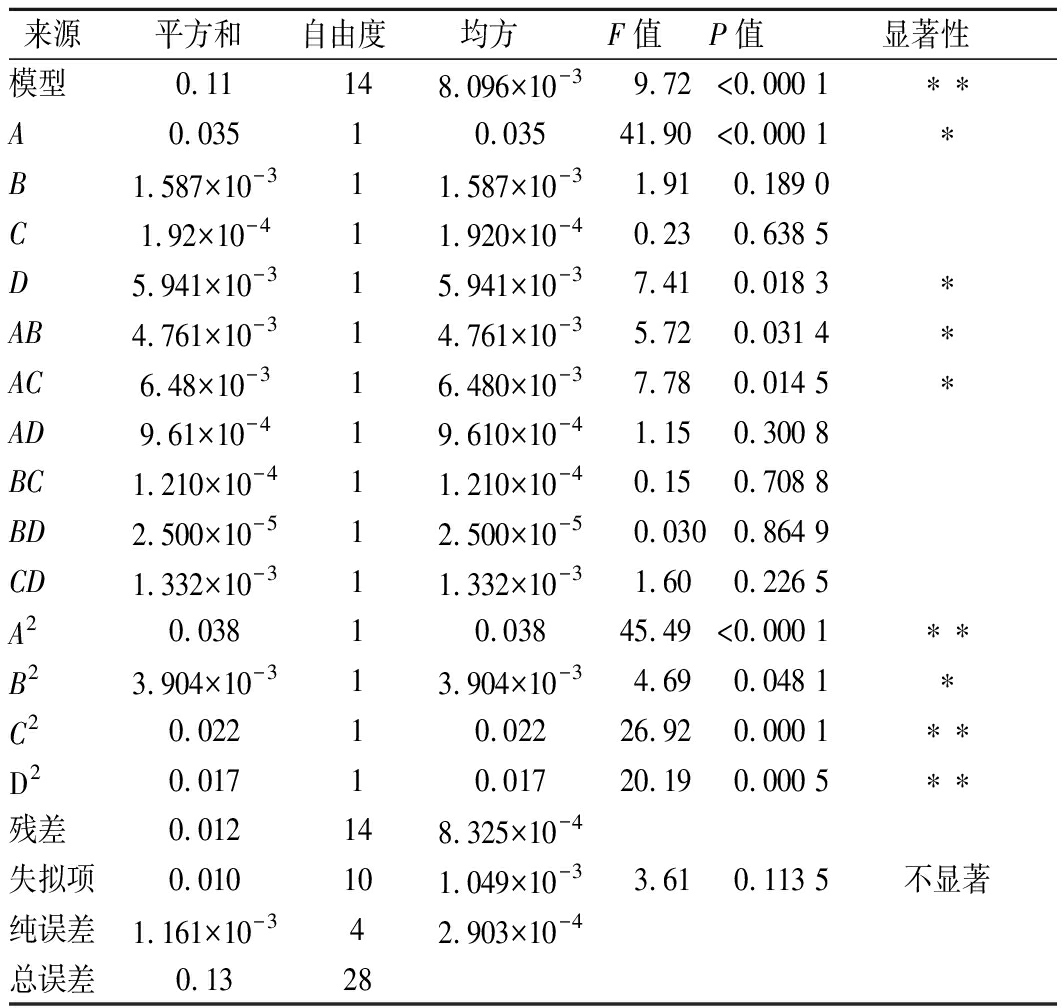
来源平方和自由度均方F值P值显著性模型0.11148.096×10-39.72<0.000 1∗∗A0.03510.03541.90<0.000 1∗B1.587×10-311.587×10-31.910.189 0C1.92×10-411.920×10-40.230.638 5D5.941×10-315.941×10-37.410.018 3∗AB4.761×10-314.761×10-35.720.031 4∗AC6.48×10-316.480×10-37.780.014 5∗AD9.61×10-419.610×10-41.150.300 8BC1.210×10-411.210×10-40.150.708 8BD2.500×10-512.500×10-50.0300.864 9CD1.332×10-311.332×10-31.600.226 5A20.03810.03845.49<0.000 1∗∗B23.904×10-313.904×10-34.690.048 1∗C20.02210.02226.920.000 1∗∗D20.01710.01720.190.000 5∗∗残差0.012148.325×10-4失拟项0.010101.049×10-33.610.113 5不显著纯误差1.161×10-342.903×10-4总误差0.1328
注:*表示P值≤0.05,差异显著;*表示P值≤0.01,差异极显著。
上述拟合方程的R2=0.906 8,且该模型显著值>0.000 1,线性关系表现优良。由表4可知,一次项碱性蛋白酶加酶量影响极显著,酶解pH影响显著,而酶解时间和酶解温度差异不显著;二次项碱性蛋白酶加酶量、酶解温度、酶解pH都是差异极显著的、酶解时间差异显著;在实验的交互影响当中,碱性蛋白酶加酶量和酶解时间、加酶量和酶解温度交互作用显著;加酶量和酶解pH、酶解时间和酶解温度、酶解时间和酶解pH、酶解温度和酶解pH交互作用差异不显著。
图8~图13为双因素交互作用曲面图和等高线图,根据等高线的位点不同可判断交互作用是否显著,等高线呈椭圆形则说明交互作用显著,并随着椭圆长半轴变长交互越显著,而圆形则表示交互不显著。从图8可以得到,碱性蛋白酶加酶量和酶解时间对提取多肽质量浓度影响交互作用显著,随着加酶量和酶解时间的增加,提取多肽浓度呈现先增加后降低的趋势。这是在反应达到饱和后加入过量的酶不能增加多肽质量浓度,而过长的酶解时间反而会影响反应中接触面积从而降低多肽质量浓度。从图9可知,碱性蛋白酶加酶量和酶解温度交互作用对提取多肽质量浓度影响极显著,当加酶量过大和酶解温度过高后,提取多肽质量浓度反而减小,这是因为酶解温度过大易使酶失活。
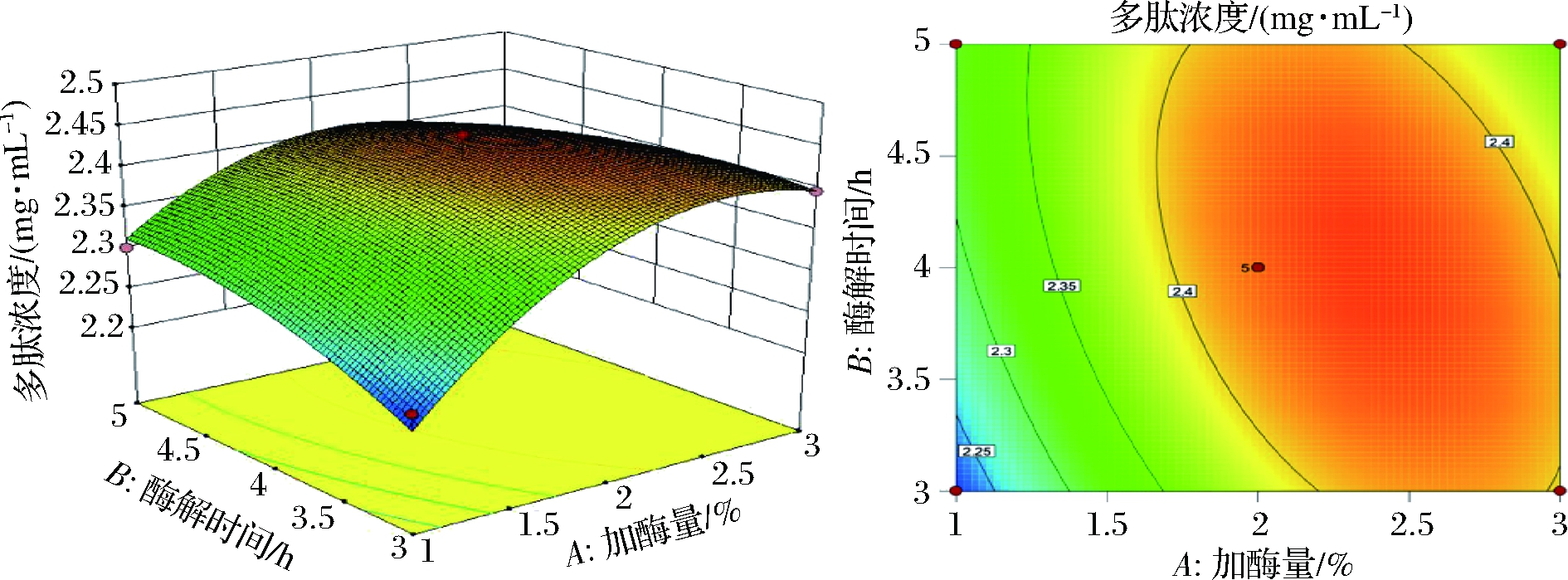
图8 碱性蛋白酶加酶量和酶解时间对提取多肽浓度的影响
Fig.8 Effect of alkaline protease addition enzyme and enzymatic hydrolysis time on extracted peptide concentration
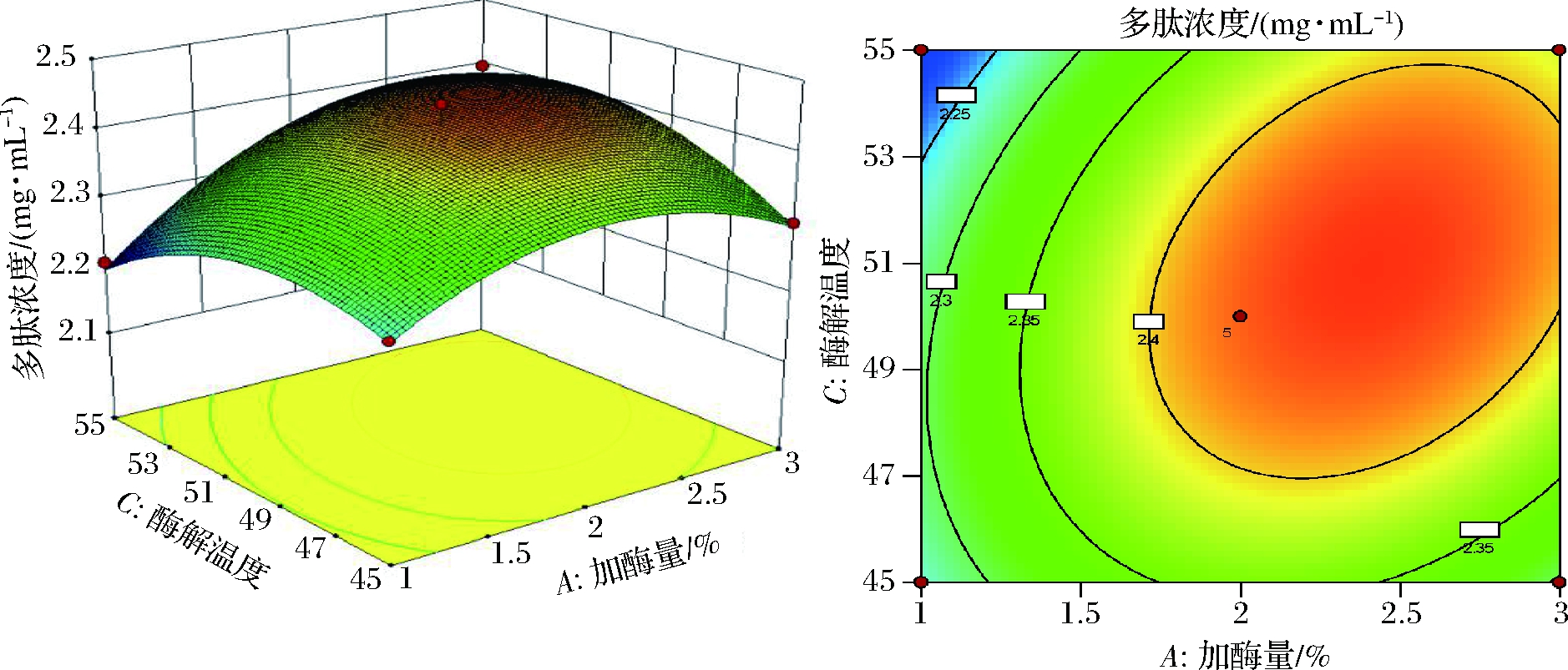
图9 碱性蛋白酶加酶量和酶解温度对提取多肽浓度的影响
Fig.9 Effect of alkaline protease addition enzyme and enzymatic hydrolysis temperature on extracted peptide concentration

图10 碱性蛋白酶加酶量和酶解pH对提取多肽浓度的影响
Fig.10 Effect of alkaline protease addition enzyme and enzymatic hydrolysis pH on extracted peptide concentration
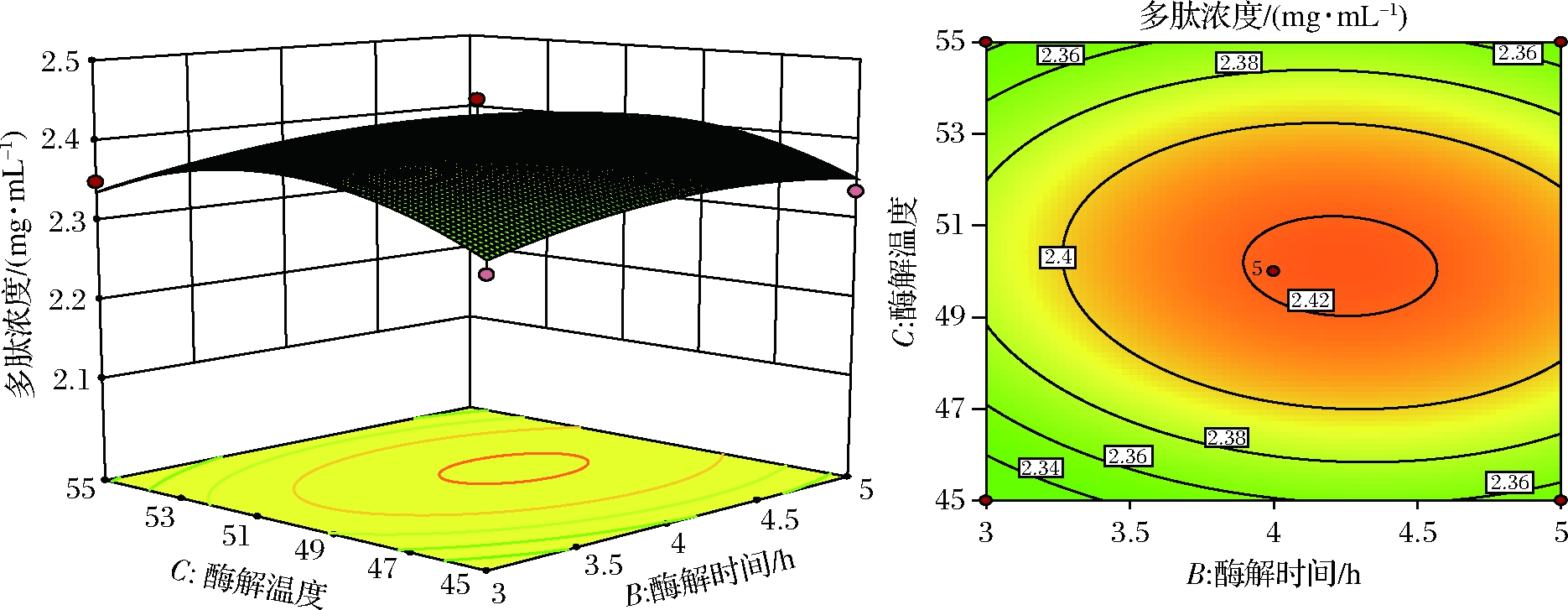
图11 酶解时间和酶解温度对提取多肽浓度的影响
Fig.11 Effect of enzymatic hydrolysis time and enzymatic hydrolysis temperature on the concentration of extracted Peptide
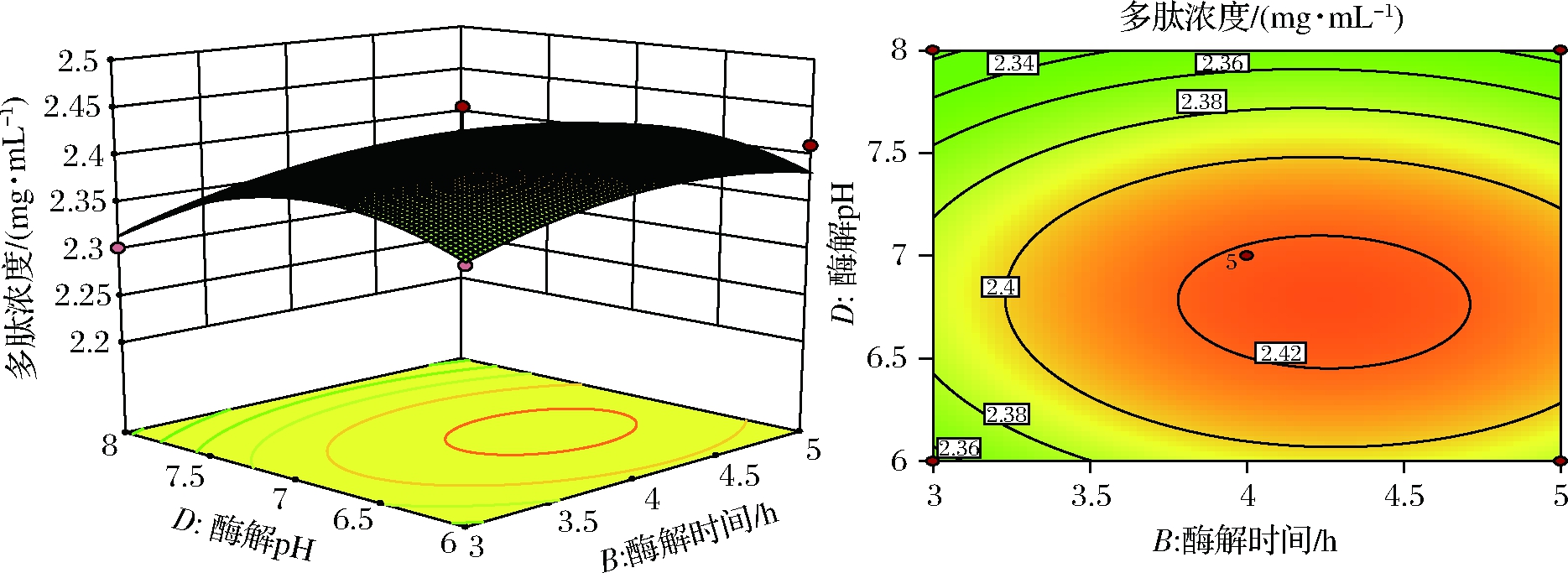
图12 酶解时间和酶解pH对提取多肽浓度的影响
Fig.12 Effects of enzymatic hydrolysis time and enzymatic hydrolysis pH on the concentration of peptides extracted
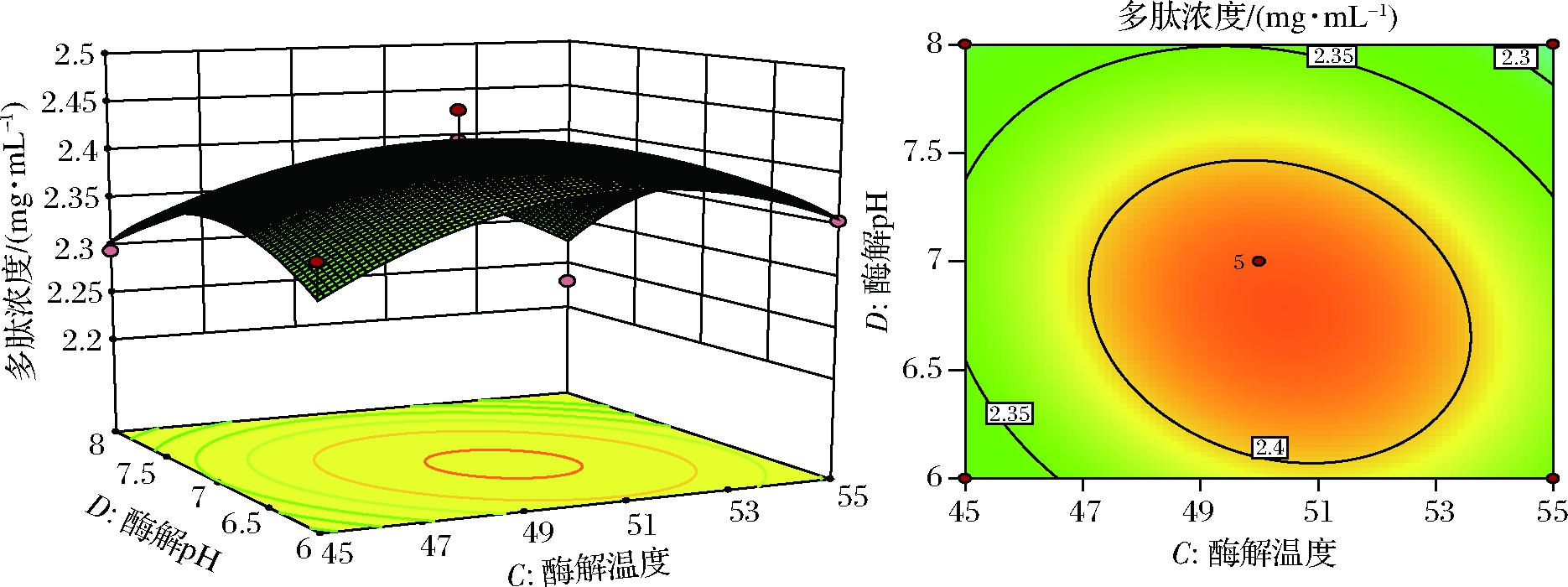
图13 酶解温度和酶解pH对提取多肽浓度的影响
Fig.13 Effects of enzymatic hydrolysis temperature and enzymatic hydrolysis pH on the concentration of extracted peptides
从图10可知,加酶量和酶解pH交互作用极显著,随着加酶量和酶解pH的增加,提取多肽质量浓度先上升后略下降,加酶量升到一定值后对提取值的影响变化较小,因为加酶量和酶解pH过高也易导致碱性蛋白酶酶活性降低甚至失活。
从图11可知,酶解时间和酶解温度的交互作用极显著,响应曲面反应的趋势先上升后略下降,刚开始时反应不完全且酶解温度低,提取不完全,酶解时间过长则可能导致多肽浓度饱和甚至是酶解过度。从图12可知,酶解时间与酶解pH的交互作用显著,等高线图表明适宜酶解时间条件下,更高一些的酶解pH有利于多肽的提取。从图13可知,酶解温度与酶解pH的交互作用显著,曲线与等高线表明酶解温度适宜时,过高pH会使酶失活,导致酶解不适当,多肽浓度较低。
综合分析得到酶解法提取多肽浓度的最佳条件为加酶量2.03%,酶解时间4.2 h,酶解温度50.24 ℃,酶解pH 7.13,根据实际情况可将最佳工艺条件调整为加酶量2%,酶解时间4 h,酶解温度50 ℃,酶解pH 7,在此条件下进行验证得到核桃多肽提取质量浓度为2.55 mg/mL,与上述预测结果无偏差,说明预测结果良好。
[1] SZE-TAO K W C,SATHE S K. Walnuts(Juglans regia L):proximate composition,protein solubility,protein amino acid composition and protein in vitro digestibility[J]. Journal of the Science of Food and Agriculture, 2000,80(9):1 393-1 401.
[2] SAVAGE G. Chemical composition of wanlnuts (Juglans regia L.) grown in New Zealand[J]. Plant Foods for Human Nutrition (Formerly Qualitas Plantarun),2001,56(1):75-82.
[3] 毛晓英,吴庆智,田洪磊,等.核桃仁抗氧化作用研究进展[J].中国油脂,2017,42(8):82-85.
[4] 周美含,郭勇,魏贞,等.榛仁降脂活性肽分离纯化及结构鉴定[J].食品科学,2019,40(16):124-129.
[5] 阚建全. 加强食品化学与营养学的研究,促进食品工业的发展[J]. 食品安全质量检测学报, 2015,6(6):1 971-1 972.
[6] 谢庆武,郑海艳,李德荣.固定化蛋白酶法制备低苦味蛋白质水解物的研究[J].食品与药品,2010,12(9):305-307.
[7] 周迎春,姜太玲,李月仙,等.蛋白质酶水解物的功能特性及其生物活性的研究进展[J].农产品加工,2018(3):42-46.
[8] 黄金梅,胡居吾,高红,等.米渣肽双酶两步水解法制备过程中物化特性与结构变化[J].食品与发酵工业,2019,45(16):32-39.
[9] 左蕾蕾,焦婷,邹丽霞,等.沙棘叶多肽制备工艺研究[J].食品与发酵科技,2019,55(1):30-34.
[10] PURIFICACI N S,TADEUSZ M, MAR
N S,TADEUSZ M, MAR A J N, et al. An overview of the kjeldahl method of nitrogen determination. Part I. early history, chemistry of the procedure, and titrimetric finish[J]. Critical Reviews in Analytical Chemistry,2013,43(4):178-223.
A J N, et al. An overview of the kjeldahl method of nitrogen determination. Part I. early history, chemistry of the procedure, and titrimetric finish[J]. Critical Reviews in Analytical Chemistry,2013,43(4):178-223.
[11] 张弘,李博斌,曾金红,等.凝胶柱层析—考马斯亮蓝染色法测定牛奶中的真蛋白质[J].中国乳品工业,2010,38(12):41-44.
[12] ROSE A, FUNK D, NEIGER R. Comparison of refractometry and biuret assay for measurement of total protein concentration in canine abdominal and pleural fluid specimens[J]. Journal of the American Veterinary Medical Association, 2016, 248(7):789-794.
[13] 么晓黎.大豆粗蛋白含量测定的催化条件初探[J].现代畜牧科技,2018(8):25.
[14] SANTOS A S D O D, COSTA F F, ESTEVES W T, et al. Linearization of the bradford protein assay to application in cow milk proteins quantification by uv-vis spectrophotometry method[J]. Revista Do Instituto De Latícinios Candido Tostes, 2015, (6):69.
[15] 张丹,王昌利,卜雕雕,等.Box-Behnken响应面法优化蒲公英酚酸提取工艺[J].中南药学,2019,17(5):667-671.
[16] 颜小捷,刘幼娴,郑立浪,等.胃蛋白酶和木瓜蛋白酶水解核桃蛋白工艺研究[J].广西植物,2014,34(2):183-188.
[17] 柳荫,吴凤智,王晓丹,等.响应面法优化胰蛋白酶酶解核桃蛋白的工艺[J].江苏农业科学,2014,42(9):239-242.
[18] 包怡红,于阳阳,赵若诗.酶解山核桃蛋白制备降血压肽的工艺[J].食品科学,2013,34(1):220-224.
[19] LIN S, WANG J, ZHAO P, et al. Optimized antioxidant peptides fractions preparation and secondary structure analysis by MIR[J]. International Journal of Biological Macromolecules, 2013, 59:151-157.
[20] 珠娜,李勇.核桃肽生物活性的研究进展[J].中国食物与营养,2018,24(12):58-62.
[21] 唐开永,周鸿翔,田娅玲,等.低浓度小分子多肽含量测定方法的比较研究[J].食品研究与开发,2018,39(16):144-148.