饮料在我国有巨大的消费市场,2018年我国饮料产量达156 79.2万t,同比增长6.9%,零售额突破2 000亿元,是我国食品工业的重要组成部分[1]。近年来,伴随着消费需求逐步升级,发酵型饮料产品取得较快发展,其中果醋饮料是近年来增长最快的种类之一。果醋饮料是水果深加工的新型产品,含有丰富的有机酸、氨基酸等营养与风味物质,风味独特,深受消费者喜爱[2-3]。
工业生产中果醋饮料主要以水果或者果汁为原料,经酒精发酵和醋酸发酵2个过程酿造而成的一种风味独特、营养丰富的饮品[4-5]。目前市场上消费量最大的果醋饮料是苹果醋饮料,此外还有部分山楂醋饮料、草莓醋饮料等。采用的微生物主要有酿酒酵母(Saccharomyces cerevisiae)和醋酸菌(Acetic acid bacteria),特别是在醋酸菌发酵阶段,由于醋酸具有较强的抑菌能力,普通微生物较难生长,而醋酸菌由于具有较强的醋酸耐受性以及乙醇氧化能力,常用于果醋发酵,常用的醋酸菌主要有Acetobacter、Komagataeibacter[6-7]。果醋饮料的生产过程为:原料→调配→酒精发酵→过滤→醋酸发酵→过滤→调配→杀菌→灌装→杀菌→包装,整个过程工业化程度较高,配合规范的管理操作能够保障产品的质量安全。但由于发酵型果醋饮料产品营养丰富,并且生产线较长,也存在微生物污染的可能[8-9]。本研究对苹果原醋储罐底部出现的异常沉淀物进行检测,分析潜在污染微生物,进一步对苹果醋饮料生产过程关键环节管道及样品进行分析检测,从而确定生产过程预防微生物污染的关键控制点,为指导生产过程质量控制和潜在污染微生物的有效防治提供依据。
1 材料与方法
1.1 实验材料
1.1.1 实验样品
某苹果醋生产企业提供的苹果原醋储罐中的絮状沉淀物,某苹果醋饮料企业提供的苹果醋饮料产品。
1.1.2 培养基
PCA培养基(g/L):胰蛋白胨5.0;酵母浸粉2.5;葡萄糖1.0;琼脂15.0;pH 7.0±0.2。
1.1.3 仪器设备
S20K精密pH计,上海梅特勒-托利多仪器有限公司;WS2-134-75恒温培养箱,天津市实验仪器厂;1X2-1LLJ100普通光学显微镜,OLYMPUS;ZHJH-C1112B超净工作台,上海智城分析仪器制造有限公司;YXQ-LS-50SII高压灭菌锅,上海博迅实业有限公司;PCR仪,德国艾本德公司;Gel Doc XR+凝胶成像仪,美国伯乐公司;IS50傅里叶红外光谱,美国赛默飞世尔公司。
1.2 实验方法
1.2.1 苹果原醋中沉淀物成分分析
从某苹果醋生产企业苹果醋储罐底部取部分絮状沉淀,利用红外光谱方法分析沉淀成分。将少量样品涂于2片红外透明的KRS-5窗片之间,窗片的互相挤压形成1个样品薄层。压片做好后,放入平台检测窗内,将探头对准检测窗,顺时针旋下紧贴样品进行红外光谱分析[12]。
1.2.2 苹果原醋沉淀物对苹果醋饮料的影响
将苹果原醋中沉淀物按照0.1%的接种量接种至苹果醋饮料中,30 ℃静置培养3~5 d,分析沉淀物对苹果醋饮料生物稳定性以及产品理化指标的影响,主要检测pH、总酸、还原糖、有机酸等指标变化。
1.2.3 苹果原醋沉淀物中主要微生物分析
(1)样品预处理:将沉淀物放入50 mL无菌离心管中,加入一定量的无菌生理盐水,旋涡振荡,8 000 r/min离心5 min,弃去上清液,用生理盐水洗涤沉淀,8 000 r/min离心5 min,弃去上清液,收集菌体。
(2)利用深加工食品提取DNA试剂盒操作说明提取苹果原醋沉淀物中细菌基因组,送金唯智基因公司测序,利用SILVA 123数据库对测序结果进行比对分析,选择同源性最高的菌种属来解析微生物群落组成。
1.2.4 苹果醋饮料生产过程潜在污染微生物分析
(1)针对苹果醋饮料原料及生产过程设计取样点,共选取11个取样点,如图1所示,编号1~11分别为软化水、苹果浓缩汁、果酒过滤管道、果酒循环泵、果酒储罐、果醋管道、果醋循环泵、果醋储罐、调配罐、巴杀出口、成品罐,每个取样点分别用棉签吸取或者蘸取3个不同位置后混合,用于潜在污染微生物分析。
(2)微生物数量检测:在超净工作台中,将取样点样品接种到PCA液体培养基中进行富集培养,24 h后,取富集后样品逐次稀释成10-1、10-2、10-3、10-4、10-5不同浓度梯度,吸取0.1 mL稀释液涂布到PCA培养基分离平板,正向放置30 min待液体被固体培养基吸收完全,37 ℃培养箱培养,每个稀释度做3个平行。
(3)潜在污染微生物分离纯化与鉴定:将各取样点样品于生理盐水中悬浮振荡,分别于80 ℃水浴20 min进行热处理,再涂布于平板培养基上,37 ℃培养24 h,利用3区划线法对耐热微生物菌落进行纯化。对纯化后单菌落进行培养,利用试剂盒提取基因组,选用细菌通用上下游引物27F与1492R扩增16S rDNA片段,送公司测序,测序序列在GenBank进行Blast比对,选择同源性最高的种属作为鉴定结果。

图1 苹果醋饮料生产过程取样示意图
Fig.1 Sampling diagram of apple vinegar beverage production process
1.2.5 分析方法
根据GB/T 30884—2014方法测定苹果醋饮料pH;根据GB/T 5009.39—2003测定苹果醋饮料中还原糖和总酸含量(以乙酸计);采用HPLC法[13]测定苹果醋饮料中有机酸含量。
1.2.6 数据统计分析
样品理化指标、菌落计数等实验均设置3个平行,利用Excel软件计算平均值及方差。
2 结果与分析
2.1 苹果原醋中沉淀物分析
采用红外光谱检测方法分析苹果原醋中絮状沉淀物组成。化合物红外光谱与分子的结构密切相关,通过红外光谱测定,可以分析样品中存在哪些有机官能团,继而确定化合物的可能结构。由图2-A可知,苹果原醋中絮状沉淀物在1 205~1 036 cm处的吸收峰是糖苷键的特征峰,说明该物质中含有连接糖苷分子中的非糖部分(即苷元)与糖基,或者糖基与糖基[12]。通过查阅相关文献,推测苹果原醋样品中的絮状沉淀物可能为细菌纤维素[13],红外光谱分析表明该沉淀物与细菌纤维素的特征峰位基本一致(图2-B)。
2.2 苹果原醋絮状沉淀物对苹果醋饮料生物稳定性的影响
根据图2分析,苹果原醋样品中出现的絮状沉淀可能为细菌纤维素,可能由一些具有耐酸性的微生物产生,说明苹果原醋中出现的絮状沉淀对后续苹果醋饮料的生产有潜在危害,因此将苹果原醋中絮状沉淀物接入苹果醋饮料产品中,分析其对产品生物稳定性的影响。正常的苹果醋饮料清澈透明,接入絮状沉淀物后苹果醋饮料中出现浑浊,并有絮状沉淀产生,说明苹果原醋样品中的絮状沉淀含有部分微生物,会导致苹果醋饮料的污染。通过显微镜观察,没有发现明显的丝状真菌以及酵母,经染色发现革兰氏阳性和革兰氏阴性细菌。
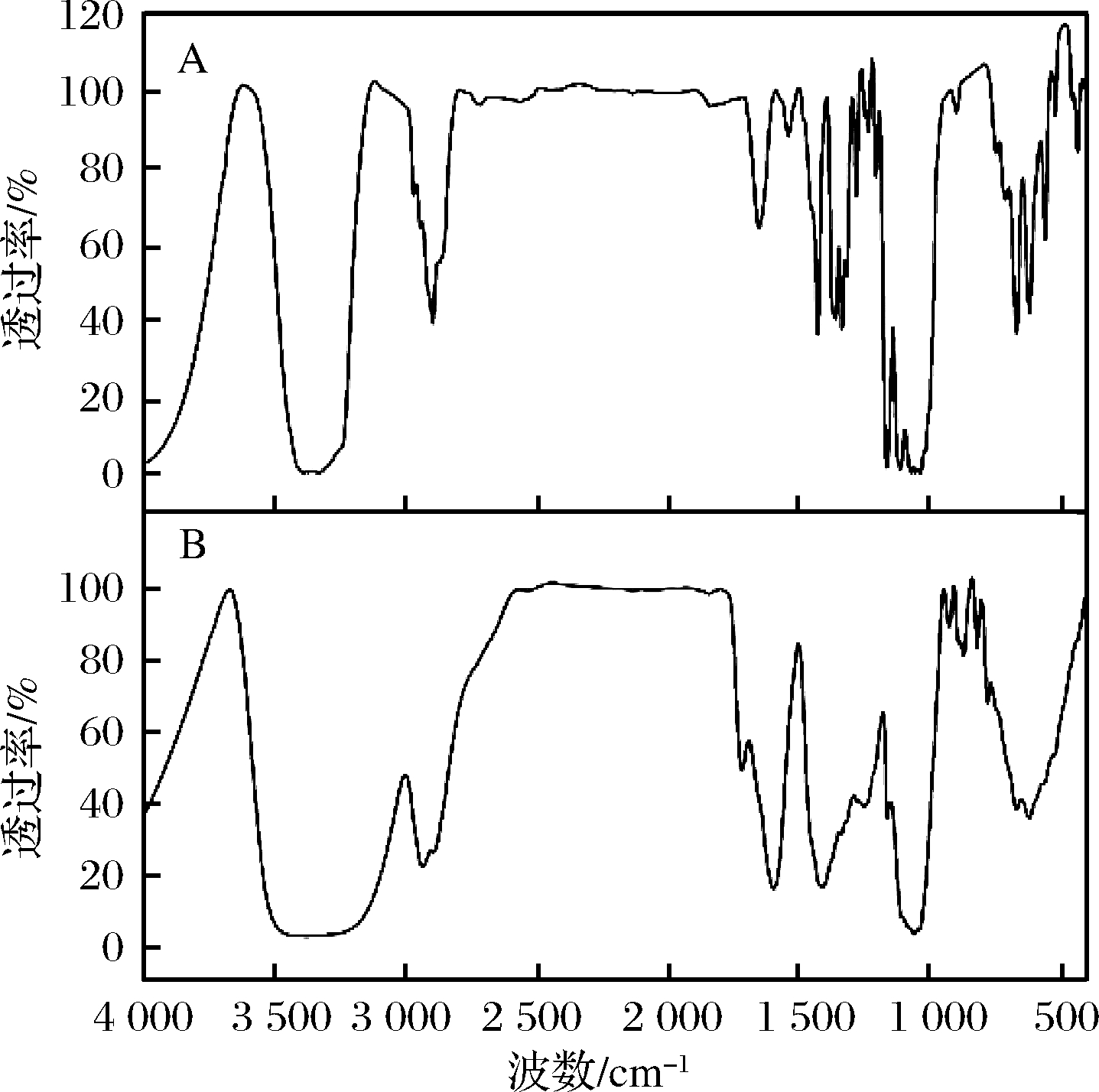
A-苹果原醋中絮状沉淀;B-细菌纤维素
图2 沉淀物红外光谱分析
Fig.2 Infrared spectra analysis of sediment
分析比较苹果醋饮料接菌前后的主要理化指标,如表1所示,与对照相比,接菌后的苹果醋饮料样品还原糖降低约1.0 g/100 mL,总酸(以乙酸计)增加11.8%,说明絮状沉淀物中的污染微生物会利用苹果醋饮料中的还原糖代谢产生有机酸,因此,进一步分析了其中有机酸组成。
表1 样品的主要理化指标分析
Table 1 Analysis of samples physical and chemical properties

检测指标pH总酸/[g·(100 mL)-1]还原糖/[g·(100 mL)-1]乳酸/[g·(100 mL)-1]乙酸/[g·(100 mL)-1]柠檬酸/[g·(100 mL)-1]苹果酸/[g·(100 mL)-1]接种絮状沉淀4.26±0.040.40±0.053.57±0.080.30±0.020.28±0.030.03±0.010.01±0.00对照4.20±0.020.37±0.093.67±0.160.09±0.04∗∗0.28±0.020.03±0.010.01±0.00
注:**,极显著(P< 0.01)。
乙酸、乳酸、柠檬酸、苹果酸是苹果醋饮料中的主要有机酸,与对照相比,接菌后的苹果醋饮料乳酸浓度增加2.3倍,其他有机酸浓度变化不大。有研究报道,许多微生物能够以异养方式合成胞外细菌纤维素,主要有葡糖醋杆菌属(Gluconacetobacter)、八叠球菌属(Sarcina)、假单胞菌属(Pseudomonas)、产碱菌属(Alcaligenes)、根瘤菌属(Rhizobium)、固氮菌属(Azotobacter)、土壤杆菌属(Agrobacterium)、无色杆菌属(Achromobacter)和产气杆菌属(Aerobacter)等[14]。微生物可以利用糖类物质,通过糖酵解、戊糖磷酸等途径将单糖转化为丙酮酸,进而生成乳酸等代谢产物[15-16],从而导致酸度升高。
以苹果原醋中絮状沉淀为样品,提取基因组,分析其中微生物多样性,结果如图3所示,苹果原醋产生的絮状沉淀中主要微生物为Pediococcus,此外,Paracoccus,Gluconacetobacter和Lactobacillus也占有较高的浓度。其中,测序结果同源性最高的种分别为Pediococcus stilesii(99%)、Paracoccus angustae(100%),Gluconacetobacter xylinus(100%)、Lactobacillus acetotolerans(99%)、Aquabacterium olei(100%)和Lysobacter gummosus(96%)。有研究表明,Gluconacetobacter xylinus能够产生细菌纤维素[17],这与前面沉淀物的红外光谱分析结果一致。翟磊等[18]通过对比分析以及回接实验证明耐酸乳杆菌(Lactobacillus acetotolerans)会引起正常醋样出现产气、异味、颜色变化,以及可溶性固形物减少和pH升高等变质现象。Lysobacter分泌于胞外酶和活性小分子物质,能抑制真菌的生长及增殖,这也有可能有利于抑制苹果原醋中真菌的生长[19]。
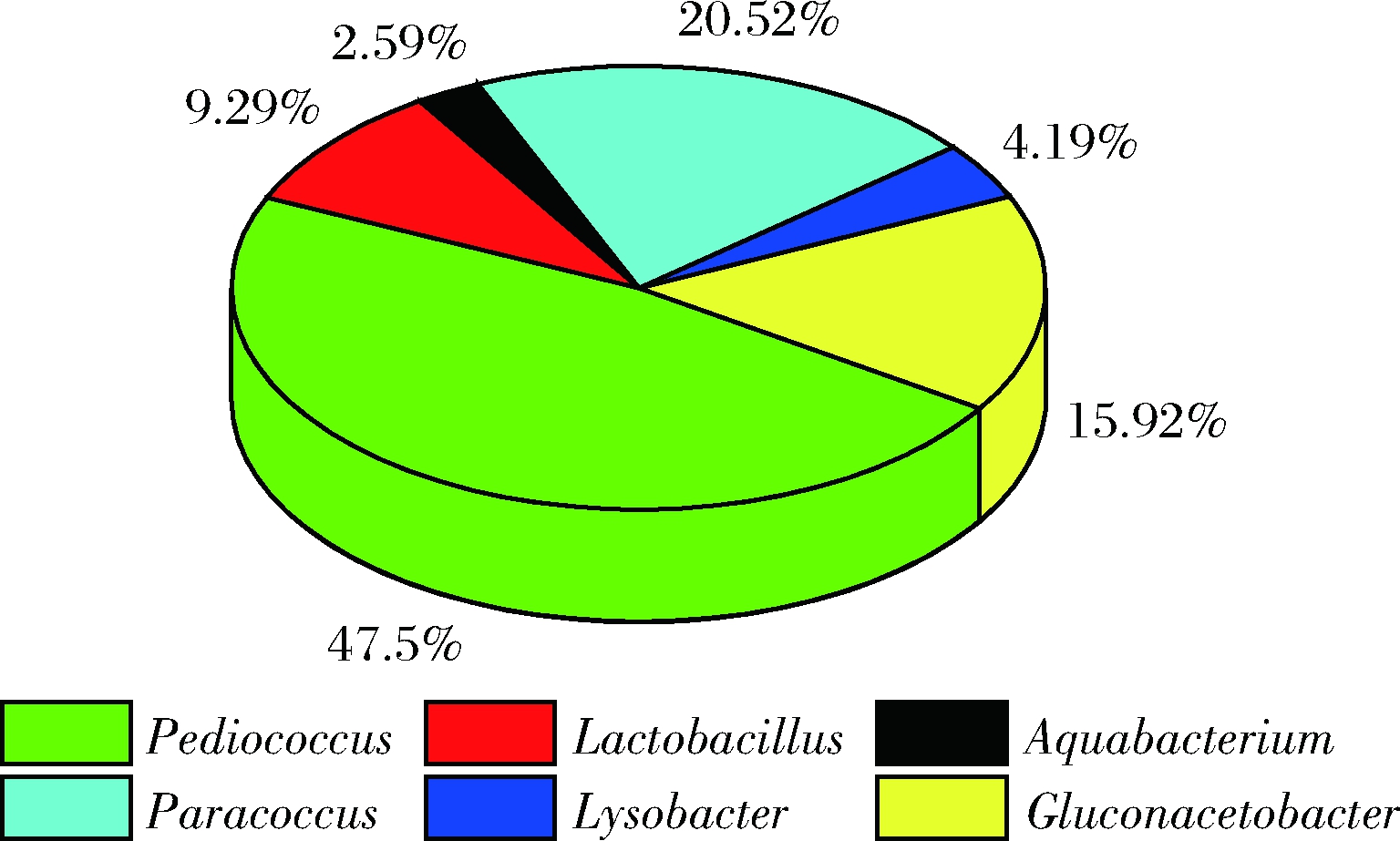
图3 苹果原醋沉淀中细菌菌群组成
Fig.3 Composition of bacteria in sediment of raw apple vinegar
2.3 苹果醋饮料生产过程微生物污染预防关键点分析
为准确分析各个取样点对后续苹果醋饮料产品的危害,对样品进行巴氏杀菌处理,重点分析其中耐热微生物。结果如表2所示,通过取样分析,发现有部分耐热微生物存在于生产过程中,菌落数较多的地方集中在软化水、果酒循环泵、果酒过滤管道、果醋管道,尤其以各环节原料运输的管道居多。苹果醋饮料生产过程存在的耐热微生物主要有7个属,15个种,其中芽胞杆菌属(Bacillus)和短芽胞杆菌属(Brevibacillus)居多,给产品质量安全带来危害。欧文氏杆菌和科恩氏菌普遍存在于空气和土壤中[20-21],本文首次在苹果醋生产过程中分离得到。
表2 苹果醋饮料生产过程微生物检测
Table 2 Microbial detection during the production process of apple vinegar

编号取样点微生物数量耐热微生物鉴定1软化水+++腐殖质类芽胞杆菌(Paenibacillus humicus)、强壮类芽胞杆菌(Paenibacillus validus)、土壤短芽胞杆菌(Brevibacillus agri)、流水短芽胞杆菌(Brevibacillus fluminis)、空气芽胞杆菌(Bacillus aerius)、蜡样芽胞杆菌(Bacillus cereus)、奥斯陆莫拉菌(Moraxella osloensis)、金黄色葡萄球菌(Staphylococcus aureus)、耐热科恩氏菌(Cohnella thermotolerans)、欧文氏杆菌(Erwinia tasmaniensis)2苹果浓缩汁--3果酒过滤管道++腐殖质类芽胞杆菌(Paenibacillus humicus)、蜡样芽胞杆菌(Bacillus cereus)4果酒循环泵+++根系科恩氏菌(Cohnella rhizosphaerae)、蜡样芽胞杆菌(Bacillus cereus)5果酒储罐++土壤短芽胞杆菌(Brevibacillus agri)、蜡样芽胞杆菌(Bacillus cereus)6果醋管道+侧胞短芽胞杆菌(Brevibacillus laterosporus)、硝化短芽胞杆菌(Brevibacillus nitrificans)、蜡样芽胞杆菌(Bacillus cereus)7果醋循环泵+土壤短芽胞杆菌(Brevibacillus agri)、中胞短芽胞杆菌(Brevibacillus centrosporus)8果醋储罐+特基拉芽胞杆菌(Bacillus tequilensis)9调配罐+土壤短芽胞杆菌(Brevibacillus agri)10巴杀出口--11成品罐--
注:微生物菌落数(CFU/mL):“-”未检出;“+”1-10个;“++”10-100个;“+++”100~1 000个。
苹果醋是一种酸性食品,含有较高浓度的乙酸等有机酸,乙酸能够使蛋白变性并导致细菌死亡[22],使得大多数污染微生物不能生长繁殖。除苹果醋外,一些耐酸微生物也会导致谷物醋的污染,孙文丽等[23]在胀气食醋中分离到6株细菌,其中一株为Bacillus tequilensis,该菌株可在糖发酵培养基中产生较多白色絮状物沉淀,同时还检测到2株金黄色葡萄菌属也可以产生沉淀。本文检测到的耐热微生物的数量随着生产过程逐渐减少,成品中没有检测到耐热微生物,说明生产过程中清洗、杀菌等工艺能够有效减少微生物污染的威胁。但也有一些微生物具有特殊的性能,能够在高酸和高温条件下存活,比如一些芽胞杆菌属的细菌生成的芽胞结构致密,较难被破坏,一旦条件适宜即可大量繁殖[24-25]。特别是其中的蜡样芽胞杆菌,它是一种较为常见的食品污染微生物,在10~45 ℃、pH为2~11的环境下都可以生长繁殖,在酸性条件下其营养细胞会发生一系列的应激反应来适应酸性环境[26]。有文献报道,80~85 ℃水浴5~10 min可刺激蜡样芽胞杆菌的芽胞萌发[27],因此这类微生物是生产过程预防的重点。
值得注意的是,部分样品经过热处理后依然可能存在微生物污染,而且如果暂存罐和运输管道的灭菌不彻底,灌装和存储过程中的管理不善,都有可能造成微生物污染。通过微生物的耐热实验,发现部分污染微生物采用普通巴氏灭菌条件很难被杀死,可以考虑采用瞬时超高温灭菌,或者采用膜过滤等方式除菌[28]。同时,也可以采用抑菌效果更好的防腐剂。有研究指出防腐剂山梨酸钾和乳酸链球菌素在酸性条件下对芽胞杆菌具有较强的抑制作用,防腐剂尼泊金丙酯钠只需要0.15 g/kg添加量就能很好地抑制细菌生长[29-30]。
3 结论
通过红外光谱技术分析,发现苹果原醋中的絮状沉淀物可能为细菌纤维素,采用高通量测序方法检测到絮状沉淀物中主要存在6个属的细菌,将沉淀物接种到苹果醋饮料中会导致产品生物稳定性降低,乳酸浓度显著增加。根据苹果醋饮料生产工艺流程,对苹果醋饮料生产过程中11个关键点进行微生物检测,发现存在微生物污染较多的地方集中在软化水、果酒循环泵、果酒过滤管道、果醋管道,以及果酒和果醋储罐中,尤以各环节连接管道居多,主要耐热微生物为具有芽胞生成能力的细菌,如芽胞杆菌属和短芽胞杆菌属。苹果醋饮料生产过程中要注意生产设施的清洗杀菌,完善在线清洗与在线杀菌系统(CIP/SIP),预防原料与管道中潜在污染微生物污染。
[1] 王超,林小晖,杜冰.乳酸菌发酵型饮料的研究现状与前景[J].饮料工业,2018(1):68-70.
[2] 李欢.富含乳酸苹果原醋酿造工艺的研究[D].无锡:江南大学,2017.
[3] 向进乐,罗磊,郭香凤,等.果醋功能性研究进展[J].食品科学,2013,34(13):356-360.
[4] KHEZRI S S,SAIDPOUR A,HOSSEINZADEH N,et al. Beneficial effects of apple cider vinegar on weight management,visceral adiposity index and lipid profile in overweight or obese subjects receiving restricted calorie diet:A randomized clinical trial[J].Journal of Functional Foods,2018,43:95-102.
[5] 栗亚男,宋慧,强阿娟,等.响应面法优化山楂复合果醋发酵工艺[J].中国调味品,2015,40(1):57-61.
[6] ZHENG Y,MOU J,NIU J,et al.Succession sequence of lactic acid bacteria driven by environmental factors and substrates throughout the brewing process of Shanxi aged vinegar[J].Applied Microbiology and Biotechnology,2018,102(6):2 645-2 658.
[7] ANDRES B C,SAAD M M, FERRETE E C,et al.Metaproteomics and ultrastructure characterization of Komagataeibacter spp. involved in high-acid spirit vinegar production[J].Food Microbiology,2016,55:112-122.
[8] 欧阳友生,陈仪本,陈娇娣,等.广东食品(饮料)企业车间霉菌污染及优势种群调查[J].中国卫生检验杂志,2001,(4):446-448.
[9] 许晓云,陈倩,刘琦,等.包装饮用水生产线中铜绿假单胞菌的检测与防控[J].饮料工业,2018,21(3):14-18.
[10] 朱忠顺.细菌纤维素的发酵生产及其对重金属离子的吸附作用[D].郑州:河南大学,2017.
[11] 高年发,任雪.HPLC测定独流老醋陈酿过程中有机酸变化[J].中国酿造,2010,29(3):143-147.
[12] 刘磊,陈鹏,赵劲,等.化学生物学基础[M].北京科学出版社,2010.
[13] KASHCHEYEVA E I,GLADYSHEVA E K,SKIBA E A,et al.A study of properties and enzymatic hydrolysis of bacterial cellulose[J].Cellulose,2019,26(4):2 255-2 265.
[14] 杨礼富. 细菌纤维素研究新进展[J]. 微生物学通报, 2003, 30(4):95-98.
[15] 程瑶, 赵千婧,王佳,等. 化合物代谢新途径构建及微生物糖代谢网络改造的研究进展[J]. 北京化工大学学报(自然科学版), 2018, 45(5):82-95.
[16] 马霞,王瑞明,关凤梅,等.发酵生产细菌纤维素菌株的特点[J].四川食品与发酵,2005(1):20-22.
[17] TOLIENG V,PRASIRTSAK B,MIYASHITA M,et al.Sporolactobacillus shoreicorticis sp.nov.a lactic acid-producing bacterium isolated from tree bark[J].International Journal of Systematic and Evolutionary Microbiology,2017,67(7):2 363-2 369.
[18] YE L,ZHOU X,HUDARI M S B,et al.Highly efficient production of l-lactic acid from xylose by newly isolated Bacillus coagulans C106[J].Bioresource Technology,2013,132(132):38-44.
[19] 咸赫,史素娟,毛静静,等.一株细菌纤维素生产菌株Gluconacetobacter xylinus的分离鉴定及其产物分析[J].纤维素科学与技术,2016,24(2):77-84.
[20] 翟磊,苏姣姣,刘洋,等.食醋中污染菌的分离与鉴定[J].生物技术通报,2016,32(3):198-202.
[21] LI S,JOCHUM C C,YU F,et al.An antibiotic complex from Lysobacter enzymogenes strain C3:antimicrobial activity and role in plant disease control[J].Phytopathology,2008,98(6):695-701.
[22] BAHADOU S A,OUIJJA A,KARFACH A,et al.New potential bacterial antagonists for the biocontrol of fire blight disease (Erwinia amylovora) in Morocco[J].Microbial Pathogenesis,2018,117(C):7-15.
[23] LEE K C,KIM K K,KIM J S,et al.Cohnella collisoli sp. nov. isolated from lava forest soil[J].International Journal of Systematic and Evolutionary Microbiology,2015,65(9):3 125-3 130.
[24] 郑志永,姚善泾.应用溶氧反馈控制高密度培养重组大肠杆菌过程中乙酸的产生[J].高校化学工程学报,2006,20(2):233-238.
[25] 孙文丽.胀气食醋中污染微生物的分离鉴定及其生理生化特性[J].食品工业科技,2018,39(17):99-105.
[26] 徐智勇,闫岩,王卫,等.芽孢生成和萌发相关机制[J].中西医结合护理(中英文),2016,2(11):169-172.
[27] ABHYANKAR W R,WEN J,SWARGE B N,et al.Proteomics and microscopy tools for the study of antimicrobial resistance and germination mechanisms of bacterial spores[J].Food Microbiology,2018,81:89-96.
[28] KOTIRANTA A,LOUNATMAA K,HAAPASALO M.Epidemiology and pathogenesis of Bacillus cereus infections[J].Microbes and Infection,2000,2(2):189-198.
[29] 张翼.婴幼儿食品中呕吐型蜡样芽孢杆菌的鉴别与多位点序列分析[D].武汉:武汉轻工大学,2015.
[30] 郭天文,叶红.解决酱油货架期涨袋、爆瓶的探讨[J].中国酿造,2010(3):138-140.