大量研究表明乳酸菌具有维持肠道微生态平衡、抑制肠道有害菌生长繁殖等益生功能。针对一些乳酸菌的代谢产物,如具有抑菌功能的食品级乳酸菌细菌素,目前已有大量的理论及应用研究。乳酸菌细菌素具有很高的应用价值,但由于其体内作用机制尚不清楚,出于安全性考虑,乳酸菌细菌素在生产实践中仍面临着诸多困难。此外,随着人们对肠道菌群与人体健康研究的不断深入,发现肠道菌群结构的变化与诸多人体疾病相关。因此,本被认为可安全食用的乳酸菌,其中能够产细菌素的个体,是否会对肠道菌群造成潜在的不良影响,也逐渐被人们所重视。乳酸菌在肠道中发挥益生功效是否与其代谢合成细菌素有关、乳酸菌及其细菌素在食品领域的应用是否会影响到人体的肠道菌群并进而影响人体健康等问题也成为人们新的研究方向。
1 乳酸菌及其合成的细菌素
作为一类可发酵碳水化合物、主要产乳酸的细菌[1],乳酸菌通常被认为是安全的微生物。目前在细菌分类学上,乳酸菌至少可分为23个属,主要包括乳杆菌属、链球菌属、双歧杆菌属、乳球菌属等[2]。乳酸菌是一种兼性厌氧细菌,革兰氏染色呈阳性,接触酶阴性,无芽孢,存在球状、球杆状和棒杆状3种形态,DNA碱基组成中G+C含量低于55 mol%。几千年来,乳酸菌除了在发酵工业中提高食品的风味和营养,还可以抑制腐败菌和致病菌,提高食品的卫生安全质量[3-4]。乳酸菌所产的抑菌物质包括双乙酰、有机酸、过氧化氢和细菌素等[5]。双歧杆菌、乳酸杆菌等乳酸菌被大量应用于食品行业,以发酵乳制品、益生菌粉等形式进入人体,在肠道内发挥着益生作用。
1.1 产细菌素的乳酸菌
1908年,报道了乳酸杆菌对非肠道微生物的抑制作用,自此乳酸菌代谢产物得到广泛研究。一些乳酸菌种属,可以通过定植于肠道,竞争肠道生态位、代谢产生乳酸与细菌素等,从而抑制病原菌入侵和定植[6],调节肠道免疫功能[7],改善肠道屏障功能[8]。至今发现的产抑菌活性物质的乳酸菌至少有8个属,如乳杆菌属Lactobacillus sp.、链球菌属Streptococcus sp.、乳球菌属Lactococcus sp.、明串珠菌属Leuconostoc sp.、片球菌属Pediococcus sp.、双歧杆菌属Bifidobacterium sp.、肉食杆菌属Carnobacterium sp.和肠球菌属Enterococcus sp.等[9]。细菌素是乳酸菌合成的一种十分重要的抑菌物质,也是乳酸菌发挥其益生作用的重要因素。据研究统计,在发酵食品(包括动物类的酸奶和植物类的泡菜等)、婴儿粪便、动物肠道和变质食品中都可以分离出产细菌素的乳酸菌。此外,除了已知的细菌素外,益生菌清除致病菌的机理仍在不断探究中。如芽孢杆菌益生菌可以合成脂肽类抗生素FENGYCIN[10],通过竞争抑制干扰目标菌群体感应途径,从而清除肠道内金黄色葡萄球菌。这也为乳酸菌的益生机制提供新的思路。
1.2 乳酸菌细菌素
一类细菌素会作用于目标菌细胞壁及被膜,阻碍细胞壁的合成,形成膜孔道,使胞内容物外泄导致菌死亡,如Lantibiotic NAI-107可以吸附在参与合成细胞壁多糖骨架的萜醇上,作用于细胞膜,损害其功能[11],另一类作用于细胞内,影响基因表达和蛋白合成,如来源于kefir的Peptide F1可以进入Escherichia coli细胞,黏在菌的DNA上阻止其合成[12]。乳酸菌细菌素种类繁多,采取高效可靠的鉴别方法,细菌素以不同的标准分类,有助于了解乳酸菌细菌素的特性,便于根据特性进行细菌素改造、利用,实现其在多个行业的开发应用。
1.2.1 乳酸菌细菌素分类
要理解细菌素的表征及其作用模式,关键是根据细菌素的生化特性对其进行鉴别分类。例如产生菌的种属、抗菌肽大小、作用模式、抑菌能力、免疫机制和靶细胞上的作用受体、是否经过翻译后修饰、细菌素特性甚至结构[13-15]。一般细菌素鉴别需经过分离、层析、HPLC纯化和质谱分析等步骤[16],繁琐耗时。近年来PCR技术应用于细菌素分类鉴别方面已有许多研究,如利用已知的植物乳杆菌素基因设计引物PCR扩增目标菌DNA,根据发现的相关基因可以快速确定目标菌产的细菌素种类[17]。
对乳酸菌合成的细菌素进行分类最早是由KLAENHAMMER[18]提出的,随着一些新发现的细菌素无法归到原有的类别中,之后有很多学者在此基础上做出新的分类:①classⅠ细菌素,包括所有在细菌素生物合成期间经过酶修饰的肽,由1个供酶识别、转运和保持肽失活状态的前导肽和与之融合的中心肽组成[19],带有不常见氨基酸,性质受结构影响,可细分为6小类,属于这类的细菌素有Nisin、Enterocin AS-48、Subtilosin A、Streptolysin S和Glycocin F等;②classⅡ细菌素,抑菌活性和稳定性优于其他几类[20],可分为4小类,由于这类细菌素并未经过修饰,因此除了前导肽和运输体,其成熟不需要酶作用;这类细菌素有片球菌素Pediocin PA-1、双肽链细菌素Lactococcin G、环状细菌素Enterocin L 50、非片球菌素单一线性肽Lactococcin 972等。近年KASUGA等[21]通过SDS-PAGE原位活性测定并确定Gassericin T和Gassericin S均为Ⅱb细菌素,并且发现两者协同作用可以拓宽抑菌谱;③classⅢ细菌素,未经修饰,可分为Bacteriolysins和Non-lytic。具体的乳酸菌所产细菌素分类见表1。
表1 乳酸菌细菌素的分类
Table 1 Classification of Bacteriocins from lactic acid bacteria
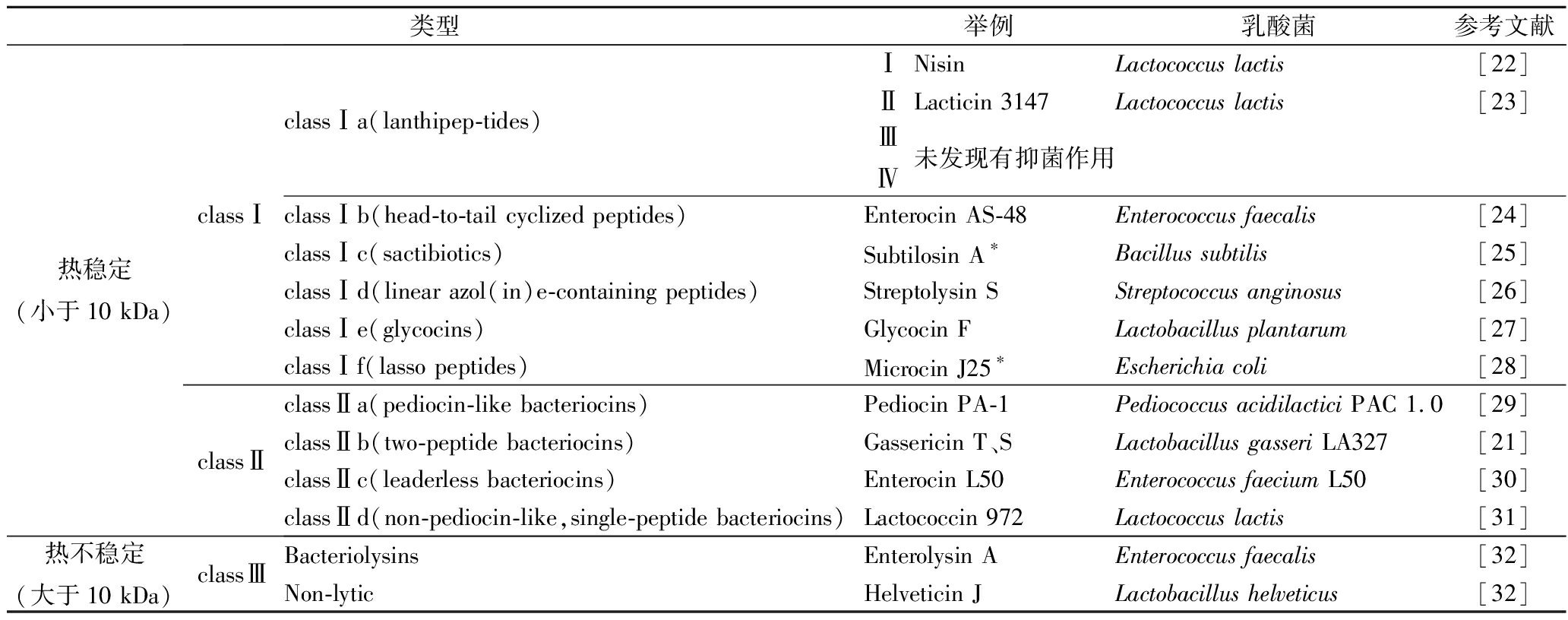
类型举例乳酸菌参考文献热稳定(小于10 kDa)classⅠclassⅠa(lanthipep-tides)ⅠNisinLactococcus lactis[22]ⅡLacticin 3147Lactococcus lactis[23]ⅢⅣ未发现有抑菌作用classⅠb(head-to-tail cyclized peptides)Enterocin AS-48Enterococcus faecalis[24]classⅠc(sactibiotics)Subtilosin A∗Bacillus subtilis[25]classⅠd(linear azol(in)e-containing peptides)Streptolysin SStreptococcus anginosus[26]classⅠe(glycocins)Glycocin FLactobacillus plantarum[27]classⅠf(lasso peptides)Microcin J25∗Escherichia coli[28]classⅡclassⅡa(pediocin-like bacteriocins)Pediocin PA-1Pediococcus acidilactici PAC 1.0[29]classⅡb(two-peptide bacteriocins)Gassericin T、SLactobacillus gasseri LA327[21]classⅡc(leaderless bacteriocins)Enterocin L50Enterococcus faecium L50[30]classⅡd(non-pediocin-like,single-peptide bacteriocins)Lactococcin 972Lactococcus lactis[31]热不稳定(大于10 kDa)classⅢBacteriolysinsEnterolysin AEnterococcus faecalis[32]Non-lyticHelveticin JLactobacillus helveticus[32]
注:*为非乳酸菌细菌素。
1.2.2 乳酸菌细菌素的特点
乳酸菌细菌素的优势主要有:①在体内外,乳酸菌细菌素均可抑制或杀死与其产生菌亲缘较近的细菌;②毒性低,无污染、无副作用、无抗药性;③分子稳定,有较好的耐热性、耐酸碱性;④宽、窄抗菌谱的细菌素有各自适用的范围;⑤细菌素生产方式多样;⑥细菌素直接由基因编码合成,通过操纵编码基因可以进行“生物工程改造(bioengineering)”[33],便于后期修饰;⑦细菌素有可能通过乳酸菌原位(in situ)产生[34]。当然,乳酸菌细菌素也存在一些缺陷,如:①有些细菌素的溶解度低甚至不溶解;②大多细菌素只能抑制革兰氏阳性菌;③乳酸菌细菌素有可能引发耐细菌素细菌的出现,研究表明免疫模仿(immune mimicry)[35]和对细菌素的溶蛋白性裂解是限制细菌素在临床上应用的一个重要原因。但随着更多新的广谱细菌素不断被发现,乳酸菌细菌素的缺陷也正在被克服,如PEI等[36]报道的经筛选提纯得到的Plantaricin SLG1, 这种植物乳杆菌素具有更宽的抑菌谱,可以抑制革兰氏阳性、阴性菌和一些真菌。
1.2.3 乳酸菌细菌素的应用
乳酸菌细菌素由于其独特优势,在多个行业得到广泛应用,尤其是养殖、食品和医药领域。在养殖领域,替代抗生素是乳酸菌细菌素的一个主要用途。由于抗生素在消灭致病菌的同时,也杀死了有益菌,使得有些菌群永远无法完全恢复[37]。此外,抗生素耐药性的产生也是一大威胁。将乳酸菌细菌素添加到饲料中可以延长饲料的保质期,防止饲料受到污染,而且可以抑制动物体内致病微生物的生产繁殖[38]。韩雪等[39]采用产细菌素乳酸菌发酵的棉籽粕饲喂蛋鸡后,发现替代基础日粮40%时,可显著提高蛋鸡的免疫能力和对营养素的利用率。李南充[40]在水中直接加入乳酸菌细菌素或产细菌素的乳酸菌,发现能改善水质,调整鱼肠道菌群结构,提高饲料吸收率。应用可产细菌素、能定植于动物肠道的乳酸菌对开发无抗生素饲料、推动养殖业发展具有重要价值。在食品领域,随着健康理念的深入,消费者偏向于无化学添加的食品,天然细菌素成了替代化学添加剂的最佳选择之一,它可以赋予食品一个“先天免疫”形式[41]。50年前,Ⅰ类羊毛硫氨酸细菌素Nisin成为首个商业化运用的细菌素型食品防腐剂[42],至今已有50多个国家将其用于乳制品及罐装食品中。采用细菌素进行食品生物保藏[43]的方式有4种:①乳酸菌发酵食品;②纯化、半纯化的细菌素用作食品添加剂;③细菌素嵌入或涂层于包装膜上[44];④发酵食品做原料用于食品加工。人们还将细菌素以固定化形式用于食品工业中,既保证细菌素的梯度增强式释放,又防止细菌素与食物成分及酶发生作用而失活[45]。VUKOMANOVI 等[46]将Nisin结合到纳米Au的表面后,发现通过纳米包埋技术,Nisin抗菌效果显著增强。在医药领域,由于细菌素的作用机制特殊,致病菌一般不会对其产生耐药性,被认为是“策划药物”。研究表明许多细菌素对临床疾病中的靶向致病菌有很强的特异性,其中就包括耐抗生素的菌株。DICKS等[47]发现细菌素Nisin F可以预防金黄色葡萄球菌感染长达7 d,因此可将乳酸菌细菌素用于感染性细菌的术后控制。GIACOMETTI等人[48]比较了单独使用Nisin和Nisin与抗菌物质联用时的抑菌效果,发现均对耐甲氧西林金黄色葡萄球菌有抑制作用,但联用后的效果更强。最有趣的是探究细菌素作为潜在的抗癌剂,VILLARANTE等[49]报道了一种类似PediocinPA-1、分离自Pediococcus acidilactici K2a2-3的新Pediocin,具有针对HT29(人结肠腺癌和HeLa细胞系)的细胞毒活性。因此,通过优化已有的细菌素以及对新型细菌素的开发,解决现有细菌素的不足,将使细菌素得到更广泛的应用。
等[46]将Nisin结合到纳米Au的表面后,发现通过纳米包埋技术,Nisin抗菌效果显著增强。在医药领域,由于细菌素的作用机制特殊,致病菌一般不会对其产生耐药性,被认为是“策划药物”。研究表明许多细菌素对临床疾病中的靶向致病菌有很强的特异性,其中就包括耐抗生素的菌株。DICKS等[47]发现细菌素Nisin F可以预防金黄色葡萄球菌感染长达7 d,因此可将乳酸菌细菌素用于感染性细菌的术后控制。GIACOMETTI等人[48]比较了单独使用Nisin和Nisin与抗菌物质联用时的抑菌效果,发现均对耐甲氧西林金黄色葡萄球菌有抑制作用,但联用后的效果更强。最有趣的是探究细菌素作为潜在的抗癌剂,VILLARANTE等[49]报道了一种类似PediocinPA-1、分离自Pediococcus acidilactici K2a2-3的新Pediocin,具有针对HT29(人结肠腺癌和HeLa细胞系)的细胞毒活性。因此,通过优化已有的细菌素以及对新型细菌素的开发,解决现有细菌素的不足,将使细菌素得到更广泛的应用。
2 乳酸菌细菌素与肠道菌群
人体肠道微生态是一个密集、复杂和动态的系统,肠道菌群是系统中最重要且活跃的组成之一,肠道菌群的结构组成反映了微生物及其宿主水平的自然选择,促进了二者之间的相互合作并维持这个复杂系统的功能稳定性。肠道菌群的结构和代谢产物的改变与人体健康关系密切,造成肠道菌群结构及代谢产物变化的因素很多,包括饮食[50]、环境[51]、抗生素[52]以及益生菌的摄入等。
2.1 肠道菌群结构和代谢产物对相关疾病的影响
肠道菌群可以定植于肠道黏膜,构成天然保护屏障[53],并且合成有益的代谢产物(如短链脂肪酸SCFAs[54]等),产生抑菌物质,预防机体感染[55]。近年来,研究者发现肠道菌群的结构及其代谢产物能够以不同方式作用于宿主的免疫、激素和神经等系统,从而影响人体的健康。对单种菌群和复杂肠道菌群的组成与功能的表征显示了肠道微生物代谢对宿主的极大重要性。当肠道微生态的平衡被打破,造成的紊乱会引发许多疾病,如2型糖尿病[56]、肥胖症[57]、炎症性肠病[58]、精神类疾病、肿瘤、癌症[59]和机体老化等[60]。例如,张婷等[61]通过收集167例炎症性肠病患者、54例健康志愿者的新鲜粪便,对其中10种细菌进行分析,研究结果表明患者的肠道菌群结构发生明显失衡:肠球菌等条件致病菌数量上升,破坏肠道黏膜屏障功能,同时乳酸杆菌等有益菌数量也有所增加,这种有益菌的增多在某种程度上反映了肠道自我保护的反馈调节。因此,探究乳酸菌及其代谢产物对于肠道菌群的影响,进而影响疾病的治疗,具有极大的临床价值。
2.2 乳酸菌细菌素对肠道菌群结构及其代谢产物的影响
目前有关乳酸菌细菌素影响肠道菌群的研究报道还较少,主要集中于细菌素对于动物肠道环境的影响。例如,肠炎沙门菌与家禽的诸多胃肠道疾病有关,王蕾等[62]通过实验,从1月龄藏鸡的小肠黏膜中分离出具有强抑制肠炎沙门菌的食窦魏斯氏菌,这种乳酸菌产的细菌素可用来治疗感染肠炎沙门菌的家禽。副溶血性弧菌被认为是与食用海鲜有关的胃肠炎的主要原因,LV等[63]从鲫鱼肠道分离得到产细菌素的植物乳杆菌FGC-12,扫描电镜分析表明,鱼源细菌素能破坏目标副溶血性弧菌的细胞壁,使得菌细胞电导率增大,影响细胞膜的完整性,使得胞内容物泄露,他们进一步把这种菌产生的细菌素添加到虾中,证实了其对副溶血性弧菌有较强的抗菌活性。TOMITA等[64]通过巧妙的设计,获得了一种携带有接合缺陷型pPD1的粪肠球菌,这种菌可表达细菌素,但不能接合转移,能减少或消除耐万古霉素的肠球菌在小鼠肠道上的定殖,降低因使用抗生素治疗疾病导致肠道菌群紊乱进而引发的感染。CORR等[65]的实验表明,通过自身合成的细菌素ABP-118介导,Lactobacillus salivarius UCC118可以与病原菌直接拮抗,有效抵抗小鼠模型中出现的食源性Listeria monocytogenes感染。
在研究乳酸菌细菌素对肠道内目标致病菌产生抑制效果的同时,也有研究学者关注了乳酸菌细菌素对整体肠道菌群结构的影响。DABOUR等[66]通过体内外实验表明,Pediococcus acidilactici UL5在ICR小鼠体内可以合成片球菌素,Pediocin PA-1可有效抑制L. monocytogenes感染,阻碍病原体易位到肝和脾,且实验证明,相较于其他抗菌药物,Pediocin PA-1的潜在优势在于对小鼠肠道菌群结构基本无影响。基因改造Clostridium difficile CD4合成的细菌素,得到修饰的R型细菌素diffocin Av-CD291.1和Av-CD291.2可以在基本不影响小鼠原生肠道菌群结构的情况下,有针对性地预防艰难梭菌在宿主肠道定植,并将其杀灭[67]。B UERL等[68]研究结果表明,5种产Pediocin PA-1、Plantaricins EF等Ⅱ类细菌素的乳酸菌具有潜在的益生功能,如抑制肠道内问题细菌,短暂有利地改善宿主属水平上的原生肠道菌群结构,基本不影响门水平上的结构。此外,也有研究显示[69],唾液乳杆菌是否产细菌素Abp118基本不影响小鼠与猪的门水平上肠道菌群结构。另有实验证实[70],小鼠摄入的乳酸菌是否产细菌素、产生的细菌素种类及细菌素抑菌谱的宽窄都可能影响小鼠肠道的菌群结构,但不会显著影响其代谢产生的SCFAs含量。实验筛选得到具有抑菌能力的Pediococcus acidilactici CCFM 28和Lactobacillus gasseri JCM 11657,前者抑菌谱较宽,对小鼠肠道菌群中厚壁菌门和拟杆菌门的影响较小,后者抑菌谱较窄,会显著降低厚壁菌门的比例,提高拟杆菌门的比例,而对代谢产物SCFAs均无显著影响。
UERL等[68]研究结果表明,5种产Pediocin PA-1、Plantaricins EF等Ⅱ类细菌素的乳酸菌具有潜在的益生功能,如抑制肠道内问题细菌,短暂有利地改善宿主属水平上的原生肠道菌群结构,基本不影响门水平上的结构。此外,也有研究显示[69],唾液乳杆菌是否产细菌素Abp118基本不影响小鼠与猪的门水平上肠道菌群结构。另有实验证实[70],小鼠摄入的乳酸菌是否产细菌素、产生的细菌素种类及细菌素抑菌谱的宽窄都可能影响小鼠肠道的菌群结构,但不会显著影响其代谢产生的SCFAs含量。实验筛选得到具有抑菌能力的Pediococcus acidilactici CCFM 28和Lactobacillus gasseri JCM 11657,前者抑菌谱较宽,对小鼠肠道菌群中厚壁菌门和拟杆菌门的影响较小,后者抑菌谱较窄,会显著降低厚壁菌门的比例,提高拟杆菌门的比例,而对代谢产物SCFAs均无显著影响。
由此推测,乳酸菌可以通过细菌素作用,在基本不干扰宿主肠道结构及其稳态平衡的前提下,拮抗宿主体内某些致病菌,有效预防病原菌的感染,并促进了有益菌的生长,维持了动物肠道菌群与宿主之间的动态交流,但是以上报道均未深入探究体内细菌素对肠道菌群在分子机制层面的作用。乳酸菌细菌素种类多、数量大,抑菌分子机制十分复杂,目前对于这方面的研究还比较少。现有研究证实,部分细菌素作用于目标菌细胞膜,会在胞外释放出K+、Na+等金属阳离子,通过降低电势[71]影响膜的形状与生长。国内外研究者认为细菌素可以作用于参与合成细胞壁的物质、Lipid II、DNA和膜上甘露糖磷酸转移酶系统(MPTs)的N末端胞外环等,然而SANDHU等[72]发现,虽然目标菌细胞膜上缺少Lipid II,但Nisin仍对其产生作用。DABA等[73]发现Lactococcus lactis QU 7产的新型特异细菌素Lactococcin Z与已知的Lactococcin A有55.6%的同源性,但是可能由于两者C末端区相似度较低,Lactococcin Z杀菌时没有降低敏感细胞的膜电位,也不形成膜孔道,这表明细菌素抑菌还存在着诸多未知的机制。PIEWNGAM等[10]通过Agr缺陷菌株证实了Staphylococcus aureus肠道定植依赖于其Agr群体感应系统,而益生菌枯草芽孢杆菌产生的脂肽芬荠素Fengycin和自诱导肽AIP这一群体感应关键因子结构相似,能干扰Agr信号转导,并且灌胃产Fengycin的枯草芽孢杆菌能完全消除Staphylococcus aureus在小鼠肠道的定植,这为乳酸菌类细菌素在肠道中是否也存在通过干扰目标菌的信号转导从而影响其在肠道内的定植进而消除致病菌干扰的机制提供了新的思路。人体肠道环境复杂,不同的乳酸菌细菌素在体内能否特异性识别致病菌并将其杀灭、体外抑菌分子机制明确的细菌素在体内是否遵循相同的机制杀菌、是否会给人体健康带来未知的影响还需进一步研究。
基于肠道菌群与人体健康的密切联系、乳酸菌的益生功能和乳酸菌细菌素有效的抑菌性,研究乳酸菌细菌素对肠道微生态影响意义重大,了解细菌素对肠道菌群及代谢产物的影响能更好地确定益生菌株的有效性及安全性。然而在人体内,乳酸菌细菌素对肠道菌群的影响还非常少。人体共生菌群中的有益菌,有希望在上皮细胞的外表面产生细菌素,从而抑制细菌感染。据推测,乳酸菌细菌素对肠道菌群和宿主的作用可以分成2种,一种是细菌素先影响肠道菌群的结构,改变其种类及数量,再影响肠道菌群的代谢,最终影响宿主的正常功能,这类细菌素就是定植肽[74](colonizing peptides)和杀伤肽[75](killing peptides)。另一种是细菌素直接影响宿主的代谢,类似于细菌素作为一个信号分子起作用,即信号肽[76](signaling peptides)。如HEENEY等[77]认为,植物乳杆菌通过与细菌素Plantaricin EF相关的机制减少HFD诱导小鼠的体重增加,改善肥胖小鼠的肠道,并且有可能强化肠上皮细胞。此外,产细菌素的乳酸菌除了可以通过胞外分泌的信号肽实现菌种间或乳酸菌成员间的交流,也可以起到与人类自身产生的抗菌肽一样的作用,作用于人体细胞,比如免疫细胞。例如TAVERNE等[78]发现Lactobacillus plantarum WCFS1的产细菌素基因在一定程度上可对人树突状细胞进行免疫调节,从而影响宿主代谢,因此,乳酸菌细菌素可能具有一定调节宿主免疫系统的功能。
然而值得警惕的是,编码细菌素的基因如存在于质粒上,则可能存在将细菌素基因传递给其他菌的情况。例如,可在种间和属间找到类Pediocin PA-1的细菌素,而且在原位情况下质粒的转移效率更高[79],若是将这类菌运用于肠道中,由于细菌素能增强产生菌在肠道中的定植能力,则可能会造成该种细菌的大量繁殖,引发肠道菌群的紊乱,存在引发疾病的风险。
3 展望
细菌素由于表现出的优良性质使其很可能被用于临床治疗,但是目前这些研究多基于动物模型,人体实验还比较少,需要进一步理解其作用机制、建立防止或减少耐细菌素细菌产生的有效措施。乳酸菌在人体内发挥益生功效离不开肠道菌群这个重要的场所,由于乳酸菌在生活中占据着越来越重要的消费地位,乳酸菌是否安全以及乳酸菌细菌素是否会对健康人体的原生肠道产生影响成为迫在眉睫的问题。由于部分乳酸菌抗菌肽的产生需要竞争诱导,而人体肠道菌群是一个十分复杂的系统,有些在体外试验中不产细菌素或细菌素产量低的乳酸菌到了体内有可能产生大量的抗菌物质,因此乳酸菌的安全性还需要经过其对人体肠道菌群的影响进行评估。结合飞速发展的宏基因组技术,人们需要更深入地研究肠道中菌群与产细菌素乳酸菌的关系,对乳酸菌的应用提出更科学的依据。
[1] 杨洁彬, 郭兴华,张箎,等. 乳酸菌:生物学基础及应用[M]. 北京:中国轻工业出版社, 1996.
[2] 霍贵成. 乳酸菌的研究与应用[M]. 北京:中国轻工业出版社, 2007.
[3] CLEVELAND J,MONTVILLE T J,NES I F,et al. Bacteriocins: safe, natural antimicrobials for food preservationa[J]. International Journal of Food Microbiology, 2001, 71(1): 1-20.
[4] LIU Hui, ZHANG Lanwei, YI Huaxi, et al. A novel enterocin T1 with anti-pseudomonas activity produced by Enterococcus faecium T1 from Chinese Tibet cheesea[J].World Journal of Microbiology & Biotechnology,2016,32(21): 1-9.
[5] 王刚,贺禹丰,陈晓华,等.乳酸菌生物学特性与其拮抗空肠弯曲杆菌在小鼠肠道定植能力的分析[J].食品与发酵工业,2017,43(8): 73-80.
[6] AFFHAN S, DACHANG W, XIN Y, et al. Lactic acid bacteria protect human intestinal epithelial cells from Staphylococcus aureus and Pseudomonas aeruginosa infections[J]. Genetics & Molecular Research Gmr, 2015, 14(4): 17 044-17 058.
[7] HEMARAJATA P,VERSALOVIC J.Effects of probiotics on gut microbiota: mechanisms of intestinal immunomodulation and neuromodulation[J]. Therapeutic Advances in Gastroenterology, 2013, 6(1): 39-51.
[8] HOU Qihang,YE Lulu,LIU Haofei,et al.Lactobacillus accelerates ISCs regeneration to protect the integrity of intestinal mucosa through activation of STAT3 signaling pathway induced by LPLs secretion of IL-22[J].Cell Death & Differentiation,2018,25(9):1 657-1 670.
[9] 刘静,杨富民,白斌芳,等.产细菌素乳酸菌菌株的来源及所产细菌素的分类研究进展[J].中国酿造,2018,37(6):20-24.
[10] PIEWNGAM P,ZHENG Yue,NGUYEN T H,et al. Pathogen elimination by probiotic bacillus via signalling interference[J]. Nature, 2018, 562(7 728): 532-537.
[11] MUNCH D, MULLER A, SCHNEIDER T, et al. The Lantibiotic NAI-107 binds to bactoprenol-bound cell wall precursors and impairs membrane functions[J].Journal of Biological Chemistry,2014, 289(17): 12 063-12 076.
[12] MIAO Jianyin,LIU Guo,KE Chang,et al.Inhibitory effects of a novel antimicrobial peptide from kefir against Escherichia coli [J]. Food Control, 2016, 65:63-72.
[13] DAW M A, FALKINERFR. Bacteriocins: nature, function and structurea[J]. Micron, 1996,27(6):467-479.
[14] GILLOR O,ETZION A,RILEY M.The dual role of bacteriocins as anti-and probiotics[J].Applied Microbiology and Biotechnology,2008, 81(4): 591-606.
[15] ZOUHIRA,HAMMAMIR,FLISSI,et al. A new structure-based classification of gram-positive bacteriocins[J].The Protein Journal, 2010, 29(6): 432-439.
[16] 马国涵,马欢欢,吕欣然,等.大菱鲆肠道中广谱拮抗活性乳酸菌的筛选及其细菌素鉴定[J].食品科学,2019,40(6):159-165.
[17] 吴轶,贡汉生,刘文丽,等.一株产细菌素乳杆菌的鉴定及其细菌素编码基因的获得[J].食品科学,2015,36 (11):110-113.
[18] KLAENHAMMER T. Genetics of bacteriocins produced by lactic acid bacteria[J].FEMS Microbiology Reviews, 1993, 12(1-3): 39-85.
[19] ARNISON PG,BIBB MJ,BIERBAUM G,et al.Ribosomally synthesized and post-translationally modified peptide natural products: overview and recommendations for a universal nomenclature[J]. Natural Product Reports,2013, 30(1): 108-60.
[20] ZHANG Jianming,YANG Yanyan,YANG Hui,et al. Purification and partial characterization of bacteriocin Lac-B23, a novel bacteriocin production by Lactobacillus plantarum J 23, isolated from chinese traditional fermented milk[J].Frontiers in Microbiology, 2018, 9:2 165.
[21] KASUGA G, TANAKA M, HARADA Y, et al. Homologous expression and characterization of gassericin T and gassericin S, a novel class IIb bacteriocin produced by Lactobacillus gasseri LA327[J].Applied and Environmental Microbiology,2019, 85(6): e02815-18.
[22] SHI Feng,WANG Yanwei,LI Yongfu,et al.Mode of action of leucocin K7 produced by Leuconostoc mesenteroides K7 against Listeria monocytogenes and its potential in milk preservation [J].Biotechnology Letters,2016, 38(9):1 551-1 557.
[23] DRAPER A L,COTTER D P,HILL C,et al. The two peptide lantibiotic lacticin 3147 acts synergistically with polymyxin to inhibit gram negative bacteria[J]. BMC Microbiology, 2013, 13: 212.
[24] FERN NDEZ M,MART
NDEZ M,MART NEZ-BUENO M,MART
NEZ-BUENO M,MART N M C,et al. Heterologous expression of enterocin AS-48 in several strains of lactic acid bacteria[J].Journal of Applied Microbiology, 2007, 102(5): 1 350-1 361.
N M C,et al. Heterologous expression of enterocin AS-48 in several strains of lactic acid bacteria[J].Journal of Applied Microbiology, 2007, 102(5): 1 350-1 361.
[25] SHELBURNE C E,AN F Y, DHOLPE V,et al. The spectrum of antimicrobial activity of the bacteriocin Subtilosin A[J]. Journal of Antimicrobial Chemotherapy, 2007(59): 297-300.
[26] ASAM D, MAUERER S, SPELLERBERG B.Streptolysin S of Streptococcus anginosus, exhibits broad-range hemolytic activity[J]. Medical Microbiology & Immunology, 2014,204(2):227-237.
[27] BRIMBLE M A,EDWARDS P J,HARRIS P W R,et al.Synthesis of the antimicrobial s-linked glycopeptide, glycocin f[J]. Chemistry-A European Journal, 2015, 21(9): 3 556-3 561.
[28] ALVAREZ-SIEIRO P,MONTALB N-L
N-L PEZ M,MU Dongdong,et al. Bacteriocins of lactic acid bacteria: Extending the family[J]. Applied Microbiology and Biotechnology,2016,100(7):2 939-2 951.
PEZ M,MU Dongdong,et al. Bacteriocins of lactic acid bacteria: Extending the family[J]. Applied Microbiology and Biotechnology,2016,100(7):2 939-2 951.
[29] BERNBOM N,JELLE B,BROGREN C,et al.Pediocin PA-1 and a Pediocin producing Lactobacillus plantarum strain do not change the hma rat microbiota[J].International Journal of Food Microbiology, 2009, 130(3): 251-257.
[30] CINTAS LM,CASAUS P,FERN NDEZ MF,et al. Comparative antimicrobial activity of Enterocin L50, Pediocin PA-1, Nisin a and Lactocin S against spoilage and foodborne pathogenic bacteria[J]. Food Microbiology, 1998, 15(3): 289-298.
NDEZ MF,et al. Comparative antimicrobial activity of Enterocin L50, Pediocin PA-1, Nisin a and Lactocin S against spoilage and foodborne pathogenic bacteria[J]. Food Microbiology, 1998, 15(3): 289-298.
[31] MART NEZ B,RODR
NEZ B,RODR GUEZ A,SU
GUEZ A,SU REZ JE. Lactococcin 972, a bacteriocin that inhibits septum formation in lactococci[J]. Microbiology, 2000,146(4): 949-955.
REZ JE. Lactococcin 972, a bacteriocin that inhibits septum formation in lactococci[J]. Microbiology, 2000,146(4): 949-955.
[32] 张甜甜.中国传统发酵食品中Enterolysin及Helveticin J基因多样性及抑菌活性研究[D].上海:上海海洋大学,2013.
[33] COTTER P D.Bioengineering: A bacteriocin perspective[J]. Bioengineered, 2012,3(6): 313-319.
[34] SETTANNI L,MASSITTI O,SINDEREN V D,et al. In situ activity of a bacteriocin-producing lactococcus lactis strain. influence on the interactions between lactic acid bacteria during sourdough fermentation[J].Journal of Applied Microbiology,2005,99(3): 670-681.
[35] DRAPER A L,GRAINGER K,DEEGAN H L,et al.Cross-immunity and immune mimicry as mechanisms of resistance to the lantibiotic lacticin 3147[J].Molecular Microbiology,2009, 71(4):1 043-1 054.
[36] PEI J,LI X,HAN H,et al.Purification and characterization of plantaricin SLG1,a novel bacteriocin produced by L.plantarum,isolated from yak cheese[J].Food Control,2017,84:111-117.
[37] BLASER M. Antibiotic overuse stop the killing of beneficial bacteria[J]. Nature, 2011(476):393-394.
[38] 匡珍,李学英,徐春霞,等.乳酸菌细菌素研究进展及其在水产养殖和加工中的应用[J].食品工业科技,2019,40(4):292-298.
[39] 韩雪,王雅冰,郝建雄,等.产细菌素乳酸菌发酵棉籽粕饲喂蛋鸡效果研究[J].中国饲料,2019(11):45-48.
[40] 李南充.微生态制剂在池塘养殖中的应用研究[J].水产科学,2015,34(4): 251-255.
[41] COTTER P D,HILL C,ROSS R P.Bacteriocins:developing innate immunity for food[J].Nature Reviews Microbiology,2005, 3(10): 777-788.
[42] DELVES-BROUGHTON J,BLACKBURN P,EVANS RJ,et al.Applications of the bacteriocin,Nisin[J].Antonie van Leeuwenhoek,1996(69):193-202.
[43] SCHILLINGER U,GEISEN R,HOLZAPFEL W H. Potential of antagonistic microorganisms and bacteriocins for the biological preservation of foods[J]. Trends in Food Science & Technology, 1996, 7(5): 158-164.
[44] 张晓宁,尚一娜,陈境,等.乳酸菌细菌素的作用机制及在肉制品中的应用[J].食品研究与开发,2018,39(11):192-199.
[45] BALCIUNAS E M,MARTINEZ F A C,TODOROV S D,et al.Novel biotechnological applications of bacteriocins: A review[J]. Food Control,2013,32(1):134-142.
[46] VUKOMANOVI
![]() al.Nano-engineering the antimicrobial spectrum of lantibiotics:activity of nisin against gram negative bacteria[J].Scientific Reports,2017,7(1):4 324.
al.Nano-engineering the antimicrobial spectrum of lantibiotics:activity of nisin against gram negative bacteria[J].Scientific Reports,2017,7(1):4 324.
[47] VAN STADEN A D,BRAND A M,DICKS L M T.Nisin F-loaded brushite bone cement prevented the growth of Staphylococcus aureus in vivo[J]. Journal of Applied Microbiology,2012, 112(4): 831-840.
[48] GIACOMETTI A,CIRIONI O,BARCHIESI F,et al.In-vitro activity and killing effect of polycationic peptides on methicillin-resistant Staphylococcus aureus and interactions with clinically used antibiotics[J]. Diagn Microbiol Infect Dis, 2000, 38(2): 115-118.
[49] VILLARANTE KI, ELEGADOF B, IWATANI S,et al.Purification and characterization and in vitro cytotoxicity of the bacteriocin from Pediococcus acidilactici K2a2-3 against human colon adenocarcinoma (HT29) and human cervical carcinoma (HeLa) cells[J].World Journal of Microbiology and Biotechnology, 2011, 27(4): 975-980.
[50] KIILERICH P, MYRMEL LS, FJ☞RE E,et al. Effect of a long-term high-protein diet on survival, obesity development, and gut microbiota in mice[J]. American Journal of Physiology-Endocrinology and Metabolism, 2016, 310(11): 886-899.
[51] JIN Yuanxiang,WU Sisheng,ZENG Zhaoyang,et al.Effects of environmental pollutants on gut microbiota[J]. Environmental Pollution, 2017, 222: 1-9.
[52] LANGE K, BUERGER M, STALLMACH A, et al. Effects of antibiotics on gut microbiota[J]. Digestive Diseases, 2016, 34(3): 260-268.
[53] NEISH A S. Mucosal immunity and the microbiome[J]. Annals of the American Thoracic Society, 2014, 11: 28-32.
[54] BESTEN G D, EUNEN K V, GROEN A K,et al. The role of short-chain fatty acids in the interplay between diet, gut microbiota, and host energy metabolism[J].The Journal of Lipid Research, 2013, 54(9): 2 325-2 340.
[55] HUANG Xiuyan, ZENG Yaoying.Advances in pathophysiology of gut microbiota[J].Chinese Journal of Pathophysiology, 2014, 30(6): 1 127-1 135.
[56] AHMADI S, NAGPAL R, WANG S, et al. Prebiotics from acorn and sago prevent high-fat-diet-induced insulin resistance via microbiome-gut-brain axis modulation [J]. The Journal of Nutritional Biochemistry, 2019, 67:1-13.
[57] XU Pengfei,HONG Fan,WANG Jialin,et al. Microbiome Remodeling via the montmorillonite adsorption-excretion axis prevents obesity-related metabolic disorders[J]. EBioMedicine, 2017, 16:251-261.
[58] YU LC. Microbiota dysbiosis and barrier dysfunction in inflammatory bowel disease and colorectal cancers: exploringa common ground hypothesis[J].Journal of Biomedical Science,2018,25(1): 79-79.
[59] WANG Tingting,CAI Guoxiang,QIU Yunping,et al.Structural segregation of gut microbiota between colorectal cancer patients and healthy volunteers[J].Isme Journal, 2011,6(2):320-329.
[60] 陈卫,田培郡,张程程,等.肠道菌群与人体健康的研究热点与进展[J].中国食品学报,2017,17(2):1-9.
[61] 张婷,陈烨,王中秋,等.炎症性肠病患者肠道菌群结构的变化及其与炎性指标的关系[J].南方医科大学学报,2013,33(10):1 474-1 477;1 498.
[62] 王蕾,张辉,童小乐,等.藏鸡源食窦魏斯氏菌的抑菌特性研究[J].畜牧与兽医,2017,49(12):55-59.
[63] LV Xinran,DU Jingfang,YU Jie,et al.Purification and antibacterial mechanism of fish-borne bacteriocin and its application in shrimp (Penaeus vannamei) for inhibiting vibrio parahaemolyticus[J].World Journal of Microbiology and Biotechnology,2017,33(8).
[64] TOMITA H,FUJIMOTO S,TANIMOTO K,et al. Cloning and genetic and sequence analyses of the bacteriocin 21 determinant encoded on the Enterococcus faecalis pheromone-responsive conjugative plasmid pPD1[J].Journal of Bacteriology,1997,179(24): 7 843-7 855.
[65] CORR S C,LI Yin,RIEDEL C U,et al.Bacteriocin production as a mechanism for the antiinfective activity of lactobacillus salivarius UCC118[J].Proceedings of the National Academy of Sciences,2007,104(18):7 617-7 621.
[66] DABOUR N,ZIHLER A,KHEADR E,et al.In vivo study on the effectiveness of Pediocin PA-1 and pediococcus acidilactici UL5 at inhibiting Listeria monocytogenes[J].International Journal of Food Microbiology,2009,133(3):225-233.
[67] GEBHART D,LOK S,CLARE S,et al.A modified R-type bacteriocin specifically targeting clostridium difficile prevents colonization of mice without affecting gut microbiota diversity[J]. MBio, 2015,6(2):e02 368-14.
[68] UMU ÖC O, B UERL C, OOSTINDJER M, et al.The potential of class II bacteriocins to modify gut microbiota to improve host health[J]. Plos One, 2016, 11(10):e0 164 036.
UERL C, OOSTINDJER M, et al.The potential of class II bacteriocins to modify gut microbiota to improve host health[J]. Plos One, 2016, 11(10):e0 164 036.
[69] RIBOULET-BISSON E,STURME M H J,JEFFERY I B,et al.Effect of Lactobacillus salivarius bacteriocin Abp118 on the mouse and pig intestinal microbiota[J].PLoS One, 2012,7(2):e31 113.
[70] 俞赟霞,王刚,赵建新,等.乳酸菌细菌素对小鼠肠道菌群结构及代谢产物的影响[J].食品与发酵工业,2018,44(7):20-28.
[71] LEE S Y, KANG D H. Survival mechanism of Escherichia coli O157: H7 against combined treatment with acetic acid and sodium chloride[J]. Food Microbiol,2016,(55): 95-104.
[72] PRINCEA,SANDHU P,ROR P,et al.Corrigendum:Lipid-Ⅱ independent antimicrobial mechanism of Nisin depends on its crowding and degree of oligomerization[J].Scientific Reports,2016,6(1):37 908.
[73] DABA G M, ISHIBASHI N, GONG X, et al.Characterisation of the action mechanism of a Lactococcus-specific bacteriocin, lactococcin Z[J]. Journal of Bioscience and Bioengineering, 2018, 126(5): 603-610.
[74] WALSH M C,GARDINER G E,HART O M,et al.Predominance of a bacteriocin-producing Lactobacillus salivarius component of a five-strain probiotic in the porcine ileum and effects on host immune phenotype[J].FEMS Microbiology Ecology, 2008, 64(2): 317-327.
[75] KOMMINENI S,BRETL D J,LAM V,et al.Bacteriocin production augments niche competition by enterococci in the mammalian GI tract[J]. Nature, 2015, 526(7 575):719-722.
[76] STURME M H J,KLEEREBEZEM M,NAKAYAMA J,et al.Cell to cell communication by autoinducing peptides in gram-positive bacteria[J]. Antonie Van Leeuwenhoek, 2002, 81(1-4): 233-243.
[77] HEENEY D D, ZHAI Z, BENDIKS Z, et al.Lactobacillus plantarum bacteriocin is associated with intestinal and systemic improvements in diet-induced obese mice and maintains epithelial barrier integrity in vitro[J]. Gut Microbes, 2019, 10(3): 382-397.
[78] MEIJERINK M,VAN H S,TAVERNE N,et al.Identification of genetic loci in Lactobacillus plantarum that modulate the immune response of dendritic cells using comparative genome hybridization[J]. PLoS One, 2010, 5(5): e10 632.
[79] DEVI S M,HALAMI P M.Conjugal transfer of bacteriocin plasmids from different genera of lactic acid bacteria into Enterococcus faecalis JH2-2[J].Annals of Microbiology,2013,63(4): 1 611-1 617.