淀粉酶是一类重要的糖苷水解酶,可作用于淀粉,将其分解为糊精、麦芽糖、葡萄糖等小分子糖,根据作用方式的不同,分为α-淀粉酶、β-淀粉酶、糖化酶和异淀粉酶等[1]。作为工业应用中最广泛的一类酶,淀粉酶在发酵、食品、饲料、医疗和印染等领域都具有重要应用价值[2],如添加适量中温α-淀粉酶到面粉中,可以有效改善面团质量,增强面条口感与质构咀嚼性[3];在啤酒酿造时添加淀粉酶高粱辅料,可降低啤酒生产成本,增加企业效益[4];在禽畜饲料中添加淀粉酶可以提高饲料转化率,增强禽畜生产性能[5-6]。
白酒酿造离不开大曲,而淀粉酶则是大曲中重要的一类水解酶[7],对于大曲原料利用以及白酒风味物质形成具有重要作用[8],还稳定出酒率,提高基酒质量[9]。大曲中淀粉酶主要来源于大曲微生物,但目前对大曲中产淀粉酶菌株的研究多集中于细菌及霉菌[10-15],对高产淀粉酶酵母研究的较少。
扣囊复膜孢酵母是一类产子囊孢子的二形态酵母[16],广泛存在于高淀粉含量基质中,能够分泌淀粉酶、酸性蛋白酶及β-葡萄糖苷酶[17-19],是大曲发酵前期优势菌种,在白酒酿造过程中被广泛分离使用[20-22]。作为产生淀粉分解酶类最好的子囊孢子菌之一,扣囊复膜孢酵母在酿酒行业极具应用潜力,因此对筛选得到的高产淀粉酶扣囊复膜孢酵母进行研究是十分必要的。
本研究通过单因素实验及响应面分析对筛选自芝麻香型白酒高温大曲中的高产淀粉酶菌株扣囊复膜孢酵母(Saccharomycopsis fibuligera)CICC 33077进行了发酵产酶条件的优化,并对该酶酶学性质进行了初步探究,旨在为该菌株在制曲及白酒生产中的实际应用奠定理论基础。
1 材料与方法
1.1 试验菌株
S. fibuligera CICC 33077分离于扳倒井芝麻香型白酒高温大曲,保藏于中国工业微生物菌种保藏管理中心(China Center of Industrial Culture Collection, CICC)。
1.2 试验试剂
麦芽浸粉琼脂(malt extract agar,MEA) 培养基、麦芽浸粉肉汤(malt extract broth,MEB) 培养基,北京陆桥技术有限公司。
可溶性淀粉,天津市福晨化学试剂厂;无水葡萄糖,广东汕头市西陇化工厂;K2HPO4、KH2PO4,北京化工厂;麦芽浸粉、蛋白胨、大豆蛋白胨,北京奥博星生物技术有限责任公司。
1.3 试验设备
FE20型pH计,梅特勒-托利多仪器(上海)有限公司;BHG-8082型恒温培养箱、THZ-98C恒温振荡培养箱,上海一恒科学仪器有限公司;Multiskan FC型酶标仪,赛默飞世尔(上海)仪器有限公司;HH3A型恒温水浴锅,国华电器有限公司。
1.4 试验方法
1.4.1 培养基及主要试剂配制
种子培养基(质量分数):麦芽浸粉3.586%、大豆蛋白胨1.216%、蛋白胨1.470%、K2HPO4 1.148%,pH 6.0,121 ℃下灭菌15 min。
葡萄糖标准溶液:准确称取葡萄糖0.1 g,用超纯水溶解并定容至100 mL,配制成质量浓度1 g/L的葡萄糖标准溶液。
质量浓度10 g/L可溶性淀粉缓冲液:准确称取可溶性淀粉1.0 g,加入少量蒸馏水煮沸至透明,冷却后加入0.2 mol/L pH 5.50磷酸缓冲液10 mL,定容至100 mL。
3,5-二硝基水杨酸(3,5-dinitrosalicylic acid, DNS)试剂:准确称取DNS 6.3 g、NaOH 21 g,加水,加热至50 ℃全溶,称取酒石酸钾钠182 g于300 mL水中,加热溶解并倒入前溶液中,加入重蒸苯酚5 g、无水Na2SO4 5 g,溶解后定容至1 000 mL,过滤,贮于棕色瓶中放置7 d后使用。
1.4.2 种子液制备
菌株活化:将甘油保藏的S.fibuligera CICC 33077接种到MEA斜面培养基,30 ℃培养24 h后挑取一环接种到MEB液体培养基中,于30 ℃,200 r/min培养24 h。
种子液制备:按照2%接种量将活化后的S.fibuligera CICC 33077接种于装液量为50 mL/250 mL种子液培养基中,30 ℃、200 r/min条件下培养24 h。
1.4.3 粗酶液制备
取1 g固体发酵物,加水定容至200 mL,静置浸提30 min后,于5 000 r/min条件下离心20 min,取上清液为粗酶液。
1.4.4 标准曲线绘制
将配制好的葡萄糖标准溶液分别稀释为质量浓度0.2、0.4、0.6、0.8、1.0 g/L的标准糖液组,在装有0.5 mL标准糖液的试管中加入1.5 mL DNS试剂,于沸水中煮沸15 min,冷却,加入10.5 mL蒸馏水,摇匀后在550 nm波长下测吸光值A。以葡萄糖含量为横坐标,吸光值A为纵坐标,绘制葡萄糖标准曲线,求出回归方程。
1.4.5 淀粉酶酶活力的测定方法
使用DNS[23]法测定淀粉酶活力:将1 mL粗酶液加入到9 mL pH 5.5的质量浓度10 g/L淀粉缓冲液中,50 ℃恒温水浴中精确反应20 min后迅速吸取0.5 mL反应液加入到1.5 mL DNS试剂中,终止反应,后续处理参照1.4.4。利用葡萄糖标准曲线计算生成的还原糖(以葡萄糖计)量。淀粉酶活力单位定义为:1 mL粗酶液(或1g固体发酵物)在pH 5.0、50 ℃的条件下,1 h水解质量浓度10 g/L淀粉液生成1 μmol葡萄糖为1个酶活力单位,以μ/mL(μ/g)表示。
1.4.6 产淀粉酶发酵条件优化
(1)发酵培养基原料确定
分别选取麸皮、高粱、玉米、小麦和稻谷5种原料(除麸皮外,均带皮粉碎)25 g装入500 mL三角瓶中,按照干基量的40%加入10 mL水,灭菌后接入10% 种子液,30 ℃培养96 h后,检测发酵物淀粉酶活力,选取酶活最高者为后续试验发酵培养基的原料。
(2)单因素试验
确定发酵培养基原料后,分别探究原料添加量、干基含水量、接种量、发酵温度以及发酵时间对S.fibuligera CICC 33077固体发酵产酶的影响,确定不同因素的适宜范围及后续响应面试验的中心点。
(3)Box-Behenken响应面分析法试验设计
在单因素试验的基础上,运用Design-Expert 10.0.4软件设计响应面试验。根据Box-Behnken试验的设计原理[24-25],以淀粉酶酶活力为响应值,选取对菌株产酶影响较大的原料添加量、干基含水量、发酵温度和接种量4个因素,设计4因素3水平响应面试验,并进行回归分析及显著性检验,以确定产淀粉酶发酵的最佳条件组合。每个试验组合做3组平行,取平均值,其中各影响因素水平编码如表1所示。
表1 Box-Behnken试验设计因素与水平
Table 1 Factors and levels of Box-Behnken experiments design

代码因素水平-101A原料添加量/g102540B含水量/%204060C发酵温度/℃202530D接种量/%102030
1.4.7 淀粉酶性质初探
(1)酶最适反应温度测定
在优化得到的产淀粉酶最佳条件组合下发酵72 h,以pH 5.5的质量浓度10 g/L的可溶性淀粉缓冲液为底物,按照上述酶活力的测定方法,分别在30、40、50、60、70 ℃条件下测定发酵物淀粉酶活力,并以淀粉酶酶活力最高者为100%。
(2)酶最适反应pH值测定
在优化得到的产淀粉酶最佳条件组合下发酵72 h,分别用pH 2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0的缓冲液配制质量浓度10 g/L的可溶性淀粉为底物,按照上述酶活力的测定方法,在最适反应温度下测定发酵物的淀粉酶活力,并以淀粉酶酶活力最高者为100%。
2 结果与分析
2.1 发酵培养基原料确定
淀粉酶是一类水解酶,不同的原料对S.fibuligera CICC 33077发酵产酶均有影响。试验选取麸皮、高粱、玉米、小麦、稻谷为原料进行产酶发酵,结果表明(图1),发酵培养基以麸皮为原料时,酶活力最高,达到7 000 U/g以上;以高粱、小麦为原料时,酶活力相当,为2 500 U/g左右,而以玉米和稻谷为原料时,淀粉酶活力相对较低。麸皮价格低廉,且所产淀粉酶活力最高,因此选取麸皮为后续发酵试验培养基原料。
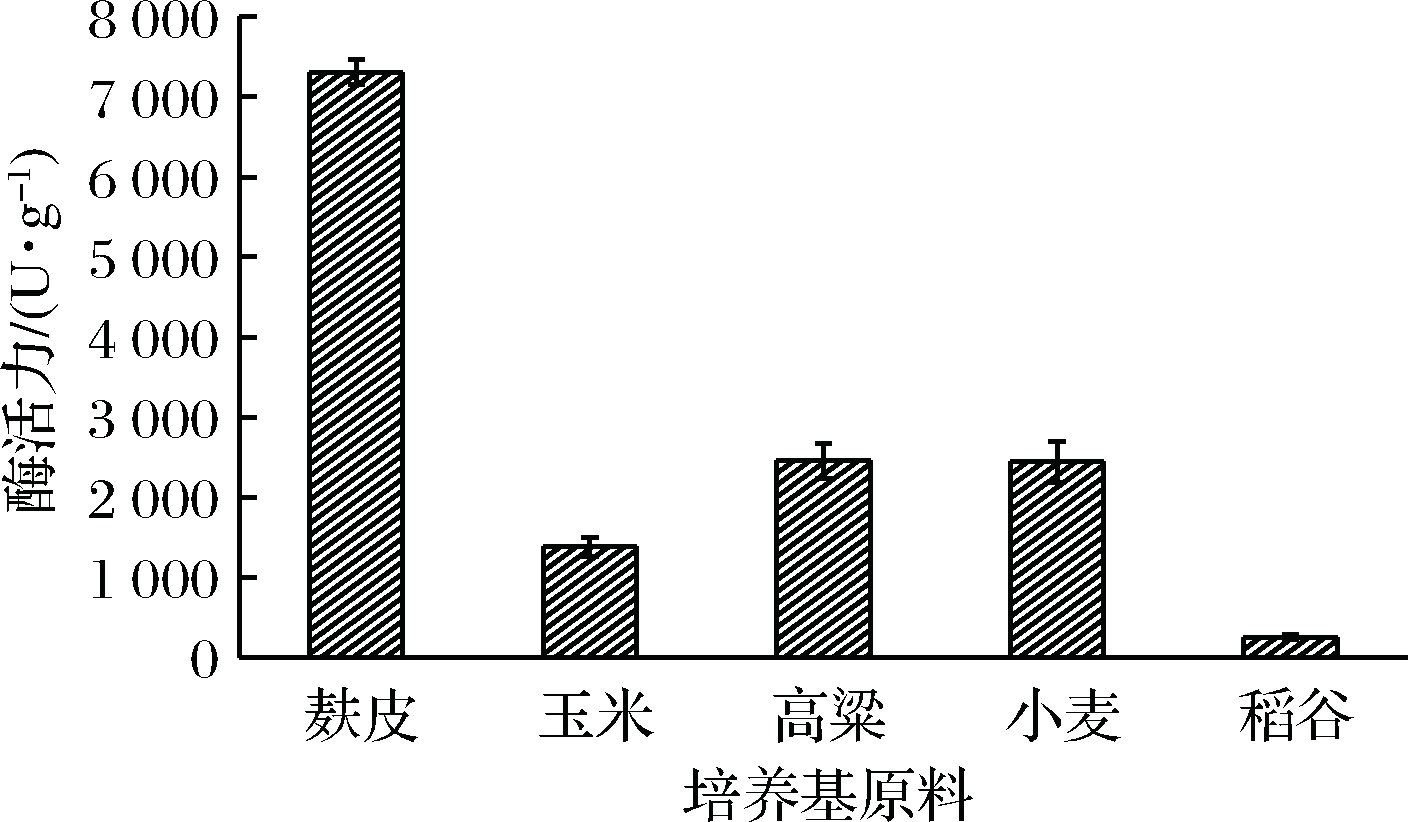
图1 不同发酵培养基原料发酵试验
Fig.1 Fermentation test of different fermentation medium raw materials
2.2 单因素试验设计与分析
2.2.1 原料添加量对S. fibuligera CICC 33077 产酶的影响
分别取10、25、40、55、70 g麸皮装入500 mL三角瓶中,按加入原料质量的40%加入一定量的水,接入10% 种子液,30 ℃发酵96 h后,测定淀粉酶活力,考察原料添加量对于菌株发酵产酶的影响。实验结果表明,原料添加量在10~70 g内,淀粉酶活力呈先增大后下降的趋势,原料添加量为25 g条件下,酶活力最高,为7 586 U/g,而后随着原料添加量的增加,酶活力显著下降。这是因为麸皮中含有硫胺酸、核黄素、尼克酸等营养物质,利于微生物生长产酶[26];但添加量过多时,培养基的蓬松程度会受到影响,通气量大大降低,从而影响微生物产酶。故选取原料添加量25 g为响应面试验中心点。
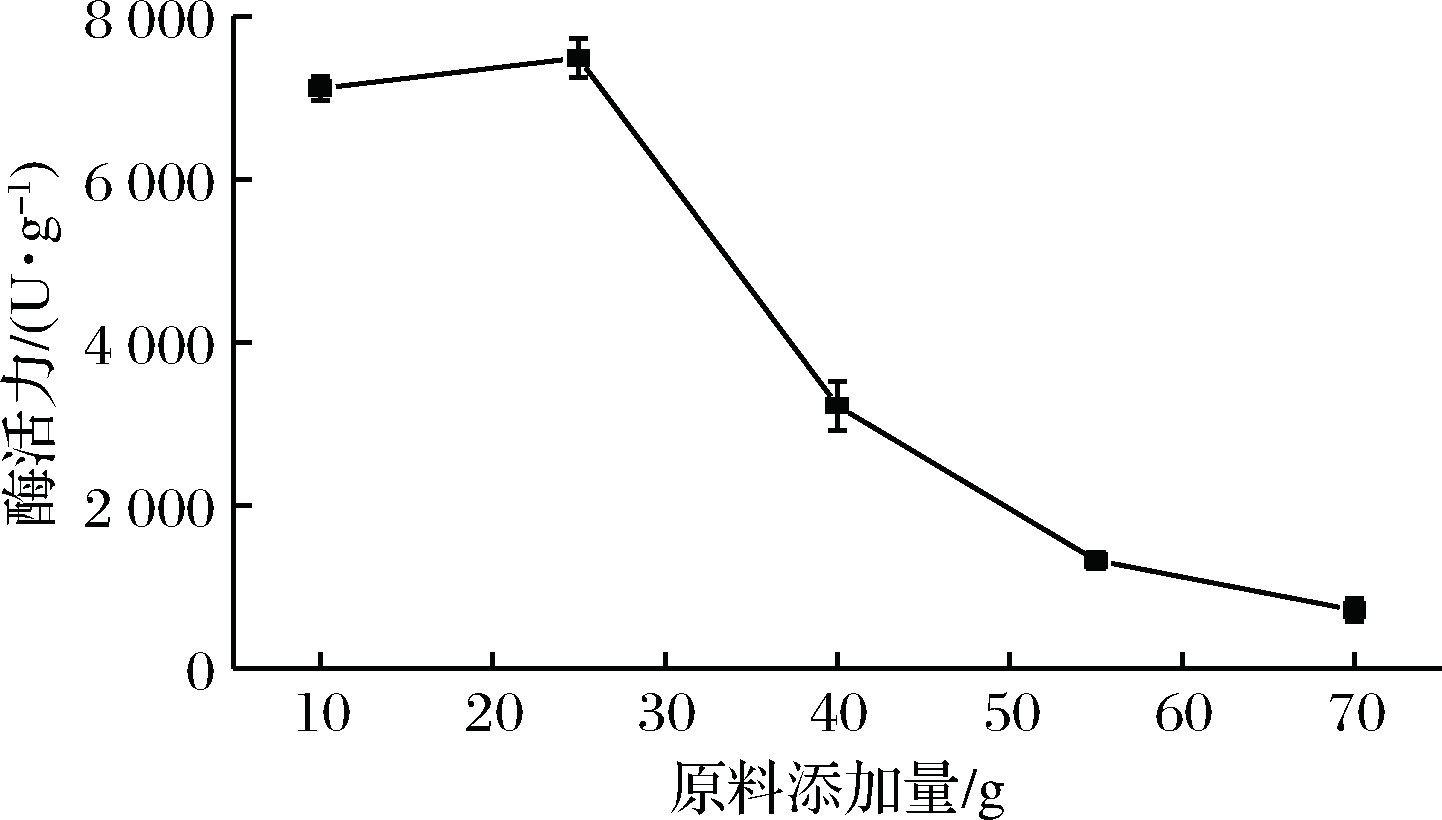
图2 原料添加量单因素试验
Fig.2 Single factor test of raw material amount
2.2.2 含水量对S. fibuligera CICC 33077 产酶的影响
取25 g麸皮装入500 mL三角瓶中,分别按干基质量的20%、40%、60%、80%、100%、120% 加入一定量的水,接入10% 种子液,30 ℃发酵96 h后,测定淀粉酶活力,探究干基含水量对菌株发酵产酶的影响。实验结果表明,原料水含量在 20%~40%内,随水含量增加,淀粉酶活力增大,当水含量为40%时,酶活力达到最大值,当水含量超过40%时,淀粉酶活力有下降趋势。这是因为微生物的一切代谢活动都离不开水,水分含量的高低直接影响微生物对营养物质的利用效率;当培养基干基含水量为40% 时,麸皮湿润疏松,培养基的颗粒之间存在合适的空隙,利于O2融入、CO2排出和菌体生长繁殖,从而增加产酶量[27];当含水量过低时,不能维持菌体生长特性,引起细胞新陈代谢不平衡,影响产酶量;而当含水量过高时,物料易结块成团,多孔性降低,物料内的气体交换减少,培养基透气性下降,难以进行通风和散热,不利于微生物生长和产酶。因此,40%水含量为培养基最适含水量,并以此作为响应面实验中心点。
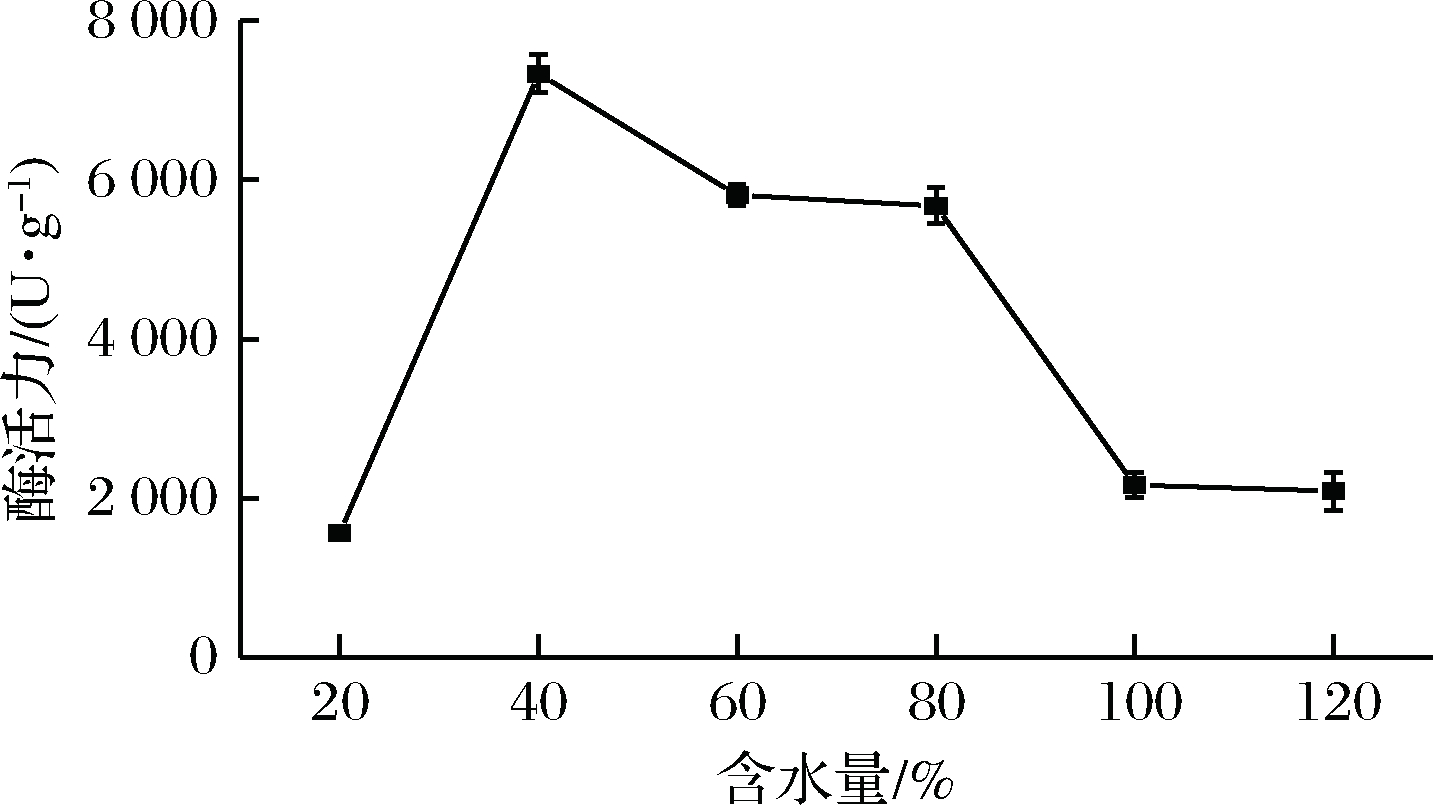
图3 含水量单因素试验
Fig.3 Single factor test of water content
2.2.3 接种量对S. fibuligera CICC 33077 产酶的影响
取25 g麸皮装入500 mL三角瓶中,按干基质量的40% 加入一定量的水,分别接入10%、20%、30%、40%、50%的种子液,30℃发酵96 h后,测定淀粉酶活力,探究接种量对于菌株发酵产酶的影响。实验结果表明,随着接种量增加,酶活也相应增大,当种子液接种量为20%时,淀粉酶活力达到最大,当接种量大于20%时,淀粉酶活力反而减小。这是因为接种量过小时,会造成菌体细胞生长量小,菌株到达对数生长期的时间延滞,从而延长发酵时间,对产酶有不利影响;而接种量过大,菌体生长过旺,会加快培养基消耗,菌体快速进入稳定期和衰亡期,同时大量产热,造成培养基内部温度快速升高,对产酶有不利影响[28]。因此选取接种量20%为响应面实验中心点。
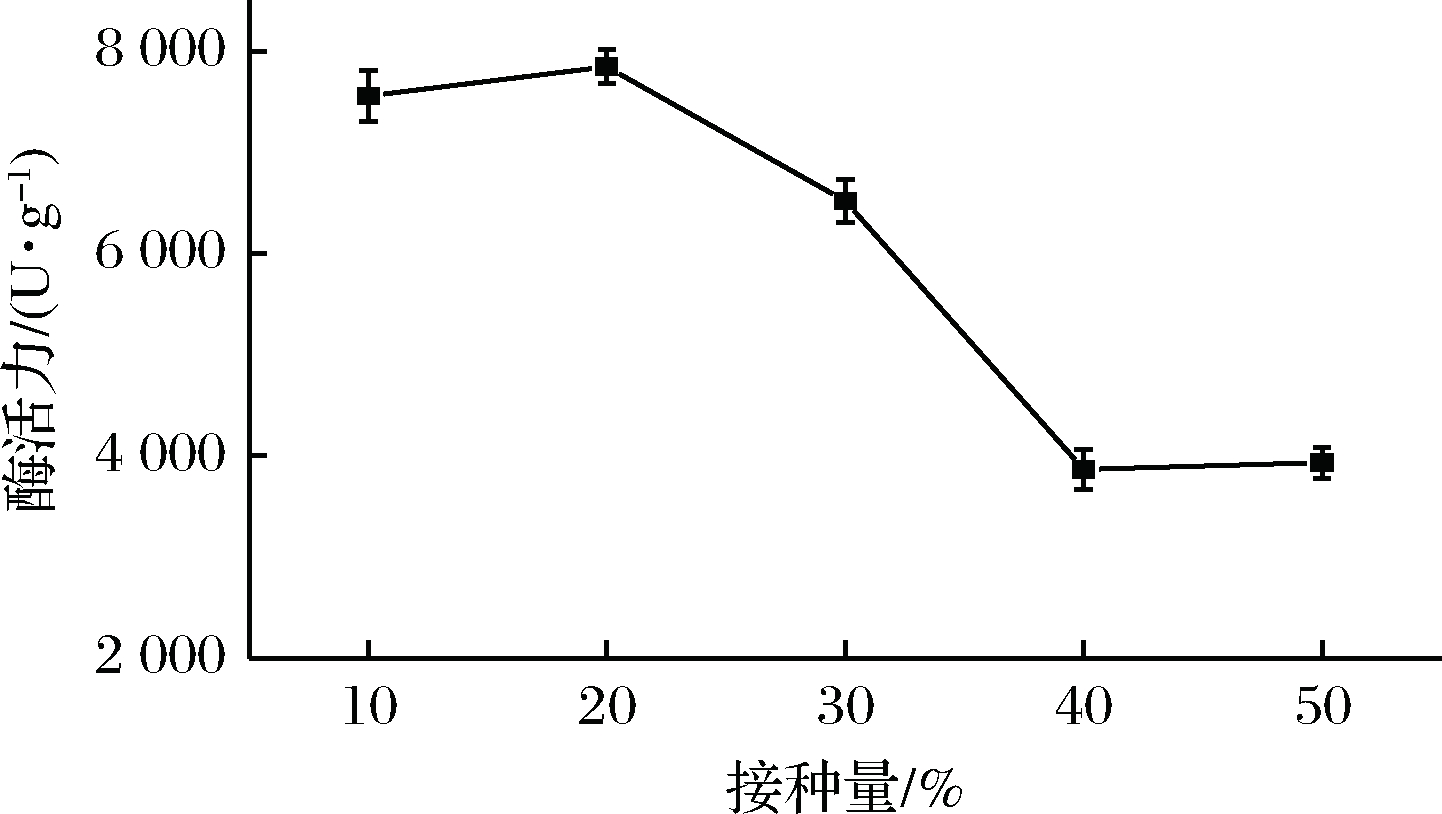
图4 接种量单因素实验
Fig.4 Single factor test of inoculum dosage
2.2.4 发酵温度对S. fibuligera CICC 33077 产酶的影响
取25 g麸皮装入500 mL三角瓶中,按加入原料质量的40% 加入一定量的水,接入10%种子液,分别于20、25、30、37、42 ℃发酵96 h后,测定淀粉酶活力,探究发酵温度对于菌株发酵产酶的影响。实验结果表明,25 ℃条件下菌株产酶能力最强,淀粉酶活力达到11 716 U/g,而温度过低或过高条件下均不利于菌株发酵产酶。这是因为温度不仅影响微生物的生长速率、细胞组成以及营养需求,同时还影响离子的运输和扩散、细胞膜的渗透压及表面张力[29];在一定范围内,微生物生长速率随温度升高而增加,同时产酶也增加;但温度过高时,菌体虽生长旺盛,但培养基中的营养物质被过多用于菌体自身生长繁殖,产酶速率会相对降低,且酶活性丧失较快[30]。因此对菌株CICC 33077而言,最适产酶发酵温度为25 ℃,并以此作为响应面实验中心点。
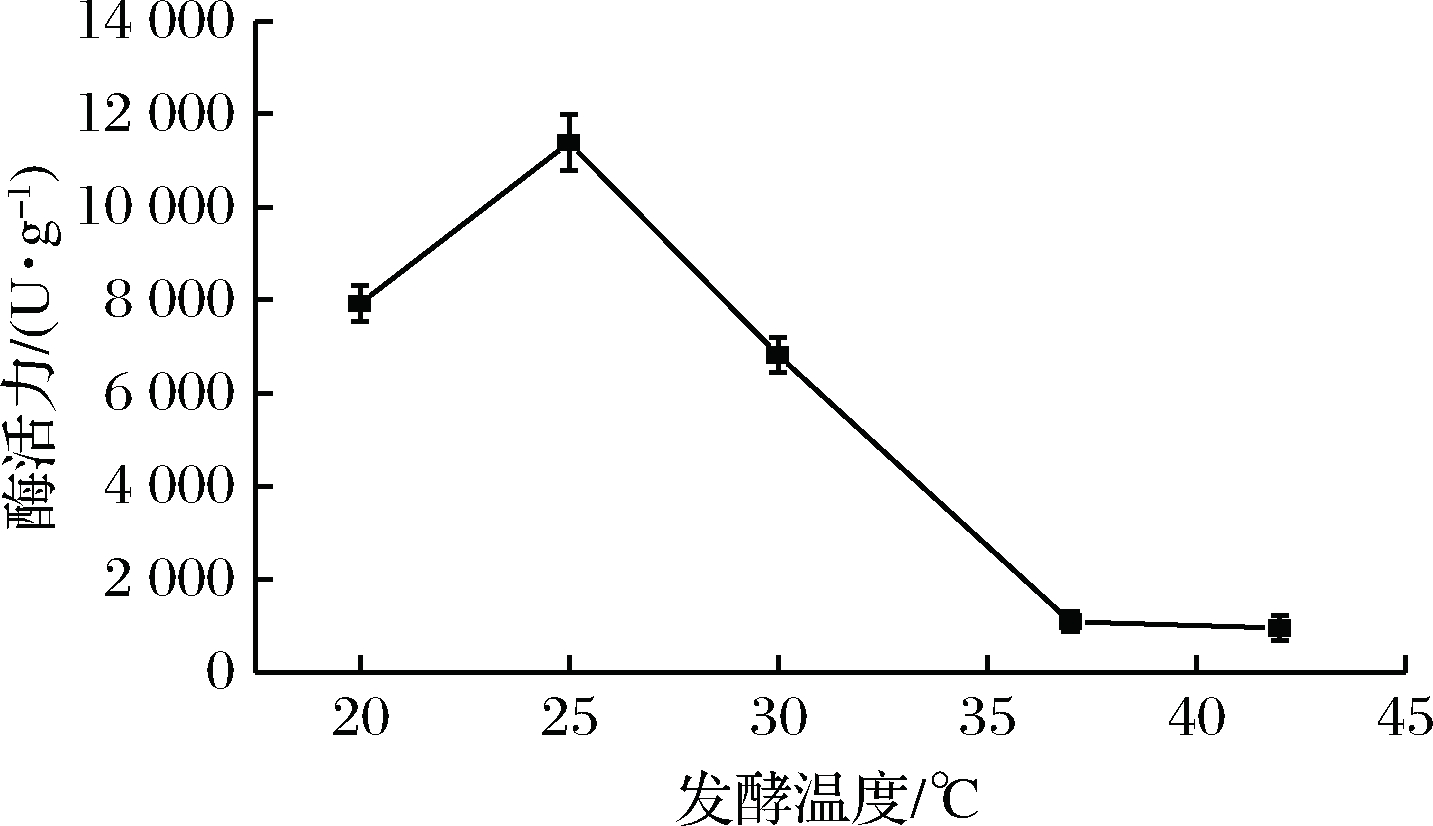
图5 发酵温度单因素实验
Fig.5 Single factor test of fermentation temperature
2.2.5 发酵时间对S. fibuligera CICC 33077 产酶的影响
取25 g麸皮装入500 mL三角瓶中,按干基量的40% 加入一定量的水,接入10%种子液,于30 ℃分别发酵24、48、72、96、120 h后,测定淀粉酶活力,考察发酵时间对于菌株发酵产酶的影响。在24~72 h内,随发酵时间的延长,产酶不断增加,72 h后产酶趋于平缓且在96 h后有下降趋势。这可能是因为在72 h前,基质中的营养物质尚未耗尽,随着微生物不断繁殖,产酶逐渐增加,之后基质内营养物质耗尽,微生物开始死亡,产酶趋于平缓,同时随着时间延长,所产淀粉酶开始失活,因此有下降趋势。考虑到在72~96 h范围内淀粉酶活力变化不大,为节省时间成本,将72 h作为最佳发酵时间,同时发酵时间不作为后续响应面实验因素。
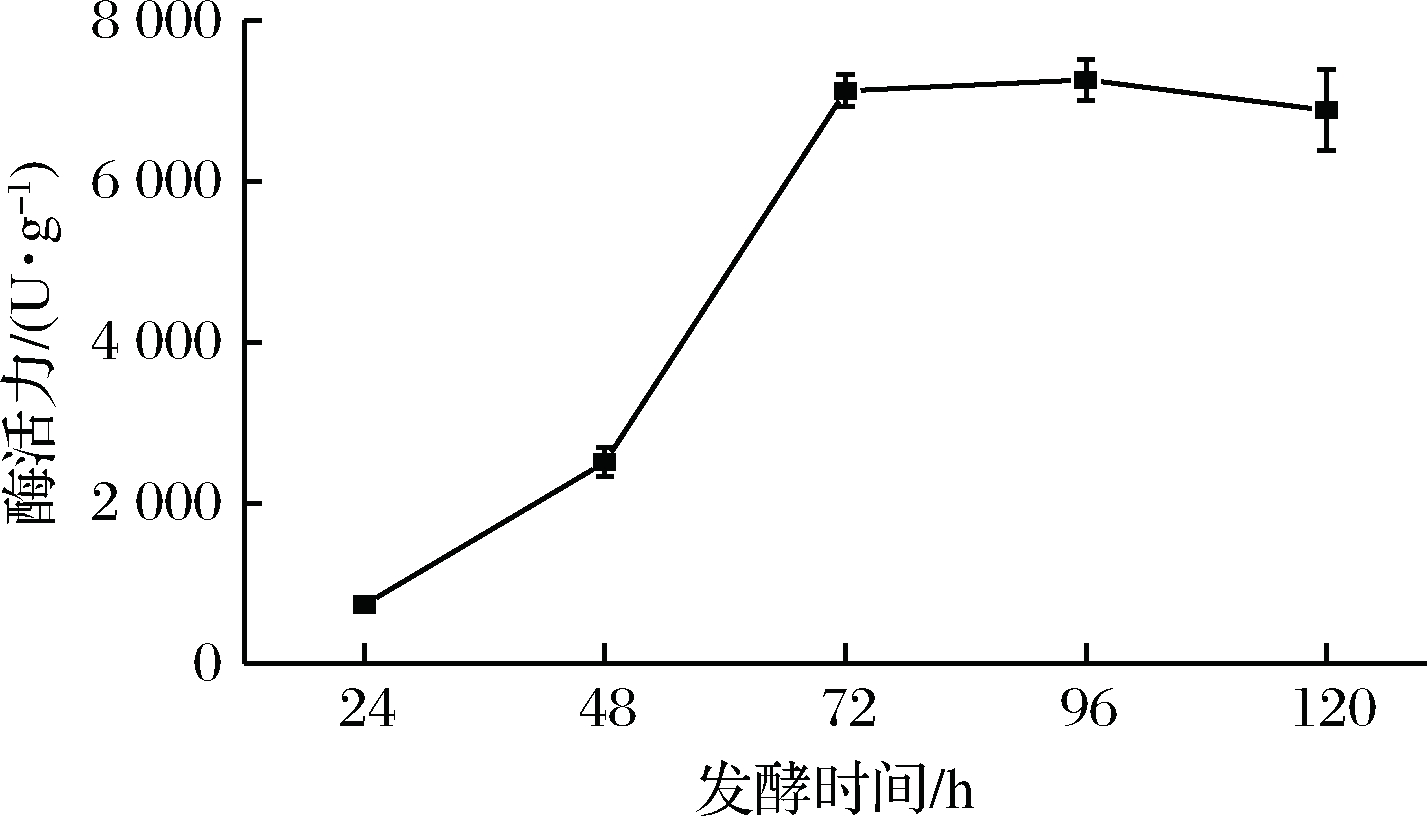
图6 发酵时间单因素实验
Fig.6 Single factor test of fermentation time
2.3 响应面实验设计与结果分析
利用实验软件Design Expert进行实验设计,根据表2的试验结果以淀粉酶活力(Y)为响应值进行回归拟合分析,得到淀粉酶活力(Y)对原料添加量(A)、含水量(B)、发酵温度(C)、接种量(D)的二次多项回归方程:Y=11 688.07-1 272.38A+1 953.48B-1 228.66C+390.20D-1 986.14AB-343.76AC-1 200.70AD-1 620.62BC-2 762.61BD-810.37CD-3 706.54A2-3 109.39B2-4 033.15C2-1 507.16D2。对回归模型进行显著性检验及方差分析,结果显示,模型P值为0.000 2<0.01(表3),说明拟合回归方程有意义,模型达到极显著水平;且失拟项P=0.210 3>0.05,失拟项不显著,说明实验数据误差较小,实验精度高,能够较好描述实验结果且用于预测考察因素与淀粉酶活力之间的关系。
表2 Box-Behnken试验设计及结果
Table 2 Design and results of Box-behnken experiments
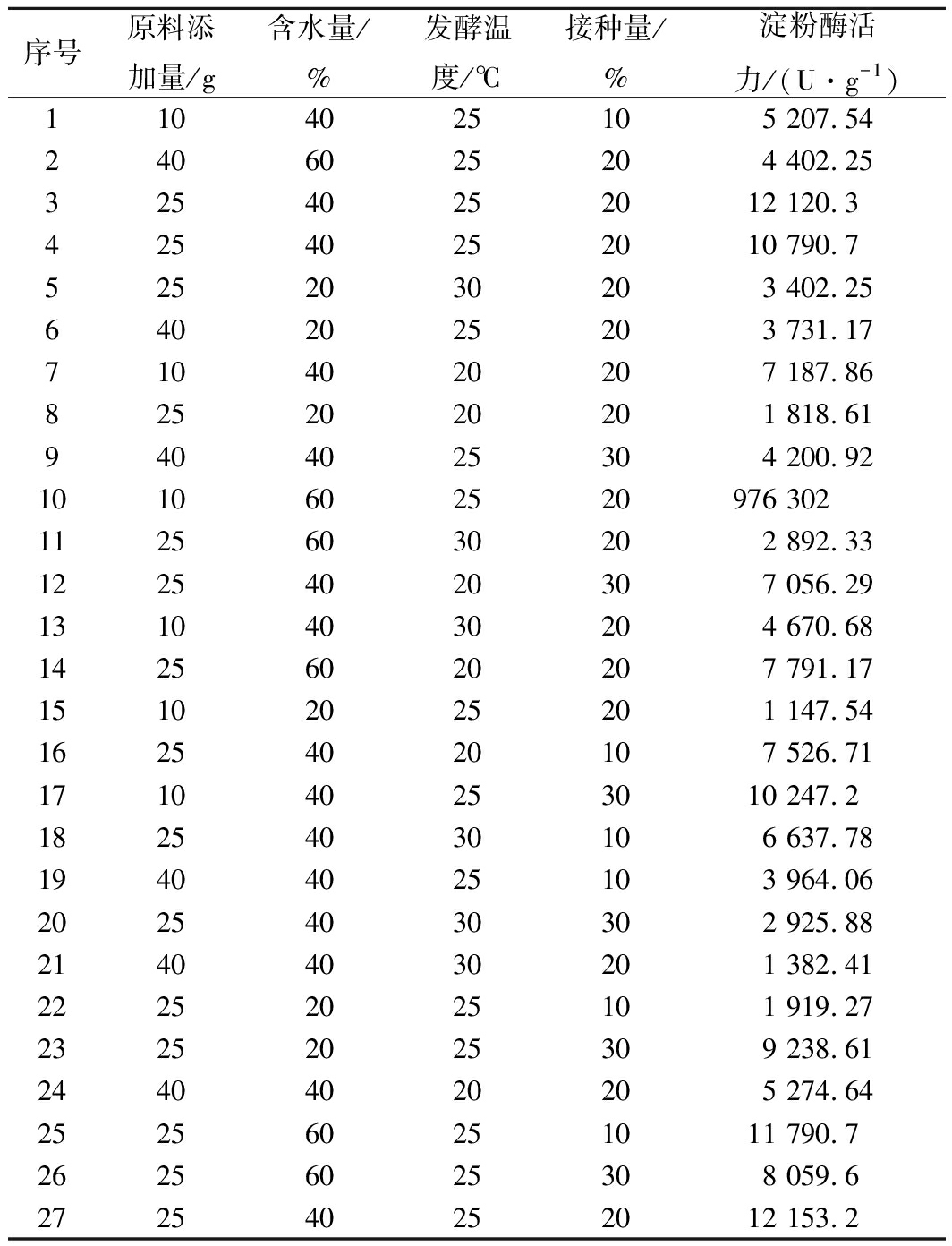
序号原料添加量/g含水量/%发酵温度/℃接种量/%淀粉酶活力/(U·g-1)1104025105 207.542406025204 402.2532540252012 120.342540252010 790.75252030203 402.256402025203 731.177104020207 187.868252020201 818.619404025304 200.921010602520976 30211256030202 892.3312254020307 056.2913104030204 670.6814256020207 791.1715102025201 147.5416254020107 526.71171040253010 247.218254030106 637.7819404025103 964.0620254030302 925.8821404030201 382.4122252025101 919.2723252025309 238.6124404020205 274.64252560251011 790.726256025308 059.6272540252012 153.2
表3 回归模型方差分析
Table 3 Variance analysis of regression model
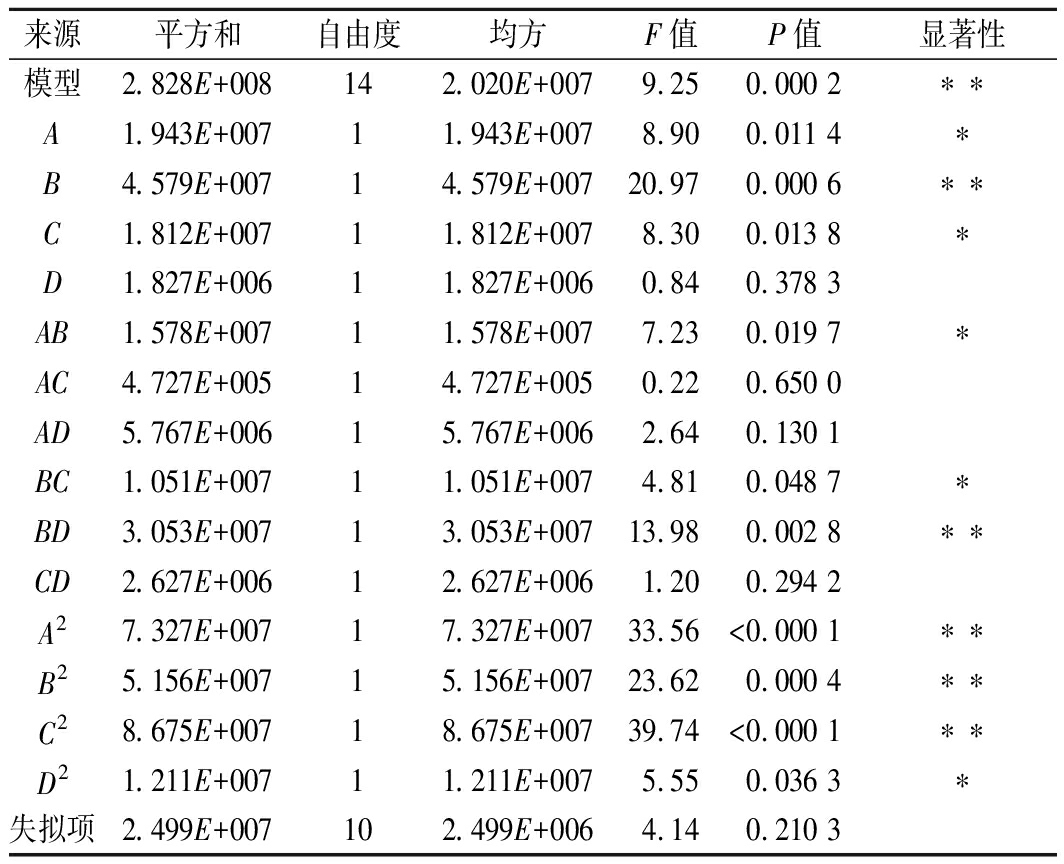
来源平方和自由度均方F值P值显著性模型2.828E+008142.020E+0079.250.000 2∗∗A1.943E+00711.943E+0078.900.011 4∗B4.579E+00714.579E+00720.970.000 6∗∗C1.812E+00711.812E+0078.300.013 8∗D1.827E+00611.827E+0060.840.378 3AB1.578E+00711.578E+0077.230.019 7∗AC4.727E+00514.727E+0050.220.650 0AD5.767E+00615.767E+0062.640.130 1BC1.051E+00711.051E+0074.810.048 7∗BD3.053E+00713.053E+00713.980.002 8∗∗CD2.627E+00612.627E+0061.200.294 2A27.327E+00717.327E+00733.56<0.000 1∗∗B25.156E+00715.156E+00723.620.000 4∗∗C28.675E+00718.675E+00739.74<0.000 1∗∗D21.211E+00711.211E+0075.550.036 3∗失拟项2.499E+007102.499E+0064.140.210 3
注: “*”表示差异显著(P<0.05);“**”表示差异极显著(P<0.01)。
根据方差分析结果及各因素间响应面立体分析图,原料添加量(A)、发酵温度(C)对菌株固体发酵产酶影响显著,含水量(B)影响极显著;同时,原料添加量与含水量交互作用(图7)、含水量与发酵温度交互作用影响显著(图8);含水量与接种量交互作用影响极显著(图9),当含水量一定时,淀粉酶的酶活力随接种量的增加呈先升高后降低的趋势。

图7 原料添加量和含水量交互作用对淀粉酶活力影响的响应面和等高线图
Fig.7 Response surface and contour polt showing the effects of raw material amount and water content on amylase activity

图8 含水量和温度交互作用对淀粉酶活力影响的响应面和等高线图
Fig.8 Response surface and contour polt showing the effects of water content and temperature on amylase activity

图9 含水量和接种量交互作用对淀粉酶活力影响的响应面和等高线图
Fig.9 Response surface and contour polt showing the effects of water content and inoculum dosage on amylase activity
根据软件分析计算结果,淀粉酶活力预测最大值是12 506.69 U/g,最优条件为原料添加量20 g,含水量51%,发酵温度24 ℃,接种量18%。经3次平行实验验证,发酵物淀粉酶活力实际值为(12 297±302) U/g,与预测值基本相符,说明该模型可用于该菌株产淀粉酶发酵条件的优化。
2.4 淀粉酶酶学性质研究
2.4.1 酶最适反应温度测定
淀粉酶最适反应温度试验结果如图10所示,S.fibuligera CICC 33077所产淀粉酶的最适反应温度为50 ℃,淀粉酶在30~50 ℃条件下能够保持60%以上的酶活力,超过60 ℃时,酶活丧失较大。这说明该菌株所产淀粉酶能够适应大曲发酵环境,在大曲发酵前中期充分发挥作用,水解大曲原料。
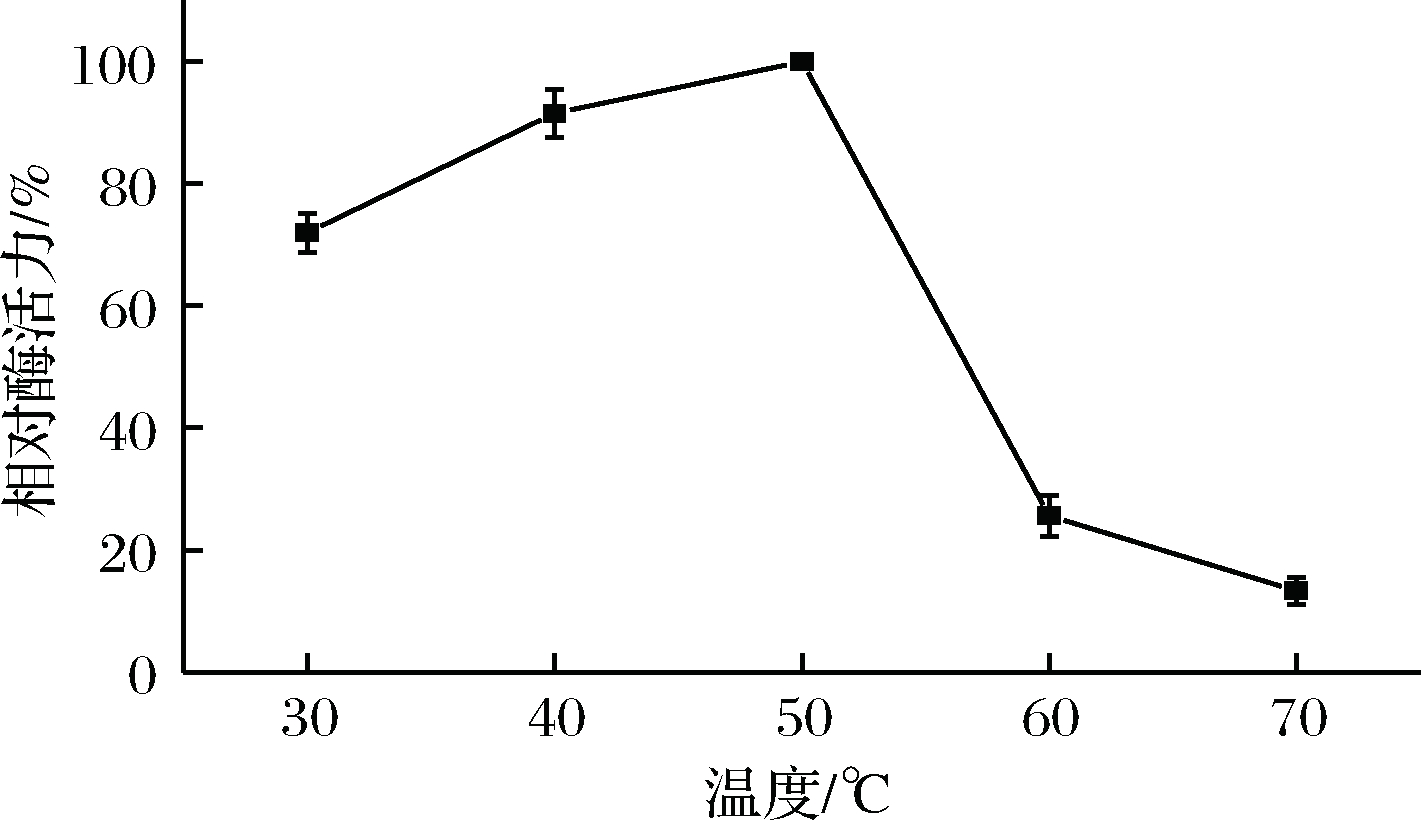
图10 反应温度对S.fibuligera CICC 33077淀粉酶活力的影响
Fig.10 Effect of reaction temperature on amylase activity of S. fibuligera CICC 33077
2.4.2 酶最适反应pH值测定
淀粉酶最适反应pH值试验结果如图11所示,S.fibuligera CICC 33077所产淀粉酶的最适反应pH值为4.0,在pH 3.0~6.0条件下能够保持70%以上的淀粉酶活力。这说明该菌株所产淀粉酶在较酸的环境中具有较好的反应活性,能够适应大曲发酵酸性环境,并在大曲发酵过程中发挥作用。
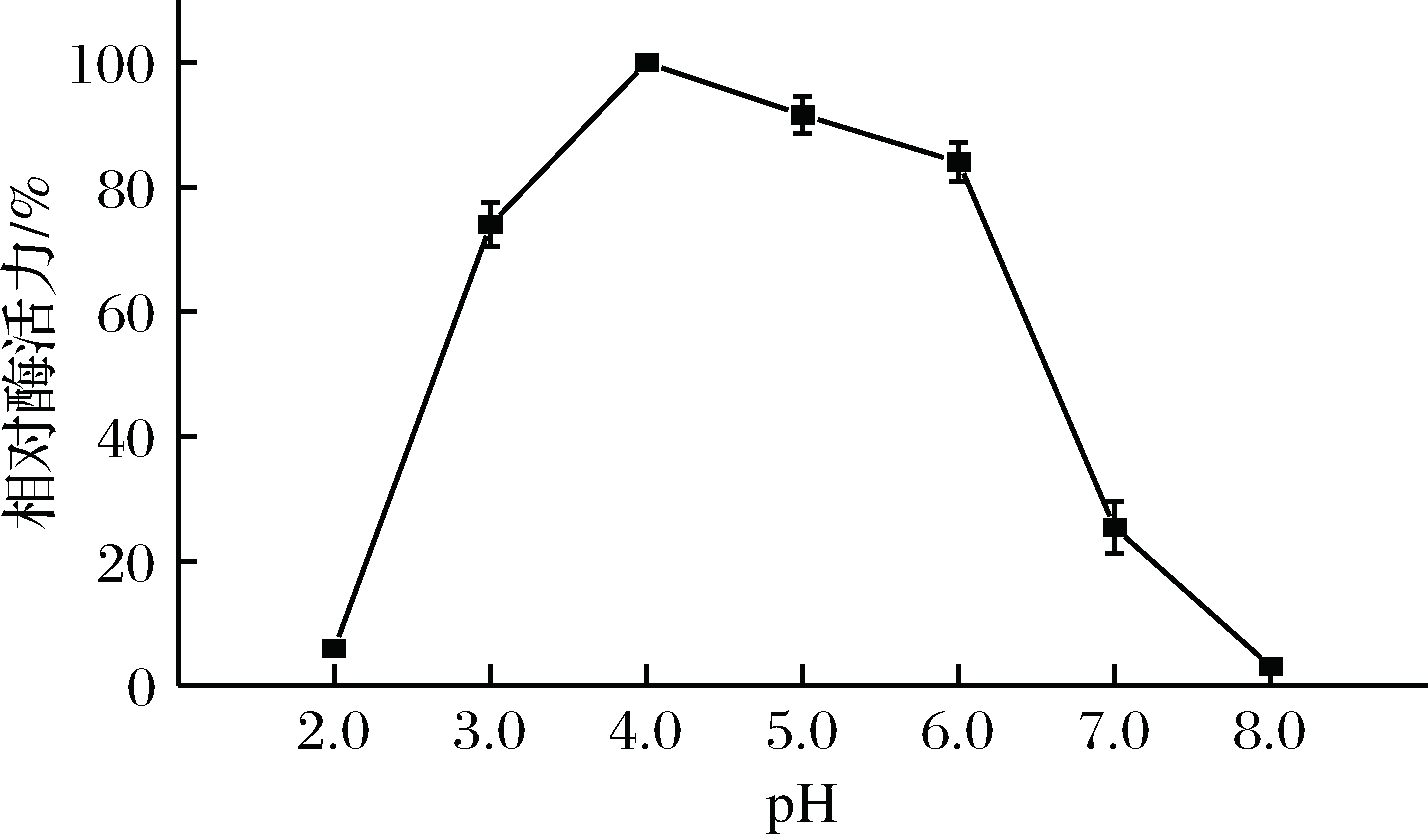
图11 反应pH值对S.fibuligera CICC 33077淀粉酶活力的影响
Fig.11 Effect of reaction pH value on amylase activity of S. fibuligera CICC 33077
3 结论与讨论
本研究利用单因素及响应面实验对S.fibuligera CICC 33077产淀粉酶条件进行优化,菌株淀粉酶活力可达到12 297 U/g,高于目前文献报道水平[31-32],说明该菌株产淀粉酶能力强,性能优良。同时该菌株淀粉酶性质研究结果表明,其淀粉酶最适反应温度为50 ℃,最适反应pH值为4.0,表明该菌株所产淀粉酶能够在大曲发酵的酸性高温环境中发挥作用,高效降解大曲中的淀粉颗粒,产生大量小分子糖,既能参与到美拉德反应中,生成白酒风味成分或前体物质,丰富大曲风味,又能供其他微生物的生长繁殖,避免曲块死板,起到促进大曲微生物群落结构更替的作用,具有应用于大曲生产的潜力。
本研究通过对高温大曲中筛选出的高产淀粉酶S.fibuligera进行产酶条件与酶学性质的研究,为菌株在白酒生产中的开发利用打下坚实基础,同时也为稳定不同地区、季节大曲品质提供可能。
[1] 任伟豪, 刘亚伟,徐仰丽. 常见的淀粉酶及其应用[J]. 淀粉与淀粉糖, 2008(3):11-13.
[2] 丁皓, 王冠,徐丽,等. α-淀粉酶的应用研究进展[J]. 饲料博览, 2012(8):12-14.
[3] 何承云, 孙俊良,李光磊,等. 中温α-淀粉酶在鲜湿面条中的应用研究[J]. 食品研究与开发, 2017, 38(13):104-108.
[4] 石晓峰. 挤压添加中温α-淀粉酶高粱作啤酒辅料的试验研究[D]. 淄博:山东理工大学, 2015.
[5] 闫祥洲, 高研,吴勃,等. 日粮中添加低温淀粉酶对仔猪生长性能的影响[J]. 饲料工业, 2015(s2):31-33.
[6] GENCOGLU H, SHAVER R D, STEINBERG W, et al. Effect of feeding a reduced-starch diet with or without amylase addition on lactation performance in dairy cows[J]. Journal of Dairy Science, 2010, 93(2):723-732.
[7] 胡宝东, 王晓丹,班世栋,等. 白酒大曲酶系研究进展[J]. 酿酒, 2015, 42(1):17-22.
[8] 李季鹏. 淀粉酶、蛋白酶在芝麻香型白酒中的应用[D]. 济南:济南大学, 2013.
[9] 吴生文, 张志刚,李旭晖. 大曲微生物在大曲酒生产中的研究开发现状及发展前景[J]. 中国酿造, 2011, 30(5):8-13.
[10] 孙剑秋, 刘雯雯,臧威,等. 酱香型白酒酒醅中霉菌群落组成与功能酶活性[J]. 中国食品学报, 2013, 13(8):239-247.
[11] 鲁珍, 魏姜勉,谌馥佳,等. 高温大曲中高产α-淀粉酶菌株分离鉴定及其产酶性能研究[J]. 农业研究与应用, 2016(2):5-11.
[12] 毛祥, 黄丹,沈才萍,等. 酱香型大曲中产淀粉酶菌的分离鉴定及发酵特性研究[J]. 中国酿造, 2015, 34(12):24-27.
[13] 侯小歌, 王俊英,张杰,等. 宋河酒曲中产淀粉酶芽孢菌的分离鉴定及产酶特性[J]. 贵州农业科学, 2012, 40(6):138-141.
[14] 李绍亮, 李学思,侯小歌,等. 宋河酒曲中主要霉菌的鉴定及其产酶特性的研究[J]. 酿酒, 2016, 43(6):24-29.
[15] 王鑫昕, 耿霄,吴子龙,等. 丛台酒大曲中高产淀粉酶细菌的分离和鉴定[J]. 酿酒科技, 2017(1):30-32.
[16] BAB′EVA I P. The yeasts, a taxonomic study[M]. Amsterdam: Elsevier Science, 2011.
[17] CHI Z M, CHI Z, LIU G L, et al. Saccharomycopsis fibuligera and its applications in biotechnology[J]. Biotechnology Advances, 2009, 27(4):423-431.
[18] WICKERHAM L J, LOCKWOOD L B, PETTIJOHN O G, et al. Starch hydrolysis and fermentation by the yeast Endomycopsis fibuliger[J]. Journal of Bacteriology, 1944, 48(4):413-427.
[19] JEON E, HYEON J E, EUN L S, et al. Cellulosic alcoholic fermentation using recombinant Saccharomyces cerevisiae engineered for the production of Clostridium cellulovorans endoglucanase and Saccharomycopsis fibuligera β-glucosidase[J]. Fems Microbiology Letters, 2010, 301(1):130-136.
[20] 乔晓梅, 赵景龙,杜小威,等. 高通量测序法对清香大曲真菌群落结构的分析[J]. 酿酒科技, 2015(4):28-31.
[21] 明红梅, 郭志,周健,等. 浓香型大曲中产香微生物的筛选及鉴定[J]. 现代食品科技, 2015(4):186-191.
[22] 胡佳音, 周森,赵卫鹏,等. 清、浓、酱三种大曲真菌多样性初步分析[J]. 酿酒科技, 2016(8):87-90.
[23] 曾东方, 杨帆,聂欢欢. DNS法对食用菌发酵液淀粉酶活力的测定[J]. 现代农业科技, 2011(11):16-16.
[24] 杨文雄, 高彦祥. 响应面法及其在食品工业中的应用[J]. 中国食品添加剂, 2005(2):68-71.
[25] 赵敏洁, 蔡海莺,李杨,等. 出芽短梗霉产脂肪酶培养基的响应面优化[J]. 中国食品学报, 2017, 17(7): 77-85.
[26] 刘鑫, 李佳,刘克武,等. 高产酸性蛋白酶黑曲霉菌种选育[J]. 四川大学学报(自然科学版), 2005, 42(1):158-161.
[27] 谢玉球, 时晓,周二干,等. 洋河大曲中糖化酶高产霉菌的筛选鉴定及固态发酵条件优化[J]. 酿酒科技, 2016(4):39-42.
[28] 王晓明, 孙玉辉,张欢,等. 绿色木霉固态发酵生产纤维素酶条件优化与酶的固定化[J]. 浙江农业学报, 2014, 26(1):186-193.
[29] 张文芝, 郭坚华. 微生物发酵工艺优化研究进展[J]. 广东农业科学, 2013, 40(6):114-117.
[30] 王中月, 滕超,汤回花,等. 产高分子量木聚糖酶细菌的筛选及产酶条件优化[J]. 食品与发酵工业, 2017, 43(10):88-95.
[31] 庾昌文, 薛栋升,郭威,等. 酒醅中高产淀粉酶酵母的分离鉴定及产酶条件研究[J]. 酿酒, 2015, 42(5):71-75.
[32] 应玲云, 伍时华,赵东玲,等. 烧酒曲中扣囊复膜酵母的分离及鉴定[J]. 食品与发酵工业, 2013, 39(1):146-150.