乳酸乳球菌(Lactococcus lactis)作为一种传统的乳品发酵剂[1],被广泛地应用于干酪、酸奶油和酸奶等发酵乳制品的生产过程中[2]。乳糖是牛乳中最主要的碳水化合物[3-4],其含量高达99%以上,乳糖代谢特性对乳酸乳球菌在乳体系中的应用至关重要[5]。目前,国内外对乳糖代谢的研究着重于通过乳酸菌的发酵降低乳制品中的乳糖含量。OHLSSON等[6]发现,在牛乳中添加乳酸乳球菌乳脂亚种能代谢更多的乳糖。
研究发现,乳酸菌中有2条乳糖代谢通路(图1)[7],一条是通过磷酸转运系统(phosphotransferase systems,PTS)摄入乳糖,磷酸化使其转化为6-磷酸乳糖,6-磷酸乳糖在磷酸-β-半乳糖苷酶(phosphate-β-galactosidase,P-β-galactosidase)的作用下水解成6-磷酸半乳糖和葡萄糖,6-磷酸半乳糖通过塔格糖-6-磷酸(tagatose-6-phosphate,T6P)途径发生进一步代谢,葡萄糖则进入糖酵解途径代谢分解[8-11];另一条则是乳糖通过透性酶进入细胞内,在β-半乳糖苷酶(β-galactosidase)的作用下水解形成半乳糖和葡萄糖,半乳糖经Leloir途径进一步代谢,葡萄糖进入糖酵解途径[12-13]。
乳糖的不彻底分解会造成大量的半乳糖积累,这些半乳糖的存在往往会影响发酵乳制品的品质,如造成马苏里拉奶酪、瑞士硬干酪和切达奶酪的褐变[14-16]。WU等[17]研究发现干酪乳杆菌、副干酪乳杆菌、鼠李糖乳杆菌和乳酸乳球菌等能够通过上述2条不同的代谢途径代谢半乳糖,其中干酪乳杆菌、副干酪乳杆菌和鼠李糖乳杆菌编码T6P途径的基因位于染色体上,而乳酸乳球菌则是由质粒编码[13]。因此,乳酸乳球菌的半乳糖代谢能力存在菌株差异性。
本文选取了10株不同的乳酸乳球菌并测定了它们在以乳糖为单一碳源的培养基中生长、产酸、乳糖代谢情况以及β-半乳糖苷酶和P-β-半乳糖苷酶的活力,以市售发酵剂中保加利亚乳杆菌和嗜热链球菌为对照,探究不同的乳酸乳球菌菌株在乳糖代谢能力方面是否存在差异。为了进一步确定各菌株中2种半乳糖代谢途径的差异,测定了发酵液中半乳糖积累情况,为从乳糖利用角度筛选优良的乳酸乳球菌发酵剂提供了一定的研究基础。
1 材料与方法
1.1 材料
1.1.1 实验试剂
胰蛋白胨、酵母粉、牛肉膏、无水葡萄糖、柠檬酸氢二铵、吐温80、一水合乳糖、CH3COONa、MgSO4·7H2O、MnSO4·H2O、K2HPO4·3H2O、CHCl3、Na2CO3、Na2HPO4、NaH2PO4·H2O、KCl,均为分析纯,国药集团化学试剂有限公司;邻硝基苯-β-D-吡喃半乳糖苷(ONPG),分析纯,生工生物工程(上海)股份有限公司;邻硝基苯-β-D-吡喃半乳糖苷-6-磷酸环己胺盐,分析纯,上海创赛科技有限公司。
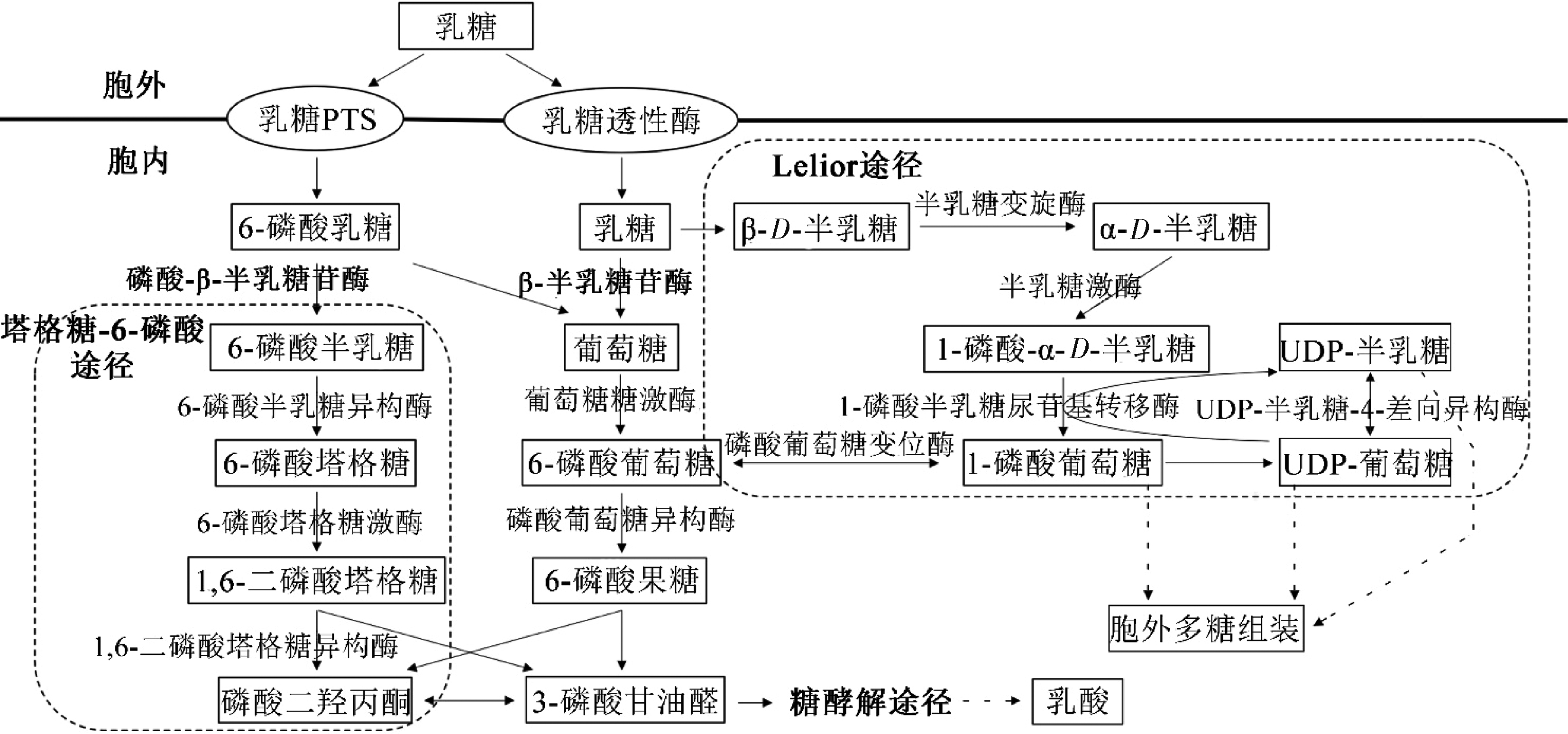
图1 乳酸菌Leloir途径和塔格糖-6-磷酸途径的概貌
Fig.1 General presentation on the Leloir pathway and tagatose-6-phosphate pathway in lactic acid bacteria
1.1.2 仪器设备
UV-1800紫外可见分光光度计,岛津仪器(苏州)有限公司;3020酶标仪,Thermo Fisher SCIENTIFIC;ST3100型pH计,奥豪斯仪器(常州)有限公司;MK-20型干式恒温器,杭州奥盛仪器有限公司;HWS-150型恒温恒湿培养箱,上海森信实验仪器有限公司;GR60DA型立式自动压力蒸汽灭菌锅,致微(厦门)仪器有限公司;TGL-16M型台式高速冷冻离心机,上海卢湘仪离心机仪器有限公司;SW-CJ-1FD型超净工作台,苏州安泰空气技术有限公司。
1.1.3 实验菌株
本文所使用的10株乳酸乳球菌、1株德氏乳杆菌保加利亚亚种和1株嗜热链球菌均由江南大学食品学院生物技术中心提供。菌株具体信息如表1所示。
表1 实验菌株信息
Table 1 Information of strains used in this study

菌株编号种属分离源E207Lactococcus lactis市售酸奶油DSCAB2M1Lactococcus lactis四川阿坝曲拉DSCAB11M15Lactococcus lactis四川阿坝曲拉DSCAB12M2Lactococcus lactis四川阿坝曲拉DYNDL21-2Lactococcus lactis云南大理牛乳DYNDL34-3Lactococcus lactis云南大理牛乳DYNDL50-3Lactococcus lactis云南大理牛乳DYNDL66M43Lactococcus lactis云南大理牛乳FJNDD18M8Lactococcus lactis人群粪便FSDHZ-D8-L3Lactococcus lactis人群粪便LbK1Lactobacillus delbrueckii subsp. bulgaricus市售发酵剂StK1Streptococcus thermophilus市售发酵剂
1.2 方法
1.2.1 试剂配制
1.2.1.1 培养基
普通MRS培养基参照WU等[18]的配方,MRS-乳糖培养基(MRS-lactose broth)在普通MRS培养基配方的基础上稍作修改,用乳糖等量替换葡萄糖。所有培养基在使用前均于115 ℃中灭菌20 min。
1.2.1.2 半乳糖苷酶检测工作液
参照WU等[18]的配方配制Z buffer和ONPG底物溶液,邻硝基苯-β-D-吡喃半乳糖苷-6-磷酸环己胺盐底物溶液在ONPG底物溶液配方的基础上,用邻硝基苯-β-D-吡喃半乳糖苷-6-磷酸环己胺盐等量替代ONPG。
1.2.2 菌株活化
实验前菌株需在MRS培养基中活化3代,第1代从保菌管中蘸取菌液,涂布于MRS固体平板上,划线分离,30 ℃培养48 h;第2代挑取单菌落至MRS液体培养基,30 ℃培养24 h;第3代按体积分数2%接种于MRS液体培养基中,30 ℃培养10 h。
1.2.3 菌株在MRS-乳糖培养基中生长特性的测定
将活化后的菌液按体积分数2%接种于MRS-乳糖液体培养基中,置于30 ℃培养箱中培养,每隔2 h取样测定pH值和OD600,测定0、2、4、6、8、10、12 h菌株生长、产酸情况,取培养12 h的发酵液于-20 ℃冻存,待测。
1.2.4 乳糖水解酶活力的测定
1.2.4.1 β-半乳糖苷酶
参照WU等[18]的方法测定乳酸乳球菌的β-半乳糖苷酶。
1.2.4.2 磷酸-β-半乳糖苷酶
参照WU等[18]的方法并略作修改,将ONPG底物溶液换成邻硝基苯-β-D-吡喃半乳糖苷-6-磷酸环己胺盐底物溶液,测定菌株的P-β-半乳糖苷酶活力。
1.2.5 复配实验
选取具有代表性的乳酸乳球菌菌株分别与嗜热链球菌菌株和保加利亚乳杆菌菌株进行复配实验,将活化3代的单菌菌液按1∶1(V∶V)的比例两两复配,并按体积分数2%接种于MRS-乳糖液体培养基中,置于30 ℃培养箱中培养,取培养12 h的发酵液于-20 ℃冻存,待测。
1.2.6 乳糖、半乳糖含量的测定
量取1 mL上述待测的12 h后的发酵液,加纯净水稀释4倍,混匀,以11 000 r/min在4 ℃离心5 min,离心后的菌液过0.22 μm滤膜,取滤液1 mL,送至江南大学国家重点实验室测试平台利用HPLC检测乳糖和半乳糖含量。
1.2.7 统计分析及数据处理
采用SPSS 21.0统计分析软件进行数据处理和统计分析,数据间的比较采用Duncan模型进行显著性分析,显著性水平P<0.05;数据图采用Origin Pro8软件绘制。
2 结果与讨论
2.1 菌株在MRS-乳糖培养基中的生长和产酸特性
对10株乳酸乳球菌、嗜热链球菌和保加利亚乳杆菌在MRS-乳糖培养基中的生长和产酸情况进行测定,结果如图2、3所示。10株乳酸乳球菌在以乳糖为单一碳源的MRS培养基中均能生长,其中6株乳酸乳球菌(DYNDL66M43、DYNDL21-2、DSCAB12M2、DSCAB11M15、DSCAB2M1、E207)在培养6 h后进入稳定期,pH值降到4.90以下。2株乳酸乳球菌(FJNDD18M8和FSDHZ-D8-L3)在MRS-乳糖培养基中的生长和产酸较为缓慢,12 h内尚未进入稳定期,pH值末达到5.10。剩余2株乳酸乳球菌(DYNDL34-3和DYNDL50-3)在MRS-乳糖中生长极为缓慢,虽然6 h也能进入稳定期,但pH值只在前2 h内下降0.2~0.3,之后维持稳定。嗜热链球菌和保加利亚乳杆菌在MRS-乳糖培养基中生长较为缓慢,在12 h内尚未进入稳定期,保加利亚乳杆菌pH值在12 h降至4.70以下,而嗜热链球菌pH值为5.36。因此,结合上述菌株生长和产酸的情况可以推断,乳酸乳球菌的不同菌株在以乳糖为单一碳源的环境中生长、产酸能力存在较大差异,且生长和产酸情况呈正相关关系,其中6株乳酸乳球菌的生长、产酸情况优于市售发酵剂中的嗜热链球菌和保加利亚乳杆菌。
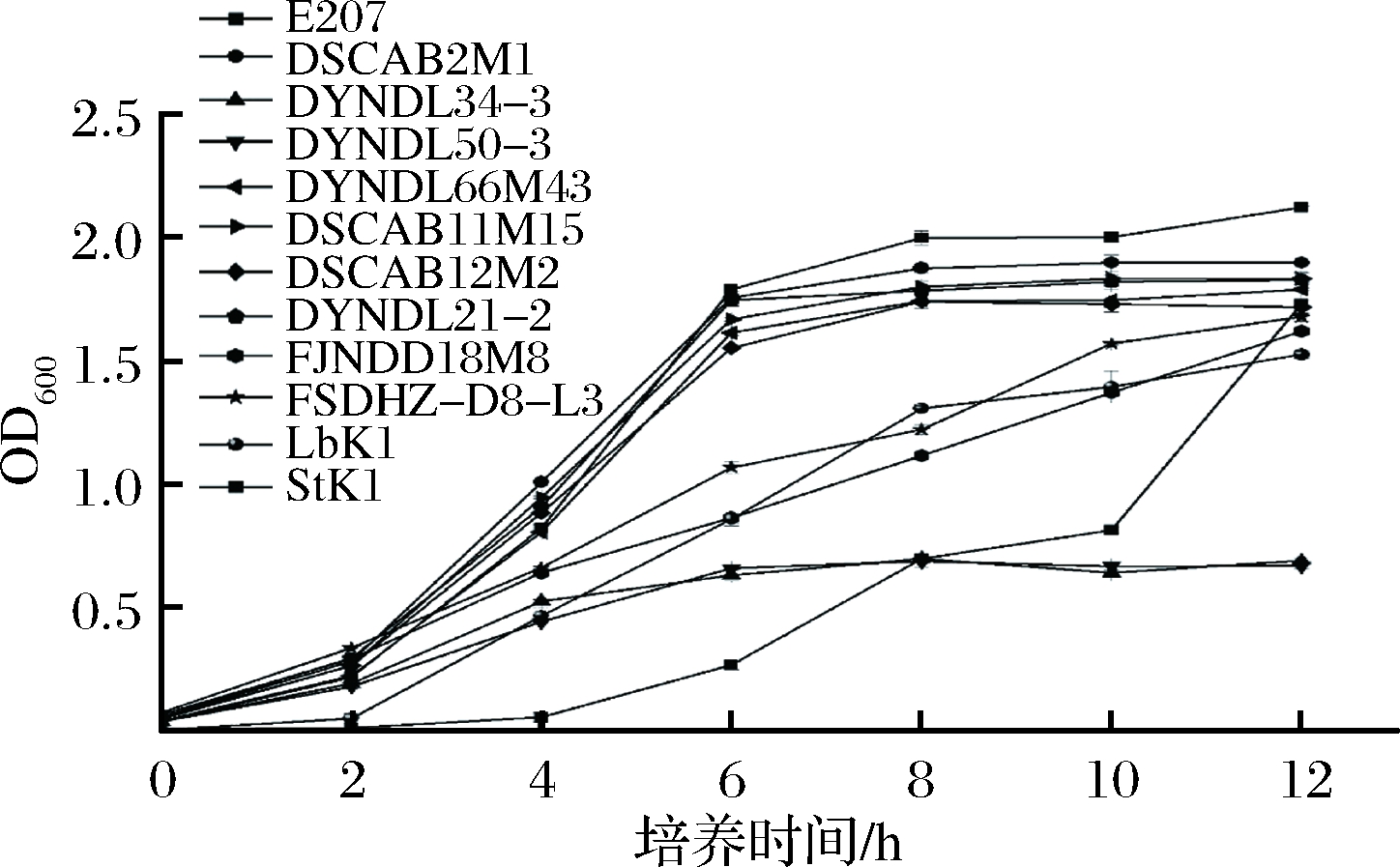
图2 不同菌株在MRS-乳糖培养基中的生长情况
Fig.2 Growth of different strains in MRS-lactose broth
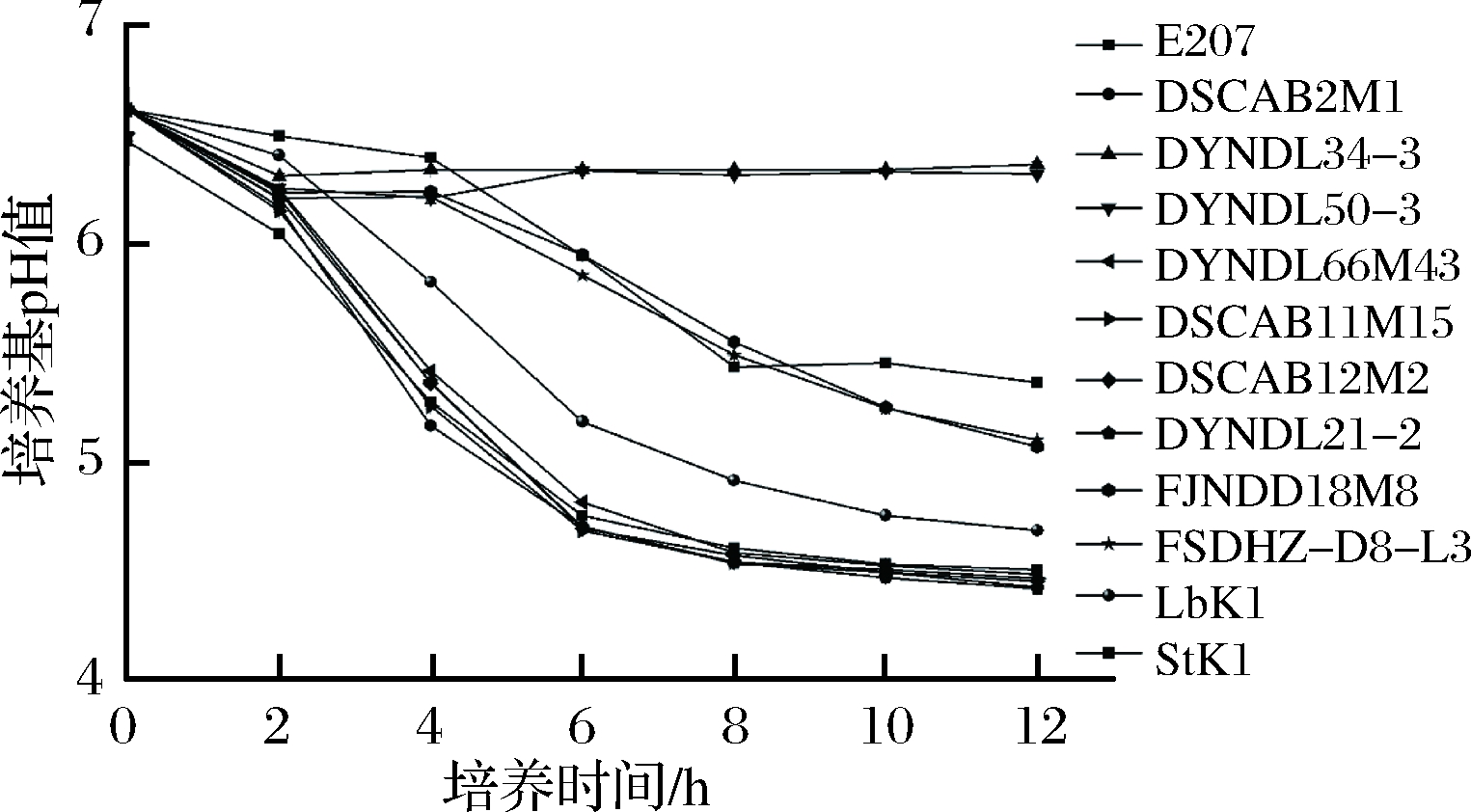
图3 菌株在MRS-乳糖培养基中的pH值变化情况
Fig.3 Changes pH of different strains in MRS-lactose broth
2.2 菌株在MRS-乳糖培养基中乳糖的利用情况
通过测定菌株发酵液中残余乳糖含量可知菌株利用乳糖能力强弱(如图4)。
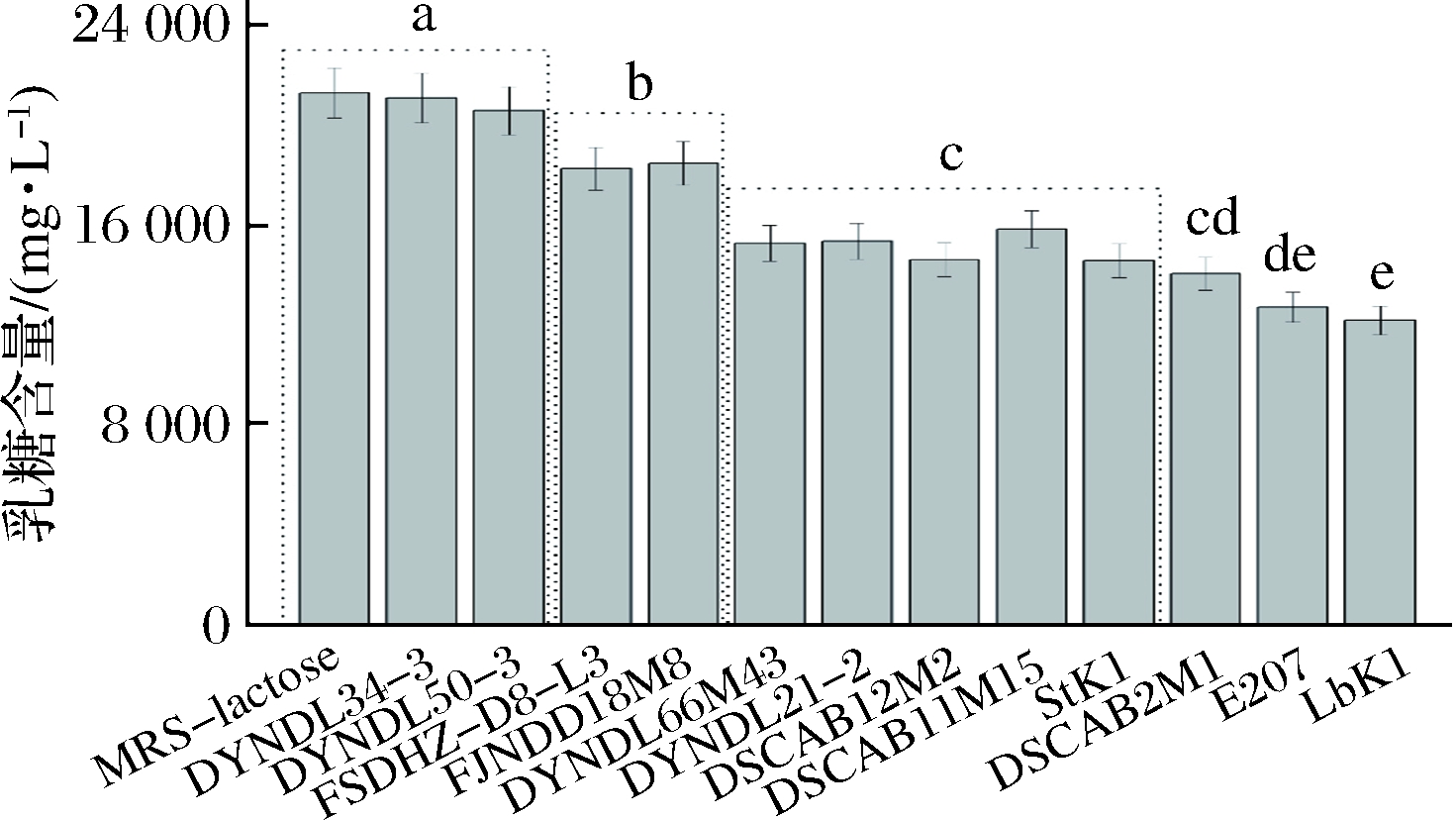
图4 不同菌株在MRS-乳糖培养基中培养12 h后培养基中残余乳糖含量
Fig.4 Residual lactose content of different strains in MRS-lactose broth after 12 h cultivation
注:不同字母表示存在显著性差异(P<0.05),下同。
从图4可以看出,用于空白对照的MRS-乳糖培养基中乳糖含量为21 279.04 mg/L;与对照组相比,乳酸乳球菌DYNDL34-3和DYNDL50-3的发酵液中乳糖含量没有发生显著性下降,FSDHZ-D8-L3和FJNDD18M8的乳糖含量出现小幅度下降,其余6株乳酸乳球菌(DYNDL66M43、DYNDL21-2、DSCAB12M2、DSCAB11M15、DSCAB2M1、E207)和嗜热链球菌StK1的乳糖利用较多,12 h内发酵液中乳糖下降5 439~8 551 mg/L。而相较于乳酸乳球菌和嗜热链球菌,保加利亚乳杆菌的乳糖利用能力最强,在12 h内发酵液乳糖含量下降约9 100 mg/L。
菌株在MRS-乳糖培养基中的乳糖利用情况与菌株的生长情况(图2)基本一致,其中乳糖利用多的DYNDL66M43、DYNDL21-2、DSCAB12M2、DSCAB11M15、DSCAB2M1和E207在MRS-乳糖培养基中的生长明显优于菌株DYNDL34-3、DYNDL50-3、FSDHZ-D8-L3和FJNDD18M8,因此推测各菌株的β-半乳糖苷酶活力和P-β-半乳糖苷酶活力存在差异,导致菌株的乳糖利用能力差异较大,酶活力高的菌株可以代谢更多的乳糖获得生长优势。
2.3 乳糖水解酶活力的测定
为了进一步探究不同菌株乳糖利用存在差异的原因,对10株乳酸乳球菌、嗜热链球菌StK1和保加利亚乳杆菌LbK1的β-半乳糖苷酶活力和P-β-半乳糖苷酶活力进行了测定,结果如图5所示。保加利亚乳杆菌LbK1的β-半乳糖苷酶活力最高,达到1 947.22 Miller Units,嗜热链球菌的β-半乳糖苷酶活力次之,为1 375.90 Miller Units。而10株乳酸乳球菌中FSDHZ-D8-L3和FJNDD18M8的β-半乳糖苷酶活力较高,分别为223.97 Miller Units和173.65 Miller Units,其余8株菌的β-半乳糖苷酶几乎无活力。以往研究表明,保加利亚乳杆菌和嗜热链球菌的β-半乳糖苷酶活力要高于其他乳酸菌。WU等[18]的结果显示,保加利亚乳杆菌ASCC859的β-半乳糖苷酶活力约为1 500 Miller Units,嗜热链球菌ASCC1275的酶活力超过1 000 Miller Units,远高于瑞士乳杆菌和干酪乳杆菌。
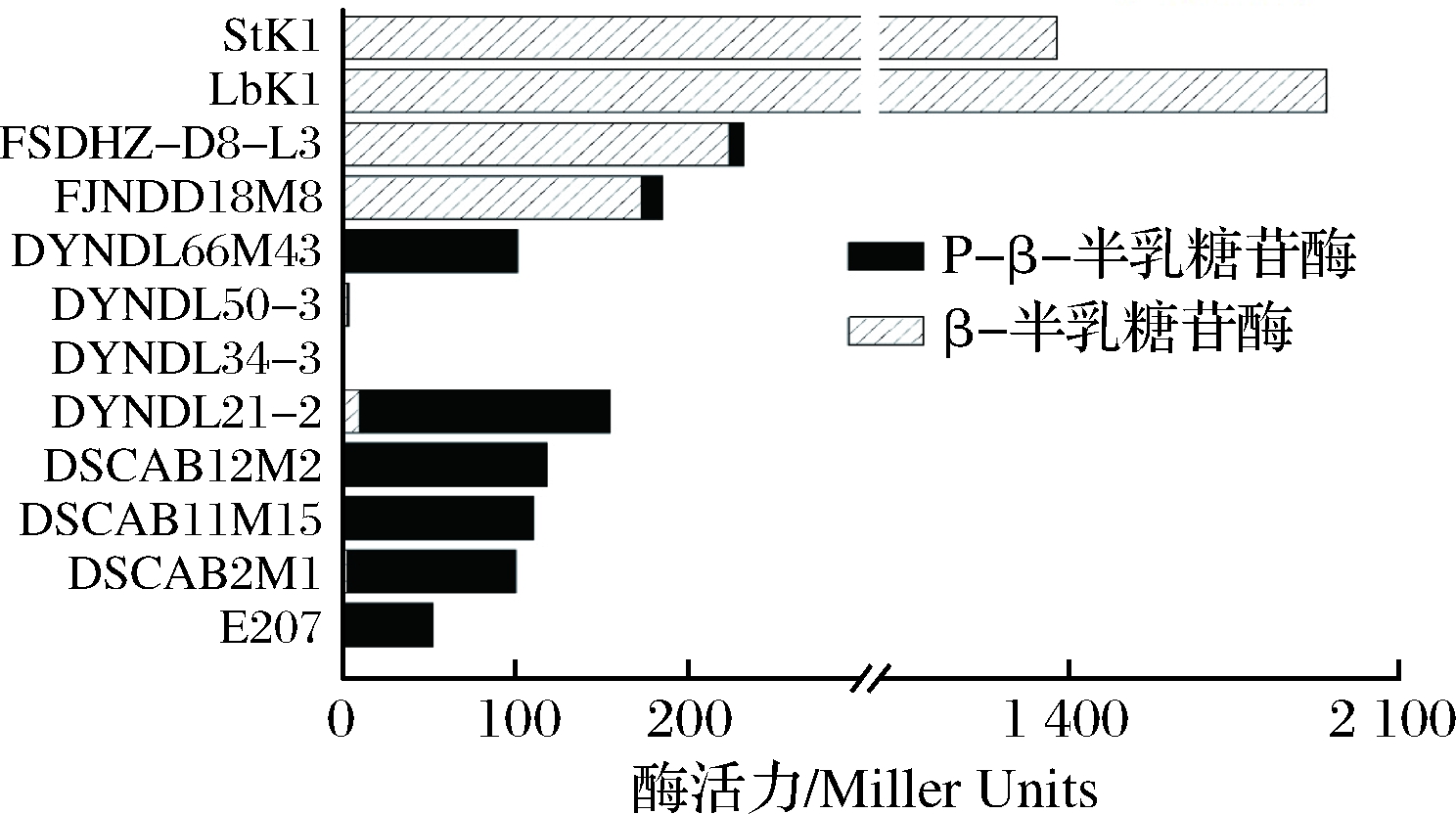
图5 不同菌株的β-半乳糖苷酶和磷酸-β-半乳糖苷酶活力
Fig.5 β-galactosidase and phosphate-β-galactosidase activities of different strains
嗜热链球菌StK1和保加利亚乳杆菌LbK1均无P-β-半乳糖苷酶活力,8株乳酸乳球菌都表现出一定的P-β-半乳糖苷酶活力,其中菌株DYNDL21-2的活力最高,达到144.89 Miller Units。此外,P-β-半乳糖苷酶活力在100 Miller Units以上的菌株还包括DSCAB11M15,DSCAB12M2,DYNDL66M43。E207和DSCAB2M1的P-β-半乳糖苷酶的酶活力大于50 Miller Units,其余2株乳酸乳球菌的P-β-半乳糖苷酶活力都低于15 Miller Units,DYNDL34-3和DYNDL50-3基本无P-β-半乳糖苷酶活力。
结合菌株的β-半乳糖苷酶和磷酸-β-半乳糖苷酶活力可知,不存在1株菌的2种半乳糖苷酶活力均高于15 Miller Units,即这些菌株多以1种半乳糖苷酶活力为主。由此推断,菌株FSDHZ-D8-L3、FJNDD18M8、StK1和LbK1主要依赖β-半乳糖苷酶水解乳糖,进而利用Leloir途径代谢半乳糖,菌株DSCAB2M1、DSCAB11M15、DSCAB12M2、DYNDL21-2、DYNDL66M43和E207主要依赖P-β-半乳糖苷酶水解乳糖,并利用T6P途径代谢半乳糖,而菌株DYNDL34-3和DYNDL50-3不能水解乳糖,因此无法在以乳糖为单一碳源的培养基中生长。
WU等[17]将NCBI上公布的各类乳酸菌的全基因组进行了KEGG数据库比对,结果发现绝大多数乳酸菌含有Leloir途径,而乳酸菌中T6P途径存在种属差异。其中,已公布全基因组的11株乳酸乳球菌全部含有完整的Leloir途径,但只有3株菌含有编码T6P途径的基因,且基因位于质粒上,存在菌株差异性。然而这种差异跟菌株的分离源是否存在一定的联系,目前尚需进一步确认。
此外,菌株DYNDL34-3和DYNDL50-3分离自乳源(表1),但在以乳糖为单一碳源的培养基中基本不利用乳糖(图4),β-半乳糖苷酶和P-β-半乳糖苷酶活力(图5)也很低,推测菌株基因组中不存在编码酶的相关基因或基因未被诱导表达。对这2株菌的全基因组进行KEGG数据库比对,结果显示2株菌基因组中只含有编码β-半乳糖苷酶和Leloir途径的基因,缺乏编码P-β-半乳糖苷酶和T6P途径的基因(数据未公布),由此可知2株菌的β-半乳糖苷酶在乳糖培养基中未被诱导表达。而DYNDL34-3和DYNDL50-3能在其自身分离源中生长,推测可能是环境中其他乳酸菌水解乳糖生成了半乳糖和葡萄糖,2株菌利用Leloir途径代谢环境中的半乳糖得到生长。
2.4 T6P途径对乳酸球菌半乳糖代谢的影响
NEVES等[19]利用13C核磁共振发现乳酸乳球菌MG1363中Leloir途径的代谢中间产物半乳糖-1-磷酸和葡萄糖-1-磷酸有积累现象,且葡萄糖磷酸变位酶活力有限,而该酶是半乳糖通过Leloir途径代谢的关键酶。WU等[18]通过HPLC测定干酪乳杆菌的发酵液,发现乳糖利用多且半乳糖积累少,而干酪乳杆菌基本不表达β-半乳糖苷酶,因此推断菌株利用T6P途径比利用Leloir途径积累的半乳糖少。
利用HPLC对10株乳酸乳球菌、保加利亚乳杆菌LbK1和嗜热链球菌StK1在MRS-乳糖培养基中培养12 h后的发酵液中半乳糖含量进行测定,结果如图6所示。
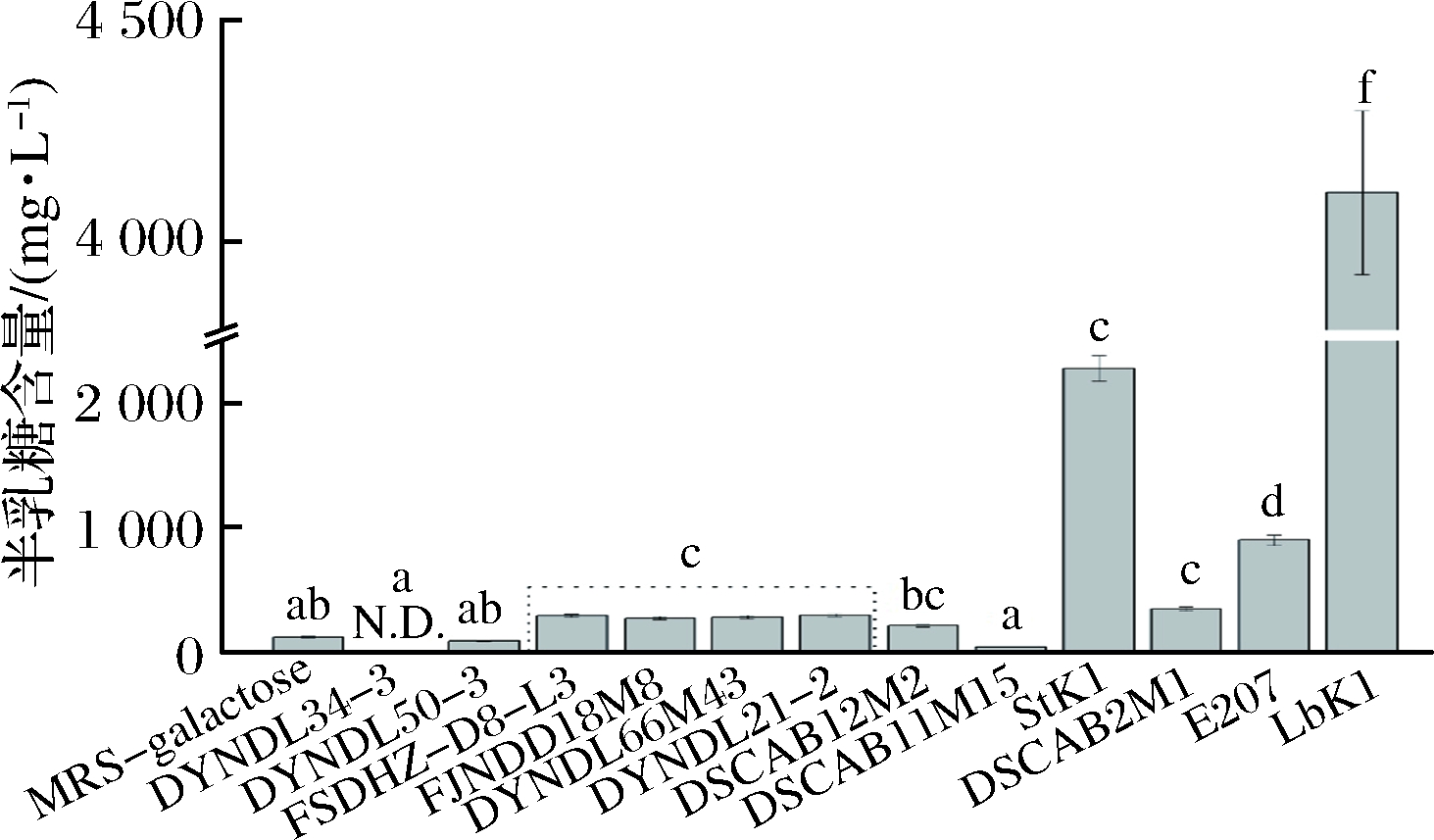
N.D.表示未检测到半乳糖
图6 不同菌株在MRS-乳糖培养基中培养12 h后培养基中残余半乳糖含量
Fig.6 Residual galactose content of different strains in MRS-lactose broth after 12 h cultivation
从图6可以看出,保加利亚乳杆菌LbK1和嗜热链球菌StK1的发酵液中积累了大量半乳糖,而利用T6P途径代谢半乳糖的乳酸乳球菌发酵液中半乳糖积累很少。乳酸乳球菌中乳糖利用最多的DSCAB2M1菌株的发酵液中乳糖含量在12 h内下降7 213 mg/L,保加利亚乳杆菌LbK1的乳糖含量下降9 083 mg/L,而2株菌发酵液中的半乳糖含量分别为344和4110 mg/L,可知保加利亚乳杆菌代谢乳糖出现严重的半乳糖积累现象。对于残余乳糖含量相差不多的乳酸乳球菌DYNDL66M43、DYNDL21-2、DSCAB12M2、DSCAB11M15和嗜热链球菌StK1,4株乳酸乳球菌的半乳糖含量都小于300 mg/L,而嗜热链球菌StK1的半乳糖含量高达2 281 mg/L。此外,利用Leloir途径代谢半乳糖的FSDHZ-D8-L3和FJNDD18M8的半乳糖含量也分别达到290和272 mg/L。综上,利用Leloir途径代谢乳糖的LbK1、StK1、FSDHZ-D8-L3和FJNDD18M8都出现严重的半乳糖积累现象,而利用T6P途径代谢半乳糖的乳酸乳球菌菌株无半乳糖积累现象。WU等[18]认为T6P途径代谢半乳糖涉及的酶促反应少,而Leloir途径代谢半乳糖涉及的反应多且复杂。NEVES等[19]从生物能量学的角度论述了PTS是碳水化合物从胞外转运到胞内最有效的方式。TAMARA等[20]也认为乳糖最有效的转运方式是PTS。因此,乳酸乳球菌利用T6P途径代谢半乳糖更加高效。
2.5 T6P途径代谢的影响的乳酸乳球菌对嗜热链球菌半乳糖
从10株乳酸乳球菌中选取6株具有代表性的菌株分别与保加利亚乳杆菌和嗜热链球菌进行复配,测定12 h后发酵液中残余乳糖和半乳糖的含量,结果如图7、图8所示。
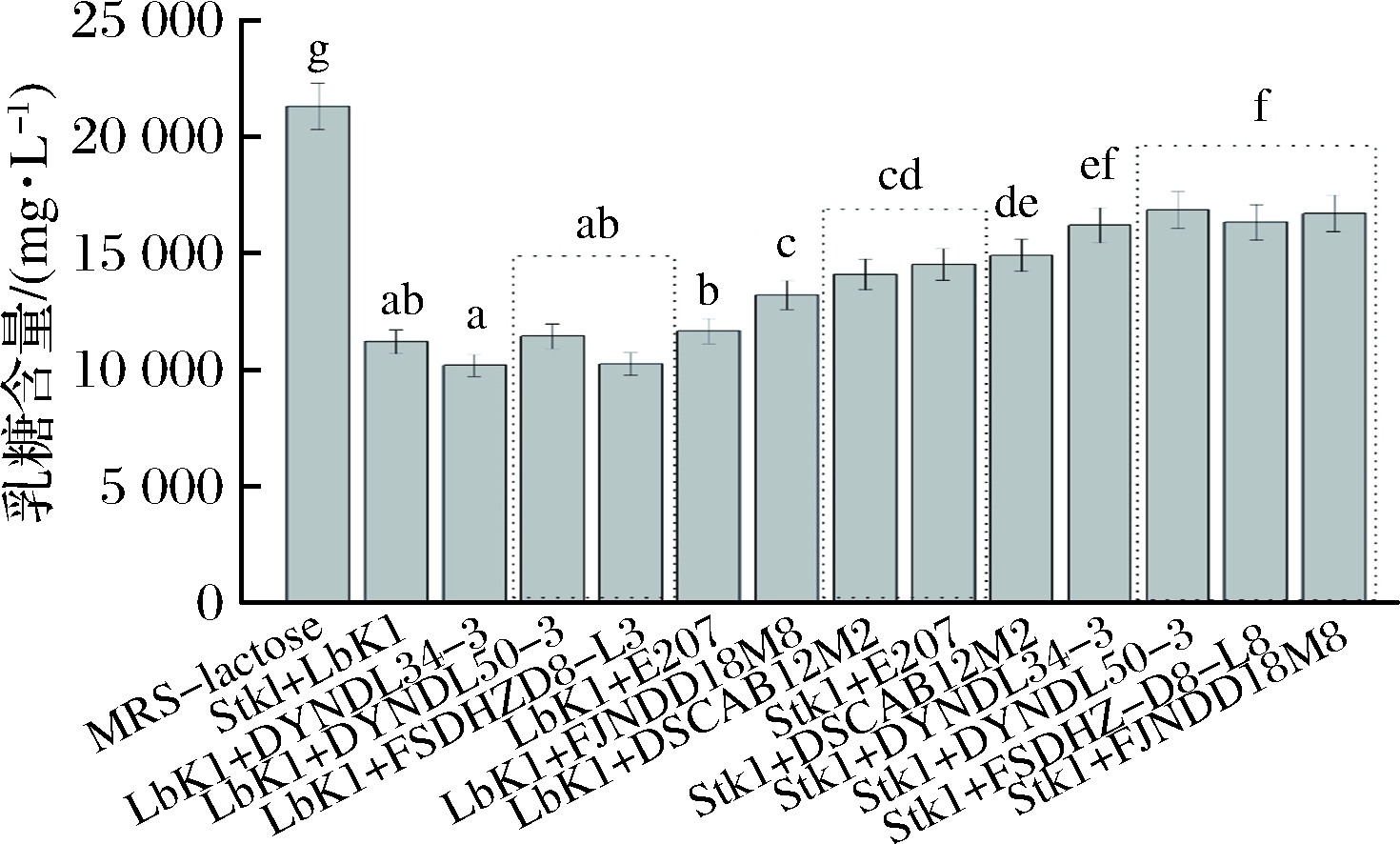
图7 复配菌株在MRS-乳糖培养基中培养12 h后培养基中残余乳糖含量
Fig.7 Residual lactose content of co-culture strains in MRS-lactose broth after 12 h cultivation

图8 复配菌株在MRS-乳糖培养基中培养12 h后培养基中残余半乳糖含量
Fig.8 Residual galactose content of co-culture strains in MRS-lactose broth after 12 h cultivation
从图7、图8中可以看出,嗜热链球菌StK1单菌培养时,发酵液中乳糖含量在12 h内下降6 694 mg/L,与E207、DSCAB12M2复配时,发酵液乳糖含量在12 h内分别下降6 791和6 399 mg/L,而半乳糖含量仅为1 002和802 mg/L,半乳糖积累现象明显减弱。由此推断,利用T6P途径代谢半乳糖的乳酸乳球菌与嗜热链球菌StK1复配之后积累的半乳糖含量明显低于嗜热链球菌单菌培养时积累的半乳糖量。此外,对于保加利亚乳杆菌LbK1而言,这种利用T6P途径减弱半乳糖积累的现象存在菌株差异性。LbK1和E207、DSCAB12M2混合培养12 h后发酵液中乳糖含量分别下降9 653和7 224 mg/L,而半乳糖含量分别为4 038和1 024 mg/L,可知LbK1和E207复配半乳糖积累严重。WU等[18]论述了利用T6P途径代谢半乳糖的干酪乳杆菌分别与保加利亚乳杆菌和嗜热链球菌复配时半乳糖积累的情况,发现干酪乳杆菌与嗜热链球菌组合可以减弱半乳糖积累,而与保加利亚乳杆菌复配时半乳糖含量明显大于保加利亚乳杆菌单菌培养时半乳糖的含量。由此可见,这种利用T6P途径减弱半乳糖积累的作用在菌株之间存在差异性。
3 结论
通过对不同的乳酸乳球菌菌株在以乳糖为单一碳源环境下的生长、产酸和乳糖代谢情况以及β-半乳糖苷酶和P-β-半乳糖苷酶的活力进行了测定,发现不同菌株的乳糖代谢能力存在显著性差异。2种乳糖水解酶活力差异影响了各菌株半乳糖代谢的差异性,其中P-β-半乳糖苷酶水解乳糖产生的半乳糖-6-磷酸进入T6P途径代谢,而β-半乳糖苷酶水解乳糖生成的半乳糖进入Leloir途径代谢。测定乳酸乳球菌、嗜热链球菌和保加利亚乳杆菌的12 h发酵液中的半乳糖含量,发现Leloir途径代谢半乳糖出现积累现象,而利用T6P途径代谢半乳糖可减轻半乳糖积累情况。将可以利用T6P途径代谢半乳糖的乳酸乳球菌分别与保加利亚乳杆菌和嗜热链球菌复配,发现与嗜热链球菌复配时半乳糖积累现象得到明显减弱,而与保加利亚乳杆菌复配时半乳糖积累减弱的现象存在菌株差异。
如何降低发酵乳制品中乳糖、半乳糖含量的问题备受关注,而通过乳酸菌代谢有效降低发酵乳制品中乳糖、半乳糖的含量一直是潜在的研究方向。利用含有P-β-半乳糖苷酶和T6P途径的乳酸乳球菌可以显著降低发酵乳制品中的乳糖且半乳糖积累较少,但在与其他传统发酵剂复配时情况较为复杂,有待进一步的研究。
[1] CAVANAGH D, FITZGERALD G F, MCAULIFFE O. From field to fermentation: the origins of Lactococcus lactis and its domestication to the dairy environment[J]. Food Microbiology,2015,47(1):45-61.
[2] MILLS S, O′SULLIVAN O, HILL C, et al. Changing face of dairy starter culture research: From genomics to economics[J]. International Journal of Dairy Technology, 2010,63(2):149-170.
[3] ISKANDAR C F, CAILLIEZ-GRIMAL C, RAHMAN A, et al. Genes associated to lactose metabolism illustrate the high diversity of Carnobacterium maltaromaticum[J]. Food Microbiology,2016,58(1):79-86.
[4] THA S CAROLINE MOREIRA,
S CAROLINE MOREIRA,  GATHA TRANSFELD DA SILVA, FAGUNDES C, et al. Elaboration of yogurt with reduced level of lactose added of carob (Ceratonia siliqua L.)[J]. LWT-Food Science and Technology,2017,76(1):326-329.
GATHA TRANSFELD DA SILVA, FAGUNDES C, et al. Elaboration of yogurt with reduced level of lactose added of carob (Ceratonia siliqua L.)[J]. LWT-Food Science and Technology,2017,76(1):326-329.
[5] 李兴.酶法降解乳糖及低乳糖发酵酸乳的发酵工艺技术研究[D].石家庄:河北科技大学, 2013.
[6] OHLSSON J A, JOHANSSON M, HANSSON H, et al. Lactose, glucose and galactose content in milk, fermented milk and lactose-free milk products[J]. International Dairy Journal,2017,73(1):151-154.
[7] KANDLER O. Carbohydrate metabolism in lactic acid bacteria[J]. Antonie Van Leeuwenhoek,1983,49(3):209-224.
[8] ABRANCHES J, CHEN Y Y M, BURNE R A. Galactose metabolism by Streptococcus mutans[J]. Applied and Environmental Microbiology,2004,70(10):6 047-6 052.
[9] SOLOPOVA A, BACHMANN H, TEUSINK B, et al. A specific mutation in the promoter region of the silent cel cluster accounts for the appearance of lactose-utilizing Lactococcus lactis MG1363[J]. Applied and Environmental Microbiology,2012,78(16):5 612-5 621.
[10] ZENG L, DAS S, BURNE R A. Utilization of lactose and galactose by Streptococcus mutans: Transport, toxicity, and carbon catabolite repression[J]. Journal of Bacteriology,2010,192(9):2 434-2 444.
[11] ZENG L, MARTINO N C, BURNE R A. Two gene clusters coordinate galactose and lactose metabolism in Streptococcus gordonii[J]. Applied and Environmental Microbiology,2012,78(16):5 597-5 605.
[12] ZBIGNIEW L, HEBER G, ANNE-MARIE C, et al. Awakening the endogenous Leloir pathway for efficient galactose utilization by Yarrowia lipolytica[J]. Biotechnology for Biofuels,2015,8(1):185-200.
[13] NEVES A R, POOL W A, SOLOPOVA A, et al. Towards enhanced galactose utilization by Lactococcus lactis[J]. Applied and Environmental Microbiology,2010,76(21):7 048-7 060.
[14] BASKARAN D, SIVAKUMAR S. Galactose concentration in pizza cheese prepared by three different culture techniques[J]. International Journal of Dairy Technology,2010,56(4):229-232.
[15] HUTKINS R, HALAMBECK S M, MORRIS H A. Use of galactose-fermenting Streptococcus thermophilus in the manufacture of Swiss, mozzarella, and short-method cheddar cheese[J]. Journal of Dairy Science,1986,69(1):1-8.
[16] MICHEL, VALÉRIE, MARTLEY F G. Streptococcus thermophilus in Cheddar cheese-production and fate of galactose[J]. Journal of Dairy Research,2001,68(2):317-325.
[17] WU Q, CHEUNG C K W, SHAH N P. Towards galactose accumulation in dairy foods fermented by conventional starter cultures: Challenges and strategies[J]. Trends in Food Science and Technology,2015,41(1):24-36.
[18] WU Q, SHAH N. The potential of species-specific tagatose-6-phosphate (T6P) pathway in Lactobacillus casei group for galactose reduction in fermented dairy foods[J]. Food Microbiology,2017,62(1):178-187.
[19] NEVES A R, POOL W A, KOK J, et al. Overview on sugar metabolism and its control in Lactococcus lactis - the input from in vivo NMR[J]. Fems Microbiology Reviews,2010,29(3):531-554.
[20] ALEKSANDRZAK-PIEKARCZYK T, KOK J, RENAULT P, et al. Alternative lactose catabolic pathway in Lactococcus lactis IL1403[J]. Applied and Environmental Microbiology,2005,71(10):6 060-6 069.