芳香酯是天然存在于植物中的短链酯,赋予植物及其衍生产品宜人风味,主要包括乙酸乙酯、己酸乙酯、乳酸乙酯、辛酸乙酯和丁酸丁酯[1]。芳香酯也是食品、饮料、日化和制药工业等产品中的常用外加风味物质[2]。
目前,芳香酯多从自然资源中提取或由化学法合成制得[3]。前者收得率低、生产成本高且受气候和农业条件影响显著[4];后者是目前芳香酯制备的主要方法,但环境不友好、产物分离纯化复杂、碳排放量高[2,5]。某些特殊类别的脂肪酶在非天然催化条件下对芳香酯的合成作用已被广泛研究[6-8],这些脂肪酶也被应用于发酵食品、饮料的加工过程,以改善产品风味[9-11]。开发具有芳香酯合成能力的脂肪酶,对研究芳香酯酶法合成新技术及其在发酵食品、饮料生产中的应用具有极其重要的意义[12]。
为此,本文在分析黑曲霉基因组脂肪酶生物信息的基础上,对其中一个功能未知的脂肪酶进行基因克隆和表达,并就其酶学性质特别是芳香酯合成能力进行解析。
1 材料与方法
1.1 菌种
黑曲霉(Aspergillus niger)F0215、大肠杆菌(Escherichia coli)JM109、毕赤酵母(Pichia pastoris)GS115和质粒pPIC9k,均为本实验室保藏。
1.2 主要试剂
限制性内切酶和PyrobestTM DNA聚合酶,购自大连宝生物工程有限公司;质粒提取试剂盒和DNA纯化试剂盒,由北京庄盟国际生物基因科技有限公司提供;真菌RNA快速提取试剂盒、cDNA合成试剂盒和G418,为Invitrogen公司产品;BCA蛋白浓度测定试剂盒,为北京索莱宝科技有限公司产品;对硝基苯酚羧酸酯(C2~C16),购自Sigma公司;其他生化试剂均为国产分析纯,国药集团化学试剂有限公司。
1.3 基因克隆和表达
基因扩增、连接、转化与鉴定等,按照实验室常规方法进行[13];黑曲霉总RNA的提取与cDNA制备,按照试剂盒说明书进行;基因扩增采用的寡核苷酸引物,由上海生工生物工程公司合成;其序列为:上游引物:5′-gtaGCCCCCACCGCCACCCAC-3′,下游引物:5′-tgctctaga CTAAGAAGAAGAAACCCCCGCAGCCTG-3′(下划线部分为限制性酶切位点)。所克隆的脂肪酶基因按照常规方法,在毕赤酵母中进行表达[14]。在250 mL三角瓶中通过甲醇诱导制备发酵酶液。发酵结束后,离心取发酵液上清获得粗酶液;用30%~60%的(NH4)2SO4分级沉淀,再用PD-10脱盐柱(GE公司产品)进行脱盐,冷冻干燥后备用。蛋白质浓度采用BCA蛋白浓度测定试剂盒进行测定。
1.4 脂肪酶酶活力测定与酶学特征分析
1.4.1 脂肪酶的活力测定
脂肪酶活力测定按照文献方法进行[15]。500 μL反应体系中包括400 μL、50 mmol/L、pH 7.0的磷酸盐缓冲液、50 μL、20 mmol/L、p-NPB和50 μL酶液,30℃下反应10 min,500 μL无水乙醇终止反应,410 nm下测定吸光值。酶活力定义为:在一定温度和pH下,每分钟催化对硝基苯丁酸酯水解生成1 μmol对硝基苯酚的酶量为一个酶活力单位。
1.4.2 最适作用温度和最适作用pH
在不同温度(20~70℃)和不同pH下(pH 4.0~10.0),按照1.4.1中的方法进行脂肪酶活力的测定,以最高酶活为100%计算相对酶活。
1.4.3 热稳定性和pH稳定性
将酶液分别置于不同温度(20~60℃)和不同pH(pH 4.0~10.0)下,放置不同时间,然后在酶的最适作用条件下,测定残余酶活,以未经处理的酶液活力为100%,计算相对酶活。所用缓冲液为:20 mmol/L醋酸盐缓冲液(pH 4.0~5.5)、20 mmol/L磷酸盐缓冲液(pH 6.0~7.5)、20 mmol/L Tris-HCl缓冲液(pH 8.0~9.0)和20 mmol/L甘氨酸-NaOH缓冲液(pH 9.5~10.0)。
1.4.4 金属离子、螯合剂和有机溶剂对酶活的影响
在反应体系中分别加入1 mmol/L的金属离子或螯合剂,室温放置2 h,按照上述方法测定酶活,以未做添加的酶液活力为100%,计算相对酶活。40 μL酶液和10 μL有机溶剂混合,室温下150 r/min振荡2 h,按照酶活测定方法测定残余酶活力,以未做添加的酶液活力为100%,计算相对酶活。
1.5 底物特异性分析和动力学参数测定
分别以5种不同碳链长度的对硝基苯酚羧酸酯(C2、C4、C8、C12、C16)为底物,测定脂肪酶的酶活力,以最高酶活力为100%,计算相对酶活。用异丙醇配制一系列不同浓度的底物,测定脂肪酶在不同底物浓度下的酶活力,以底物浓度的倒数(1/[S])为横坐标、反应速率的倒数1/V为纵坐标作图,并利用公式(1)计算Km和Vmax的值[16]:
(1)
1.6 芳香酯合成
芳香酯(辛酸乙酯、乳酸乙酯和丁酸丁酯)的酶法合成,按照文献[6-8]的方法,在30 ℃、150 r/min条件下反应12 h。其中,辛酸乙酯合成体系为:0.6 mol/L辛酸、0.72 mol/L乙醇和100 U/mL重组酶,溶剂为正庚烷;乳酸乙酯合成体系为:1.17 mol/L乳酸、4.68 mol/L乙醇和50 U/mL重组酶,溶剂为叔丁醇;丁酸丁酯合成体系为:0.1 mol/L丁酸、0.2 mol/L丁醇和20 U/mL重组酶,溶剂为正己烷。反应结束后以12 000 r/min离心2 min,取上清进行产物分析。
芳香酯组成与含量用气相色谱法分析[17],色谱条件为:毛细管柱HP-INNOWax(30 m×0.32 mm×0.5 μm),检测器为FID;进样口温度200℃,检测器温度250℃,H2流量40 mL/min,空气流量300 mL/min,尾吹流量25 mL/min;进样量1 μL,分流比10∶1;载气为氮气,流速0.8 mL/min;起始柱温50℃,保持8 min,以5 ℃/min的速度上升至200 ℃,保持5 min。
1.7 生物信息学分析
A. niger CBS 513.88基因组序列信息(EMBL AM270980-AM270998),来自GenBank;脂肪酶序列比对,用Clustal X2程序进行;信号肽分析,采用SignalP 4.1软件进行在线分析。
2 结果与分析
2.1 黑曲霉脂肪酶CutA的基因克隆与表达
对A. niger CBS 513.88基因组序列中疑似脂肪酶开放读框进行分析,获得了一个功能未知的脂肪酶开放读框cutA,大小为0.8 kb,编码289个氨基酸残基,含有由16个氨基酸残基组成的典型信号肽序列。以A. niger F0215 cDNA为模板,对其成熟肽编码序列进行扩增并克隆入表达载体pPIC9K中,获得重组质粒pPIC-cutA;经核苷酸序列测定与分析后发现,所克隆的cutA核苷酸序列与A. niger CBS 513.88中相应序列存在5个碱基差异,但氨基酸序列完全一致。
将线性化的重组质粒pPIC-cutA转化入毕赤酵母GS115,经筛选与鉴定后获得cutA重组菌,命名为ANL-CutA。经摇瓶发酵,重组菌ANL-CutA的发酵上清中含有7.52 U/mL的脂肪酶酶活。通过30%(质量分数)(NH4)2SO4去除杂蛋白,再继续添加(NH4)2SO4至饱和度为60%沉淀目的蛋白CutA,目的蛋白用磷酸盐缓冲液复溶并检测酶活及蛋白浓度,纯化后CutA的比酶活为46.28 U/mg。重组CutA在SDS-PAGE上呈现单一条带(图1),分子质量约为27 ku,与理论分子质量大小相符。
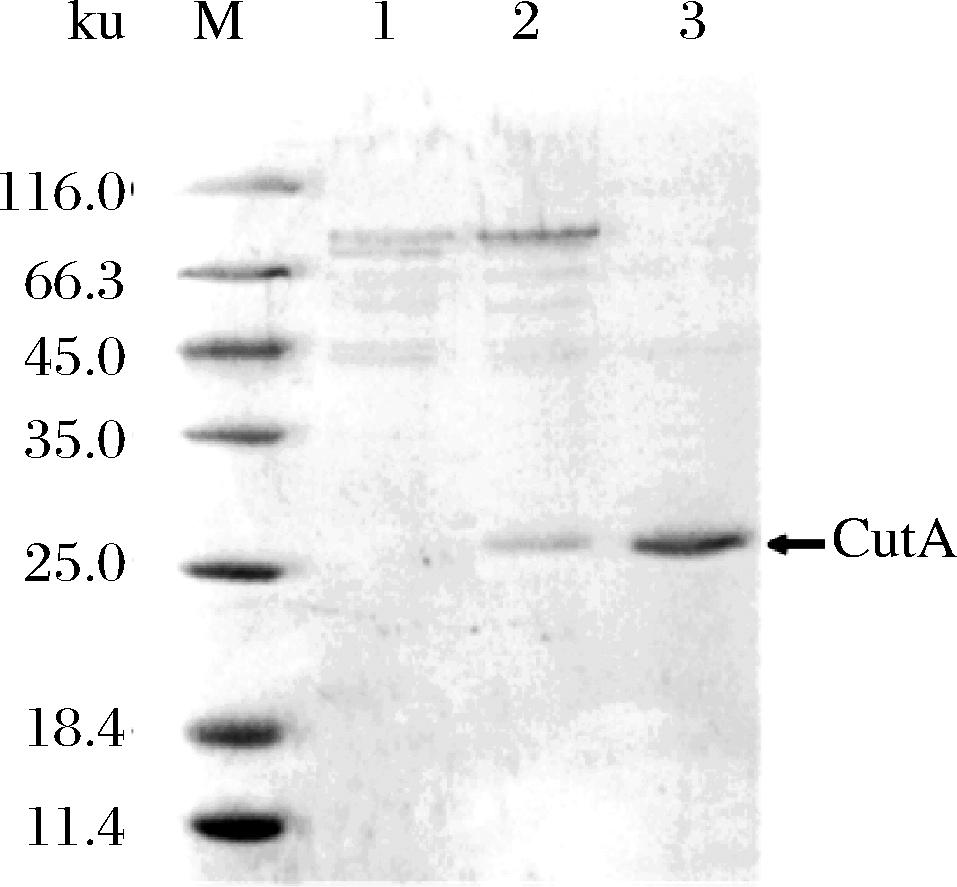
M-蛋白分子质量标准;1-GS115发酵液;2-ANL-CutA发酵液;3-纯化后的重组CutA
图1 重组CutA的SDS-PAGE电泳图谱
Fig.1 SDS-PAGE profile of the recombinant CutA
2.2 重组CutA的酶学性质
2.2.1 最适作用温度和热稳定性
在不同温度下检测CutA的脂肪酶活力,结果显示,CutA的最适作用温度为30℃(图2-a);当温度降至20℃时相对酶活仅为30%,当温度高至60℃时酶活接近丧失(图2-a)。重组酶在低于40℃下孵育4 h,残余酶活均在60%以上,稳定性良好;随着温度的上升,酶活力稳定性明显下降(图2-b)。
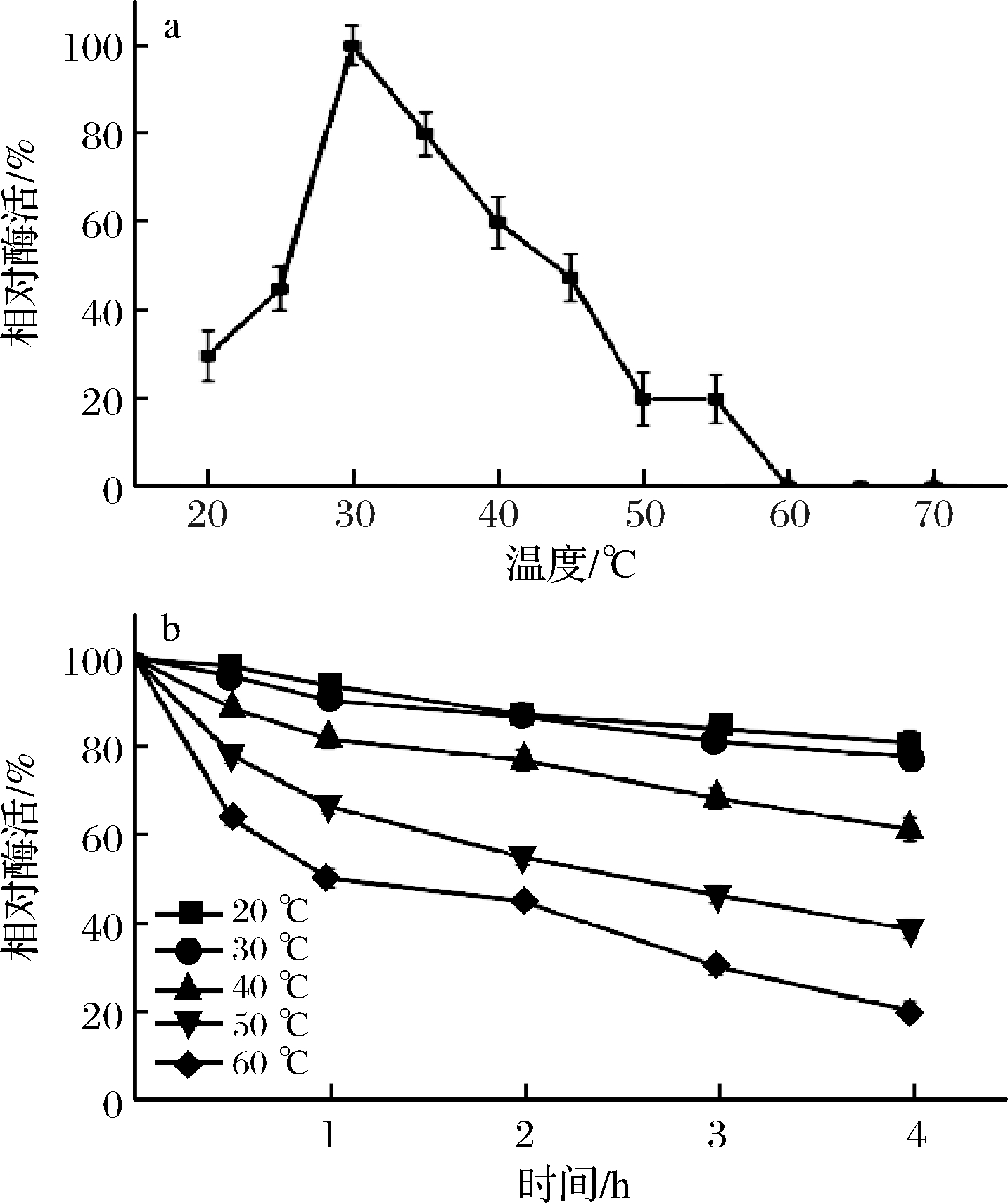
a-最适作用温度;b-热稳定性
图2 温度对CutA活力和稳定性的影响
Fig.2 Effect of temperature on the activity and stability of CutA
2.2.2 最适作用pH和pH稳定性
在不同pH下检测CutA的活力,结果显示,CutA的最适作用pH为7.0,在pH 6.5~8.0酶活保持在60%以上(图3-a)。重组酶在不同pH下孵育4 h,在pH为6.0~8.0的缓冲体系下残余酶活在60%以上,在接近中性pH范围内,CutA稳定性良好(图3-b)。
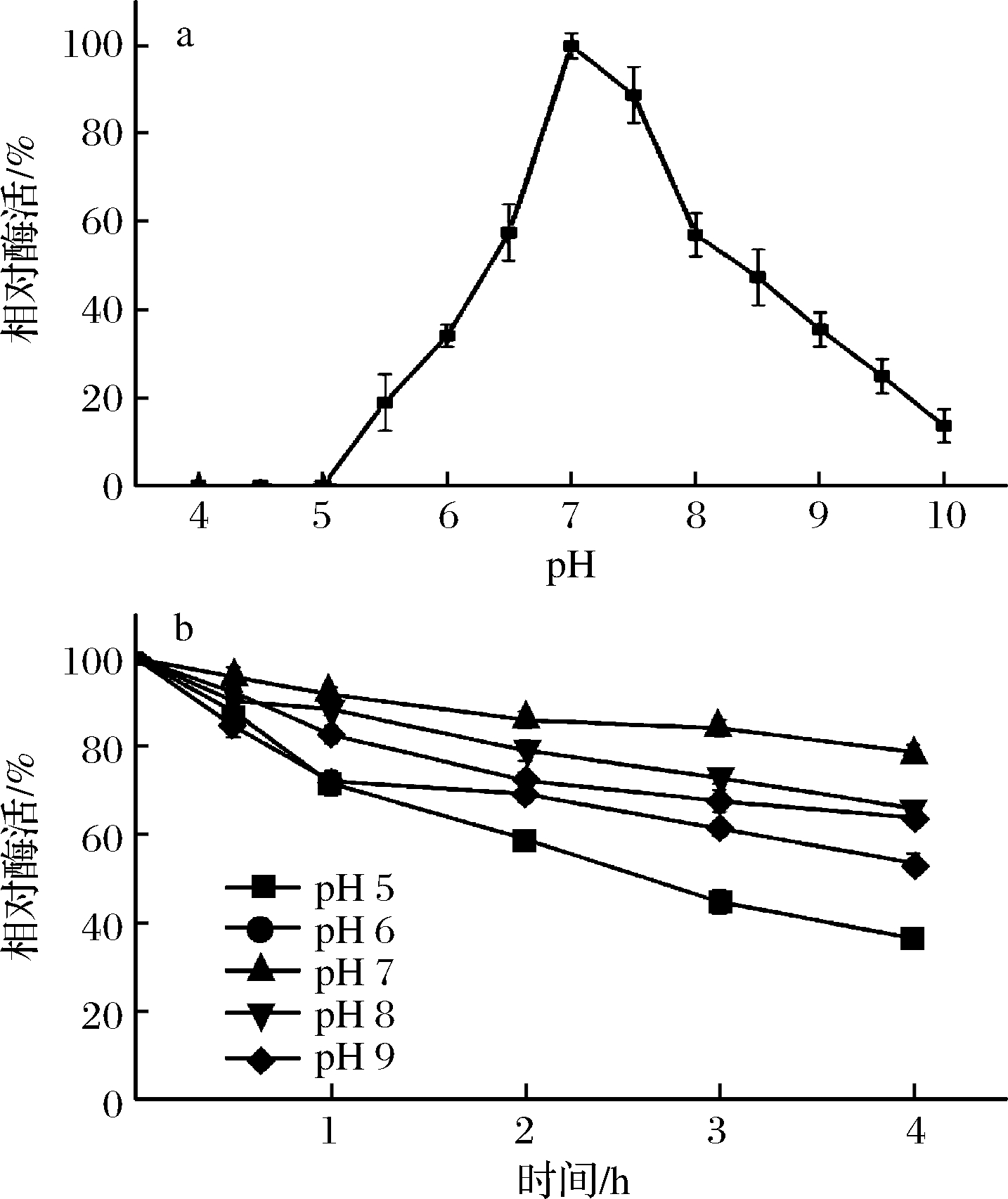
a-最适作用pH;b-pH稳定性
图3 pH值对CutA活力和稳定性的影响
Fig.3 Effect of pH on the activity and stability of CutA
2.2.3 金属离子和螯合剂对重组脂肪酶活力的影响
在反应体系中加入1 mmol/L的金属离子或螯合剂,研究金属离子或螯合剂对CutA酶活的影响,结果汇总于表1。所检测的金属离子和化学品对此酶皆有不同程度的抑制作用,以Fe3+对CutA抑制作用最为显著。
表1 金属离子及螯合剂对CutA活力的影响
Table 1 Effects of metal ions and chelate agent on the activities of CutA

金属离子或螯合剂相对酶活/%对照100.00±3.13Ca2+84.23±4.20Sn2+76.93±3.00K+87.59±3.67Cu2+78.75±4.33Mg2+76.02±3.48Mn2+85.32±2.67Co2+75.93±4.87Fe3+66.03±3.00Zn2+81.20±3.80EDTA89.63±2.80
2.2.4 重组酶有机溶剂耐受性
研究了不同有机溶剂对重组酶活力的影响,结果如图4所示。由图4可知,叔丁醇和庚烷对CutA活力几乎无影响;乙醇、氯仿、正己烷、正辛烷、二甲基亚砜和甲苯有一定抑制作用;二氯甲烷和丙三醇的抑制作用最为显著。
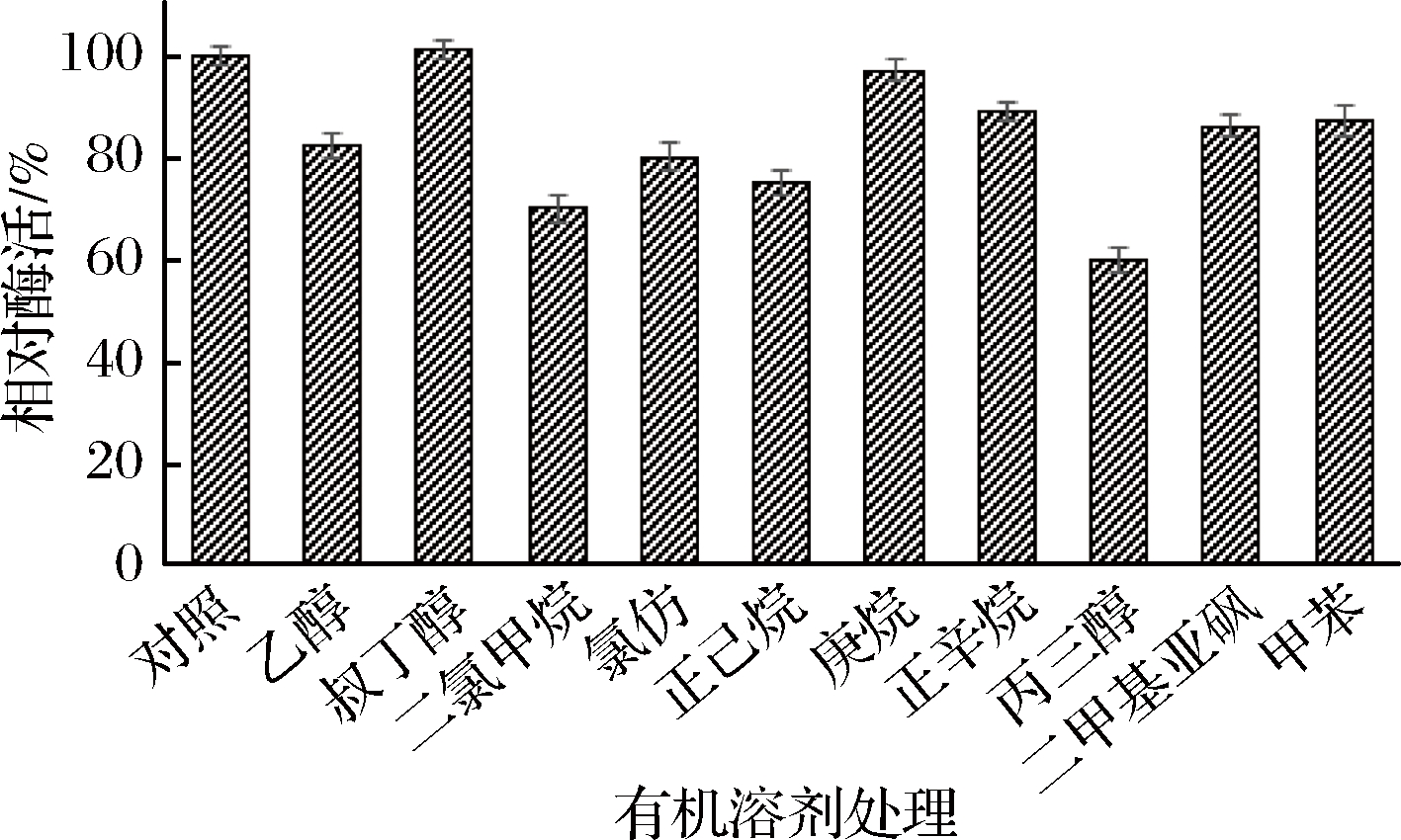
图4 有机溶剂对脂肪酶活力的影响
Fig.4 Effect of organic solvents on the activity of CutA
2.3 重组脂肪酶底物特异性
以不同链长的对硝基苯酚酯为底物,对重组CutA的水解特征进行分析,结果如图5所示。CutA的最适作用底物为C2,其次依次为C4、C8和C12,对C16无水解作用。CutA对不同链长底物呈现出不同的水解活性,偏好于对短链脂肪酸酯的水解。以对硝基苯酚乙酯为底物,CutA的Km值为19.5 mmol/L,Vmax为63.3 mmol/(mL·h)。
2.4 CutA具有酯化活性
以重组CutA为催化剂,进行了3种常见芳香酯的酶促合成,结果如图6所示。CutA可催化合成丁酸丁酯、乳酸乙酯和辛酸乙酯,合成丁酸丁酯、乳酸乙酯和辛酸乙酯的转化率分别为17.2%、4.7%和1.8%。实验条件下,CutA更倾向于丁酸丁酯的酶促合成;对乳酸乙酯和辛酸乙酯的合成能力次之。

图5 CutA的底物特异性
Fig.5 The substrate specificity of CutA
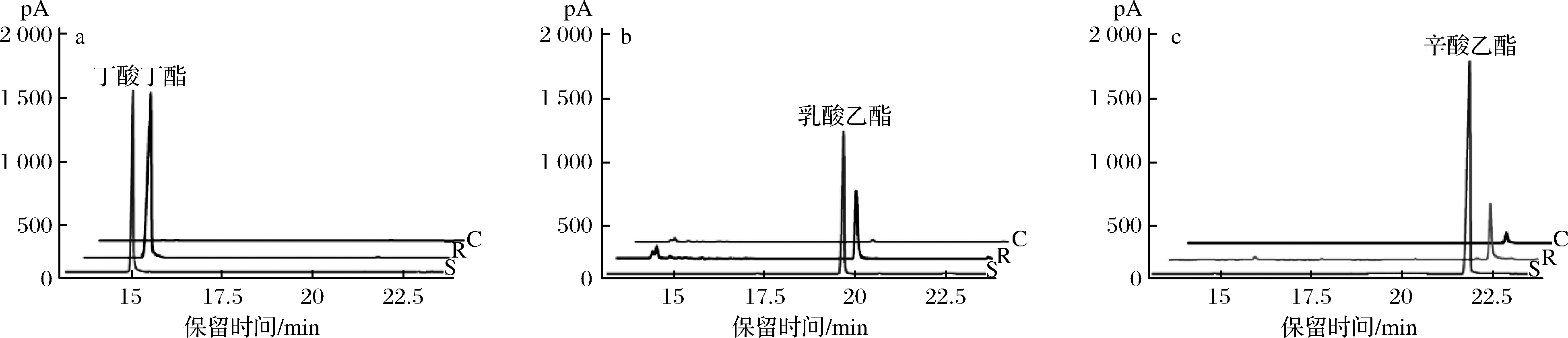
a-CutA催化丁酸和丁醇反应;b-CutA催化乳酸和乙醇反应;c-CutA催化辛酸和乙醇反应S-标准品;R-反应组;C-对照组
图6 CutA催化合成芳香酯的气相谱图
Fig.6 GC profiles of of butyl butyrate, ethyl caprylate and ethyl lactate synthesized by CutA
3 结论与讨论
芳香酯广泛来源于植物,也存在于常见发酵食品、饮料。辛酸乙酯是浓香型白酒中仅次于己酸乙酯的重要风味成分[18]。乳酸乙酯对减少白酒酒体刺激感、增加醇甜感和厚度、延长后味有显著作用[19];在酸菜自然发酵中后期,是挥发性风味物质中含量最高的组分[20]。丁酸丁酯见于白酒、奶酪、火腿等风味成分的报道[21-23]。
酶制剂在食品风味增强与改善中的应用已得到广泛研究。吴华昌等在白酒陈化中分别使用不同种类的脂肪酶,其中一种可加速白酒中酸、酯、醇平衡[9]。封莉等以脂肪酶促进中式香肠中挥发性风味物质的生成,适量添加可显著提高香肠香气[10]。张硕等在奶酪中添加脂肪酶,奶酪中酯、酸等挥发性物质增加,奶酪风味得到改善[11]。
本研究首次报道了黑曲霉脂肪酶CutA具有合成乳酸乙酯、辛酸乙酯和丁酸丁酯的酯化活性,为芳香酯形成或合成提供了新的可能性,CutA的酯化活性在食品加工和酿造方面具有一定的应用潜力。
[1] LIAQUAT M, APENTEN R K O R. Synthesis of low molecular weight flavor esters using plant seedling lipases in organic media[J]. Journal of Food Science, 2000, 65(2): 295-299.
[2] BRAULT G, SHARECK F, HURTUBISE Y, et al. Short-chain flavor ester synthesis in organic media by an Escherichia coli whole-cell biocatalyst expressing a newly characterized heterologous lipase[J]. PLoS One, 2014, 9(3): 1-9.
[3] LONGO M A, SANROM N M A. Production of food aroma compounds: Microbial and enzymatic methodologies[J]. Food Technology and Biotechnology, 2006, 44(3): 335-353.
N M A. Production of food aroma compounds: Microbial and enzymatic methodologies[J]. Food Technology and Biotechnology, 2006, 44(3): 335-353.
[4] DEBARROS D P C, AZEVEDO A M, CABRAL J M S, et al. Optimization of flavor esters synthesis by Fusarium solanipisi cutinase[J].Journal of Food Biochemistry, 2012, 36(3): 275-284.
[5] DEBARROS D P C, FERNANDES P, CABRAL J M S, et al. Synthetic application and activity of cutinase in an aqueous, mini-emulsion model system: Hexyl octanoate synthesis[J]. Catalysis Today, 2011, 173(1): 95-102.
[6] PATEL V, GAJERA H, GUPTA A, et al. Synthesis of ethyl caprylate in organic media using Candida rugosa lipase immobilized on exfoliated graphene oxide: Process parameters and reusability studies[J]. Biochemical Engineering Journal, 2015, 95: 62-70.
[7] KOUTINAS M, YIANGOU C, OS RIO N M, et al. Application of commercial and non-commercial immobilized lipases for biocatalytic production of ethyl lactate in organic solvents[J]. Bioresource Technology, 2018, 247: 496-503.
RIO N M, et al. Application of commercial and non-commercial immobilized lipases for biocatalytic production of ethyl lactate in organic solvents[J]. Bioresource Technology, 2018, 247: 496-503.
[8] DUAN Xiaojie, LIU Yu, YOU Xin, et al. High-level expression and characterization of a novel cutinase from Malbranchea cinnamomea suitable for butyl butyrate production[J]. Biotechnology for Biofuels, 2017, 10(1): 223.
[9] 吴华昌,由耀辉,卢中明,等. 脂肪酶应用于白酒催陈的初探[J]. 中国酿造, 2011, 30(3): 75-77.
[10] 封莉,邓绍林,黄明,等. 脂肪酶对中式香肠脂肪降解、氧化和风味的影响[J]. 食品科学, 2015, 36(1): 51-58.
[11] 张硕,王玉田,孟鑫. 内源性脂肪酶对奶酪风味的作用及风味成分分析[J]. 食品工业科技, 2013, 34(6): 100-103.
[12] GANDHI N N, PATIL N S, SAWANT S B, et al. Lipase-catalyzed esterification [J]. Catalysis Reviews, 2000, 42(4): 439-480.
[13] 诸葛健,王正祥. 工业微生物实验技术手册[M]. 北京:中国轻工业出版社, 1994: 413-450.
[14] GREEN M R, SAMBROOK J. Molecular Cloning: A Laboratory Manual: Three-Volume Set[M]. 4th ed. New York: Cold Spring Harbor Laboratory Press, 2012.
[15] XU Haibo, YAN Qiaojuan, DUAN Xiaojie, et al. Characterization of an acidic cold-adapted cutinase from Thielavia terrestris and its application in flavor ester synthesis[J]. Food Chemistry, 2015, 188: 439-445.
[16] SINGH A K, MUKHOPADHYAY M. Immobilization of lipase on carboxylic acid-modified silica nanoparticles for olive oil glycerolysis[J]. Bioprocess and Biosystems Engineering, 2018, 41(1): 115-127.
[17] GB/T 10345—2007白酒分析方法[S]. 北京:中国标准出版社, 2007.
[18] 李志斌,李净. 浓香型白酒中的重要物质-辛酸乙酯含量及其贡献分析[J]. 酿酒, 2013, 40(3): 33-35;36.
[19] 谢玉球,钟雨,谢旭,等. 乳酸菌在固态法白酒生产中的地位与作用[J]. 酿酒科技, 2008, 173(11): 83-86.
[20] WU Rina, YU Meiling, LIU Xiaoyu, et al. Changes in flavour and microbial diversity during natural fermentation of suan-cai, a traditional food made in northeast China[J]. International Journal of Food Microbiology, 2015, 211: 23-31.
[21] 段明松,胡晓龙,曾田,等. 不同空间位置的浓香型原酒中香气成分的差异性分析[J]. 酿酒科技, 2019, 295(1): 126-130;135.
[22] 郑晓吉,刘飞,任全路,等. 基于SPME-GC-MS法比较新疆哈萨克族不同居住区奶酪风味差异[J]. 食品科学, 2018, 39(8): 83-89.
[23] 戴照琪,赵见营,罗辑,等. 复合精油涂层对干腌火腿挥发性风味品质的影响研究[J]. 食品工业科技, 2018, 39(3): 243-249;258.