糖尿病是以高血糖为特征的代谢性疾病,主要包括Ⅰ型糖尿病(type I diabetes, T1D)和Ⅱ型糖尿病(type Ⅱ diabetes, T2D),其中大部分为T2D[1]。T2D的发病机制主要为自身免疫破坏的胰岛功能缺陷和敏感性不足导致的胰岛素抵抗,进而导致明显的高血糖[2]。国际糖尿病联合会(International Diabetes Federation,IDF)的调查结果显示,2017年全球约有4.25亿年龄大于19岁的人患有糖尿病,如果继续维持这种发展趋势,约30年后,糖尿病患者人数将高达6.93亿[3]。因此控制糖尿病已迫在眉睫。
已有研究表明,肠道微生物失调与多种疾病有关,包括多种肠道疾病(肠炎、大肠癌)[4]和代谢类疾病(糖尿病、肥胖和非酒精性脂肪性肝病等)[5]。模型动物的研究表明,与正常小鼠相比,T2D小鼠体内的肠道微生物组成发生了很大的变化,主要体现为厚壁菌门与拟杆菌门的比值增加,产丁酸细菌属的丰度也会产生变化,这与T2D患者的肠道菌群变化结果是一致的[6]。
双歧杆菌是一种可食用的益生菌,部分研究报道该属的部分菌株可有效缓解肠道菌群失调的现象[7]。研究表明,含两歧双歧杆菌的复配配方能有效增强T2D小鼠的胰岛素敏感性[8],降低空腹血糖,调节机体抗氧化能力,修复脂质代谢,缓解炎症,甚至起到改变SCFAs组成,改善肠道菌群失调的作用[9]。然而,大量的研究也表明,益生菌的功能具有显著的菌株特异性,两歧双歧杆菌是否都具有缓解T2D的作用尚不明确,且关于单一的两歧双歧杆菌抗糖尿病的研究并不多,具体的改善途径也不明确。因此,本研究分析了3株不同来源的两歧双歧杆菌在单菌情况下缓解T2D能力的差异,并希望借此找到两歧双歧杆菌缓解T2D的可能途径。
1 材料与方法
1.1 试剂与仪器
STZ,美国Sigma公司; 60%高脂饲料,南通特洛菲实验动物饲料高科技平台;血糖仪和试纸,美国罗氏公司;TNF-a、IL-1β试剂盒,美国RD公司;胰岛素试剂盒,南京森贝伽生物科技有限公司;总蛋白试剂盒,南京碧云天生物技术有限公司;TC、TG、HDL-C、LDL-C试剂盒,南京建成生物工程研究所;引物,上海生工生物工程。
5415R型台式高速冷冻离心机,德国Eppendorf公司;SW-CJ-1FD型超净工作台,上海智诚科技有限公司;RC BIOS 10型落地式离心机,美国Thermo公司;1300-ISQ型Thermo/Trace GC-MS,美国Thermo公司;3020型多功能酶标仪,美国Thermo公司;PE300型MiSeq高通量测序平台,美国Illumina公司;2100型Agilent(安捷伦)生物分析仪,美国Agilent科技有限公司;Gel DocTM EZ imager型凝胶成像系统,美国Bio-Rad公司。
1.2 乳酸菌悬浮液的制备
实验用3株菌株(BB1:B. bifidum JSYC2M2、BB13:B. bifidum BB13、H35:B. bifidum H35),均来源于江南大学食品生物技术中心菌种保藏库。菌株于固体培养基上划线分离后,挑取单菌落于液体MRS培养基中,于 37 ℃、24 h条件下活化,48 h活化2代后接种于MRS培养基中培养24 h进行扩培(37 ℃),将培养好的两歧双歧杆菌在4 ℃,5 000 r/min条件下离心10 min,所得菌泥用PBS清洗2次,用倾注计数方法调整总活菌量在5×1010 CFU/mL,于菌泥中加入 30 %的蔗糖保护剂后保藏于-80℃备用;灌胃前将菌液离心,然后用3%蔗糖重悬后使用。
1.3 动物和实验设计
动物实验的设计方案,如图1所示。所有动物实验的操作严格遵守江南大学动物管理和使用委员会的章程(SYXK 2012-0002)。48只3周龄的无特定病原(specific pathogen free,SPF)级C57BL/6J小鼠,购自上海斯莱克动物中心。小鼠分为6组(每组8只):正常组、模型组、罗格列酮药物组、BB1组、BB13组和H35组。所有小鼠适应性喂养1周,从第2周开始,正常组小鼠喂食普通对照饲料,其余小鼠喂食60%高脂饲料。在第11周的第1天:所有小鼠禁食不禁水12 h,空白组注射50 mmol/L柠檬酸-柠檬酸钠缓冲液(pH 4.5),其余组按照100 mg/kg(bw)的剂量注射50 mmol/L STZ(冰上避光,现配现用),STZ用50 mmol/L柠檬酸-柠檬酸钠缓冲液溶解。STZ注射后1周,小鼠禁食不禁水测定空腹血糖(fasting blood glucose,FBG),以FBG>7.0 mmol/L且糖负荷2 h后血糖>11.1 mmol/L即为造模成功[10]。从第2周开始至16周试验结束,小鼠每周灌胃6次,剂量为0.2 mL,各组小鼠灌胃样品如下:
(1)空白组和模型组:灌胃3%的蔗糖溶液;
(2)罗格列酮药物组:灌胃含10 mg/kg(bw)罗格列酮的3%蔗糖溶液;
(3)BB1组:灌胃含有两歧双歧杆菌BB1(5×109 CFU/mL)的3%蔗糖溶液;
(4)BB13组:灌胃含有两歧双歧杆菌BB13(5×109 CFU/mL)的3%蔗糖溶液;
(5)H35组:灌胃含有两歧双歧杆菌H35(5×109 CFU/mL)的3%蔗糖溶液。
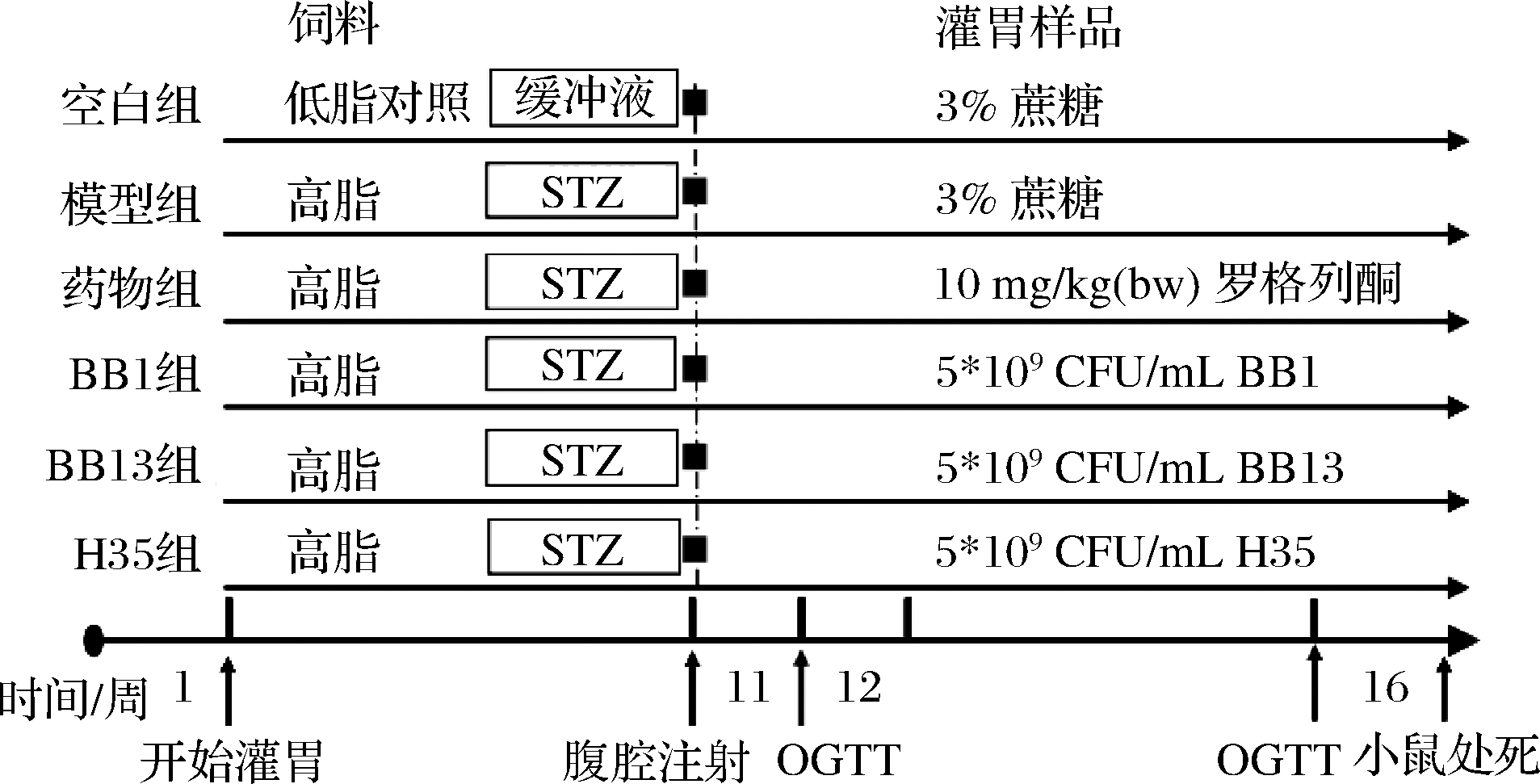
图1 动物实验设计方案
Fig.1 Animal experimental design
1.4 样品采集及处理
实验结束前,采集新鲜粪便样品于2 mL灭菌的干燥EP管中,立刻冰上放置并快速转移至-80 ℃冰箱保存备用。动物禁食不禁水12 h后,采用质量浓度为10 g/L的戊巴比妥钠溶液 0.5 mL/10 g对小鼠进行腹腔注射,取血后辅以颈椎脱臼法处死。全血取出后分成2份,一份全血装于抗凝管中直接置于-80 ℃保存,另一份经3 000 r/min离心15 min后,收集上层血清,转移至-80 ℃冰箱保存备用。将胰腺组织用4 ℃预冷的生理盐水漂洗后保存在4%多聚甲醛溶液中;对肝脏组织称重并将其和结肠组织各分为2份,一份保存在4%多聚甲醛溶液中用于组织切片,另一份经液氮冷冻后,置于-80 ℃保存备用。
1.5 空腹血糖及口服糖耐量测定
动物实验期间,每周第1天检测小鼠的空腹血糖(fasting blood alucose,FBG),小鼠禁食不禁水12 h后,用采血针以尾部取血的方式,用罗氏血糖仪进行检测;在STZ注射后1周和试验结束前1周时进行口服糖耐量实验(oral glucose tolerance test,OGTT):小鼠禁食不禁水12 h后,检测0 min时的初始血糖,然后按照2 g/kg(bw)的用量灌胃30%葡萄糖溶液,分别在30、60和120 min后检测血糖值。
1.6 生化分析
全血取出后分成2份,一部分全血直接用于测定糖化血红蛋白(hemoglobin A1c,HbA1c),另一部分3 000 r/min离心15 min离心后吸取上层血清保存在-80 ℃备用,后续用ELISA试剂盒对胰岛素、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)和低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)等指标进行定量测定。
1.7 肝脏匀浆中炎症因子和抗氧化指标的测定
称取一定量肝脏组织,按1∶9 (质量比)加入生理盐水进行组织研磨,3 000 r/min离心10 min,取上清,采用ELISA试剂盒测定肝脏匀浆中肿瘤坏死因子(tumornecrosis factor-α,TNF-α)和白介素-1β(interleukin-1β,IL-1β)水平,按照试剂盒说明书的方法检测肝脏匀浆中丙二醛(malondialdehyde,MDA)和总蛋白的水平。
1.8 组织病理学分析
用4%多聚甲醛溶液固定胰腺、肝脏组织,用石蜡包埋,然后用苏木精-伊红染色。在物镜(×40)下,分别拍摄肝脏和胰腺具有代表性的显微照片并进行病理学分析。
1.9 短链脂肪酸(short-chain fatty acids,SCFAs)的测定
采用气质联用仪(GC-MS)对粪便中乙酸、丙酸、丁酸等短链脂肪酸进行分析,小鼠粪便中短链脂肪酸的萃取和测定参考文献稍作修改[11]:取50 mg粪便样品于饱和NaCl溶液浸泡打碎至无明显块状物;加入20 μL H2SO4溶液酸化;加入1 000 μL乙醚旋涡萃取;13 000×g离心15 min,转移上清液至装有0.25 g无水Na2SO4的EP管中,再以同样的条件离心取上层乙醚相,加入到气相样品瓶中,于GC-MS仪器上测定SCFAs的含量。
1.10 肠道菌群的测定
根据前人的测定方法检测小鼠粪便样品中的肠道菌群[12]。按照Fast DNA Spin试剂盒的说明书提取小鼠粪便中细菌的基因组,对细菌16S rDNA的V4区进行PCR扩增,扩增产物进行1.2%琼脂糖凝胶电泳,电压 120 V、30 min,采用凝胶成像仪拍照并记录电泳结果、按照GeneClean Turbo试剂盒的说明书进行V4区PCR产物的胶回收与定量检测,按等质量浓度原则混样,构建文库并用MiSeq测序仪上机测序。
1.11 统计分析
数据表示为“平均值±标准差”,用GraphPad Prism 5绘图,用SPSS的单因素ANOVA和Duncan’s多量程检验对各组数据的差异进行分析,以不同字母标注表示具有显著差异(P<0.05)。
2 结果与分析
2.1 不同两歧双歧杆菌对T2D小鼠血糖水平和HbA1c的影响
空腹血糖(FBG)是衡量血糖状态的关键性指标,之前也有大量研究表明益生菌具有降低FBG的效果,如L. rhamnosus MTCC-5897[13]和L. casei CCFM0412 [14]都可以改善T2D小鼠的FBG。本实验结果如表1所示,STZ注射1周后,所有组的FBG均与空白组呈现出显著性差异(P <0.05),BB1和H35处理组与模型组表现出显著性差异,其中BB1组预防FBG升高的效果与罗格列酮药物组类似。STZ注射后2~5周,模型组小鼠的FBG远高于空白组(P<0.05),虽然BB13组、H35组在此期间能观察到对FBG水平的降低作用,但随着时间的推移,和模型组FBG的差异逐渐消失,这说明这2株两歧双歧杆菌随着造模时间的延长,已无法阻止高脂饮食和STZ注射造成的机体糖代谢紊乱。相反,与罗格列酮药物组相似,两歧双歧杆菌BB1在STZ注射后第5周仍有较好的降FBG效果,甚至可使小鼠的FBG恢复至正常水平,这表明两歧双歧杆菌BB1具有优于BB13和H35的延缓糖尿病进程的作用,其甚至可发挥与罗格列酮药物相当的降血糖作用。
HbA1c浓度通常可以反映取样前2~3月的平均血糖水平[15]。如图2所示,本研究模型组小鼠的HbA1c明显高于空白组,而BB1组的HbA1c相比模型组有显著降低(P<0.05),效果与药物组类似。前人研究表明,L. rhamnosus CCFM0528喂养糖尿病小鼠后,小鼠的空腹血糖水平和HbA1c浓度显著降低[16],这与我们的研究结果相一致。
为了进一步研究3株两歧双歧杆菌是否能发挥延缓糖尿病发生、改善糖尿病的作用,在实验第11周(STZ注射后1周)和实验第16周(STZ注射后5周)进行了口服糖耐量测定。如图3-a和图3-b所示,模型组、药物组、灌菌组小鼠在11周时血糖耐受性受损;模型组血糖曲线下面积(glucose undercurve,AUCglucose)明显高于空白组(P<0.05)。与BB13组不同的是,BB1组和H35组的AUC葡萄糖值显著低于模型组(P<0.05),这表明这2株两歧双歧杆菌均能预防小鼠糖耐量受损的情况。由图3-c可知,STZ注射5周后,模型组在30 min时血糖水平急剧上升,小鼠口服药物和两歧双歧杆菌可明显抑制口服葡萄糖后血糖水平的升高。与模型组相比,罗格列酮药物组、BB1、BB13和H35组的AUC葡萄糖值分别降低了44.48%、33.56%、14.75%和13.13%,数据显示,罗格列酮、BB1、BB13和H35处理的小鼠比未治疗的糖尿病小鼠均有更好的葡萄糖代谢能力,其中BB1灌菌组的效果与罗格列酮药物组相似,显著改善了由STZ和高脂饮食诱导的糖耐量受损情况(P<0.05)。
表1 STZ注射后小鼠空腹血糖 单位:mmol/L
Table 1 Fasting blood glucose in mice after STZ injection
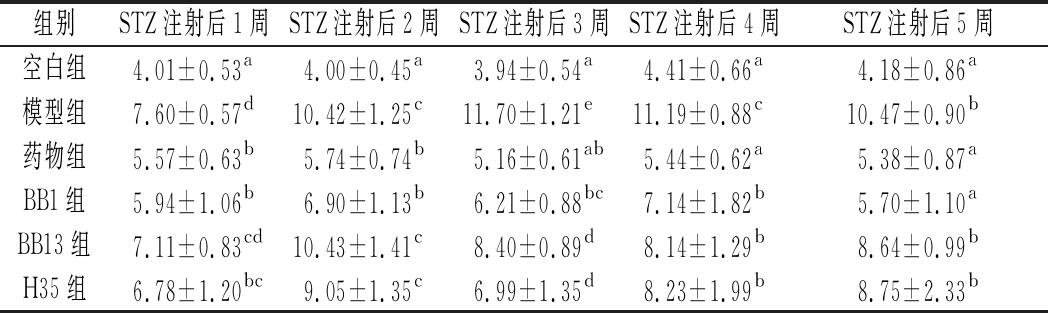
组别STZ注射后1周STZ注射后2周STZ注射后3周STZ注射后4周STZ注射后5周空白组4.01±0.53a4.00±0.45a3.94±0.54a4.41±0.66a4.18±0.86a模型组7.60±0.57d10.42±1.25c11.70±1.21e11.19±0.88c10.47±0.90b药物组5.57±0.63b5.74±0.74b5.16±0.61ab5.44±0.62a5.38±0.87aBB1组5.94±1.06b6.90±1.13b6.21±0.88bc7.14±1.82b5.70±1.10aBB13组7.11±0.83cd10.43±1.41c8.40±0.89d8.14±1.29b8.64±0.99bH35组6.78±1.20bc9.05±1.35c6.99±1.35d8.23±1.99b8.75±2.33b
注:同行肩标的不同小写字母表示不同组之间差异显著(P < 0.05)。下同。
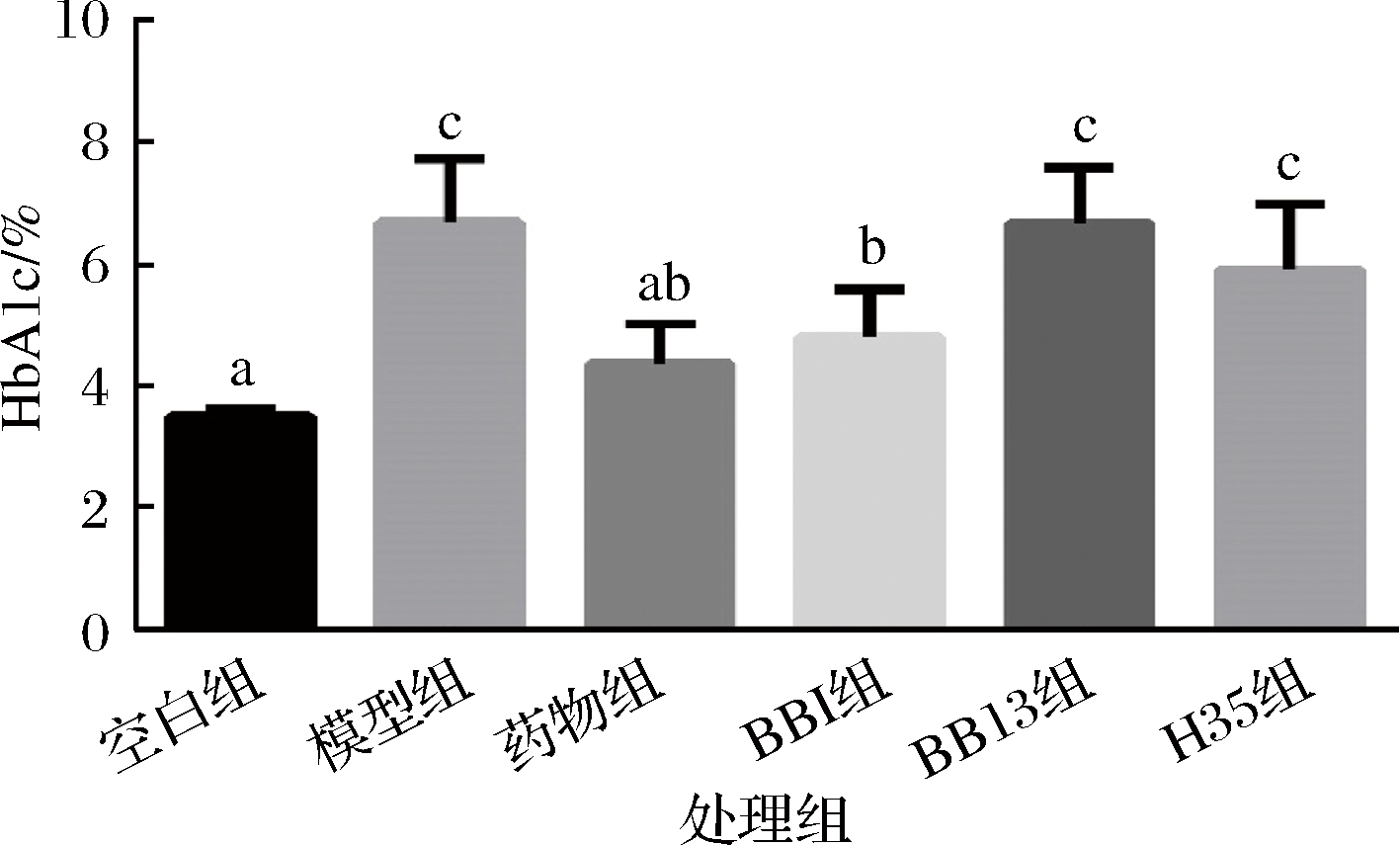
图2 不同两歧双歧杆菌对T2D小鼠HbA1c的影响
Fig.2 Effect of different Bifidobacterium bifidum on HbA1c
in T2D mice
注:图中不同小写字母表示不同组之间差异显著(P<0.05)。下同。
2.2 不同两歧双歧杆菌对T2D小鼠胰岛素抵抗的影响
据报道,L.rhamnosus GG有着较好的降血糖效果,且能够显著改善胰岛素抵抗情况[17]。为了检验BB1、BB13和H35治疗是否也能够显著改善糖尿病小鼠的胰岛素抵抗情况,在实验结束前,我们测定了空腹胰岛素水平,并计算了胰岛素抵抗指数(homeostatic model assessment of insulin resistance,HOMA-IR)值。如表2所示,与空白组相比,模型组、药物组和BB13灌菌组胰岛素含量显著上升(P<0.05),BB1和H35灌菌组在一定程度上降低了糖尿病小鼠的胰岛素水平,从胰岛素抵抗指数来看,3株两歧双歧杆菌中只有BB1可显著改善糖尿病小鼠的胰岛素抵抗(P<0.05),其效果与药物组相当。
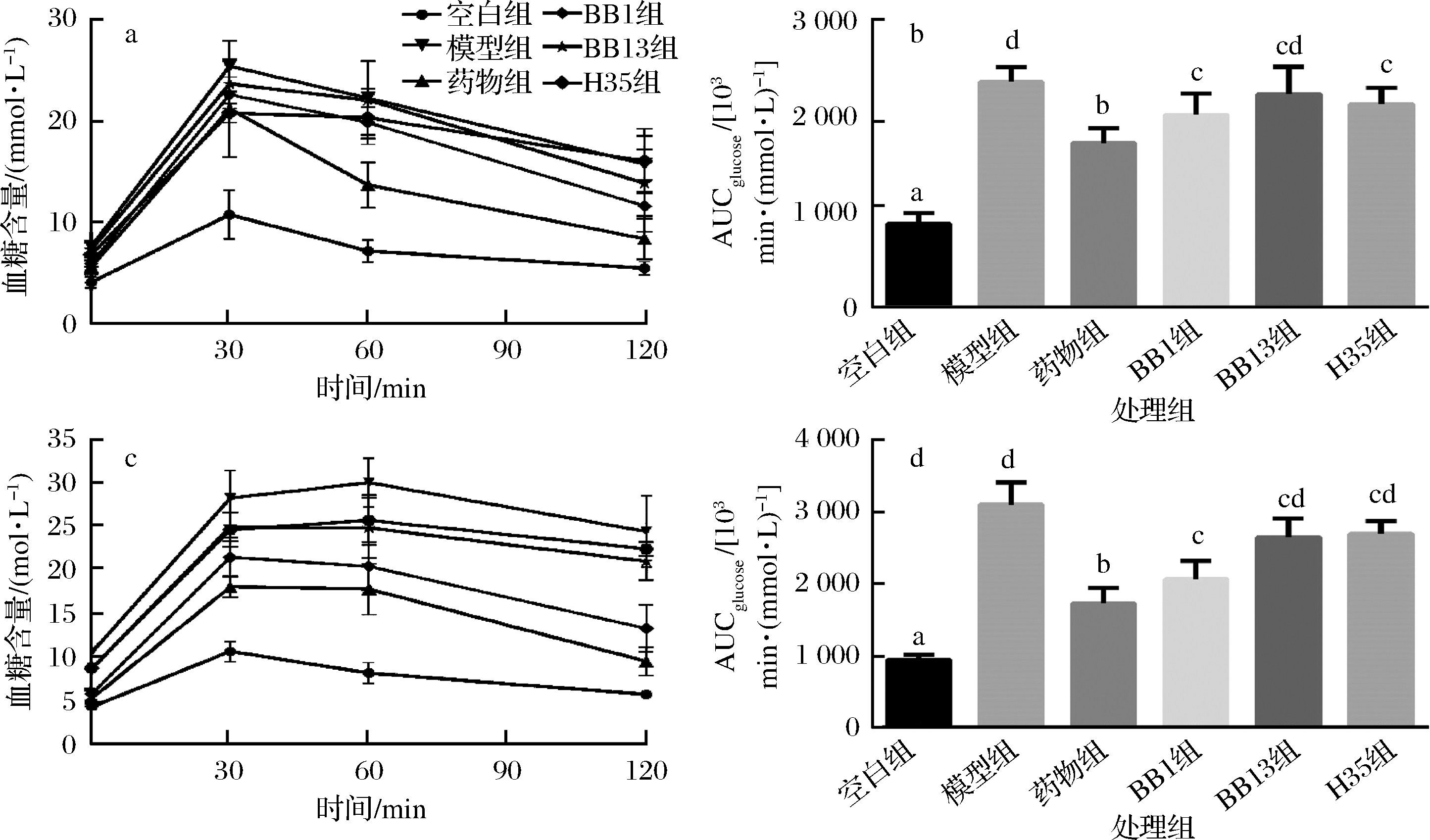
a-STZ注射后1周小鼠OGTT血糖变化;b-STZ注射后1周小鼠OGTT曲线下面积;c- STZ注射后5周小鼠OGTT血糖变化;d- STZ注射后5周小鼠OGTT曲线下面积
图3 不同两歧双歧杆菌对T2D小鼠糖耐量的影响
Fig.3 Effect of different Bifidobacterium bifidum on glucose tolerance in T2D mice
表2 不同两歧双歧杆菌对T2D小鼠胰岛素抵抗的影响
Table 2 Effect of different Bifidobacterium bifidum oninsulin resistance in mice

组别胰岛素含量/(mIU·L-1)胰岛素抵抗指数空白组9.17±0.75a1.65±0.50a模型组11.81±0.95b5.18±0.34b药物组11.66±2.15b2.82±0.42aBB1组11.11±2.23ab2.74±0.88aBB13组11.66±2.17b4.53±1.04bH35组10.91±1.81ab4.26±1.29b
2.3 不同两歧双歧杆菌对T2D小鼠血脂的影响
血脂异常是 Ⅱ 型糖尿病的一个常见特征,也是 Ⅱ 型糖尿病并发症发生的主要原因。血清TG、TC、HDL-C和LDL-C这4个指标通常用来诠释血脂状态。与空白组小鼠相比,模型组小鼠具有明显较高的TC、LDL-C水平以及较低的HDL-C水平(P<0.05),这些结果表明糖尿病小鼠的体内血脂代谢也出现异常。本研究中的药物未发挥改善血脂代谢异常的作用,而两歧双歧杆菌处理组主要通过恢复HDL-C水平来发挥相应的作用。本文研究结果表明,两歧双歧杆菌并非对所有的血脂指标都具有调节作用,并且不同两歧双歧杆菌对血脂代谢发挥作用的能力也不尽相同。
表3 不同两歧双歧杆菌对T2D小鼠血脂状态的影响 单位:mmol/L
Table 3 Effects of different Bifidobacterium bifidumon lipid status in T2D mice

组别TCTGHDL-CLDL-C空白组2.31±0.15a0.92±0.13ab4.61±0.58d0.58±0.16a模型组3.69±0.51b0.73±0.12a2.54±0.52a1.44±0.31b药物组3.26±0.21b0.79±0.18ab3.04±1.02b1.43±0.45bBB1组3.24±0.36b1.00±0.22b3.49±0.75bc1.26±0.33bBB13组3.55±0.25b0.93±0.17ab4.01±0.60d1.64±0.47bH35组3.25±0.58b0.76±0.18ab3.49±0.43bc1.51±0.39b
2.4 不同两歧双歧杆菌对T2D小鼠氧化应激的影响
T2D的诱因有多种假说,其一就是氧化应激假说。氧化应激主要由体内自由基大量增加,同时机体的抗氧化能力受损导致。MDA是脂质过氧化反应的终产物[18-19];由图4可知,模型组小鼠的MDA明显高于正常组(P<0.05),表明模型组小鼠体内出现一定程度的氧化损伤,而服用罗格列酮药物后,氧化损伤出现显著的改善和恢复。采用BB1和H35处理糖尿病小鼠后, MDA水平明显降低(P < 0.05)。从以上结果可以发现,BB1和H35这2株两歧双歧杆菌均可以在一定程度上发挥抗氧化作用。

图4 不同两歧双歧杆菌对T2D小鼠肝脏MDA的影响
Fig.4 Effect of different Bifidobacterium bifidum on liver MDA in T2D mice
2.5 不同两歧双歧杆菌对T2D小鼠肝脏炎症的影响
T2D伴有一种持续性的慢性低度炎症,无论是在糖尿病发展的初期还是在糖尿病后期导致的并发症中,炎症反应都发挥重要作用,通常表现为IL-1β、TNF-α等细胞因子水平增高[20]。如表4所示,模型组小鼠肝脏匀浆中IL-1β和TNF-α的水平明显高于空白组(P<0.05),口服BB1显著降低了这3种细胞因子的水平(P<0.05),效果优于药物组,含量接近于空白组。这些结果表明,3株两歧双岐杆菌只有BB1才能显著改善糖尿病模型小鼠的炎症反应。
表4 不同两歧双歧杆菌对T2D小鼠肝脏炎症水平的影响 单位:pg/mg蛋白质
Table 4 Effect of different Bifidobacterium bifidum a on liver inflammation in T2D mice

组别IL-1βTNF-α空白组135.63±23.37a140.60±12.15a模型组209.85±22.59c240.20±27.90c药物组170.63±48.42ab199.61±36.42bBB1组148.61±27.05a166.84±21.99aBB13组203.72±31.08bc226.48±40.07bcH35组206.33±34.06bc233.83±34.59bc
2.6 不同两歧双歧杆菌对T2D小鼠组织损伤的影响
T2D的主要指标,除了胰岛素抵抗外,还包括由于长期胰岛素抵抗而导致的胰岛损伤[21]。因此,我们通过HE染色观察BB1、BB13和H35对胰岛形态的影响。如图5所示,与正常组相比,模型组小鼠在胰腺形态和胰岛数量发生了明显的变化,而用BB1、BB13和H35处理后,小鼠胰腺细胞受损情况得到了明显的改善,并且BB1改善受损胰岛细胞的能力要强于BB13和H35,表现出明显的菌株差异性。由图6可知,模型组小鼠的肝脏出现大量的脂肪空泡变性,而BB1、BB13和H35菌处理组明显改善了小鼠肝脏的病变情况,其中BB1效果最佳,值得一提的是,罗格列酮药物组呈现出比模型组更严重的肝脏病变情况,这表明虽然药物组具有较好的降血糖效果,但是长期服用药物会对小鼠肝脏产生比较严重的损伤。
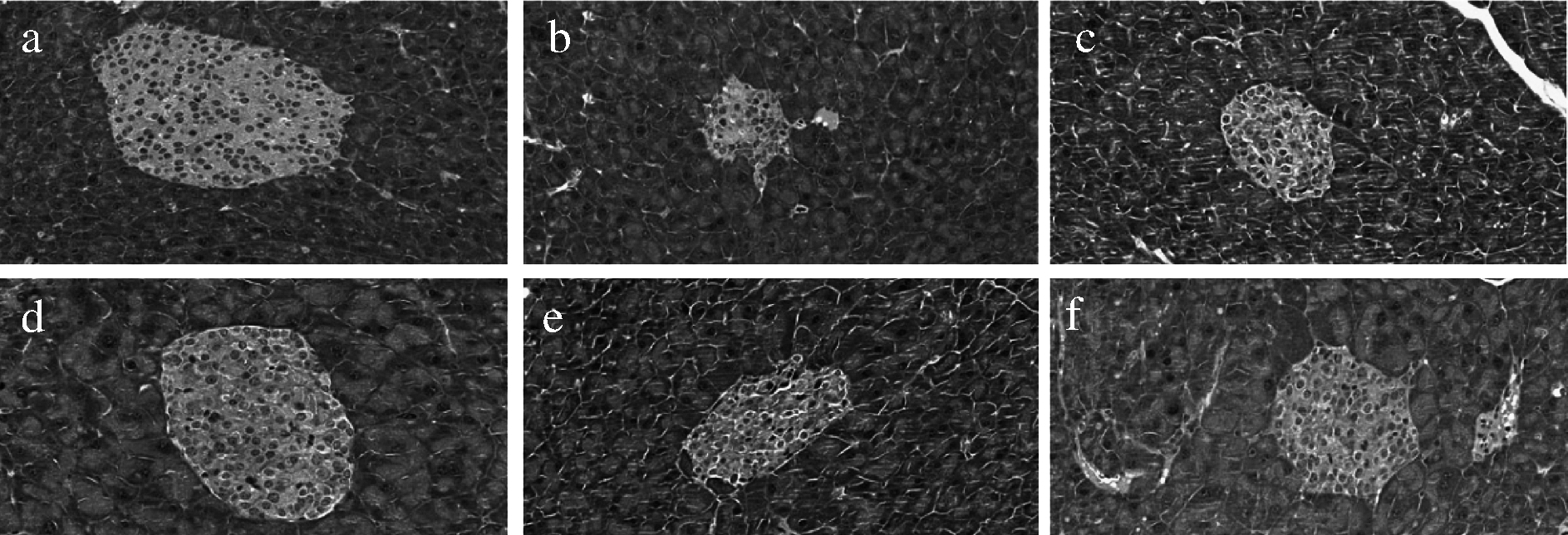
a-空白组;b-模型组;c-药物组;d-BB1组;e-BB13组;f-H35组
图5 不同两歧双歧杆菌对T2D小鼠胰岛形态的影响
Fig.5 Effect of different Bifidobacterium bifidum on the islet morphology in T2D mice
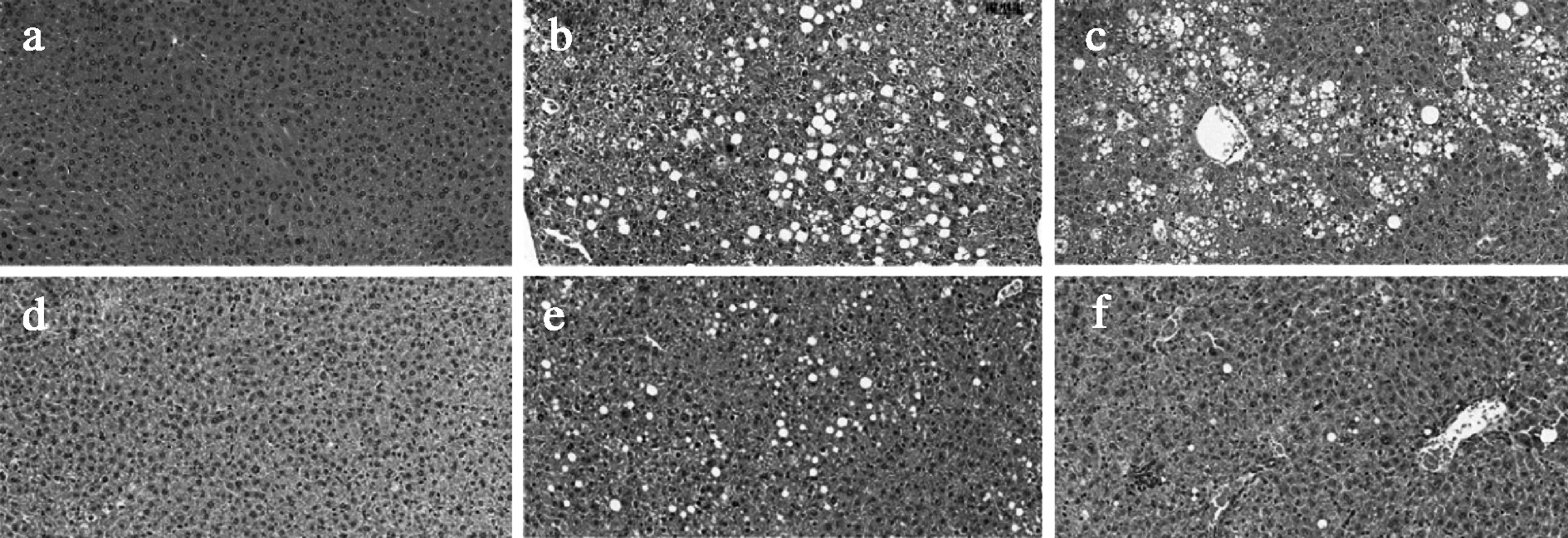
a-空白组;b-模型组;c-药物组;d-BB1组;e-BB13组;f-H35组
图6 不同两歧双歧杆菌对T2D小鼠肝脏形态的影响
Fig.6 Effect of different Bifidobacterium bifidum on the liver morphology in T2D mice
2.7 不同两歧双歧杆菌对T2D小鼠短链脂肪酸的影响
肠道内的短链脂肪酸(SCFAs),主要由未消化的淀粉经过厌氧微生物发酵产生[22]。肠道内的主要短链脂肪酸包括乙酸、丙酸和丁酸。研究表明,短链脂肪酸可以促进肠上皮细胞增殖,维持肠道屏障的完整性[23];可以激活肝脏和胰腺上的受体改善糖脂代谢,缓解胰岛素抵抗[24];可以通过结合游离脂肪酸受体2(recombinant free fatty acid receptor 2,FFAR2)降低疾病的炎症反应[25]。如表5所示,本研究中模型组小鼠几种短链脂肪酸的含量都低于正常组小鼠,而3株两歧双歧杆菌中只有BB1对乙酸、丙酸和丁酸水平具有明显的恢复作用(P<0.05)。据报道,丁酸盐具有抗炎、抗氧化的作用[26],这些结果表明,BB1可能通过增加短链脂肪酸水平,缓解了炎症状态,进而缓解了胰岛素抵抗的情况。
2.8 不同两歧双歧杆菌对T2D小鼠肠道菌群的影响
Chao1指数、Observed species指数通常用来表示样本中含有的物种数目,值越大,表示物种的丰富度越高。如图7所示,高脂饮食和STZ造模后,与空白组相比,模型组小鼠粪便菌群α多样性未发生明显变化,有趣的是,药物组对小鼠肠道菌群的多样性也并无影响,而两歧双歧杆菌灌胃处理后,均提高了粪便菌群物种丰富度,其中以BB1灌菌组效果最明显(P<0.05)。主坐标分析(prinapal co-ordinates analysis,PCoA)结果显示,高脂饮食和STZ使得糖尿病小鼠的肠道微生物组成发生了明显的改变,两歧双歧杆菌处理后,小鼠的肠道菌群结构均出现不同程度的改善。药物组虽然未能改善肠道菌群的多样性,但药物组小鼠的肠道菌群β多样性与空白组最为相近。
表5 不同两歧双歧杆菌对T2D小鼠粪便SCFAs的影响 单位:pmol/mg
Table 5 Effect of different Bifidobacterium bifidum onfecal SCFAs in T2D mice
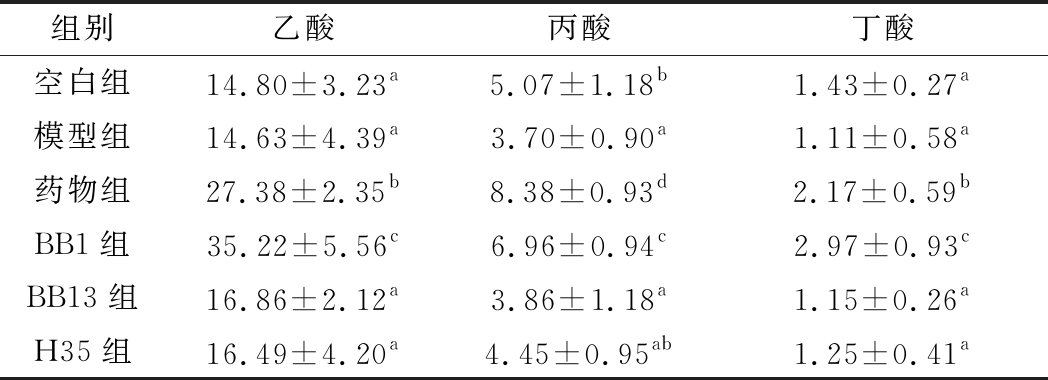
组别乙酸丙酸丁酸空白组14.80±3.23a5.07±1.18b1.43±0.27a模型组14.63±4.39a3.70±0.90a1.11±0.58a药物组27.38±2.35b8.38±0.93d2.17±0.59bBB1组35.22±5.56c6.96±0.94c2.97±0.93cBB13组16.86±2.12a3.86±1.18a1.15±0.26aH35组16.49±4.20a4.45±0.95ab1.25±0.41a

a-chao1指数;b-observed species;c-PCA图
图7 不同两歧双歧杆菌对小鼠肠道菌群多样性的影响
Fig.7 Effect of different Bifidobacterium bifidum on intestinal flora diversity in T2D mice
小鼠的肠道微生物主要由4个门组成,包括厚壁菌门、拟杆菌门、变形菌门和放线菌门。由图8可知,与空白组相比,模型组小鼠肠道微生物组成发生了显著变化,在门水平上,模型组小鼠肠道微生物中厚壁菌门丰度增加,拟杆菌门丰度下降,且厚壁菌门和拟杆菌门的比值显著高于空白组,PASCALE等研究表明,厚壁菌门和拟杆菌门比值的上升与低度炎症有关[27],我们也在糖尿病小鼠的肝脏中发现IL-1β和TNF-α水平上升,这和前人的研究结果是一致的。BB1、H35菌处理后,缓解了这两种门的失调,厚壁菌门的丰度降低,拟杆菌门丰度升高,两者比值下调,尤其是BB1菌株组,显著改善了糖尿病小鼠肠道菌群失调的现象,这些差异与其降低血糖、改善糖尿病的表型相一致。进一步对肠道菌群深入分析发现(图9),相比于空白组小鼠,模型组未处理的糖尿病小鼠肠道菌群中Bacteroidales、Bacteroidales S24-7、Bifidob-acterium显著减少(P<0.05),罗格列酮和两歧双歧杆菌灌胃处理后,均在不同程度上缓解了Bacteroidales、Bacteroidales S24-7的变化,其中药物组和BB1灌菌组缓解效果更明显。3株两歧双歧杆菌杆菌均显著提高了Bifidobacterium属的水平。之前也有研究报道,Bacteroidales S24-7是肠道内的短链脂肪酸生产者[28],且Bifidobacterium的丰度也与肠道内SCFAs的含量呈正相关[29],由此可以推测,两歧双歧杆菌BB1可能在肠道内有较好的定植能力,这有助于其产生更多SCFAs并且对肠道菌群产生更大的影响,尤其是可以通过提高产短链脂肪酸菌群的丰度进而改善T2D。
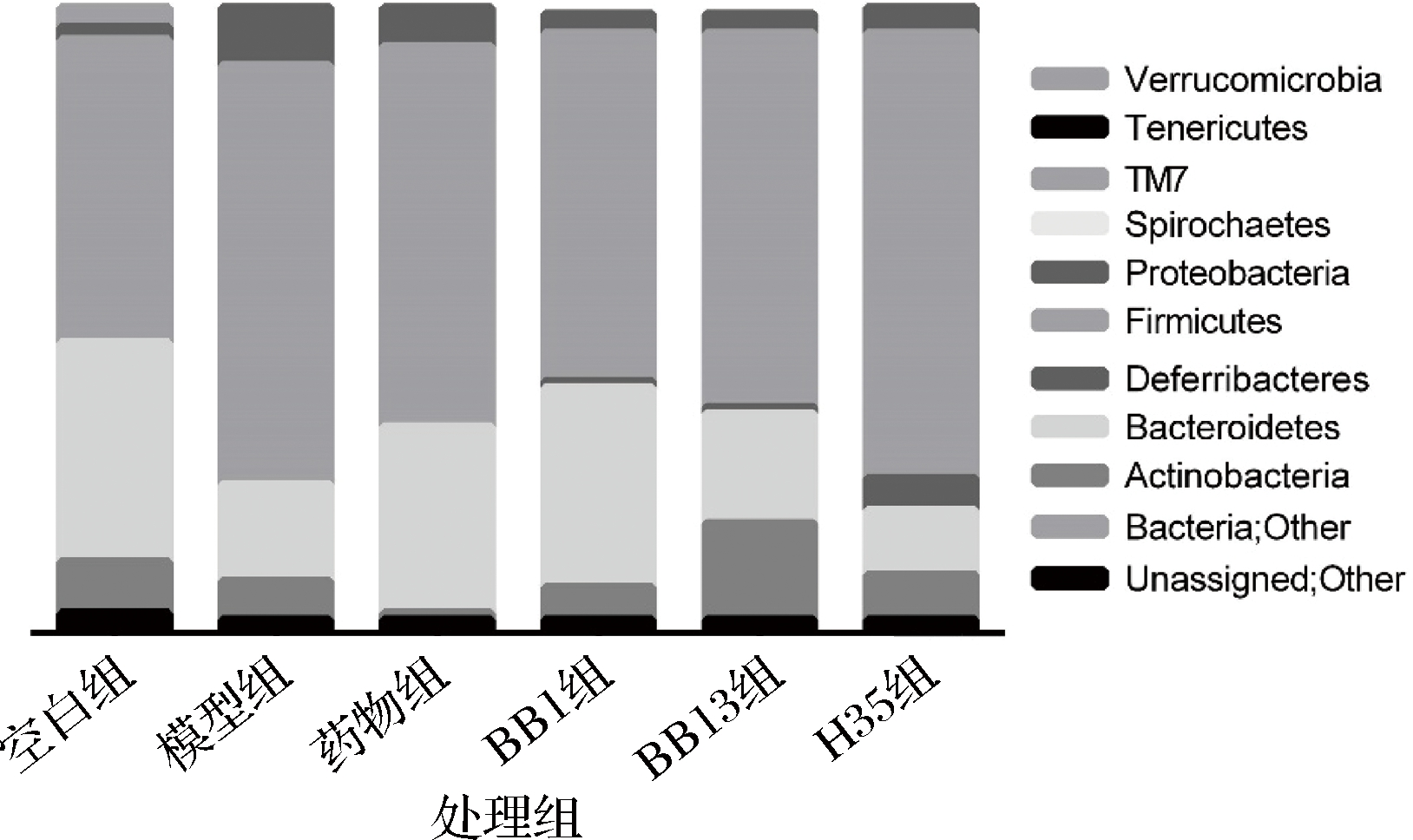
图8 不同双歧杆菌对T2D小鼠肠道菌群门水平的影响
Fig.8 Effect of different Bifidobacterium bifidum on gut
microbial community at the phylum level in T2D mice
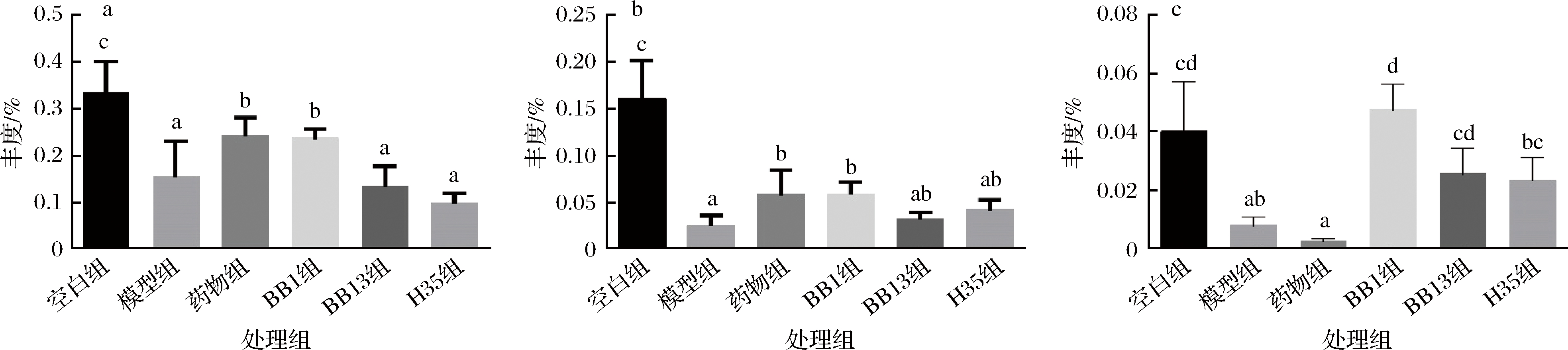
a-Bacteroldales丰度;b-Bacteroidales S24-7丰度;c-Bifidobacterium丰度
图9 不同双歧杆菌对T2D小鼠肠道菌群目和科属水平的影响
Fig.9 Effect of different Bifidobacterium bifidum on gut microbial community at the order and family genus level in T2D mice
3 结论
BB1和H35这2株两歧双歧杆菌均能在一定的程度上发挥预防空腹血糖升高的作用,但随着T2D病情的发展,H35降低空腹血糖的作用逐渐消失,且3株两歧双歧杆菌在缓解空腹血糖、HbA1c、胰岛素抵抗情况、血脂情况(HDL-C)、炎症情况(IL-1β、TNF-α)和调节短链脂肪酸和肠道菌群失调等方面呈现出明显的差异。值得一提的是,与两歧双歧杆菌BB13和H35相比,BB1对高脂饮食和链脲佐菌素诱导的T2D小鼠的血糖不耐受、血脂代谢异常和免疫功能均有明显的改善作用。灌胃两歧双歧杆菌BB1后,小鼠粪便中丁酸含量显著提高,且肠道菌群分析结果显示,BB1显著改善了T2D导致的肠道菌群失调,推测其缓解T2D的可能途径是BB1缓解由高脂饮食和STZ导致的肠道菌群失调,其中增加了产短链脂肪酸(尤其是丁酸)的Bacteroidales S24-7的丰度,短链脂肪酸含量升高,进一步缓解了小鼠体内的低度炎症,从而改善胰岛素抵抗,缓解了T2D。
[1] BACANLI M, DILSIZ S A, BA ARAN N, et al. Effects of phytochemicals against diabetes [J]. Advances in Food and Nutrion Research,2019,89:209.
ARAN N, et al. Effects of phytochemicals against diabetes [J]. Advances in Food and Nutrion Research,2019,89:209.
[2] MUROTOMI K, UMENO A, YASUNAGA M, et al. Oleuropein-rich diet attenuates hyperglycemia and impaired glucose tolerance in type 2 diabetes model mouse[J]. Journal of Agricultural and Food Chemistry, 2015, 63(30):6 715-6 722.
[3] CHO N H, SHAW J E, KARURANGA S, et al. IDF Diabetes Atlas: Global estimates of diabetes prevalence for 2017 and projections for 2045 [J]. Diabetes Research and Clinical Practice, 2018, 138:271-281.
[4] NELL S, SUERBAUM S, JOSENHANS C. The impact of the microbiota on the pathogenesis of IBD: iessons from mouse infection models[J]. Nature Reviews Microbiology, 2010, 8(8):564-577.
[5] XU P, HONG F, WANG J, et al. Microbiome remodeling via the montmorillonite adsorption-excretion axis prevents obesity-related metabolic disorders[J]. EBioMedicine, 2017, 16:251-261.
[6] AHMADI S, NAGPAL R, WANG S, et al. Prebiotics from acorn and sago prevent high-fat-diet-induced insulin resistance via microbiome-gut-brain axis modulation [J]. The Journal of Nutritional Biochemistry, 2019, 67:1-13.
[7] 许应强,董艳. 双歧杆菌的临床作用和应用[J]. 中国现代药物应用, 2007, 1(7):61-62.
[8] SOLEIMANI A, MOJARRAD M Z, BAHMANI F, et al. Probiotic supplementation in diabetic hemodialysis patients has beneficial metabolic effects[J]. Kidney International, 2017, 91(2):435-442.
[9] BAGAROLLI R A, TOBAR N, OLIVEIRA A G, et al. Probiotics modulate gut microbiota and improve insulin sensitivity in DIO mice [J]. The Journal of Nutritional Biochemistry, 2017, 50:16-25.
[10] AMERICAN DIABETES A. Classification and diagnosis of diabetes: standards of medical care in diabetes-2018 [J]. Diabetes Care, 2018, 41(Suppl 1): S13-S27.
[11] VIJAY-KUMAR M, AITKEN J D, CARVALHO F A, et al. Metabolic syndrome and altered gut microbiota in mice lacking Toll-like receptor 5 [J]. Science, 2010, 328(5 975): 228-231.
[12] MAO B, LI D, ZHAO J, et al. Metagenomic insights into the effects of fructo-oligosaccharides (FOS) on the composition of fecal microbiota in mice [J]. Journal of agricultural and food chemistry, 2015, 63(3): 856-863.
[13] BHAT M I, SINGH V K, SHARMA D, et al. Adherence capability and safety assessment of an indigenous probiotic strain Lactobacillus rhamnosus MTCC-5897 [J]. Microbial Pathogenesis, 2019, 130:120-130.
[14] CHEN P, ZHANG Q, DANG H, et al. Antidiabetic effect of Lactobacillus casei CCFM0412 on mice with type 2 diabetes induced by a high-fat diet and streptozotocin [J]. Nutrition, 2014, 30(9): 1 061-1 068.
[15] LIPSKA K J, WARTON E M, HUANG E S, et al. HbA1c and risk of severe hypoglycemia in type 2 diabetes: The diabetes and aging study[J]. Diabetes Care, 2013, 36(11): 3 535-3 542.
[16] CHEN P, ZHANG Q, DANG H, et al. Oral administration of Lactobacillus rhamnosus CCFM0528 improves glucose tolerance and cytokine secretion in high-fat-fed, streptozotocin-induced type 2 diabetic mice [J]. Journal of Functional Foods, 2014, 10:318-326.
[17] KIM S W, PARK K Y, KIM B, et al. Lactobacillus rhamnosus GG improves insulin sensitivity and reduces adiposity in high-fat diet-fed mice through enhancement of adiponectin production [J]. Biochemical and Biophysical Research Communications, 2013, 431(2): 258-263.
[18] CHEN P, ZHANG Q, DANG H, et al. Screening for potential new probiotic based on probiotic properties and α-glucosidase inhibitory activity [J]. Food Control, 2014, 35(1): 65-72.
[19] EJTAHED H S, MOHTADI-NIA J, HOMAYOUNI-RAD A, et al. Probiotic yogurt improves antioxidant status in type 2 diabetic patients [J]. Nutrition, 2012, 28(5): 539-543.
[20] LIM S M, JEONG J J, WOO K H, et al. Lactobacillus sakei OK67 ameliorates high-fat diet-induced blood glucose intolerance and obesity in mice by inhibiting gut microbiota lipopolysaccharide production and inducing colon tight junction protein expression [J]. Nutrition Research, 2016, 36(4): 337-348.
[21] LI C, DING Q, NIE S P, et al. Carrot juice fermented with Lactobacillus plantarum NCU116 ameliorates type 2 diabetes in rats[J]. Joumal of agricuture and Food Chemistry, 2014, 62(49): 11 884-11 891.
[22] GARLAND S H. Short chain fatty acids may elicit an innate immune response from preadipocytes: A potential link between bacterial infection and inflammatory diseases [J]. Med Hypotheses, 2011, 76(6): 881-883.
[23] PENG L, LI Z R, GREEN R S, et al. Butyrate enhances the intestinal barrier by facilitating tight junction assembly via activation of AMP-activated protein kinase in Caco-2 cell monolayers [J]. The Journal of Nutrition, 2009, 139(9): 1 619-1 625.
[24] MANDALIYA D K, SESHADRI S. Short chain fatty acids, pancreatic dysfunction and type 2 diabetes [J]. Pancreatology, 2019, 19(24): 617-622.
[25] MASLOWSKI K M, VIEIRA A T, NG A, et al. Regulation of inflammatory responses by gut microbiota and chemoattractant receptor GPR43 [J]. Nature, 2009, 461(7 268): 1 282-1 286.
[26] VIEIRA E L M, LEONEL A J, SAD A P, et al. Oral administration of sodium butyrate attenuates inflammation and mucosal lesion in experimental acute ulcerative colitis [J]. J Nutr Biochem, 2012, 23(5): 430-436.
[27] PASCALE A, MARCHESI N, GOVONI S, et al. The role of gut microbiota in obesity, diabetes mellitus, and effect of metformin: New insights into old diseases [J]. Current Opinion in Pharmacology, 2019, 49:1-5.
[28] ZHANG B, SUN W, YU N, et al. Anti-diabetic effect of baicalein is associated with the modulation of gut microbiota in streptozotocin and high-fat-diet induced diabetic rats [J]. Journal of Functional Foods, 2018, 46:256-267.
[29] LI C, NIE S P, DING Q, et al. Cholesterol-lowering effect of Lactobacillus plantarum NCU116 in a hyperlipidaemic rat model [J]. Journal of Functional Foods, 2014, 8:340-347.