桑叶作为国家卫生部公布的药食同源且可用于开发保健食品的食品原料,受到了消费者的广泛关注,在东南沿海一带产生了较大的经济效益。现代药理实验证明,桑叶富含多酚类、多糖类、黄酮类、生物碱等活性成分[1],具有降血糖、降血压、抗炎、抗衰老、抑制肿瘤等功效[2],营养价值很高。目前已开发的可食用桑叶产品有:桑叶茶[3]、新鲜桑叶菜(桑枝前端的一芽两叶)、半干型桑叶菜[4]、速冻桑叶菜等。
新鲜桑叶菜因其鲜甜的口感且富含生物活性成分成为深受人们喜欢的桑叶产品,可用于制备各种美味菜肴。桑叶菜叶片薄、多酚含量高,采后极易发生失水萎蔫、黄化及木质化等问题,严重影响其新鲜度和品质[5]。汪泰初等[6]研究发现,离体桑叶在贮藏过程中失水严重,叶绿素含量不断下降,膜损伤程度逐渐升高,活性氧含量升高,最终导致桑叶黄化、衰老。
然而,目前国内外还没有关于桑叶菜保鲜的相关研究报道,桑叶菜采后品质变化规律研究空白。桑叶菜采摘自桑枝最嫩的顶端,于高温季节多产,相比成熟的桑叶更难以保存,而且目前桑叶菜机械采摘不普及,人工采摘效率低,存在采后难以快速商品化处理的实际问题,那么桑叶菜在采后与商品化处理之间的品质会发生怎样变化及其对后期贮藏品质影响如何?这些问题的探索,将有望为桑叶菜采后商品化处理提供理论支撑,促进桑叶菜产业化发展。
自发气调包装是一种通过果蔬自身呼吸作用调节袋内氧气、二氧化碳含量,使其达到相对稳定的保鲜技术。这种技术被广泛运用于水果和蔬菜保鲜。相较于主动气调保鲜技术,这种技术不仅操作简单、成本低,而且能避免二氧化碳含量过高对园艺产品造成的毒性危害[7]。有相关研究已经证实,自发气调保鲜包装可以延长大白菜和卷心菜等叶菜的保鲜期[8-10]。
基于此,本研究拟采用气调包装保鲜技术,在0 ℃贮藏条件下研究采后处理时间间隔对桑叶菜品质的影响规律,并初步确定一种可行有效的桑叶菜采后保鲜方法,以期为桑叶菜采后商品化处理及贮运保鲜提供理论基础。
1 材料与方法
1.1 材料与试剂
桑叶菜(粤桑11号、桑枝顶端的一芽两叶),采自广东省英德市万仔蚕桑专业合作社;气调保鲜袋(主要材质为改性低密度聚乙烯,厚度20 μm,25 ℃条件下氧气透过率为8 259 cm3/(m2·d·0.1 MPa)、水蒸气透过率23.19 g/(m2·d));邻苯二胺(分析纯),国药集团化学试剂有限公司;苯酚(分析纯)、邻苯二酚(分析纯)、乙酰溴(分析纯),Aladin公司;考马斯亮蓝MYM, Biological Technology公司;液氮,佛山市普雷克斯公司。
1.2 仪器与设备
TA-XT plus质构分析仪,英国Stable Micro Systerm公司;Cary Eclipse荧光分光光度计,美国Agilent公司;Checkpoint手持气体分析仪,丹麦PBI-Dansensor公司;UV-2450型紫外/可见光分光光度计,日本Shimaodzu公司;Millipore Elix纯水仪,德国Merck Millipore公司。
1.3 方法
1.3.1 样品处理
将桑叶菜采摘后在室内阴凉处(25 ℃)分别放置1、2、4 h(放置时间从每一批桑叶菜采摘终点时刻开始计算)后,迅速使用气调保鲜袋包装(每袋200 g),相应样品分别记为T1、T2、T4,将样品放入有冰袋的泡沫箱迅速运送至广东省农业科学院蚕业与农产品加工研究所进行冷藏(0 ℃),于第0天和第7天时取样品直接测定相关指标或用液氮磨粉后测定相关指标,考察采后处理时间间隔对桑叶菜品质的影响。
1.3.2 可溶性糖和可溶性蛋白含量测定
可溶性糖含量测定:采用苯酚-硫酸法,参考张媛媛等[11]的方法并加以修改。
可溶性蛋白含量测定:采用考马斯亮蓝法进行测定,参考罗政等[12]的方法并加以修改。
1.3.3 多酚和VC含量测定
VC含量测定:参考王惠惠等[13]的方法并加以修改,利用Cary Elipse荧光分光光度计进行测定。
多酚含量测定:参考孙小静等的方法并加以修改[14],称取0.6 g桑叶菜粉,加入8 mL体积分数70%的乙醇浸提2次,每次2 h,合并提取液,取适量提取液用70%乙醇稀释10倍后,取1 mL稀释液于离心管中,先后加入0.5 mL福林酚溶液、1.5 mL碳酸钠溶液(1 mol/L),反应2 h后于760 nm处测定吸光值,并根据以没食子酸为标准品获得的标准曲线计算总酚含量。
1.3.4 木质素和硬度测定
木质素含量测定:桑叶菜木质素的测定参考HUANG等[15]的方法并加以修改,称取桑叶菜粉0.5 g放入15 mL离心管中,迅速加入10 mL 95%乙醇溶液混合均匀,再放置于沸水中水浴加热30 min。取出冷却至室温后,离心,弃去上清液,沉淀中加入体积分数95%的乙醇,按照上述工艺重复处理3~4次,收集沉淀并干燥。将干燥物溶于1 mL 25%(体积分数)溴化乙酰-冰醋酸溶液中,恒温水浴后加入1 mL、1 mol/L NaOH溶液终止反应,再加入1 mL冰醋酸和0.1 mL、7.5 mol/L盐酸羟胺,并用冰醋酸定容至5 mL,再用冰醋酸稀释100倍得到样品提取液,在280 nm处测定样品提取液吸光值,根据标准曲线计算木质素含量。
硬度测定:参考OMS-OLIU等[16]的方法并加以修改,使用TA-XT质构分析仪,利用A/WEG探头,设置测前速度1 mm/s、测后速度5 mm/s、测试位移1.5 mm,对桑叶菜上的桑枝一位叶和二位叶中间部分进行切割测量硬度。
1.3.5 相对电导率和丙二醛含量测定
相对电导率测定:参考SIKANDAR等[17]的方法并加以修改。用打孔器取20片直径为10 mm的桑叶菜样品0.3 g,加入20 mL超纯水,静置30 min后测其离子强度(L0),再于沸水煮15 min后冷却至室温测其离子强度(L1),相对点到按公式(1)计算:
相对电导率![]()
(1)
丙二醛(malondialdehyde,MDA)含量测定:参考YAO等[18]的方法并加以修改。准确称取0.5 g桑叶菜粉,加入3 mL三氯乙酸,冰浴提取10 min后12 000 r/min离心,取1 mL上清液,加入2.5 mL的硫代巴比妥酸溶液,95 ℃水浴20 min后快速冷却至室温,12 000 r/min离心10 min,取上清液在450、532、600 nm条件下测定吸光值OD450、OD532、OD600,根据公式(2)计算MDA含量。
MDA含量=
(2)
1.3.6 数据处理
所有实验都设置3次平行实验和至少2次重复实验,利用Excel 2013对数据进行整理、OriginPro 8.5.1制图,采用SPSS 20.0数据处理软件对测定的数据进行单因素方差分析(ANOVA),利用Duncan式多重比较对差异显著性进行分析(P<0.05)。
2 结果与分析
2.1 桑叶菜包装冷藏后的外观品质情况
如图1所示,经气调保鲜袋包装并在冷库(0 ℃)中贮藏7 d后,除了轻微的失水萎蔫之外,桑叶菜外观品质良好,植株保持鲜绿色、腐烂率为0,3个处理之间没有显著性差异,说明了自发气调包装技术是一种有效保持桑叶菜采后新鲜度和品质的保鲜技术,在该技术条件下,黄化不是桑叶菜采后贮藏品质劣变的主要问题。另外,随着采后处理时间间隔延长,桑叶菜叶片有轻微的失水,但对其贮藏后的外观品质影响不大。

图1 采后处理时间间隔对桑叶菜低温贮藏7 d后
的外观品质影响
Fig.1 Effect of postharvest treatment interval on
visual appearance of mulberry leaf vegetables after
cold storage for 7 days
2.2 桑叶菜可溶性糖和可溶性蛋白含量的变化
如图2-A所示,第0天时,桑叶菜样品T1的可溶性糖含量与T2没有显著性差异,但明显高于T4(T1:47.00 mg/g,T4:37.67 mg/g),说明采后处理时间间隔越长,可溶性糖消耗越多。贮藏7 d后,所有样品的可溶性糖含量均发生明显的下降,样品T4的可溶性糖含量最低,其含量仅为T1的66.38%,说明采后处理时间间隔延长,不利于桑叶菜采后贮藏中可溶性糖的保留。戴凡炜等[19]报道桑叶菜的可溶性糖含量与其鲜甜度呈极显著正相关关系。可见,可溶性糖是桑叶菜中重要的风味物质,而采后处理时间间隔的延长显著降低了这种风味物质含量,加速了桑叶菜风味的破坏。
如图2-B所示,在第0天时,桑叶菜的可溶性蛋白含量在采后处理时间间隔4 h内没有显著性差异,但贮藏7 d后,T1可溶性蛋白含量明显高于T2和T4(分别高11.34%和12.28%),说明采后处理时间间隔延长不利于桑叶蛋白在贮藏过程中的保留。SUN等[20]对桑叶蛋白提取物进行分析发现其具有很好的抗氧化性,ZHAO等[21]研究发现桑叶蛋白提取物具有抑菌作用,可见,桑叶蛋白具有很高的营养价值,是桑叶菜中重要的营养物质,采后处理时间间隔的延长不利于桑叶蛋白的保留,严重降低了桑叶菜的营养价值。

图2 采后处理时间间隔对桑叶菜可溶性糖(A)和可溶性蛋白(B)含量的影响
Fig.2 Effect of postharvest treatment interval on soluble sugar (A) and soluble protein (B) content of mulberry leaf vegetables
2.3 桑叶菜VC和多酚含量的变化
如图3-A所示,在采后4 h内,桑叶菜的VC含量没有显著性的差异,但包装贮藏7 d后,所有处理组桑叶菜的VC含量都有显著性下降(由1.29~1. 28 mg/g下降至1.02~0.88 mg/g),并且T4的VC含量最低,相比T1减少了约12.86%。
如图3-B所示,桑叶菜样品T1和T2的多酚含量显著高于T4。贮藏7 d后,T1多酚含量显著高于T2和T4(分别高5.46%和18.45%)。多酚具有抗氧化活性,对人体具有抗衰老、抗炎等功效[22]。ZHANG等[23]对白桑、鲁桑、长果桑的桑叶多酚进行分析后发现桑叶抗氧化活性与多酚含量存在显著的正相关关系。LI等[24]报道桑叶多酚和纤维对肠道微生态和抗肥胖具有协同作用。可见,多酚是桑叶菜中重要的营养和功能成分,然而采后处理时间间隔延长不利于这些营养物质的保留,严重降低桑叶菜的营养价值。
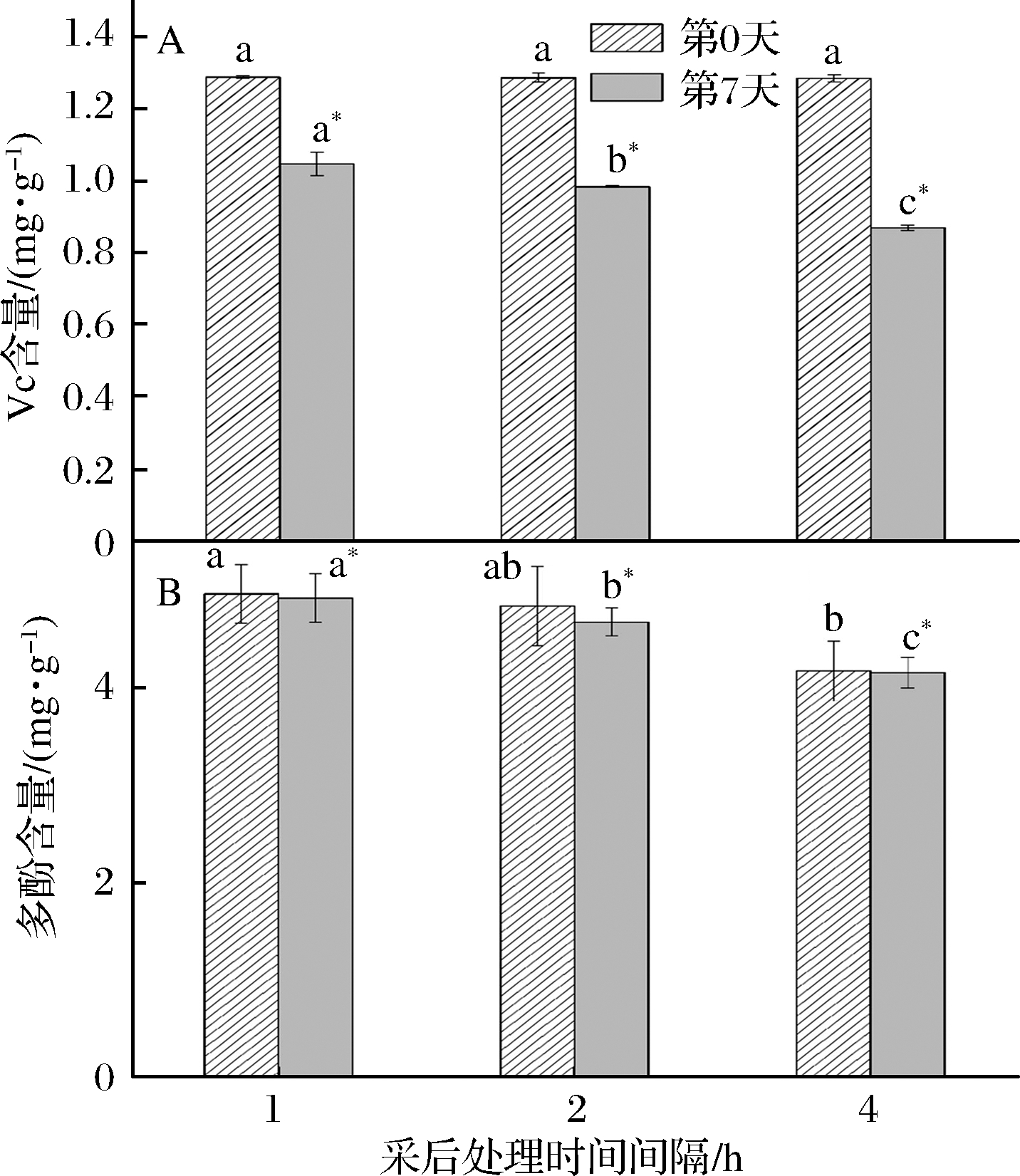
图3 采后处理时间间隔对桑叶菜VC(A)和多酚(B)含量的影响
Fig.3 Effect of postharvest treatment interval on vitamin C (A) and total polyphenol (B) content of mulberry leaf vegetables
2.4 桑叶菜木质素含量和硬度的变化
桑叶菜采后容易发生木质化而影响其食用品质。植物组织木质化是指在细胞的胞间层、初生壁和次生壁上积累木质素[25],木质素积累可以增加桑叶菜细胞壁的机械强度,使其硬度增加,食用品质下降[26]。如图4-A所示,在第0天时,随着采后处理时间间隔的延长,桑叶菜的木质素含量逐渐增加,其中T4的木质素含量相比T1增加了25.19%,说明不适宜的环境条件会诱导桑叶菜采后木质化,使其品质降低。贮藏7 d后,所有样品的木质素含量均进一步增加,T4的木质素含量增加最为严重,其比T1多增加了27.26%,说明包装贮藏对桑叶菜采后木质化的延缓与其包装前品质息息相关,采后处理时间间隔延长会导致桑叶菜木质化加剧,影响其食用品质。
硬度是评价桑叶菜食用品质的直观指标。如图4-B所示,贮藏7 d后,桑叶菜的桑枝部分硬度随着采后处理时间间隔的延长而增加,3个处理组之间具有显著性差异,样品T4的硬度比T1和T2分别高115.86%和23.53%。经相关性分析可知,桑叶菜的硬度与木质素含量呈显著的正相关关系(r=0.926; P<0.05),这与LUO等[27]、SCHAEFR等[28]研究结果一致,说明延缓采后木质化对保持桑叶菜鲜嫩等食用品质至关重要,采后至商品化处理之间时间间隔越长,桑叶菜老化越严重,食用品质劣变越明显。

图4 采后处理时间间隔对桑叶菜木质素含量(A)和第7天硬度(B)的影响
Fig.4 Effect of postharvest treatment interval on lignin content (A) and hardness on day 7 (B) of mulberry leaf vegetables
2.5 桑叶菜细胞膜透性和丙二醛含量的变化
细胞膜透性反映果蔬的衰老程度,细胞膜透性增加,表明植物细胞膜被破坏。丙二醛是表征果蔬细胞膜脂过氧化程度的指标,丙二醛含量越高,细胞膜脂过氧化程度越高[29]。如图5-A所示,第0天时,桑叶菜样品T1和T2的细胞膜透性基本无显著性差异,T4的细胞膜透性明显高于前两者分别高8.03%和5.81%;贮藏7 d后,3个处理组样品的细胞膜透性均显著性增加,相比于T1,T2和T4的细胞膜透性分别增加了10.09%和62.60%,说明采后处理时间间隔延长,不利于后续贮藏保鲜技术对桑叶菜衰老的延缓。
第0天时,桑叶菜样品T2和T4的丙二醛积累显著高于(T2:2.94×10-3 μmol/g;T4:2.89×10-3 μmol/g;T1:1.30×10-3 μmol/g)。贮藏7 d后,所有样品的丙二醛进一步积累,T2与T4的丙二醛含量显著高于T1(图5-B,分别高12.20%和15.40%)。可见,采后处理时间间隔延长会加速桑叶菜的丙二醛积累,从而加速其衰老。
根据相关性分析,丙二醛和与木质素存在显著的正相关关系(r=0.836; P<0.05),相对电导率与木质素存在显著的正相关关系(r=0.923; P<0.05)。贮藏过程中由于时间间隔延长,多酚、可溶性蛋白、可溶性糖和VC等营养成分消耗速度加快,桑叶菜细胞膜受到了更大的环境压力。环境压力会刺激木质素合成[30],而木质素单体需要通过细胞膜从细胞内转移到细胞外进行聚合反应[31],膜脂过氧化会增强膜蛋白转运木质素单体的能力,从而促进木质素合成[32]。可见细胞膜透性和膜脂过氧化在木质化形成过程中发挥了重要作用。
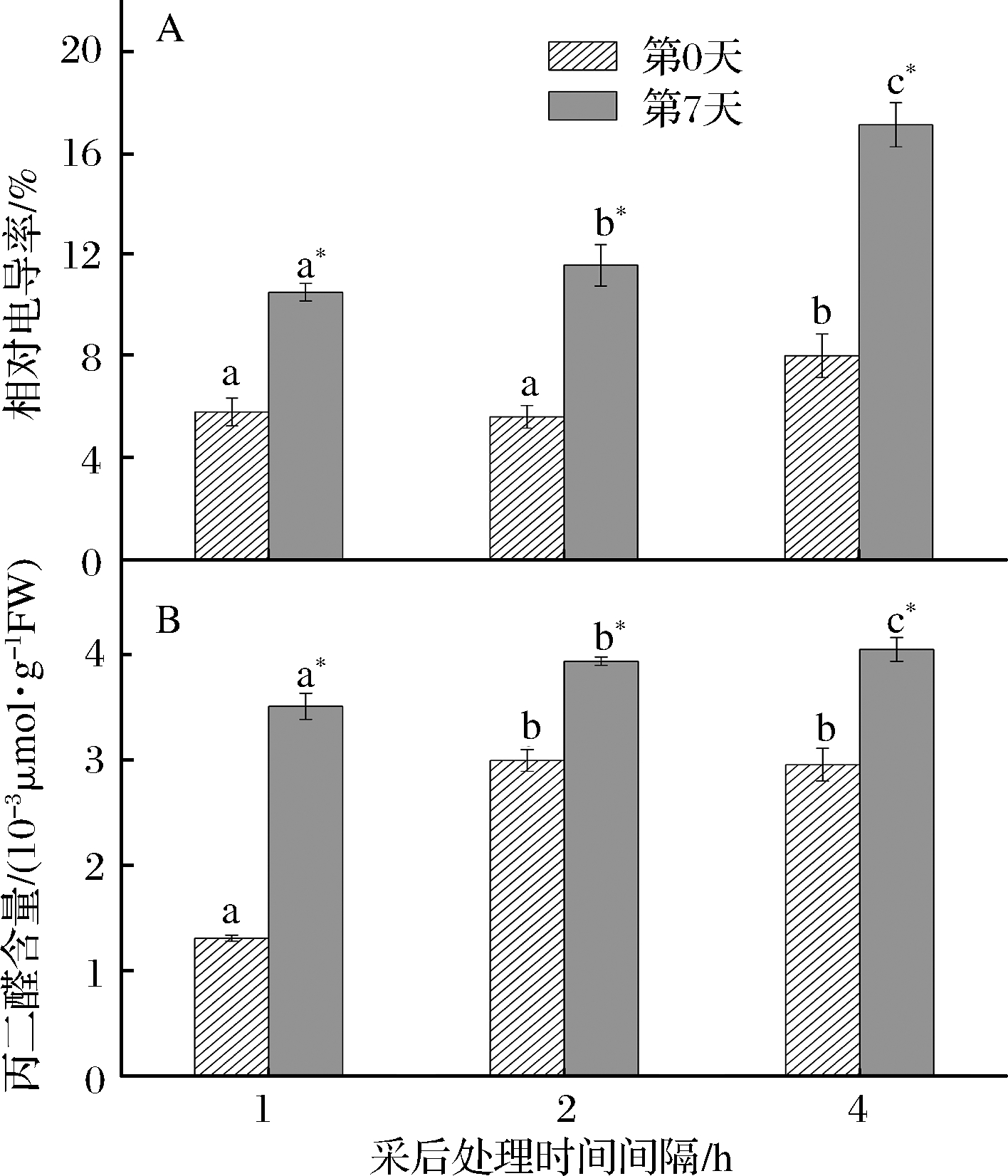
图5 采后处理时间间隔对桑叶菜相对电导率
(A)和丙二醛含量(B)的影响
Fig.5 Effect of postharvest treatment interval on relative conductivity (A) and malondialdehyde content
(B) of mulberry leaf vegetables
3 结论
以新鲜桑叶菜为试材,在气调保鲜包装下,研究了采后处理时间间隔对桑叶菜品质的影响。在该贮藏条件下,不同处理间的桑叶菜外观品质没有显著差异,仍保持鲜绿色,没有明显的腐烂发生。随着采后处理时间间隔的延长,桑叶菜的可溶性糖、可溶性固形物、多酚、VC等营养物质含量降低,木质素含量和硬度逐渐增加,细胞膜透性增加与丙二醛积累加剧。可见,采后至商品化处理时间间隔越长,桑叶菜贮藏保鲜过程中的品质保留越差。桑叶菜采后商品化处理前的品质变化规律的研究,可为其采后商品化处理及贮运保鲜提供理论基础,促进桑叶菜产业化发展。
[1] WEN Peng,HU Tenggen,ROBERT J L,et al.Mulberry:A review of bioactive compounds and advanced processing technology[J].Trends in Food Science & Technology,2019,83(1):138-158.
[2] CAI Shengyu,SUN Wen,FAN Yixin,et al.Effect of mulberry leaf (Folium Mori) on insulin resistance via IRS-1/PI3K/Glut-4 signalling pathway in type 2 diabetes mellitus rats[J].Pharmaceutical Biology,2016,54 (11):2 685-2 691.
[3] 施英,廖森泰,邹宇晓,等.加工工艺对桑叶乌龙茶品质和风味的影响[J].蚕业科学,2015,41(3):525-533.
[4] 谢怀龙,邹宇晓,廖森泰,等.半干型桑叶菜的加工工艺条件优化试验[J].蚕业科学,2018,44(4):573-579.
[5] 孙小静,邹宇晓,廖森泰,等.干燥方式对脱水桑叶品质的影响[J].中国食品学报,2016,16(10):139-146.
[6] 汪泰初,冯纪元,贾鸿英.离体桑叶在贮藏过程中生理变化的研究[J].中国蚕业,2003,24(4):31-32.
[7] YANG Da,LI Dongli,XU Wencai, et al. Design and application of a passive modified atmosphere packaging for maintaining the freshness of Chinese cabbage[J].LWT-Food Science & Technology,2018,94(1):136-141.
[8] HODGES D M,TOIVONEN P M A. Quality of fresh‐cut fruits and vegetables as affected by exposure to abiotic stress[J]. Postharvest Biology and Technology, 2008,48(2):155-162.
[9] HYUN J E, BAE Y M, YOON J H, et al. Preservative e?ectiveness of essential oils in vapor phase combined with modified atmosphere packaging against spoilage bacteria on fresh cabbage[J]. Food Control, 2015, 51(1):307-313.
[10] OLIVEIRAM,ABADIAS M,USALL J et al. Application of modified atmosphere packaging as a safety approach to fresh-cut fruits and vegetables.Trends in Food Science & Technology,2015,46(1),13-26.
[11] 张媛媛,张彬.苯酚-硫酸法与蒽酮-硫酸法测定绿茶茶多糖的比较研究[J].食品科学,2016,37(4):158-163.
[12] 罗政,陈飞平,陈于陇,等.广陈皮原料茶枝柑与其他典型柑橘成分差异分析[J].热带作物学报,2019,40(1):174-179.
[13] 王惠惠,陈于陇,肖更生.高氧气调包装对鲜切菜心品质的影响[J].中国食品学报,2014,14(2):161-170.
[14] 孙小静,刘军,廖森泰,等.不同桑品种新鲜桑叶制作脱水桑叶菜品质的综合评价[J].蚕业科学,2015,41(3):534-541.
[15] HUANG Weina,LIU Hongkai,KANG Yufan.Ethylene-induced changes in lignification and cell wall-degrading enzymes in the roots of mungbean (Vigna radiata) sprouts[J].Plant Physiology and Biochemistry,2013,73(12):412-419.
[16] OMS-OLIU G,SOLIVA-FORTUNY R,MARTIN-BELLOSO O.Modeling changes of headspace gas concentrations to describe the respiration of fresh -cut melon under low or super atmospheric oxygen atmospheres[J].Journal of Food Engineering,2008,85(3):401-409.
[17] SIKANDAR H,HUSAIN A,CHENG Zhihui,et al. Aqueous garlic extract stimulates growth and antioxidant enzymes activity of tomato (Solanum lycopersicum)[J].Scientia Horticulturae,2018,240(10):139-148.
[18] YAO Dongxia,ZHANG Xueyan,ZHAO Xinhua,et al.Transcriptome analysis reveals salt-stress-regulated biological processes and key pathways in roots of cotton (Gossypium hirsutum L)[J].Genomics,2011,98(1):47-55.
[19] 戴凡炜,罗国庆,赵超艺,等.桑树嫩芽营养成分含量及与口感的相关性分析[J].蚕业科学,2018,44(6):968-972.
[20] SUN Chongzhen,WU Wenjia,MA Yurong,et al.Physicochemical, functional properties, and antioxidant activities of protein fractions obtained from mulberry (morus atropurpurea roxb.) leaf[J].International Journal of Food Properties,2017,20(3):S3 311-S3 325.
[21] ZHAO Ming,MA Yan,PAN Yinghong,et al.A hevein-like protein and a class I chitinase with antifungal activity from leaves of the paper mulberry[J].Biomedical Chromatography,2011,25(8):908-912.
[22] KUMAR G,BAOJUN X.Polyphenol-Rich Dry Common Beans (Phaseolus vulgaris L.) and Their Health Benefits[J].International Journal of Molecular Sciences,2017,18(11):2 331-2 356.
[23] ZHANG Yanxin,DU Wei,ZHANG Xuewen,et al. Antioxidant activity and the potential for cholesterol‐lowering of phenolic extract of Morus alba, Morus multicaulis, and Morus laevigata leaves from Yunnan (China)[J].Journal of Food Biochemistry,2016,41(1):e12 339
[24] LI Qian,LIU Fan,LIU Jun,et al.Mulberry leaf polyphenols and fiber induce synergistic antiobesity and display a modulation effect on gut microbiota and metabolites[J].Nutrients,2019,11(5):1 017-1 035.
[25] 付伟,廖祥儒,王俊峰,等.植物体内的木质素[J].生物学通报,2004,39(2):12-14.
[26] MAURA C C,KIMBERLY T,QI H,et al.Self-assembly of the plant cell wall requires an extensin scaffold[J].Proceedings of the National Academy of Sciences,2008,105(6):2 226-2 231.
[27] LUO Zisheng,XU Xiaoling,YAN Bifang.Accumulation of lignin and involvement of enzymes in bamboo shoot during storage[J].European Food Research and Technology,2008,226(4):635-640.
[28] SCHAFER J,WAGNER S,TRIWEILER B,et al.Characterization of cell wall components and their modifications during postharvest storage of Asparagus officinalis L.storage-related changes in dietary fiber composition[J].Journal of Agricultural and Food Chemistry,2016,64(2):478-486.
[29] 王学奎.植物生理生化原理和技术[M].北京:高等教育出版社,2006:280.
[30] MOURA J C M S,BONINE C A V,DEOLIVEIRA F V J,et al. Abiotic and biotic stresses and changes in lignin content and composition in plants[J]. J Integr Plant Biol,2010,52:360-376.
[31] MIAO Yuchen,LIU Changjun.ATP-binding cassette-like transporters are involved in the transport of lignin precursors across plasma and vacuolar membranes[J].PNAS,2010,107(52):22 728-22 733.
[32] LIU Qingquan,ZHENG Li,HE Fei.Transcriptional and physiological analyses identify a regulatory role for hydrogen peroxide in the lignin biosynthesis of copper-stressed rice roots[J].Plant Soil,2015,387(1):323-336.