纤维素是自然界中含量最多的一类碳水化合物,也是最廉价的可再生资源,纤维素主要存在植物细胞壁中[1]。纤维素酶是能催化水解纤维素生成葡萄糖的一类糖苷水解酶,又称纤维素酶系[2]。纤维素酶系根据其功能的差异,主要分为三大类,分别为内切葡聚糖酶(endo-1,4-β-D-glcanohdrolase,EG)、外切葡聚糖酶(cellobiohydrolase,CBH)和β-葡萄糖苷酶(β-D-glucosidase,BG),它们在纤维素的水解过程中协同作用,高效降解纤维素。EG随机水解纤维素非结晶区内部的糖苷键,主要产生纤维糊精和低聚糖。CBH从纤维素链的还原端或非还原端释放纤维二糖。BG水解纤维二糖和寡糖以释放可发酵的葡萄糖[2,3]。纤维素酶广泛应用于生物质乙醇、食品、纺织、饲料等行业,我国有丰富的纤维素资源,开发高效的纤维素酶具有重要的应用价值[4]。
纤维素酶广泛存在于微生物中,多种产纤维素酶活性较高的微生物已被发现和工业化应用[5]。因真菌产纤维素酶系较全,分解纤维素能力较强,国内外对降解纤维素菌研究多集中于真菌,比较典型的有木霉菌属木酶属(Trichoderma)、曲霉属(Aspergillus)和青霉属(Penicillium)等[2-6]。
嗜热纤维梭状芽孢杆菌(Clostridium thermocellum,以下简称嗜热纤维梭菌,俗称为梭热杆菌)是一种嗜热厌氧细菌,分泌大量纤维素酶,是目前自然界中已知的降解纤维素最高效的微生物之一,是利用纤维素生产生物能源和化学品的理想菌株[7-8]。嗜热纤维梭菌中含有催化纤维素降解的纤维小体,它是由若干纤维素酶活性的催化单元与无催化活性的支架蛋白结合形成的复合物,其独特的结构,使得它可以比真菌纤维素酶更紧密地结合到纤维素表面,从而高效降解底物[9-12]。嗜热纤维梭菌产生的纤维素酶耐热性好,但是由于热纤梭菌是一种严格的厌氧菌,培养条件极其苛刻,分泌纤维素酶必须在高度厌氧的条件下进行,且酶产量相对较低,我国目前尚未实现嗜热纤维梭菌纤维素酶的工业化生产,也很少见到有关该菌发酵产酶的工艺优化等基础研究报道。
本文对从美国罗切斯特大学引进的嗜热纤维梭菌进行了发酵工艺优化研究。
1 材料与方法
1.1 菌株
嗜热纤维梭菌(Clostridium thermocellum)ATCC 27405菌株[13]:由美国罗切斯特大学化学工程系J. H. David Wu教授提供。
1.2 培养基
基础培养基(g):KH2PO4 1.5;K2HPO4 2.9;尿素2.1;MgCl2·6H2O 1.0;CaCl2·2H2O 0.15;FeSO4·7H2O 0.002 5;盐酸胱氨酸1.0; Resazurin 2.0mg;纤维二糖5.0;吗啉丙烷磺酸(morpholinopropane sulfonic acid,MOPS) 10.0;酵母提取物 5.0;二水柠檬酸钠3.0。
种子培养基(g/L):纤维二糖10,玉米浆12,柠檬酸三钾盐2,一水柠檬酸1.25,Na2SO4 1,KH2PO4 1,NaHCO3 2.5,NH4Cl 1.5,尿素5,酵母抽提物l,MgCl2·6H2O 50,FeCl2·4H2O 0.1,MgCl2 0.2,一水半胱氨酸盐酸盐1,二盐酸吡哆胺0.02,对氨基苯甲酸0.004,D-生物素0.002,VB12 0.02,VB1 0.002,pH值自然。115 ℃湿热灭菌20 min。
发酵培养基(g/L):纤维二糖10,微晶纤维素10,玉米浆12,柠檬酸三钾盐2,一水柠檬酸1.25,Na2SO4 1,KH2PO4 1,NaHCO3 2.5,NH4Cl 1.5,尿素5,酵母抽提物1,MgCl2·6H2O 50,FeCl2·4H2O 0.1, CaCl2·2H2O 0.2,一水半胱氨酸盐酸盐1,二盐酸吡哆胺0.02,对氨基苯甲酸0.004,D-生物素0.002,VB12 0.02,VB1 0.002,pH值自然。115℃湿热灭菌20min。
1.3 纤维素酶酶活测定
酶活测定(滤纸酶活)参考文献进行[14]。
取50 mg滤纸(剪成1 cm×6 cm的滤纸条),加1 mL pH 4.8的 50 mmol/L柠檬酸缓冲液,加入适当稀释含酶液(发酵上清液)0.5 mL,50℃反应1 h,加入3 mL 3,5-二硝基水杨酸溶液,沸水浴5 min,迅速冷却至室温,加入20 mL去离子水,混合均匀后测定540 nm处的吸光值。空白对照对应加入500 μL柠檬酸缓冲液(50 mmol/L,pH 4.8)。以上酶活均扣除发酵液中的还原糖后计算酶活力,发酵培养基中的残留乳糖通过高效液相色谱测定:Bio-Rad HPX-87P 色谱柱,柱温30 ℃,流动相为5 mmol/L的稀硫酸,检测器为示差检测器。
酶活定义为每分钟水解生成1 μmol葡萄糖的酶量为1个活力单位。
1.4 发酵培养条件优化
1.4.1 菌株活化
采用基础培养基进行菌株活化。将配制好的基础液体培养基煮沸驱氧,而后用定量加样器趁热分装到螺口厌氧试管中,每支10 mL,并插入通氮气的长针头以排除氧气。此时可以清楚地看到培养基内加入的氧化还原指示剂刃天青由蓝到红最后变成无色,说明试管内已成为无氧状态,然后,盖上螺口的丁烯胶塞及螺盖,121℃灭菌20 min后备用。
将嗜热纤维梭菌接种到培养管的培养基中,然后将培养管放入60℃生化培养箱培养60 h。
1.4.2 发酵条件的探索
培养管中活化培养后的菌株接种到装液量60 mL的100 mL厌氧培养瓶中进行下列不同发酵条件的研究。对发酵温度、发酵培养时间、培养基初始pH值分别进行单因素试验,寻找最适条件。
设置不同的发酵温度,分别为30、40、50、55、60 ℃,发酵72 h,发酵结束后测定纤维素酶活。
设置不同的培养时间,分别为24、48、60、72、84、96 h,60℃培养,发酵结束后测定纤维素酶活。
设置不同的培养基初始pH,分别为5.5、6、6.5、7、7.5、8,发酵结束后测定纤维素酶活。
1.5 发酵工艺探索
1.5.1 放大工艺下的纤维素酶发酵法
将活化的菌株按照2%的接种量转接到50 mL发酵培养基,55℃恒温培养24 h,得到一级种子液。
发酵培养基装入5 L发酵罐,装液量3 L,灭菌结束后,向发酵罐通入氮气,除去培养基及罐内氧气。调节培养pH恒定为7,罐温控制为55℃,然后接入一级种子液,停止通气,间歇式搅拌发酵。保持发酵罐内无氧状态,厌氧发酵。
1.5.2 补料分批发酵制备纤维素酶
1.5.2.1 补料时间点的确定
将活化菌株接种到种子培养基中,然后以 2%的接种量接种到发酵培养基中,得到一级种子液,将种子液以5%的接种量接种到装有3 L发酵培养基的5 L发酵罐中,厌氧培养,罐温控制为55℃,调节pH为7,间歇式搅拌。根据菌体生长情况和糖耗情况,分别在发酵开始后的16、20、24 h开始向发酵体系中缓慢添加纤维二糖溶液,流速为6 mL/h,上述纤维二糖溶液质量浓度为200 g/L,比较产酶情况。
1.5.2.2 补料碳源的确定
将活化的菌株接种到种子培养基中,然后以2%的接种量接种到发酵培养基中,得到一级种子液,将种子液以5%的接种量接种到装有3 L发酵培养基的5 L发酵罐中,厌氧培养,罐温控制为55℃,调节pH为7,间歇式搅拌。发酵16~48 h,分别添加纤维二糖、微晶纤维素、木聚糖溶液,流速为6 mL/L,上述碳源溶液质量浓度为200 g/L,发酵至60 h,比较产酶情况。
2 结果与分析
2.1 发酵条件的优化结果
嗜热纤维梭菌是严格厌氧菌,进行发酵条件研究时,保证发酵的无氧条件,厌氧发酵。
不同发酵温度下的研究结果表明,嗜热纤维梭菌在50~60℃的条件下相对酶活较高,可达90%以上,其中55℃时相对酶活力最高(图1)。此温度与报道的该菌的嗜热特征和产纤维素酶的条件相似,因此,利用该菌进行发酵生产纤维素酶的最适温度应为55℃。
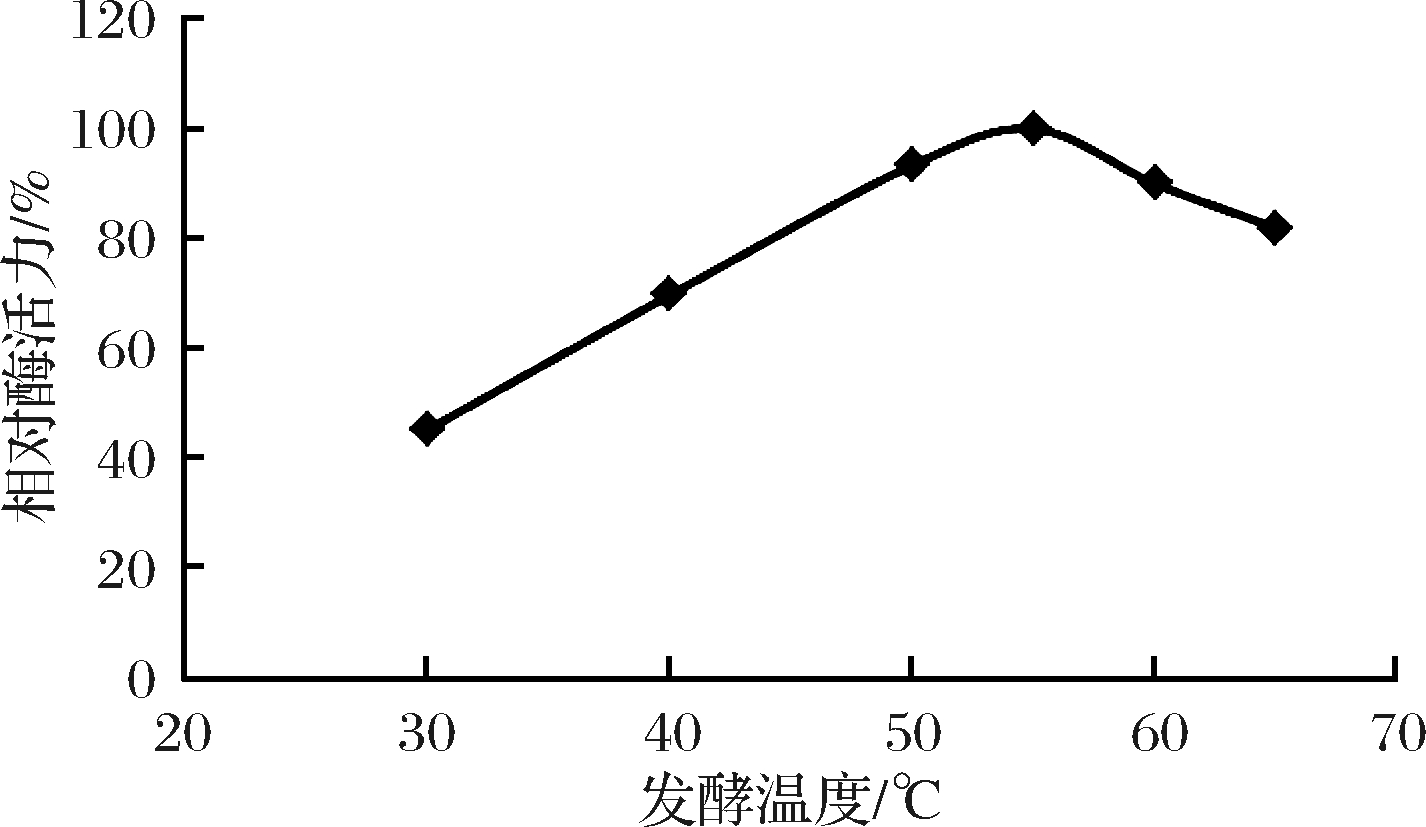
图1 发酵温度对酶活影响
Fig.1 Effect of fermentation temperature on enzymatic activity
不同发酵时间的结果表明,随着发酵时间的增加,酶活力呈上升趋势,发酵至60 h酶活力达到峰值,96 h酶活开始下降(图2)。所以发酵进行60 h后停止,可以大大节约发酵成本。

图2 发酵时间对酶活影响
Fig.2 Effect of fermentation time on enzymatic activity
培养基不同初始pH值的研究结果表明,当培养基初始pH为6.5~8时,相对酶活可达90%以上,最适培养基pH为7(图3)。按照上述优化条件即在55℃,初始培养基pH为7的条件下发酵60 h,测得酶活为5.12 U/mL,为未优化的1.5倍。

图3 培养基初始pH对酶活影响
Fig.3 Effect of initial fermentation pH on enzymatic activity
2.2 发酵工艺的优化
2.2.1 放大工艺下的纤维素酶发酵法
嗜热纤维梭菌是严格厌氧菌,发酵放大工艺研究时维持发酵罐内无氧条件,厌氧发酵。将保藏的菌株接种到种子培养基中,然后,以 2%的接种量接种到发酵培养基中,得到一级种子液,将种子液以5%的接种量接种到装有3 L发酵培养基的5 L发酵罐中,厌氧培养,罐温控制为55℃,调节pH为7,间歇式搅拌。发酵60 h酶活为12.37 U/mL。结果表明,发酵罐的放大培养条件下,嗜热纤维梭菌产纤维素酶酶活显著高于厌氧瓶条件下的酶活。
2.2.2 补料分批发酵制备纤维素酶的最佳时间
首先研究了根据嗜热纤维梭菌生长曲线和糖耗的关系,结果表明菌体在16 h后进入指数生长期,生物量显著增加,此时糖的利用率最大(图4)。根据菌体生长和糖耗情况,确定了补料时间点。分别在发酵开始后的16、20、24 h开始向发酵体系中缓慢添加质量浓度为200 g/L纤维二糖溶液,流速为6 mL/h。比较产酶情况,发现0~12 h糖耗和生长情况较缓慢,进入16 h后,菌体快速生长和糖耗进入快速消耗阶段,所以选择16、20、24 h作为补料点。通过比较了不同补料时间点的产酶情况,发现从16 h的点开始补料,酶活最高,达到16.38 U/mL(表1)。发酵48 h后,菌体到达稳定期,糖耗变缓,因此,确定补料时间为16~48 h。
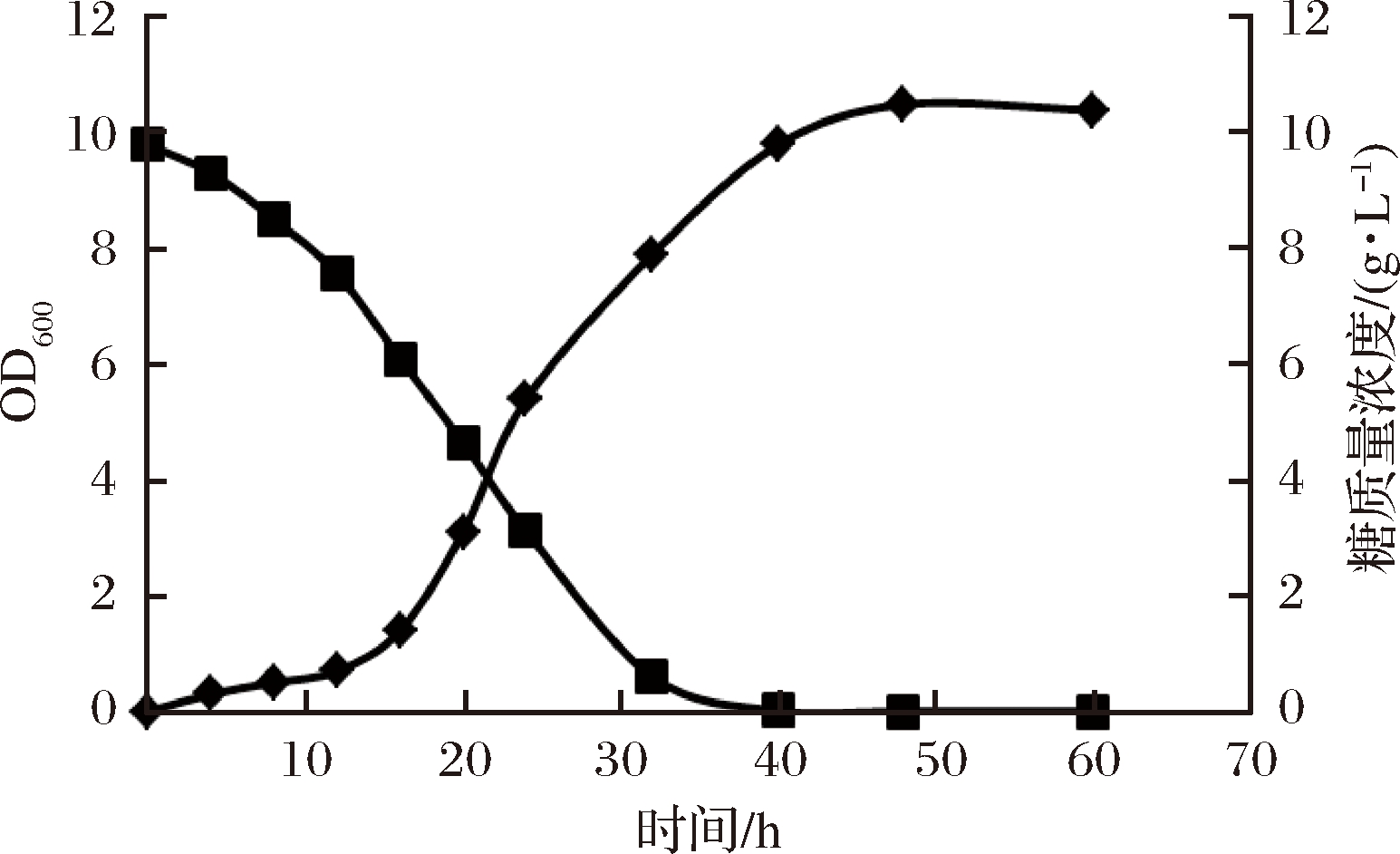
图4 嗜热纤维梭菌生长和糖耗曲线
Fig.4 Curve of growth and glucose use for Clostridium thermocellum
表1 不同补料时间点对酶活影响
Table 1 Effect of different time of carbon addition on enzymatic activity
不同补料时间/h162024发酵结束时的酶活/(U·mL-1)16.3815.5815.21
2.2.3 补料分批发酵制备纤维素酶的最佳碳源
对几种可能提高嗜热纤维梭菌纤维素酶发酵产生酶活的碳源进行了研究。发酵16~48 h,分别添加质量浓度为200 g/L的纤维二糖、微晶纤维素、木聚糖溶液,流速为6 mL/L,发酵60 h后,测定酶活。酶活结果分析比较发现,添加纤维二糖的时候,酶活最高,达16.56U/mL(表2)。因此,纤维二糖为分批补料发酵条件下的最佳补料碳源。
表2 不同碳源对酶活影响
Table 2 Effect of different carbon sources on enzymatic activity
不同碳源纤维二糖微晶纤维素木聚糖发酵结束时的酶活/(U·mL-1)16.5614.4414.11
3 结论
纤维素的分解和利用是当今世界研究热点之一,可以用于生物基能源生产、新型生物工艺和功能产品开发等,但转化效率很低,高效纤维素酶、纤维小体的研究和开发应用是突破瓶颈的关键[15-16]。纤维素酶已在转化利用含纤维素物质生产生物燃料、食品和饲料原料加工、造纸业、纺织业等多个行业进行商业化生产和应用[17-19]。目前纤维素酶研究主要集中于真菌,但由于细菌相对真菌来说生长速率较高,所产纤维素酶的热稳定性和碱稳定性高,用细菌产生纤维素酶的优势正在引起更多研究者的关注[20-22]。
嗜热纤维梭菌是嗜热厌氧细菌,产生纤维小体,纤维素酶具有耐高温、催化活性高等明显的优势[23-25],该菌产纤维素酶的培养条件探索和优化是利用其进行工业化生产的前提。嗜热纤维梭菌是严格厌氧菌,工业化生产条件要求苛刻,要确保发酵罐内无氧条件,厌氧发酵。本文对该菌在发酵厌氧瓶水平上进行了发酵条件探索,发现在55℃,初始培养基pH为7、发酵60 h为最佳条件,此时测得酶活为5.12 U/mL。此外,在放大的发酵罐水平上进行了发酵工艺探索和优化,根据菌体生长情况对分批发酵条件下的补料时间和添加碳源进行了研究,放大和优化后,该菌产纤维素酶的酶活由5.12 U/mL提高到16.56 U/mL,效果极显著。研究结果为进一步规模化的工业化生产降低成本和设计工艺提供了参考依据。
[1] LOUISE G, MONIKA S, JAMIE H D, et al.Plant cell wall deconstruction by Ascomycete fungi[J]. Annual Review of Microbiology, 2013,67:477-498.
[2] PAYNE C M, KNOTT B C, MAYES H B, et al.Fungal cellulases[J]. Chemical Reviews,2015 115(3):1 308-1 448.
[3] TIWARI R,NAIN L, LABROU N E, et al. Bioprospecting of functional cellulases from metagenome for second generation biofuel production: A review [J]. Critical Reviews in Microbiology,2018,44(2):244-257.
[4] KUHAD R C, DESWAL D,SHARMA S, et al. Revisiting cellulase production and redefining current strategies based on major challenges[J]. Renewable & Sustainable Energy Reviews, 2016,55: 249-272.
[5] JUTURU V, WU J C. Microbial cellulases: Engineering, production and applications[J]. Renewable & Sustainable Energy Reviews, 2014,33:188-203.
[6] 邓婷婷,郑春娟,来亚鹏,等.丝状真菌产纤维素酶相关碳代谢阻遏因子的研究进展[J].纤维素科学与技术,2019,27(1):65-71.
[7] DEMAIN A L, NEWCOMB M, WU J H. Cellulase, clostridia, and ethanol[J]. Microbiology and Molecular Biology Review, 2005,69(1):124-154.
[8] 陈林,王禄山,张怀强.热纤梭菌高效降解木质纤维素过程的组学研究进展[J].微生物学报,2014,54(2):121-128.
[9] 李爽,吴宪明,陈红漫,等.嗜热纤维梭菌纤维小体研究进展[J].生物技术通报,2011(5):31-37.
[10] OREN Y,GALIT F,ILYA B, et al. Fine structural variance of family 3 carbohydrate-binding modules as extracellular biomass sensing components of Clostridium thermocellum anti-σI factors[J]. Acta Crystallographica,2014 (2):522-534.
[11] 郝敏,李慧,黄恒猛,等.纤维小体研究进展[J].化学与生物工程,2014,31(2):4-7.
[12] 王金兰,王禄山,刘巍峰,等.降解纤维素的“超分子机器”研究进展[J].生物化学与生物物理进展,2011,38(1):28-35.
[13] NEWCOMB M, MILLEN J, CHEN C Y, et al.Co-transcription of the celC gene cluster in Clostridium thermocellum[J].Applied Microbiology and Biotechnology, 2011,90 (2):625-634.
[14] GHOSE T K. Measurement of cellulase activities[J]. Pure & Applied Chemistry, 2013, 59(2):257-268.
[15] FONTES CARLOS M G A, HARRY J G. Cellulosomes: Highly efficient nanomachines designed to deconstruct plant cell wall complex carbohydrates[J]. Annual Review of Biochemistry,2010,79(1):655-681.
[16] BAYER E A, JEAN-PIERRE B, YUVAL S, et al. THE CELLULOSOMES: Multienzyme machines for degradation of plant cell wall polysaccharides[J]. Annual Review of Microbiology,2004,58:521-554.
[17] PATEL A K, SINGHANIA R R, SIM S J, et al.Thermostable cellulases: Current status and perspectives[J]. Bioresource Technology,2019,279:385-392.
[18] JENG W Y, LIU C I,LU T J. et al.Crystal structures of the C-terminally truncated endoglucanase Cel9Q from Clostridium thermocellum complexed with cellodextrins and Tris[J]. Chembiochem: a European Journal of Chemical Biology,2019,20: 295-307
[19] SHARMA K,FONTES C M,NAJMUDIN S. Molecular organization and protein stability of the Clostridium thermocellum glucuronoxylan endo-β-1,4-xylanase of family 30 glycoside hydrolase in solution[J]. Journal of structural biology,2019,206(3):335-344.
[20] ROZMAN G I,YANIV O,ORTIZ DE O L, et al. Distinctive ligand-binding specificities of tandem PA14 biomass-sensory elements from Clostridium thermocellum and Clostridium clariflavum[J]. Proteins,2019, 87(11):917-930.
[21] DASH S,OLSON D G,JOSHUA C S H, et al. Thermodynamic analysis of the pathway for ethanol production from cellobiose in Clostridium thermocellum[J]. Metabolic engineering,2019,55:161-169.
[22] ICHIKAWA S, OGAWA S, NISHIDA A, et al. Cellulosomes localize on the surface of membrane vesicles from the cellulolytic bacterium Clostridium thermocellum[J]. FEMS microbiology letters,2019,366(12):fnz145.
[23] SATYAKAM D, D G O, SIU H J C, et al. Thermodynamic analysis of the pathway for ethanol production from cellobiose in Clostridium thermocellum[J]. Metabolic Engineering,2019,55:161-169.
[24] 严鸿林.细菌产生的纤维素酶(综述)(续2)[J].国外畜牧学(猪与禽),2018,38(12):23-25.
[25] TORKTAZ I, KARKHANE A A, HEMMAT J. Rational engineering of Cel5E from Clostridium thermocellum to improve its thermal stability and catalytic activity[J]. Applied microbiology and biotechnology,2018,102(19): 8 389-8 402.