嫩度是一种重要的肉质性状,本质上,肉品嫩度决定于内在因素,如结缔组织的数量和溶解度、肌纤维在僵直过程中的肌节缩短以及宰后肌原纤维和肌纤维相关的蛋白分解(钙蛋白酶类及组织蛋白酶类)[1]。超声波作为一种绿色、高效的新型嫩化方法,其机械、空化效应可快速破坏肉品结构,加速肌肉僵直期,从而达到肉品短时促嫩效果[2-4]。过往磷酸盐类常用于肉品嫩度改善和提高保水性能,但过量添加会表现出金属味,并且摄入过多对人体有一定伤害,而碳酸盐的功效归因于其溶解肌纤维蛋白和增强静电排斥作用的能力,NaHCO3作为一种常见的无磷食品添加剂,可提高产品多汁性、整体适口性、减少蒸煮损失和剪切力来提高肉制品的营养质量,有效改善产品嫩度[5-6]。然而,关于NaHCO3联合超声波处理在嫩化肉类中的应用尚未被报道,因此,本研究采用NaHCO3联合超声波处理新鲜羊肉,分析其对羊肉嫩度及肌动球蛋白含量的影响,以期为快速高效地解决肉类嫩度这一首要肉品工业问题提供科学依据。
1 材料与方法
1.1 材料与试剂
羊肉,江苏苏食食品有限公司(南京);预染宽范围标准蛋白,加拿大Fermentas公司;各试剂均为分析纯,南京建成生物工程研究所有限公司;羊肉剔除表面结缔组织和肌膜后,待用。
1.2 仪器与设备
超声波细胞破碎仪,宁波新芝;C-LM-3B型数显式肌肉嫩度仪,东北农业大学工程学院;HH-4数显恒温水浴锅,常州国华;TVT-300XP质构仪,瑞典TexVol;ZQZY-75BS振荡培养箱,北京乾明;UniCenMR台式冷冻离心机,英国Herolab;HI-9025酸度计,意大利Hanna;EVO-LS10扫描电镜,德国ZEISSE Oberkochen;多功能酶标仪,美国Biotek。
1.3 方法
1.3.1 样品的预处理
将大小、薄厚均匀的同批次羊肉切成40 mm×40 mm×20 mm矩形块(50±3)g。随机选取做以下处理:C组,不做任何处理,4 ℃放置1 h;W组,去离子水4 ℃浸泡1 h;W+U组,去离子水浸泡1 h后超声处理5 min(400 W,20 kHz);S组,0.2 mol/L NaHCO3浸泡1 h;S+U组,0.2 mol/L NaHCO3浸泡1 h后超声处理(同上)。其中,去离子水与NaHCO3溶液用量均为500 mL(1 000 mL烧杯,完全淹没样品),各组平行3次试验。
1.3.2 羊肉浸泡前后浸泡液pH、质量、粗蛋白测定
采用手持HI-9025酸度计测定羊肉浸泡前后浸泡液的pH值;鉴于浸泡液质量变化占比微小且不易称量,故以肉块质量变化反推,处理完后,肉块置于烧杯上方(图1)自然滴定表面残余水分30 min,并准确称量浸泡前后肉块质量变化(结果保留小数点后2位);粗蛋白含量测定采用考马斯亮蓝法(结果保留小数点后3位)。
图1 浸泡液质量损失测定装置
Fig.1 Device of mass loss of soaking solution
1.3.3 肉品pH测定
取1.3.1处理后羊肉2 g,剁成肉糜,置于100 mL离心管中(含18 mL去离子水),搅拌均匀后用手持HI-9025酸度计测定pH值,测定3次取均值。
1.3.4 蒸煮损失的测定
根据YANG等[7]方法并略作修改,肉块蒸煮前擦拭肉块表面水分后称重,记为m1。数显温度计插入肉块中央(顺肌纤维方向),置于7号自封袋内并封口,85 ℃恒温水浴加热至中心温度75 ℃后立即取出,流水冷却至室温25 ℃,擦拭表面水分后称重,记为m2。由公式(1)计算蒸煮损失率:
蒸煮损失率![]()
(1)
1.3.5 质构特性的测定
采用物性测定仪质构剖面分析(TPA)模式测定羊肉质构特性。将处理后的羊肉切成1 cm3方块,测试速率为1 mm/s,触发力5 g,形变量50 %,探头型号为P/75。测试6次取均值。
1.3.6 剪切力的测定
取1.3.4处理后肉块,用铁直尺与手术刀顺肌纤维方向切割成30 mm×10 mm×10 mm肉柱,肌肉嫩度仪垂直肌纤维方向剪切,测定5次取均值。
1.3.7 肌原纤维小片化指数(myofibril fragmentation index,MFI)
参考HOPKINS等[8]方法并作适当的修改:2 g羊肉糜加20 mL MFI提取缓冲液(0.1 mol/L KCl,l mmol/L NaN3,l mmol/L MgCl2,20 mmol/L K2HPO4,l mmol/L EGTA,pH 7.1,4 ℃),12 000 r/min冰浴均质(30 s/次,2次),冷冻离心(12 000×g,15 min)。重复上述步骤后于沉淀中加入15 mL MFI缓冲液,混匀,过双层纱布,滤液为肌原纤维蛋白溶液。考马斯亮蓝试剂盒测定其浓度,酶标仪测定540 nm处吸光度(调节质量浓度至0.5 g/L)。由公式(2)计算MFI值:
MFI=OD540×200
(2)
1.3.8 肉品持水力测定
离心法测定羊肉持水力[9]。三层滤纸包裹肉样,置于50 mL离心管,10 000×g冷冻离心10 min,记录离心前后肉块质量分别为m1与m2。由公式(3)计算持水力:
持水力![]()
(3)
1.3.9 超微结构分析
扫描电镜(scanning electron microscopy,SEM)测定羊肉微观结构。薄片肉样大小为3 mm× 3 mm× 2 mm(顺肌纤维方向切片),3 %戊二醛固定,乙醇梯度洗脱后冷冻干燥、喷金镀膜,观察超微结构。
1.3.10 组织切片分析
羊肉处理后切成5 mm厚小块,3 %戊二醛固定后做石蜡切片,染色脱水后镜检分析。
1.3.11 肌动球蛋白的提取
参考OKITANI等[10]方法并作微调:2 g肉糜加20 mL Weber溶液(0.6 mol/L KCl,0.04 mol/L NaHCO3,0.01 mol/L Na2CO3,pH 7.2),12 000 r/min冰浴匀浆(30 s/次,2次,间停20 s)。匀浆液摇床振荡20 h(200 r/min,4 ℃),过2层纱布除去羊肉筋膜等不溶物。调整滤液中KCl浓度为0.2 mol/L后继续振荡1 h,经冷冻离心(15 000×g,20 min)后取沉淀。沉淀溶解于KCl-Tris溶液(0.02 mol/L Tris-HCl,0.6 mol/L KCl,pH 7.2),即为肌动球蛋白溶液。BCA法测定其浓度,并稀释至1.0 g/L,待用。
1.3.12 肌动球蛋白SDS-PAGE凝胶电泳测定
取1.3.11稀释后的肌动球蛋白60 μL,加15 μL上样缓冲液(5×),干式恒温器95 ℃灭酶10 min,12 000×g离心3 min。取上清进行电泳分析,每孔等体积上样5 μL,蛋白Marker(10 ~180 kDa)作对照,泳槽中缓慢倒入1 L电泳缓冲液,先于电流16 mA下电泳15 min,后32 mA下电泳60 min。结束后,考马斯亮蓝R-250染色15 min,脱色后成像分析。
1.4 数据处理
试验均3次重复,SPSS 24.0统计软件进行数据分析,Origin 8.0绘制图表,两组间数据分析采用Turkey检验,P<0.05,表示差异显著。
2 结果与分析
2.1 羊肉浸泡前后浸泡液pH、质量、粗蛋白变化
由表1可知,未超声组(W组,S组)浸泡液pH前后差异不显著,且略有降低,这是由于本实验组羊肉pH低于去离子水与NaHCO3的pH,肉块中少许成分与去离子水、NaHCO3置换引起。对比超声组,可见S+U组pH略有上升,NaHCO3浸泡后液体pH变化较小,超声空化效应与机械效应促进组织内盐溶性蛋白渗出,同时也促进组织液渗出,由于NaHCO3溶液pH远高于肉块组织pH,混匀后液体pH依旧略有提高,而W+U组因去离子水pH与肉块pH相差并不大,组织液经超声渗出后,致使浸泡液pH略有下降,但仍与单独去离子水处理差异不大。浸泡液质量变化可由肉块质量变化反映,表中除W组变化不显著,其余组肉块质量均有所提高(即浸泡液质量均有所损失),超声处理破坏了肌原纤维蛋白,肉品组织结构变得松软,促进了浸泡液渗透,肉块吸收液体能力增强,NaHCO3呈弱碱性,对肉块具有腐蚀性,对纤维组织具有软化作用,两者协同效果更加明显。粗蛋白含量经考马斯亮蓝试剂盒测定,超声组均较未超声组有所提高,验证了超声处理对蛋白的溶出作用。
表1 浸泡液pH、质量、粗蛋白变化
Table 1 Changes of pH, mass, crude protein of
soaking solution
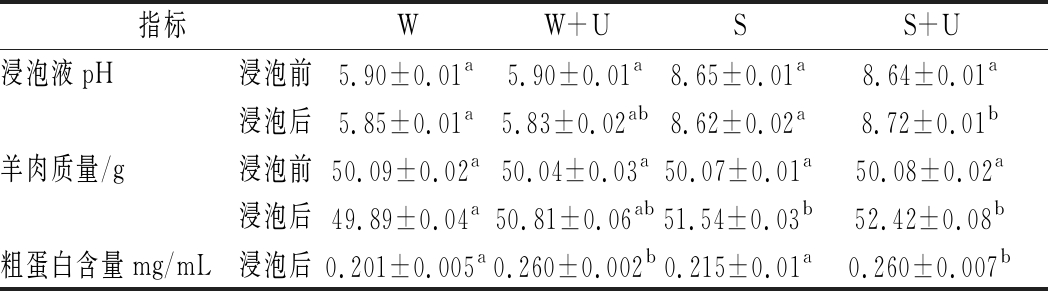
指标WW+USS+U浸泡液pH浸泡前5.90±0.01a5.90±0.01a8.65±0.01a8.64±0.01a浸泡后5.85±0.01a5.83±0.02ab8.62±0.02a8.72±0.01b羊肉质量/g浸泡前50.09±0.02a50.04±0.03a50.07±0.01a50.08±0.02a浸泡后49.89±0.04a50.81±0.06ab51.54±0.03b52.42±0.08b粗蛋白含量mg/mL浸泡后0.201±0.005a0.260±0.002b0.215±0.01a0.260±0.007b
注:同指标同列数据肩标不同小写字母表示差异显著(P<0.05)。
2.2 羊肉肉糜pH变化
宰后肌肉pH变化反映其糖原酵解速率与乳酸生成量关系,动物宰杀后因氧气供应中断,吗肌糖原无氧酵解生成乳酸,而成熟期pH升高,肉质嫩度得到改善[11]。
如图2所示,各处理组pH值均处于宰后僵直成熟期pH范围(5.8 ~ 6.5)。与C组相比,W组与W+U组羊肉pH值均升高,即偏中性去离子水浸泡使偏酸性羊肉pH略有上升,但差异不明显,这可能归因于超声引起的“水波震动”及“注水滚揉嫩化”[12],但两者均与S+U组差异显著(P<0.05)。与C组相比较,S组和S+U处理组较未处理组羊肉pH显著升高,范围在0.5~1.0,且2种嫩化方法均较对照组差异显著(P<0.05),S+U组羊肉pH最大,嫩化效果最好,这与张坤等[13]结果相似。宰后肌肉pH值下降引起肌浆网和钙泵功能改变,导致细胞内钙浓度增加、肌肉僵硬[14],而超声可促进肌动球蛋白解离,加快糖酵解进程,羊肉pH显著升高。另一方面可能因为NaHCO3溶于水呈弱碱性,羊肉pH上升。且高pH保持时间越长,利于钙蛋白酶的活性提高,羊肉嫩度得以改善[15]。NaHCO3、超声波均能改善肉品嫩度,两者联合效果更为明显。
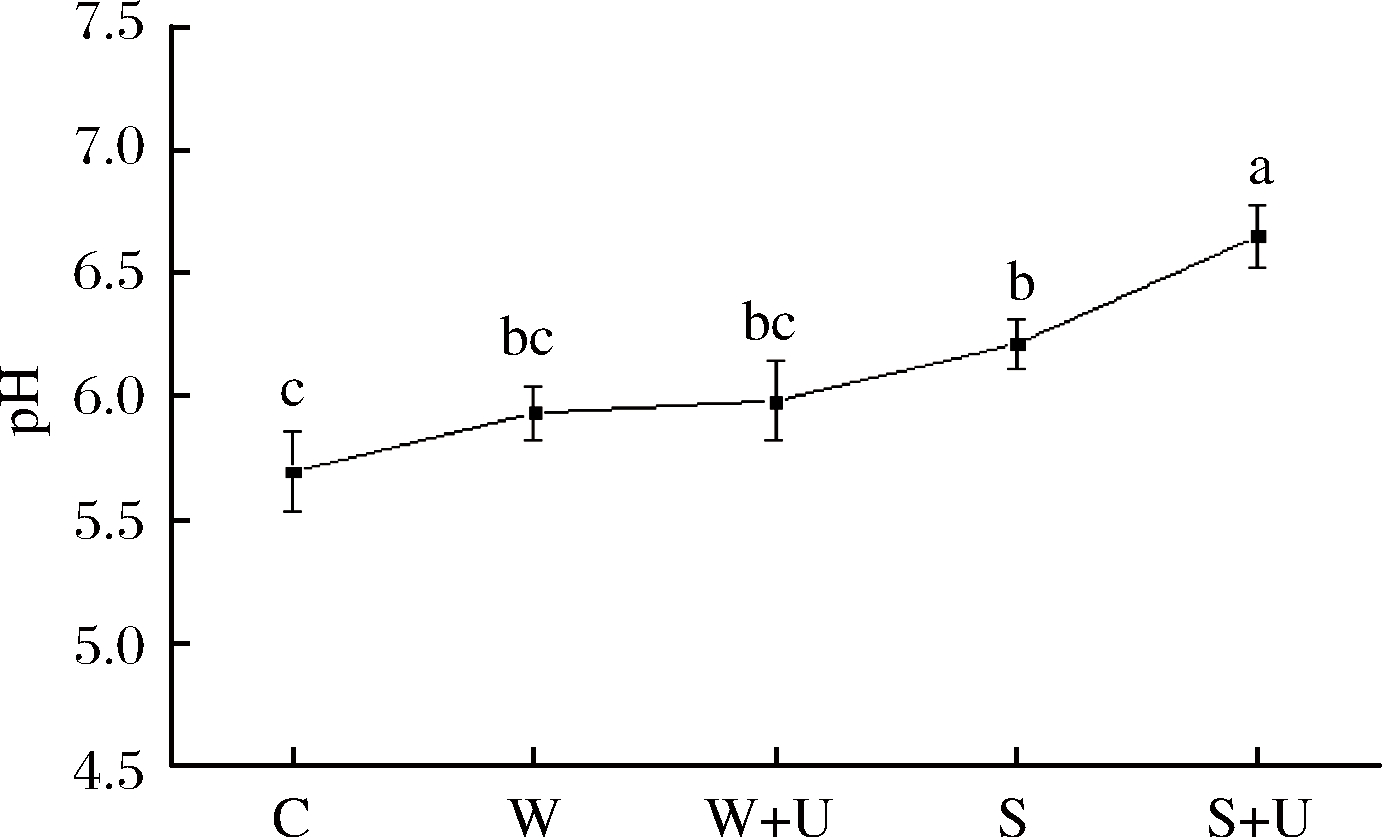
图2 NaHCO3和超声处理对羊肉pH的影响
Fig.2 Effects of sodium bicarbonate and
ultrasound treatments on pH of lamb
注:C-未处理组;W-去离子水浸泡1 h;W+U-去离子水浸泡
1 h后超声处理;S-碳酸氢钠浸泡1 h;S+U-碳酸氢钠浸泡1 h
后超声处理。不同字母表示差异显著(P<0.05)。下同。
2.3 羊肉肉块蒸煮损失变化
如图3所示,未处理组羊肉肉块蒸煮损失明显高于其他处理组。单独去离子水处理虽较未处理组有显著性差异,但效果不如NaHCO3,且W+U组与S+U组的差异明显(P<0.05)。S+U组在加热蒸煮过程中损失最低,较未处理组降低了18 %,具有良好的保水效果,说明超声波处理可降低肉块的蒸煮损失率,提高肉块的保水性,这可能是由于超声破坏了细胞原有结构,胞内Ca2+外流,钙激活酶被激活,肌原纤维蛋白分解加快,使羊肉嫩度增大、肉质变嫩[16]。超声处理促进盐溶性蛋白向羊肉的表面大量集中,盐溶性蛋白含量的多少与蒸煮加热后蛋白形成的凝胶有关,含量越高,凝胶结构越致密,束缚的水分越多,超声处理增大了羊肉肉块表面阻止水分向外面扩散的能力[17];与此同时,NaHCO3处理显著降低了羊肉蒸煮损失率,优于单独去离子水浸泡,这与李楠等[18]结论一致(NaHCO3的添加显著降低了PSE鸡胸肉与正常鸡胸肉的蒸煮损失)。NaHCO3联合超声波处理效果最优。

图3 NaHCO3和超声处理对羊肉蒸煮损失的影响
Fig.3 Effect of sodium bicarbonate and ultrasound treatments on cooking loss of lamb
2.4 羊肉质构特性变化
由图4可知,经单独去离子水处理的肉块,其咀嚼性、内聚性、胶着性与未处理组差异不显著(P>0.05),W组肉块表面色泽稍有变化,但去离子水不易渗入组织纤维内部,对质构影响不大。与未处理组相比,W+U组和S+U组各项质构参数有显著差异(P<0. 05),即超声促进去离子水与NaHCO3渗入组织内部,较好地改善了羊肉品质。此外,W+U组与S+U组、W组与S组两两差异显著,说明NaHCO3
较去离子水浸泡嫩化效果更好,联合超声可进一步增强该效果。对照组硬度较其余处理组均明显偏大,而W+U组与S+U组也有差异,说明超声处理对羊肉的硬度影响较大,可改变肉品嫩度。与JAYASOORI-YA等[19]发现超声处理降低牛肉剪切力和硬度、提高其质构和改善牛肉品质的结论相符。GOT等[20]对牛肉块进行超声处理,其肌间Ca2+释放较对照组提高30 %,即超声不仅破坏肌纤维,对细胞/细胞膜也存在影响,促使Ca2+提前释放至肌细胞间隙。此外,超声处理亦可拉伸肌节长度,提高肉品嫩度。另外,NaHCO3呈碱性,对于肉品有一定的腐蚀性,可能会破坏羊肉的结构和肌原纤维,有效地改善了肉品的质构特性和嫩度,符合2.1所述推测,NaHCO3联合超声波处理对羊肉质构效果显著。

A-咀嚼型;B-内聚性;C-胶着性;D-硬度
图4 NaHCO3和超声处理对羊肉质构的影响
Fig.4 Effect of sodium bicarbonate and ultrasound treatments on texture properties of lamb
2.5 羊肉剪切力变化
由图5可知,经NaHCO3、NaHCO3联合超声波、去离子水联合超声波处理的羊肉剪切力均较未处理组有显著减小(P<0.05),W组剪切力变化不大,而S+U组剪切力最小,即NaHCO3联合超声波处理对羊肉嫩化效果最好,与JAYASOORIYA等[19]发现超声波处理可以降低牛肉的剪切力结论一致。这可能是由于超声波机械效应物理破坏肌纤维蛋白,空化作用破坏其线粒体和溶酶体膜等,大量盐溶蛋白与嫩化酶释放,一定程度上促进了盐溶蛋白富集于肉块表面,从而引起羊肉嫩度改善[21]。这与朱秋劲等[22]结论相似(新鲜牛肉经超声处理可促进蛋白酶分泌,游离氨基酸含量增加,组织结构改变,从而改善嫩度)。NaHCO3呈碱性,影响蛋白结构,两者联合处理使蛋白空间立体性增加,高级结构改变,提高了羊肉嫩度品质[23]。
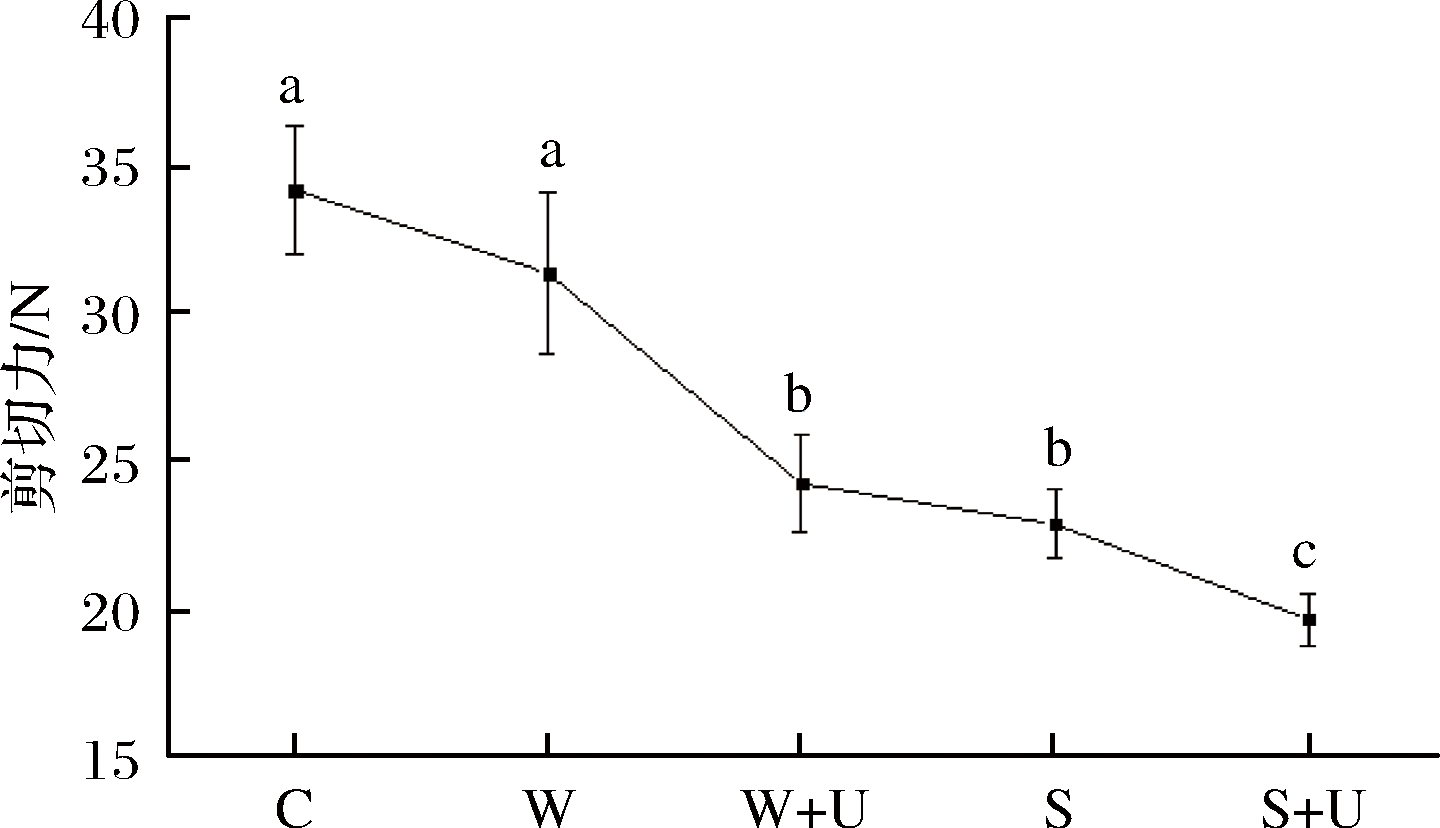
图5 NaHCO3和超声处理对羊肉剪切力的影响
Fig.5 Effect of sodium bicarbonate and ultrasound treatments on shear force of lamb
2.6 羊肉肌原纤维小片化指数(MFI)变化
由图6可知,未处理组肌原纤维小片化指数较其他处理组差异明显(P<0.05),且W+U组与S+U组之间也存在显著差异,说明碳酸氢钠嫩化效果优于去离子水,且超声处理可增大羊肉的嫩度。其中S+U组MFI显著大于其他组,且较未处理组提高近1倍,说明NaHCO3联合超声波处理效果最佳。在宰后肌肉中,钙蛋白酶激活,引起Z盘相关肌原纤维蛋白降解,造成肌纤维断裂[24]。MFI是表现肌原纤维断裂程度的参数,也是表征肉品嫩度的重要指标,MFI值与肌原纤维断裂程度及肉品嫩度成正比,与剪切力值变化息息相关。所以可推断,超声波的空化效应和穿透性导致羊肉肌原纤维和结缔组织被破坏,肌原纤维小片化程度加快,MFI增大。另一方面,NaHCO3可使羊肉软化,肌原纤维断裂,变成肌节小片,MFI增大,故NaHCO3联合超声波处理的效果最佳。

图6 NaHCO3和超声处理对羊肉MFI的影响
Fig.6 Effect of sodium bicarbonate and ultrasound treatments on MFI of lamb
2.7 羊肉肉品持水力变化
肌肉持水力与肉品嫩度和食用品质密切相关,肌肉蛋白中起保水性、黏着性的是肌纤维中的肌球蛋白(含量最高,也最重要)[25]。研究发现,肌肉系水力与其蛋白含量呈正相关[26]。值得注意的是,蛋白变性与肉品持水力有直接关系,变性引起结构松驰,组织间隙变大,持水性增强。如图7所示,S+U组肉品
持水力明显高于C组和W+U组(P<0.05),W+U组和C组存在差异,但不显著(P>0.05)。可能是因为超声改变了肉品中蛋白质的含量,间接影响了肉品的持水力。这与SIRO等[27]结论相似(适宜频率和强度的超声波可改变肌肉组织微观结构,提高持水性)。此外,肉品pH值影响持水力大小,当pH大于或小于蛋白质等电点时,肌肉发生松弛,改变肉品的持水力,碳酸氢钠为弱碱,会增大肉品的pH,适当地增大持水力,这与2.1中浸泡液质量损失、肉品吸水性能增加具有较好的一致性,因此,NaHCO3联合超声波处理的肉品持水力最佳。

图7 NaHCO3和超声处理对羊肉肉品持水力的影响
Fig.7 Effect of sodium bicarbonate and ultrasound treatments on holding water capacity of lamb
2.8 羊肉超微结构变化
由图8可知,未处理组羊肉纤维紧密、严实,表面平整光滑,没有裂缝和空洞。W+U组羊肉肌原纤维进一步地变大,纤维之间开始出现裂缝、少许空洞以及轻微的断裂。S组与S+U组羊肉肌原纤维的结构断裂明显,空间和结构变得疏松和细碎,表面空洞明显,促进了羊肉的嫩化,这是因为超声引起空化气泡积聚在样品表面后爆裂引起微射流,导致样品表面结构冲蚀、可溶性物质释放[28]。超声波可以破坏羊肉的肌原纤维和结缔组织,增大肉品嫩度,碳酸氢钠可以软化肌原纤维和降解肌肉蛋白质,使纤维更易断裂,两者联合改善嫩度效果最好。
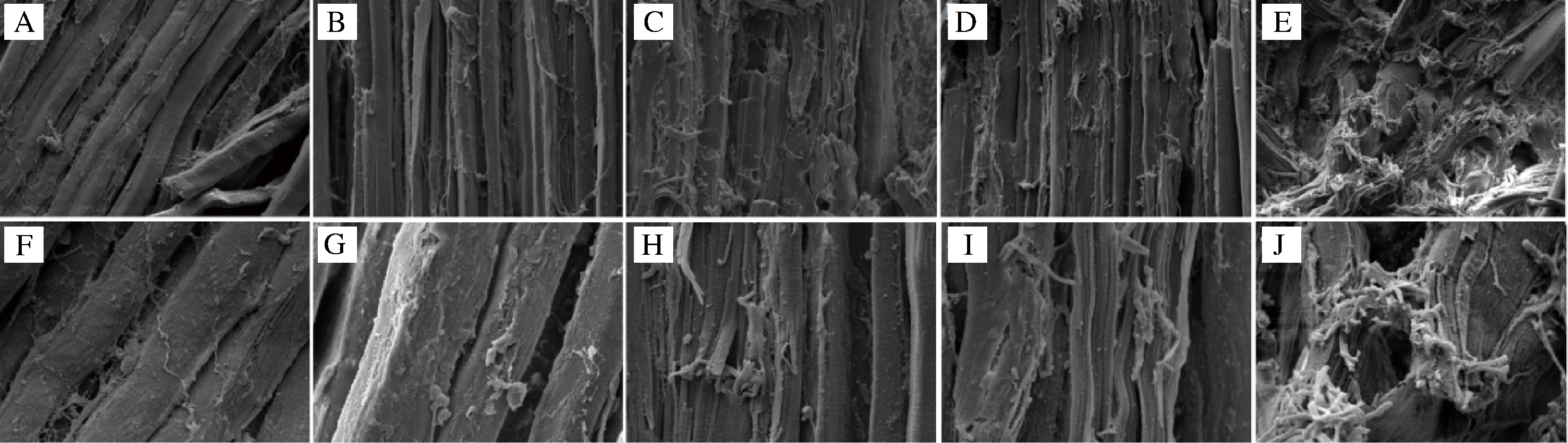
A~E-C、W、W+U、S、S+U(300×);F~J-C、W、W+U、S、S+U(1 000×)
图8 不同处理组羊肉的扫描电镜图
Fig.8 The scanning electron microscopy photographs of lamb under different treatments
2.9 羊肉组织切片变化
图9为各处理组羊肉组织横、纵切面图,未处理组羊肉肌原纤维束完整,纤维间间隙较小,排列紧密,无破坏迹象。单独去离子水处理对羊肉组织切片影响不大,W+U组的肌原纤维因经去离子水浸泡后超声处理促进水分进入而有轻微的增大,由纵切面可以观察到间隙稍增大,部分纤维束不完整,遭到一定程度的破坏。S+U组的肌原纤维断裂程度最大,间隙最大,且在间隙中可观察到细胞内容物的释放,肌纤维结构断裂片段大小不一,超声机械与空化效应导致细胞中的内容物包括蛋白酶等物质释放到纤维间隙,组织蛋白酶的活性被激活增大,肌原纤维断裂明显[29]。NaHCO3由于自身呈碱性,对肉品具有一定的腐蚀作用,协助超声波加重羊肉肌原纤维破坏断裂。肌纤维的断裂和纤维间隙的增大对于羊肉的嫩化有较大的促进作用,去离子水联合超声波对肌纤维的断裂有一定的效果,而碳酸氢钠联合超声波处理对于肉品的嫩化效果最佳,进一步证实了上述肌纤维小片化指数结论。

A-未处理组的横截面; B-去离子水处理组的横截面;C-去离子水联合超声波处理组的横截面;D-NaHCO3处理组的横截面;E-NaHCO3联合超声波处理组的横截面;F~J-分别为各处理组对应的纵截面
图9 羊肉组织肌原纤维横切图和肌原纤维纵切图
Fig.9 Tissue section of lamb
2.10 肌动球蛋白SDS-PAGE凝胶电泳结果分析
电泳图难以表征肌原纤维蛋中肌球蛋白(大分子质量蛋白,约510 kDa),但肌动蛋白为小分子质量蛋白(约43 kDa),在SDS-PAGE凝胶电泳试验中可以常规宽分子质量Marker作为参比,操作相对简便,故常以肌动蛋白含量表征肌动球蛋白解离情况[30]。
图10为各组羊肉肉块中提取的肌动球蛋白SDS-PAGE凝胶电泳图,各处理组之间的蛋白条带均完整,没有出现碎条带,说明超声波、NaHCO3、去离子水均未破坏蛋白的亚基组成。不同处理组之间的肌动球蛋白条带粗细、深浅不一,有显著的差别。S+U组的肌动蛋白条带最粗,且和C组、W+U组差异显著,肌动蛋白含量最高。这可能是由于弱碱性NaHCO3起到降解肌动球蛋白作用,肌动蛋白游离,表现为肌动蛋白条带增粗,同时超声处理会破坏细胞膜和细胞基本结构,细胞的内容物包括组织蛋白酶和钙蛋白酶等被释放,作用于羊肉肉品,进一步改善羊肉嫩度,这也与质构特性、剪切力等指标的结论一致。

图10 羊肉肌动球蛋白的SDS-PAGE图
Fig.10 Sodium dodecyl sulfate-gel electrophoresis patterns of actomyosin in lamb
3 结论
本试验对未处理和经去离子水、NaHCO3及对应的超声波联合处理的羊肉进行对比分析,结果表明,NaHCO3联合超声波处理可增大羊肉的pH、加速宰后成熟期、降低蒸煮损失和剪切力,其质构参数变化显著,嫩度增大,肉质得以改善。同时羊肉的肌原纤维小片化指数(MFI)增大,持水力增强,提高了肉制品的质量和食用价值。NaHCO3联合超声波处理可使羊肉表面的某些微观结构发生显著的改变,肌原纤维出现不同程度的断裂和软化,纤维间间隔增大、肉质疏松,肌动球蛋白经NaHCO3联合超声波处理后,其微环境改变,游离态肌动蛋白的含量升高。但仍需验证该联合处理对羊肉嫩度与肌动球蛋白解离的关系、优化复合嫩化参数,并对处理后羊肉感官风味品质、营养流失等作进一步的分析,以及从肌球蛋白(肌原纤维中最重要的蛋白)着手研究NaHCO3联合超声波嫩化羊肉机理,为改善畜禽类肉品品质提供新的方向和方法。
[1] WARNER R D, MCDONNELL C K, BEKHIT A E D, et al. Systematic review of emerging and innovative technologies for meat tenderisation[J]. Meat Science, 2017, 132: 72-89.
[2] CHEMAT F, ROMBAUT N, SIGAIRE A G, et al. Ultrasound assisted extraction of food and natural products. Mechanisms, techniques, combinations, protocols and applications A Review[J]. Ultrasonics Sonochemistry, 2017, 34: 540-560.
[3] CHEMAT F, KHAN M K. Applications of ultrasound in food technology: Processing, preservation and extraction[J]. Ultrasonics Sonochemistry, 2010, 18(4): 813-835.
[4] ZOU Ye, ZHANG Kun, ZHANG Xinxiao, et al. Optimization of goose breast meat tenderness by rapid ultrasound treatment using response surface methodology and artificial neural network[J]. Animal Science Journal, 2018, 89(9): 1 339-1 347.
[5] MOHAN A, JAICO T, KERR W, et al. Functional properties of bicarbonates on physicochemical attributes of ground beef[J]. LWT - Food Science and Technology, 2016, 70: 333-341.
[6] 李楠,张艳芳,韩剑飞,等. 滚揉过程中添加碳酸氢钠对鸡胸肉品质的影响[J]. 肉类工业, 2015(2): 13-15.
[7] YANG Huijuan, ZHANG Wangang, LI Teng, et al. Effect of protein structure on water and fat distribution during meat gelling[J]. Food Chemistry, 2016, 204: 239-245.
[8] HOPKINS D L, LITTLEFIELD P J, THOMPSON J M. A research note on factors affecting the determination of myofibrillar fragmentation[J]. Meat Science, 2000, 56(1): 19-22.
[9] XUE Siwen, XU Xinglian, SHAN Huimin, et al. Effects of high-intensity ultrasound, high-pressure processing, and high-pressure homogenization on the physicochemical and functional properties of myofibrillar proteins[J]. Innovative Food Science & Emerging Technologies, 2018, 45: 354-360.
[10] OKITANI A, ICHINOSE N, ITOH J, et al. Liberation of actin from actomyosin in meats heated to 65℃[J]. Meat Science, 2009, 81(3): 446-450.
[11] 马晓冰,苏琳,林在琼,等. 不同品种肉羊肌肉的糖酵解潜力及其与肉品质的相关性[J]. 食品科学, 2015, 36(15): 1-4.
[12] 薛维利. 提高火腿、红肠和烤肉口感的新方法[J]. 肉类工业, 2001(9): 13.
[13] 张坤,吴海虹,邹烨,等. 超声波联合一磷酸腺苷(AMP)对鸡胸肉的嫩化效果[J]. 江苏农业学报, 2018, 34(6): 167-174.
[14] FERGUSON D M, GERRARD D E. Regulation of post-mortem glycolysis in ruminant muscle[J]. Animal Production Science, 2014, 54(4): 464-481.
[15] HUFF-LONERGAN E, MITSUHASHI T, BEEKMAN D D, et al. Proteolysis of specific muscle structural proteins by μ-calpain at low pH and temperature is similar to degradation in postmortem bovine muscle[J]. Journal of Animal Science, 1996, 74(5): 993-1 008.
[16] 黄明,赵莲,徐幸莲,等. 钙离子和钙激活酶外源抑制剂对牛肉钙激活酶活性和超微结构的影响[J]. 南京农业大学学报, 2004, 27(4): 101-104.
[17] KRAUSE R J, OCKERMAN H W, KROL B, et al. Influence of tumbling, tumbling time, trim and sodium tripolyphosphate on quality and yield of cured hams[J]. Journal of Food Science, 2010, 43(3): 853-855.
[18] 李楠,张艳芳,韩剑飞,等. 滚揉过程中添加碳酸氢钠对鸡胸肉品质的影响[J]. 肉类工业, 2015(2): 13-15.
[19] JAYASOORIYA S D, TORLEY P J, D'ARCY B R, et al. Effect of high power ultrasound and ageing on the physical properties of bovine semitendinosus and longissimus muscles[J]. Meat Science, 2007, 75(4): 628-639.
[20] GOT F, CULIOLI J, BERGE P, et al. Effects of high-intensity high-frequency ultrasound on ageing rate, ultrastructure and some physicochemical properties of beef[J]. Meat Science, 1999, 51(1): 35-42.
[21] 陈立娟,李欣,李铮,等. 蛋白质磷酸化调控羊肉肌原纤维蛋白的功能[J]. 中国农业科学, 2016, 49(7): 1 360-1 370.
[22] 朱秋劲,罗爱平,林国虎,等. 超声波和气调贮藏对冷却牛肉保鲜效果的影响[J]. 食品科学, 2006,27(1): 240-246.
[23] 史培磊,闵辉辉,李春保,等. 滚揉腌制前后鹅肉品质的变化[J]. 食品科学, 2011, 32(11): 88-92.
[24] D′ALESSANDRO A, MARROCCO C, RINALDUCCI S, et al. Chianina beef tenderness investigated through integrated omics[J]. Journal of Proteomics, 2012, 75(14): 4 381-4 398.
[25] ASGHAR A, SAMEJIMA K, YASUI T, et al. Functionality of muscle proteins in gelation mechanisms of structured meat products[J]. Critical Reviews in Food Technology, 1985, 22(1): 27-106.
[26] WANG E, XU Weiwei, KANG Ning, et al. Microstructural, protein denaturation and water holding properties of lamb under pulse vacuum brining[J]. Meat Science, 2016, 113: 132-138.
[27] SIR I, V
I, V N C S, BALLA C, et al. Application of an ultrasonic assisted curing technique for improving the diffusion of sodium chloride in porcine meat[J]. Journal of Food Engineering, 2009, 91(2): 353-362.
N C S, BALLA C, et al. Application of an ultrasonic assisted curing technique for improving the diffusion of sodium chloride in porcine meat[J]. Journal of Food Engineering, 2009, 91(2): 353-362.
[28] PETIGNY L, P RINO-ISSARTIER S, WAJSMAN J, et al. Batch and continuous ultrasound assisted extraction of boldo leaves (Peumus boldus
RINO-ISSARTIER S, WAJSMAN J, et al. Batch and continuous ultrasound assisted extraction of boldo leaves (Peumus boldus Mol.)[J]. International Journal of Molecular Sciences, 2013, 14(3): 5 750-5 764.
Mol.)[J]. International Journal of Molecular Sciences, 2013, 14(3): 5 750-5 764.
[29] ERTBJERG P, HENCKEL P, KARLSSON A, et al. Combined effect of epinephrine and exercise on calpain/calpastatin and cathepsin B and L activity in porcine longissimus muscle[J]. Journal of Animal Science, 1999, 77(9): 2 428-2 436.
[30] 邓少颖,王道营,张牧焓,等. 鸭胸肌肉加热过程中肌动球蛋白解离研究[J]. 食品科学, 2015, 36(1): 1-5.