番荔枝(Annona squamosa L.)属番荔枝科(Annonaceae)番荔枝属(Annona)植物,又称释迦果、洋波罗、佛头果,呈圆球状或圆锥形,果皮黄绿色,外表有瘤状凸起,薄白蜡粉[1]。番荔枝广泛种植于热带和亚热带地区,现我国海南、广东、广西、福建、台湾等热带地区广泛种植[2]。其果肉鲜嫩美味,浓甜爽口,营养丰富而深受消费者的喜爱。但番荔枝是典型的呼吸跃变型果实,对乙烯极敏感,呼吸速率呈峰型变化,出现呼吸高峰,采后易受机械损伤和病害侵染[3],与大多数热带亚热带园艺产品一样,番荔枝在低温冷藏过程中容易发生生理失调,诱发冷害现象发生,导致果肉组织木质化,木质素积累,伴随营养成分的流失质地糙硬少汁、内部组织褐变和裂果等一系列劣变现象,影响了番荔枝果实的外观品质和商品价值,限制了番荔枝果实产业化发展[4-6]。
1-甲基环丙烯(1-methylcyclopropene,1-MCP)是一种有效的乙烯拮抗剂,通过阻止乙烯与乙烯受体结合,导致乙烯信号转导受阻,从而抑制果蔬的生理生化反应,可延长果蔬的呼吸高峰,延缓果蔬后熟化[7]。若能在植物体内乙烯作用之前施用1-MCP,1-MCP会首先与乙烯受体蛋白结合,从而阻止乙烯与其结合[8],因此1-MCP会显著影响呼吸跃变型果实的采后生理。
硝普钠(sodium nitroprusside,SNP)作为NO的载体化合物,通常被用来研究外源NO对植物生长的作用[9]。外源NO作为一种气调保鲜剂,广泛应用于果蔬产品的保鲜。NO处理延长果蔬的贮藏期主要通过2个途径,一方面是通过NO作用抑制果蔬内源乙烯的生成,抑制果蔬的呼吸速率,从而延长货架期;另一方面是NO处理可以提高果蔬的抗氧化酶活性,提高果实的抗氧化能力,从而达到保鲜的目的[10-11]。
目前国内关于番荔枝保鲜的研究主要集中在冷藏、气调贮藏、涂膜保鲜和成熟度等对品质的影响,而有关1-MCP和SNP等化学保鲜剂对番荔枝采后果实的研究较少。本文预实验的研究基础上,探究1-MCP和SNP处理对冷藏番荔枝果实呼吸速率、营养品质、木质素含量及与木质素合成相关酶活性的影响,以期为番荔枝果实贮藏保鲜提供参考。
1 材料与方法
1.1 材料与试剂
大目番荔枝,采摘于中国热带农业科学院南亚热带作物研究所果园,当天运回实验室,选择大小一致,七八成熟,无病虫害,无机械损伤的番荔枝果实。
考马斯亮蓝、苯酚、浓H2SO4、葡萄糖、苯酚、浓HCl、甲醇、乙醇、正己烷、冰醋酸、NaOH均为分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
SY-1022果蔬呼吸测定仪,辽宁赛亚斯科技有限公司;UV-1780型紫外可见分光光度计,日本Shimadzu公司;3-30K型低温高速离心机,德国Sigma公司;GY-4果实硬度计,智取精密仪器有限公司;TP-214电子天平,北京赛多利斯系统有限公司。
1.3 方法
1.3.1 番荔枝保鲜处理
1-MCP处理:设置0.8、1.8、2.8 μL/L,共3个浓度梯度,于25℃下密闭熏蒸处理24 h,处理完毕后,打开培养箱通风0.5 h,4℃相对湿度80%条件下贮藏18 d;SNP处理:设置0.25、0.5、1.0 mmol/L,共3个浓度梯度,避光浸泡30 min后,室温下晾干,4℃相对湿度80%条件下贮藏18 d;每2 d从各处理组取样,并用液氮速冻,于-80℃超低温冰箱保存备用,重复3次测定。在以上预实验的基础上,确定以1.8 μL/L 1-MCP、0.5 mmol/L SNP保鲜剂处理和对照组,进一步探究不同保鲜剂对冷藏番荔枝的营养品质及木质素合成代谢相关酶活性的变化。
1.3.2 呼吸速率的测定
采用果蔬呼吸测定仪测定,各处理组中挑选3个果实,置于容积为2 L的呼吸室中,进行测定,结果以mg/(kg·h)表示。
1.3.3 硬度和失重率的测定
硬度:采用GY- 4型果实硬度计测定。随机选取3个果实,去皮,于果实最大横径处,将探针垂直指向平面,均匀施加压力至刻度线,读取数值,单果重复10次。结果以N表示。
失重率:各处理组中挑选3个果实,每天同一时间对其进行称重,计算公式如式(1):
失重率![]()
(1)
式中:W1为贮藏前质量,g;W2为贮藏后质量,g。
1.3.4 可溶性蛋白和糖的测定
参考曹建康等[12]方法,可溶性蛋白采用考马斯亮蓝染色法进行测定,在波长595 nm处比色测定吸光值,结果以mg/g表示;可溶性糖采用苯酚-硫酸法进行测定,在波长485 nm处比色测定吸光值,结果以%表示。
1.3.5 总酚和类黄酮的测定
参考曹建康等[12]方法,提取液用1% HCl-甲醇溶液稀释10倍后,在波长280 nm处吸光度表示总酚含量,结果以OD280/g表示;提取液用1% HCl-甲醇溶液稀释5倍后,在波长325 nm处吸光度表示类黄酮含量,结果以OD325/g表示。
1.3.6 木质素的测定
参考陈发河等[13]的方法,取1 g样品,加5 mL 95%的乙醇研磨,于3 000×g离心7 min,沉淀物以95%乙醇冲洗3次,再用95%乙醇与正乙烷混合液(V(95%乙醇)∶V(正乙烷)=1∶2)冲洗3次,干燥后,溶于25%溴乙酰冰醋酸溶液中,70 ℃恒温水浴中加塞保温30 min,然后加入0.9 mL、2 mol/LNaOH溶液终止反应,加5 mL冰醋酸和0.1 mL 7.5 mol/L羟胺盐酸,并以冰醋酸定容至10 mL,再用冰醋酸稀释125倍得到样品提取液,取上清液在280 nm处测定吸光度值,以OD280/g FW表示木质素的含量。
1.3.7 PAL、PPO、POD、SOD活性的测定
苯丙氨酸解氨酶(phenylalanine ammonia-lyase, PAL)活性测定:参考KOUKOL等[14]的方法。取1.0 g番荔枝果肉,加入5 mL提取缓冲液(含40 g/L PVP、2 mmol/L EDTA、5 mmol/L β-巯基乙醇),冰浴条件下研磨。于4℃,10 000×g离心20 min,收集上清液,即为粗酶提取液,低温保存备用。波长290 nm处测定吸光度,以每克样品(鲜重)在每毫升反应体系中吸光度290 nm变化0.01为一个酶活力单位,结果以U/g鲜重表示。
多酚氧化酶(polyphenol oxidase, PPO)活性测定:参照GALEAZZI等[15]的方法。反应15 s开始记录反应体系在波长420 nm的吸光度值,然后每隔1 min 记录1次,连续测定至少6组。以每克样品(鲜重)吸光度变化0.01为一个酶活力单位,结果以U/g鲜重表示。
过氧化物酶(peroxidase,POD)活性测定:参照HAMMERSCHMIDT等[16]的方法。反应15 s时记录反应体系在波长470 nm的吸光度值,然后每隔1 min记录1次,连续测定至少6组。以每毫克组织蛋白每分钟催化1 μg底物酶量为一个酶活力单位,结果以U/mgprot表示。
超氧化物歧化酶(superoxide dismutase, SOD)活性测定:取5.0 g番荔枝果肉,加入5 mL提取缓冲液(含4% PVPP和5 mmol/L DTT)冰浴条件下研磨。4℃,10 000×g离心20 min,收集上清液,即为粗酶提取液,低温保存备用。取5支试管中均加入1.7 mL 0.05 mol/L pH 7.8磷酸缓冲液,再分别加入0.3 mL 130 mmol/L蛋氨酸溶液、0.75 mmol/L氮蓝四唑溶液、0.1 mmol/L EDTA-Na2溶液和0.02 mmol/L核黄素溶液以及0.1 mL酶液,立即混合后,将其中2支试管置于暗处,其他各管用光强3 000 lx的荧光灯光照15 min后,置于暗处终止反应。以未光照管调零,于波长560 nm处测定吸光度值。以每克组织在1 mL反应液中SOD抑制率达50%时所对应的SOD量为一个酶活力单位,结果以U/mg prot表示。
1.4 数据统计与分析
采用Graphpad软件绘图,利用SPSS 20.0 软件进行数据分析,用Duncan法检验差异显著性(P<0.05)。
2 结果与分析
2.1 不同处理对番荔枝呼吸速率的影响
呼吸作用是衡量采后果蔬新陈代谢强弱的重要指标[17]。由图1可知,各处理组番荔枝的呼吸速率均呈先上升后下降的趋势,在第9天出现呼吸高峰,对照组、1-MCP和SNP处理组呼吸速率分别为274.54,172.65和207.45 mg/(kg·h),与对照组差异显著(P<0.05)。在0~3 d和12~18 d,1-MCP和SNP处理组间差异不显著(P > 0.05)。上述结果表明,1-MCP和SNP处理可以抑制冷藏番荔枝的呼吸速率,其中1-MCP处理抑制呼吸高峰效果更好。
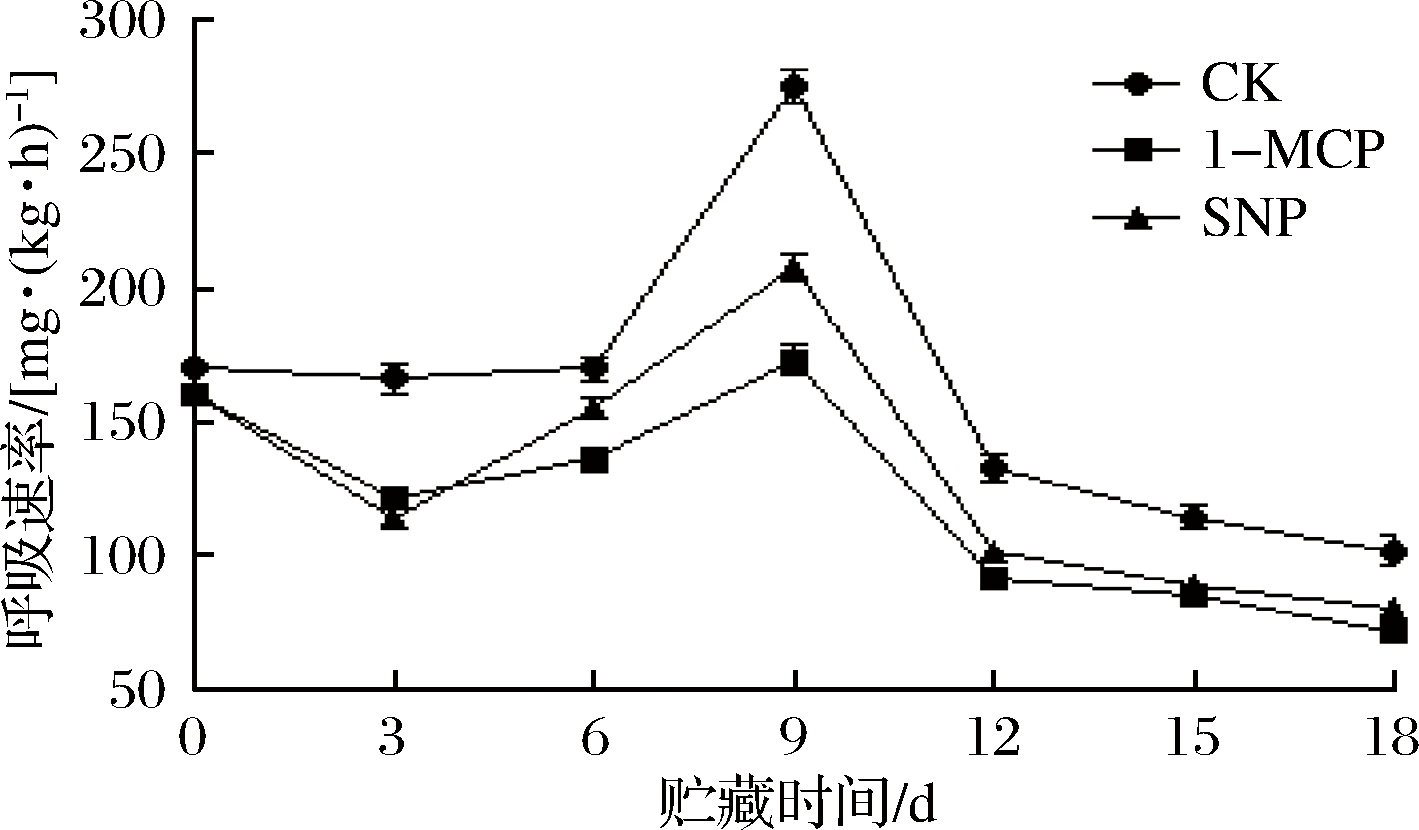
图1 不同处理对番荔枝呼吸速率的影响
Fig.1 Effects of different treatments on respiratory rate of Annona squamosa L.
2.2 不同处理对番荔枝硬度和失重率的影响
失重率和硬度的变化直接反映采后番荔枝品质的变化,失重率越高表明果蔬品质下降越严重[18]。由图2-A 可知,番荔枝果实硬度随着贮藏时间的延长而下降,在第18天,对照组果实硬度为4.63 N,分别是1-MCP和SNP处理的45.3%和39.7%,显著高于对照组(P<0.01),说明1-MCP和SNP处理可以有效维持番荔枝果实的硬度水平,两处理组间差异不显著(P>0.05)。
由图2-B可知,番荔枝果实的失重率随贮藏时间的延长而增加,在整个贮藏期间,1-MCP和SNP处理失重率显著低于对照组(P<0.05),而两处理组间差异不显著(P>0.05)。综上表明,1-MCP和SNP处理均可以抑制番荔枝果实硬度的下降及失重率的上升,减少重量损失,从而保持果实品质。
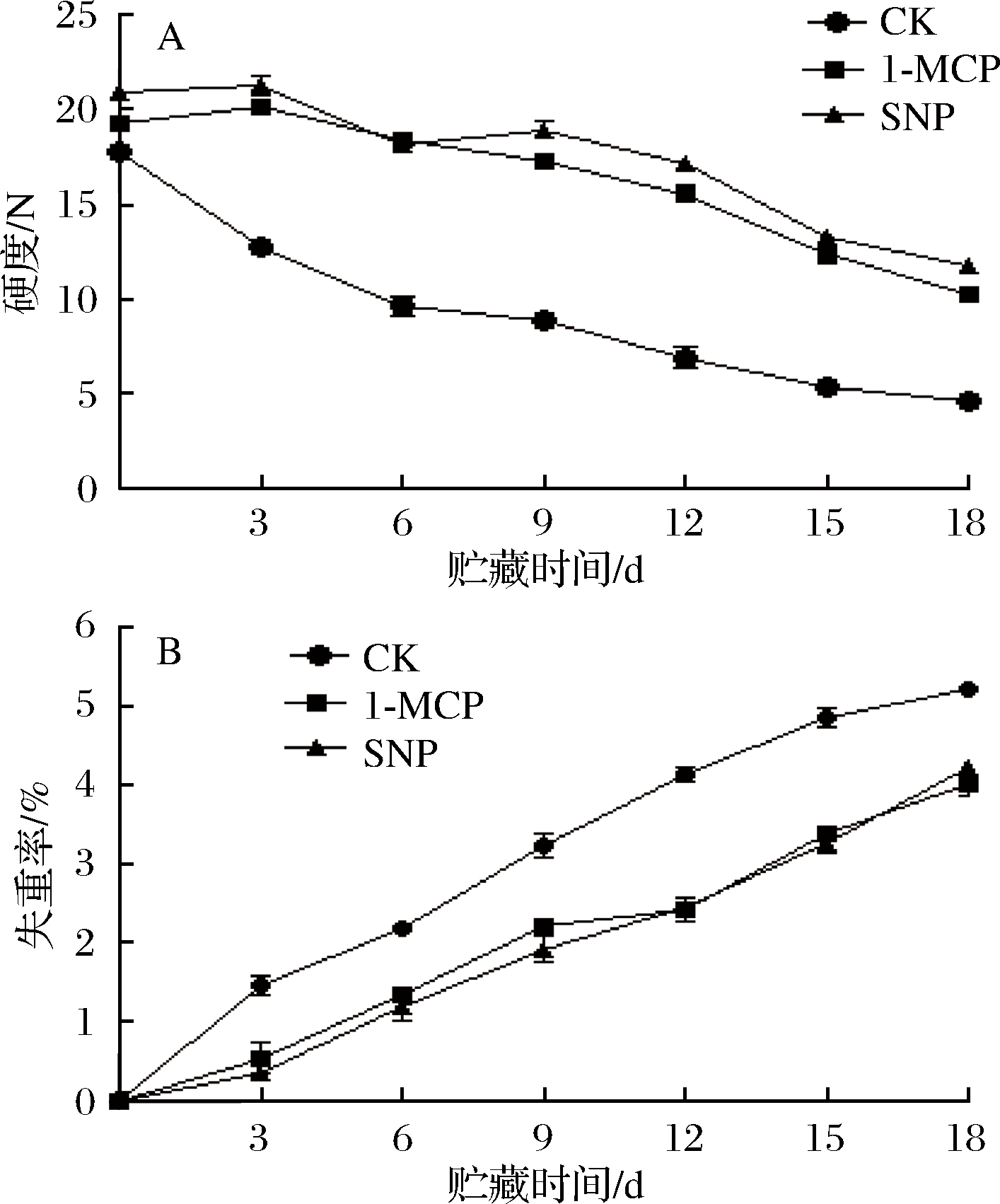
图2 不同处理对番荔枝硬度和失重率的影响
Fig.2 Effects of different treatments on firmness and fruit weight loss of Annona squamosa L.
2.3 不同处理对番荔枝营养成分的影响
由图3-A可知,0~9 d,1-MCP和SNP处理可溶性蛋白质含量迅速上升,到第9天,1-MCP处理可溶性蛋白含量达4.52 mg/g,分别是对照组、SNP处理1.4倍和1.1倍。到第18天,对照组的可溶性蛋白质含量比1-MCP和SNP处理低27.2%和21.6%,差异显著(P<0.05)。结果表明,1-MCP和SNP处理可以维持冷藏番荔枝较高的可溶性蛋白质含量,其中1-MCP能更好地提高贮藏中期果实的可溶性蛋白质含量。
可溶性糖通过呼吸代谢作用为果实组织提供能量,主要包括葡萄糖和果糖,是评价果实品质的重要指标之一[19]。由图3-B可知,对照组番荔枝采后果实糖含量总体呈缓慢下降趋势,均显著低于1-MCP和SNP处理(P < 0.05)。在第9 天,1-MCP处理可溶性糖含量达到最大值,为14.72%,分别比对照组和SNP处理高35.3%和8.0%,在0~3 d和15~18 d,1-MCP和SNP组差异不显著(P > 0.05)。表明2种处理均能保持果实可溶性糖含量且1-MCP处理有效提高贮藏中期的可溶性糖含量。
总酚和类黄酮都是植物组织产生的主要次生代谢产物,与果蔬的成熟衰老有着密切的关系[20]。同时,番荔枝总酚的含量与木质素的合成紧密相关[21]。由图3-C可知,在贮藏第0~9天,对照组总酚含量迅速上升,番荔枝果实褐变程度严重与总酚含量相关;在第9~18天,总酚含量变化平缓,且显著高于1-MCP和SNP处理(P<0.05)。1-MCP和SNP处理在贮藏前期总酚含量基本一致,在第9~18天,1-MCP组总酚含量显著低于SNP处理组(P<0.05)。
由图3-D可知,对照组类黄酮含量呈先迅速上升后缓慢下降的变化趋势,在第9天时达到最大值,是1-MCP和SNP处理组的1.63和1.58倍,在整个贮藏期间均显著高于1-MCP和SNP处理组(P<0.05)。贮藏过程中,1-MCP处理类黄酮含量较低于SNP处理,其中在第6、第12和第15天显著低于SNP处理(P<0.05)。表明1-MCP和SNP处理能有效抑制果实总酚和类黄酮含量,从而抑制木质素含量的上升,以1-MCP处理效果更佳。
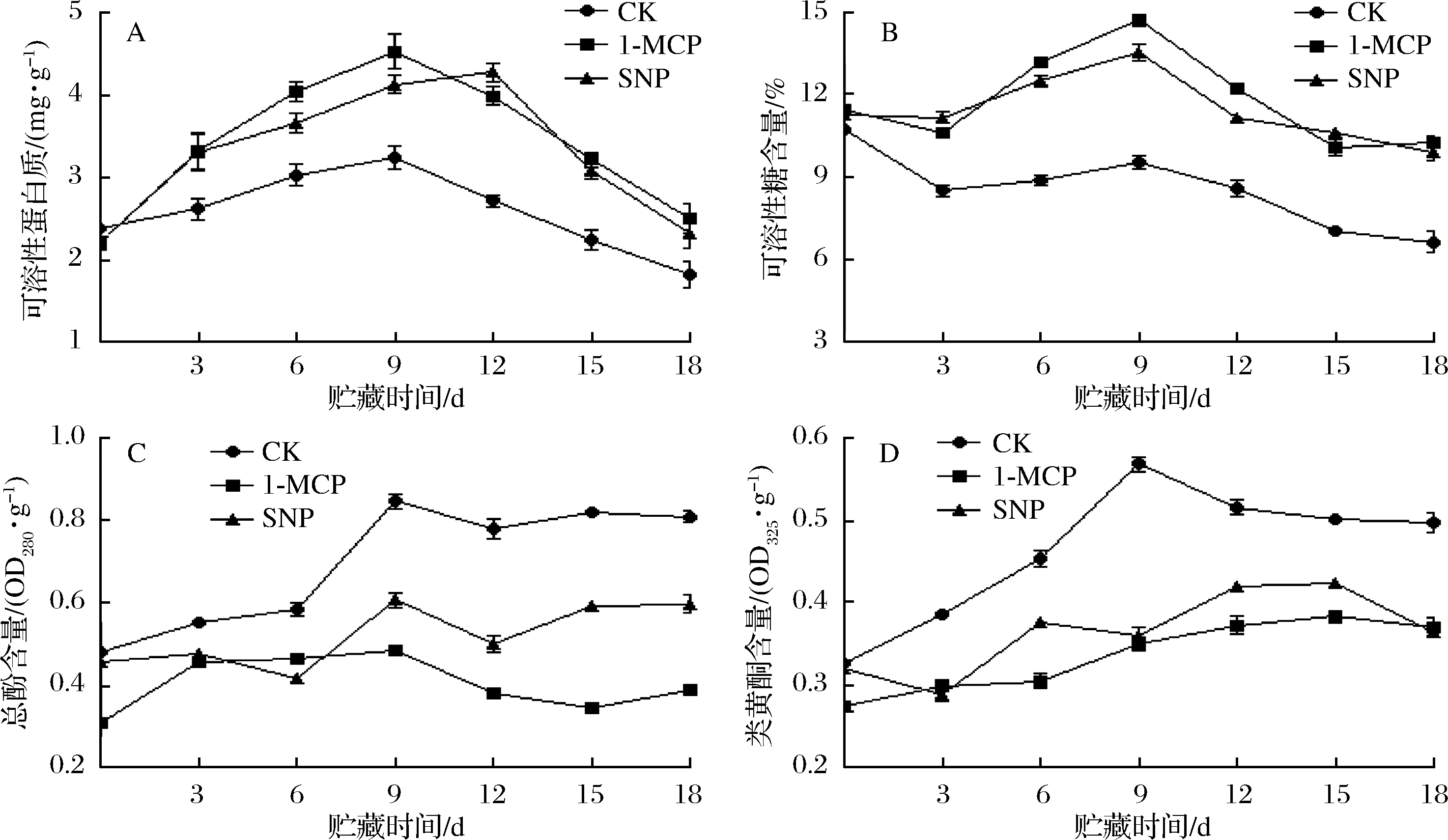
图3 不同处理对番荔枝营养成分的影响
Fig.3 Effects of different treatments on nutrient contents of Annona squamosa L.
2.4 不同处理对番荔枝木质素的影响
木质素作为植物组织的次生代谢产物,是构成细胞壁的主要成分[22],木质素的积累是导致采后果实品质劣变的主要原因之一。如图4所示,番荔枝的木质素含量逐步上升,贮藏第12天,对照组木质素含量达到最大值,1-MCP处理的1.48倍,显著高于1-MCP和SNP处理(P<0.05)。1-MCP和SNP处理木质素含量基本保持一致,在第9天,SNP处理显著高于1-MCP处理(P<0.05)。表明1-MCP和SNP处理明显抑制番荔枝果实木质素的合成,从而延缓果实木质化进程。
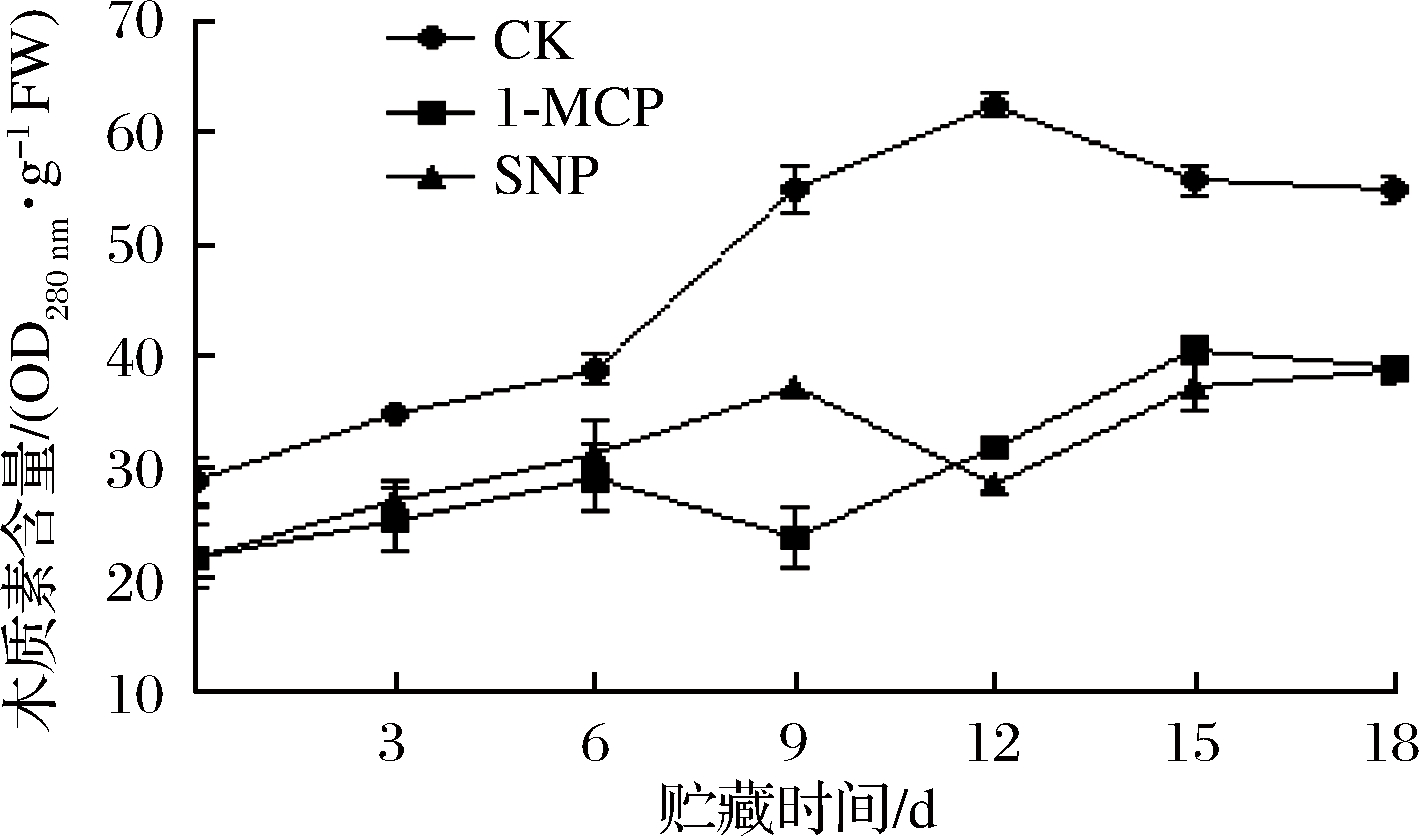
图4 不同处理对番荔枝木质素含量的影响
Fig.4 Effects of different treatments on lignin content of Annona squamosa L.
2.5 不同处理对番荔枝PAL、PPO、POD、SOD的影响
PAL是苯丙烷类物质代谢过程中的起始酶,在木质素沉积中起着重要的作用。由图5-A可知,PAL活性呈先上升后下降的趋势,对照组在贮藏第9天达峰值,为29.16 U/g,是 1-MCP和SNP处理组1.61和1.48倍;在整个贮藏过程中,对照组PAL活性始终显著高于1-MCP和SNP处理组(P<0.05),在0~9 d,1-MCP和SNP处理差异不显著(P>0.05),在12~15 d,1-MCP处理PAL活性显著低于SNP处理(P < 0.05),结果表明,1-MCP和SNP处理有利于抑制番荔枝PAL活性的增加,且1-MCP对抑制贮藏后期PAL活性较SNP处理效果更好。
PPO活性直接反映了果实的褐变情况。由图5-B 可知,在整个冷藏期间,对照组番荔枝果PPO活性均显著高于1-MCP和SNP处理组(P < 0.05),这也是对照组果实褐变程度明显高于1-MCP和SNP处理的原因。1-MCP和SNP处理PPO活性在贮藏期间呈缓慢下降的趋势,在贮藏第6~15天,1-MCP处理PPO活性显著低于SNP处理(P<0.05)。结果表明,1-MCP和SNP处理能抑制果实PPO活性,其中1-MCP处理抑制效果更佳。
POD在木质素合成过程中起关键作用,催化H2O2分解促使木质素单体聚合[23]。由图5-C可知,贮藏前3 d,番荔枝POD活性迅速增加,可以认为是果实的逆境胁迫所致,抵御自由基的伤害。对照组POD活性在第9天达到峰值,随后呈下降趋势,且显著高于1-MCP和SNP处理(P<0.05)。由此可见,1-MCP和SNP处理对冷藏番荔枝POD活性具有抑制作用,但1-MCP和SNP处理果实POD活性在贮藏过程中差异不明显(P<0.05)。
SOD是植物组织体内酶促活性氧清除系统中的细胞保护酶。由图5-D可知,SOD活性呈先上升后下降的变化趋势。在贮藏前期,1-MCP和SNP处理SOD活性无显著差异(P < 0.05),在贮藏第9天,1-MCP处理组达到峰值,为433.29 U/mgprot,分别是对照和SNP处理组的1.24和1.10倍。1-MCP和SNP处理SOD活性显著高于对照组(P < 0.05),贮藏第9~15天,1-MCP处理显著高于SNP处理(P<0.05)。表明1-MCP和SNP处理提高了冷藏番荔枝SOD活性,可以更好地清除细胞的活性氧和自由基,其中1-MCP处理更好。
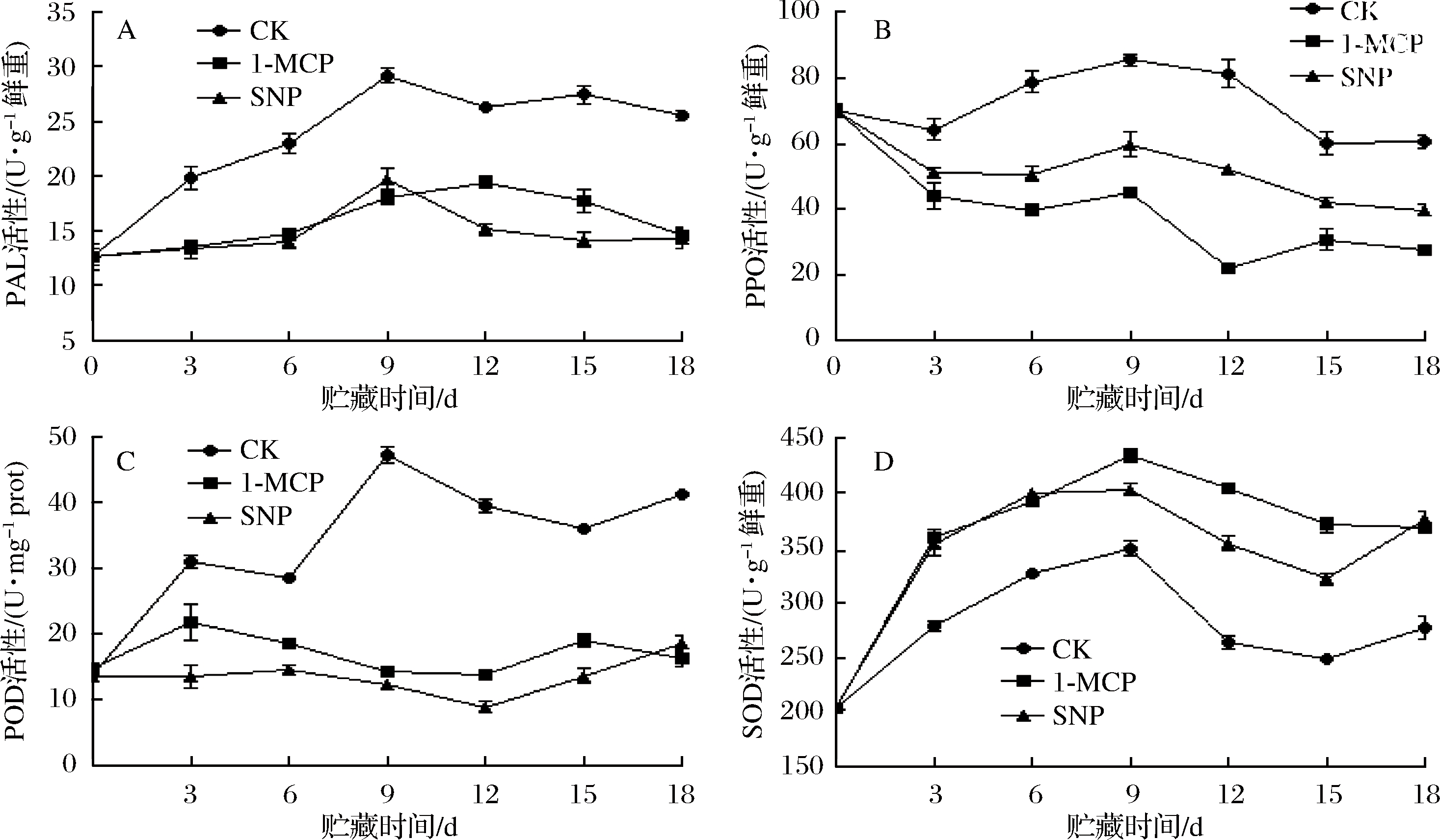
A-PAL活性;B-PPO活性;C-POB活性;D-SOD活性
图5 不同处理对番荔枝PAL、PPO、POD和SOD活性的影响
Fig.5 Effects of different treatments on the PAL, PPO,POD and SOD activities of Annona squamosa L.
3 讨论
呼吸是生命的基本特征,提供各种代谢活动所需能量。对于呼吸跃变型果实来说,当呼吸高峰出现后,果实的品质就会迅速下降,包括物理特性(硬度和失重率等)和营养指标(可溶性蛋白和糖等)。其中,木质素的形成和积累是导致番荔枝采后果实品质劣变的主要原因,已在枇杷[24]、猕猴桃[25]等果实研究可知。本试验中,1-MCP和SNP处理在贮藏过程中失重率均呈上升趋势,这可能是由于果实受到机械损伤以及成熟衰老进程中,导致水分流失,并且伴随着果实变软和果皮变黑等症状,但与对照组相比,保鲜剂处理能更好地减少果实质量损失。可溶性糖含量贮藏前期呈上升趋势,可能是由于果实在成熟阶段有机酸转化为糖类,而贮藏后期下降可能与番荔枝采后成熟衰老相关,果实为维持正常的生理活动,通过氧化分解可溶性糖,提供能量。酚类物质是木质素合成所必需的前体物质。酚类物质调控木质素合成,主要是通过氧化交联作用,增厚果实的细胞壁,导致木质化程度加剧,总酚含量前期上升可能是番荔枝果实表面受到轻微的机械损伤以及成熟阶段果实组织内酶活性提高,导致酚类物质合成加快;而贮藏后期轻微下降可能是由于酚类物质参与酶促褐变和木质素合成所消耗的量大于生成量。
番荔枝果实发生木质化现象是多种因素综合作用的结果,果肉的PAL,PPO,POD和SOD等木质素合成代谢相关酶都参与酚类物质代谢,与果实木质化的发生密切相关。其中,PAL是木质素生物合成的起始酶,催化苯丙氨酸转化为肉桂酸;PPO是酶促褐变发生的主要酶,参与酚类物质的氧化过程,从而影响木质素的合成;POD在木质素合成过程中起关键作用,催化H2O2分解氧化酚类物质;SOD广泛存在于植物体内,是酶促活性氧清除系统重要的细胞保护酶。本研究发现,1-MCP和SNP处理有利于抑制番荔枝PAL活性的增加,且1-MCP对抑制贮藏后期PAL活性较SNP处理效果更好;1-MCP和SNP处理果实的PPO活性一直保持在较低的水平,一方面是由于番荔枝果实在后熟衰老进程中,果实软熟甚至裂果时,其果肉颜色仍然洁白,另一方面可能是低温抑制了果实的呼吸作用和生物代谢;1-MCP和SNP处理对冷藏番荔枝POD活性具有抑制作用,从而减缓H2O2分解生成木质素单体;1-MCP和SNP处理提高了贮藏前期冷藏番荔枝SOD活性,可能是由于果实的抗逆境反应,从而更好地清除细胞的活性氧和自由基,当番荔枝果实开始变软时达到最高值,随后逐渐下降,其中1-MCP处理更好。
综上,1-MCP和SNP处理方式都降低了果实的呼吸速率,维持较高的硬度,可溶性蛋白和糖含量,减少质量损失,且降低了多酚和类黄酮含量,以及抑制了与木质素合成相关酶的活性,从而抑制木质素含量的上升,达到延缓木质化进程的目的。但1-MCP处理在降低果实呼吸高峰,提高贮藏中期果实的可溶性蛋白质和糖含量,抑制PAL和PPO活性,提高SOD活性,抑制木质素合成方面效果更佳。
[1] 程志华,龚霄,刘洋洋,等. 番荔枝生物学特性及其研究进展[J]. 农产品加工, 2018(15): 85-93.
[2] 郭文场,刘佳贺,李悦. 热带水果番荔枝的品种与特性[J]. 特种经济动植物, 2017, 20(3): 46-48.
[3] 张福平,陈蔚辉,林建新. 番荔枝的营养成分分析[J]. 食品研究与开发, 2002 (1): 47-48.
[4] BABU K H, ZAHEERUDDIN M D, PRASAD P K. Studies on post harvest storage of custard apple[J]. Tropical Fruit in International Trade, 1990(269):299-300.
[5] MONTHATHIP T K, WACHIRAYA I, PARICHART B, et al. The effect of 1-methylcyclopropene (1-MCP) on expression of ethylene receptor genes in durian pulp during ripening[J]. Plant Physiology and Biochemistry, 2018, 125: 232-238.
[6] 李延辉. 中国植物志[M]. 北京:科学出版社, 1979: 171.
[7] DANYEN M S, BOODIA N, SERRANO E P, et al. Effects of cutting shapes and thicknesses on the quality of minimally processed pineapple (Ananas comosus), cv. ‘Queen Victoria’[J]. International Food Research Journal, 2016, 23(2): 667-674.
[8] 胡筱,潘浪,单杨. 1-MCP作用机理及其在果蔬贮藏保鲜中的应用研究进展[J]. 食品工业科技, 2019, 40(8): 304-309.
[9] 郭芹,吴斌,王吉德,等. NO延缓果蔬成熟衰老与抗病机理研究进展[J]. 热带作物学报, 2010, 31(7): 1 212-1 217.
[10] LESHEM Y Y, WILLS R B H, KU V V V. Evidence for the function of the free radical gas-nitric oxide (NO)-as an endogenous maturation and senescence regulating factor in higher plants[J]. Plant Physiology and Biochemistry, 1998, 36(11): 825-833.
[11] DUAN Xuewu, SU Xinguo, YOU Yanli, et al. Effeect of nitric oxide on pericarp browning of harvested longan fruit in relation to phenolic metabolism[J]. Food Chemistry, 2007, 104(2): 571-576.
[12] 曹建康,姜微波,赵玉梅. 果蔬采后生理生化实验指导[M]. 北京:中国轻工业出版社, 2007: 44-70.
[13] 陈发河,张美姿,吴光斌. NO处理延缓采后枇杷果实木质化劣变及其与能量代谢的关系[J]. 中国农业科学, 2014, 47(12): 2 425-2 434.
[14] KOUKOL J, CONN E E. The metabolism of aromatic and properties of the phenylalanine deaminase of hordeum vulgare[J]. Journal Biological Chemistry, 1961, 236(10): 2 692-2 698.
[15] GALEAZZI M A M, SAGARBIERI V, COSYANTINIDES S M. Isolation, purification and physiocochemical characterization of polyphenol oxidase from dwarf variety of banana (Musa carendishii)[J]. Journal of Food Science, 1981, 46(1): 150-155.
[16] HAMMERSCHMIDT R, KUC J. Lignification as a mechanism for induced systemic resistance in cucumber[J]. Physiological Plant Pathology, 1982, 20(1): 61-71.
[17] 陈学玲,张莉会,何建军,等. 杀菌剂对鲜切西兰花的保鲜作用[J]. 现代食品科技, 2018, 34(6): 197-203.
[18] SALATO G S, PONCE N M A, RAFFO M D, et al. Developmental changes in cell wall polysaccharides from sweet cherry (Prunus avium L.) cultivars with contrasting firmness[J]. Postharvest Biology and Technology, 2013, 84: 66-73.
[19] 申德省. 鲜切雷竹笋木质化和褐变的控制研究[D]. 杭州:浙江工商大学, 2015.
[20] 刘国强,吴锦程,唐朝晖,等. 枇杷采后酚类物质代谢与果肉木质化的关系[J]. 中国农学通报, 2008, 24(1): 247-251.
[21] 周琦. 鲜切雷竹笋冷藏条件下木质化机理及其壳聚糖涂膜保鲜技术研究[D]. 武汉:武汉轻工大学, 2013.
[22] 芮怀瑾,尚海涛,汪开拓,等. 热处理对冷藏枇杷果实活性氧代谢和木质化的影响[J]. 食品科学, 2009, 30(14): 304-308.
[23] 罗晓莉. 不同处理对竹笋采后木质化及品质的影响[D]. 重庆:西南大学, 2007.
[24] XU Maojun, DONG Jufang, ZHANG Ming, et al. Cold-induced endogenous nitric oxide generation plays a role in chilling tolerance of loquat fruit during postharvest storage[J]. Postharvest Biology and Technology, 2012, 65(6): 5-12.
[25] SUO Jiangtao, LI Hua, BAN Qiuyan, et al. Characteristics of chilling injury-induced lignification in kiwifruit with different sensitivities to low temperatures[J]. Postharvest Biology and Technology, 2018, 135: 8-18.