三氯蔗糖是一种甜度高、无热量的甜味剂[1],它不被人体吸收,可供肥胖、糖尿病患者食用,是一种保健型的优质调味剂[2]。三氯蔗糖的制备过程较为复杂,包括合成蔗糖-6-乙酯,氯化和脱乙酰化[3]。其中蔗糖-6-乙酯是单基团保护法制备三氯蔗糖的重要中间体[4]。由于蔗糖-6-乙酯衍生物很多,同时这类成分基本没有紫外吸收,如何对其进行定性定量的分析一直是亟需解决的问题。
薄层色谱法(thin layer chromatography,TLC)和高效液相色谱法(high performance liquid chromatography,HPLC)[5-8]是定性定量检测蔗糖-6-乙酯的常用分析方法。薄层色谱法很早便用于蔗糖酯的分析,并且应用广泛,有文献报道以V(三氯甲烷)∶V(甲醇)=3∶2为展开剂成功监测了蔗糖-6-乙酯的反应进程[9]。喻理德等[10]采用V(丙酮)∶V(乙酸乙酯)∶V(冰醋酸)∶V(DMF)=4∶5∶0.5∶0.5)作展开剂,50 %的甲醇硫酸液作显色剂,在115℃下烘干显色,结果表示该法能较好地分离6-位及4-位蔗糖乙酸酯。薄层色谱法操作快速简便,但由于蔗糖酯本身不显色,需要配制显色剂,并且合成蔗糖-6-乙酯过程中有较多副产物,薄层色谱法难以将其很好地分离,需要其他的方法有效分离产物[11]。目前,对蔗糖-6-乙酯的检测以高效液相色谱法为主,用于蔗糖-6-乙酯的合成分析的检测器有示差折光检测器(refractive index detector,RID)和蒸发光散射检测器(evaporative light scattering detector,ELSD)。李明华等[12]利用高效液相色谱法检测在离子介质中反应的蔗糖-6-乙酯,采用示差检测器,以C18(250 mm×4.6 mm×5 μm为色谱柱,V(甲醇)∶V(水)=70∶30为流动相,定量检测了蔗糖-6-乙酯含量。陆正清等[13]制备了蔗糖-6-乙酯并用高效液相色谱进行检测,采用C18反相色谱柱,V(乙腈)∶V(水)=15∶85作流动相,准确测定了蔗糖-6-乙酯的含量并由此计算产率。相较于示差折光检测器,蒸发光散射检测器更稳定,灵敏度更高,不需要复杂的样品制备,且可梯度洗脱。目前采用蒸发光散射检测器分析蔗糖-6-乙酯的文献较少,无分析方法研究文献。为了找到方便、准确的测定方法,本试验采用HPLC-ELSD建立了蔗糖-6-乙酯含量的测定方法,并对外标法与内标法进行了比较。
1 材料与方法
1.1 仪器与试剂
固定化疏棉状噬热丝孢菌脂肪酶(TLIM酶),250 IUN/g,诺维信生物技术有限公司;蔗糖八乙酸酯(分析纯,纯度为98 %),阿拉丁试剂有限公司;蔗糖-6-乙酯(纯度>95 %),实验室自制[14];甲醇、乙腈为色谱纯,Sigma;蔗糖、乙酸乙烯酯、叔戊醇、二甲基亚砜均为化学纯,国药集团化试剂有限公司。
Agilent 1200高效液相色谱仪,美国Agilent公司;Alltech 3300蒸发光散射检测器,美国Grace公司;HH-4水浴恒温振荡器,金坛市江南仪器厂。
1.2 试验方法
1.2.1 样品的制备
称取10.3 g蔗糖(0.3 mol/L)、25.8 g(3 mol/L)乙酸乙烯酯、4 g TLIM酶、1 g 4A分子筛于250 mL具塞三角瓶中,再加入(V(叔戊醇)∶V(二甲基亚砜)=83∶17)溶剂,置于恒温摇床中,30 ℃、180 r/min的条件下反应16 h。反应结束后,反应液在3 500 r/min的条件下离心10 min,取上清液,进液相分析,每组3个平行。
1.2.2 高效液相色谱条件的选择
高效液相色谱法是一种较为普遍的分析方法,其分离度好、检测灵敏度高、方便快捷,通常与紫外检测器或示差折光检测联用[15]。由于蔗糖与蔗糖酯不含发色团,因此用紫外检测器无法检测分离;示差折光检测器虽然对糖类的检测较为灵敏,但其容易受温度与流动相的影响,并且不适用于梯度洗脱。蒸发光散射检测器是近年来使用广泛的通用型检测器,其能检测不含发色团的化合物,适用于梯度洗脱,并且成本低、操作简单、不受温度影响[16]。有文献报道糖类更适合用ELSD进行检测,其灵敏度高于示差折光检测器[17]。通过先前试验室的研究基础得知[18],蔗糖-6-乙酯的检测采用ELSD,并以水作流动相,可以在20 min内将产物和试剂洗脱。
因此本试验以HPLC-ELSD对蔗糖-6-乙酯进行检测,依次对色谱柱、流动相、柱温条件进行选择,以确定最佳HPLC分析条件。
1.2.3 外标法
1.2.3.1 线性考察
精密称取蔗糖-6-乙酯自制对照品,分别用叔戊醇配制成浓度为1.10、1.84、2.21、2.76、3.64、5.52、8.27、11.03 g/L的蔗糖-6-乙酯样品溶液,用0.22 μm微孔滤膜过滤后,依次在选定的色谱条件下进样(每个样品重复测定3次),考察蔗糖-6-乙酯峰面积及其对应的浓度的关系。
1.2.3.2 精密度考察
取同一份供试品溶液,在所建立的色谱条件下连续进样6次,记录色谱图,计算RSD值。
1.2.3.3 重复性考察
取同一样品溶液6份,按供试品制备方法进行制备,在所建立的色谱条件下测定,记录色谱图,计算RSD值。
1.2.3.4 稳定性考察
取同一份供试品溶液,室温下放置,分别于0、2、4、8、12、24 h在相同色谱条件下进行测定,记录色谱图,计算RSD值。
1.2.3.5 检出限和定量限
LOD定义为S/N=3时对应的待分析浓度,LOQ定义为S/N=10 时对应的待分析浓度。
制备浓度为0.55 g/L的对照品溶液,并取12份进行测定,分别记录其响应值,如公式(1)、(2)所示:
(1)
(2)
式中:Si,样品测量读数的标准偏差;C,样品浓度;![]() 样品测量读数平均值。
样品测量读数平均值。
1.2.4 内标法
色谱条件:检测器:ELSD;色谱柱:ZORBAX SB-Aq(4.6 mm×250 mm,5 μm);梯度洗脱流动相:0~8 min,5%甲醇,9~12 min,30%甲醇,13~22 min,75%甲醇;流速:0.8 mL/min;柱温:30 ℃;进样量:5 μL。蒸发光检测器温度:85 ℃;氮气流速:1.5 L/min。
样品溶液制备:称取0.02 g蔗糖八乙酸酯,用样品溶液溶解并定容至10 mL。经0.22 μm微孔滤膜过滤后,再经HPLC分析。
1.2.4.1 线性考察
称取蔗糖-6-乙酯对照品和0.02 g蔗糖八乙酸酯,分别用叔戊醇配制成浓度为1.10、1.84、2.21、2.76、3.64、5.52、8.27、11.03 g/L的对照品溶液。经0.22 μm微孔滤膜过滤后,依次在选定的色谱条件下进样(每个样品重复测定3次),考察各样品的峰面积及其对应的浓度的关系。
1.2.4.2 精密度考察
取同一份制备好的样品溶液,在所建立的色谱条件下连续进样6次,记录色谱图,计算RSD值。
1.2.4.3 重复性考察
取同一样品6份,按制备方法进行制备,在所建立的色谱条件下测定,记录色谱图,计算RSD值。
1.2.4.4 稳定性考察
取同一份样品溶液,室温下放置,分别于0、2、4、8、12、24 h在相同色谱条件下进行测定,记录色谱图,计算RSD值。
1.2.4.5 检出限和定量限
称取0.02 g蔗糖八乙酸酯,制备浓度为0.55 g/L的对照品溶液,并取12份进行测定,分别记录其响应值。按式(1)、(2)计算。
2 结果与分析
2.1 色谱条件的确定
2.1.1 色谱柱的选择
选定HPLC条件为:检测器:ELSD;流动相:V(甲醇)∶V(水)=10∶90;流速:0.8 mL/min;柱温:30 ℃;进样量:5 μL。蒸发光检测器温度:85℃;氮气流速:1.5 L/min。分别考察ZORBAX SB-Aq(4.6 mm×250 mm,5 μm)、ZORBAX SB-C18(4.6 mm×250 mm,5 μm)、Eclipse XDB-C18(4.6 mm×250 mm,5 μm)、Extend-C18(4.6 mm×250 mm,5 μm)对分离效果的影响。由图1可以看到,采用ZORBAX SB-C18、Eclipse XDB-C18、Extend-C18柱的色谱图中蔗糖多酯峰形矮胖、分离效果不好,而ZORBAX SB-Aq柱不仅对蔗糖、蔗糖-6-乙酯和蔗糖多酯的分离效果都较好,并且保留时间较短,因此选择ZORBAX SB-Aq进行后续试验。
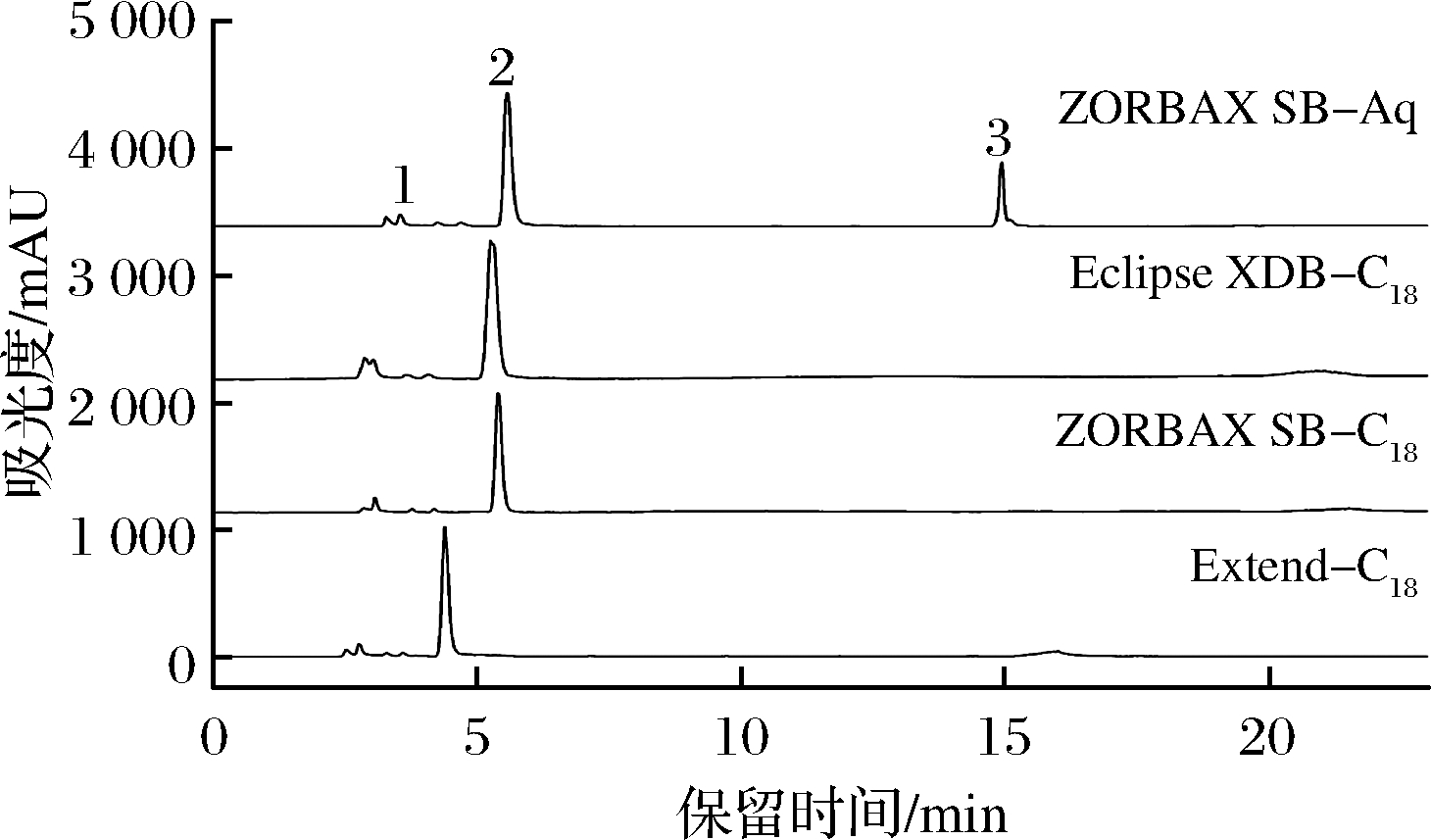
图1 不同色谱柱下的蔗糖-6-乙酯HPLC色谱图
Fig.1 HPLC chromatogram of sucrose-6-acetate under different columns
2.1.2 流动相的选择
选定HPLC条件为:检测器:ELSD;色谱柱:ZORBAX SB-Aq(4.6 mm×250 mm,5 μm);流速:0.8 mL/min;柱温:30 ℃;进样量:5 μL。蒸发光检测器温度∶85℃;氮气流速:1.5 L/min。对V(甲醇)∶V(水)=5∶95、V(甲醇)∶V(水)=10∶90、V(甲醇)∶V(水)=15∶85、V(甲醇)∶V(水)=20∶80、V(甲醇)∶V(水)=30∶70六种流动相系统进行考察。由图2可以看到,随着流动相极性减小,保留时间变短,但各组分距离变近,分离度变小,分离效果不好。但考虑超纯水保留时间较长,最后选择V(甲醇)∶V(水)=5∶95为流动相,来进行后续试验。
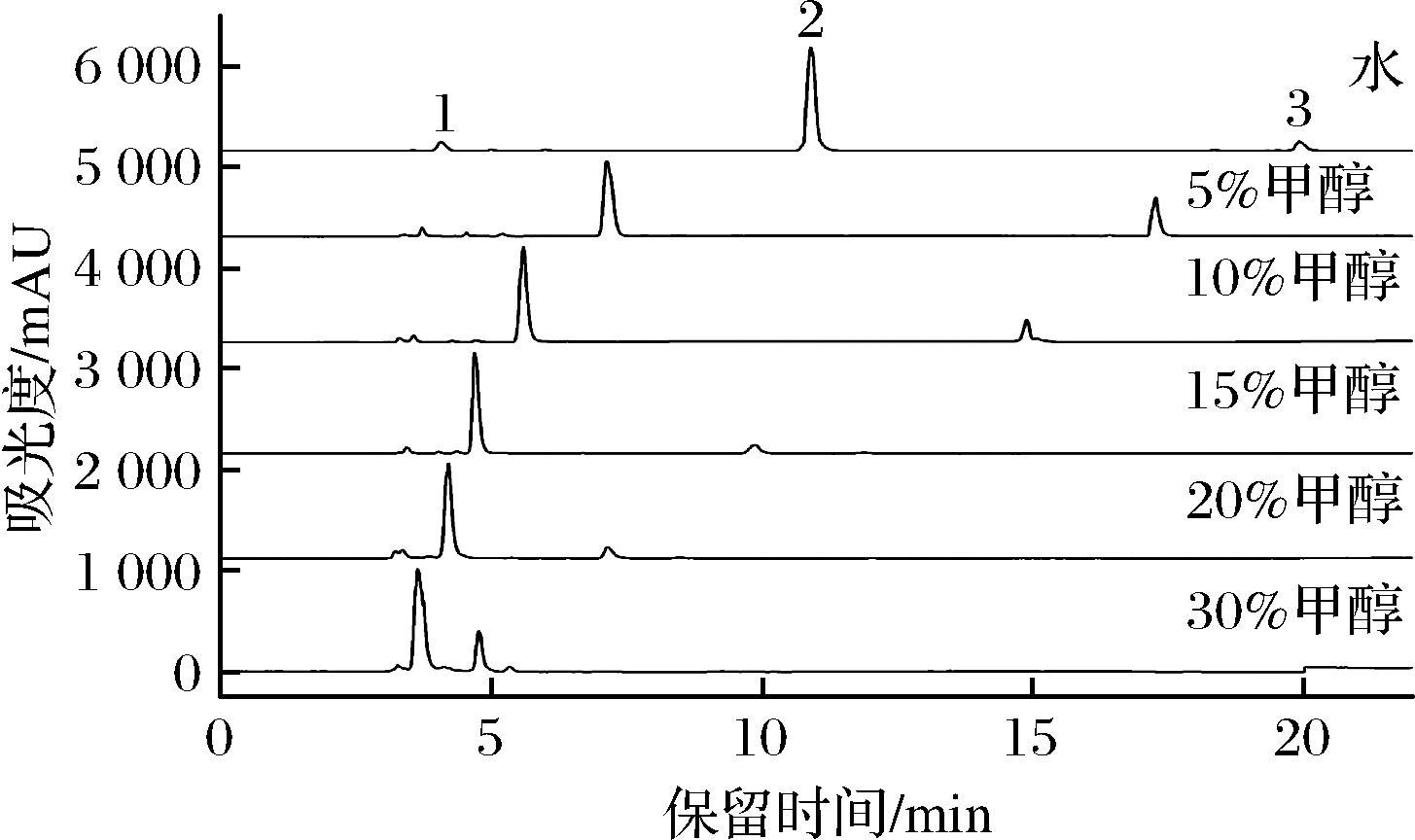
图2 不同流动相下的蔗糖-6-乙酯HPLC色谱图
Fig.2 HPLC chromatogram of sucrose-6-acetate in different mobile phases
2.1.3 柱温的选择
在2.1.2的试验条件下,分别考察柱温为:20、25、30、35、40 ℃时对分离效果的影响。如图3所示,随着温度的升高,蔗糖保留时间不变,蔗糖-6-乙酯保留时间变短,蔗糖多酯保留时间变长,同时蔗糖多酯的峰在30 ℃时分离效果较好,因此综合考虑最终选择柱温为30 ℃,进行后续试验。

图3 不同柱温下的蔗糖-6-乙酯HPLC色谱图
Fig.3 HPLC chromatogram of sucrose-6-acetate in different mobile phases
2.1.4 色谱条件的确定
样品的分离色谱图如图4所示。蔗糖保留时间为3.732 min,蔗糖-6-乙酯保留时间为7.143 min,蔗糖多酯保留时间为17.272 min。
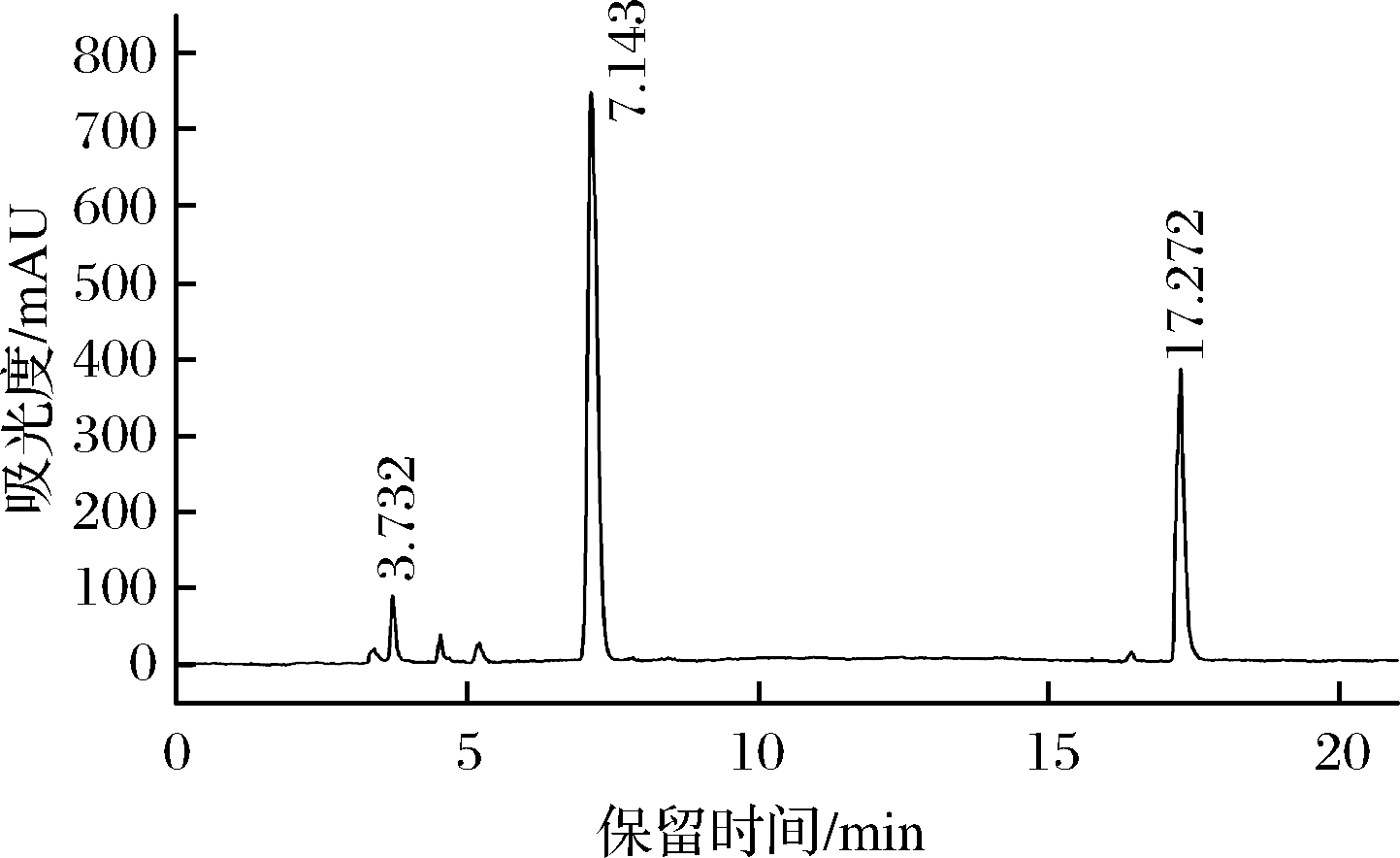
图4 蔗糖-6-乙酯样品色谱图
Fig.4 Sucrose-6-acetate sample chromatogram
2.3 外标法
2.3.1 线性考察
将不同浓度样品溶液进行HPLC分析,由于蒸发光散射检测器响应值与浓度关系较为复杂,查阅相关文献发现糖类或糖酯类的ELSD分析采用的线性关系主要有2种:浓度与峰面积直接作线性回归、浓度的对数与峰面积的对数作线性回归[15, 19-20]。于是对两种线性关系进行了比较,结果如图5所示。

a-浓度对数与峰面积对数线性回归图;b-浓度与峰面积线性回归图
图5 外标法测定蔗糖-6-乙酯标准曲线图
Fig.5 Standard curve of sucrose-6-ethyl by external standard method
结果表明将浓度与峰面积直接进行线性回归关系更加良好。图5表明,在1.10~11.03 g/L,蔗糖-6-乙酯质量浓度与其峰面积呈现良好的线性关系,回归方程为A=2 427.8C-3 355.4,相关系数为R2=0.994。
2.3.2 精密度考察
取同一份样品溶液,在优化的色谱条件下连续进样6次,测得6次试验结果如表1所示,RSD<3.0 %,表明该方法精密度好。
表1 外标法测定蔗糖-6-乙酯精密度结果
Table 1 Determination of the precision of sucrose-6-acetate by external standard method
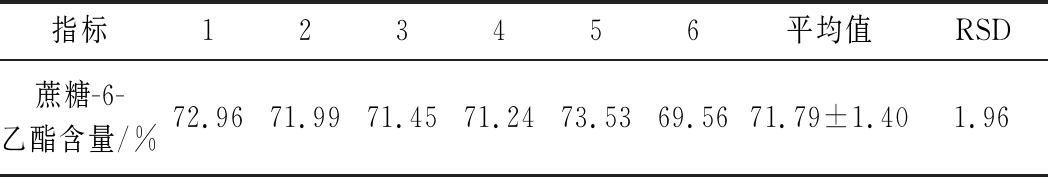
指标123456平均值RSD蔗糖-6-乙酯含量/%72.96 71.99 71.45 71.24 73.53 69.56 71.79±1.40 1.96
2.3.3 重复性考察
取同一样品6份,按供试品制备方法进行制备,在所建立的色谱条件下测定,测得试验结果如表2所示,RSD<2.0 %,表明该方法重现性良好。
表2 外标法测定蔗糖-6-乙酯重复性结果
Table 2 Determination of the repeatability of sucrose-6-acetate by external standard method
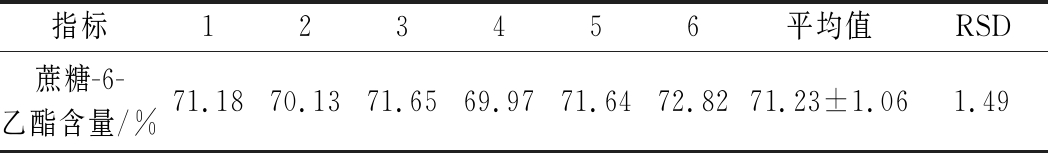
指标123456平均值RSD蔗糖-6-乙酯含量/%71.18 70.13 71.65 69.97 71.64 72.82 71.23±1.06 1.49
2.3.4 稳定性考察
取同一份供试品溶液,室温下放置,分别于0、2、4、8、12、24 h在相同色谱条件下进行测定,对含量的变化情况进行计算分析,结果如表3所示。由表可知,其RSD<2.0 %,说明在24 h内该检测方法稳定可靠。
表3 外标法测定蔗糖-6-乙酯稳定性结果
Table 3 Determination of the stability of sucrose-6-acetateby external standard method

指标0 h2 h4 h8 h12 h24 h平均值RSD蔗糖-6-乙酯含量/%63.55 64.66 65.41 63.61 63.88 64.43 64.26±0.72 1.12
2.3.5 检出限和定量限
将12份浓度为0.55 g/L的样品进行测定,记录峰面积,计算得到LOD=53.05 μg/mL,LOQ=176.83 μg/mL。
2.4 内标法
样品与内标的分离色谱图如图所示。蔗糖保留时间为3.796 min,蔗糖-6-乙酯保留时间为6.856 min,蔗糖多酯保留时间为10.630 min,蔗糖八乙酸酯保留时间为17.813 min。
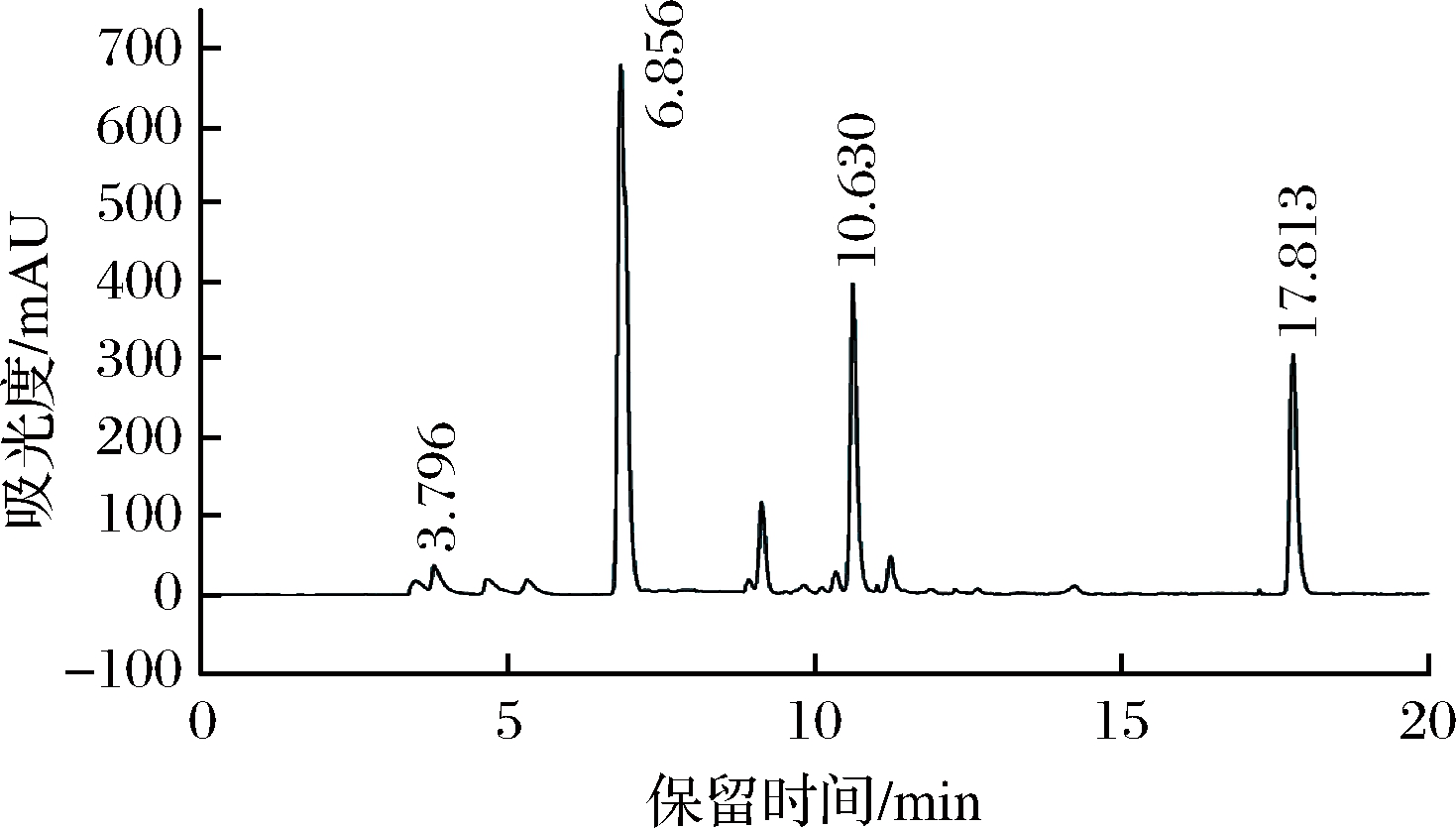
图6 内标法测定蔗糖-6-乙酯样品色谱图
Fig.6 Chromatogram of sucrose-6-acetate sample by internal standard method
2.4.1 线性考察
将不同浓度样品溶液进行HPLC分析,分别作了浓度与峰面积的线性回归和浓度对数与峰面积对数的线性回归(图7)。
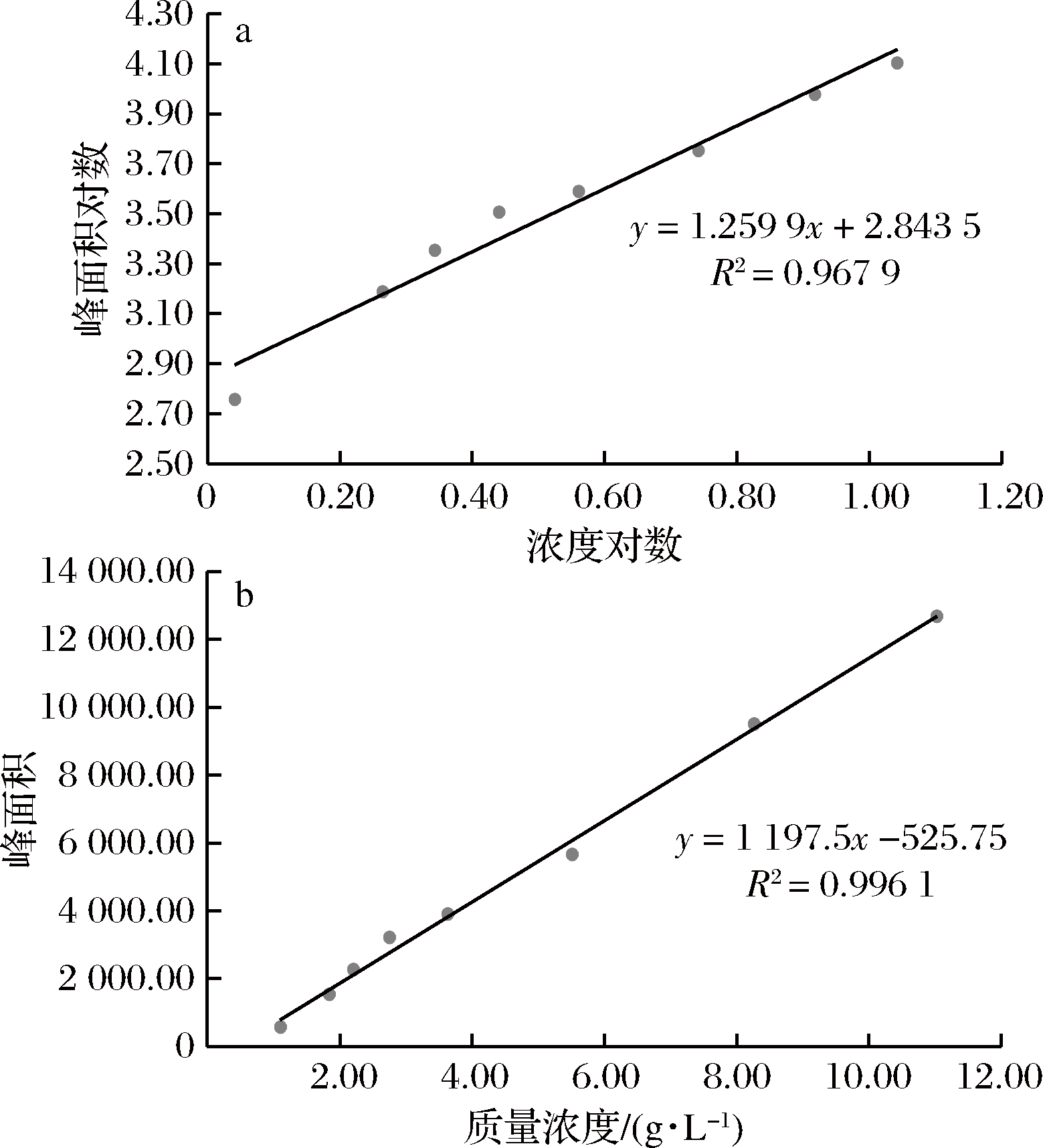
a-浓度对数与峰面积对数线性回归图;b-浓度与峰面积线性回归图
图7 内标法测定蔗糖-6-乙酯标准曲线图
Fig.7 Standard curve of sucrose-6-ethyl by internal standard method
经过比较浓度与峰面积的线性关系和浓度的对数与峰面积的对数的线性关系,结果表明,将浓度与峰面积直接进行线性回归关系更加良好。在1.10~11.03 g/L,蔗糖-6-乙酯质量浓度与其峰面积呈现良好的线性关系,回归方程为A=1 197.5C-525.75,相关系数为R2=0.996 1。
2.4.2 精密度考察
取同一份样品溶液,在内标法色谱条件下连续进样6次,测得6次试验结果如表4所示,RSD<1.0 %,表明该内标法精密度很好。
表4 内标法测定蔗糖-6-乙酯精密度结果
Table 4 Determination of the precision of sucrose-6-acetateby internal standard method
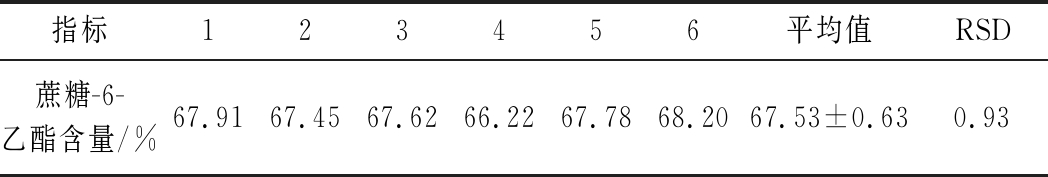
指标123456平均值RSD蔗糖-6-乙酯含量/%67.9167.4567.6266.2267.7868.2067.53±0.630.93
2.4.3 重复性考察
取同一样品溶液6份,按制备方法进行制备,在内标法色谱条件下测定,测得试验结果如表5所示,RSD 1.0 %,表明该方法重复性良好。
表5 内标法测定蔗糖-6-乙酯重复性结果
Table 5 Determination of the repeatability of sucrose-6-acetate by internal standard method
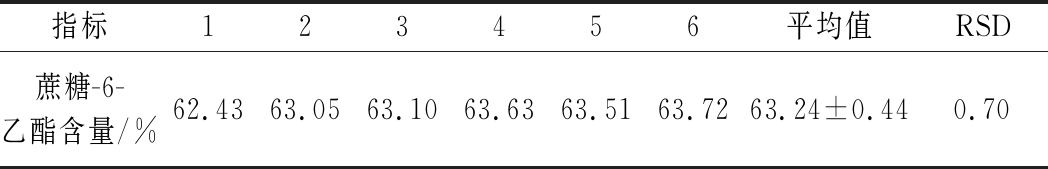
指标123456平均值RSD蔗糖-6-乙酯含量/%62.43 63.05 63.10 63.63 63.51 63.72 63.24±0.440.70
2.4.4 稳定性考察
取同一份样品溶液,室温下放置,分别于0、2、4、8、12、24 h在相同色谱条件下进行测定,对样品含量的变化情况进行计算分析,结果如表6所示。RSD<2.0 %,说明在24 h内该检测方法稳定可靠。
表6 内标法测定蔗糖-6-乙酯稳定性结果
Table 6 Determination of the stability of sucrose-6-acetateby internal standard method

指标0 h2 h4 h8 h12 h24 h平均值RSD蔗糖-6-乙酯含量%63.7063.1060.9062.3163.3760.9162.38±1.121.80
2.4.5 检出限和定量限
将12份质量浓度为0.55 g/L的对照品任溶液进行测定,记录峰面积,计算得到LOD=31.04 μg/mL,LOQ=103.46 μg/mL。
3 结论
本文对蔗糖-6-乙酯的检测分析方法进行了条件优化,建立了能够快速准确测定蔗糖-6-乙酯的高效液相色谱-蒸发光散射检测方法(HPLC-ELSD)。首次对检测蔗糖-6-乙酯所建立的分析方法进行了方法学验证,得到较好的结果。同时通过HPLC-ELSD进行内标法和外标法检测,并对两种方法进行比较,结果表明2种方法各项指标都能满足试验室要求。其中外标法无需前处理,可以通过标准曲线直接计算含量,更简便快速;相比较而言,内标法可以一定程度上抵消大多外界条件的影响,因而更准确,而且内标法可以在无标准品情况下进行检测,优越性更高。因此可以根据试验室条件与需求对两种方法进行选择。与现有的检测蔗糖-6-乙酯的分析方法相比,本文所建立的分析方法稳定、快捷、方便、准确,并且所做的方法学验证确保了该分析方法的可靠性,为蔗糖酯的检测分析提供了参考。
[1] XU Y, LIN Z, WANG Y, et al. The UV/peroxymonosulfate process for the mineralization of artificial sweetener sucralose[J]. Chemical Engineering Journal, 2017, 317: 561-569.
[2] 赵淑芹,鲍忠剑,蒋鑫,等. 人工甜味剂三氯蔗糖生物安全性的研究进展[J]. 中国临床药理学杂志,2018,34(22): 2 678-2 680.
[3] SUN J, CHEN L, LOU B, et al. Acetylation and deacetylation for sucralose preparation by a newly isolated Bacillus amyloliquefaciens WZS01[J]. Journal of Bioscience & Bioengineering, 2017, 123(5): 576-580.
[4] LABARE M P, ALEXANDER M. Microbial cometabolism of sucralose, a chlorinated disaccharide, in environmental samples[J]. Applied Microbiology and Biotechnology, 1994, 42(1): 173-178.
[5] YAN W, WANG N, ZHANG P, et al. Analysis of sucrose acetates in a crude 6-O-acetyl sucrose product by on-line hydrolysis-high-performance liquid chromatography with pulsed amperometric detection[J]. Journal of Chromatography A, 2016,1449: 71-77.
[6] YANG X, ZHENG P, NI Y, et al. Highly efficient biosynthesis of sucrose-6-acetate with cross-linked aggregates of Lipozyme TL 100 L[J]. Journal of Biotechnology, 2012, 161(1): 27-33.
[7] 孙杰,陈梁,娄波,等. 催化蔗糖-6-乙酸酯合成的微生物筛选和培养条件优化[J]. 发酵科技通讯, 2016, 45(3): 147-151.
[8] HAN Y, LIU G, HUANG D, et al. Study on the synthesis of sucrose-6-acetate catalyzed by fructosyltransferase from Aspergillus oryzae[J]. New Biotechnology, 2011, 28(1): 14-18.
[9] 孟慧琴,晏日安,何志荣. 三氯蔗糖制备过程中分析监控方法的研究[C]. 广东省分析化学研讨, 2010: 5.
[10] 喻理德,黄绍华,胡晓波. 蔗糖-6 -乙酸酯合成过程的薄层层析研究[J]. 江西化工, 2001(4): 34-36.
[11] 王利宾,李文林,何江,等. 蔗糖多酯的合成及分析研究进展[J]. 中国油脂, 2009, 34(6):39-43.
[12] 李明华,孟秀梅,吴金山,等. 离子液体介质中脂肪酶催化合成蔗糖-6-乙酯工艺优化[J]. 中国食品添加剂, 2016(11): 82-87.
[13] 陆正清,沈彬,张满. 原酸酯法制备蔗糖- 6- 乙酸酯的研究[J]. 食品研究与开发, 2006,27(11): 20-22.
[14] 刘敏. 脂肪酶催化合成蔗糖-6-乙酯的选择性研究[D]. 杭州:浙江工业大学, 2011.
[15] 兰梅娟,徐勇士,杨旭. HPLC-ELSD分析超声法合成月桂酸蔗糖酯的含量[J]. 甘蔗糖业, 2016(6): 53-58.
[16] PATR CIA P K G C, THA
CIA P K G C, THA S D M, THA
S D M, THA S F C S, et al. Development and validation of HILIC-UHPLC-ELSD methods for determination of sugar alcohols stereoisomers and its application for bioconversion processes of crude glycerin[J]. Journal of Chromatography A, 2019, 1 589: 56-64.
S F C S, et al. Development and validation of HILIC-UHPLC-ELSD methods for determination of sugar alcohols stereoisomers and its application for bioconversion processes of crude glycerin[J]. Journal of Chromatography A, 2019, 1 589: 56-64.
[17] LIU X, AI N, ZHANG H, et al. Quantification of glucose, xylose, arabinose, furfural, and HMF in corncob hydrolysate by HPLC-PDA-ELSD[J]. Carbohydrate Research, 2012, 353: 111-114.
[18] ZHONG X, QIAN J, LIU M, et al. Candida rugosa lipase-catalyzed synthesis of sucrose-6-acetate in a 2-butanol/buffer two-phase system[J]. Engineering in Life Sciences, 2013, 13(6): 563-571.
[19] 孙胜斌,陈翔宇,王文鹏,等. HPLC-ELSD法测定丹参注射液中单糖含量[J]. 亚太传统医药, 2018,14(1): 22-24.
[20] 黄明军,杨新河,覃彩芹,等. HPLC-ELSD法测定黑茶中单糖和双糖的含量[J]. 食品工业, 2017,38(1): 306-310.