黄曲霉毒素B1(Aflatoxin B1,AFB1)是各种黄曲霉毒素中危害最大最受关注的毒素,早在1993年就被国际癌症研究机构(IARC)划定为Ⅰ类致癌物[1-2]。AFB1广泛存在于花生、玉米等油料作物中,对人类健康和牲畜安全造成了严重威胁[3]。在我国,花生油作为产量和消费量最大的植物油脂之一,其质量安全问题备受关注。因花生在贮运过程中易受黄曲霉等微生物的侵染,加工后的花生油若不经去毒处理,易含超标的黄曲霉毒素(主要为AFB1),因此许多国家和组织都对AFB1在花生油中的限量标准做出了严格规定[4],我国现行标准GB 2761—2017[5]中规定:花生油、花生及其制品中的AFB1检出量≤20 μg/kg;而欧盟更加严格地限定为≤2 μg/kg[6]。严格的限定标准意味着需要更精准的检测技术作为支持,因此研究建立灵敏、准确、快速的黄曲霉毒素检测方法,具有广阔的应用前景和重要的现实意义。
目前基于电化学的AFB1检测法拥有快速、灵敏等显著优势,尤其是以电化学传感器为基础的各种检测技术是近几年的研究热点。利用标记抗体、适配体、酶等生物分子作为识别元件构建的电化学免疫传感器[7]、电化学适体传感器[8-9]、电化学酶传感器[10-11]具有快速、高灵敏度、高特异性的检测特性,但是样品的前处理过程以及敏感元件与靶标物质的反应时间仍然较长。
交流电动(AC electrokinetics,ACEK)可以通过交流电场作用对被测分子进行富集并促进其与捕获元件的快速、充分结合,提升检测速度、灵敏度和可靠性[12]。使用ACEK作为待测物的富集方法,通过电容变化来判断被测物的反应情况,目前已被用于检测蛋白质[13],双酚A[14-15],黄体酮[16]等物质,但在食品安全尤其是真菌毒素检测中目前尚未有研究。
本研究采用微电极上负载抗AFB1单抗的形式,引入交流电信号,使被测液体产生局部流体运动,促进AFB1分子的定向运动和富集,通过测定微电极上抗原-抗体结合前后的电容变化来对AFB1进行定量,从而开发出基于ACEK电容式感应原理的快速、高灵敏检测AFB1的免疫传感方法,尤其适用于食用油等液态食品中AFB1的快速前处理及检测,实现花生油中AFB1的快速高灵敏检测,同时为微芯片的商品化应用打下基础。
1 材料与方法
1.1 材料与试剂
黄曲霉毒素(Aflatoxin,AF)标准品(AFB1、AFB2、AFG1、AFM1);赭曲霉毒素A(Ochratoxin A,OTA)、玉米赤霉烯酮(Zearalenone,ZEN)、脱氧雪腐镰刀菌烯醇(Deoxynivalenol,DON),新加坡Pribolab公司;抗AFB1单克隆抗体(6 mg/mL),北京沫之东生物技术有限公司;硫脲(thiourea,TU),阿拉丁试剂(上海)有限公司;戊二醛(glutaric dialdehyde,GA)、丙酮、无水乙醇、Na2HPO4·12H2O、NaH2PO4·2H2O,成都市科龙化工试剂厂;6-巯基己醇(MCH),阿达玛斯试剂有限公司;Super Block-Blocking Buffer,赛默飞世尔科技(中国)有限公司;压榨花生油,当地市售。所有试剂均为分析纯,试验用水为超纯水。
1.2 仪器与设备
E4990A阻抗分析仪(20 Hz-110 MHz),德科技(中国)有限公司;CHI610E电化学工作站,上海辰华仪器有限公司;叉指金微电极阵列芯片(金电极宽度为5 μm,厚度约 100~200 nm,指间距为5 μm,成对的金电极周期性地分布在石英基底上形成电极阵列,四周以陶瓷作为边界材料构建免疫反应室微腔,该微腔尺寸约为 4.5 mm×3 mm×1 mm,固定于可连仪器进行检测的配套芯片),重庆微奥云生物技术有限公司;KW-4AC紫外固化机,上海凯美特功能陶瓷技术有限公司;KQ3200DV型数控超声波清洗器,昆山市超声仪器有限公司。
1.3 方法
1.3.1 AFB1免疫传感器的构建和电信号表征
微电极芯片经丙酮浸泡20 min,无水乙醇、超纯水依次冲洗20 s后氮气吹干,紫外固化机对电极表面改性20 min后浸入250 mmol/L TU水溶液中,室温放置24 h后超纯水冲洗晾干,滴加10 μL 5%(GA与水的体积比)的GA水溶液,25 ℃放置10 min,10 μL 1 mmol/L pH 7.0的PBS溶液清洗2~3次,吸水纸吸干后滴加10 μL、10 μg/mL的抗AFB1单抗溶液,25 ℃放置18 h,PBS清洗2~3次后用吸水纸吸干,再滴加10 μL、10%Super Block室温放置30 min,PBS清洗2~3次,吸水纸吸干。
在前述每一步骤修饰后的微电极芯片中滴加10 μL PBS,使用电化学工作站cyclic voltammetric(CV)扫描模式,在-0.6~+0.6 V电位范围,以50 mV/s对微电极芯片进行电信号表征。
1.3.2 TU、GA修饰浓度和时间对传感及富集效果的影响研究
依据1.3.1对芯片进行预处理后滴加10 μL PBS,用阻抗仪测定电极表面电容值Cz,对TU的修饰浓度和时间、GA的修饰浓度和时间等进行研究,相应处理后测定电极表面电容值Ci,根据公式(1)计算电容变化率[15-17]:
电容变化率![]()
(1)
式中:Ci修饰ih后的电极表面电容值;Cz修饰0 h后的电极表面电容值。
各因素研究条件如下:
TU浓度:10、25、50、100、250、500 mmol/L
TU修饰时间:0.5、1、3、6、12、24、36、48 h
GA浓度:1%、5%、10%(GA与水的体积比)
GA修饰时间:5、10、20、30、60、120 min
1.3.3 抗AFB1单抗修饰浓度和时间对传感及富集效果的影响研究
研究不同AFB1单抗浓度(1、2、3、6、10、20 μg/mL)和孵育时间(3、6、12、18、24 h)对传感及富集效果的影响。处理已修饰好TU和GA的芯片,封闭后用阻抗仪测定芯片表面电容C0。之后滴加固定浓度的AFB1标准品溶液,待免疫反应结束后再次测定芯片表面电容C,根据(2)式计算归一化电容变化率(dC/dt(%/min))[15, 17]。
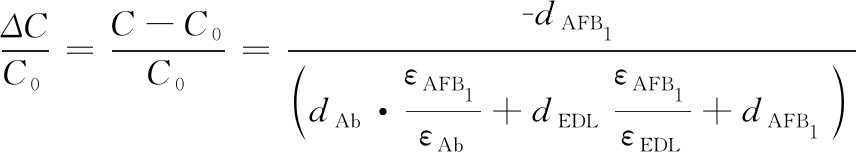
(2)
式中:C0,免疫反应前电极表面电容;C,免疫反应后电极表面电容;dAFB1、dAb和dEDL分别为目标物AFB1、特异性抗AFB1单抗和双电层的厚度;εAFB1、εAb和εEDL分别为目标物AFB1、抗体和样品溶液的介电常数。
1.3.4 抗AFB1单抗修饰浓度和时间对传感及富集效果的影响研究
将交流电频率(0.5、1、3、5、50 kHz)和电压(5、10、50、100、200、300 mV)分别作为变量,施加在构建好的免疫传感器上,测定固定浓度的AFB1标准品溶液,测定免疫反应前后的芯片表面电容C0和C,根据(2)式计算归一化电容变化率,并设置空白组,以测定背景液的电容响应值。
1.3.5 实际样品检测
称取1.00 g花生油,加入3 mL正己烷和5 mL 70%甲醇水溶液,超声功率60%处理10 min,10 000 r/min离心10 min,取下层溶液10 μL用PBS稀释100倍,取10 μL滴加于处理好的微电极芯片表面,在交流频率和电压分别为3 kHz和50 mV的条件下,用阻抗分析仪检测免疫反应前后电极表面电容,根据(2)式计算归一化电容变化率,利用线性关系式计算出AFB1含量。
2 结果与分析
2.1 AFB1免疫传感器的构建与表征
电极表面修饰过程如图1所示。TU首先与金电极反应形成硫金键;继而GA中的醛基与TU中的氨基发生缩合反应;最后GA另一端暴露的醛基与抗体中氨基进行席夫碱反应,从而将抗体固定在电极表面。
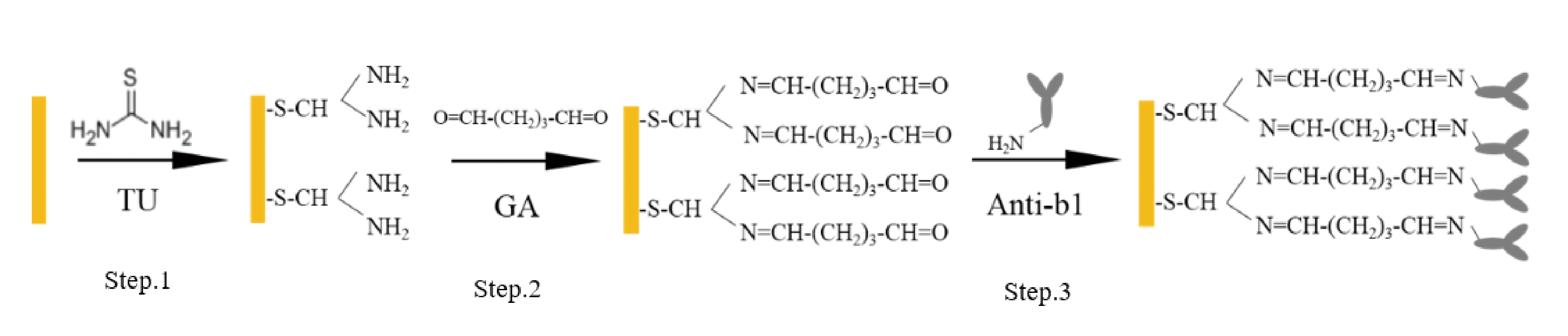
图1 免疫传感器构建示意图
Fig.1 Immunosensor construction diagram
用1.3.1中的方法对电极进行表征,由图2可知,当工作电极为裸金电极时,响应电流最大, 而TU通过巯基自组装到金电极上后响应电流减小,表明金电极表面形成了有序、致密的巯基单层膜,使得金电极表面电阻增大,从而使响应电流减小。当电极上TU的氨基与GA的醛基结合后,形成的修饰膜电阻继续增大,电流继续减小。抗AFB1单抗与封闭蛋白通过氨基与GA尾端的醛基共价结合后,电极响应电流均进一步减小,因为蛋白是非导电物质,会使电极电阻持续增大。
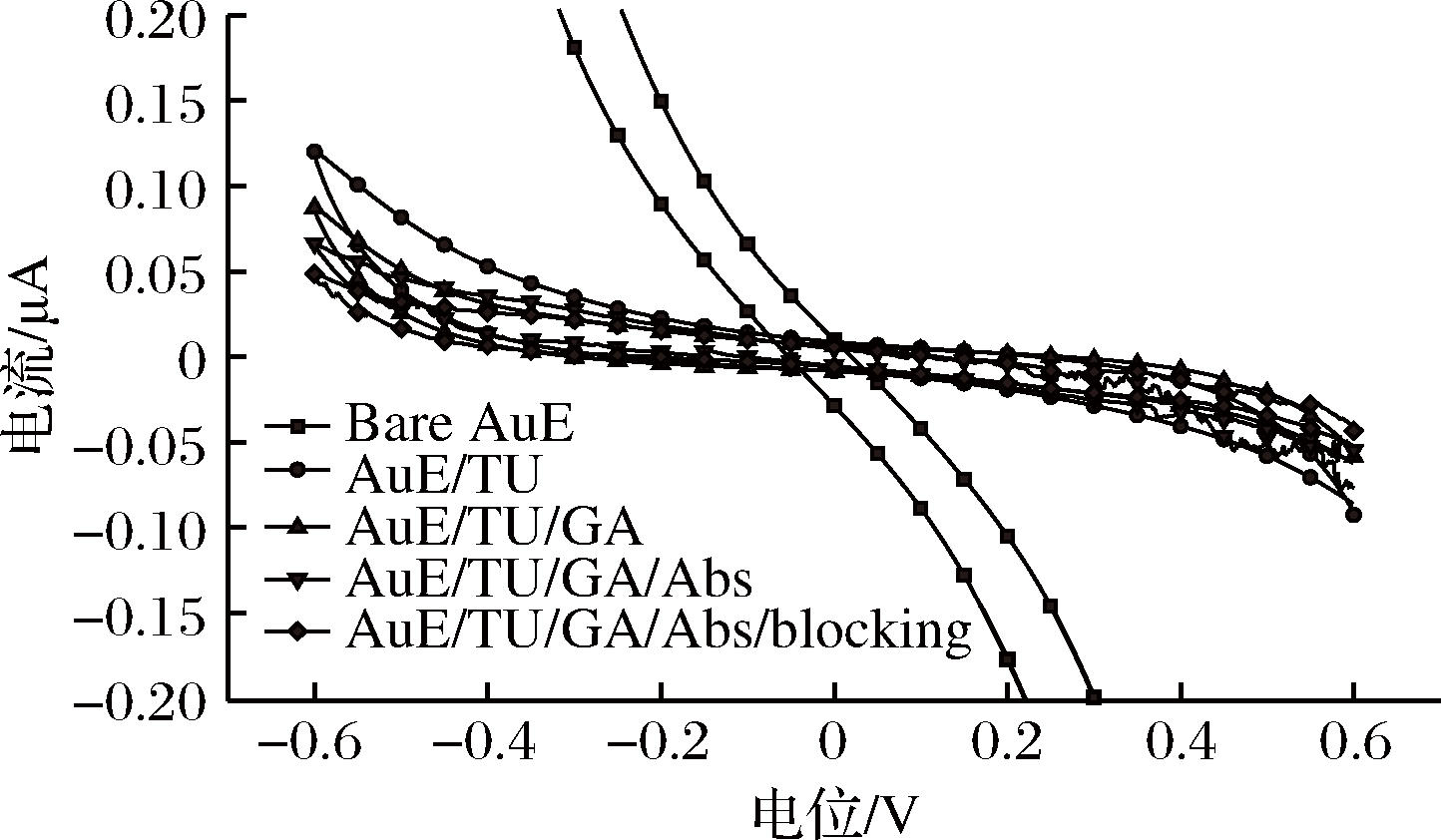
图2 修饰电极的循环伏安法表征
Fig.2 Cyclic voltammetric characterization of modified electrode
2.2 传感及富集效果的影响因素研究
2.2.1 TU修饰浓度及时间
由图3-a可知,0~250 mmol/L的TU修饰电极24 h,电容变化率一直减小,说明TU的浓度越高,固定在电极表面的分子就越多,导致界面双电层厚度不断增加,电容也就随之减小。在TU浓度达到250 mmol/L后电容变化率趋于稳定,说明250 mmol/L浓度的TU可能使电极表面位点基本被占满,达到饱和状态。
由图3-b可知,固定TU浓度为250 mmol/L,修饰时间少于6 h时,电容变化率逐渐增加,说明TU分子不断固定在电极表面,电极表面的界面双电层电容逐渐增大,但由于时间较短,排布不均,此时双电层电容器的面积变化是制约电容变化的主要因素,电容随着电极表面积的增加而增大;修饰时间大于6 h时,电容变化率开始减小,说明此时TU排布趋于均匀,表面电容主要受双电层厚度变化影响,随着更多TU分子的均匀组装,电极表面的界面双电层厚度增大,电容减小;修饰时间达到24 h以上,电容变化率趋于稳定,表明TU已较均匀地固定在电极表面。故TU修饰浓度和时间分别确定为250 mmol/L、24 h。
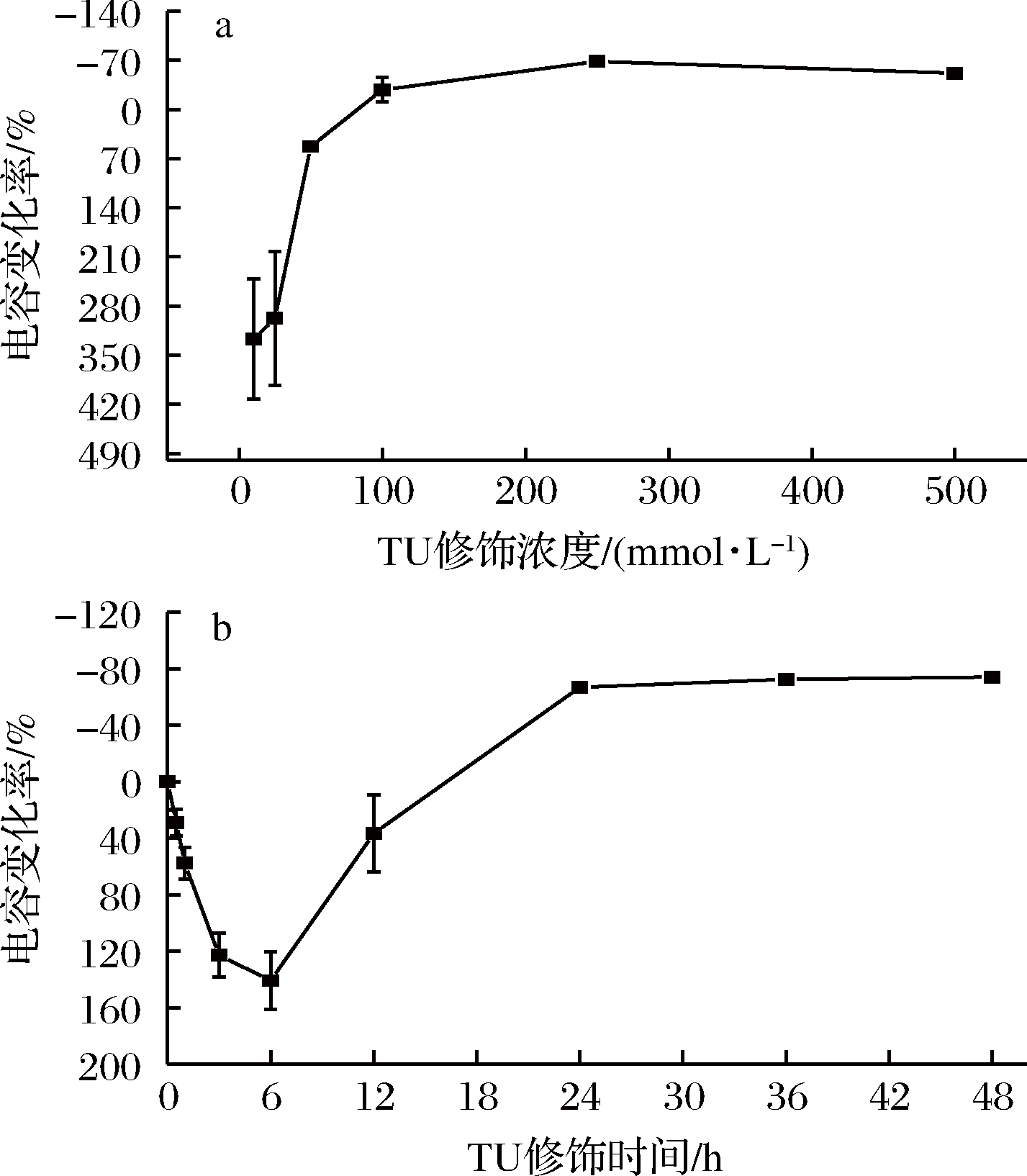
图3 TU不同修饰浓度及时间对电极表面电容变化率的影响
Fig.3 Effect of different modification concentration and time of TU on the change rate of surface capacitance
2.2.2 GA修饰浓度及时间
由图4可知,从修饰时间上看,电容变化率均随着时间的延长先增后减,这是由于双电层电容器的面积大小及界面双电层厚度两者同时制约电容的变化,随着时间的推移,主导因素由电容器的面积逐渐转向双电层厚度。10 min是电容变化率由增到减的转折点,说明此时界面双电层电容器的面积最大,可以提高抗体的固定量并最大程度保持抗体抗原结合能力,因此GA的修饰时间确定为10 min。
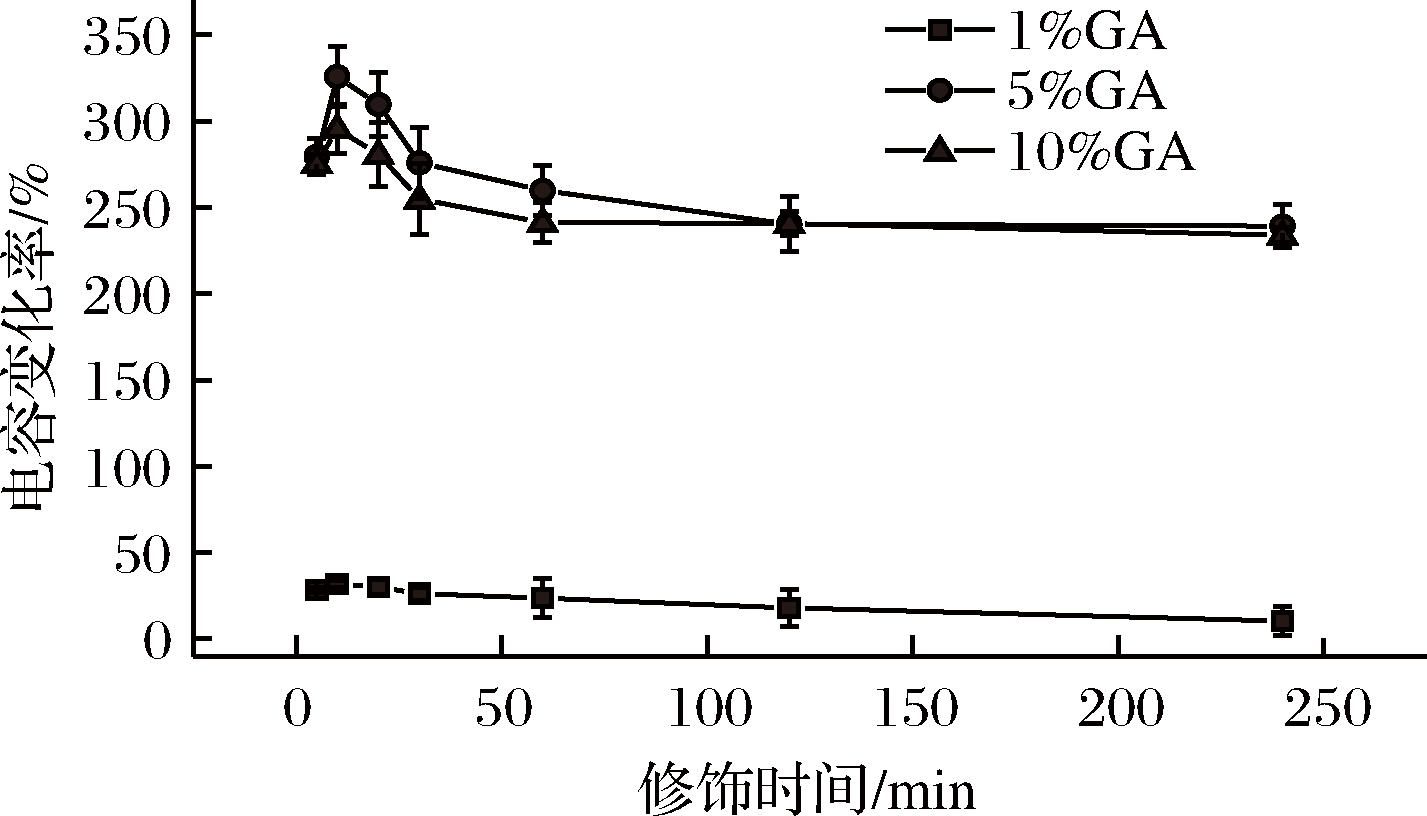
图4 GA不同修饰浓度及时间对电极表面电容变化率的影响
Fig.4 Effect of different modification concentration and time of GA on the change rate of surface capacitance
从GA的浓度上看,在GA修饰时间为10 min时,电容变化率的大小关系为5% GA>10% GA>1% GA,表明随GA浓度增加,电容变化率呈现先增后减的趋势,同样,当GA浓度较小时,界面双电层电容器的面积变化占主导地位,面积增大使得电容增大,当GA浓度增大时,双电层厚度变化占主导地位,厚度增加使得电容减小。同时,GA的浓度对抗体的交联有很大的影响,浓度过低会使交联的抗体量降低,浓度过高又会使交联的抗体失活[18]。在5%和10%浓度的GA修饰下,电容变化率差距不大,说明当浓度大于5%时,GA的结合开始接近饱和的状态,因此最终GA浓度确定为5%。
2.2.3 抗AFB1单抗包被浓度及时间
使用AFB1标准品进行免疫反应后的信号值与背景液信号值的差异代表了电极上抗原-抗体结合物的数量,侧面反映了抗体在芯片上的包被情况,如图5所示,单抗浓度为10 μg/mL,包被时间为18 h时免疫反应后的信号值与背景液的信号值归一化计算后差值最大,说明此时芯片上可结合的靶标物质最多,检测效果最好。
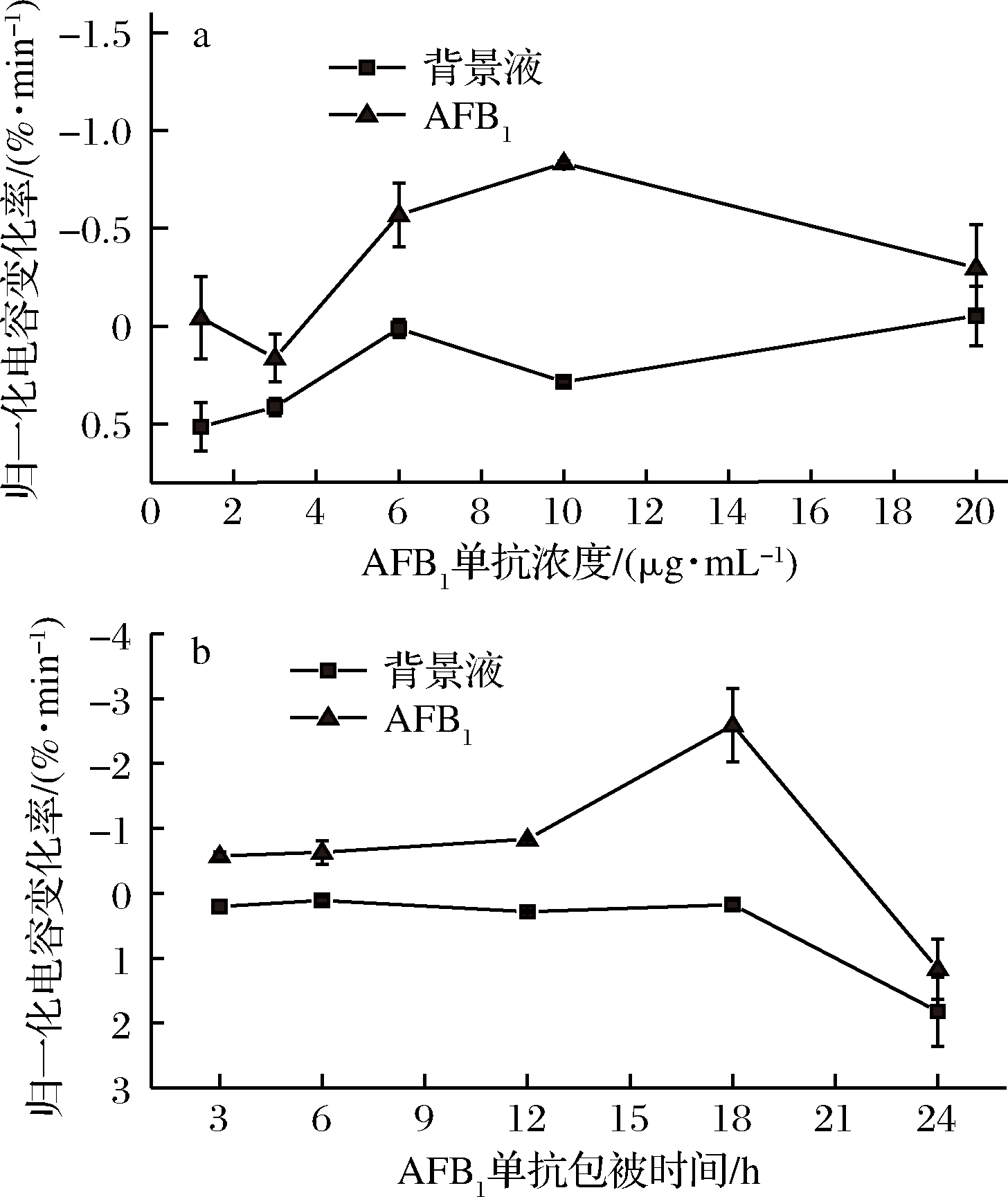
a-AFB1单抗浓度;b-AFB1单抗包时间
图5 不同抗AFB1单抗包被浓度及时间对检测电容变化率的影响
Fig.5 Effect of different AFB1 McAb modification concentration and time on capacitance change rates
2.2.4 交流电动作用的频率和电压对AFB1加速富集作用的影响
由图6可知,在频率由500 Hz增大至50 kHz、电压由0 mV增大至300 mV的过程中,归一化电容变化率的AFB1检测值和背景液信号之差均呈现先增大后减小的趋势,在3 kHz和50 mV时表现最大。这说明当交流电频率和电压分别为3 kHz和50 mV时,交流电动作用对待测液中的目标物产生较好的加速富集作用,在该条件下,当待测液中AFB1浓度一定时,能被电极表面的单抗捕获的AFB1分子最多,响应值最大,因此灵敏度和准确度达到最优。

图6 不同频率及电压对检测电容变化率的影响
Fig.6 Effect of different frequency and voltage of functional electrode on capacitance change rates
2.3 方法学评价
2.3.1 线性范围与检测限
在本研究确定的条件下,测定不同浓度AFB1的电容变化率(每个浓度水平做3个平行样),在 10-6~10-2 μg/mL,AFB1浓度的对数值与电极表面电容变化率成良好的线性关系,线性回归方程为C=10[ (dC/dt)+19.98]/-1.57,R2=0.993 6,最低检出限为 2.01×10-7 μg/mL(3 σ/S),定量限为2.35×10-7 μg/mL(10 σ/S)[19]。结合1.3.5中样品前处理过程,实际样品中AFB1含量检测范围为0.8~8 000 μg/kg,含量计算公式为C=10[ (dC/dt)+22.82]/-3.14,相关系数r=0.996 8,完全可以满足食用油中痕量AFB1的检测需求(食用油中AFB1限量标准为≤20 μg/kg[5])。

图7 电容变化率与AFB1浓度的函数关系
Fig.7 Capacitance change rate as a function of AFB1 concentrations
2.3.2 精密度
以相对标准偏差(RSD)衡量该方法的精密度,结果如表1,RSD(n=5)为6.63%~15.60%,表明该方法的精密度良好。
表1 不同浓度水平的相对标准偏差
Table 1 Relative standard deviation at differentconcentration levels
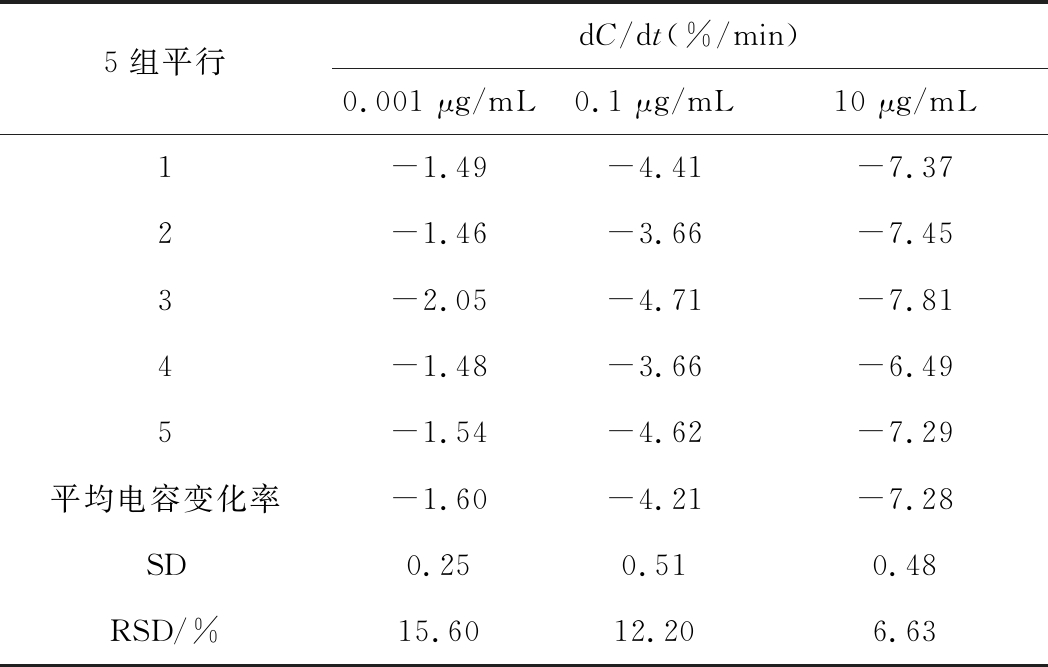
5组平行dC/dt(%/min)0.001 μg/mL0.1 μg/mL10 μg/mL1-1.49-4.41-7.372-1.46-3.66-7.453-2.05-4.71-7.814-1.48-3.66-6.495-1.54-4.62-7.29平均电容变化率-1.60-4.21-7.28SD0.250.510.48RSD/%15.6012.206.63
2.3.3 准确度
对花生油样品进行不同浓度的加标回收试验(每个添加水平做3个平行样,每个样品做3次重复检测),结果如表2,平均加标回收率为85.20%~97.70%。
表2 实际样品加标回收试验
Table 2 Standard-added recovery test of actual samples
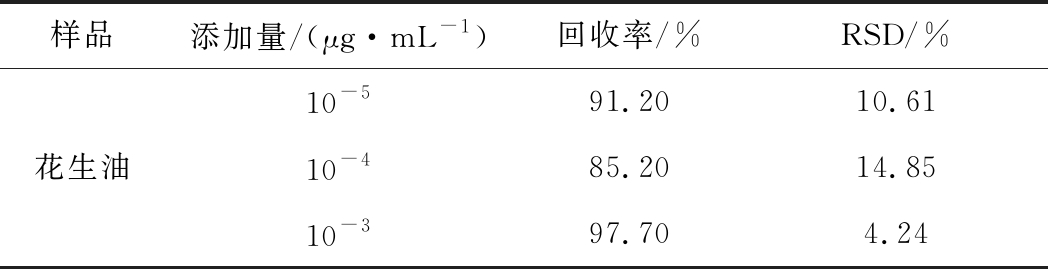
样品添加量/(μg·mL-1)回收率/%RSD/%10-591.2010.61花生油10-485.2014.8510-397.704.24
2.3.4 特异性
采用构建的AFB1免疫传感器对AFB1和AFB2、AFM1、AFG1、OTA、DON、ZEN等共存干扰毒素(AFB1浓度的100倍)进行特异性和抗干扰能力的检测(每种毒素做3个平行样)。结果如图8所示,当检测物为AFB1时,电容变化率最大,说明电极表面发生大量的免疫结合反应,使得检测响应值发生较大变化;检测背景液或干扰毒素时,干扰毒素浓度为AFB1的100倍,电容变化率仍不足AFB1信号值的1/5,说明此时电极表面未发生或较少发生特异性结合,表明该传感器特异性良好。
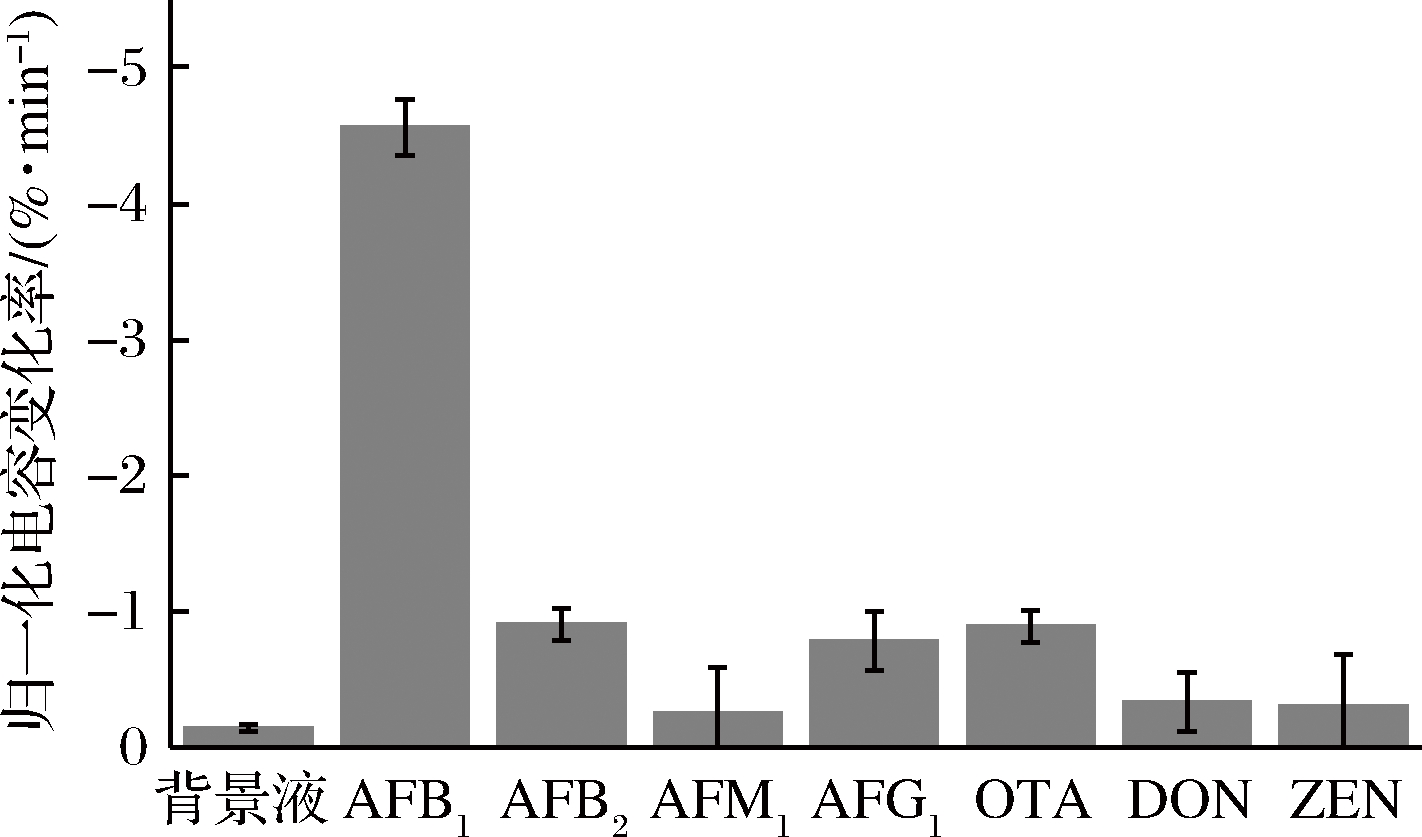
图8 不同毒素的电容变化率
Fig.8 Capacitance change rates for different toxins
3 结论与讨论
本研究构建了AFB1检测的微芯片免疫传感平台,通过交流电动作用加速富集,打破传统免疫反应单纯依靠目标物自身随机运动与抗体结合发生特异性结合的方式,显著提高检测的灵敏度(检出限为2.01×10-7 μg/mL)并缩短痕量检测时间(30 s),展现出了良好的准确度、精密度和特异性,与文献中的同类方法对比(如表3),优势明显。
表3 AFB1测定方法的比较
Table 3 Comparison of different methods for thedetermination of AFB1
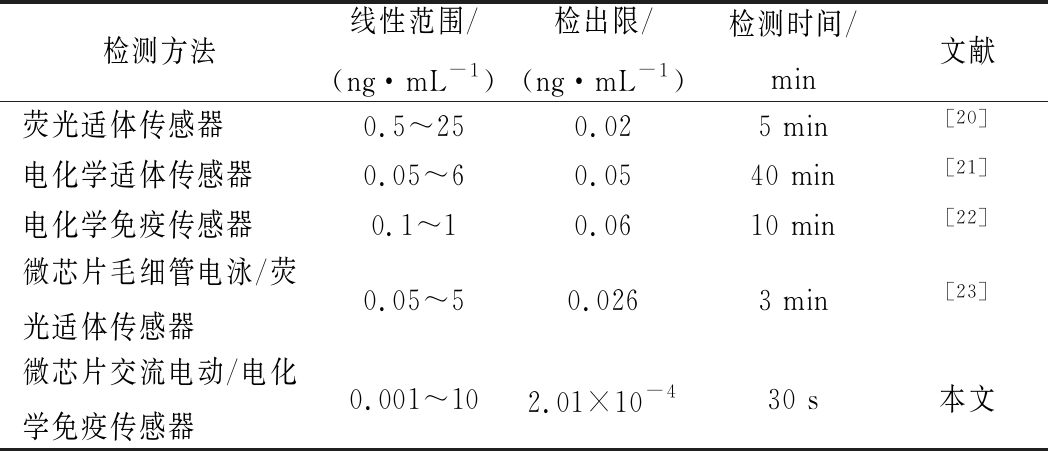
检测方法线性范围/(ng·mL-1)检出限/(ng·mL-1)检测时间/min文献荧光适体传感器0.5~250.025 min[20]电化学适体传感器0.05~60.0540 min[21]电化学免疫传感器0.1~10.0610 min[22]微芯片毛细管电泳/荧光适体传感器0.05~50.0263 min[23]微芯片交流电动/电化学免疫传感器0.001~102.01×10-430 s本文
本研究不仅为花生油中AFB1的快速、高灵敏检测提供了一种新方法,而且替换相应的抗体后,该方法理论上可以应用于其他真菌毒素的检测。
[1] IARC W G O T. Some traditional herbal medicines, some mycotoxins, naphthalene and styrene[J]. IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, 2002,82:1-556.
[2] 褚庆华,张艺兵,鲍蕾. 农产品中真菌毒素的检测分析[M]. 北京:化学工业出版社, 2006.
[3] DUARTE S C, PENA A, LINO C M. A review on ochratoxin A occurrence and effects of processing of cereal and cereal derived food products[J]. Food Microbiology, 2010,27(2):187-198.
[4] LIU J, SUN L, ZHANG J, et al. Aflatoxin B1, zearalenone and deoxynivalenol in feed ingredients and complete feed from central China[J]. Food Additives & Contaminants. Part B, Surveillance, 2016,9(2):91-97.
[5] GB 2761—2017 食品安全国家标准食品中真菌毒素限量[S].北京:中国标准出版社,2017.
[6] 常纪文. 从欧盟立法看动物福利法的独立性[J]. 环球法律评论, 2006(3):343-351.
[7] AZRI F A, SELAMAT J, SUKOR R. Electrochemical Immunosensor for the detection of aflatoxin B1 in palm kernel cake and feed samples[J]. Sensors:2017,17(12):2 776.
[8] 王嫦嫦,马良,刘微,等. 基于先进材料的适配体传感器在真菌毒素快速检测中的研究进展[J/OL]. 食品科学:1-9[2019-11-05].http://kns.cnki.net/kcms/detail/111.2206.TS.20190507.1830.040.html.
[9] YUGENDER GOUN K, CATANANTE G, HAYAT A, et al. Disposable and portable electrochemical aptasensor for label free detection of aflatoxin B1 in alcoholic beverages[J]. Sensors & Actuators: B. Chemical, 2016,235:466-473.
[10] 谭红霞,马良,郭婷,等. 玉米赤霉烯酮新型生物传感器检测技术研究进展[J]. 食品与发酵工业,2019,45(2):240-246.
[11] LI S C, CHEN J H, CAO H, et al. Amperometric biosensor for aflatoxin B1 based on aflatoxin-oxidase immobilized on multiwalled carbon nanotubes[J]. Food Control, 2011,22(1):43-49.
[12] WU J. Interactions of electrical fields with fluids:laboratory-on-a-chip applications[J]. IET Nanobiotechnology, 2008,2(1):14-27.
[13] LIU X, CHENG C, WU J, et al. A low cost and palm-size analyzer for rapid and sensitive protein detection by AC electrokinetics capacitive sensing[J]. Biosensors and Bioelectronics, 2017,90:83-90.
[14] CUI H, WU J, EDA S, et al. Rapid capacitive detection of femtomolar levels of bisphenol A using an aptamer-modified disposable microelectrode array[J]. Microchimica Acta, 2015,182(13):2 361-2 367.
[15] LIN X, CHENG C, TERRY P, et al. Rapid and sensitive detection of bisphenol a from serum matrix[J]. Biosensors and Bioelectronics, 2017,91:104-109.
[16] CUI H, CHENG C, WU J, et al. Rapid detection of progesterone by commercially available microelectrode chips, 2013[C]. Sensors,2013 IEEE.IEEE, 2013:1.4.
[17] 李姗姗.基于交流电场的生物分子快速检测及其试验研究[D]. 哈尔滨:哈尔滨工业大学, 2014.
[18] PELUSO P, WILSON D S, DO D, et al. Optimizing antibody immobilization strategies for the construction of protein microarrays[J]. Analytical Biochemistry, 2003,312(2):113-124.
[19] 江虹,张琴,吴征真,等.双波长共振瑞利散射法快速测定皮蛋中的Cd[J].食品与发酵工业,2017,43(6):263-267.
[20] WANG L, ZHU F, ZHU Y, et al. Rapid and visual detection of aflatoxin B1 in foodstuffs using aptamer/G-quadruplex DNAzyme probe with low background noise[J]. Food Chemistry, 2019,271:581-587.
[21] LI X, CAO L, ZHANG Y, et al. Fabrication and modeling of an ultrasensitive label free impedimetric immunosensor for aflatoxin B1 based on protein A self-assembly modified gold 3D nanotube electrode ensembles[J]. Electrochimica Acta, 2017,247:1 052-1 059.
[22] MA H, SUN J, ZHANG Y, et al. Label-free immunosensor based on one-step electrodeposition of chitosan-gold nanoparticles biocompatible film on Au microelectrode for determination of aflatoxin B1 in maize[J]. Biosensors and Bioelectronics, 2016,80:222-229.
[23] XIAO M, BAI X, LIU Y, et al. Simultaneous determination of trace Aflatoxin B1 and Ochratoxin A by aptamer-based microchip capillary electrophoresis in food samples[J]. Journal of Chromatography A, 2018,1 569:222-228.