屎肠球菌(Enterococcus faecium)是革兰氏阳性球菌,属肠球菌属,菌落形态呈卵圆形,在其培养过程中会产生大量的乳酸,是一种兼性厌氧的乳酸菌,广泛分布于人体和动物肠道中,是肠道中的正常菌群[1],具有耐酸、耐热、肠道黏附能力强等特点,还具有抑制病原菌、增强免疫力等作用[2]。相对于需要严格厌氧培养、保存条件极为苛刻的双歧杆菌和乳杆菌来说,屎肠球菌的生长特性决定其是便于工业化生产和畜牧业使用的首选菌种之一[3]。屎肠球菌广泛存在于传统乳制品[3-5]、泡菜[6]、豆酱[7]、香肠[8]等发酵食品中,可以影响食品的香气、风味、质地,还能产生多种有益成分[9]。但是肠球菌属是临床上一种条件致病菌,可引起呼吸道、泌尿生殖道、腹腔等部位的感染[10-11]。引起感染的主要原因是因为肠球菌属含有毒力因子和比较广泛的耐药性[12]。多重耐药菌株往往导致严重的感染,不能很好地治愈,特别是万古霉素耐药肠球菌在公共卫生方面产生的问题[13]。因此,屎肠球菌在应用之前必须要对其进行安全性评价。
实验室前期从发酵泡菜中筛选出1株产酸能力较强的菌株屎肠球菌R2,该菌株可用于酸浆豆腐及豆干等的生产[14],减少致病菌及杂菌含量,保证酸浆的质量及稳定性,进而提高豆制品的安全性。屎肠球菌R2在发酵黄浆水的过程中无需补充蔗糖、葡萄糖等碳源,且在发酵结束后无需补充醋酸即可达到适宜的酸度,有效地降低了生产成本[15],因此,屎肠球菌R2作为一种新型酸浆纯种发酵剂,对于黄浆水的开发利用及酸浆豆腐的规范化生产具有重要意义。为了更好地利用该菌株,保证酸浆豆制品的安全性,本研究通过毒力基因和耐药基因筛查实验,有害代谢产物检测实验,确定该菌株是否具有安全性;通过对外界环境耐受性和生理功能特性实验,确定该菌株的耐受性,为屎肠球菌R2应用于酸浆豆腐生产奠定理论基础。
1 材料与方法
1.1 实验材料
屎肠球菌Enterococcus faecium R2,CGMCC No.14944(专利保藏菌种)、屎肠球菌(E. faecium)CICC 24252,购自中国工业微生物菌种保藏管理中心,作为阳性对照菌;细菌基因组DNA快速抽提试剂盒、牛胆盐、PCR反应相关试剂,上海生工;成品血琼脂培养基、对二氨基苯甲醛、L-赖氨酸、L-精氨酸、L-组氨酸、L-酪氨酸、L-鸟氨酸,国药集团化学试剂有限公司。
MRS培养基(g/L):蛋白胨10,酵母浸粉5,K2HPO4 2,柠檬酸二铵2,葡萄糖 20,牛肉膏10,CH3COONa 5,MgSO40.2,MnSO4 0.05,琼脂粉 20,CaCO3 20,吐温-80 1 mL。
氨基酸培养基(g/L):蛋白胨5,酵母膏3,葡萄糖1,1.6%溴甲酚紫-乙醇溶液1,pH 6.8,分别添加0.5%(质量分数)的酪氨酸、鸟氨酸、赖氨酸、组氨酸、精氨酸配成5组氨基酸培养基。
硝酸盐培养基:在1 000 mL的MRS培养基中加入KNO4 0.2 g,加热搅拌至完全溶解,调节pH至7.4,配制成硝酸盐培养基。
1.2 仪器与设备
LDZW-60KCS-Ⅱ立式压力蒸汽灭菌锅,上海申安医疗器械;SW-CJ-2D双人单面垂直净化工作台,苏州博莱尔净化设备有限公司;,EX Zone2电子天平,深圳安普特电子科技有限公司;BSC-250恒温恒湿培养箱,上海博讯实业有限公司医疗设备厂;DYY-6C型电泳仪,北京市六一仪器厂;GZX-DH500-BS-Ⅱ电热恒温干燥箱,上海跃进医疗器械厂; pHS-3C pH计,上海仪电科学仪器股份有限公司;ABI型PCR仪,美国ABI公司;GEL DOC XR凝胶成像系统, 美国Bio-rad;5804R型离心机,Eppendorf公司。
1.3 试验方法
1.3.1 安全性评价
1.3.1.1 毒力基因检测
将屎肠球菌R2接种到MRS培养基中,37 ℃下静置培养16 h,离心收集沉淀,按照细菌基因组DNA快速抽提试剂盒方法提取屎肠球菌R2基因组DNA。以基因组DNA为模板,用PCR扩增屎肠球菌R2的毒力基因,毒力基因的引物序列如表1所示,引物均由安徽滁州通用生物系统(安徽)有限公司合成。RCR反应体系:10 μmol/L上下游引物各1 μL、模板DNA 1 μL、2×Taq PCR StarMix 10 μL、补充ddH2O 至25 μL,设阴性对照。退火温度分别为52 ℃(gelE和efaA)、56 ℃(cylA、asa1和esp)、58 ℃(hyl)。其余PCR条件为:94 ℃预变性5 min,94 ℃变性1 min,退火30 s,72 ℃延伸1min,共35个循环,最后72 ℃充分延伸5 min。PCR结束后,将扩增产物置于含EB的1.0%(质量分数)琼脂糖凝胶中进行电泳,并拍照分析。
1.3.1.2 耐药性基因检测
以基因组DNA为模板,PCR扩增屎肠球菌R2的万古霉素耐药基因,耐药基因的引物序列如表2所示,引物均有安徽滁州通用生物系统(安徽)有限公司合成。RCR反应体系:10 μmol/L上下游引物各1.0 μL、模板DNA 1.0 μL、2×Taq PCR StarMix 12.5 μL、补充ddH2O 至25 μL。阴性对照模板以1.0 μL ddH2O代替。PCR条件为:94 ℃预变性5 min,94 ℃变性1min,54 ℃退火1 min,72 ℃延伸1min,共30个循环;最后72 ℃充分延伸10 min;4 ℃保存。PCR结束后,将扩增产物置于含EB的1.0%琼脂糖凝胶中进行电泳,并拍照分析。
表1 六种常见毒力基因引物序列
Table 1 Sequences of six common virulence genes

基因引物(5'-3')大小/bp参考文献gelEF: TATGACAATGCTTTTTGG-GATR: AGATGCACCCGAAATA-ATATA213[16]espF: AGATTTCATCTTTGAT-TCTTGGR: AATTGATTCTTTAG-CATCTGG510[16]asa1F: GCACGCTATTACGAAC-TATGAR: TAAGAAAGAACATCAC-CACGA375[16]cylAF: ACTCGGGGATTGATAGGCR: GCTGCTAAAGCTGCGCTT688[16]efaAF: GACAGACCCTCACGAATAR: AGTTCATCATGCTGTAGTA705[17]hylF: ACAGAAGAGCTGCAG-GAAATGR: GACTGACGTCCAAGTTTC-CAA276[17]
表2 耐药基因引物序列
Table 2 Sequences of vancomycin resistant genes

基因引物(5'-3')大小/bp参考文献vanAF: CATGAATAGAATAAAAGTTG-CAATAR: CCCCTTTAACGCTAATACGAT-CAA1 030[18]vanBF: AAGCTATGCAAGAAGCCATGR: CCGACAATCAAATCATCCTC536[19]vanC1F: GGTATCAAGGAAACCTCR: CTTCCGCCATCATAGCT822[18]vanC2/3F: CGGGGAAGATGGCAGTATR: CGCAGGGACGGTGATTTT 484[19]vanDF:TGTGGGATGCGATATTCAAR:TGCAGCCAAGTATCCGGTAA500[2]vanEF:TGTGGTATCGGAGCTGCAGR: ATAGTTTAGCTGGTAAC430[2]vanGF:CGGCATCCGCTGTTTTTGAR: GAACGATAGACCAATGCCTT941[2]
1.3.1.3 有害代谢产物检测
氨基酸脱羧酶检测实验:无菌条件下,将活化后的屎肠球菌R2菌悬液按3%接种量分别接入5组氨基酸培养基中,37 ℃静置培养24 h和48 h,观察培养颜色变化[20-21],以MRS培养基作为对照组。
硝酸盐还原酶检测实验:无菌条件下,将活化后的屎肠球菌R2菌悬液按3%的接种量接入到硝酸盐培养基中,37 ℃静置培养48 h后,先滴加10滴5%(质量分数)的KI溶液,再滴加10滴5%(质量分数)的淀粉溶液,充分振荡混匀后观察培养基颜色变化[22],以不接菌的培养基作为对照组。
吲哚实验:在无菌条件下,将活化后的屎肠球菌R2菌悬液按3%接种量接入到蛋白胨水培养基中,37 ℃培养48 h后,向培养基中加入2 mL乙醚,充分振荡,静置片刻,使乙醚浮于上层液面,此时再沿管壁缓慢加入10滴吲哚试剂(切勿摇动),观察两层交界处颜色变化[23],以不接菌的培养基作为对照组。
溶血实验:在无菌条件下,用灭菌后的接种环挑取活化后的屎肠球菌R2菌悬液在血琼脂平板上划线,倒置放入37 ℃培养箱培养48 h后,观察菌落周围有无溶血圈,拍照记录反应现象。若在菌株菌落周围的琼脂显示绿色,则为α-溶血;在菌落周围出现透明圈,为β-溶血;如果对溶血无作用或不溶血,为γ-溶血[24-25](用金黄色葡萄球菌作为阳性对照组进行比较)。
1.3.2 环境胁迫耐受性
1.3.2.1 耐酸性
将活化后的屎肠球菌R2按3%接种量接分别接种到pH为2.0、2.5、3.0、3.5的MRS液体培养基中,置于37 ℃恒温培养箱中静置培养,分别在 0、1、2、3 h处取样,采用平板菌落计数法测定样品中的菌体数量[25-26]。以未经调整过的MRS液体培养基(pH约为6.8)作为对照。
1.3.2.2 胆盐耐受性
将活化胡的屎肠球菌R2按3%接种量分别接种到含有0.1%、0.2%、0.3%、1.0%、2.0%(质量分数)牛胆盐的MRS液体培养基中,37 ℃静置培养3 h后,采用平板菌落计数法测定样品中的菌体数量。以不加胆盐的MRS液体培养基作对照,计算存活率。存活率计算如公式(1):
菌株存活率![]()
(1)
式中:N1为处理组的细菌数;N0为对照组的细菌数。
1.3.2.3 耐高盐评价
将活化后的屎肠球菌R2按3%接种量分别接种到含有1%、2%、3%、4%、5 % NaCl的MRS液体培养基中,37 ℃静置培养24 h后,采用平板菌落计数法测定样品中的菌体数量[26]。以不含NaCl的MRS液体培养基作为对照。
1.3.3 生理特性评价
1.3.3.1 自聚集性
将活化后的屎肠球菌R2在3 000 r/min下离心 10 min,蒸馏水洗涤2次,再悬浮,用蒸馏水稀释,调整OD值在660 nm下为 0.3(记为OD0)。在37 ℃下孵育60 min后,再次测量660 nm下的OD值(记为OD60)[26]。自聚集计算如公式(2):
自聚集![]()
(2)
1.3.3.2 疏水性
采用碳氢化合物黏着法。取活化好的屎肠球菌R2菌液,4 ℃、4 000 r/min离心10 min,收集菌体,用无菌生理盐水洗涤2次。生理盐水作空白对照,用生理盐水调整菌体浓度,使A560nm值约为1.00。取2 mL调整后的菌液,加入2 mL二甲苯,涡旋振荡2 min后室温静置 180 min,使得有机相跟水相明显分界。取水相,在560 nm波长下测定吸光值[27]。疏水率如计算公式(3):
疏水率![]()
(3)
式中:A0和A分别是二甲苯混匀前、混匀后菌液在560 nm波长下测得的A值。
1.4 数据处理
使用SPSS 16.0软件中的AVOVA单因素方差分析及LSD多重检验(P<0.05),对数据进行统计处理和方差显著性分析,数据表示为平均值±标准偏差表示。
2 结果与分析
2.1 屎肠球菌R2的安全性评价
2.1.1 毒力基因检测
屎肠球菌R2的毒力基因检测结果如图1所示,结果表明,屎肠球菌R2不携带肠球菌常见的6种毒力基因,而阳性对照菌(屎肠球菌CICC 24252)检测到了esp基因,esp基因对应的毒力因子是肠球菌表面蛋白,主要起到黏附宿主细胞的作用[16]。
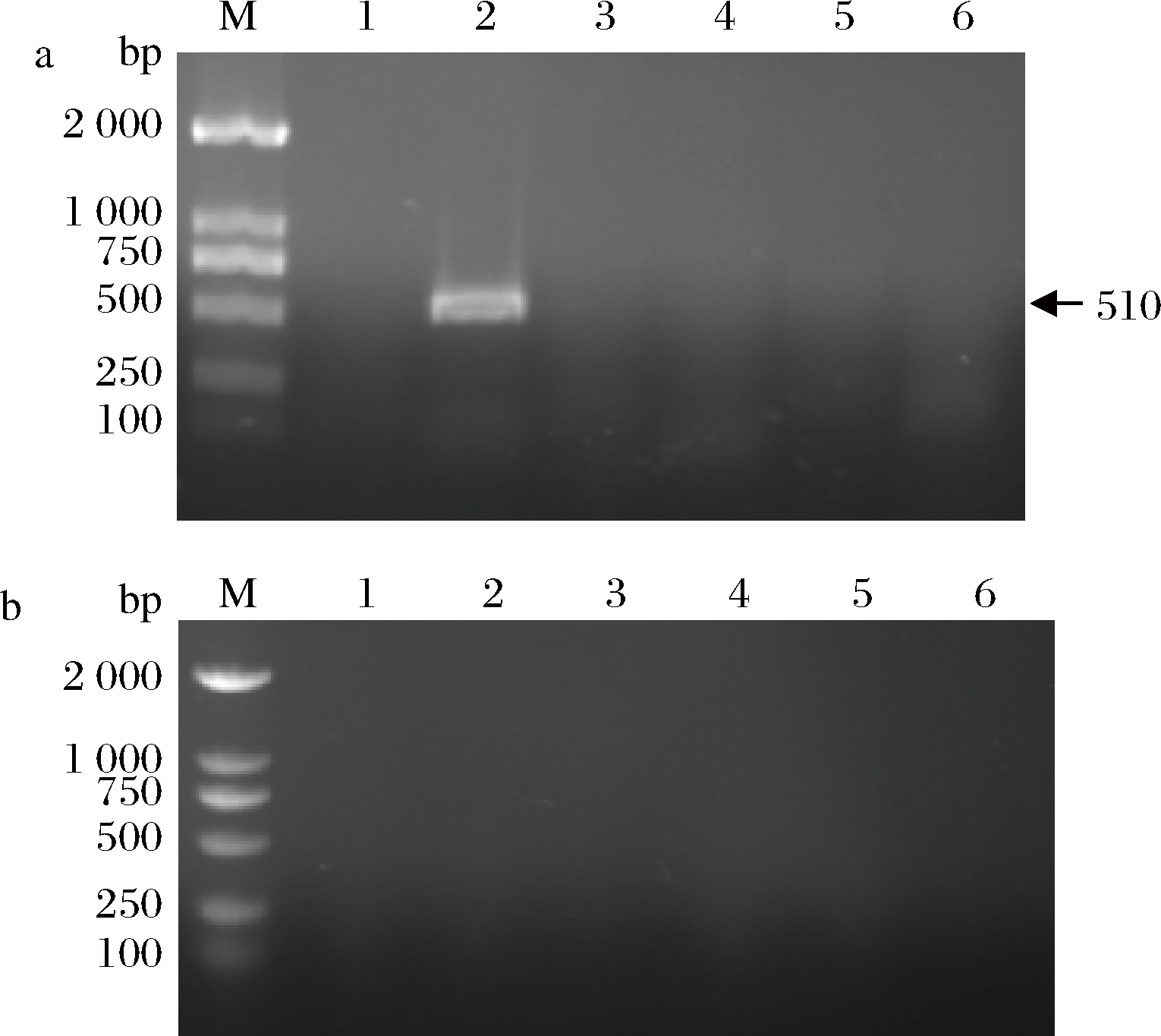
M-DL 2000 Marker;1、2、3、4、5、6-gelE、
esp、asa1、 cylA、 efaA、hyl的检测结果
a-阳性对照菌(E. faecium CICC 24252);b-受试菌屎肠球菌R2
图1 屎肠球菌R2的毒力基因扩增电泳图谱
Fig.1 Specific amplified results of virulence genes from
E. faecium R2
2.1.2 耐药基因检测
前期药敏性实验结果显示屎肠球菌R2对四环素、万古霉素、青霉素及链霉素4种常见抗生素药物敏感[15]。大量研究表明屎肠球菌引起的感染非常依赖万古霉素耐药性,因此进一步对屎肠球菌R2的万古霉素耐药基因进行检测,结果如图2所示,结果表明,屎肠球菌R2的vanA、vanB、vanC、vanC2/3、vanD、vanE和vanG基因扩增均为阴性。
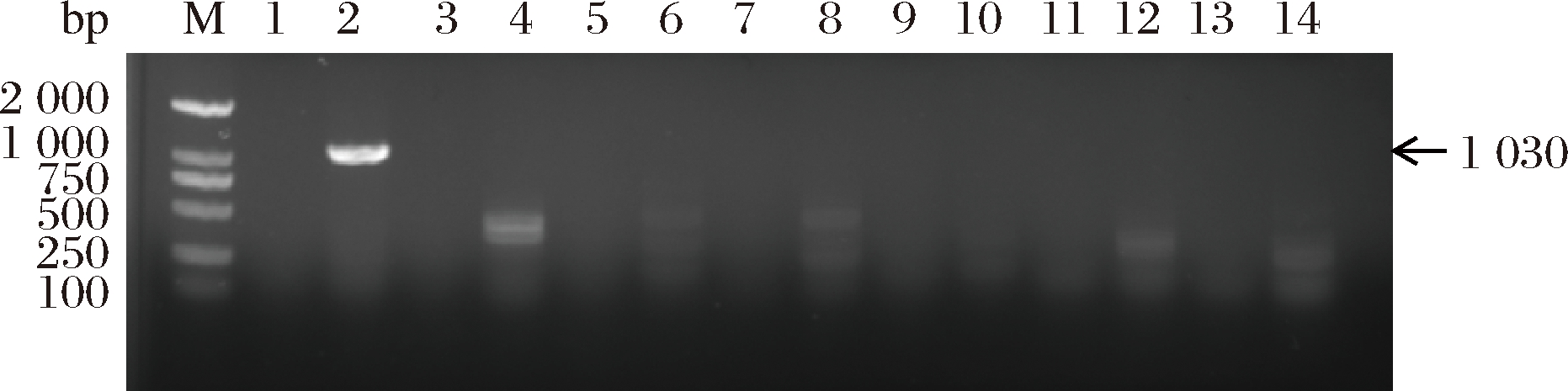
M-DL 2000 Marker;1、3、5、7、9、11、13-受试屎肠球菌R2的vanA、vanB、vanC、vanC2/3、
vanD、vanE和vanG的检测结果;2、4、6、8、10、12、14-阳性对照菌(E. faecium CICC 24252)的vanA、vanB、vanC、vanC2/3、vanD、vanE和vanG的检测结果
图2 屎肠球菌R2的万古霉素耐药基因扩增电泳图谱
Fig.2 Specific amplified results of vancomycin resistant genes from E. faecium R2
2.1.3 有害代谢产物检测
吲哚实验可以检测菌株是否能分解蛋白质中的色氨酸。色氨酸为人体必需氨基酸,参与人体蛋白质合成、调节免疫功能和促进消化。色氨酸代谢过程发生障碍会引起肝功能衰退、恶性肿瘤等[28]。吲哚实验结果显示为阴性(见表3),向培养好的菌液中滴加指示剂,没有红色圆环产生,说明没有产生吲哚类物质,表明屎肠球菌R2不会分解色氨酸产生吲哚。
硝酸盐还原酶能够催化硝酸盐还原成亚硝酸盐,而亚硝酸盐是强致癌物亚硝胺的前提物质,与食品中蛋白质分解的中间产物仲胺反应形成亚硝胺,后者可又发胃癌、肝癌、咽喉癌等多种癌症[29]。结果显示菌液均未变蓝,为阴性反应(见表3),说明屎肠球菌R2的代谢产物中不含有硝酸还原酶或硝酸还原酶无活性。
一些乳酸菌具有氨基酸脱羧酶活性,能够将食品中的氨基酸脱羧还原成生物胺类物质,如果胺类在体内积累过多,就会引起中毒的症状。而具有氨基酸脱羧酶的细菌,能够分解氨基酸使其脱羧生成胺(赖氨酸→尸胺,鸟氨酸→腐胺,精氨酸→精胺)和二氧化碳,进而使培养基变碱性,当滴加指示剂(溴甲酚紫),呈黄色为阴性,呈紫色为阳性[27]。实验结果显示测定管呈黄色(见表4),为阴性,说明屎肠球菌R2的代谢产物中不含有氨基脱羧酶,即对人体无害。
表3 有害代谢产物实验结果
Table 3 The results of harmful metabolites

有害代谢产物实验实验现象实验结果吲哚实验对照组培养基无变化,实验组培养基变浑浊且乙醚层为无色阴性,无色氨酸生成硝酸盐还原酶实验对照组培养基无变化,实验组培养基变浑浊且为淡黄色阴性,不产生硝酸盐还原酶氨基酸脱羧酶实验对照组与实验组均变黄色阴性,无生物胺产生
溶血现象是人体内一种不正常的现象,溶血素生产能力越强,红血球破坏越严重,溶血现象就越严重,人体一旦感染,就会造成非常严重的败血症,因此溶血现象是乳酸菌安全性评价的重要检测指标之一。如图3所示,屎肠球菌R2在血平板上培养48 h后长出乳白色菌落且没有溶血圈,属于没有毒性的γ-溶血,说明该菌株对溶血无作用或不溶血,而金黄色葡萄球菌则表现出β-溶血。

a-屎肠球菌R2;b-金黄色葡萄球菌
图3 溶血实验检验结果
Fig.3 The result of hemolysis test
2.2 屎肠球菌R2的环境胁迫耐受性
2.2.1 耐酸性实验
人体胃液pH的大小根据饮食结构的不同而变化,通常维持在3.0左右。空腹或食用酸性食品后pH可达到1.5,食用碱性食品后pH可达到4~5,食物通过胃的时间一般为1~2 h。表4为屎肠球菌R2在不同pH条件下培养不同时间的活菌数。由表4可知,屎肠球菌R2在pH 6.8(对照组)和pH 3.5的MRS培养基中进行培养时,活菌数随着培养时间的延长而增加,但是与对照组相比,pH 3.5的培养基中屎肠球菌R2的活菌数有所下降;在pH为2.0、2.5和3.0的MRS培养基中培养时,活菌数随着培养时间的延长而降减少。
由表4可以看出,即使在pH 2.0的培养基中培养3 h后,屎肠球菌R2的活菌数仍然保持在108CFU/mL以上,而益生菌在人体内发挥作用的浓度要求一般为106~109 CFU/mL。由此可知,屎肠球菌R2对人体生理浓度范围内的酸性变化有较好的耐受性。
表4 屎肠球菌R2在不同酸度条件下的存活数
Table 4 Survival of E. faecium R2 in different acidic environments
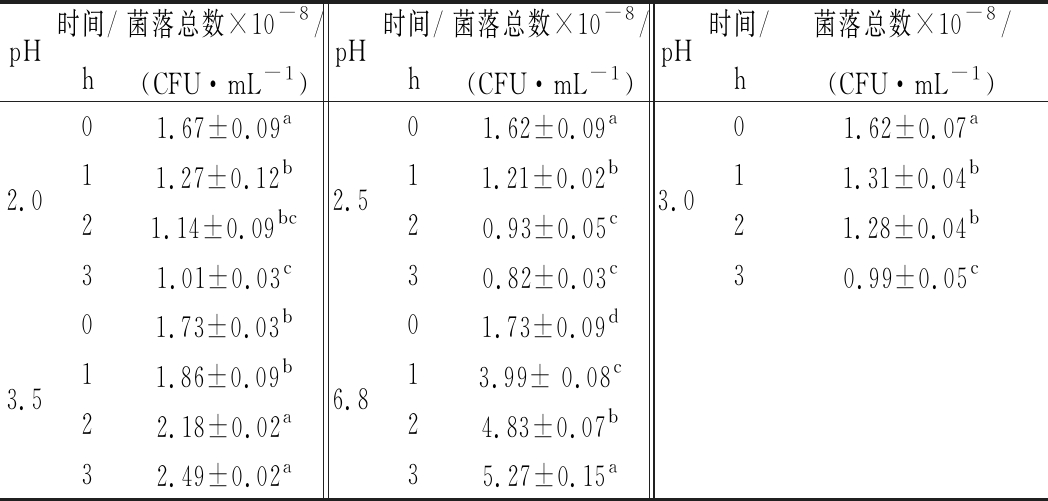
pH时间/h菌落总数×10-8/(CFU·mL-1)pH时间/h菌落总数×10-8/(CFU·mL-1)pH时间/h菌落总数×10-8/(CFU·mL-1)2.001231.67±0.09a1.27±0.12b1.14±0.09bc1.01±0.03c2.501231.62±0.09a1.21±0.02b0.93±0.05c0.82±0.03c3.001.62±0.07a11.31±0.04b21.28±0.04b30.99±0.05c3.501231.73±0.03b1.86±0.09b2.18±0.02a2.49±0.02a6.801.73±0.09d13.99± 0.08c24.83±0.07b35.27±0.15a
注:同列肩标字母不同表示差异显著(P<0.05),表5、表6同。
2.2.2 耐胆盐实验
小肠是益生菌发挥作用的重要场所,正常人体小肠中胆汁的质量分数一般在0.1%~0.3%。实验结果如表5所示,屎肠球菌R2在含有质量分数为0.3%胆盐的培养基中培养3 h后,存活率为91.95%;在含有质量分数为1.0%和2.0%胆盐的培养基中培养3 h后,仍有82%以上的存活率。可见,屎肠球菌R2对胆盐具有很强的耐受能力。
表5 屎肠球菌R2在不同胆盐浓度下的存活率
Table 5 Viability of E. faecium R2 under different bile salt concentrations

胆盐质量分数/%存活率/%0.199.57±0.32a0.298.13±0.86a0.391.95±4.85b1.085.91±0.92c2.082.83±2.01c
2.2.3 耐高盐实验
人体肠胃道中NaCl质量分数一般在1.0%~4.0%。NaCl的质量分数变化会影响渗透压的大小,微生物对于渗透压的耐受能力是有限的,渗透压过高会造成微生物停止生长甚至死亡[30]。屎肠球菌R2在不同NaCl质量分数的培养基中培养24 h后的活菌数如表6所示,NaCl质量分数在4.0%以下,屎肠球菌R2的活菌数随着NaCl质量分数的增加而增加,当NaCl质量分数为4.0%时,活菌数达到了109 CFU/mL以上。当NaCl质量分数为5%时,屎肠球菌R2的活菌数明显下降(P<0.05),但仍然维持在108 CFU/mL以上。由此可见,屎肠球菌R2具有较强的耐高盐能力,在胃肠道的高盐环境中能够有效地消除高渗透压所带来的不利影响,可以维持菌体渗透压的相对平衡。
表6 屎肠球菌R2在不同盐浓度下的存活数
Table 6 Survival of E. faecium R2 in different salt concentraion

NaCl质量分数%菌落总数×10-8/(CFU·mL-1)0.04.73±0.25d1.04.97±0.40d2.05.70±0.40c3.07.63±0.31b4.010.73±0.45a5.03.23±0.55e
2.3 屎肠球菌R2的生理特性
自聚集是生物膜形成的一个重要特性,而乳酸菌的生物膜可以通过保护胃肠道转运中的菌株,产生某种抗菌化合物和刺激免疫应答从而进行肠道定植[29],因此,自聚集性可以反映细菌的黏附性能。屎肠球菌R2菌悬液在37 ℃条件下孵育60 min后,它的自聚集性为15.94%。同样条件下,田原等[31]测定的副干酪乳杆菌L1的自聚集性为15.8%,与本实验结果相近;任大勇[32]测定的鼠李糖乳杆菌GG孵育在120 min后自聚集性可达到33%。由此可知,屎肠球菌R2具有一定的自聚集性。PEREZ等研究表明,菌株疏水性的大小来推断其黏附能力的高低,疏水性在细菌发挥黏附作用和自聚集反应中都具有重要作用,即疏水性高的菌株对肠上皮细胞的黏附作用就强,且这种关联呈现一定的依赖性[33]。屎肠球菌R2菌悬液的疏水性为7.31%,可以看出该菌具有一定的疏水性,但相对偏低。
3 结论与讨论
屎肠球菌是人和动物肠道内的正常菌群,并广泛存在于许多传统发酵食品中。肠球菌具有蛋白酶、脂肪酶活性及产生二乙酰等代谢能力,在奶酪加工、发酵肉类的后熟和产品的特殊风味及香气形成中发挥重要作用[34]。有些屎肠球菌可以产生肠球菌素,可以抑制奶酪表面单增李斯特菌的生长和繁殖,对奶酪的保鲜具有一定效果[7]。另外,屎肠球菌生物学特性良好,对于高温、高盐、酸碱和氧气具有较好的抗逆性,董晓芬等[35]从枳椇果梗中筛选出一株富硒能力强且适宜发酵枳椇液的屎肠球菌,可耐受pH 2.5的酸和0.3%(质量分数)胆盐。此外,有报道表明厌氧条件下屎肠球菌E. faecium EPI1与Lactobacillus mucosae EPI2等菌株混合发酵可产生雌马酚[36],雌马酚为大豆异黄酮代谢终产物,具有比其他异黄酮类物质和其前体物质大豆苷元更强的类雌激素活性。实验所用菌株屎肠球菌R2具有α-半乳糖苷酶和β-葡萄糖苷酶活性,可代谢豆腐黄浆水中的棉籽糖和水苏糖,同时将活性低的糖苷型大豆异黄酮(主要为大豆苷和染料木苷)转化为高活性游离型苷元大豆异黄酮,对改善豆制品的品质具有重要的意义。
本实验通过对屎肠球菌R2的安全性评价可知,该菌在毒力基因检测和万古霉耐药基因筛查实验中,实验结果均为阴性;在有害代谢产物检测实验中,实验结果也均为阴性,且为无毒的γ-溶血;且该菌对外界环境中的酸性、胆盐及高渗透压耐受性良好,也体现了一定的聚集性和疏水性,因此,屎肠球菌R2表现了良好的安全性和环境耐受性,具有潜在的应用前景。
[1] 熊媛媛.猪源益生肠球菌的分离鉴定和筛选[D].武汉:华中农业大学,2010.
[2] 刘洋,张欣,陈建国,等.粪肠球菌Enterococcus faecalis EC-12的万古霉素耐药基因检测[J].食品与发酵工业,2018,44(3):226-229.
[3] 夏玉,郑华,林捷,等.屎肠球菌发酵特性及其功能性研究[J].食品工业科技,2014,35(12):123-126;132.
[4] KIVANC S A,KIVANC M,YIGIT T.Antibiotic susceptibility,antibacterial activity and characterisation of Enterococcus faecium strains isolated from breast milk[J].Experimental and Therapeutic Medicine,2016,12:1 732-1 740.
[5] HASSANZADAZAR H,EHSANI A,MARDANI K.Antibacterial activity of Enterococcus faecium derived from Koopeh cheese against Listeria monocytogenes in probiotic ultra-filtrated cheese[J].Veterinary Research Forum,2014,5(3):169-175.
[6] 卢海强,霍文敏,黄蕾,等.一株具有潜在益生特性屎肠球菌的筛选及在酸菜中的应用[J].食品科技,2017,42(7):2-7.
[7] 王晓蕊,邹婷婷,郭志富,等.豆酱中产细菌素屎肠球菌的筛选及特性分析[J].食品与发酵工业,2016,42(4):91-97.
[8] 张楠,杨勇,李彬彬,等.四川自然发酵香肠中组胺降解菌的筛选鉴定及初步应用[J].食品与发酵工业,2018,44(1):72-79.
[9] 伍先绍,贺稚非,陈卫良.肠球菌素及其产生菌株在食品工业中的研究和应用现状[J].食品与发酵工业,2008,34(11):111-116.
[10] OMAR N B,CASTRO A,LUCAS R,et al.Functional and safety aspects of Enterococci isolated from different Spanish foods[J].Systematic and Applied Microbiology,2004,27(1):118-130.
[11] ZHENG W,ZHANG Y,LU H M,et al.Antimicrobial activity and safety evaluation of Enterococcus faecium KQ 2.6 isolated from peacock feces[J].BMC Biotechnology,2015,15(1):30.
[12] FRANZ C M A P,HUCH M,ABRIOUEL H,et al.Enterococci as probiotics and their implications in food safety[J].International Journal of Food Microbiology,2011,151(2):125-140.
[13] WERNER G,COQUE T M,HAMMERUM A M,et al.Emergence and spread of vancomycin resistance among enterococci in Europe[J].Eurosurveillance,2008,13(47):1-11.
[14] 陈志娜,张科贵,叶韬,等.一株屎肠球菌菌株及其在酸浆豆腐加工中的应用:中国,CN201810041844.9[P].2018-07-03.
[15] 陈志娜,叶韬,丁曼,等.屎肠球菌Enterococcus faecium R2的分离鉴定及其在酸浆豆干加工中的应用[J].食品与发酵工业,2019, 45(8):130-135.
[16] VANKERCKHOVEN V,VAN A T,VAEL C,et al.Development of a multiplex PCR for the detection of asa1, gelE, cylA, esp, and hyl genes in enterococci and survey for virulence determinants among european hospital isolates of Enterococcus faecium[J]. Journal of Clinical Microbiology,2004,42(10):4 473-4 479.
[17] EATON T J,GASSON M J.Molecular screening of Enterococcus virulence determinants and potential for genetic exchange between food and medical isolates[J].Applied & Environmental Microbiology,2001,67(4):1 628-1 635.
[18] KARIYAMA R,MITSUHATA R,CHOW J W,et al.Simple and reliable multiplex PCR assay for surveillance isolates of vancomycin-resistant enterococci[J].Journal of Clinical Microbiology,2015,38(8): 3 092-3 095.
[19] ELSAYED S,HAMILTON N,BOYD D,et al.Improved primer design for multiplex PCR analysis of vancomycin-resistant Enterococcus spp.[J].Journal of Clinical Microbiology,2001,39(6):2 367-2 368.
[20] PISANO M B, VIALE S,CONTI S,et al.Preliminary evaluation of probiotic properties of Lactobacillus strains isolated from Sardinian dairy products[J]. Journal of Biomedicine and Biotechnology,2014,29(10):1 913-1 922.
[21] SHOKRYAZDAN P,JAHROMI M F,LIANG J B,et al.In vitro assessment of bioactivities of Lactobacillus strains as potential probiotics for humans and chickens[J].Journal of Food Science,2017,82(4):2 734-2 745.
[22] 王梦姣,李少英,李淑芬,等.马奶及其制品中肠球菌属乳酸菌的安全性评价[J].食品科学,2014,35(17):204-208.
[23] 南晓芳.豆豉和腐乳中耐盐乳酸菌的筛选、鉴定及其功能特性研究[D].呼和浩特:内蒙古农业大学,2016.
[24] SHEKH S L,DAVE J M,VYAS B R M.Characterization of Lactobacillus plantarum strains for functionality,safety and γ-amino butyric acid production[J].LWT-Food Science and Technology,2016,74:234-241.
[25] YEO S,LEE S,PARK H,et al.Development of putative probiotics as feed additives: Validation in a porcine-specific gastrointestinal tract model[J].Applied Microbiology & Biotechnology,2016,100(23):1-12.
[26] ALBUQUERQUE T M R D,GARCIA E F,ARAUJO A O,et al.In vitro characterization of Lactobacillus strains isolated from fruit processing by-products as potential probiotics[J].Probiotics and Antimicrobial Proteins,2017,10(4):1-13.
[27] 翟梦凯.一株屎肠球菌的益生特性及安全性研究[D].泰安:山东农业大学,2017.
[28] 李剑欣,张绪梅,徐琪寿.色氨酸的生理生化作用及其应用[J].氨基酸和生物资源,2005,27(3):58-62.
[29] 顾旭峰,艾连中,宋馨,等.两株干酪乳杆菌的安全性评价[J].食品与发酵科技,2015,51(2):63-65.
[30] 王翔宇,王琳琳,陈炼红.传统发酵牦牛乳中2株高产胞外多糖乳酸菌在模拟消化道中耐受力的研究[J].食品科技,2019, 44(4):12-17.
[31] 田原,季子非,郭浩南,等.副干酪乳杆菌L1的安全性及益生性评价[J].食品工业科技,2019,40(2):120-127.
[32] 任大勇.益生乳酸杆菌的黏附及免疫调节作用研究[D].长春:吉林大学,2013.
[33] PEREZ P F,MINNAARD Y,DISALVO E A,et al.Surface properties of bifidobacterial strains of human origin[J].Applied and Environmental Microbiology,1998,64(1):21-26.
[34] FOULQUI M M R,SARANTINOPOULOS P,TSAKALIDOU E,et al. The role and application of enterococci in food and health[J].International Journal of Food Microbiology,2006,106(1):1-24.
M M R,SARANTINOPOULOS P,TSAKALIDOU E,et al. The role and application of enterococci in food and health[J].International Journal of Food Microbiology,2006,106(1):1-24.
[35] 董晓芬,胡仲秋,魏建平,等.枳椇果梗自源性富硒乳酸菌的筛选[J].食品科技,2019,44(5):8-14.
[36] DECROOS K,STEFI V,SOFIE C,et al.Isolation and characterisation of an equol-producing mixed microbial culture from a human faecal sample and its activity under gastrointestinal conditions[J].Archives of Microbiology,2004,183(1):45-55.