颜色是影响红葡萄酒感官质量的重要指标[1]。其中花色苷是红葡萄酒颜色的物质基础,对葡萄酒颜色起着重要作用[2-3]。如何提高红葡萄酒的色度和增强葡萄酒的稳定性一直是葡萄酒酿造行业倍加关注的问题。
花色苷主要以游离、结合和聚合形态存在于葡萄酒中,其中新鲜葡萄酒中主要是游离态的单体花色苷[3-4]。单体花色苷可以与辅色素分子间相互作用生成稳定的复合物,进而增强葡萄酒色泽、提高颜色稳定性[5-6]。辅色素包括黄酮、其他酚类、生物碱、有机酸等[5,7-8]。葡萄酒中存在大量的酚酸、黄烷醇、黄酮醇等酚类物质,其中一些单体酚是很好的辅色素,不同品种的葡萄酿造的酒中单体酚及单体花色苷种类和含量都不同,所以在葡萄酒发酵前添加不同结构辅色素(如酚酸、黄烷醇、黄酮醇等)或者利用不同葡萄品种共发酵,可以有效增强红葡萄酒颜色及其稳定性[9-11]。
近年来辅色素对葡萄酒颜色稳定性影响的研究已陆续开展,REIN在花色苷模拟溶液中分别添加槲皮素、芦丁、绿原酸、5-磺酸槲皮素、5-磺酸莫兰钠盐/单宁酸、中药黄酮提取物7种辅色素,测定储存过程中的红移和增色效应,结果发现,黄酮提取物的辅色效果最佳[12]。G MEZ-M
MEZ-M GUEZ等通过辅色作用比较了槲皮苷、杨梅苷、咖啡酸、香豆酸、儿茶素、表儿茶素和原花青素B2这7种辅色素与花色苷malvidin-3-glucoside间辅色效果,研究了模拟酒体系在储存过程中的颜色变化,结果显示黄酮醇中杨梅苷和槲皮苷的辅色效果最好,酚酸中的咖啡酸及香豆酸次之,而儿茶素和表儿茶素的辅色效果最差[6]。SCHWARZ等研究了发酵前添加辅色素对赤霞珠及丹魄红葡萄酒色泽的影响。结果发现,添加辅色素显著增强了花色苷的提取以及辅色作用,提高了红色色调,而上述作用在赤霞珠葡萄酒中表现的更为明显,特别是添加了芦丁或对香豆酸[13]。DARIAS-MARTIN等向发酵前的Listan negro葡萄酒中添加儿茶素和咖啡酸作为辅色素,结果显示,儿茶素增强了葡萄酒10%的颜色,而相同浓度的咖啡酸则增强了60%[14]。但是目前关于辅色素对葡萄酒花色苷及颜色影响的相关研究国内还鲜有报道[15]。
GUEZ等通过辅色作用比较了槲皮苷、杨梅苷、咖啡酸、香豆酸、儿茶素、表儿茶素和原花青素B2这7种辅色素与花色苷malvidin-3-glucoside间辅色效果,研究了模拟酒体系在储存过程中的颜色变化,结果显示黄酮醇中杨梅苷和槲皮苷的辅色效果最好,酚酸中的咖啡酸及香豆酸次之,而儿茶素和表儿茶素的辅色效果最差[6]。SCHWARZ等研究了发酵前添加辅色素对赤霞珠及丹魄红葡萄酒色泽的影响。结果发现,添加辅色素显著增强了花色苷的提取以及辅色作用,提高了红色色调,而上述作用在赤霞珠葡萄酒中表现的更为明显,特别是添加了芦丁或对香豆酸[13]。DARIAS-MARTIN等向发酵前的Listan negro葡萄酒中添加儿茶素和咖啡酸作为辅色素,结果显示,儿茶素增强了葡萄酒10%的颜色,而相同浓度的咖啡酸则增强了60%[14]。但是目前关于辅色素对葡萄酒花色苷及颜色影响的相关研究国内还鲜有报道[15]。
本研究选择3种不同类型的辅色素(表焙儿茶素-黄烷醇、咖啡酸-酚酸、槲皮素-黄酮醇),利用高效液相色谱对储存过程中葡萄酒内主要单体花色苷进行检测分析,采用CIELAB颜色参数系统比较不同辅色素对葡萄酒颜色及其稳定性的影响,研究对葡萄酒酿造生产中进一步提高红葡萄酒的色泽及稳定性具有很好的理论和实际意义。
1 材料与方法
1.1 材料与试剂
单体花色苷:二甲花翠素-3-O-葡萄糖苷(malvidin-3-O-glucoside, Mv3g)、二甲花翠素乙酰葡萄糖苷(malvidin-3-O-acetylglucoside, Mv3ac) 、二甲花翠素香豆酰葡萄糖苷(malvidin-3-O-coumarylglucoside,Mv3cm),纯度分别为96.8%,96.3%,98.7%,实验室制备[12];蛇龙珠葡萄,张裕葡萄酿酒股份有限公司提供;槲皮素(quercetin)、咖啡酸(caffeic acid)、表焙儿茶素(epigallocatechin,EGC)均为色谱纯,购自Sigma;乙腈、甲酸(色谱纯),上海安谱科学仪器有限公司。
1.2 仪器与设备
UV-1800紫外分光光度计,上海翱艺公司;酶标仪,美国Thermo Scientific公司;纯水仪,美国Millipore公司;AL204-IC分析天平,瑞士METTLER TOLEDO公司;P680戴安高效液相色谱仪,美国戴安公司。
1.3 实验方法
1.3.1 葡萄酒酿造
参考TANG等的方法进行发酵实验[16],挑选完整无破损,无霉烂果的蛇龙珠,适度破碎。添加60 mg/L SO2、发酵助剂、酵母K1,参考文献添加量添加辅色素EGC、咖啡酸、槲皮素120 mg/L[13],28 ℃控温发酵,空白组为未添加辅色素。每天循环2次,待液面平静,皮渣沉底,主发酵基本结束。接着皮渣分离,酒泥经低温自然沉降后,上清酒液移至酒瓶,调硫至50 mg/L,满容储存。
1.3.2 花色苷的HPLC分析
利用实验室已建立的方法[17],选用LiChroCART C18 色谱柱(250 mm×4.6 mm i.d.,5 μm),520 nm检测波长,柱温 45℃,进样体积 20 μL,流速 0.8 mL/min;
流动相A∶V(水)∶V(乙腈)∶V(甲酸)=800∶100∶25,流动相B∶V(水)∶V(乙腈)∶V(甲酸)=400∶500∶25(体积比)。
洗脱梯度:0~15 min,94%~70% A;15~30 min,30%~50% A;30~35 min,50%~60% A;35~
40 min,60%~6% A;40~45 min,6%A。
称取一定质量的花色苷Mv3g、Mv3ac、Mv3cm,用V(水)∶V(乙晴)∶V(甲酸)=87∶3∶10混合溶液稀释成不同浓度梯度的标准溶液,绘制成标准曲线,如表1所示。
表1 花色苷的标准曲线
Table 1 Calibration curves of three anthaocyanins

化合物保留时间/min标准曲线R2Mv3g15.697y=1.245 9x0.99Mv3ac24.624y=2.367 1x0.99Mv3cm29.583y=6.281 7x0.99
1.3.3 葡萄酒CIELAB颜色分析
葡萄酒样品经过0.45 μm微孔水相滤膜过滤,经0.5 cm光程,以蒸馏水作为对照,分别在 440、530和 600 nm下测定吸光度值,利用CIELAB法计算亮度 L*、红色色调a*、黄色色调b*、色度C*以及色调h参数,所有测定重复3次。
其中,L*代表亮度,L*=0代表黑色,L*=100代表无色,与葡萄酒颜色的深浅相关;a*代表红/绿色参数,若 a*>0,与红色相关,a*<0,与绿色相关;b*代表黄/蓝色参数,当 b*>0,与黄色相关,b*<0,与蓝色相关;色度 C*与葡萄酒的颜色鲜艳程度成正比;色调h表示不同的颜色[18]。
1.3.4 数据处理
所有样品检测数据重复3次,数据处理由SPSS 20.0(SPSS Inc., Chicago, Illinois, USA)及Microsoft Excel 2013实现。
2 结果与分析
2.1 辅色素对葡萄酒颜色的影响
由表2可知,随着储存时间的延长,L*值会逐渐升高,葡萄酒颜色变浅。添加辅色素的葡萄酒亮度降低速度比对照组缓慢,空白组亮度损失最大,约为18%,添加EGC、咖啡酸和槲皮素的葡萄酒亮度损失率分别为13.5%、12.7%、8.1%。
表2 添加不同辅色素葡萄酒储存过程中L*的变化
Table 2 Changes in lightness (L*) of wine containing different copigments during storage
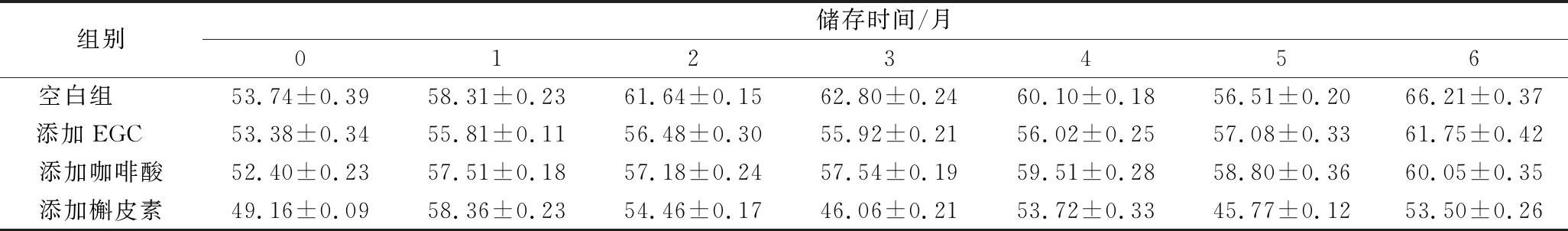
组别储存时间/月0123456空白组 53.74±0.3958.31±0.2361.64±0.1562.80±0.2460.10±0.1856.51±0.2066.21±0.37添加EGC 53.38±0.3455.81±0.1156.48±0.3055.92±0.2156.02±0.2557.08±0.3361.75±0.42添加咖啡酸52.40±0.2357.51±0.1857.18±0.2457.54±0.1959.51±0.2858.80±0.3660.05±0.35添加槲皮素49.16±0.0958.36±0.2354.46±0.1746.06±0.2153.72±0.3345.77±0.1253.50±0.26
由表3可知,随着储存时间的延长,a*值逐渐降低,红色色调降低,添加辅色素的葡萄酒红色色调降低速度比对照组缓慢,空白组红色色调降低最多,约为40.1%,添加EGC、咖啡酸和槲皮素的葡萄酒损失率分别为34.9%、31.1%、27.5%。 此外,添加EGC葡萄酒在储存初期就具有较强的红色色调,但储存后期a*值下降较快。推测EGC与花色苷在开始就形成辅色作用、生成辅色复合物,但辅色复合物的稳定性较差[19]。
表3 添加不同辅色素葡萄酒储存过程中a*的变化
Table 3 Changes in redness of wine containing different copigments during storage
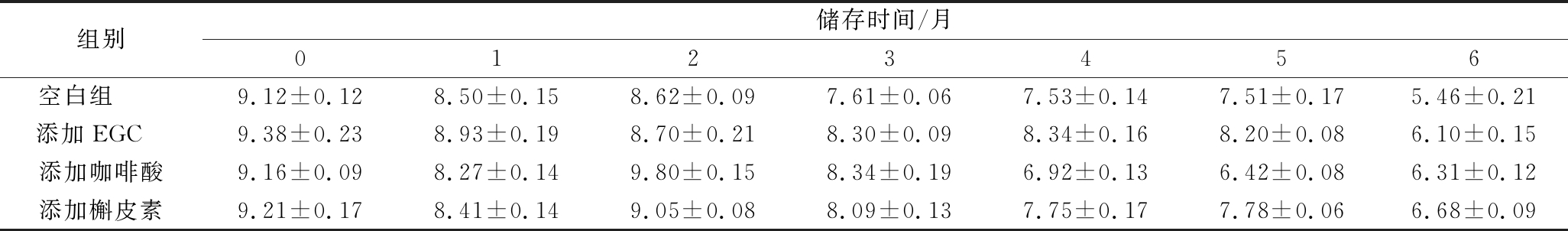
组别储存时间/月0123456空白组 9.12±0.128.50±0.158.62±0.097.61±0.067.53±0.147.51±0.175.46±0.21添加EGC 9.38±0.238.93±0.198.70±0.218.30±0.098.34±0.168.20±0.086.10±0.15添加咖啡酸9.16±0.098.27±0.149.80±0.158.34±0.196.92±0.136.42±0.086.31±0.12添加槲皮素9.21±0.178.41±0.149.05±0.088.09±0.137.75±0.177.78±0.066.68±0.09
由表4可知,随着储存时间的延长,b*值略有升高,黄色色调升高。但不同处理对葡萄酒的b*值影响不同,空白组、添加EGC、咖啡酸和槲皮素的葡萄酒黄色色调增加率分别为17.3%、15.6%、12.9%、7.8%,空白组黄色色调要明显高于添加辅色素的处理组。
表4 添加辅色素葡萄酒储存过程中b*的变化
Table 4 Changes in yellowness of wine containing different copigments during storage
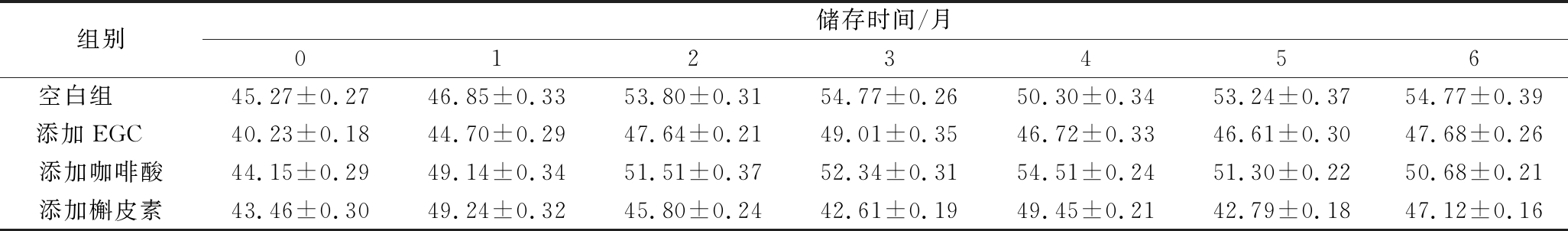
组别储存时间/月0123456空白组 45.27±0.2746.85±0.3353.80±0.3154.77±0.2650.30±0.3453.24±0.3754.77±0.39添加EGC 40.23±0.1844.70±0.2947.64±0.2149.01±0.3546.72±0.3346.61±0.3047.68±0.26添加咖啡酸44.15±0.2949.14±0.3451.51±0.3752.34±0.3154.51±0.2451.30±0.2250.68±0.21添加槲皮素43.46±0.3049.24±0.3245.80±0.2442.61±0.1949.45±0.2142.79±0.1847.12±0.16
由表5可以看出,储存过程中3种添加辅色素葡萄酒的色度C*与红色色调a*的变化趋势相同。随着储存时间的延长,葡萄酒C*值逐渐降低,色度降低。添加辅色素的葡萄酒色度降低速度比对照组缓慢,空白组色度降低最多,约为34.67 %,添加EGC、咖啡酸和槲皮素的葡萄酒损失率分别为21.95 %、14.69 %、11.21 %。
表5 添加不同辅色素葡萄酒储存过程中色度C*的变化
Table 5 Changes in chroma of wine containing different copigments during storage
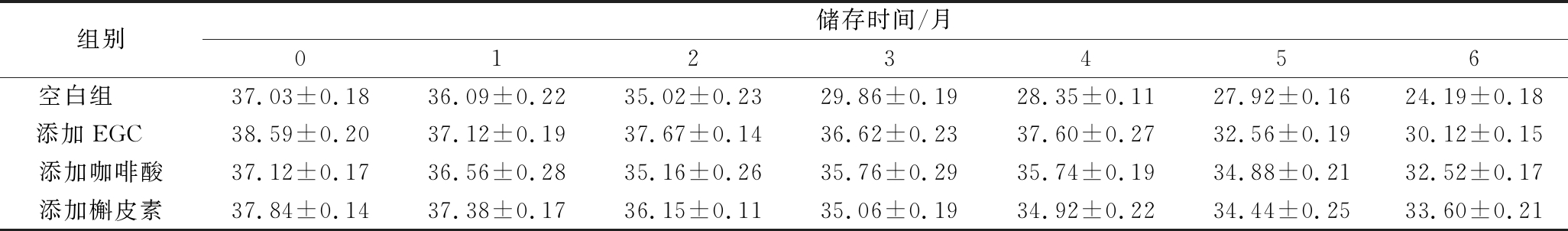
组别储存时间/月0123456空白组 37.03±0.1836.09±0.2235.02±0.2329.86±0.1928.35±0.1127.92±0.1624.19±0.18添加EGC 38.59±0.2037.12±0.1937.67±0.1436.62±0.2337.60±0.2732.56±0.1930.12±0.15添加咖啡酸37.12±0.1736.56±0.2835.16±0.2635.76±0.2935.74±0.1934.88±0.2132.52±0.17添加槲皮素37.84±0.1437.38±0.1736.15±0.1135.06±0.1934.92±0.2234.44±0.2533.60±0.21
色调h值从-90到0,表示葡萄酒颜色从蓝色到红色渐变;从0到90,表示颜色从红色到黄色渐变。这两种变化是红葡萄酒颜色随储存时间延长的变化方向.由表6可知,h值大于0且基本保持稳定,但有缓慢增加的趋势,说明葡萄酒颜色由玫红色向浅红黄色转移。G MEZ-M
MEZ-M GUEZ等[20]、SUN等[21]也发现相似的现象,他们推测与形成了新色素的吡喃花色苷结构有关。
GUEZ等[20]、SUN等[21]也发现相似的现象,他们推测与形成了新色素的吡喃花色苷结构有关。
表6 添加不同辅色素葡萄酒储存过程中色调h的变化
Table 6 Changes in hue of wine containing different copigments during storage
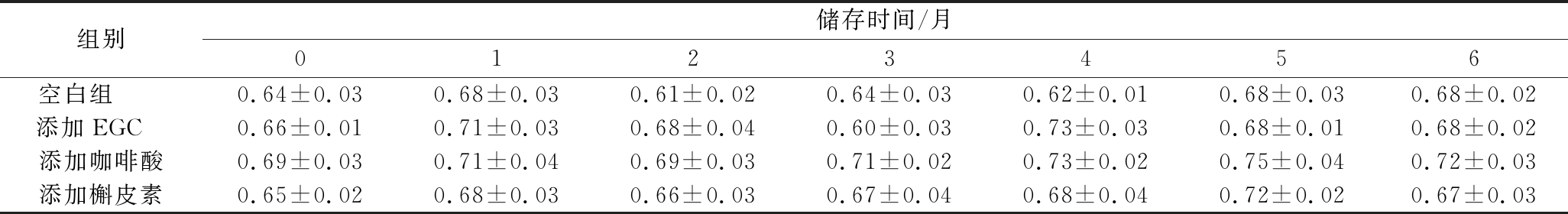
组别储存时间/月0123456空白组 0.64±0.030.68±0.030.61±0.020.64±0.030.62±0.010.68±0.030.68±0.02添加EGC 0.66±0.010.71±0.030.68±0.040.60±0.030.73±0.030.68±0.010.68±0.02添加咖啡酸0.69±0.030.71±0.040.69±0.030.71±0.020.73±0.020.75±0.040.72±0.03添加槲皮素0.65±0.020.68±0.030.66±0.030.67±0.040.68±0.040.72±0.020.67±0.03
2.2 辅色素对葡萄酒单体花色苷的影响
空白组葡萄酒储存过程中单体花色苷的变化如图1所示。
本研究选择Mv3g、Mv3ac、Mv3cm三种新鲜葡萄酒中最主要单体花色苷进行分析。刘婷婷曾测定了赤霞珠、蛇龙珠和梅鹿辄3个品种的41款新鲜葡萄酒,发现花色苷Mv3g的含量最高,占单体花色苷含量的27.71%~60.62%;2种酰化花色苷Mv3ac和Mv3cm含量次之;此3种花色苷的含量占单体花色苷总含量的76.45%~98.11%[19]。由图1可知,空白组总单体花色苷含量随贮存时间延长而逐渐降低,新酿葡萄酒总单体花色苷含量179.51 mg/L,6个月后总单体花色苷含量76.27 mg/L,降低57.5%。

图1 空白组葡萄酒储存过程中单体花色苷含量变化
Fig.1 The content of monomeric anthocyanins during
wine storage in blank group
添加EGC葡萄酒储存过程中单体花色苷的变化如图2所示。
与空白组相似,添加EGC葡萄酒总单体花色苷含量同样随贮存时间延长而逐渐降低,但是花色苷相较空白组减少更多,新酿葡萄酒总单体花色苷含量192.97 mg/L,6个月后总单体花色苷含量58.31 mg/L,降低69.7%。
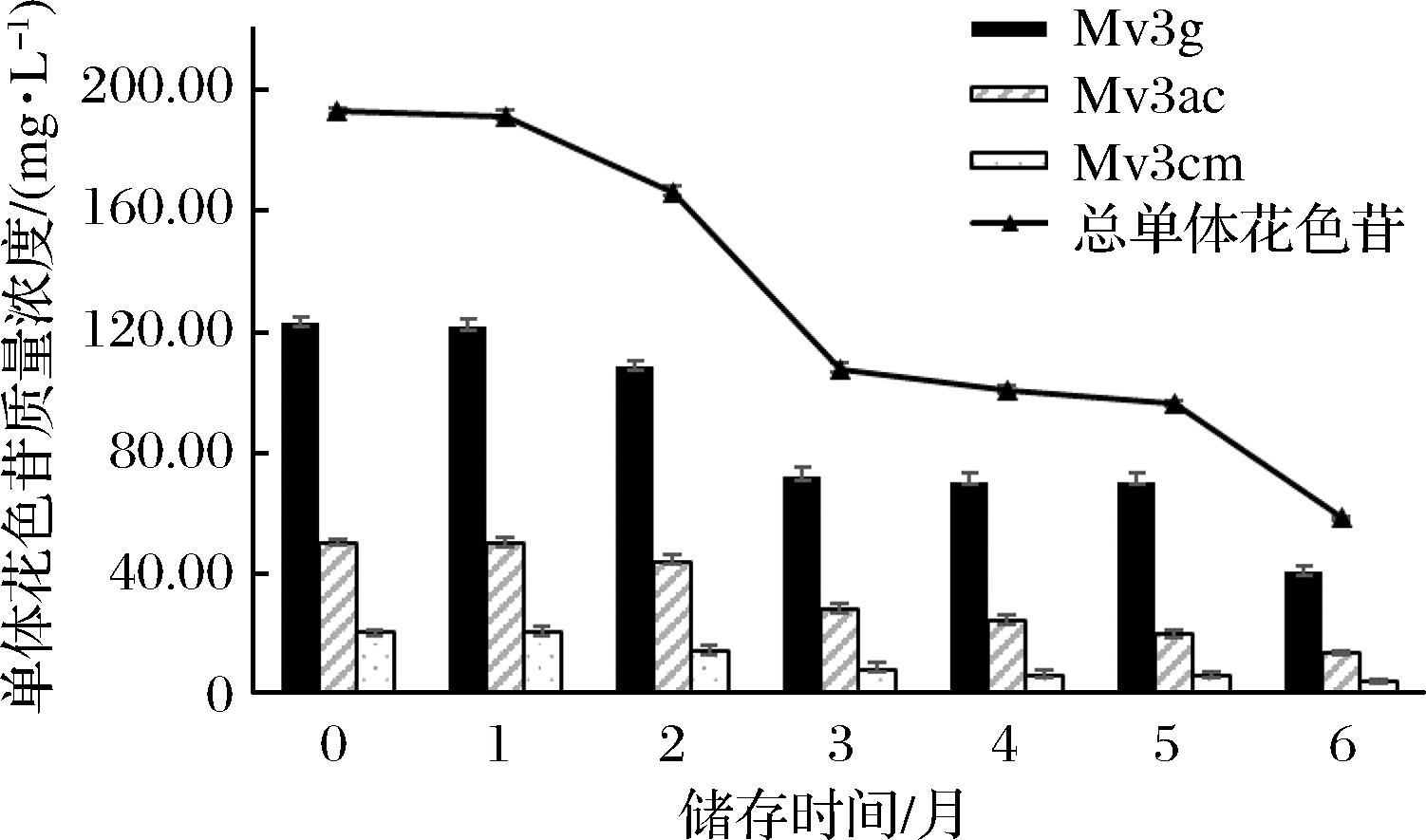
图2 添加EGC葡萄酒储存过程中单体花色苷含量变化
Fig.2 The content of monomeric anthocyanins during wine storage in EGC group
添加咖啡酸的葡萄酒储存过程中单体花色苷的变化如图3所示。
添加咖啡酸的葡萄酒中总单体花色苷含量随贮存时间延长而逐渐降低,新酿葡萄酒总单体花色苷含量196.90 mg/L,6个月后总单体花色苷含量57.25 mg/L,降低70.9%.
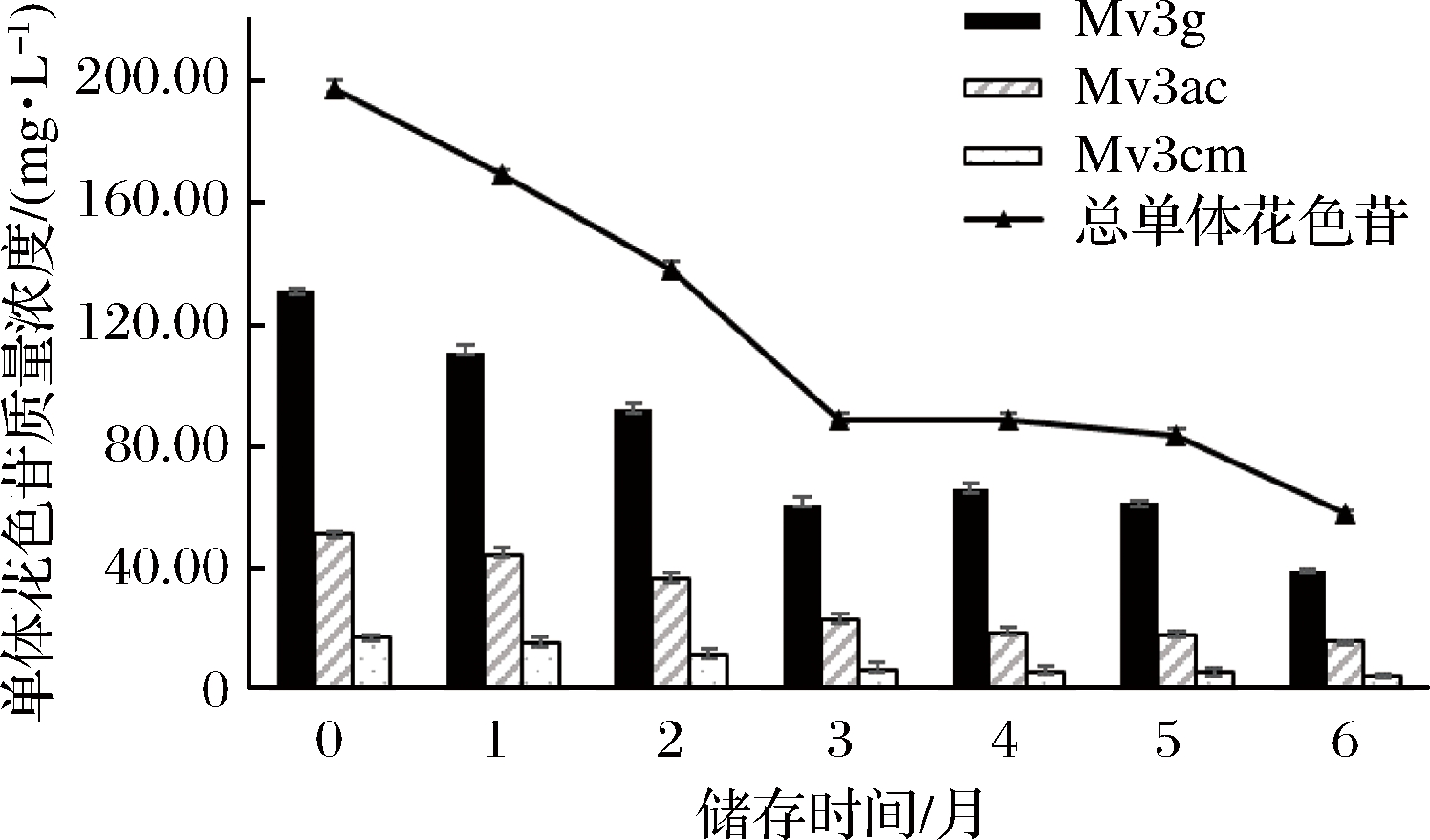
图3 添加咖啡酸葡萄酒储存过程中单体花色苷含量变化
Fig.3 The content of monomeric anthocyanins during wine storage in caffeic acid group
添加槲皮素的葡萄酒储存过程中单体花色苷的变化如图3所示。
与添加EGC和咖啡酸的葡萄酒相似,添加槲皮素的葡萄酒总单体花色苷含量同样随贮存时间延长而逐渐降低(图4),新酿葡萄酒总单体花色苷含量196.87 mg/L,6个月后总单体花色苷含量53.46 mg/L,降低了72.8%。
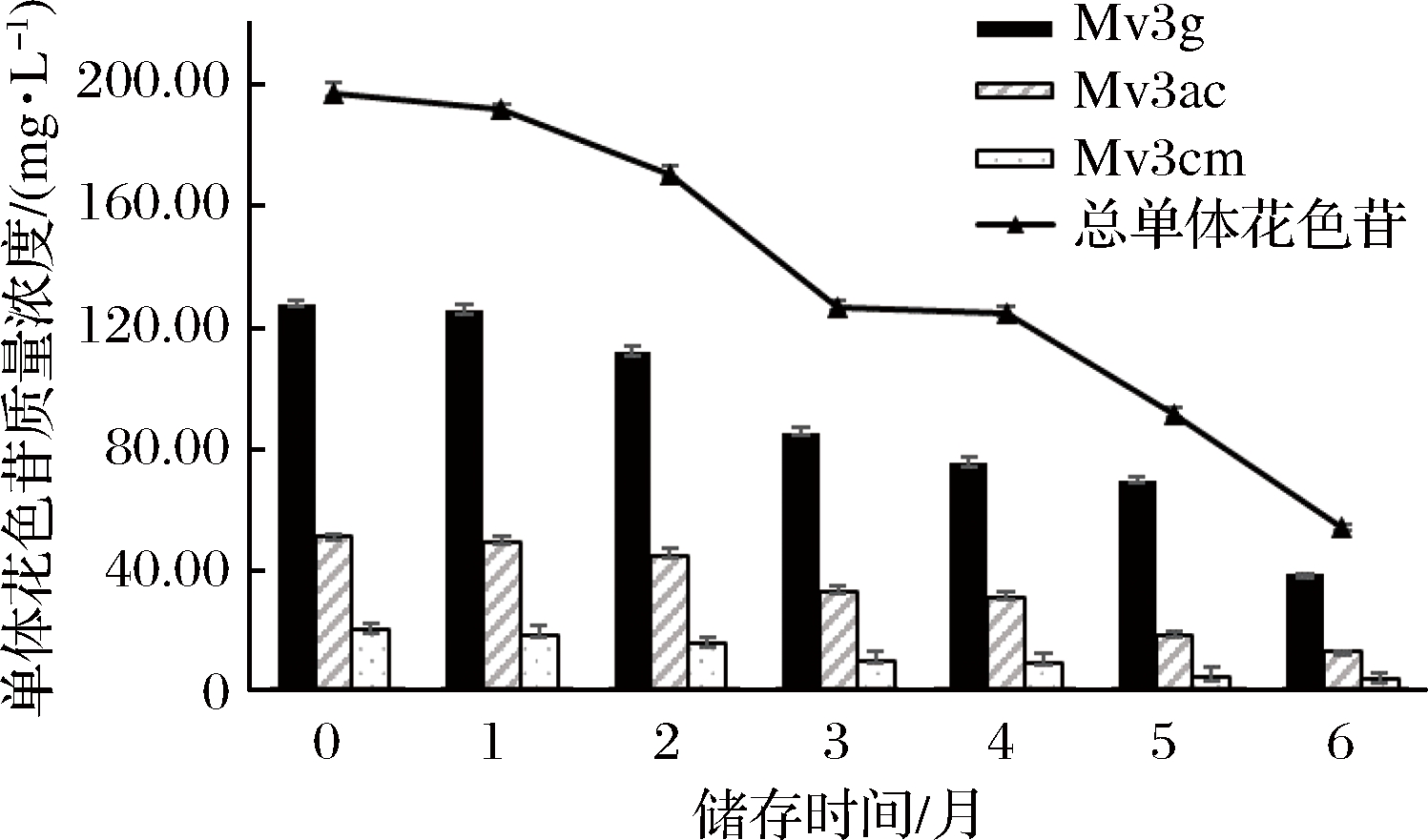
图4 添加槲皮素葡萄酒储存过程中单体花色苷含量变化
Fig.4 The content of monomeric anthocyanins during wine storage in quercetin group
辅助成色作用是一个循序渐进的过程,花色苷与辅色素形成稳定的花色苷-辅色素复合物。从上述结果看出,添加辅色素后单体花色苷含量会随着储存时间的延长而减少的更快,但是色度C*与红色色调a*的降解率却远低于空白对照组,推测是形成了稳定的花色苷-辅色素复合物,在葡萄酒陈酿过程中可以使葡萄酒颜色衰减变缓,色泽更加稳定[7]。
此外,总结关于花色苷辅色作用的文献可知,在研究较多的几类辅色素中,提高花色苷稳定性的能力由强到弱依次为黄酮醇>酚酸>黄烷醇[22-23],本研究结果也与之相符,推测这与辅色素的立体结构及分子大小有关[24-25]。
3 结论
通过分析储存过程中4组葡萄酒CIELAB颜色参数及单体花色苷含量变化,结果发现,不同的辅色素对葡萄酒颜色影响不同。随着储存时间的延长,色度降低率依次为空白组>EGC>咖啡酸>槲皮素,红色色调与色度变化趋势一致;由于储存过程中一方面单体花色苷会降解,另一方面辅色素也会与单体花色苷形成更稳定的络合物,故葡萄酒的总单体花色苷含量会逐渐降低,而添加辅色素在一定程度上可以促进这种辅助成色作用,对比添加EGC、咖啡酸和槲皮素组可知,总单体花色苷降低率依次为槲皮素>咖啡酸>EGC>空白组。综合来看,3种辅色素对葡萄酒颜色稳定性作用效果最好的是槲皮素,其次是咖啡酸、EGC。
[1] JENSEN J S, DEMIRAY S, EGEBO M, et al. Prediction of wine color attributes from the phenolic profiles of red grapes (Vitis vinifera) [J]. Journal of Agricultural and Food Chemistry, 2008, 56(3): 1 105-1 115.
[2] 韩富亮,李杨,李记明,等. 红葡萄酒花色苷结构和颜色的关系研究进展[J]. 食品与生物技术学报, 2011, 30(3): 328-336.
[3] 张波,韩舜愈,马腾臻,等. 红葡萄酒中花色苷衍生物结构研究进展[J]. 食品科学, 2018, 39(5): 284-295.
[4] TANG K, LIU T T, HAN Y H, et al. The importance of monomeric anthocyanins in the definition of wine colour properties[J]. South African Journal of Enology and Viticulture, 2017, 38(1): 1-10.
[5] ESCRIBANO-BAILON M T, SANTOS-BUELGA C. Anthocyanin copigmentation-evaluation, mechanisms and implications for the color of red wines[J]. Current Organic Chemistry, 2012, 16(6): 715-723.
[6] G MEZ-M
MEZ-M GUEZ M, GONZ
GUEZ M, GONZ LEZ-MANZANO S, ESCRIBANO-BAIL
LEZ-MANZANO S, ESCRIBANO-BAIL N M T, et al. Influence of different phenolic copigments on the color of malvidin 3-glucoside [J]. Journal of Agricultural and Food Chemistry, 2006, 54(15): 5 422-5 429.
N M T, et al. Influence of different phenolic copigments on the color of malvidin 3-glucoside [J]. Journal of Agricultural and Food Chemistry, 2006, 54(15): 5 422-5 429.
[7] 刘丽媛,苑伟,刘延琳,等. 红葡萄酒中花色苷辅助成色作用的研究进展[J]. 中国农业科学, 2010, 43(12): 2 518-2 526.
[8] BAKOWSKA A, KUCHARSKA A Z, OSZMIANSKI J. The effects of heating, UV irradiation, and storage on stability of the anthocyanin-polyphenol copigment complex[J]. Food Chemistry, 2003, 81(3): 349-355.
[9] BOULTON R. The copigmentation of anthocyanins and its role in the color of red wine: A critical review [J]. American Journal of Enology and Viticulture, 2001, 52(2): 67-87.
[10] ZHANG X K, HE F, ZHANG B, et al. The effect of prefermentative addition of gallic acid and ellagic acid on the red wine color, copigmentation and phenolic profiles during wine aging[J]. Food Research International, 2018, 106: 568-579.
[11] GARC A-EST
A-EST VEZ I, ALCALDE-EON C, PUENTE V, et al. Enological tannin effect on red wine color and pigment composition and relevance of the yeast fermentation products[J]. Molecules, 2017, 22(12): 2 046.
VEZ I, ALCALDE-EON C, PUENTE V, et al. Enological tannin effect on red wine color and pigment composition and relevance of the yeast fermentation products[J]. Molecules, 2017, 22(12): 2 046.
[12] REIN M. Copigmentation reactions and color stability of berry anthocyanins [D]. Helsinki: University of Helsinki, 2005.
[13] SCHWARZ M, PICAZO-BACETE J J, WINTERHALTER P, et al. Effect of copigments and grape cultivar on the color of red wines fermented after the addition of copigments[J]. Journal of Agricultural and Food Chemistry, 2005, 53(21): 8 372-8 381.
[14] DARIAS-MART N J, CARRILLO M, D
N J, CARRILLO M, D AZ E et al., Enhancement of red wine colour by pre-fermentation addition of copigments[J]. Food Chemistry,2001,73(2):217-220.
AZ E et al., Enhancement of red wine colour by pre-fermentation addition of copigments[J]. Food Chemistry,2001,73(2):217-220.
[15] 刘婷婷,唐柯,韩业慧,等. 辅色素对单体花色苷辅色效果的研究[J].食品工业科技,2014, 35(20): 111-116.
[16] TANG K, MA L, HAN Y H, et al. Comparison and chemometric analysis of the phenolic compounds and organic acids composition of Chinese wines [J]. Journal of Food Science, 2015, 80 (1): C20-C28.
[17] TANG K, LI Y, HAN Y H, et al. Studies on preparative isolation and stability of seven main anthocyanins from Yan 73 grape [J]. Journal of the Science of Food and Agriculture, 2014, 94(12):2 472-2 481.
[18] MOYANO M J, AYALA F, ECH VARRI J F, et al. Simplified measurement of virgin olive oil color by application of the characteristic vector method [J]. Journal of Oil & Fat Industries, 2001, 78(12): 1 221-1 226.
VARRI J F, et al. Simplified measurement of virgin olive oil color by application of the characteristic vector method [J]. Journal of Oil & Fat Industries, 2001, 78(12): 1 221-1 226.
[19] 刘婷婷. 辅色素对葡萄酒花色苷辅色作用及颜色影响的研究[D]. 无锡:江南大学, 2014.
[20] G MEZ-M
MEZ-M GUEZ M, GONZ
GUEZ M, GONZ LEZ-MANZANO S, ESCRIBANO-BAIL
LEZ-MANZANO S, ESCRIBANO-BAIL N M T, et al. Influence of different phenolic copigments on the color of malvidin 3-glucoside [J]. Journal of Agricultural and Food Chemistry, 2006, 54(15): 5 422-5 429.
N M T, et al. Influence of different phenolic copigments on the color of malvidin 3-glucoside [J]. Journal of Agricultural and Food Chemistry, 2006, 54(15): 5 422-5 429.
[21] SUN J, CAO X, BAI W, et al. Comparative analyses of copigmentation of cyanidin 3-glucoside and cyanidin 3-sophoroside from red raspberry fruits[J]. Food Chemistry, 2010, 120(4): 1 131-1 137.
[22] LAMBERT S G, ASENSTORFER R E, WILLIAMSON N M, et al. Copigmentation between malvidin-3-glucoside and some wine constituents and its importance to colour expression in red wine[J]. Food Chemistry, 2011, 125(1): 106-115.
[23] GORDILLO B, RODR GUEZ-PULIDO F J, GONZ
GUEZ-PULIDO F J, GONZ LEZ-MIRET M L, et al. Application of differential colorimetry to evaluate anthocyanin-flavonol-flavanol ternary copigmentation interactions in model solutions[J]. Journal of Agricultural and Food Chemistry, 2015, 63(35): 7 645-7 653.
LEZ-MIRET M L, et al. Application of differential colorimetry to evaluate anthocyanin-flavonol-flavanol ternary copigmentation interactions in model solutions[J]. Journal of Agricultural and Food Chemistry, 2015, 63(35): 7 645-7 653.
[24] GONZ LEZ-MANZANO S, DUE
LEZ-MANZANO S, DUE AS M, RIVAS-GONZALO J C, et al. Studies on the copigmentation between anthocyanins and flavan-3-ols and their influence in the colour expression of red wine [J]. Food Chemistry, 2009, 114(2): 649-656.
AS M, RIVAS-GONZALO J C, et al. Studies on the copigmentation between anthocyanins and flavan-3-ols and their influence in the colour expression of red wine [J]. Food Chemistry, 2009, 114(2): 649-656.
[25] TEIXEIRA N, CRUZ L, BR S N F, et al. Structural features of copigmentation of oenin with different polyphenol copigments [J]. Journal of Agricultural and Food Chemistry, 2013, 61(28): 6 942-6 948.
S N F, et al. Structural features of copigmentation of oenin with different polyphenol copigments [J]. Journal of Agricultural and Food Chemistry, 2013, 61(28): 6 942-6 948.