辣木(Moringa oleifera)属辣木科辣木属植物,营养比较全面,其根、茎、叶、花、种子、枝条等均含有较为丰富的蛋白质、维生素、矿物质元素、脂肪、氨基酸等营养成分,具有较高的药用价值[1-2],辣木籽油中的油酸等物质也具有较强的抗炎、调节血脂作用[3-4]。SREELATHA等利用辣木提取物对抗和诱导人类癌症细胞实验,结果表明辣木提取物具有很强的抗癌和诱导细胞凋亡的作用,可被作为潜在的癌症治疗药物[5]。生物碱是存在于自然界的一类含氮天然化合物,研究表明生物碱是中草药中重要的有生物活性的成分之一[6-7]。辣木富含多种生物,包括多酚类、皂苷类、生物碱类等,其中生物碱类物质具有抗炎、抑菌等活性[8-10]。目前对辣木的提取工艺主要有微波萃取、有机溶剂萃取、超声波萃取、超临界流体萃取等[11-12],传统的溶剂提取技术耗时长、效率低,且易引起生物活性下降,超声波萃取技术因其快速、高效得到广泛应用,目前关于辣木的研究主要在辣木叶深加工[13]、多酚[14]、多糖[15-16]应用等方面,超声技术应用于提取辣木中生物碱类物质的研究较少,因此本研究主要以辣木茎为原料,采用超声波辅助提取其生物碱类物质,运用Central Composite Design响应面设计进行工艺优化,并研究了辣木生物碱对α-抑制葡萄糖苷酶抑制作用,为进一步促进其医药用途的开发奠定基础。
1 材料与方法
1.1 材料与仪器
新鲜辣木由广东信宜三保惠民信息服务专业合作社提供,带叶采摘后3~4 h运抵实验室,分拣去叶后的辣木茎经50 ℃干燥、粉碎过40目筛备用。
α-葡萄糖苷酶(E.C.3.2.1.20),酶活性为50 000 U/mL,上海金穗生物科技有限公司;4-硝基苯-β-D-吡喃葡萄糖苷(4-nitrophenyl-β-D-glucopyranoside,PNPG),北京梦怡美生物科技有限公司;阿卡波糖(acarbose,50 mg/片),德国拜耳医药公司;无水乙醇、Na2CO3、KH2PO4等试剂均为国产分析纯,所用水为超纯水。
XFB-200高速中药粉碎机,吉首市中诚制药机械厂;BILON-2006低温超声波萃取仪,上海比朗仪器有限制造有限公司;UV-5100紫外分光光度计,上海元析仪器有限公司;RE-52AA旋转蒸发器,上海亚荣生化仪器厂;GB204 型电子天平,瑞士梅特勒-托利多公司。
1.2 生物碱的测定
1.2.1 溴甲酚绿溶液
准确称取溴甲酚绿50.00 mg,加入100 mL烧杯中,加入6.0 mL 0.2 mol/L NaOH溶液溶解,再准确称取邻苯二甲酸氢钾1.020 g,加入适量蒸馏水溶解后定容调节pH值至4.4,备用。
1.2.2 标准曲线的制备
贝母素甲对照品溶液:准确称取贝母素甲20 mg,放置于50 mL容量瓶中,加入少量无水乙醇使其溶解后定容,摇匀,备用。参考文献[17]的方法精密量取贝母素甲对照品溶液1.0、3.0、5.0、7.0、9.0 mL于10 mL容量瓶中,各加1.2.1中的溴甲酚绿溶液1.0 mL,摇匀后再加入三氯甲烷溶液10.0 mL,混匀、静置、过滤,以三氯甲烷液为空白对照,在411 nm处测定对照品及空白溶液吸光度,以浓度为横坐标,吸光度为纵坐标,计算所得标准曲线回归方程为:A=0.037 61 C-0.011 48,R2=0.999 2(其中A为吸光度, C为质量浓度mg/L),结果表明在10~150.0 mg/L线性关系良好。
1.3 单因素试验
以辣木茎生物碱的含量为指标,考察超声萃取时间、功率、料液比以及乙醇体积分数对提取率的影响分别进行单因素实验。准确称取烘干至质量恒定的辣木茎粉末10 00 g,采用体积分数60%乙醇进行萃取,在不同的超声波功率、料液比下超声辅助萃取一定时间,抽滤,滤液浓缩备用,将提取得到的生物碱溶于10 mL无水乙醇,于25 mL容量瓶中摇匀定容,备用。按照1.2.2的方法测定吸光度,根据标准曲线计算生物碱的提取率。
1.4 响应面试验设计
根据单因素实验结果,选择超声萃取时间、功率、料液比以及乙醇体积分数为考察因素,提取率为响应值,采用Central Composite Design进行响应面设计,实验水平和编码见表1。
表1 响应面试验的因子水平和编码
Table 1 Factors and levels of response surface experiments

水平因素A(超声波功率)/WB(超声波时间)/minC(液料比)/(g∶mL)-1200201∶50250301∶101300401∶15
1.5 抑制α-葡萄糖苷酶活性测定
参照王占一等[18]的试验方法,有改动。准确移取1.5 mL 0.1 mol/L的磷酸(PBS)缓冲液(pH 6.8)及0.25 mL 0.2 U/mL α-葡萄糖苷酶溶液于试管中,加入不同浓度的样品溶液0.25 mL,混匀后于37 ℃恒温反应15 min,加入0.25 mL 2.5 mmol/L的PNPG溶液于37 ℃恒温反应20 min后,再加入0.2 mol/L的Na2CO3溶液1 mL终止反应,并于405 nm波长下测定吸光度值,记作样品组A1。以PBS缓冲液代替酶,其他条件同样品组A1,记作样品空白组A2。以PBS缓冲液代替样品溶液,其他条件同样品组,记作阴性对照组A3。以PBS缓冲液代替酶液和样品溶液,其他条件同样品组,记作空白组A4。以阿卡波糖为阳性对照,平行测定5次,取其平均值(样品浓度和阿卡波糖浓度梯度均为20、40、60、80、100、120 μg/mL)。α-葡萄糖苷酶活力单位定义为:pH 6.8 37 ℃条件下每分钟释放1.0 mol硝基酚为1个活力单位,实验设计如表2所示。
表2 抑制α-葡萄糖苷酶活性实验设计
Table 2 Design of inhibition activity α-glucosidase of alkaloid
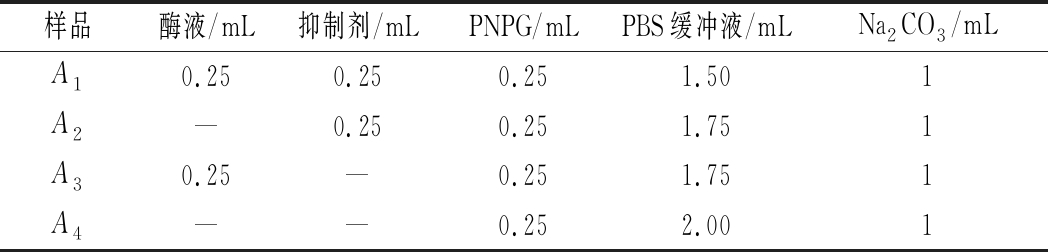
样品酶液/mL抑制剂/mLPNPG/mLPBS缓冲液/mLNa2CO3/mLA10.250.250.251.501A2—0.250.251.751A30.25—0.251.751A4——0.252.001
注:“-”表示无。
按公式(1)计算样品对α-葡萄糖苷酶的抑制率及IC50:
抑制率![]()
(1)
1.6 对α-葡萄糖苷酶抑制作用的动力学试验
设置5个不同浓度PNPG(1.0、1.5、2.0、2.5、5.0 mmol/L),3个不同样品质量浓度(0、50、100 g/L)、0.2 U/mL α-葡萄糖苷酶浓度,参照1.5的方法,以反应速度的倒数为纵坐标,绘制Lineweaver-Burk曲线,判断样品对α-葡萄糖苷酶的抑制类型。设置6个不同的α-葡萄糖苷酶浓度(0.1、0.2、0.4、0.6、0.8、1.0 U/mL),固定底物PNPG的浓度(2.5 mmoL/L)不变,以酶浓度为横坐标,反应速率为纵坐标,研究样品对α-葡萄糖苷酶的抑制作用是否可逆。
1.7 统计分析
实验数据采用Microsoft Excel和Design Expert 6.0软件进行统计分析,采用单因素方差(One-way ANOVA) 分析方法进行多重比较,P<0.05和P<0.01分别表示差异显著和极显著,试验重复测试3次。
2 结果与分析
2.1 单因素试验
超声辅助萃取辣木茎生物碱工艺中超声功率、乙醇浓度、超声时间、料液比对提取率的影响如图1所示。
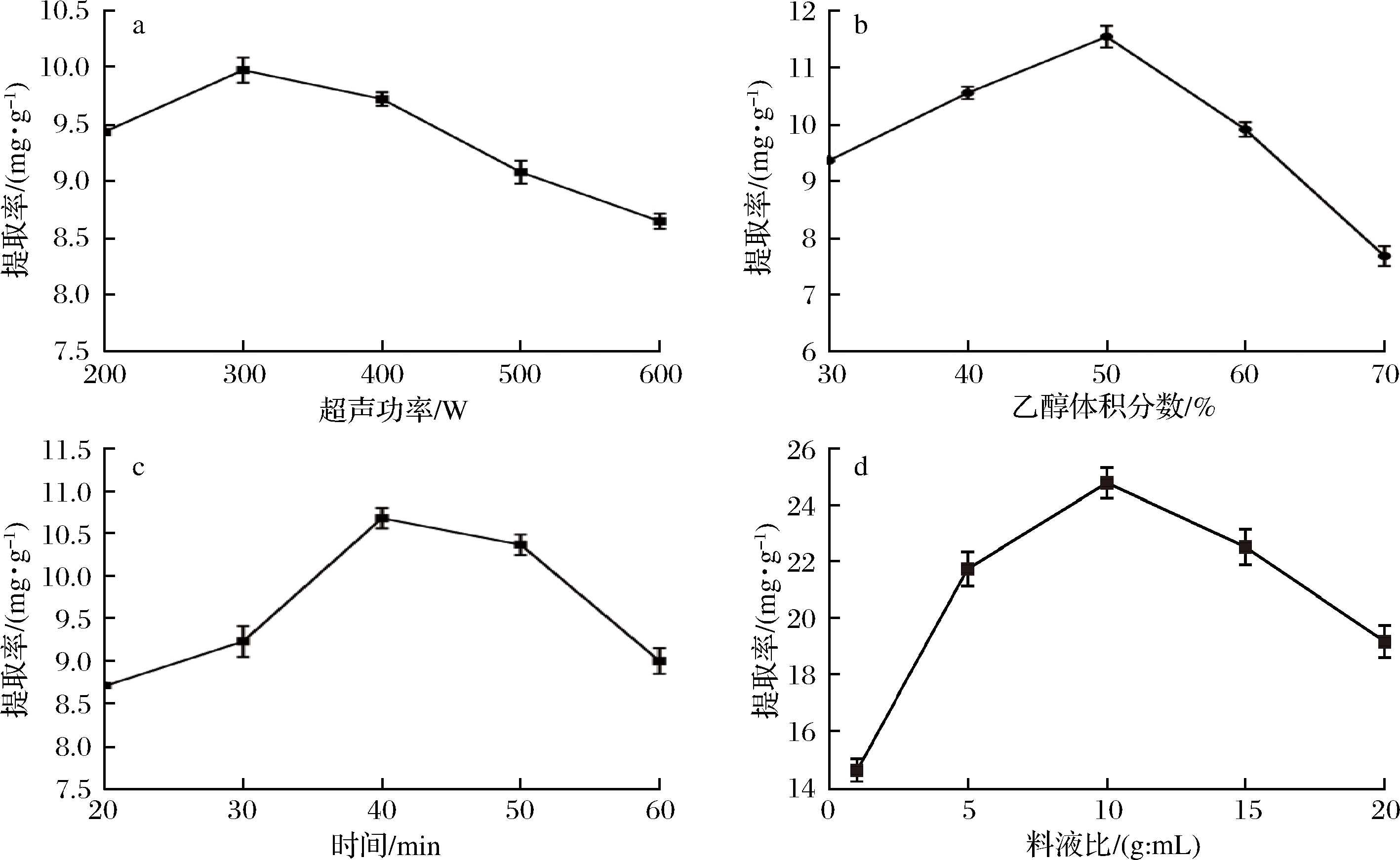
a-超声功率对提取率的影响;b-乙醇浓度对提取率的影响;c-超声时间对提取率的影响;d-料液比对提取率的影响
图1 辣木生物碱萃取工艺中超声功率、乙醇浓度、超声时间和料液比对提取率的影响
Fig.1 Effect of ultrasonic power, ethanol concentration, extraction time, solid-liquid ratio on the extraction yield
of alkaloids from Moringa oleifera
由图1-a可知,在其他萃取条件一定的情况下,超声功率为250 W时,生物碱提取率达到21.47 mg/g,当功率大于250 W时,其提取率呈下降趋势,这可能是由于随超声功率增大,分子运动导致生物碱分子氧化、分解引起的。由图1-b可知,在其他萃取条件不变的情况下,生物碱提取率随萃取溶剂乙醇浓度的增大而升高,在乙醇体积分数为60%时,生物碱提取率达到26.24 mg/g。由图1-c可知,在其他条件不变的情况下,生物碱提取率随超声提取时间的延长而增加,30 min时提取率先增加到19.14 mg/g,而后下降,这可能是由于在30 min时生物碱大部分已溶出,故确定提取过程的适宜的超声时间为30 min。由图1-d可知,在其他萃取条件不变的情况下,辣木中的生物碱提取率随料液比的增加先上升后下降,当料液比为1∶10时提取率为24.80 mg/g。当料液比大于1∶10时,其提取率的变化呈下降趋势,可能是由于低浓度的液料比使生物碱提取不充分,高浓度的液料比会导致一些其他物质溶出引起的。
2.2 响应面试验分析
根据Central Composite Design响应面设计的原理,以超声波功率(A)、时间(B)和料液比(C)为响应面的影响因数,生物碱提取率为响应值,基于单因素实验进行响应面优化分析,实验结果如表3所示。
表3 响应面分析及结果
Table 3 Response surface design analysis and experimental results
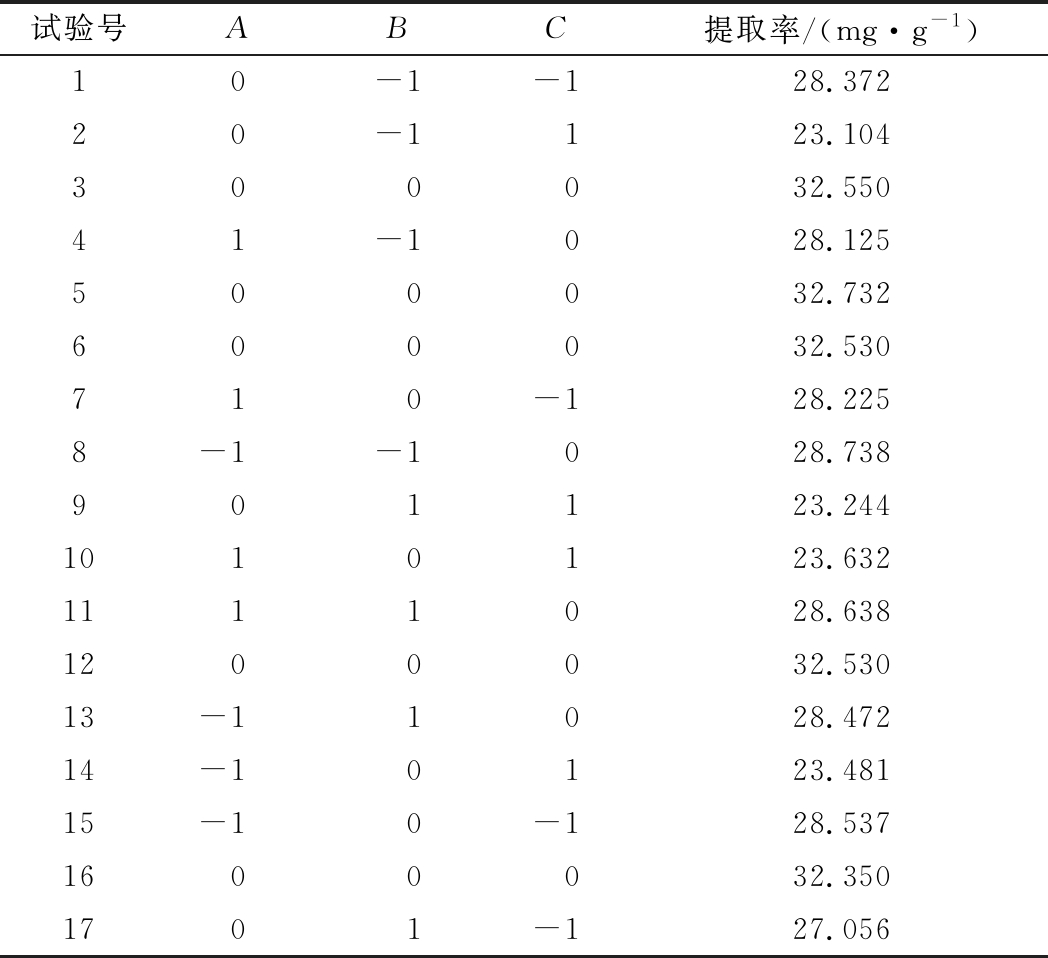
试验号ABC提取率/(mg·g-1)10-1-128.37220-1123.104300032.55041-1028.125500032.732600032.530710-128.2258-1-1028.738901123.2441010123.6321111028.6381200032.53013-11028.47214-10123.48115-10-128.5371600032.3501701-127.056
根据表3的数据来计算各项回归系数,用回归系数建立相关因子的数学回归模型,得到超声辅助萃取生物碱的响应面模型为:
Y=32.54-0.076A-0.12B-2.34C-1.76A2-2.28B2-4.81C2+0.19AB+0.12AC+0.36BC
对该模型进行方差分析,结果如表4所示。
表4 回归模型方差分析表
Table 4 Analysis of variance of the equation
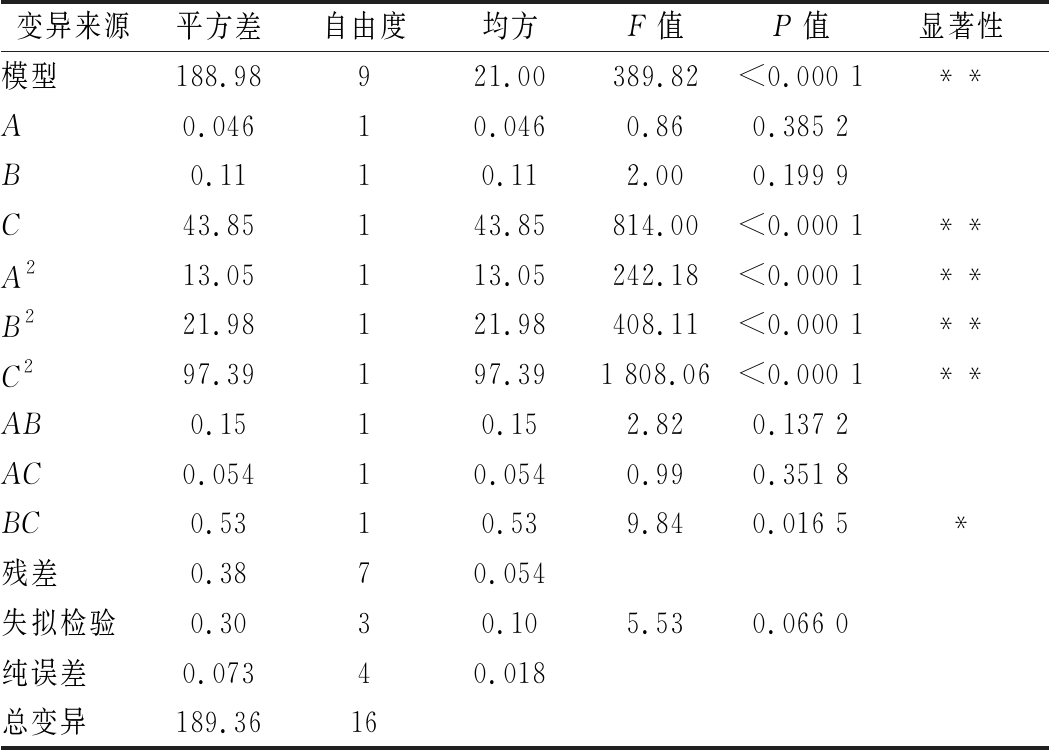
变异来源平方差自由度均方F值P值显著性模型188.98921.00389.82<0.000 1**A0.04610.0460.860.385 2B0.1110.112.000.199 9C43.85143.85814.00<0.000 1**A213.05113.05242.18<0.000 1**B221.98121.98408.11<0.000 1**C297.39197.391 808.06<0.000 1**AB0.1510.152.820.137 2AC0.05410.0540.990.351 8BC0.5310.539.840.016 5*残差0.3870.054失拟检验0.3030.105.530.066 0纯误差0.07340.018总变异189.3616
注:**表示极显著,P<0.001,*表示显著,P<0.05。
由表4可知,该模型P值<0.000 1差异极显著,失拟项的P值为0.066 0,决定系数![]() 表明该回归模型显著性较好,辣木茎生物碱提取率实际值和预测值之间具有较好的拟合度。
表明该回归模型显著性较好,辣木茎生物碱提取率实际值和预测值之间具有较好的拟合度。
2.3 交互作用分析
从回归系数的显著性检验可知,超声时间、功率与料液比的互作效应对生物碱提取率影响明显,根据二次回归方程绘制的响应面如图2所示。
由图2-a可知,当超声功率一定时,随着时间的增加,生物碱提取率增大,超声时间29.54 min时提取率最大,超声波功率的影响也是先增大后减小,在时间的交互作用下最佳的超声波功率为248.40 W。超声功率和时间交互作用较为显著,与模型的方差分析结果一致。由图2-b可知,当超声波功率一定时,随着料液比的增大提取率增大,料液比为1∶8.78时,生物碱提取率到达最大值。此外,料液比的曲面变化要比超声波功率的陡峭,等高线变化密集程度高于超声波功率等高线变化密集程度,表明料液比对生物碱提取率影响较大。由图2-c可知,超声功率不变,随着料液比的增大生物碱提取率增大,料液比到达1∶8.78时,生物碱提取率最大,但当料液比超过1∶8.78之后,生物碱提取率开始下降。在料液比的交互作用下,最佳时间为29.54 min。此外,料液比的曲面变化要比时间的陡峭,等高线变化密集程度高于时间等高线变化密集程度,表明料液比对生物碱提取率影响较为显著,这与模型的方差分析结果一致。超声波辅助提取辣木茎生物碱的最优工艺条件为是:超声波功率248.40 W、超声波时间29.54 min、料液比1∶8.78 (g∶mL),生物碱的模型预测值为32.83 mg/g,为进一步检验响应面分析法的可靠性,经优化后的生物碱提取工艺参数为超声波功率250 W、萃取时间30 min、料液比1∶9 (g ∶mL),最终测得平均提取率为32.78 mg/g,与预测值误差为0.15%,因此采用响应面分析优化得到的浸提参数准确可靠。

a-超声时间和超声功率的交互作用;b-超声功率和料液比的交互作用;c-超声时间和料液比
图2 辣木茎生物碱的超声提取响应曲面图
Fig.2 Response surface plots showing the pairwise effects of supersonic time, supersonic wave power and ratio of solid-liquid on the extraction rate of pectin
2.4 辣木生物碱对α-葡萄糖酶活性的抑制作用
辣木茎生物碱对α-葡萄糖酶活性的抑制作用影响结果如图3所示。
如图3所示,在20~120 mg/L随辣木茎中的生物碱浓度的增加,其对α-葡萄糖苷酶的抑制作用逐渐增加,120 mg/L的生物碱对α-葡萄糖苷酶抑制率达到86.11%,IC50可表示生物碱对α-葡萄糖苷酶抑制的强弱,IC50值越小说明其抑制效果越好。经计算生物碱与阿卡波糖的IC50分别为0.034 g/L和0.022 g/L(P<0.05),表明生物碱对α-葡萄糖苷酶活性具有较强的抑制作用,这与文献[19-20]报道的研究结果比较一致。
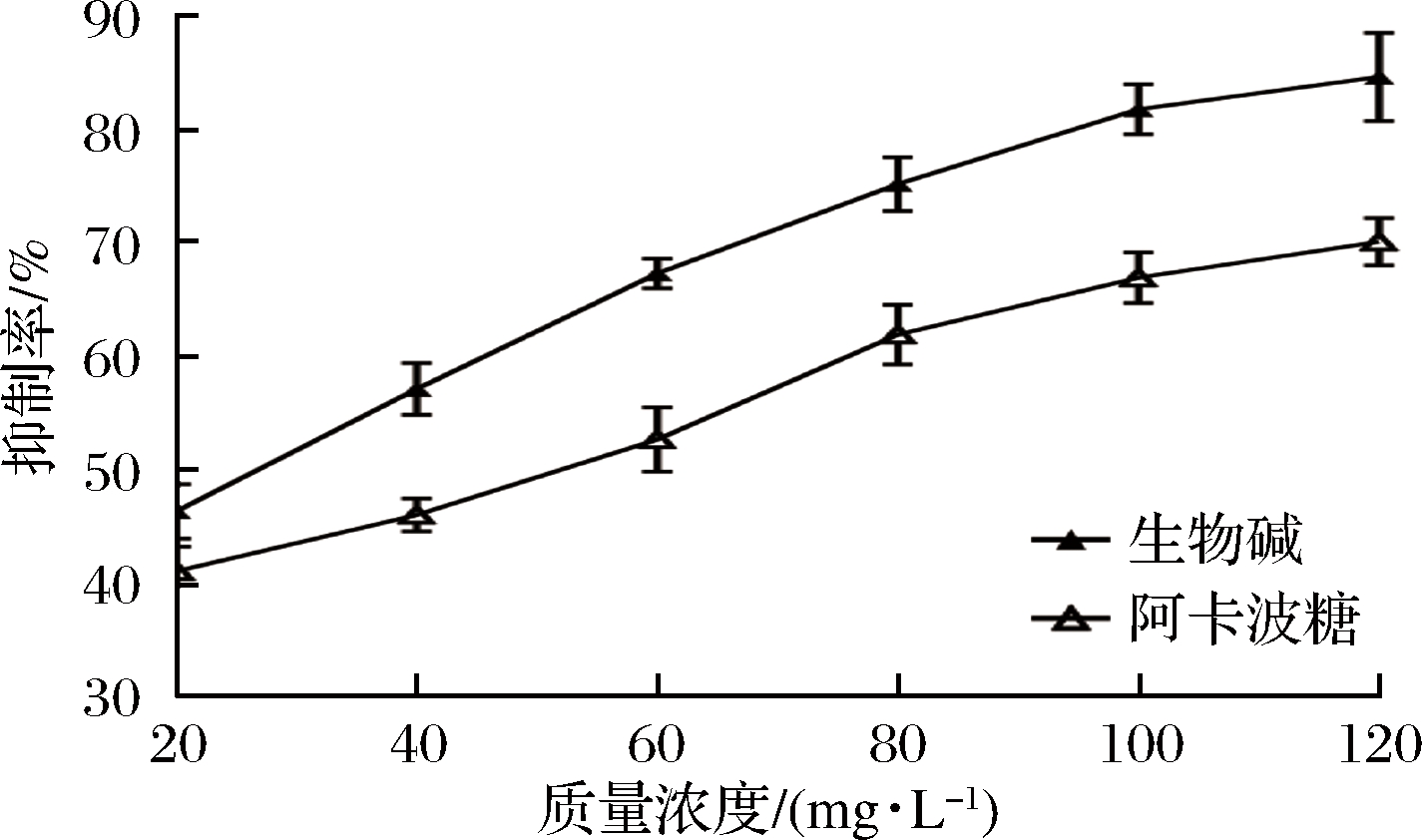
图3 辣木茎生物碱对α-葡萄糖苷酶活性的抑制作用比较
Fig.3 Comparison of inhibition activity of α-glucosidase of alkaloids from Moringa oleifera
2.5 生物碱对α-葡萄糖苷酶抑制作用的动力学试验
根据Lineweaver-Buck曲线及反应速率曲线判断生物碱的酶促反应中抑制剂的抑制类型的结果如图4所示。
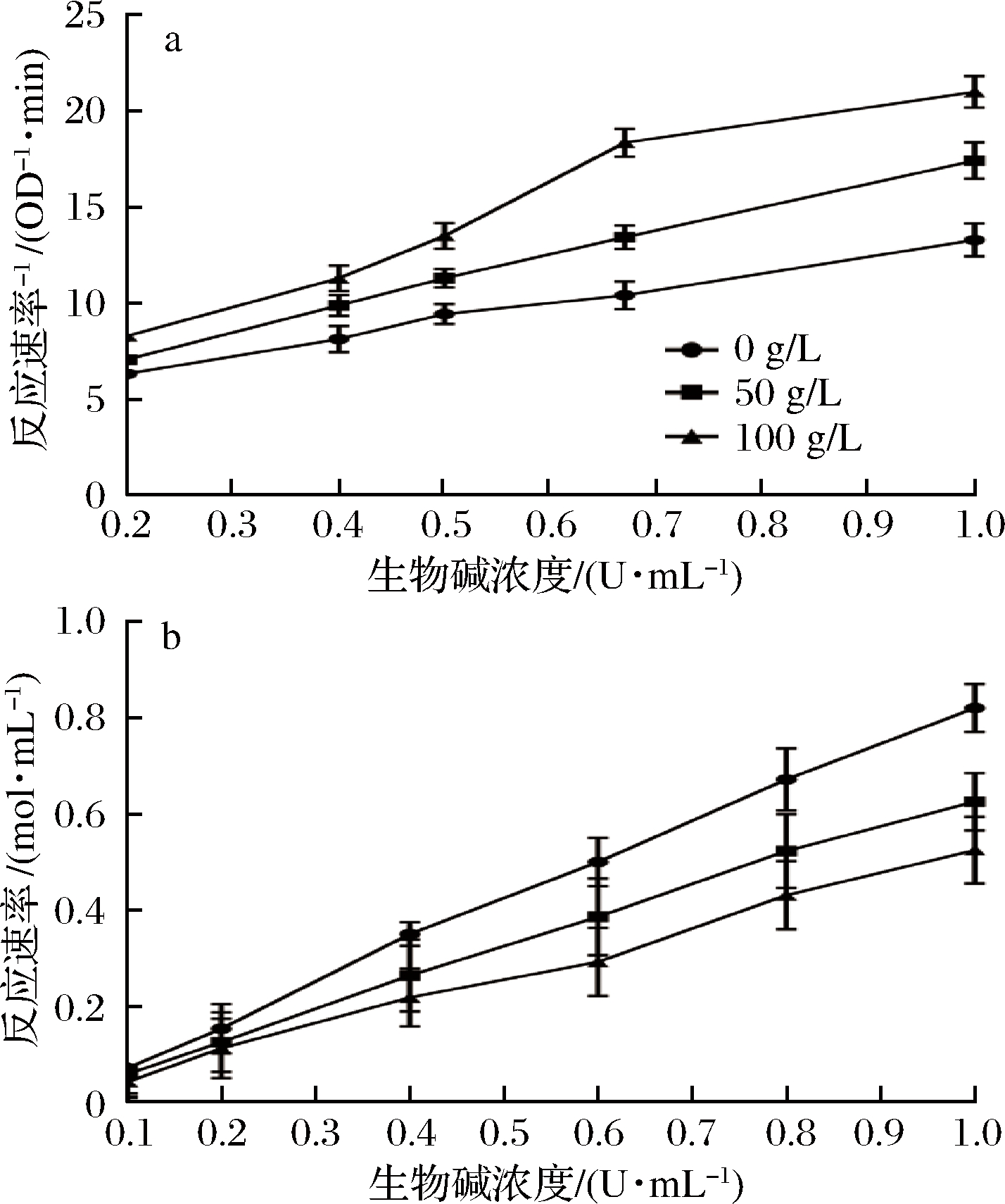
a-Lineweaver-Burk曲线;b-反应速率曲线
图4 生物碱对α-葡萄糖苷酶抑制作用的曲线
Fig.4 The curve of Lineweaver-Burk and reaction rate of inhibition α-glucosidase of alkaloids from Moringa oleifera
由图4-a可知,生物碱对α-葡萄糖苷酶活性抑制作用的Lineweaver-Burk曲线中无抑制剂组的线性回归方程为:y=8.643x+4.662;50 g/L抑制剂组的线性回归方程为:y=12.882x+4.665;100 g/L抑制剂组的线性回归方程为:y=17.299x+4.684,R2均大于0.998 0,随着抑制剂的浓度增大反应速率增强;当底物浓度相同时,抑制剂浓度从0增加到100 g/L,反应速率降低,由此可知生物碱对α-葡萄糖苷酶的抑制作用为竞争性抑制。由图4-b可知,所得的酶浓度-反应初速率曲线具有相同的变化趋势,当酶浓度相同时抑制剂浓度从0增加到100 g/L,直线斜率从0.84下降到0.52,表明生物碱对α-葡萄糖苷酶具有可逆抑制作用。
3 结论
本文结合单因素试验和响应面优化试验考察了超声功率、提取时间和料液比对辣木茎生物碱提取效果的影响。结果表明,超声辅助萃取辣木茎中的生物碱类物质的最佳工艺参数为超声功率250 W、超声波时间30 min、料液比1∶9 (g∶mL),生物碱的提取率为32.78 mg/g。
辣木茎生物碱对α-葡萄糖苷酶的抑制作用研究表明,当生物碱质量浓度为120 mg/L时,对α-葡萄糖苷酶抑制率达到86.11%,抑制作用的IC50为0.034 g/L。通过分析Lineweaver-Burk曲线和酶浓度-反应初速率曲线可知,在质量浓度20~120 mg/L,生物碱浓度与其对α-葡萄糖苷酶抑制效果之间呈现一定的正相关关系,其抑制机理属于竞争性抑制和可逆性抑制。
[1] 孙丹,管俊岭,许玫,等. 辣木的有效成分、保健功能和开发利用研究进展[J]. 热带农业科学, 2016,36(3):28-33.
[2] 邵婷,刘昕,黎重阳,等. 超声波辅助高效提取辣木籽中的蛋白质[J].食品与发酵工业, 2019, 45(9):207-213.
[3] 虎虓真,陶宁萍,许长华. 基于食药价值的辣木籽研究进展[J].食品科学, 2018, 39(15):302-309.
[4] 刘凤霞,王苗苗,赵有为,等. 辣木中功能性成分提取及产品开发的研究进展[J].食品科学, 2015, 36(19):282-286.
[5] SREELATHA S,JEYACHIITRE A,PADMA P R. Antiproliferation and induction of apoptosis by Moringa oleifera leaf extract on human cancer cells[J]. Food and Chemical Toxicology, 2011,49(6):1 270-1 275.
[6] 尚潇潇,朱琳,罗孝菁,等. 菁喜树叶中生物碱成分提取工艺优化及抗菌抗氧化活性研究[J]. 天然产物研究与开发, 2018, 30(12):2 150-2 156;2 137.
[7] 官慧敏,荆敏琪,吴磊,等. 托盘根生物碱对α-葡萄糖苷酶的抑制作用研究[J]. 吉林医药学院学报, 2015, 36(6):428-431.
[8] SHIN J, PRABHAKARAN V S, KIM K. The multi-faceted potential of plant-derived metabolites as antimicrobial agents against multidrug-resistant pathogens[J]. Microbial Pathogenesis, 2018, 116:209-214.
[9] DALJIT S A, JEMIMAH G O. In vitro antimicrobial evaluation and phytoconstituents of Moringa oleifera pod husks[J]. Industrial Crops and Products, 2014, 52:125-135.
[10] 周伟,刘能,林丽静,等.辣木叶乙醇提取物的抗氧化活性研究[J]. 现代食品科技, 2017, 33(10):149-156.
[11] 余先邦.超声波提取苦豆子生物碱工艺优化研究[J]. 安徽农学通报, 2017, 23(11):37-39.
[12] CHEN C, ZHANG B, FU X, et al. Microwave-assisted extraction of polysaccharides from Moringa oleifera Lam. leaves: Characterization and hypoglycemic activity[J]. Industrial Crops and Products,2017,100:1-11.
[13] 宁俊丽,龙霞,黄先智,等. 响应面法优化鸭油超声波提取工艺[J].食品与发酵工业, 2019, 45(8):184-190.
[14] NAIF A A D, KARUPPIAH P, PRAKASH M J. Development and validation of ultrasound-assisted solid-liquid extraction of phenolic compounds from waste spent coffee grounds[J]. Ultrasonics Sonochemistry, 2017, 34:206-213.
[15] 符稳群,孙言言,李晓花,等. Box-Behnken响应面法优化超声波辅助提取辣木叶多酚工艺科学[J]. 亚热带植物科学, 2018,47(2):107-112.
[16] CUI C, CHEN S, WANG X et al. Characterization of Moringa oleifera roots polysaccharide MRP-1 with anti-inflammatory effect[J]. International Journal of Biological Macromolecules, 2019, 132:844-851.
[17] WU X, CHAN S, MA J, et al. Investigation of association of chemical profiles with the tracheobronchial relaxant activity of Chinese medicinal herb Beimu derived from various Fritillaria species[J]. Journal of Ethnopharmacology, 2018, 210:39-46.
[18] 王占一,廖成斌,公金艳,等.复合酶提取石榴幼果总黄酮工艺优化及其抑制α-葡萄糖苷酶活性[J]. 食品工业科技, 2019, 40(9):178-183;188.
[19] CHEN S, YONG T, XIAO C, et al. Pyrrole alkaloids and ergosterols from Grifola frondosa exert anti-α-glucosidase and anti-proliferative activities[J]. Journal of Functional Foods, 2018, 43:196-205.
[20] COSTA E V, SOARES L N, MARIA L B, et al. Guaianolide sesquiterpene lactones and aporphine alkaloids from the stem bark of Guatteria friesiana[J]. Phytochemistry, 2018, 145:18-25.