生物防腐剂因具有天然、高效、安全性高等优势受到人们青睐[1],它包括生物源抑菌物质及具有抑菌活性微生物防腐2种类型[2]。生物源抑菌物质主要包括动植物提取物[3-5]和微生物代谢产物[6],抑菌性微生物主要是具有抑菌活性乳酸菌的开发[7]。微生物代谢产物由于制备周期短、产量高、成本低等优势成为生物防腐剂开发的重点。乳酸菌代谢产物和芽孢杆菌代谢产物成为重点开发的生物防腐剂[8]。其中已经商品化生产的乳酸菌代谢产物nisin,由于抑菌活性高、安全性好等优点已经被工业化生产并应用。由于nisin主要对革兰氏阳性菌抑菌效果好,对革兰氏阴性菌基本不抑制,在食品防腐中的应用具有一定的局限性[9-10]。因此,开发具有广谱抑菌活性的生物防腐剂或生物防腐剂配方具有重要的研究价值。
Brevilaterin是由Brevibacillus laterosporus S62-9产生的一类具有抑菌活性的小肽,可以抑制金黄色葡萄球菌、单核细胞增生李斯特菌、大肠杆菌、沙门氏菌等多种食源性致病菌的生长和繁殖[11-12]。Brevilaterin作为新型生物抑菌物质除具有安全性高、抑菌谱广的优点外,还具有高度热及pH值稳定性,在食品防腐中具有较高的工业化应用潜力。然而,brevilaterin对革兰氏阳性菌抑菌效果好,对革兰氏阴性菌抑菌效果较弱,在食品防腐中需要加大使用剂量才能实现广谱抑菌(同时抑制革兰氏阳性菌和阴性菌)作用,导致使用成本较高。抑菌物质的联合使用主要存在3种效应:协同、无关、拮抗[13],其中抑菌物质间的协同作用可以降低单一抑菌物质的用量,提高抑菌效果[14-15],因此可筛选与brevilaterin存在协同抑菌效应的防腐剂,通过复配降低添加剂用量,从而降低使用成本。
细菌性食源性疾病是食品安全的核心问题[16],我国每年发生的细菌性食物中毒事件占食物中毒事件总数的30%~90%,因此,控制细菌性食源性疾病对于保障食品安全至关重要。据报道全世界引发食源性疾病的主要致病菌为金黄色葡萄球菌、大肠杆菌、单核细胞增生李斯特菌和沙门氏菌[17]。因此,本研究以金黄色葡萄球菌和单核细胞增生李斯特菌作为革兰氏阳性致病菌指示菌,以大肠杆菌和鼠伤寒沙门氏菌作为革兰氏阴性致病菌指示菌,首先筛选与brevilaterin具有协同抑菌作用的抑菌物质,然后考察复配组合中各抑菌物质的添加量,并通过时间杀菌曲线验证杀菌效果,为抗菌肽复合食品防腐剂在食品防腐中的应用提供科学依据。
1 材料与方法
1.1 材料与试剂
Staphylococcus aureus ATCC 25923、Listeria monocytogenes 10403s、Escherichia coli ATCC 44752、Salmonella ATCC 14028,河北科技大学食品生物技术与安全实验室保藏。抗菌肽brevilaterin(白色粉末,1 AU=1 μg/mL)为本实验室制备[18]。丁香酚、肉桂醛、柠檬酸、ε-聚赖氨酸、茶多酚、鱼精蛋白、EDTA-Na2、乳酸链球菌素(nisin),上海麦克林生化科技有限公司;柠檬酸和磷酸三钠,天津市永大化学试剂有限公司;山梨酸钾,北京科百奥生物科技有限公司;苯甲酸钠,西陇化工股份有限公司。
1.2 仪器与设备
Scan1200全自动菌落计数仪,法国Interscience公司;Spectramax plus 384酶标仪,美国Molecular Devices;Evolution 220紫外分光光度计,美国Thermo Scientific公司。
1.3 方法
1.3.1 食品防腐剂储备液的配制
丁香酚和肉桂醛溶于5%的吐温-20,配制成质量浓度为100 mg/mL的储备液;乳酸链球菌素(nisin)、柠檬酸、苯乳酸、ε-聚赖氨酸、茶多酚、鱼精蛋白、苯甲酸钠、山梨酸钾、EDTA-Na2、磷酸三钠均溶于无菌水,配置成质量浓度为10、20、20、1、10、20、200、250、160、100 mg/mL的储备液;抗菌肽brevilaterin溶于水制备为1280 AU/mL的储备液。
1.3.2 最小抑菌浓度测定
采用96孔板微量二倍稀释法考察各抑菌物质的最小抑菌浓度(minimum inhibitory concentration,MIC)。参照WIEGAND等[19]的方法进行适当修改:在96孔板的2~11孔分别加入100 μL培养基,第12孔加入200 μL培养基作为空白对照;在第1、2孔中分别加入100 μL抗菌溶液,第2孔混匀后吸取100 μL至第3孔,重复此操作至第10孔,第10孔混合均匀后吸取100 μL弃去;在1~11孔中接种100 μL菌悬液,使每孔菌体终浓度为5×105 CFU/mL;将96孔板置于37 ℃恒温培养箱中培养18 h,最小抑菌浓度为培养前后ΔOD600≤0.05 的抑菌剂的最低浓度,结合肉眼观察即可判定为最低抑菌浓度MIC。
1.3.3 联合抑菌效应评价
参考SEGAL等[20]的微量棋盘法利用96孔板进行联合抑菌试验。将brevilaterin和食品防腐剂浓度配置为8~1/8 MIC;在孔板的A2~H2孔中分别加入8 MIC-brevilaterin,A3~H3孔中分别加入4 MIC-brevilaterin,依次进行;在H1~H8孔中分别加入8MIC-防腐剂,G1~G8孔中分别加入8MIC-防腐剂,依次进行;在A1孔中加入200 μL培养基,做空白对照;在其它孔中加入菌悬液,使每孔最终菌浓约为5×105 CFU/mL;将96孔板置于37 ℃恒温培养箱中培养18 h,根据澄清孔中2种抑菌剂联用时的最终MIC计算联合抑菌指数FICI。联合抑菌作用评价根据下列公式1:
(1)
通过计算联用时的联合抑菌指数FICI,判断两者的联用关系:FICI≤0.5,判定为协同作用;0.5
1.3.4 Brevilaterin和食品防腐剂复配配方筛选
基于联合抑菌效应评价结果,选取与brevilaterin具有协同抑菌效果的抑菌剂及两者的复配比例。分别向添加有抑菌物质和培养基的试管中分别接入对数生长期的E. coli ATCC 44752和S. aureus ATCC 25923,使最终菌体浓度为105 CFU/mL。各试管置于 37 ℃培养18 h时,取样进行菌落计数,每组平行测定3次。
2 结果与分析
2.1 Brevilaterin与食品防腐剂的最小抑菌浓度
首先考察了brevilaterin与11种食品添加剂对金黄色葡萄球菌和大肠杆菌的最小抑菌浓度,结果(表1)显示,brevilaterin对革兰氏阴性菌的MIC为160 AU/mL(大肠杆菌)和320 AU/mL(沙门氏菌),显著高于革兰氏阳性菌金黄色葡萄球菌(10 AU/mL)和单核细胞增生李斯特菌(20 AU/mL)。8种天然食品防腐剂中除了丁香酚外均呈现对革兰氏阳性菌抗菌活性优于革兰氏阴性菌的结果,且brevilaterin和ε-聚赖氨酸的效果最佳。肉桂醛对革兰氏阳性菌和阴性菌的抑菌效果相当,柠檬酸对金黄色葡萄球菌和大肠杆菌的抑菌效果优于单核细胞增生李斯特菌和沙门氏菌。关于革兰氏阴性菌的抑制,天然防腐剂中ε-聚赖氨酸对革兰氏阴性菌的抑菌效果最好,MIC值为0.125 mg/mL;其次为丁香酚、肉桂醛和茶多酚,MIC值均小于1 mg/mL。4种化学防腐剂中仅有EDTA-Na2对革兰氏阳性菌的抑菌效果最好(MIC值小于1 mg/mL),其他化学防腐剂对4种致病菌抑菌效果较差,MIC均大于 10 mg/mL。总之,以上结果表明天然防腐剂的抑菌效果优于化学防腐剂,且天然防腐剂对革兰氏阳性菌的抑菌效果普遍优于革兰氏阴性菌。
表1 Brevilaterin与食品防腐剂对食源性致病菌的最小抑菌浓度
Table 1 MICs of brevilaterin and food preservatives against foodborne pathogens
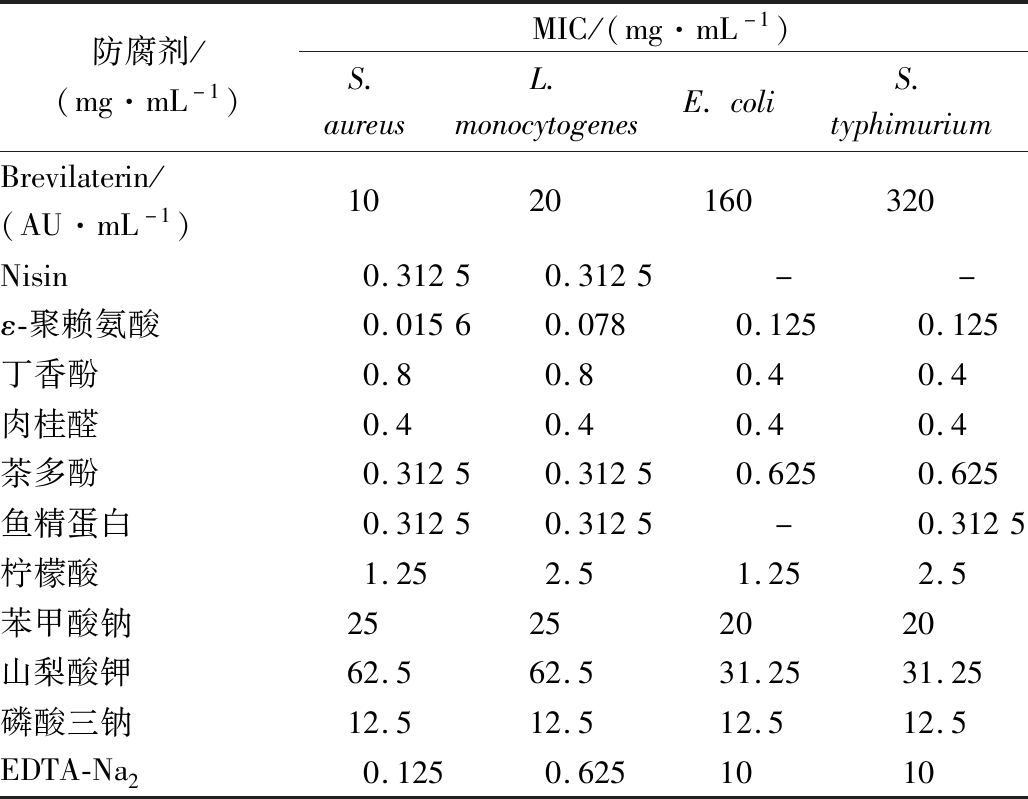
防腐剂/(mg·mL-1)MIC/(mg·mL-1)S.aureusL.monocytogenesE.coliS.typhimuriumBrevilaterin/(AU·mL-1)1020160320Nisin0.31250.3125--ε-聚赖氨酸0.01560.0780.1250.125丁香酚0.80.80.40.4肉桂醛0.40.40.40.4茶多酚0.31250.31250.6250.625鱼精蛋白0.31250.3125-0.3125柠檬酸1.252.51.252.5苯甲酸钠25252020山梨酸钾62.562.531.2531.25磷酸三钠12.512.512.512.5EDTA-Na20.1250.6251010
注:“-”代表无抑菌活性。
2.2 Brevilaterin与食品防腐剂的联合抑菌效应
2.2.1 Brevilaterin与食品防腐剂联用对金黄色葡萄球菌和单核细胞增生李斯特菌的联合抑菌作用
首先,考察了brevilaterin和食品添加剂联用对金黄色葡萄球菌的联合抑菌效应,结果(表2)显示brevilaterin和ε-聚赖氨酸联用对金黄色葡萄球菌的分级抑菌指数FICI为0.5,判定为协同作用。
表2 Brevilaterin与食品防腐剂对金黄色葡萄球菌的联合抑菌作用
Table 2 Combined antibacterial effect of Brevilaterin with food preservatives against S. aureus
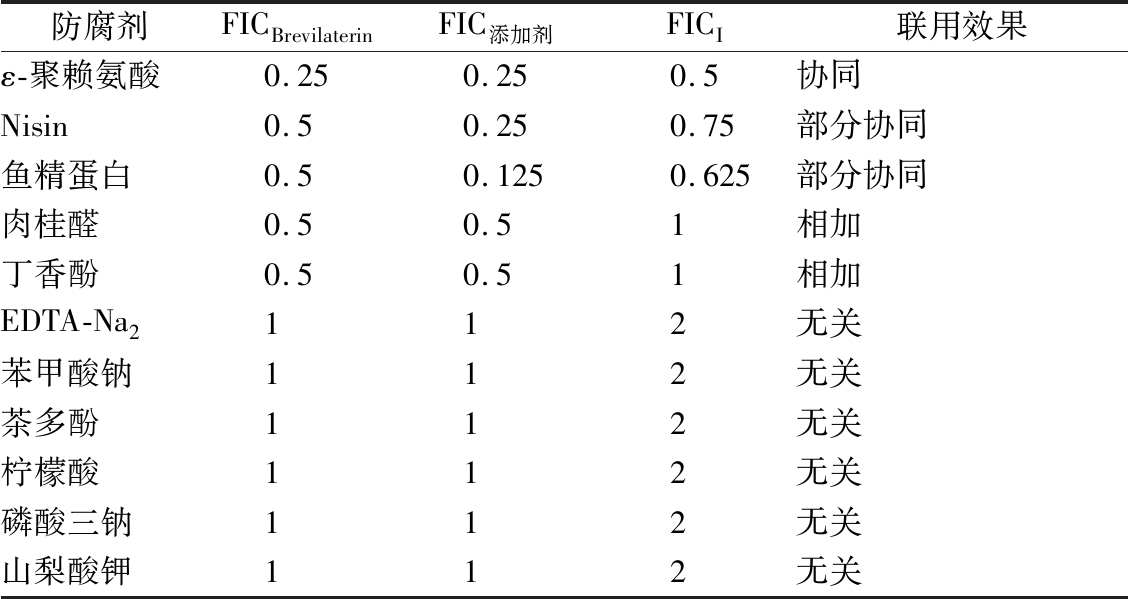
防腐剂FICBrevilaterinFIC添加剂FICI联用效果ε-聚赖氨酸0.250.250.5协同Nisin0.50.250.75部分协同鱼精蛋白0.50.1250.625部分协同肉桂醛0.50.51相加丁香酚0.50.51相加EDTA-Na2112无关苯甲酸钠112无关茶多酚112无关柠檬酸112无关磷酸三钠112无关山梨酸钾112无关
Brevilaterin-nisin和brevilaterin-鱼精蛋白对金黄色葡萄球菌的分级抑菌指数FICI介于0.5~1之间,均表现为部分协同抑菌,brevilaterin分别与ε-聚赖氨酸、nisin和鱼精蛋白联用可以降低单一添加剂的使用剂量,发挥协同增效作用。brevilaterin-丁香酚、brevilaterin-肉桂醛对金黄色葡萄球菌的分级抑菌指数FICI为1,均表现为相加作用。brevilaterin分别与柠檬酸、茶多酚、苯甲酸钠、山梨酸钾、磷酸三钠和EDTA-Na2联用对金黄色葡萄球菌的分级抑菌指数FICI均为2,表现为无关。
其次,考察了brevilaterin和食品添加剂联用对单核细胞增生李斯特菌的联合抑菌效应,结果(表3)显示brevilaterin分别与ε-聚赖氨酸、丁香酚、鱼精蛋白、苯甲酸钠、磷酸三钠、EDTA-Na2的分级抑菌指数FIC均在0.5~1之间,表明联合作用为部分协同关系;brevilaterin与肉桂醛的FICI为1,表明两者为相加作用;brevilaterin分别与nisin、茶多酚、柠檬酸、山梨酸钾的FIC均为2,表明联用为无关作用。上述结果表明brevilaterin分别与ε-聚赖氨酸和鱼精蛋白联用对革兰氏阳性致病菌具有协同或部分协同抑菌作用,brevilaterin与nisin联用对金黄色葡萄球菌具有部分协同效应。考虑到ε-聚赖氨酸和nisin为GB 2760食品添加剂使用标准中规定使用的添加剂,且应用范围较广,因此brevilaterin与ε-聚赖氨酸和nisin联用对于食品中革兰氏阳性致病菌的控制具有较高的应用潜力。
表3 Brevilaterin与食品防腐剂对单增李斯特菌的联合抑菌作用
Table 3 Combined antibacterial effect of Brevilaterin with food preservatives against L. monocytogenes
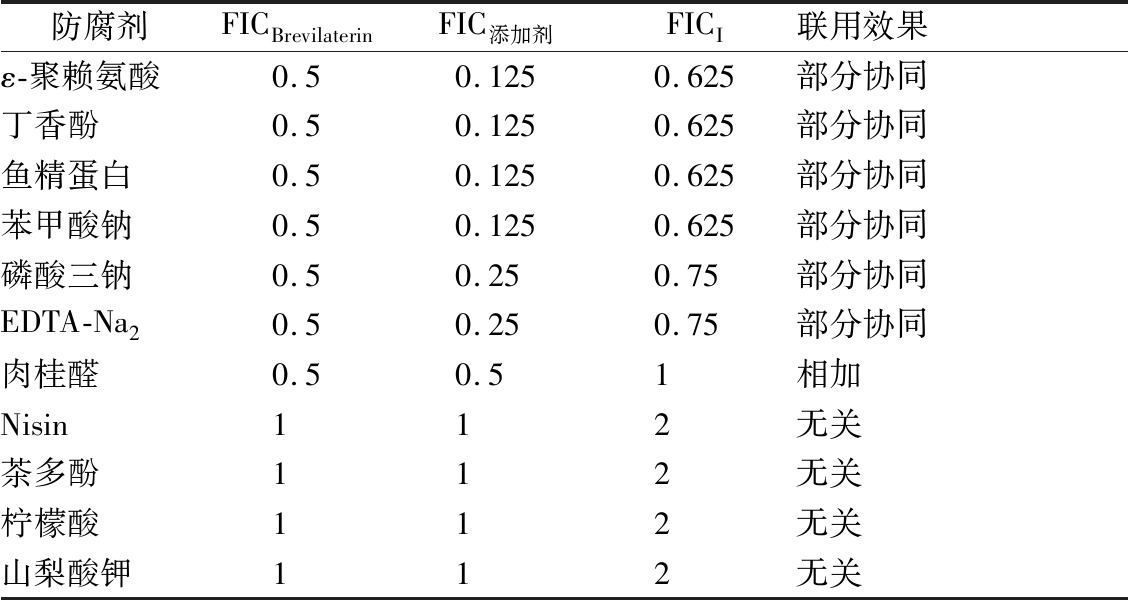
防腐剂FICBrevilaterinFIC添加剂FICI联用效果ε-聚赖氨酸0.50.1250.625部分协同丁香酚0.50.1250.625部分协同鱼精蛋白0.50.1250.625部分协同苯甲酸钠0.50.1250.625部分协同磷酸三钠0.50.250.75部分协同EDTA-Na20.50.250.75部分协同肉桂醛0.50.51相加Nisin112无关茶多酚112无关柠檬酸112无关山梨酸钾112无关
2.2.2 Brevilaterin与食品防腐剂联用对大肠杆菌和沙门氏菌的联合抑菌作用
进一步考察了brevilaterin与食品防腐剂联用对革兰氏阴性致病菌的联用作用效应,其中对大肠杆菌的联合抑菌效应结果(表4)显示:brevilaterin分别与EDTA-Na2和柠檬酸联用对大肠杆菌的FICI分别为0.141和0.5,属于协同抑菌。尽管EDTA-Na2与brevilaterin联用的协同抑菌效应更强,但是由于EDTA-Na2对大肠杆菌的MIC是柠檬酸的8倍,因此brevilaterin与柠檬酸的协同效应更值得推广应用。Brevilaterin-磷酸三钠对大肠杆菌的FICI为0.625,表明brevilaterin-磷酸三钠对大肠杆菌呈现部分协同关系。Brevilaterin分别与肉桂醛、苯甲酸钠和山梨酸钾联用对大肠杆菌的FICI均为1,表现为相加关系。Brevilaterin分别与ε-聚赖氨酸、茶多酚和丁香酚联用对大肠杆菌的FICI均为2,表现为无关作用。
表4 Brevilaterin与食品防腐剂对大肠杆菌的联合抑菌作用
Table 4 Combined antibacterial effect of brevilaterin with food preservatives against E. coli
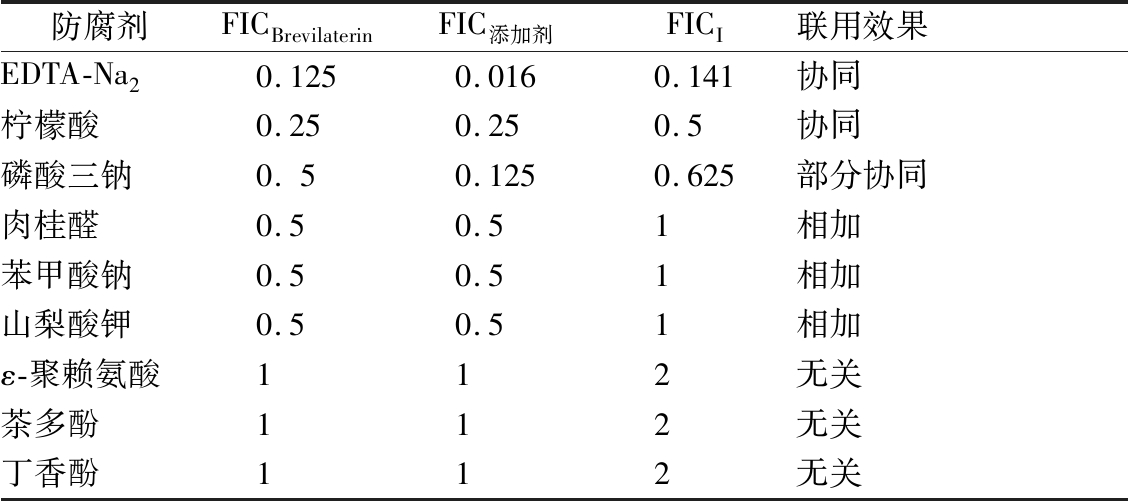
防腐剂FICBrevilaterinFIC添加剂FICI联用效果EDTA-Na20.1250.0160.141协同柠檬酸0.250.250.5协同磷酸三钠0.50.1250.625部分协同肉桂醛0.50.51相加苯甲酸钠0.50.51相加山梨酸钾0.50.51相加ε-聚赖氨酸112无关茶多酚112无关丁香酚112无关
Brevilaterin对沙门氏菌的联合抑菌效应结果(表5)显示:brevilaterin分别与EDTA-Na2和磷酸三钠联用对沙门氏菌的FIC为0.1875和0.5,表现为协同效应;brevilaterin分别与柠檬酸和苯甲酸钠联用对沙门氏菌的FIC均为0.75,表现为部分协同效应;brevilaterin与肉桂醛联用FIC为1,表现为相加作用;brevilaterin与ε-聚赖氨酸、鱼精蛋白、茶多酚、丁香酚、山梨酸钾联用的FIC均为2,表现为无关作用。上述研究表明brevilaterin与EDTA-Na2联用对2种革兰氏阴性菌食源性致病菌均呈现协同抑菌效应,与柠檬酸联用均呈现部分协同抑菌效应,与磷酸三钠联用呈现部分协同抑菌效应。由于EDTA-Na2是螯合剂,通常添加于食品中从发挥防止油脂氧化、果蔬褐变等作用[21],因此可在添加有EDTA-Na2的食品中加入brevilaterin来发挥协同抑菌作用。陈历水等[22]也发现EDTA-Na2可同其他防腐剂联用对沙雷氏菌发挥协同抑菌作用。另外,磷酸三钠常用于肉制品生产中以改善食品持水性等品质[23],因此可以考虑在添加有磷酸三钠的食品体系中使用brevilaterin作防腐剂来提高食品的保藏性。柠檬酸常作为酸度调节剂用于饮料、浓缩果汁等食品的生产中[24],因此在brevilaterin与柠檬酸复配在饮料和浓缩果汁等食品生产中具有较高的应用潜力。林琳等[25]也发现柠檬酸钠与桂皮提取物对食品中常见的革兰氏阴性致病菌具有协同抑菌效果。
表5 Brevilaterin与食品防腐剂对鼠伤寒沙门氏菌联合抑菌作用
Table 5 Combined antibacterial effect of brevilaterin with food preservatives against S. typhimurium
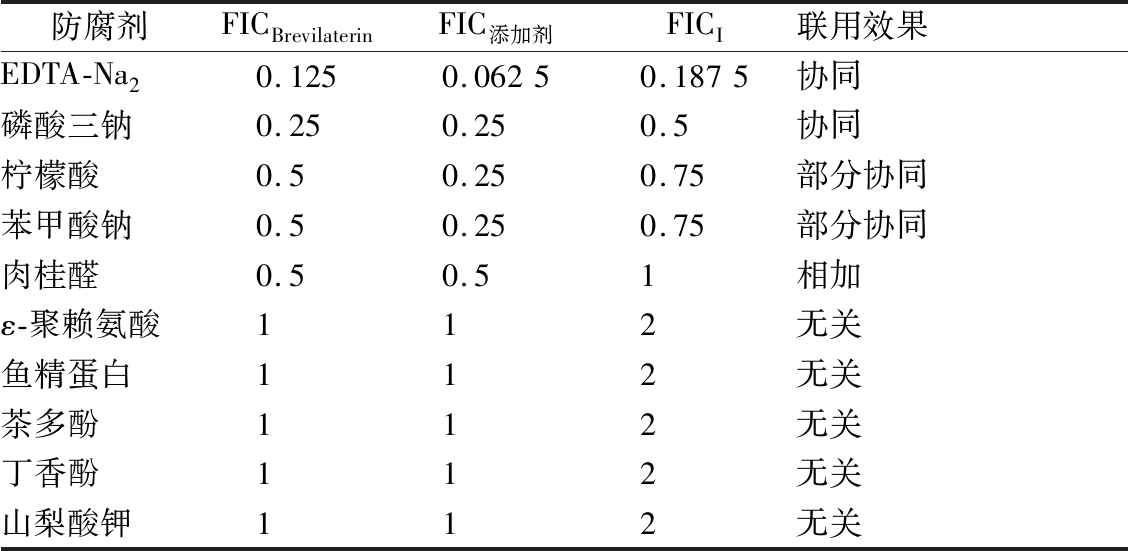
防腐剂FICBrevilaterinFIC添加剂FICI联用效果EDTA-Na20.1250.06250.1875协同磷酸三钠0.250.250.5协同柠檬酸0.50.250.75部分协同苯甲酸钠0.50.250.75部分协同肉桂醛0.50.51相加ε-聚赖氨酸112无关鱼精蛋白112无关茶多酚112无关丁香酚112无关山梨酸钾112无关
2.3 Brevilaterin和食品防腐剂复配配方筛选
基于联合抑菌效应的研究结果:brevilaterin与nisin联用对革兰氏阳性菌具有部分协同作用,与柠檬酸、EDTA-Na2联用对革兰氏阴性菌具有协同抑菌效应,但由于EDTA-Na2在食品中的应用范围较柠檬酸窄,因此最终选取brevilaterin(20 AU/mL)、nisin(0.312 5 mg/mL)和柠檬酸(0.625 mg/mL)三者进行复配,以考察三者联用对革兰氏阳性菌和阴性菌的抑菌效果。结果(图1)显示brevilaterin、nisin和柠檬酸3者复配组合对沙门氏菌呈现抑制作用,对其他3株致病菌均呈现不同程度杀菌效应。
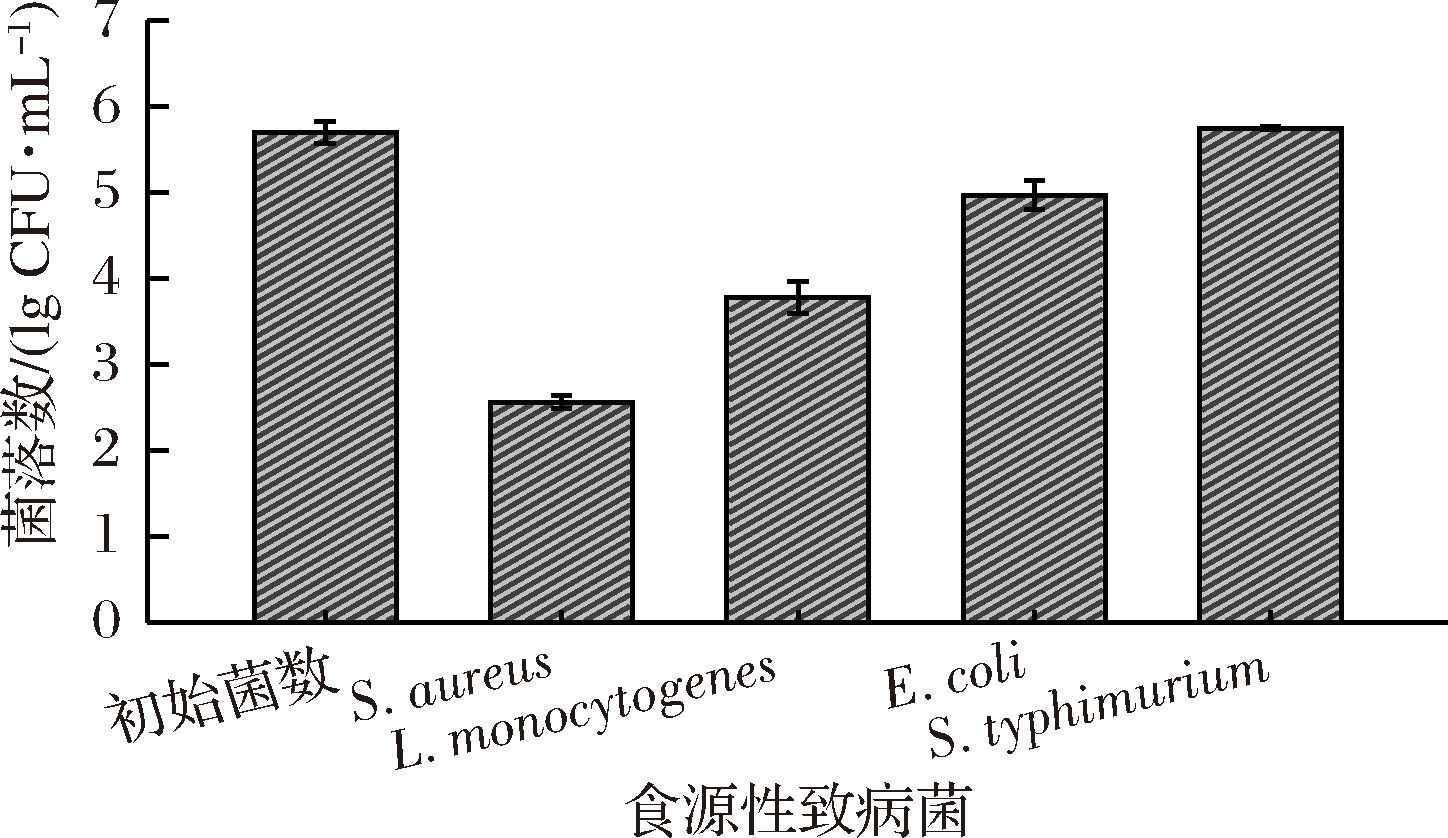
图1 Brevilaterin-nisin-柠檬酸复配对食源性致病菌的抑菌效果
Fig.1 Brevilaterin-nisin-citrate against foodborne pathogenic bacteria
为了进一步验证三者复配后的抑菌效果,进一步选取金黄色葡萄球菌和大肠杆菌作为指示菌,考察三者对2株致病菌的时间杀菌曲线。brevilaterin、nisin和柠檬酸三者联用对金黄色葡萄球菌的时间杀菌曲线如图2所示。
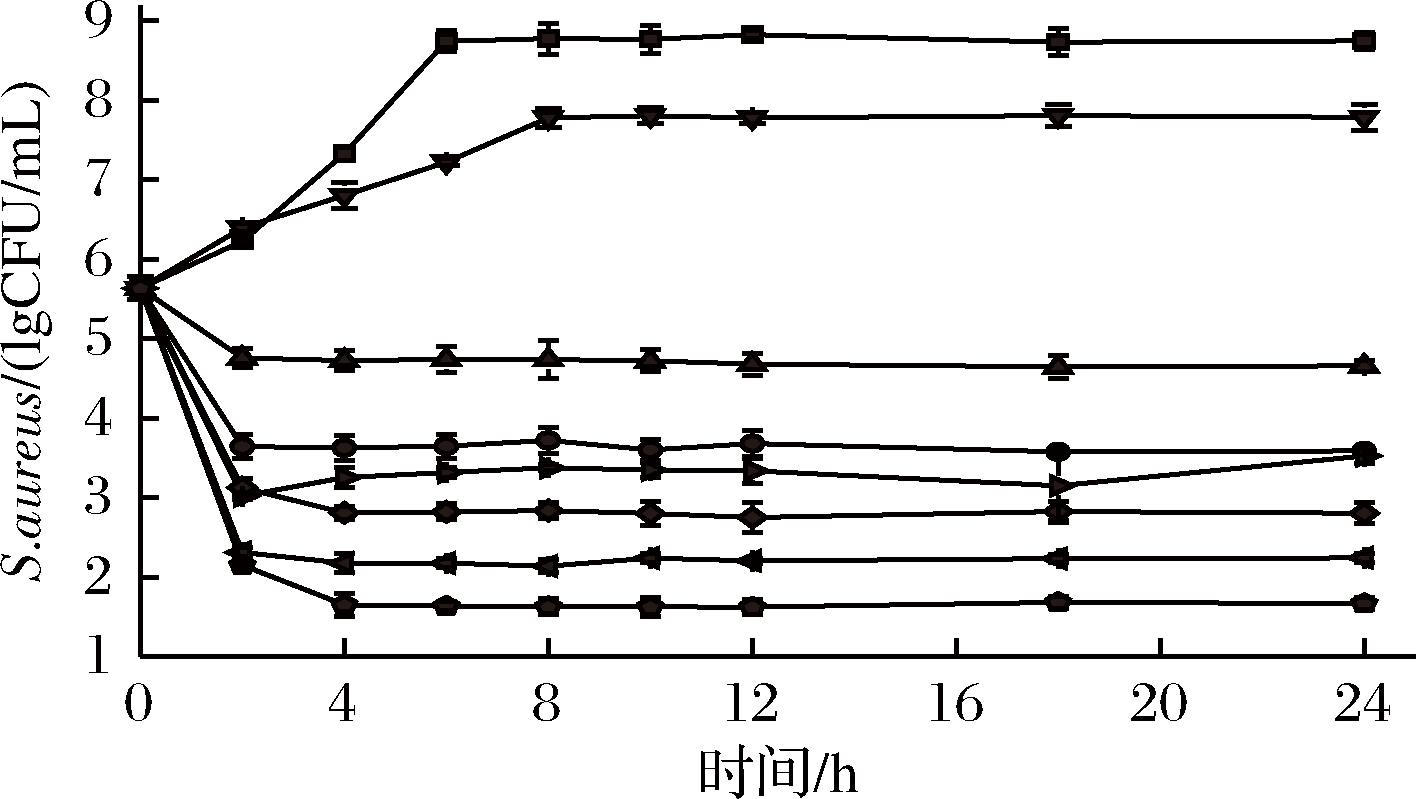
1-对照;●-brevilaterin(20 AU/mL);▲-nisin(0.312 5 mg/mL);▼-柠檬酸(0.625 mg/mL);◀-Brevilaterin(20 AU/mL)-nisin(0.312 5 mg/mL);▶-brevilaterin(20 AU/mL)-柠檬酸(0.625 mg/mL);◆-nisin(0.312 5 mg/mL)-柠檬酸(0.625 mg/mL);(Brevilaterin(20 AU/mL)-nisin(0.312 5 mg/mL)-柠檬酸(0.625 mg/mL)(下同)
图2 Brevilaterin-nisin-柠檬酸复配对金黄色葡萄球菌的时间杀菌曲线
Fig.2 Time-kill curve for brevilaterin-nisin-citrate against S. aureus
结果显示,单一添加柠檬酸(0.625 mg/mL)8 h后菌落数达到7.77 lg CFU/mL,之后随着时间延长菌落数无显著变化;单独使用brevilaterin(20 AU/mL)和brevilaterin(20 AU/mL)-柠檬酸(0.625 mg/mL)复合联用时,菌落数变化趋势相同,2 h内菌落数迅速降至3.64 lg CFU/mL和3.02 lg CFU/mL,之后菌落数保持不变,此结果与试验前期得到的brevilaterin-柠檬酸联用对金黄色葡萄球菌没有联合抑菌效果结论一致;单独使用nisin(0.312 5 mg/mL)菌落数在2 h内降至4.76 lg CFU/mL,之后菌落数不变;brevilaterin(20 AU/mL)与nisin(0.312 5 mg/mL)联用组菌落数在2 h内降至2.31 lg CFU/mL,比单独使用nisin组菌落数降低了2.45 lg CFU/mL,比单独使用brevilaterin菌落数降低1.33 lg CFU/mL,由此证明brevilaterin-nisin对金黄色葡萄球菌具有部分协同抑菌效果,与表2中结果一致;brevilaterin(20 AU/mL)、nisin(0.312 5 mg/mL)和柠檬酸(0.625 mg/mL)联用,2 h内菌落数迅速降至2.14 lg CFU/mL,2~4 h菌落数降至1.65 lg CFU/mL,之后菌落数保持不变。brevilaterin、nisin和柠檬酸三者联用比单独使用brevilaterin菌落数降低了1.99 lg CFU/mL,比单独使用柠檬酸菌落数降低了6.12 lg CFU/mL,比单独使用nisin菌落数降低了3.11 lg CFU/mL,比brevilaterin-柠檬酸联用菌落数降低了1.37 lg CFU/mL,比brevilaterin-nisin联用菌落数降低了0.66 lg CFU/mL。Brevilaterin、nisin和柠檬酸上述结果验证了三者联用对金黄色葡萄球菌的协同抑菌效应。
进一步考察了brevilaterin、nisin、柠檬酸三者对大肠杆菌的时间杀菌曲线,结果(图3)显示单独使用brevilaterin(20 AU/mL)、nisin(0.312 5 mg/mL),8 h后菌落数分别增至8.40 lg CFU/mL和8.42 lg CFU/mL,之后菌落数保持相对稳定;单独使用柠檬酸(0.625 mg/mL),6 h后菌落数增至8.29 lg CFU/mL,之后菌落数保持不变;brevilaterin(20 AU/mL)和nisin(0.312 5 mg/mL)联用,8 h后菌落数增至8.29 lg CFU/mL,之后菌落数保持相对稳定;brevilaterin(20 AU/mL)、nisin(0.312 5 mg/mL)、柠檬酸(0.625 mg/mL)三者单独使用与brevilaterin(20 AU/mL)和nisin(0.312 5 mg/mL)两者组合的最终菌落数均与对照组菌落数一致,表明不能有效控制大肠杆菌生长。
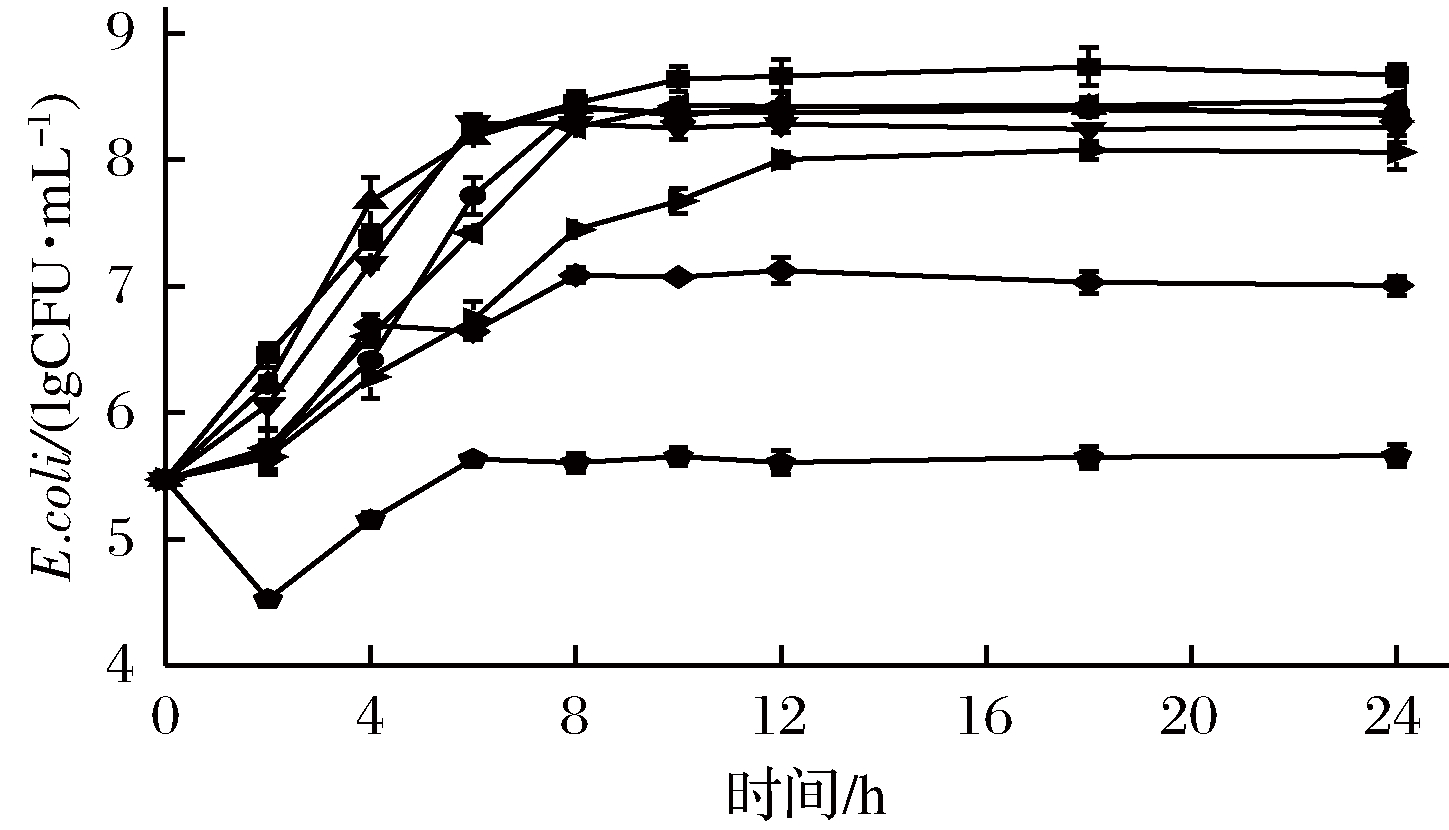
图3 Brevilaterin-nisin-柠檬酸复配对大肠杆菌的时间-杀菌曲线
Fig.3 Time-kill curve for brevilaterin-nisin-citrate against E. coli
Brevilaterin-柠檬酸联用,0~12 h菌落数增至8.00 lg CFU/mL,最终菌落数与空白组比菌落数降低0.66 lg CFU/mL,证实了brevilaterin-nisin联用对大肠杆菌没有协同抑菌效果,brevilaterin-柠檬酸对大肠杆菌有协同抑菌效果,但是菌落数降低幅度较小。nisin-柠檬酸联用,8 h后菌落数增至7.08 lg CFU/mL,之后菌落数保持稳定,比空白对照组菌落数降低了1.59 lg CFU/mL。brevilaterin(20 AU/mL)、nisin(0.312 5 mg/mL)、柠檬酸(0.625 mg/mL)3者联用,0~2 h菌落数迅速降至4.52 lg CFU/mL,2~6 h菌落数增至5.63 lg CFU/mL,之后菌落数保持相对稳定,与空白对照组相比菌落数降低了3.04 lg CFU/mL。所以,brevilaterin(20 AU/mL)、nisin(0.312 5 mg/mL)和柠檬酸(0.625 mg/mL)3者联用对大肠杆菌有协同抑菌效果,可有效降低抗菌肽添加量。
3 结论
本研究全面评价了brevilaterin与化学防腐剂和生物防腐剂的联用抑菌效应,发现brevilaterin分别与ε-聚赖氨酸、nisin联用对革兰氏阳性菌具有协同抑菌效应,分别与EDTA-Na2、Na3PO4和柠檬酸联用对革兰氏阴性菌具有协同或部分协同效应。brevilaterin(20 AU/mL)、nisin(0.312 5 mg/mL)、柠檬酸(0.625 mg/mL)三者联用对革兰氏阳性菌和阴性菌均可实现抑菌作用,而brevilaterin的添加剂量仅为原来MIC的1/8,表明通过对协同抑菌物质的复配有效地降低了brevilaterin使用剂量,且所开发的抑菌配方对食源性致病菌具有广谱抑菌活性。
[1] PILAR G, LORENA R, ANA R, et al. Food biopreservation: promising strategies using bacteriocins, bacteriophages and endolysins [J]. Trends in Food Science and Technology, 2010, 21(8): 373-382.
[2] TIWARI B K, VALDRAMIDIS V P, O'DONNELL C P. Application of natural antimicrobials for food preservation [J]. Journal of Agricultural and Food Chemistry, 2009, 57(14): 5 987-6 000.
[3] WANG Jingyi, BIE Meng, ZHOU Weijing, et al. Interaction between carboxymethyl pachyman and lotus seedpod oligomeric procyanidins with superior synergistic antibacterial activity [J]. Carbohydrate Polymers, 2019, 212: 11-20.
[4] REQUENA R, VARGAS M, CHIRALT A. Study of the potential synergistic antibacterial activity of essential oil components using the thiazolyl blue tetrazolium bromide (MTT) assay [J]. LWT-Food Science and Technology, 2019, 101: 183-190.
[5] CHAK-LUN C, REN-YOU G, NAGENDRA P S, et al. Polyphenols from selected dietary spices and medicinal herbs differentially affect common food-borne pathogenic bacteria and lactic acid bacteria [J]. Food Control, 2018, 92: 437-443.
[6] SKARIYACHAN S, GOVINDARAJAN S. Biopreservation potential of antimicrobial protein producing Pediococcus spp. towards selected food samples in comparison with chemical preservatives [J]. International Journal of Food Microbiology, 2019, 291:189-196.
[7] LUCILLE G, JEROME M, LE S, et al. Development of antifungal ingredients for dairy products: From in vitro screening to pilot scale application [J]. Food Microbiology, 2019, 81: 97-107.
[8] YANG Xu, HUANG En, AHMED E Y. Brevibacillin, a cationic lipopeptide that binds to lipoteichoic acid and subsequently disrupts cytoplasmic membrane of Staphylococcus aureus [J]. Microbiological Research, 2017, 195: 18-23.
[9] GHARSALLAOUI A, OULAHAL N, JOLY C, et al. Nisin as a Food Preservative: Part 1: Physicochemical properties, antimicrobial activity, and main uses [J]. Critical Reviews in Food Science and Nutrition, 2016, 62(8): 1 262-1 274.
[10] SUN Zhilan, LI Pengpeng, LIU Fang, et al. Synergistic antibacterial mechanism of the Lactobacillus crispatus surface layer protein and nisin on Staphylococcus saprophyticus [J]. Scientific Reports, 2017, 7: 265.
[11] 马俊美,宁亚维,王志新,等.侧孢短芽孢杆菌抗菌肽的结构与性质[J].食品与生物技术学报, 2016, 345(6): 629-634.
[12] 杨倩,于宏伟,郭润芳,等.侧孢短芽孢杆菌S62-9产抗菌物质的分离纯化及部分特性的研究[J].河北农业大学学报, 2010, 33(2): 74-78.
[13] 李兴峰,刘豆,薛江超,等.天然食品防腐剂的协同抗菌作用[J].中国食品学报, 2014, 14(3): 140-144.
[14] BAG A, CHATTOPADHYAY R R. Synergistic antibacterial and antibiofilm efficacy of nisin in combination with p-coumaric acid against food-borne bacteria Bacillus cereus and Salmonella typhimurium [J]. Letter in Applied Microbiology, 2017, 65: 366-372.
[15] 宋萌,付强,时艺翡,等.ε-聚赖氨酸复配防腐剂在酱腌菜中的应用[J].食品科学, 2018, 39(10): 276-282.
[16] 王霄晔,任婧寰,王哲,等. 2017 年全国食物中毒事件流行特征分析[J].疾病监测, 2018, 33(5): 359-363.
[17] SCHARFF R L. Economic burden from health losses due to foodborne illness in the United States [J]. Journal of Food Protection, 2012, 75(1), 123-131.
[18] 贾英民,李兴峰,王志新,等. 一种从发酵液中快速提取食用抗菌肽的方法:中国[P]. ZL 201210019936.X.
[19] WIEGAND I, HILPERT K, HANCOCK R E W. Agar and broth dilution methods to determine the minimal inhibitory concentration (MIC) of antimicrobial substances [J]. Nature Protocols, 2008, 3(2): 163-175.
[20] SEMIS R, NAHMIAS M, LEV S, et al. Evaluation of antifungal combinations of nystatin-intralipid against Aspergillus terreus using checkerboard and disk diffusion methods [J]. Journal de Mycologie Médicale, 2015, 25: 63-70.
[21] CHRISTIANE M V, EDUARDO B D O, STEPHANIA N R, et al. Evaluating strategies to control enzymatic browning of minimally processed yacon (Smallanthus sonchifolius) [J]. Food and Bioprocess Technology, 2015, 8(9): 1 982-1 994.
[22] 陈历水,刘松玲,倪军,等. 1株来源于腐败肉制品的沙雷氏菌的分离鉴定与特性研究[J].中国食品学报, 2014, 14(10): 235-240.
[23] 张莉莉,于长青.磷酸三钠对提高冷却猪肉持水性优化条件的研究[J].农产品加工, 2009(8): 71-73.
[24] 谭春明,孙通,薛勇,等.大米肽功能饮料的研制[J].食品与发酵工业, 2017, 43(3): 157-162.
[25] 林琳,张雪婧,张可星,等.柠檬酸钠与桂皮提取物对各种革兰氏阴性食源性病原菌的抑菌效果[J].中国食品添加剂, 2014(1): 77-80.