朝鲜蓟(Cynara scolymus L.),是一种富含多种高营养成分的保健蔬菜,有“蔬菜之皇”的美誉[1],含有丰富的酚类、黄酮类、萜类等功能性化合物,以及Vc、矿物质、氨基酸等营养成分[2]。研究表明,这些多酚类物质是天然的抗氧化剂,具有减肥、降血糖、降血脂、防止血管硬化等保健功能[3-4]。植物中的多酚以游离和结合2种形态存在,前者通常指水或极性溶剂可溶性酚类,后者指不溶性并主要以酯键、糖苷键、醚苷键等形式与其他物质(包括蛋白质、单糖、有机酸等)相结合的酚类[5]。目前国内外对朝鲜蓟的研究主要集中在多酚提取、纯化、酚类物质鉴定及功能性[6-9]研究等方面,但是对于朝鲜蓟的加工利用研究较少。本实验在不同干燥方法(热风干燥、真空干燥、真空冷冻干燥、微波干燥)对朝鲜蓟粉品质影响的基础上[10],探讨干燥方法对朝鲜蓟粉中酚类物质含量及香气成分的影响,并对比其游离酚与结合酚的含量及对自由基清除能力的强弱,分析经不同干燥方法处理后香气物质含量的变化,旨在为朝鲜蓟粉的开发利用提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
朝鲜蓟,采摘于云南省;芦丁,中国药品生物制品检定所;没食子酸,上海源叶生物科技有限公司;DPPH、ABTS,分析纯,Sigma公司;Folin-酚试剂,北京索莱宝科技有限公司;HCl、NaOH、乙醇、正己烷、乙酸乙酯,成都科龙化工试剂厂。
1.2 仪器与设备
DHG-9240A电热恒温鼓风干燥箱,上海齐欣科学仪器有限公司;DZF-6020型真空干燥箱,上海精宏实验设备有限公司;微波炉,格兰仕微波炉电器有限公司;LGJ-10真空冷冻干燥机,北京松源华兴科技发展有限公司;高速中药粉碎机,瑞安市永历制药机械有限公司;7200紫外-可见分光光度计,尤尼柯(上海)仪器有限公司;QP2010气相色谱-质谱联用仪,日本岛津公司。
1.3 试验方法
1.3.1 样品的制备[10]
将清洗过的朝鲜蓟苞片平铺于物料盘上,根据预实验结果将其进行微波灭酶处理(700 W,40 s),随后切分成1 cm左右条状(约0.2 g),分别进行热风干燥(60 ℃,0.8 m/s,6 h)、真空干燥(0.08 MPa,55 ℃,6 h)、真空冷冻干燥(冷阱温度-60 ℃,0.13 KPa,13 h)、微波干燥(150 W,20 min,10 min时翻动并间歇1 min,终温90 ℃),打粉备用。
1.3.2 自由态、结合态多酚提取[11]
自由态多酚提取:将0.5 g朝鲜蓟粉加入50 mL冷冻酸化乙醇(V(95%乙醇)∶V(1 mol/L HCl)=85∶15),用匀浆器在10 000 r/min的冰浴中匀浆5 min。在3 000 r/min条件下离心10 min,过滤得上清液,再次提取,将上清液在45 ℃环境下蒸发浓缩后定容至50 mL待测。
结合态多酚提取:向提取自由态多酚后剩余的残渣中加5 mL 4mol/L NaOH溶液,95 ℃水浴30 min,在室温条件下反应1 h,用6 mol/L HCl溶液酸化(pH 1),加2 mL正己烷去脂,5 min后,7 000 r/min离心5 min,再用乙酸乙酯提取4次,合并滤液后在45 ℃环境下蒸发浓缩,用70%(体积分数)乙醇复溶至15 mL待测。
1.3.3 多酚、黄酮含量测定
多酚测定:采用福林酚法[12],以没食子酸为标准物绘制标准曲线,得线性方程:y=0.097 1x+0.027 3,R2=0.994 3。总酚含量以没食子酸当量(mg GAE/g)表示。
黄酮测定:采用亚硝酸钠法[13],以芦丁为标准物,得标准曲线方程为:y=0.012 7x+0.025 7,R2=0.977 4,总黄酮含量以芦丁当量(mg RT/g)表示。
1.3.4 抗氧化性测定
DPPH自由基清除率测定参考文献[14];ABTS+自由基清除率测定参考文献[15];超氧阴离子自由基![]() 清除率测定参考文献[16];总还原力的测定参考文献[17]。
清除率测定参考文献[16];总还原力的测定参考文献[17]。
1.3.5 香气成分测定[18]
准确称取2 g鲜样及各粉末样品,分别置于15 mL顶空瓶中,用具有聚四氯乙烯隔垫的盖子密封。顶空瓶于60 ℃条件下平衡15 min,然后将已活化好的萃取头(DVB/CAR/PDMS 50/30 μm)刺入顶空瓶进行30 min的富集,解吸5 min。
色谱条件:色谱柱为DB-5MS(30 m×0.25 mm,0.25 μm);升温程序:40 ℃保持3 min,以10 ℃/min升至90 ℃,保持5 min,再以10 ℃/min升至140 ℃,保持2 min,最后以6 ℃/min升至230 ℃,保持5 min;载气(He),流速1.00 mL/min,压力50.5 kPa,进样量0.5 μL,不分流。
质谱条件:电子电离(EI)源;离子源温度230 ℃;接口温度230 ℃;溶剂延迟时间1.0 min;质量扫描范围m/z 35~500;扫描速度1 000 u/s。
1.4 数据分析
利用SPSS 22.0进行显著性分析,Origin 2017绘图。
2 结果与分析
2.1 干燥方法对朝鲜蓟粉多酚含量的影响
由图1可知,微波组与冻干组自由酚含量没有显著性差异(P>0.05),分别为29.03、28.55 mg GAE/g,但与真空组、热风组差异显著;对于结合酚而言,不同干燥组含量有显著性差异,微波组含量最高,热风组含量最低;总酚含量的顺序为微波组>冻干组>真空组>热风组,且各组自由酚含量占总酚的百分比为90.63%(热风组)、90.78%(真空组)、90.06%(冻干组)、88.70%(微波组),可能是因为热风组和真空组干燥温度较高、时间较长,造成多酚含量损失较大,冻干组由于干燥温度低且处于真空状态,所以损失较少,而微波组多酚含量最高,与NAVARRE等[19]研究结论相一致。综上所述,微波干燥对酚类保护效果最好。
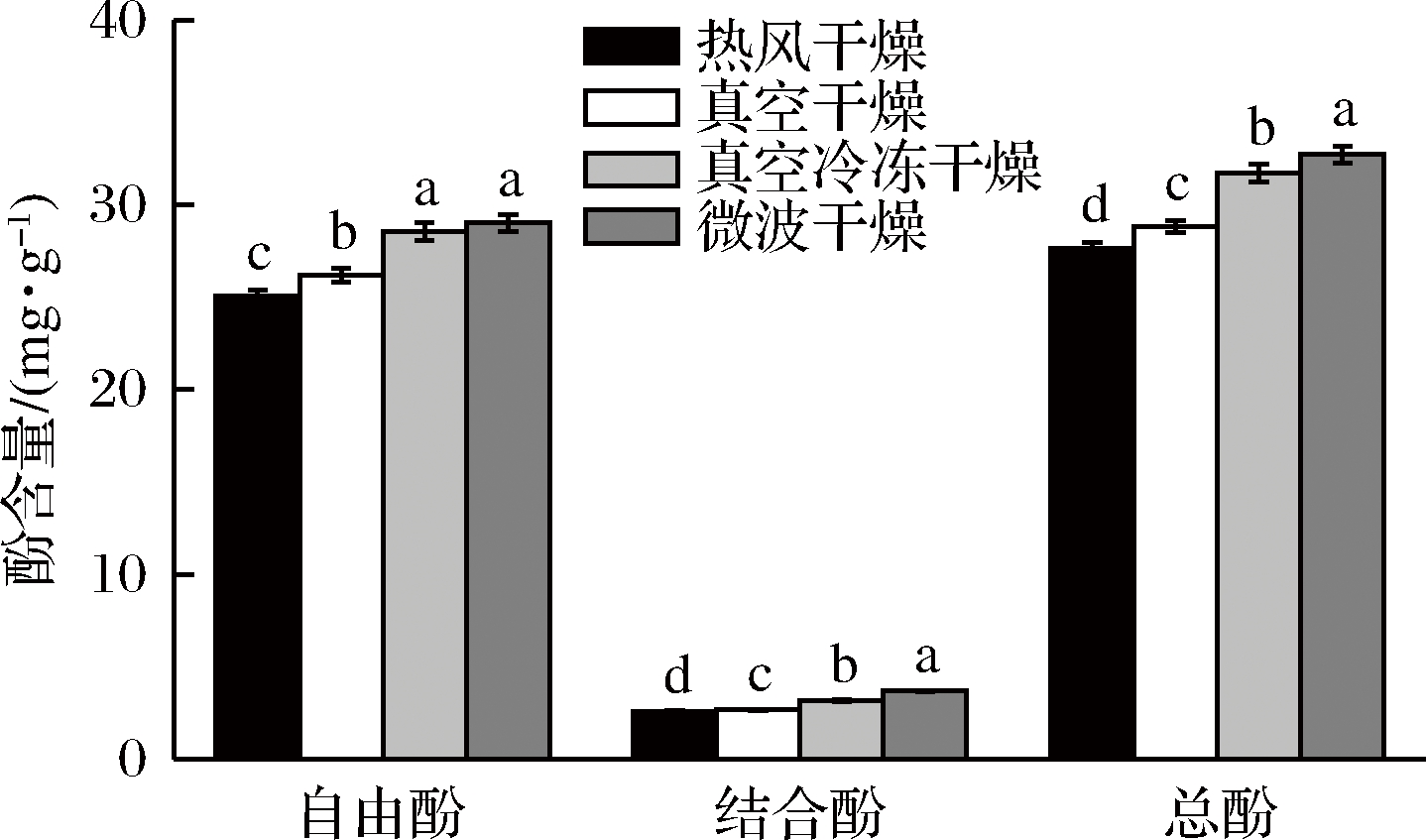
图1 干燥方法对朝鲜蓟粉多酚含量的影响
Fig.1 Effect of drying method on polyphenols content of artichoke powder
同一指标下,不同小写字母表示具有显著性差异(P<0.05)。下同。
2.2 干燥方法对朝鲜蓟粉黄酮含量的影响
由图2可知,4种干燥组之间自由黄酮含量与结合黄酮含量均有显著性差异(P<0.05),在自由黄酮含量对比中,微波组>冻干组>真空组>热风组,且含量分别为78.75、73.08、66.32、61.73 mg RT/g;但对于结合黄酮而言,热风组含量最高,且与其他3组有显著性差异,冻干组与微波组差异不显著;总黄酮含量为自由黄酮与结合黄酮含量的总和,为微波组含量最高,热风组含量最低,综上所述,微波组对黄酮保护效果最好。
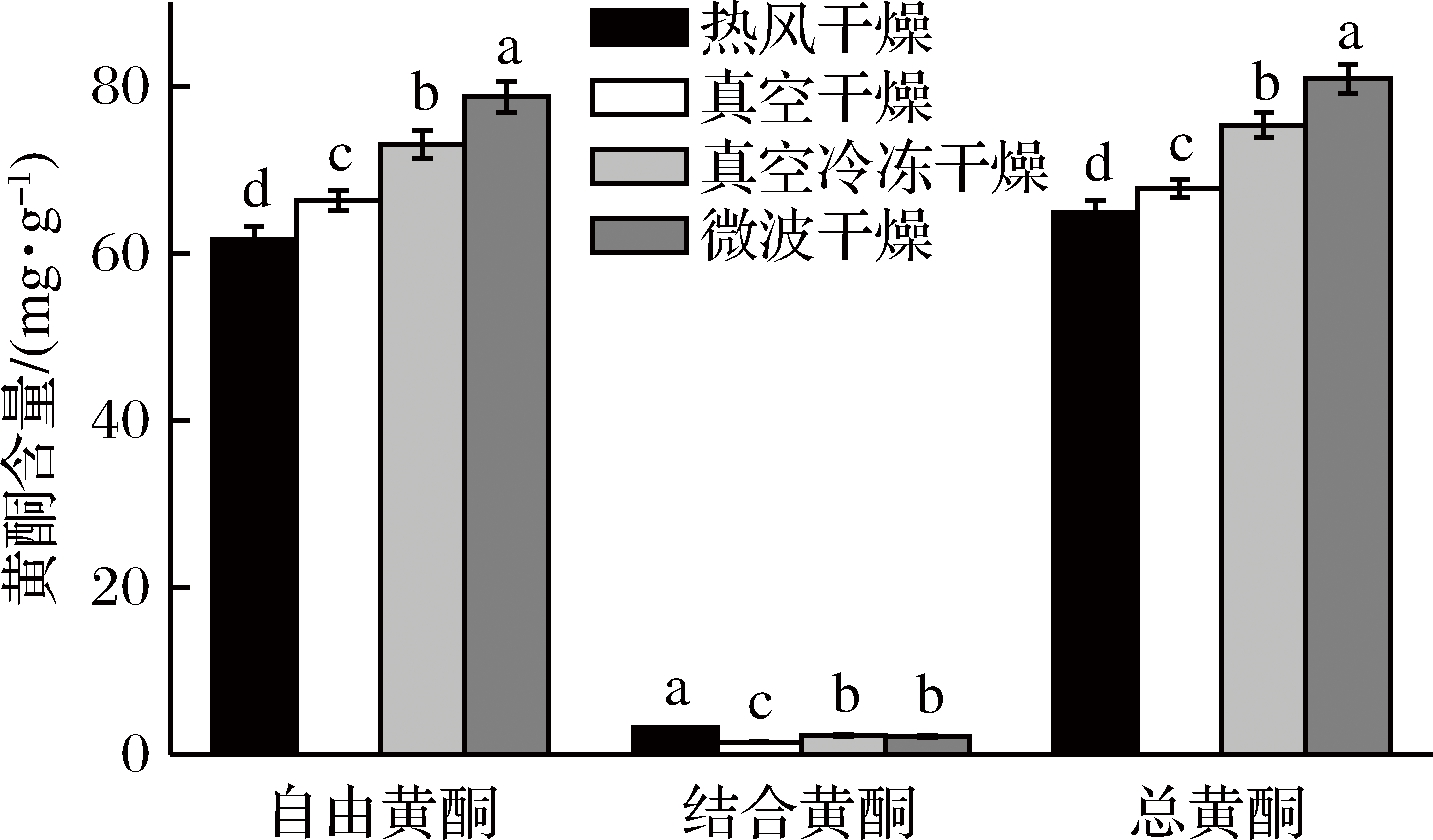
图2 干燥方法对朝鲜蓟粉黄酮含量的影响
Fig.2 Effect of drying method on flavone content of artichoke powder
2.3 提取液质量浓度(自由酚)对抗氧化能力的影响
由图3可知,抗氧化能力均随着提取液质量浓度的增加而增强。在DPPH自由基评价体系中,自由基清除能力大小顺序为微波组>冻干组>真空组>热风组,且随着提取液质量浓度的增加,清除率表现出良好的线性关系,当提取液质量浓度为1.0 mg/mL时,DPPH清除率分别达到了88.37%(热风组)、90.52%(真空组)、94.91%(冻干组)、97.32%(微波组);在ABTS+自由基评价体系中,各干燥组自由基清除率均随着提取液质量浓度增加而增加,且相互之间存在显著性差异(P<0.05),当提取液质量浓度为1.6 mg/mL时,微波组自由基清除率上升趋势逐渐放缓,但仍大于另外3组;在超氧阴离子自由基评价体系中,当提取液质量浓度为0.4 mg/mL时,微波组清除率显著大于其他3组(P<0.05),达到45.58%,随后另外3组随着提取液质量浓度增加,清除率急剧上升,在提取液质量浓度为1.2 mg/mL时,保持到较小差距,但微波组仍处于领先位置;总还原力评价体系中,冻干组最先处于最小位置,随后急剧上升,并与微波组相当,当提取液质量浓度为1.0 mg/mL时,微波组与冻干组之间没有显著性差异,均大于热风组和真空组。综上所述,在4组干燥样品中,微波组抗氧化能力最强。
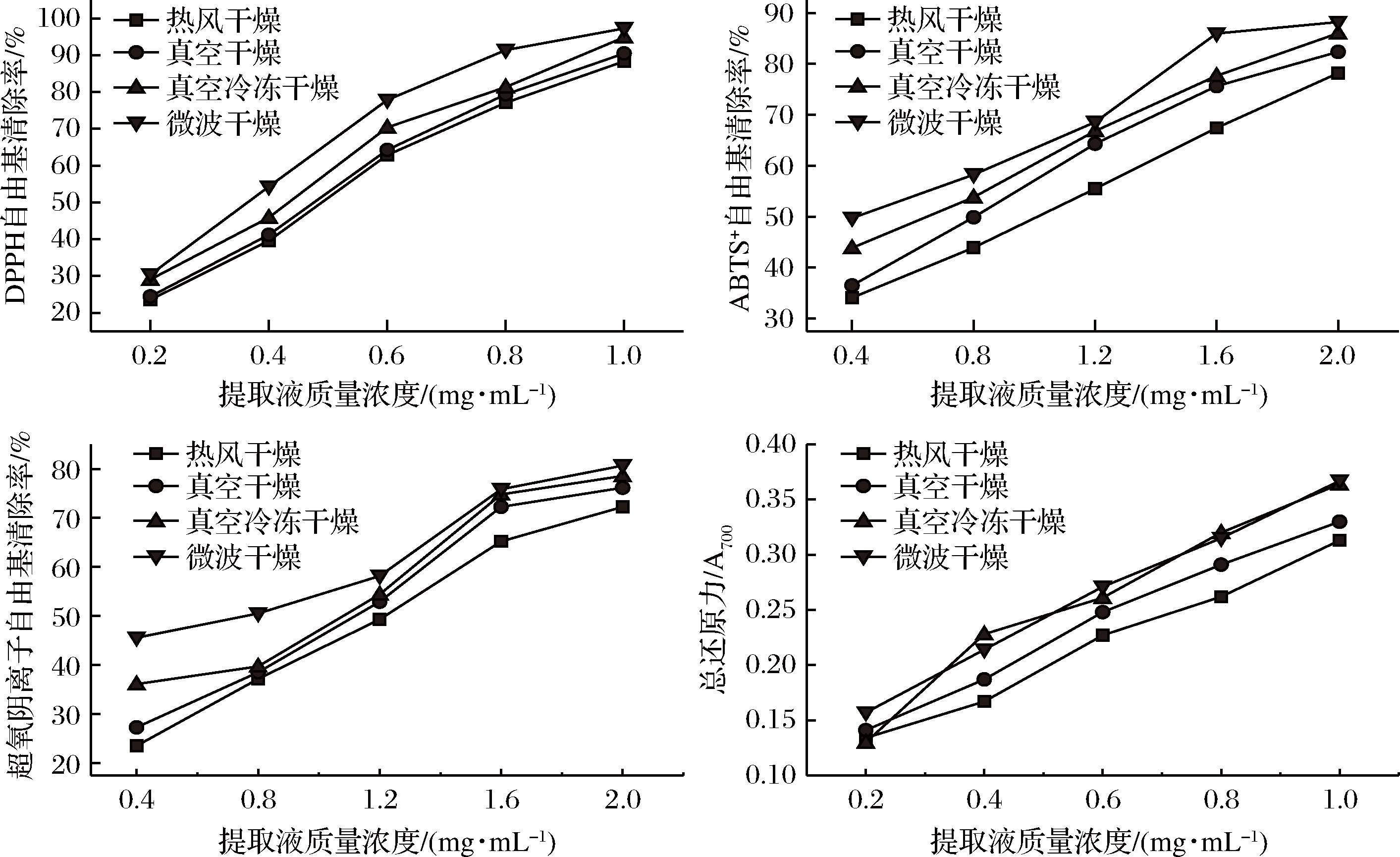
图3 提取液质量浓度(自由酚)对抗氧化能力的影响
Fig.3 Effect of extract mass concentration (free phenol) on oxidation resistance
2.4 干燥方法(结合酚)对抗氧化能力的影响
由图4可知,4种抗氧化评价指标结果均为微波组>冻干组>真空组>热风组,且相互间具有显著性差异(P<0.05),与结合酚含量的大小顺序相一致。在DPPH自由基评价体系中,4组干燥样品清除率分别为77.93%(热风组)、79.37%(真空组)、86.79%(冻干组)、90.84%(微波组);ABTS+自由基评价体系中微波组清除率最高(55.22%),分别为热风组、真空组及冻干组的1.85、1.77、1.19倍;在超氧阴离子自由基和总还原力评价体系中,同样表现为微波组最高,热风组最低。综上所述,微波组的结合酚提取液抗氧化性最强。
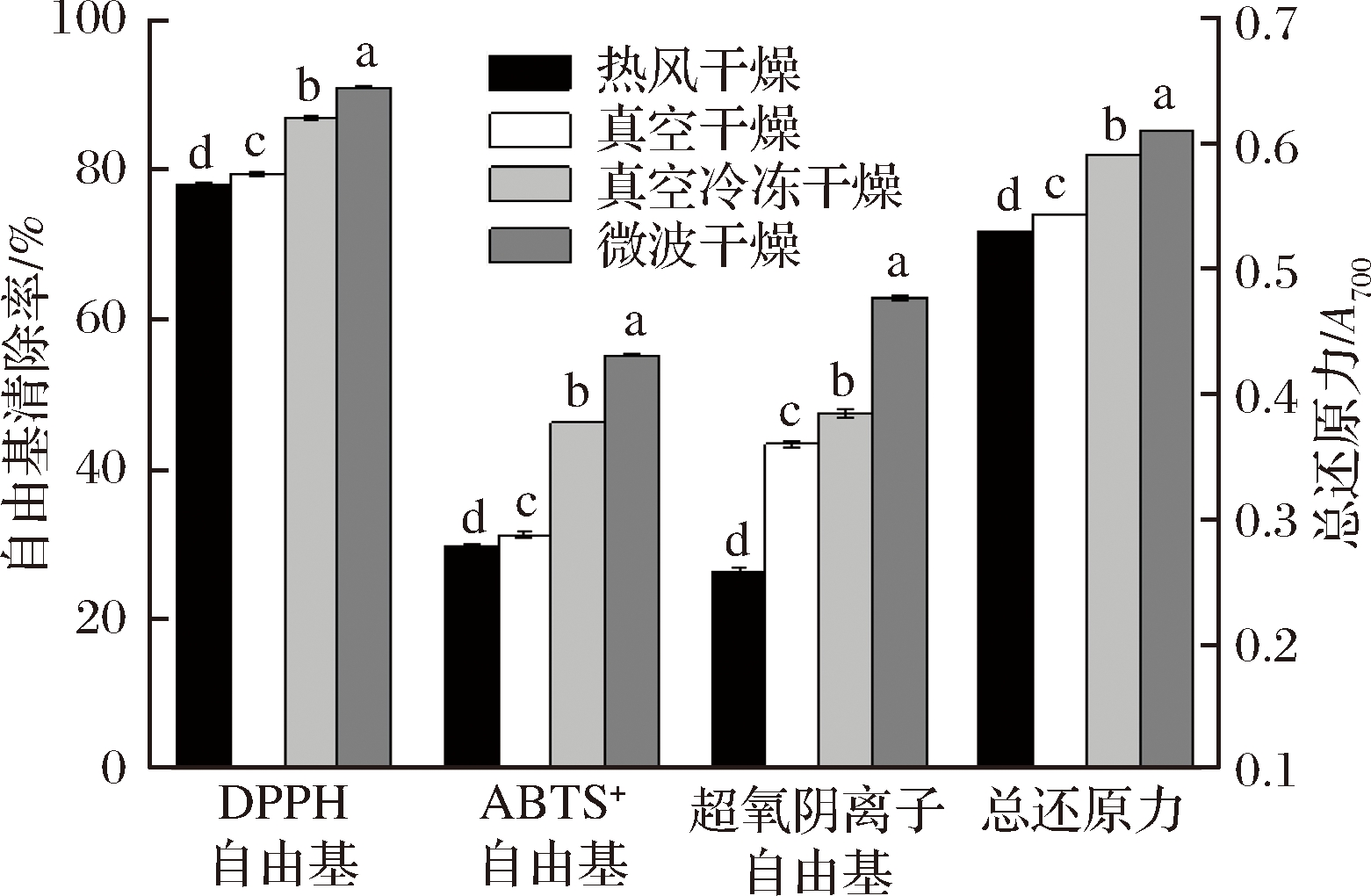
图4 干燥方法(结合酚)对抗氧化能力的影响
Fig.4 Effects of drying methods (combined phenols) on oxidation resistance
2.5 酚类物质与抗氧化能力相关性分析
由表1可知,在各组干燥样品自由酚中,提取液质量浓度与4种抗氧化评价指标均有良好的线性关系,呈0.01水平线性相关。对于结合酚而言,多酚质量浓度与DPPH自由基清除率、ABTS+自由基清除率、总还原力呈0.05水平线性相关,与超氧阴离子清除率没有显著相关性。这可能是由于朝鲜蓟经过4种干燥方法,虽然多酚含量有差异,但其酚类物质不同,故抗氧化能力也有所不同,所以相关性较低。综上所述,酚类物质与抗氧化能力有较强的相关性。
表1 酚类物质与抗氧化能力相关性分析
Table 1 Correlation analysis between phenolic compounds and antioxidant capacity
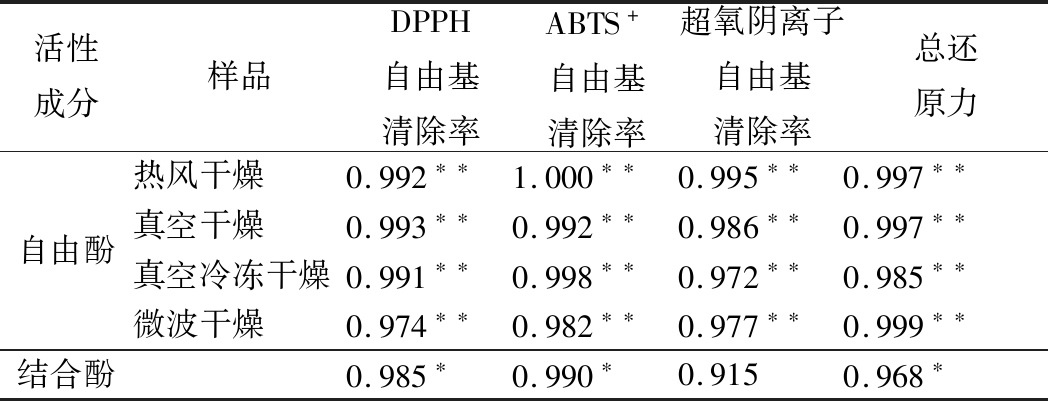
活性成分样品DPPH自由基清除率ABTS+自由基清除率超氧阴离子自由基清除率总还原力自由酚热风干燥0.992∗∗1.000∗∗0.995∗∗0.997∗∗真空干燥0.993∗∗0.992∗∗0.986∗∗0.997∗∗真空冷冻干燥0.991∗∗0.998∗∗0.972∗∗0.985∗∗微波干燥0.974∗∗0.982∗∗0.977∗∗0.999∗∗结合酚0.985∗0.990∗0.9150.968∗
注:*表示P<0.05水平显著相关;**表示P<0.01水平显著相关。
2.6 朝鲜蓟粉香气成分分析
图5为朝鲜蓟样及不同干燥方法朝鲜蓟粉香气成分总离子流图,表2为朝鲜蓟鲜样及不同干燥组朝鲜蓟粉的香气成分表。
由表2可知,从鲜样及4组干燥粉运用HS-SPME-GC-MS法共检测出香气成分107种,其中烯萜类16种,醛类22种,醇类21种,烷类24种,酯类12种以及其他物质12种。朝鲜蓟鲜样、热风组、真空组、冻干组、微波组各自检测出40、58、52、43、52种挥发性香气成分。
图5 朝鲜蓟鲜样及不同干燥方法朝鲜蓟粉香气成分总离子流图
Fig.5 GC-MS total ion chromatogram of aroma components in Artichoke and artichoke powder of different drying methods
表2 不同干燥方法对朝鲜蓟粉香气成分的影响
Table 2 Effects of different drying methods on aroma components of artichoke powder
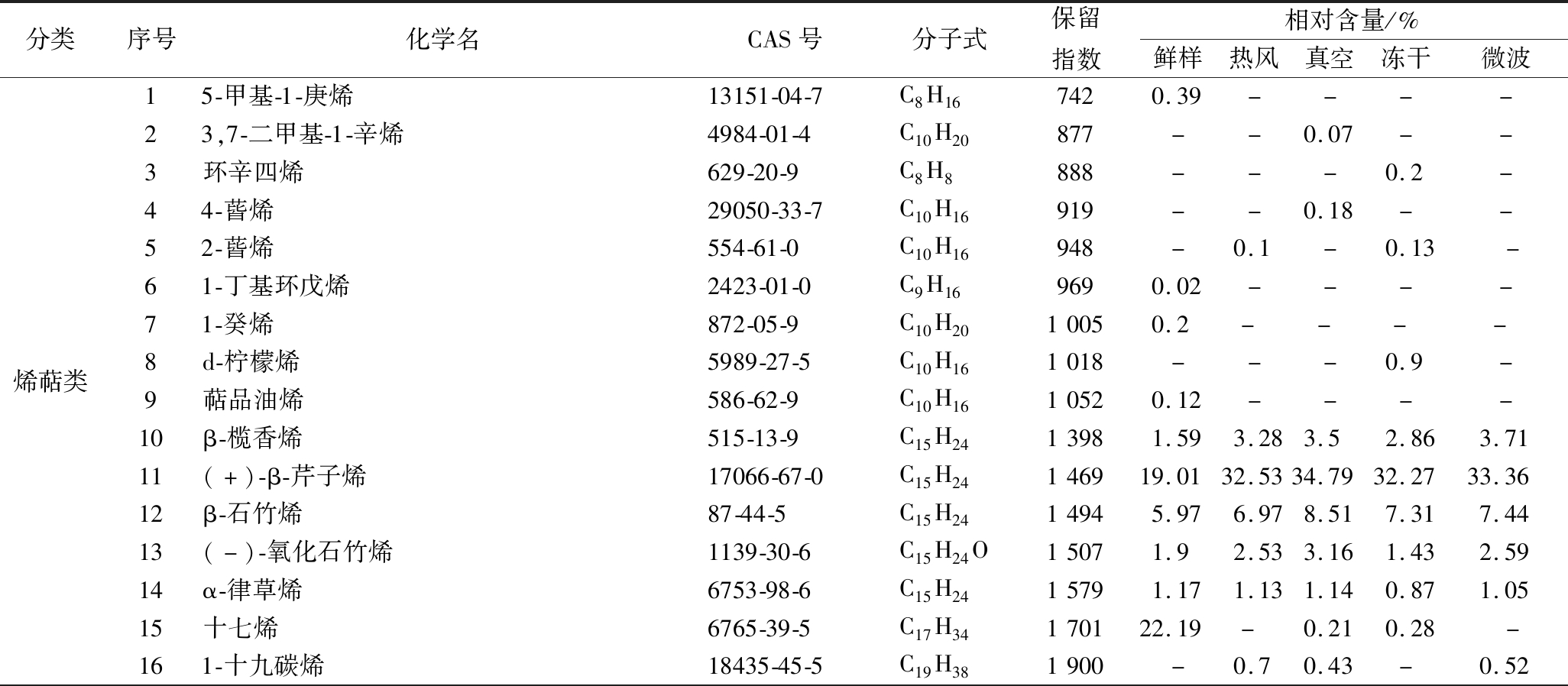
分类序号化学名CAS号分子式保留指数相对含量/%鲜样热风真空冻干微波烯萜类15-甲基-1-庚烯13151-04-7C8H167420.39----23,7-二甲基-1-辛烯4984-01-4C10H20877--0.07--3环辛四烯629-20-9C8H8888---0.2-44-蒈烯29050-33-7C10H16919--0.18--52-蒈烯554-61-0C10H16948-0.1-0.13-61-丁基环戊烯2423-01-0C9H169690.02----71-癸烯872-05-9C10H2010050.2----8d-柠檬烯5989-27-5C10H161018---0.9-9萜品油烯586-62-9C10H1610520.12----10β-榄香烯515-13-9C15H2413981.593.283.52.863.7111(+)-β-芹子烯17066-67-0C15H24146919.0132.5334.7932.2733.3612β-石竹烯87-44-5C15H2414945.976.978.517.317.4413(-)-氧化石竹烯1139-30-6C15H24O15071.92.533.161.432.5914α-律草烯6753-98-6C15H2415791.171.131.140.871.0515十七烯6765-39-5C17H34170122.19-0.210.28-161-十九碳烯18435-45-5C19H381900-0.70.43-0.52
续表2
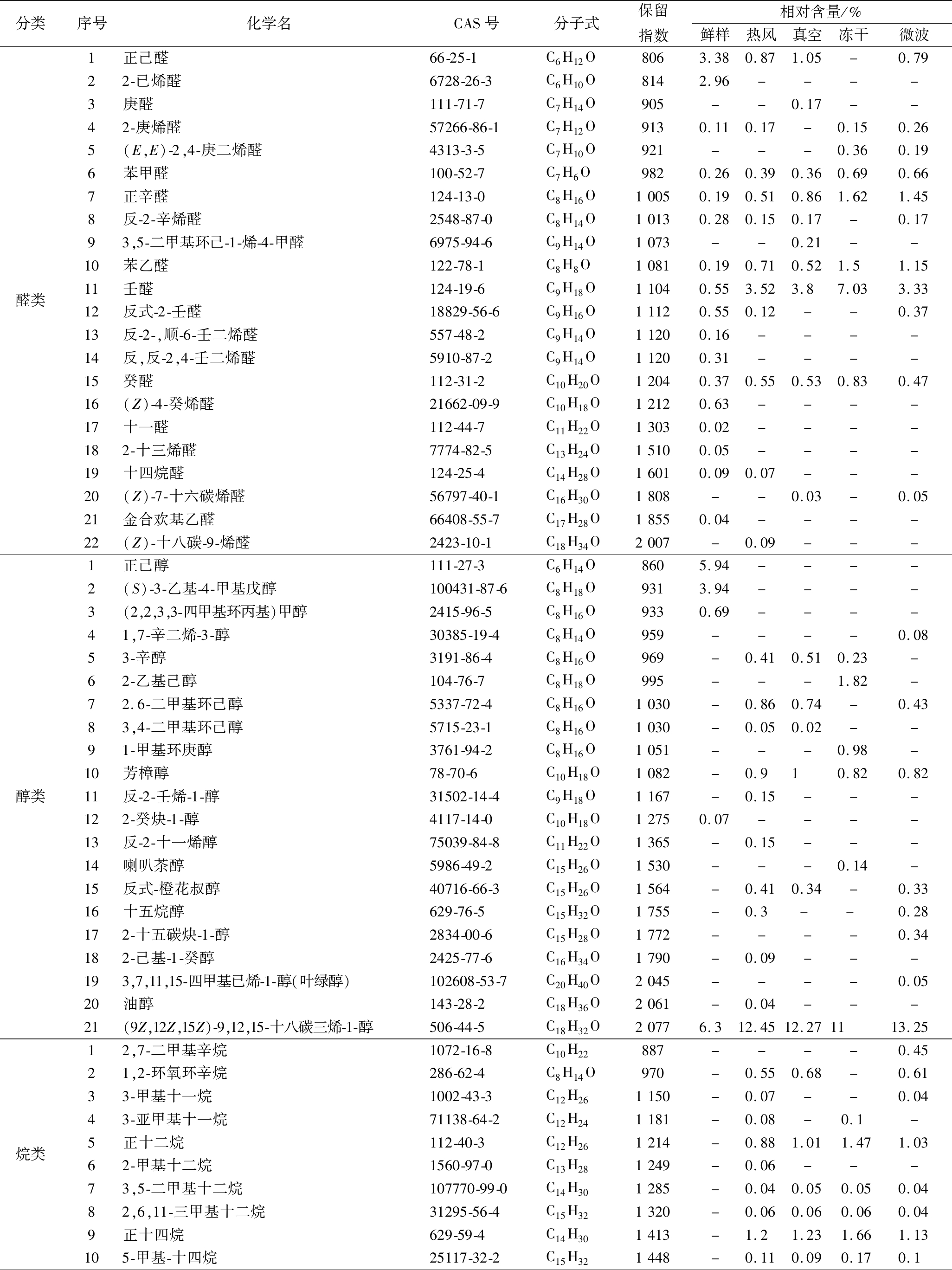
分类序号化学名CAS号分子式保留指数相对含量/%鲜样热风真空冻干微波醛类1正己醛66-25-1C6H12O8063.380.871.05-0.7922-已烯醛6728-26-3C6H10O8142.96----3庚醛111-71-7C7H14O905--0.17--42-庚烯醛57266-86-1C7H12O9130.110.17-0.150.265(E,E)-2,4-庚二烯醛4313-3-5C7H10O921---0.360.196苯甲醛100-52-7C7H6O9820.260.390.360.690.667正辛醛124-13-0C8H16O10050.190.510.861.621.458反-2-辛烯醛2548-87-0C8H14O10130.280.150.17-0.1793,5-二甲基环己-1-烯-4-甲醛6975-94-6C9H14O1073--0.21--10苯乙醛122-78-1C8H8O10810.190.710.521.51.1511壬醛124-19-6C9H18O11040.553.523.87.033.3312反式-2-壬醛18829-56-6C9H16O11120.550.12--0.3713反-2-,顺-6-壬二烯醛557-48-2C9H14O11200.16----14反,反-2,4-壬二烯醛5910-87-2C9H14O11200.31----15癸醛112-31-2C10H20O12040.370.550.530.830.4716(Z)-4-癸烯醛21662-09-9C10H18O12120.63----17十一醛112-44-7C11H22O13030.02----182-十三烯醛7774-82-5C13H24O15100.05----19十四烷醛124-25-4C14H28O16010.090.07---20(Z)-7-十六碳烯醛56797-40-1C16H30O1808--0.03-0.0521金合欢基乙醛66408-55-7C17H28O18550.04----22(Z)-十八碳-9-烯醛2423-10-1C18H34O2007-0.09---醇类1正己醇111-27-3C6H14O8605.94----2(S)-3-乙基-4-甲基戊醇100431-87-6C8H18O9313.94----3(2,2,3,3-四甲基环丙基)甲醇2415-96-5C8H16O9330.69----41,7-辛二烯-3-醇30385-19-4C8H14O959----0.0853-辛醇3191-86-4C8H16O969-0.410.510.23-62-乙基己醇104-76-7C8H18O995---1.82-72.6-二甲基环己醇5337-72-4C8H16O1030-0.860.74-0.4383,4-二甲基环己醇5715-23-1C8H16O1030-0.050.02--91-甲基环庚醇3761-94-2C8H16O1051---0.98-10芳樟醇78-70-6C10H18O1082-0.910.820.8211反-2-壬烯-1-醇31502-14-4C9H18O1167-0.15---122-癸炔-1-醇4117-14-0C10H18O12750.07----13反-2-十一烯醇75039-84-8C11H22O1365-0.15---14喇叭茶醇5986-49-2C15H26O1530---0.14-15反式-橙花叔醇40716-66-3C15H26O1564-0.410.34-0.3316十五烷醇629-76-5C15H32O1755-0.3--0.28172-十五碳炔-1-醇2834-00-6C15H28O1772----0.34182-己基-1-癸醇2425-77-6C16H34O1790-0.09---193,7,11,15-四甲基已烯-1-醇(叶绿醇)102608-53-7C20H40O2045----0.0520油醇143-28-2C18H36O2061-0.04---21(9Z,12Z,15Z)-9,12,15-十八碳三烯-1-醇506-44-5C18H32O20776.312.4512.271113.25烷类12,7-二甲基辛烷1072-16-8C10H22887----0.4521,2-环氧环辛烷286-62-4C8H14O970-0.550.68-0.6133-甲基十一烷1002-43-3C12H261150-0.07--0.0443-亚甲基十一烷71138-64-2C12H241181-0.08-0.1-5正十二烷112-40-3C12H261214-0.881.011.471.0362-甲基十二烷1560-97-0C13H281249-0.06---73,5-二甲基十二烷107770-99-0C14H301285-0.040.050.050.0482,6,11-三甲基十二烷31295-56-4C15H321320-0.060.060.060.049正十四烷629-59-4C14H301413-1.21.231.661.13105-甲基-十四烷25117-32-2C15H321448-0.110.090.170.1
续表2
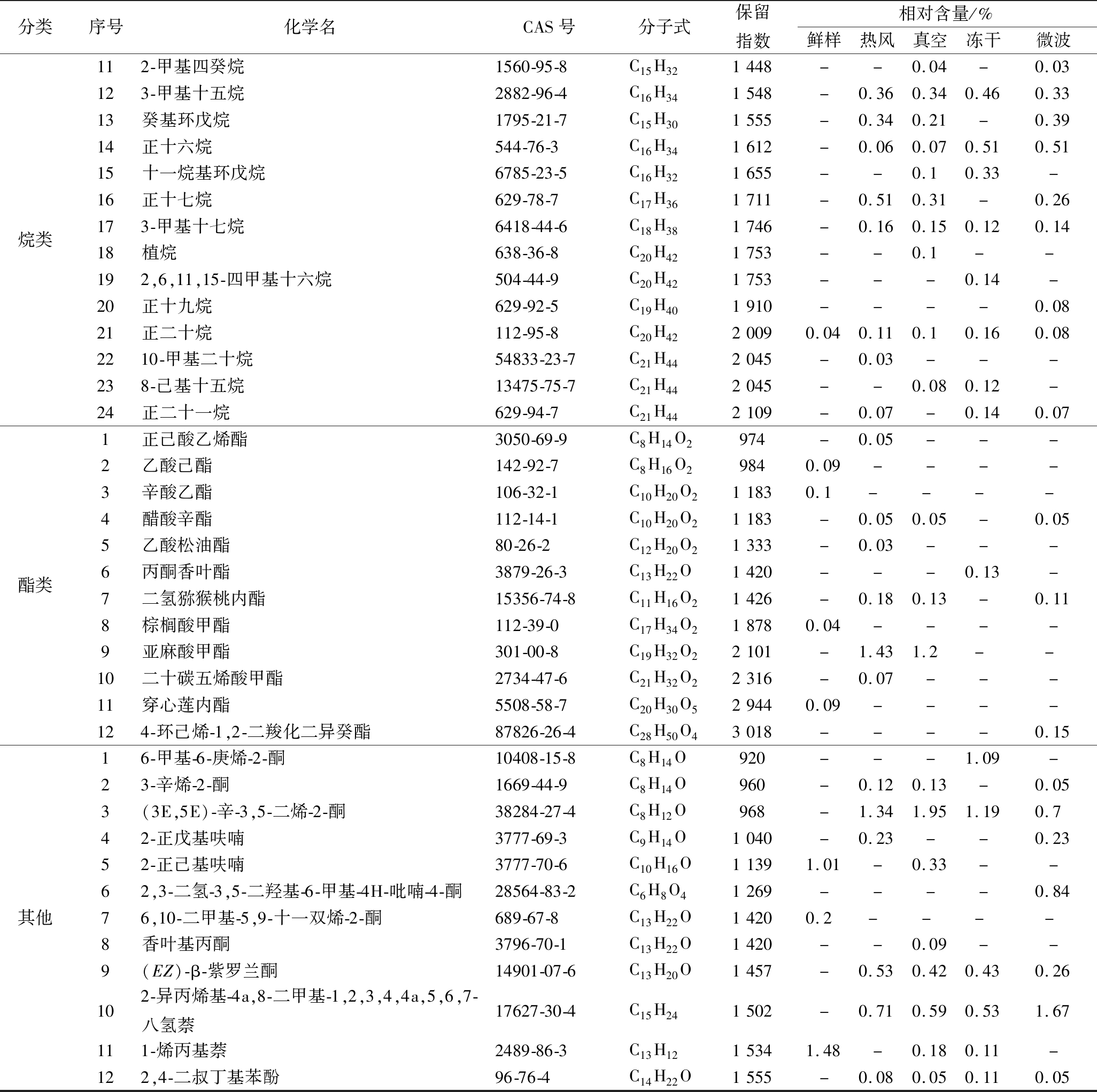
分类序号化学名CAS号分子式保留指数相对含量/%鲜样热风真空冻干微波烷类112-甲基四癸烷1560-95-8C15H321448--0.04-0.03123-甲基十五烷2882-96-4C16H341548-0.360.340.460.3313癸基环戊烷1795-21-7C15H301555-0.340.21-0.3914正十六烷544-76-3C16H341612-0.060.070.510.5115十一烷基环戊烷6785-23-5C16H321655--0.10.33-16正十七烷629-78-7C17H361711-0.510.31-0.26173-甲基十七烷6418-44-6C18H381746-0.160.150.120.1418植烷638-36-8C20H421753--0.1--192,6,11,15-四甲基十六烷504-44-9C20H421753---0.14-20正十九烷629-92-5C19H401910----0.0821正二十烷112-95-8C20H4220090.040.110.10.160.082210-甲基二十烷54833-23-7C21H442045-0.03---238-己基十五烷13475-75-7C21H442045--0.080.12-24正二十一烷629-94-7C21H442109-0.07-0.140.07酯类1正己酸乙烯酯3050-69-9C8H14O2974-0.05---2乙酸己酯142-92-7C8H16O29840.09----3辛酸乙酯106-32-1C10H20O211830.1----4醋酸辛酯112-14-1C10H20O21183-0.050.05-0.055乙酸松油酯80-26-2C12H20O21333-0.03---6丙酮香叶酯3879-26-3C13H22O1420---0.13-7二氢猕猴桃内酯15356-74-8C11H16O21426-0.180.13-0.118棕榈酸甲酯112-39-0C17H34O218780.04----9亚麻酸甲酯301-00-8C19H32O22101-1.431.2--10二十碳五烯酸甲酯2734-47-6C21H32O22316-0.07---11穿心莲内酯5508-58-7C20H30O529440.09----124-环己烯-1,2-二羧化二异癸酯87826-26-4C28H50O43018----0.15其他16-甲基-6-庚烯-2-酮10408-15-8C8H14O920---1.09-23-辛烯-2-酮1669-44-9C8H14O960-0.120.13-0.053(3E,5E)-辛-3,5-二烯-2-酮38284-27-4C8H12O968-1.341.951.190.742-正戊基呋喃3777-69-3C9H14O1040-0.23--0.2352-正己基呋喃3777-70-6C10H16O11391.01-0.33--62,3-二氢-3,5-二羟基-6-甲基-4H-吡喃-4-酮28564-83-2C6H8O41269----0.8476,10-二甲基-5,9-十一双烯-2-酮689-67-8C13H22O14200.2----8香叶基丙酮3796-70-1C13H22O1420--0.09--9(EZ)-β-紫罗兰酮14901-07-6C13H20O1457-0.530.420.430.26102-异丙烯基-4a,8-二甲基-1,2,3,4,4a,5,6,7-八氢萘17627-30-4C15H241502-0.710.590.531.67111-烯丙基萘2489-86-3C13H1215341.48-0.180.11-122,4-二叔丁基苯酚96-76-4C14H22O1555-0.080.050.110.05
注:“-”表示未检测到。
由表2可知,朝鲜蓟鲜样的主要香气成分是烯萜类、醛类以及醇类物质,含量分别达到52.56%、10.14%、16.94%。烯萜类中(+)-β-芹子烯、十七烯、β-石竹烯、(-)-氧化石竹烯、α-律草烯及β-榄香烯为主要香气物质,其中(+)-β-芹子烯、十七烯含量最高,占比达到19.01%、22.19%,(+)-β-芹子烯有令人愉快的、新鲜的柑桔和胡椒的气味并带有薄荷香气[20],对比4种干燥后朝鲜蓟样品,十七烯在真空组和冻干组中有少量检出,在热风组和微波组中未检出,β-榄香烯、(+)-β-芹子烯及β-石竹烯含量均有所上升。研究表明,烯萜类化合物大多具有花香、甜香以及果香等香气,对朝鲜蓟的香气有重要作用[21]。
醛类化合物一般与香气有密切关系,朝鲜蓟鲜样中正己醛、2-已烯醛含量较高,正己醛呈现青鲜气息和水果香[22],2-已烯醛也有浓郁的青草香气[23];而4种干燥后朝鲜蓟样品中,正己醛含量减少,且未检测出2-已烯醛,相较于鲜样苯甲醛、正辛醛、苯乙醛、壬醛及癸醛含量均有所上升,且冻干组增加量最大,微波组稍次之。苯甲醛和苯乙醛有苦杏仁和花香味[24-25],正辛醛稀释后有甜橙、蜂蜜样气味[26],壬醛则有柑橘和青鲜气息[27]。
醇类物质主要可以呈现出清香、果香、花香和柑橘类香[27],朝鲜蓟鲜样中检出醇类物质较少,仅有5种,但正己醇、(S)-3-乙基-4-甲基戊醇及(9Z,12Z,15Z)-9,12,15-十八碳三烯-1-醇含量较高,4种样品中检出醇类物质增多,但含量较低,(9Z,12Z,15Z)-9,12,15-十八碳三烯-1-醇相对鲜样含量明显增加。另外鲜样中烷类仅有1种,而干燥后样品烷类物质会增加,与酯类和其他物质一同对朝鲜蓟样品的香气起到修饰作用。
综上,干燥后增加了朝鲜蓟中挥发性物质的数量,且呈香物质发生改变,或物质含量显著上升,不同干燥组样品挥发性物质及含量均有所不同。
3 结论
本文比较了4种干燥方法对朝鲜蓟粉酚类物质含量、抗氧化性及香气成分的影响,酚类物质含量比较中,微波组自由酚及结合酚含量均大于其他3组,但自由酚与冻干组间并无显著性差异(P>0.05),自由黄酮含量大小顺序为微波组>冻干组>真空组>热风组,且相互之间差异显著(P<0.05),而热风组结合黄酮含量最高,真空组最低;在不同干燥方法样品自由酚抗氧化性能比较中,随着提取液浓度的增加,各组抗氧化能力呈线性增强趋势,4种评定体系均显示微波组抗氧化能力最强,与结合酚抗氧化能力测定结果相一致。在挥发性香气分析中,主要呈香物质为烯萜类、醛类及醇类物质,鲜样中以(+)-β-芹子烯、十七烯、β-石竹烯、正己醛、2-已烯醛、正己醇、(S)-3-乙基-4-甲基戊醇及(9Z,12Z,15Z)-9,12,15-十八碳三烯-1-醇为主,对比4种干燥组样品可得,各组样品挥发性物质及含量均有所不同,香气物质增加,主要呈香物质改变或含量增加,使朝鲜蓟香气成分更加丰富。综上所述,微波组酚类物质含量保留效果最好,抗氧化能力最强,香气物质增加且呈香效果较好,可用于朝鲜蓟粉的开发利用。
[1] 徐琳琳,曹建新. 朝鲜蓟的化学成分及药理活性研究进展[J]. 天然产物研究与开发, 2012(8):1 135-1 140.
[2] WANG M F, SIMON J E, AVILES Z F, et al. Analysis of antioxidative phenolic com-pounds in artichoke (Cynara Scolymus L.)[J]. Agriculture and Food Chemistry,2003, 51: 601-608.
[3] MOHAMED S. Functional foods against metabolic syndrome (obesity, diabetes, hypertension and dyslipidemia) and cardiovascular disease[J]. Trends in Food Science and Technology, 2014, 35(2): 114-128.
[4] RAMDATH D D, PADHI E, HAWKE A, et al. The glycemic index of pigmented potatoes is related to their polyphenol content[J]. Food & Function, 2014, 5(5): 909-915.
[5] CHU Y F, SUN J, WU X Z, et al. Antioxidant and antiproliferative activities of common vegetables[J]. Agriculture and Food Chemistry, 2002, 50: 6 910-6 916.
[6] 杨克沙. 朝鲜蓟的化学成分和活性研究[D]. 昆明:昆明理工大学, 2015.
[7] 杨美莲,程桂广,蔡圣宝,等. 朝鲜蓟叶多酚提取及抗氧化活性研究[J]. 现代食品科技, 2019, 35(4):157-165.
[8] ABU-REIDAH I M, ARR EZ-ROM N D, SEGURA-CARRETERO A, et al. Extensive characterisation of bioactive phenolic constituents from globe artichoke (Cynara scolymus L.) by HPLC-DAD-ESI-QTOF-MS[J]. Food Chemistry, 2013, 141(3):2 269-2 277.
EZ-ROM N D, SEGURA-CARRETERO A, et al. Extensive characterisation of bioactive phenolic constituents from globe artichoke (Cynara scolymus L.) by HPLC-DAD-ESI-QTOF-MS[J]. Food Chemistry, 2013, 141(3):2 269-2 277.
[9] GEORGIEVA E, KARAMALAKOVA Y, NIKOLOVA G, et al. Radical scavenging capacity of seeds and leaves ethanol extracts of —A comparative study[J]. Biotechnology & Biotechnological Equipment, 2012, 26(sup1):151-155.
[10] 王振帅,陈善敏,盛怀宇,等. 不同干燥方法对朝鲜蓟粉品质的影响[J]. 食品与发酵工业,2019,45(19):119-124
[11] 王耀红,王蕾,赵朋, 等. 不同加工方式对紫色马铃薯中酚类物质的影响[J]. 食品科学, 2017(7):123-129.
[12] JUNG J, LEE S, KOZUKUE N, et al. Distribution of phenolic compounds and antioxidative activities in parts of sweet potato (Ipomoea batata L.) plants and in home processed roots [J]. Journal of Food Composition and Analysis, 2011, 24(1): 29-37.
[13] DEWANTO V, WU X, ADOM K K, et al. Thermal processing enhances the nutritional value of tomatoes by increasing total antioxidant activity[J]. Journal of Agricultural Food Chemistry, 2002, 50(10): 3 010-3 014.
[14] 胡秦佳宝,刘璇,毕金峰,等. 非热加工与传统热处理对苹果汁品质的影响[J]. 食品与发酵工业, 2016, 42(1):102-107.
[15] 张碧莹,唐玲,张静,等. 不同加工方式对甘薯汁品质及抗氧化活性的影响[J]. 食品与发酵工业, 2017,43(12):157-163.
[16] 潘丽军,孙潇雅,姜绍通. 紫薯复合饮料的质量指标、营养成分及抗氧化性分析[J]. 食品科学, 2013, 34(20): 165-169.
[17] ZOU C, DU Y M, LI Y, et al. Preparation of lacquer polysaccharide sulfates and their antioxidant activity in vitro[J]. Carbohydrate Polymers, 2008(73): 322-331.
[18] 吴琼,刘奕,吴庆园, 等. 不同干燥方式对葛根全粉抗氧化性能和香气成分的影响[J]. 食品科学, 2017(6):208-214.
[19] NAVARRE D A, SHAKYA R, HOLDEN J, et al. The effect of different cooking methods on phenolics and vitamin C in developmentally young potato tubers[J]. American Journal of Potato Research, 2010, 87(4): 350-359.
[20] 陆俊,张佳琦,赵培瑞,等.鸭儿芹精油成分、抗氧化与抑菌活性研究[J]. 经济林研究, 2017(2):100-104.
[21] CULLERÉ L, SAN-JUAN F, CACHO J. Characterisation of aroma active compounds of Spanish saffron by gas chromatography-olfactometry: Quantitative evaluation of the most relevant aromatic compounds[J]. Food Chemistry, 2011, 127(4):1 866-1 871.
[22] ATSUSHI U, YUSEI K, SHINSUKE M, et al. Characterization of aroma-active compounds in dry flower of Malva sylvestris L. by GC-MS-O Analysis and OAV Calculations[J]. Journal of Oleo Science, 2013, 62(8):563-570.
[23] DU X, ROUSEFF R. Aroma active volatiles in four southern highbush blueberry cultivars determined by gas chromatography-olfactometry (GC-O) and gas chromatography-mass spectrometry (GC-MS)[J]. Journal of Agricultural and Food Chemistry, 2014, 62(20):4 537-4 543.
[24] 王秀娟,徐继林,严小军.2种海藻中半挥发性物质的成分分析[J].海洋科学, 2010, 34(1):25-28.
[25] JURGENS A, WITT T, GOTTSBERGER G. Flower scent composition in night-flowering Silene species (Caryophyllaceae)[J]. Biochemical Systematics & Ecology, 2002, 30(5):383-397.
[26] 朱荫,杨停,施江, 等. 西湖龙井茶香气成分的全二维气相色谱-飞行时间质谱分析[J]. 中国农业科学, 2015(20).
[27] 刘璇,赖必辉,毕金峰,等.不同干燥方式芒果脆片香气成分分析[J].食品科学, 2013, 34(22):179-184.