果胶是一种大分子酸性多糖,其理化特性、流变性质和乳化特性是食品加工过程中极其重要的特性[1]。柠檬皮渣是柠檬加工的主要副产物,其干基中果胶含量可达30%,与其他种类的果胶相比,其胶凝性强,酯化度高,分子量大,是一种较好的天然果胶来源[2-3];且柠檬果胶是一种黏性食品胶,具有良好的乳化性[4]。
果胶的提取方法主要有酸法提取(traditional acid extraction,TAE)、酶法提取(enzyme extraction,EE)、微波法辅助提取(microwave assisted extraction,MAE)、超高压法辅助提取(ultra-high pressure assisted extraction,UHPAE)及超声波法辅助提取(ultrasound assisted extraction,UAE)[4]。研究表明,不同方式提取的果胶具有不同的性质特性,所得果胶在工业生产中应用领域也不同[5-6]。因此,研究不同提取方式对柠檬果胶特性的影响可在一定程度上扩大果胶的应用。基于此,本研究主要探讨了5种不同的提取方式对柠檬果胶理化特性、流变特性和乳化特性的影响,并与商品柠檬果胶(commercial lemon pectin,CLP)比较,以期为拓展柠檬果胶在食品行业中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
干燥柠檬皮渣:自制,制备方法见参考文献[7];D-半乳糖醛酸(91510-62-2),分析纯,美国Sigma公司;咔唑试剂(86-74-8),上海展云化工有限公司;白砂糖,眉山市新纪元食品有限公司;商品柠檬果胶,安德利集团有限公司;食品级纤维素酶(酶活400 U/g),和氏璧生物科技有限公司;无水乙醇、碳酸钠溶液、浓硫酸(95%~98%)、乙二胺四乙酸(EDTA)、柠檬酸、95%(体积分数)乙醇、酚酞、氢氧化钠,分析纯,成都市科龙化工试剂厂。
1.2 仪器与设备
Triowin橙子榨汁机,上海沃迪智能装备股份有限公司;TB-214电子天平,北京赛多利斯仪器系统有限公司;SHZ-DIII旋转蒸发仪,北京普瑞奇科技股份有限公司;PHS-320 pH计,上海霄盛有限公司;SFG-02.400电热恒温鼓风干燥箱,黄石市恒丰医疗器械有限公司;SpectraMax® i3x酶标仪,美谷分子仪器(上海)有限公司;TD-5M低速离心机,四川蜀科仪器有限公司;JYD-L超声波细胞粉碎仪,上海般诺生物科技有限公司;MOOEL超高压设备,上海沃迪智能装备股份有限公司;FY-10型微波萃取仪,上海越众仪器设备有限公司;Nicolet Is 50傅立叶变换红外光谱仪,上海力晶科学仪器有限公司;MCR xx2流变仪,奥地利安东帕(中国)有限公司;Malvern Zetasizer Nano ZS激光粒度仪,英国Malvern仪器有限公司。
1.3 试验方法
1.3.1 工艺流程
柠檬干渣过筛(去除小于1 mm颗粒)→5种提取果胶工艺(详见1.3.2.1~1.3.2.5;都以0.05 mol/L EDTA为提取溶剂,0.5 mol/L柠檬酸调节pH)→1 500 r/min下离心20 min收集上清液→滤渣用蒸馏水洗涤→60 ℃旋转蒸发浓缩至原体积1/2→2倍体积的95%(体积分数)乙醇沉淀45 min并用无水乙醇洗涤3次→60 ℃干燥果胶→粉碎→果胶成品
1.3.2 提取方法
以果胶得率为指标,在预试验基础上得到5种不同提取方式的最佳提取工艺参数,如下所述:
1.3.2.1 TAE果胶工艺
料液比1∶20(g∶mL),pH 1.8,80 ℃提取150 min,其他步骤条件同1.3.1。
1.3.2.2 EE果胶工艺
料液比1∶20(g∶mL),pH 5.5,纤维素酶加酶量0.8%(质量浓度),53 ℃酶解110 min,其他步骤条件同1.3.1。
1.3.2.3 MAE果胶工艺
料液比1∶22(g∶mL),pH 2.3,在功率密度为320 W/g下提取8 min,其他步骤条件同1.3.1。
1.3.2.4 UHPAE果胶工艺
料液比1∶18(g∶mL),pH 2.3,350 MPa保压17 min,其他步骤条件同1.3.1。
1.3.2.5 UAE果胶工艺
料液比1∶18(g∶mL),pH 2.3,350 W/g提取33 min,其他步骤条件同1.3.1。
1.4 试验指标及测定方法
1.4.1 柠檬干渣果胶得率
柠檬干渣果胶得率的测定采用重量法[8],果胶得率按公式(1)计算:
(1)
式中:P,果胶得率,%;m,干燥后得到的果胶的质量,g;W,样品柠檬干渣的质量,g。
1.4.2 果胶酯化度测定
采用滴定法[9]进行,按公式(2)计算:
(2)
式中:V1,样品的初始滴定体积,mL;V2,样品溶液的皂化滴定体积,mL。
1.4.3 果胶半乳糖醛酸含量测定
采用硫酸咔唑比色法[10]进行。按公式(3)计算:
(3)
式中:E,从标准曲线中查得的半乳糖醛酸质量浓度,μg/mL。
1.4.4 果胶分子质量测定
采用凝胶色谱法测定果胶分子质量。色谱仪器:Waters 515液相色谱泵,Waters 2410示差检测器,Waters Ultrahyrdogel Linear凝胶色谱柱(300 mm×7.8 mm),Waters凝胶色谱专用软件;色谱条件:0.2 mol/L NaNO3,柱温40 ℃,流速0.60 mL/min,分子质量对照品为窄分布的葡聚糖(分子质量范围2 500~5 348 000 Dc);样品处理:称取10 mg果胶样品,加2 mL 0.2 mol/L NaNO3溶解,用0.45 μm针筒式滤膜过滤得样品溶液,窄分布葡聚糖对照品溶液用同样方法配制;分子质量计算:利用凝胶色谱专用软件计算样品的分子质量。
1.4.5 果胶的结构测定
利用Nicolet Is 50傅立叶变换红外光谱仪对样品进行红外测定。把果胶与KBr以质量比1∶25混合研磨压片制样,在400~4 000 cm-1范围内扫描。扫描64次,分辨率4 cm-1。利用Ominic 3.0软件对试验数据进行分析处理[11]。
1.4.6 果胶溶液流变性质测试
将不同提取方式的柠檬果胶样品溶解在去离子水中,使用磁力搅拌器搅拌,配制成质量分数为2%的果胶溶液。采用安东帕RheoCompass流变仪测定果胶流变性,每次测量之前,使样品平衡2 min,所有试验至少进行3次重复。
1.4.6.1 果胶溶液稳态剪切测试[12-13]
选用同轴圆筒,使样品刚好淹没圆筒内划线,转子下降后样品刚好覆盖其表面。剪切速率0.001~10 s-1,温度25 ℃,测定样品的表观黏度随剪切速率的变化。采用Power law模型对流变曲线进行拟合,模型公式如公式(4)所示:
σ=kεn
(4)
其中:σ,剪切应力;ε,剪切速率,s-1;k,黏性系数;n为流动特性指数,表示流体偏离牛顿流体的程度,当n=1,流体为牛顿流体,当n>1,流体为胀塑性流体,当n<1,流体为假塑性流体。设ηa=kεn-1,则模型公式变为σ=ηaε,ηa被称为表观黏度,即测定值中的k。
1.4.6.2 果胶溶液动态黏弹性测试[14]
振幅扫描:固定频率1 Hz,温度25 ℃,在0.01%~100%范围进行应变扫描以确定线性黏弹区(linear viscoelastic region, LVR)。
由预试验结果可知,为保证测定过程中所有果胶样品均在线性黏弹区内,选择1%作为应变扫描值。在温度25 ℃,角频率范围为0.1~100 rad/s时进行频率扫描测试。此试验选择直径为40 mm的P50平板。记录贮藏模量G′和损耗模量G″。
1.4.7 果胶溶液乳化性质测定[15]
果胶乳化性主要从乳化稳定性(emulsifying stability,ES)、乳化活性(emulsifying activity,EA)、乳液粒径及Zeta电位等方面进行表征。向质量分数为1%的20 g果胶溶液中加入15 g精制大豆油,搅拌混合,用FJ200-S高速均质机以10 000 r/min均质3次3 min(1 min/次)制备果胶乳化液。
1.4.7.1 果胶乳液粒径测定[16]
将制备好的乳液吸取2 mL于Malvern Zetasizer Nano ZS激光粒度仪比色皿中,测定乳化液粒径(volume mean diameter,D4,3)。每个样品平行3次。乳液水平放置在4 ℃冰箱中,观察储藏0、1、3、5、7 d后的乳液的稳定情况。
1.4.7.2 果胶乳液Zeta电位[14]
基于经典动态光散射理论,使用Malvern Zetasizer Nano ZS激光粒度仪Zeta potential模式测量柠檬果胶乳液的Zeta电位。为避免多重散射效应,将1%(质量分数)乳化果胶溶液稀释100倍,调节果胶溶液pH分别为 3、4、5、6、7,在25 ℃测定其电位。
1.4.7.3 果胶乳化活性及乳化稳定性[17-18]
当乳化液制备好后,0 min和10 min时分别从底部吸取1 mL乳化液于250 mL烧杯中,将乳液稀释90倍(每次稀释10倍),以0.1%(质量浓度)SDS溶液为空白,振荡均匀后在500 nm下测定吸光值。果胶EA及ES分别按公式(5)、公式(6)计算:
(5)
(6)
式中:EA,乳化活性,m2/g;ES,乳化稳定性,min;A0和A10,分别代表0 min和10 min时乳化液的吸光值;V,稀释倍数(90);L,比色皿的宽度(1 cm);φ,乳化液中油的体积分数,在本试验中油相占3/7;C,果胶溶液的质量分数,1%。
1.5 统计分析
数据以均值±标准差表示,采用SPSS 21.0 对均值进行单因素ANOVA分析和最小显著差数法(LSD)多重比较,P<0.05差异有统计学意义。采用Origin 8.5进行统计图形的绘制。
2 结果与分析
2.1 提取方法对柠檬果胶得率的影响
不同提取方式对果胶得率的影响如图1所示,通过方差分析显示通过5种不同提取方式得到的柠檬果胶得率差异显著(P<0.05)。MAE果胶得率最高为25.02%,UAE和UHPAE其次,分别是24.04%、23.76%,EE果胶得率为20.41%,TAE果胶得率最低为17.54%,这可能是由于MAE、UHPAE、UAE和EE对柠檬皮渣细胞壁的分解程度大,使得细胞破裂从而更多的多糖等物质被分解出来,所得果胶得率高。
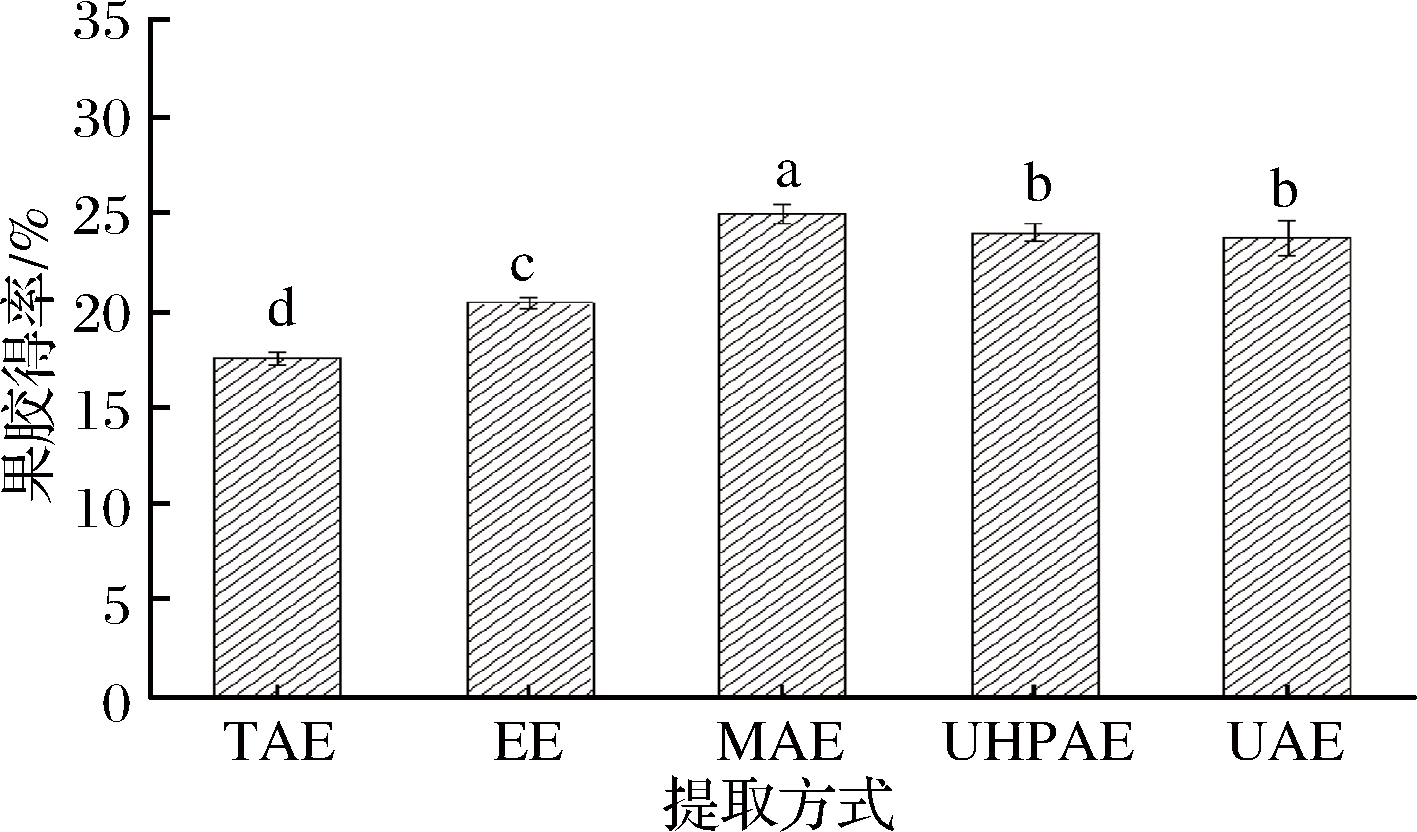
图1 提取方式对柠檬果胶得率的影响
Fig.1 Effects of extraction methods on the yield of pectin
注:相邻字母表示P<0.05;相间字母表示P<0.01。下同。
2.2 提取方式对柠檬果胶酯化度的影响
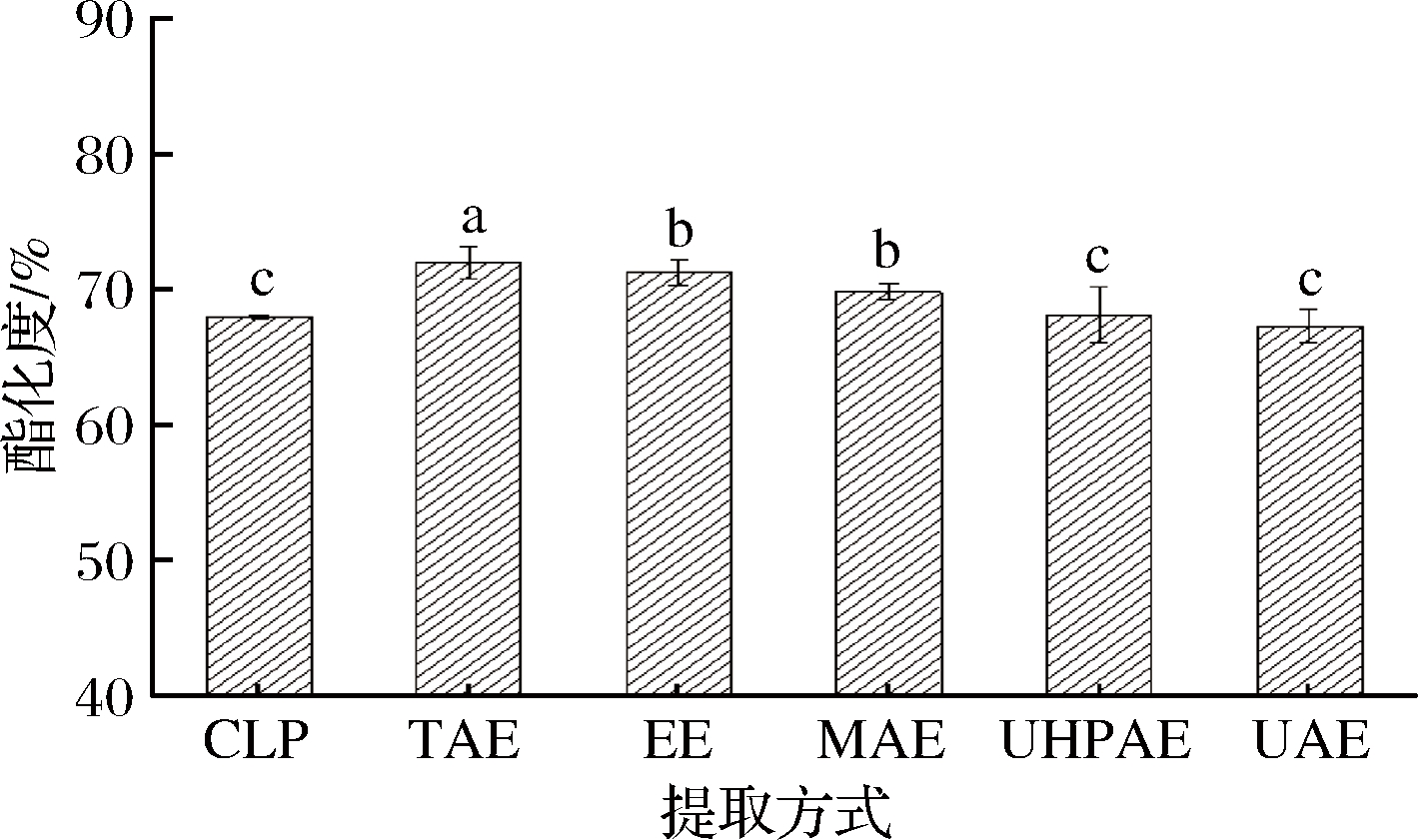
图2 提取方式对柠檬果胶酯化度的影响
Fig.2 Effects of extraction methods on esterification degree of pectin
酯化度是指果胶主链上聚半乳糖醛酸被甲酯化的程度,是果胶的一个重要功能指标[3],对果胶的溶解性、凝胶特性等影响很大。由图2可知,不同方法提取的果胶酯化度均大于50%,属于高甲氧基果胶,且不同提取方式得到的柠檬果胶酯化度差异显著(P<0.05)。5种方法提取的果胶酯化度值均大于CLP果胶。不同提取方法中,TAE得到的果胶酯化度最高,EE和MAE其次,UAE和UHPAE最低。高的DE可以允许果胶在较高的pH条件下形成凝胶,可以显著降低凝胶类食品的酸度,这对凝胶食品有重要意义[5]。
2.3 提取方式对柠檬果胶半乳糖醛酸含量的影响
半乳糖醛酸的回归方程为:y=0.004 5x-0.003 8,相关系数R2=0.999 1,半乳糖醛酸呈良好的线性关系,式中: y为所测溶液的吸光度值;x为溶液中果胶的浓度(μg/mL)。
由图3可知,不同提取方法总半乳糖醛酸含量≥65%,符合GB 25533—2010的要求,EE果胶半乳糖醛酸含量最低为80.51%,与其他果胶半乳糖醛酸含量相比差异性显著(P<0.05),而商品果胶和其他4种果胶不存在显著性差异。张晓阳等[10]使用微波法、水浴法、食用菌发酵法和超高压法提取胡萝卜渣中的果胶,发现4种方法提取所得果胶的半乳糖醛酸含量均无显著差异,与本试验结果类似。万国福等[19]采用酸提法提取柠檬皮渣中果胶,并测得其半乳糖醛酸含量为66.92%,低于本试验所得含量。
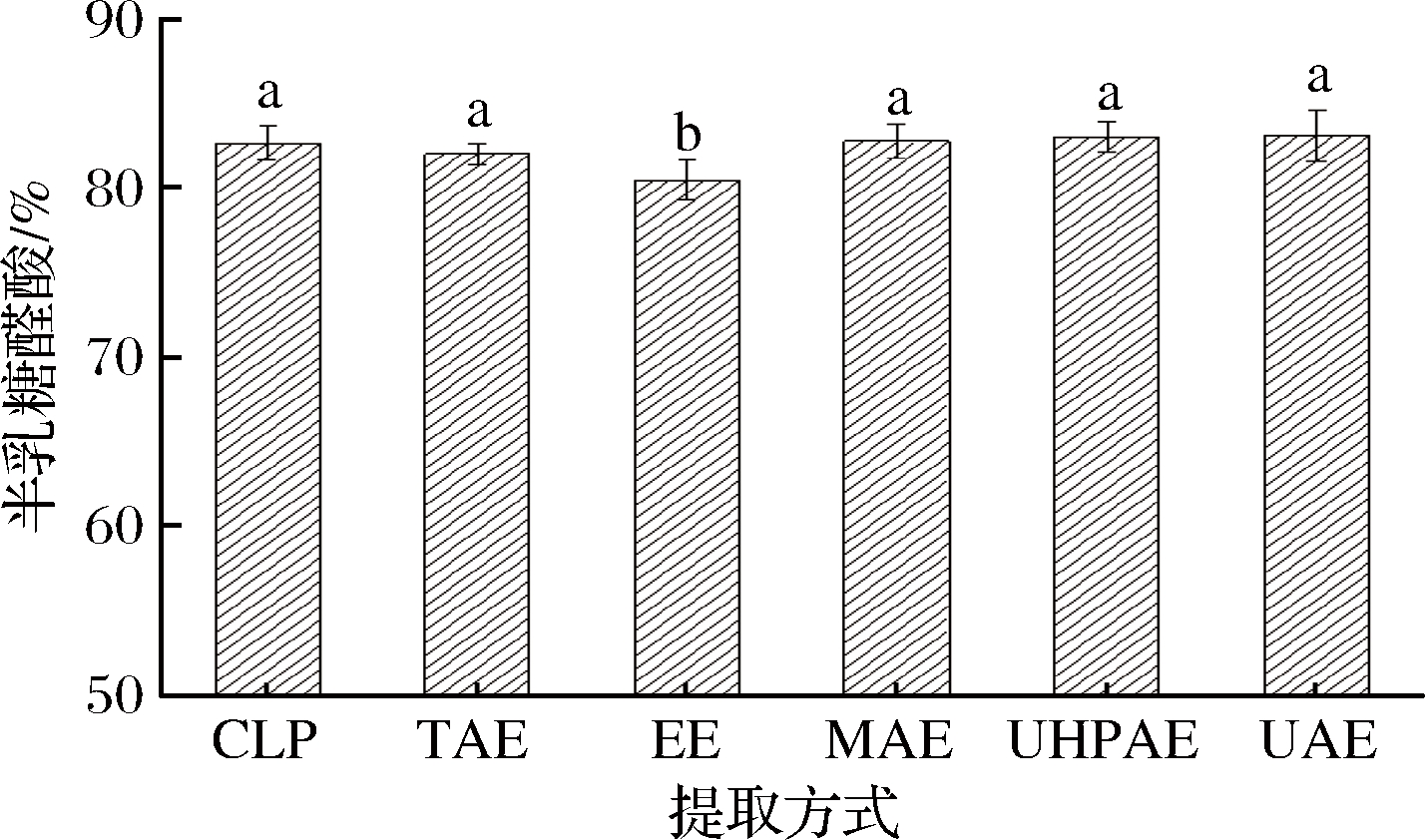
图3 提取方式对柠檬果胶半乳糖醛酸的影响
Fig.3 Effects of extraction methods on galacturonic acid of lemon pectin
2.4 提取方式对柠檬果胶分子质量的影响
果胶分子质量是影响果胶特性的一个重要因素,分子质量的差异不仅影响果胶的物理特性,还对果胶在体内的吸收分布以及与其他分子间的相互作用模式产生影响[10]。如图4所示,不同提取方法所得的果胶分子质量差异显著(P<0.05)。CLP、TAE、EE、MAE、UHPAE和UAE果胶均分子质量分别是1.38×105、1.46×105、2.04×105、2.85×105、3.67×105、2.47×105 Da,5种方法提取的果胶分子质量均大于CLP。UHPAE果胶分子质量最大,MAE果胶其次,EE果胶和UAE果胶分子质量次于MAE,TAE果胶和CLP分子质量最小,可能是因为TAE过程中时间长、温度高,果胶分子发生部分降解,使得到果胶分子质量降低,这与YAPO等[20]研究的不同提取条件对甜菜果胶性质研究结论基本一致。在实际加工生产中,可以根据果胶的特性用途选择提取方式,例如生产果冻或果酱的企业可选择经UHPAE或MAE提取的分子质量大的果胶作为增稠剂或胶凝剂,形成具有一定弹性和口感的产品。
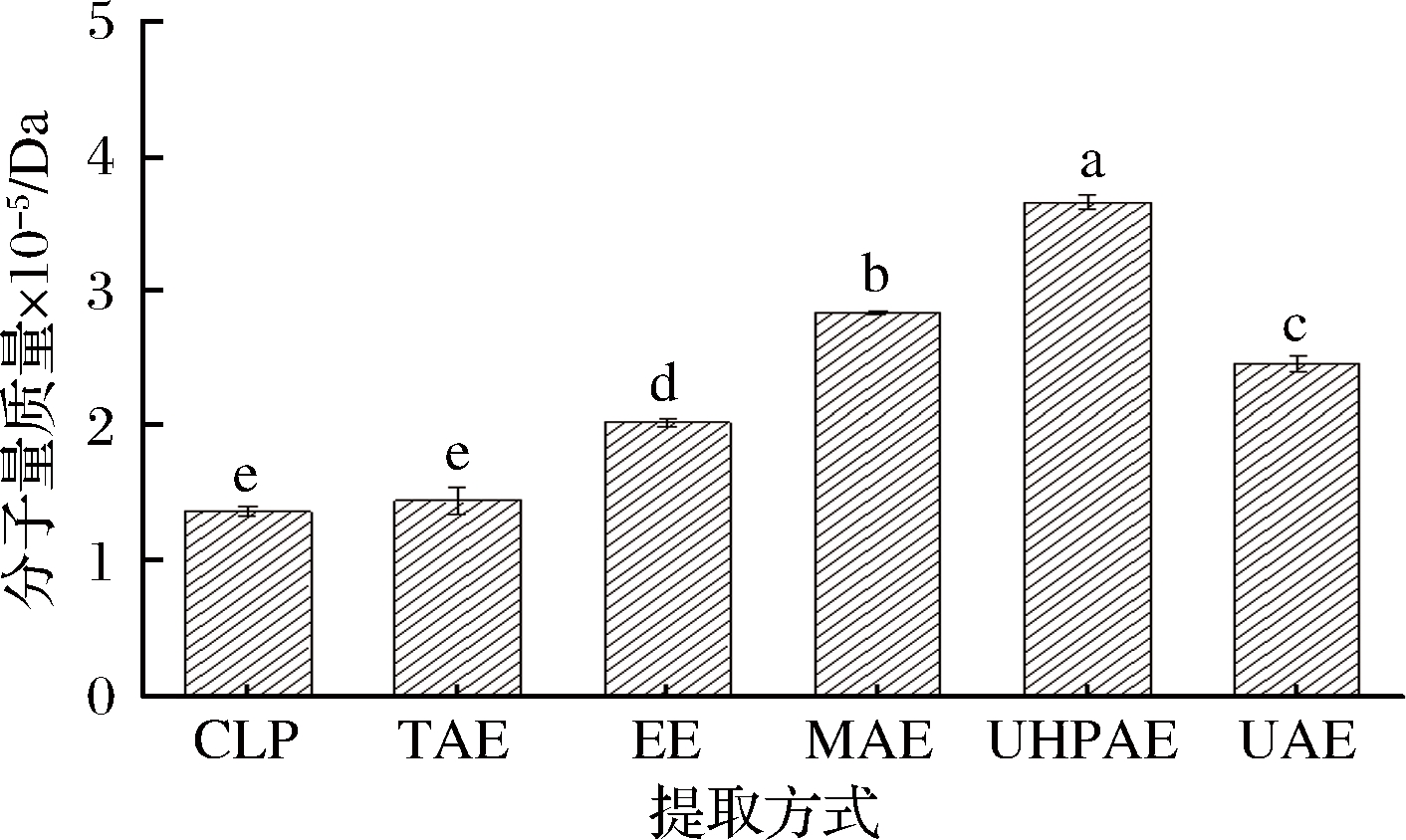
图4 提取方式对柠檬果胶分子量的影响
Fig.4 Effects of extraction methods on molecular weight of lemon pectin
2.5 柠檬果胶红外光谱分析
为了验证不同提取方式是否对柠檬果胶的结构产生影响,利用FTIR对商品柠檬果胶及经几种不同提取方式提取的柠檬果胶结构进行分析,结果如图5所示。3 600~3 200 cm-1较宽波数范围是糖类分子内或分子间O—H的伸缩振动引起的,这与果胶分子中半乳糖醛酸主链间或链内部的氢键有关,也可能是由于果胶中所含水分引起[12];3 000~2 800 cm-1是果胶甲基、亚甲基以及次甲基中C—H键的拉伸、对称和反对称的吸收峰[21],包括—CH、—CH2和—CH3的伸缩振动,—CH2波数在2 900~2 800 cm-1附近;1 760~1 730 cm-1处强的峰为果胶羧羰基和酯羰基中C![]() O的伸缩振动;1 630~1 600 cm-1处的峰由果胶羧基中COO—的振动引起的;1 400cm-1是羧基中C—O的伸缩振动的对称吸收峰;1 000是D-吡喃型糖环的醚键C—O—C和O—H的吸收峰。
O的伸缩振动;1 630~1 600 cm-1处的峰由果胶羧基中COO—的振动引起的;1 400cm-1是羧基中C—O的伸缩振动的对称吸收峰;1 000是D-吡喃型糖环的醚键C—O—C和O—H的吸收峰。
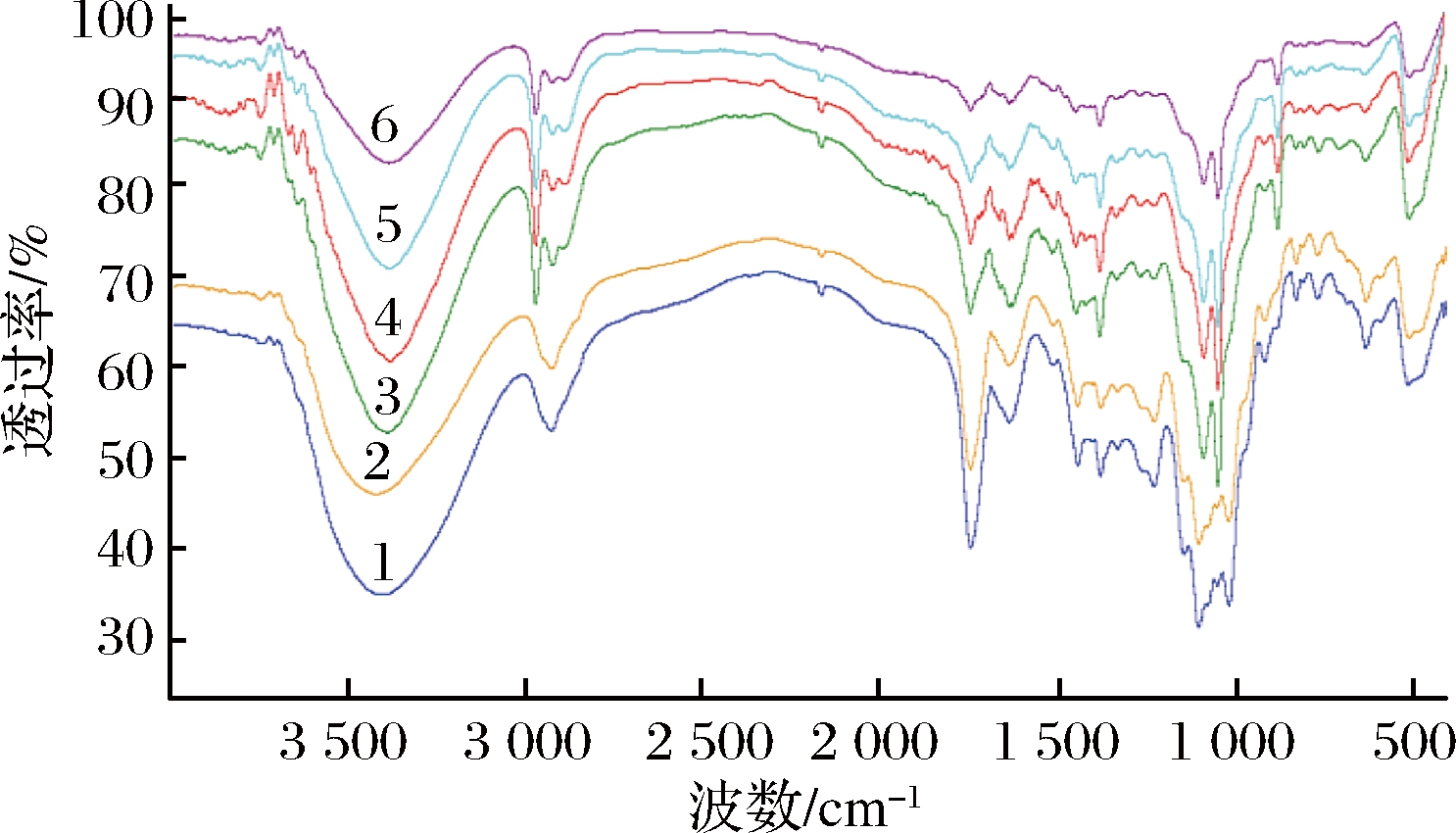
1-TAE;2-CLP;3-EE;4-MAE;5-UAE;6-UHPAE
图5 经不同提取方法提取的柠檬果胶的傅立叶红外光谱图
Fig.5 FTIR of lemon pectin extracted by different extraction methods
从图5傅里叶红外光谱图(fourier transform infrared spectrometry,FTIR)可知,几种方式提取得到的果胶和CLP在红外光谱图中特征官能团对应的波数基本相同,只是指纹区略有差异,说明不同提取方法不会对提取的果胶结构产生影响,这一结果与赵光远等[21]报道的一致。
2.6 提取方法对果胶流变性的影响
2.6.1 提取方法对果胶稳态剪切测试的影响
流变性是果胶的重要特性,流变学是在力的作用下研究物质的流动和变形。当果胶被作为增稠剂或稳定剂使用时,黏度是衡量果胶效果的一个重要指标。如图6所示,所有柠檬果胶溶液随着剪切速率的增加表观黏度降低,表现出剪切稀化行为,可能是由于高剪切速率使得果胶分子之间的空隙增大,分子链缠结数量减少,胶体的黏度降低[12]。平稳时,表观黏度由高到低分别为:MAE、UHPAE、UAE、EE、TAE、CLP,5种方法提取的果胶表观黏度值均大于CLP。不同提取方法中,MAE果胶的表观黏度最高,TAE果胶黏度最低,这可能是由于MAE果胶增加了组织细胞内部能量,分子间彼此缠结,分子量增大,分子的相对运动减弱,流体流动困难,从而表现出较大的表观黏度[13];而TAE果胶由于长时间高温提取使果胶分子链断裂,使得平均分子量最小,从而导致果胶表观黏度低。
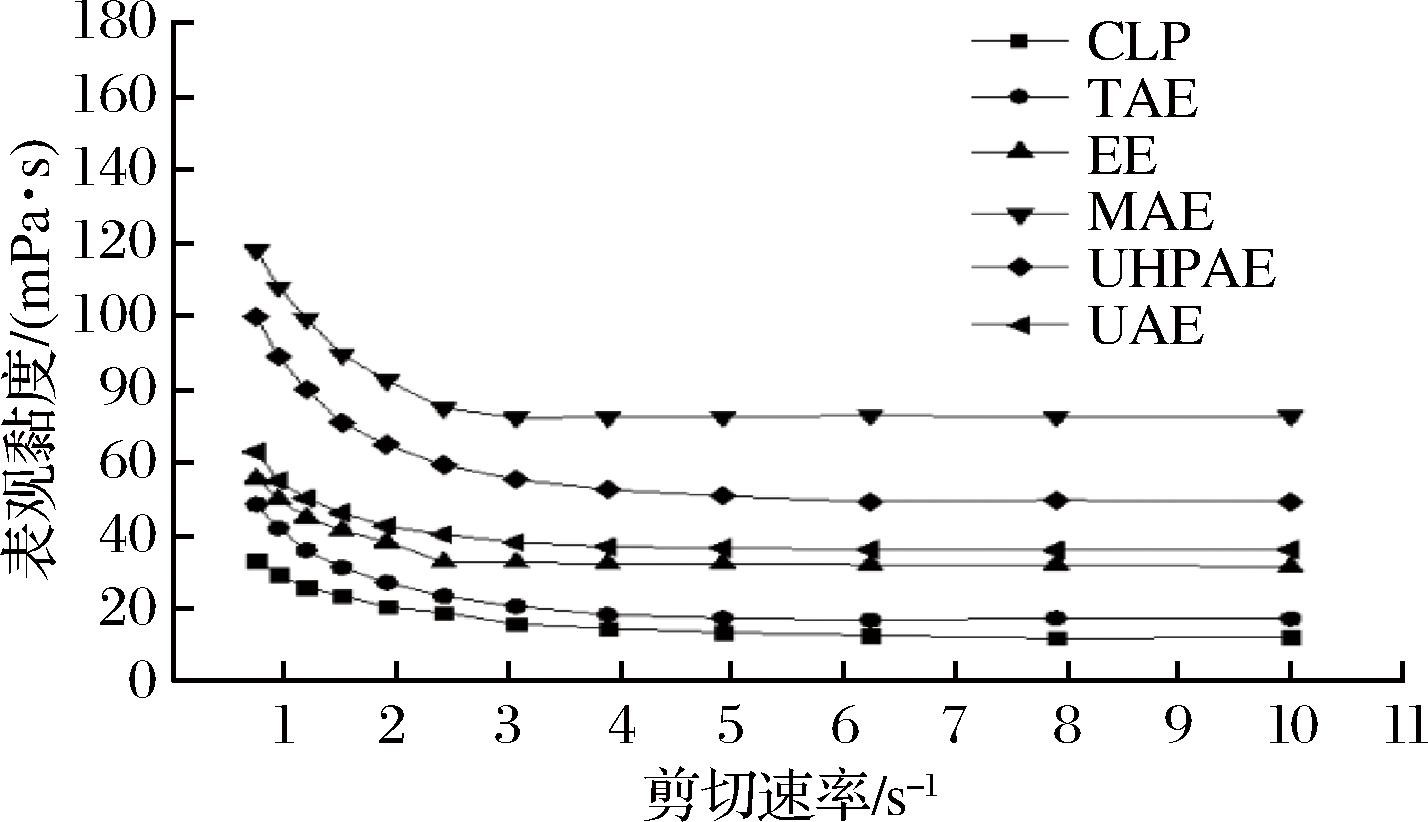
图6 提取方法对柠檬果胶表观黏度的影响
Fig.6 Effects of extraction methods on apparent viscosity of lemon pectin
根据Power law对流变数据点进行拟合,结果显示预测值和试验值相关系数为0.982~0.998,表明Power law模型(公式4)对曲线有较高的拟合精度。由表1可知,不同提取方法的流动特性指数n均小于1,柠檬果胶溶液为假塑性流体,不同提取方法中,MAE果胶的n值最小,流体表现出的假塑性最强,这与稳态表观黏度曲线的趋势相对应。
表1 不同提取方法柠檬果胶流变性模型拟合参数
Table 1 Fitting parameters rheological model of lemon pectin by different extraction methods
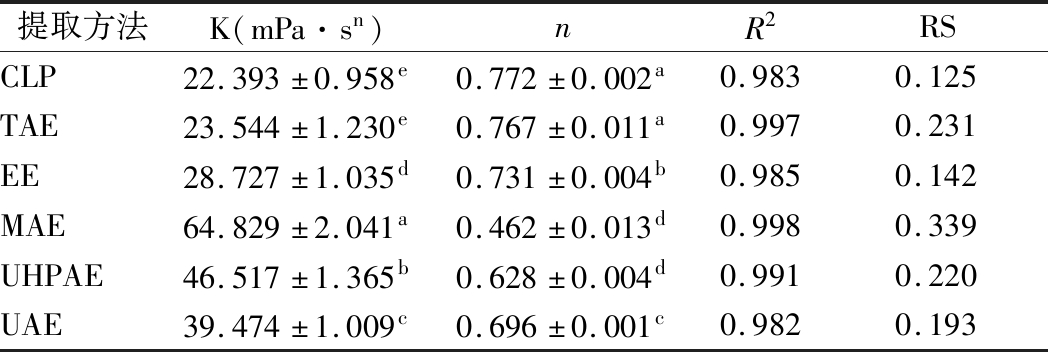
提取方法K(mPa·sn)nR2RSCLP22.393±0.958e0.772±0.002a0.9830.125TAE23.544±1.230e0.767±0.011a0.9970.231EE28.727±1.035d0.731±0.004b0.9850.142MAE64.829±2.041a0.462±0.013d0.9980.339UHPAE46.517±1.365b0.628±0.004d0.9910.220UAE39.474±1.009c0.696±0.001c0.9820.193
注:K为表观黏度,n为流体特征性指数,R2为方程拟合精度,RS为标准差,肩标小写字母表示相邻差异显著P<0.05;相间差异显著P<0.01。
2.6.2 提取方法对果胶动态黏弹性测试的影响
凝胶体系的动态黏弹性与其实际应用性能直接相关。果胶是一种大分子多糖,具有黏弹特性(同时表现出固体和液体性质)[14]。贮能模量G′代表能量贮存而可恢复的弹性性质,损耗模量G″代表体系的黏性性质,G′和G″的交点定义了果胶形成凝胶或果胶弹性行为的开始,是果胶具有较好黏弹特性的证明[22]。不同方法提取果胶溶液G′和G″由图7所示,TAE和CLP的G′和G″无交集且G″>G′,说明此时果胶的分子链缠绕较少属于溶胶体系,弹性特性较弱,果胶主要表现为黏性;EE、MAE、UAE以及UHPAE的G′和G″均出现交集,说明这几种提取方法能增强果胶的凝胶性,可能是由于这几种方法提取果胶过程中暴露了许多连接区,果胶链的相互作用更大,形成的交链系统更强,表现出一种典型的凝胶动态流变学特性[14]。
损耗正切值tanε为G″与G′比值,提供了弹性和黏性对系统的比较参数[22]。由图8可知不同提取方法的tanε值都呈现出上升趋势,当G′ <G″时,tanε>1,果胶液主要表现为黏性;当G′ >G″时,tanε<1,果胶液主要表现为弹性,表明流动性减弱,凝胶强度增加[14]。CLP和TAE的tanε恒大于1,表现出黏性,而其他几种提取体系随角频率增加tanε先小于1后大于1,表现出弱凝胶性,由于液滴被捕获在弱凝胶结构中,减缓了液滴的布朗运动,增强了液滴抵抗浮力及重力的能力,使得液滴稳定地悬浮在体系中,具有贮藏稳定性[23]。凝胶性强可改善食品体系的加工性能,在实际应用中可根据所需果胶性能选择合适的提取方式。
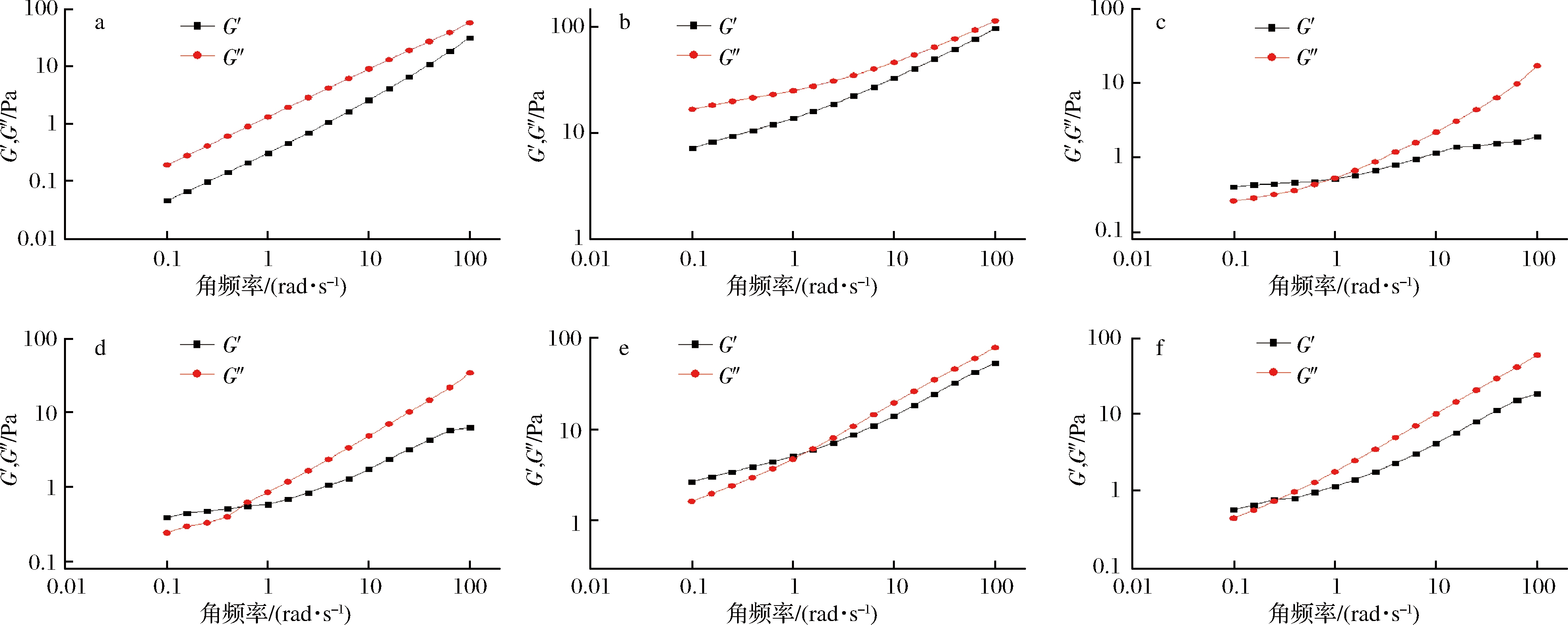
a-CLP;b-TAE;c-EE;d-MAE;e-UAE;f-UHPAE
图7 不同方法提取柠檬果胶的频率扫描结果
Fig.7 Frequency scanning results of different extraction methods of lemon pectin
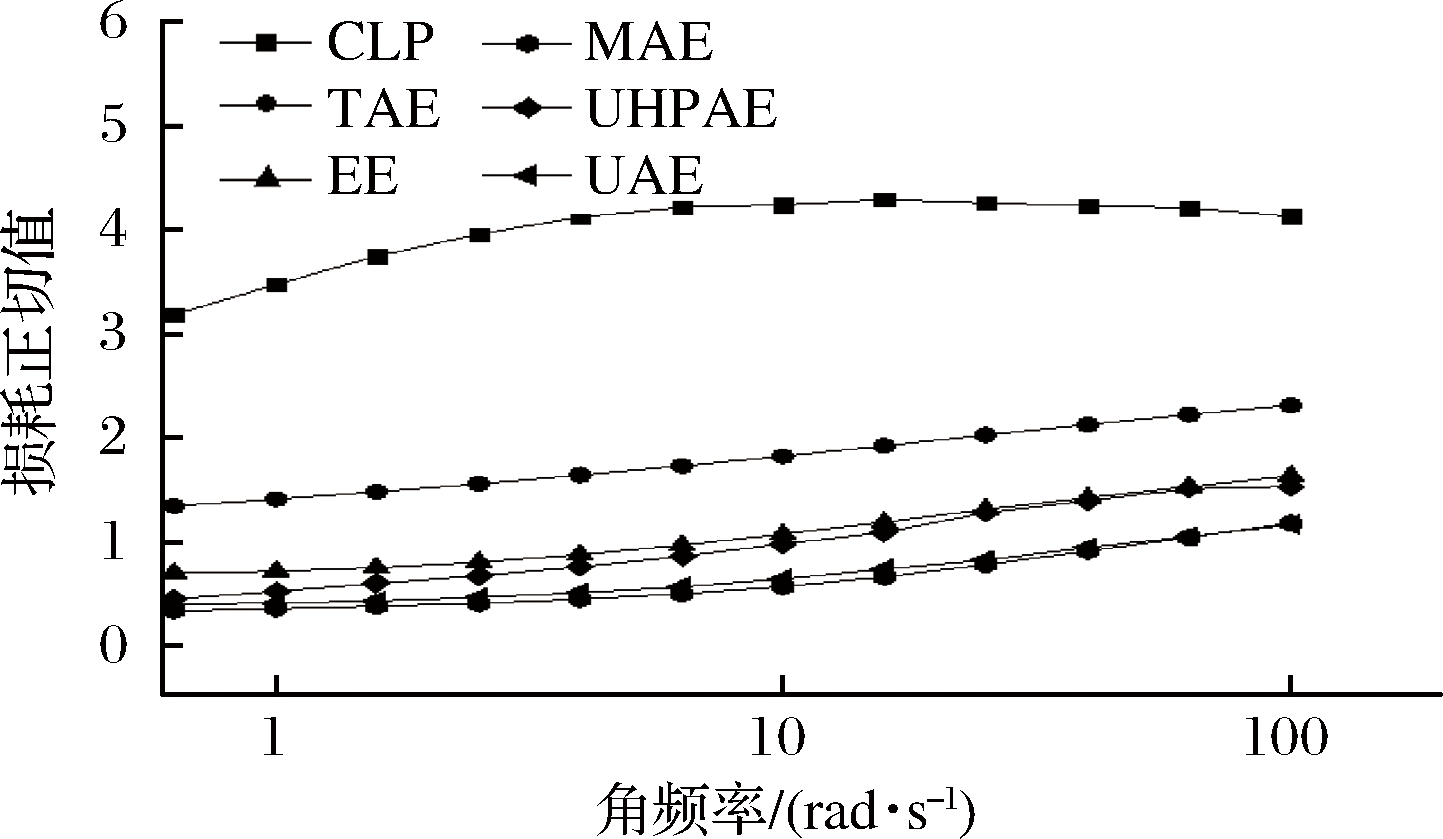
图8 提取方法对柠檬果胶损耗正切值的影响
Fig.8 Effects of extraction methods on tangent value of lemon pectin
2.7 提取方法对果胶乳化性的影响
2.7.1 提取方法对果胶乳液粒径的影响
乳化粒径大小是评价乳化液优劣的一个重要指标,正常情况下,它与乳液的稳定性呈现出良好的相关性。乳液粒径越小,分布越均匀,乳液的稳定性越好[24]。如图9所示,不同方法提取的果胶对乳化液粒径有显著差异(P<0.05)。粒径排序为:CLP>TAE>EE>UAE>UHPAE≥MAE,可能是由于MAE和UHPAE中果胶中性糖侧链多,使得果胶分子在油滴表面形成水合层厚度较高,从而产生空间位阻效应,导致果胶粒径小。在工业生产中,可以通过改变提取方式来降低乳液粒径,提高乳液的稳定性。此外,乳化液储放1~7 d后,乳化液粒径均增大,这可能是由于制备的乳液随着保存时间的延长,乳液液滴彼此之间发生聚集作用和重力沉降[16],形成大颗粒的液滴,乳液粒径增大。总体而言,CLP、TAE、EE、MAE、UHPAE、UAE储放7 d后,D4,3变化分别为1.649、1.561、1.245、0.539、0.778、0.900 μm,CLP粒径变化大于5种方法提取果胶的变化,其稳定性最差,MAE粒径变化最小,其稳定性最好。
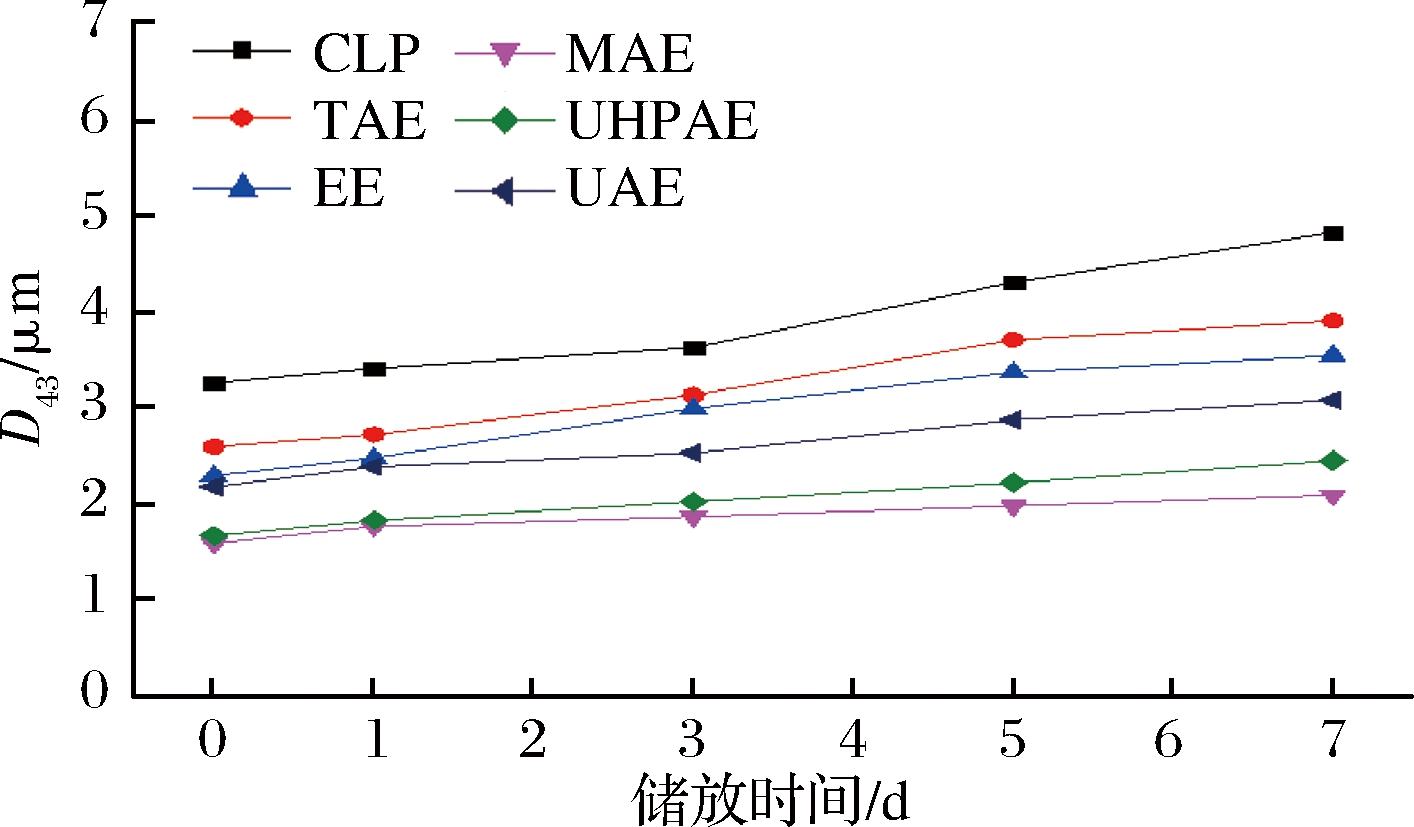
图9 不同提取方法下果胶乳液粒径
Fig.9 Effects of different extraction methods on particle size of pectin emulsion
2.7.2 提取方法对果胶乳化液Zeta电位影响
Zeta电位是指乳液中分散液滴表面与连续相内部的电位差,通常用于表征乳液体系的稳定性[17]。柠檬果胶是一种阴离子酸性多糖带负电,所测定的乳液的电位为负值,pH值变化导致果胶带电荷数量的不同,进而影响了乳化颗粒带电荷数量[18]。如表2所示,随着pH增加,各样品果胶溶液的Zeta电位变化趋势大体相同,即Zeta电位绝对值先增加后保持恒定,pH 3时各样品Zeta电位最小。总体来看,CLP乳液电位绝对值最小;MAE、UHPAE、UAE乳液电位绝对值大。这可能是因为MAE、UHPAE、UAE提高了果胶电离程度,使得乳化液液滴表面能够吸附溶液中带负电荷分子,电位值的绝对值增大,相互之间产生的作用力强,乳液稳定高[25]。不同提取方式对柠檬果胶乳液的Zeta电位有显著影响,这与对果胶乳液粒径影响结果一致。
表2 不同提取方法柠檬果胶在不同pH值下Zeta电位的影响
Table 2 Effects of zeta potential of lemon pectin by different extraction methods at different pH values

提取方法电位/mVpH=3pH=4pH=5pH=6pH=7CLP-15.60±0.96bD-27.93±0.45bC-32.33±0.90bB-35.57±1.16cA-35.10±0.44cATAE-15.93±0.23bD-28.03±1.40bC-33.86±0.91bB-36.87±0.64bcA-36.24±1.08bcAEE-16.63±0.29bD-29.87±0.45abC-33.65±0.61bB-37.63±1.78bA-37.40±1.01bAMAE-18.70±0.56aD-32.30±0.35aC-37.67±0.08aB-41.57±1.12aA-42.03±1.88aAUHPAE-18.30±0.52aD-32.72±0.52aC-38.42±1.38aB-40.40±0.80aA-41.17±1.20aAUAE-17.93±0.55aD-30.77±1.25aC-37.30±1.21aB-41.07±1.06aA-40.99±0.4aA
注:肩标小写字母表示各同列差异显著P<0.05,大写字母表示同行差异显著P<0.05。
2.7.3 不同提取方法对果胶稳定性的影响
果胶是一种天然的具有乳化能力的物质,与阿拉伯胶等乳化剂相比,果胶分子中带有的乙酰基能够增强疏水作用力,有效降低界面张力,低浓度的果胶就能形成较为稳定的乳液[17]。如图10所示,不同提取方法提取的果胶乳化液的EA差异显著(P<0.05),CLP的EA最小,UHPAE和MAE的EA最大,这可能是因为MAE和UHPAE提取对果胶中性糖侧链破坏小,表现出的活性大,得到的果胶稳定性高[15]。从ES分析可知,所有样品溶液ES均大于100 min,具有良好的稳定性,但CLP溶液稳定性显著低于5种提取方式得到的果胶(P<0.05)。这与上述果胶乳液粒径影响结果一致,在实际应用中可以通过改变果胶的提取方式来提高乳化稳定性,从而获得乳化性能较好的果胶。
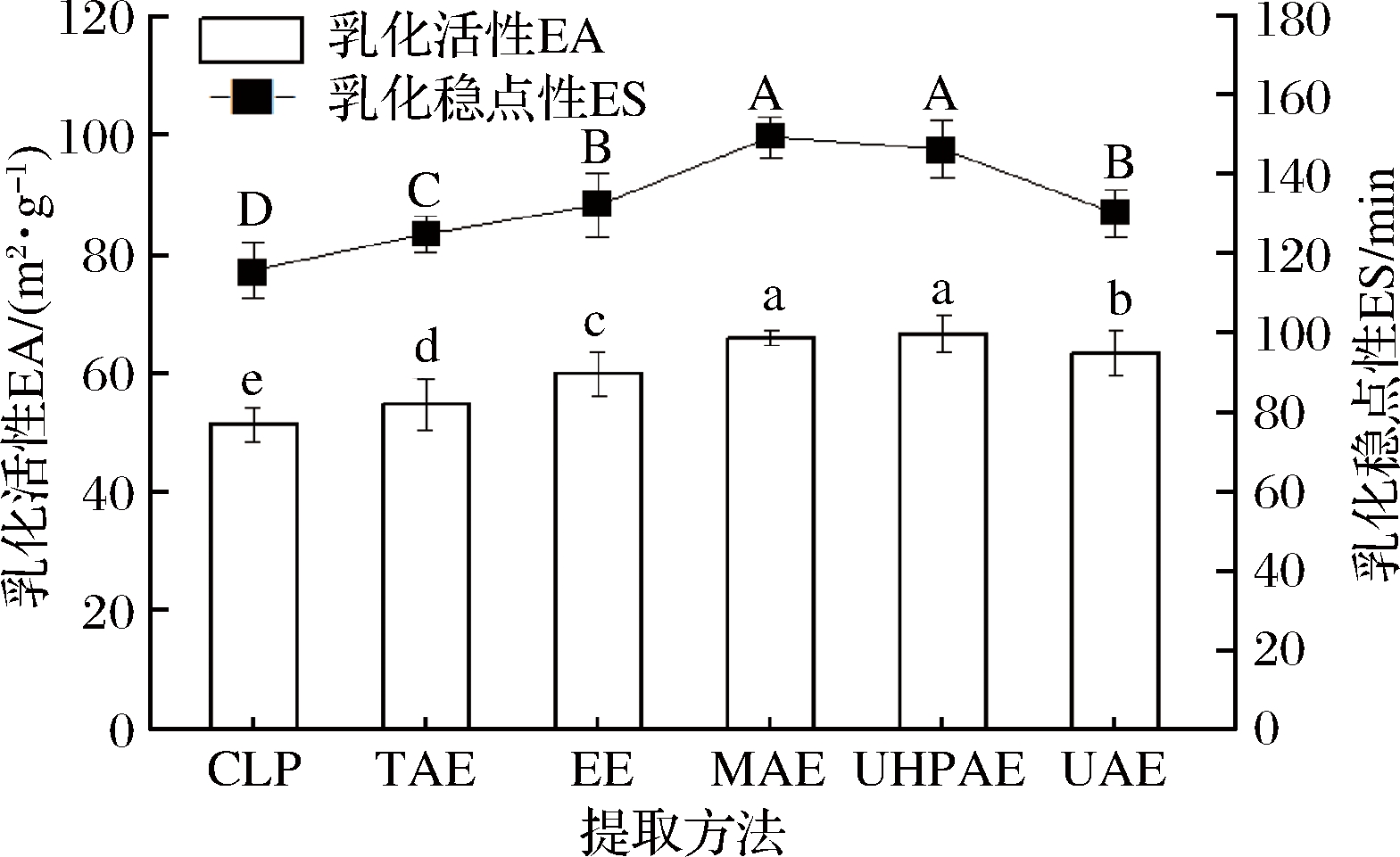
图10 不同提取方式柠檬果胶的乳化活性及稳定性
Fig.10 EA and ES of lemon pectin extracted by different methods
注:不同大写字母表示乳化活性具有显著性差异(P<0.05),不同小写字母表示乳化稳定性具有显著性差异(P<0.05)。
3 结论
不同提取方式对柠檬果胶特性有显著影响(P<0.05)。MAE果胶得率(25.02%)最高,UHPAE果胶分子质量最高(3.67×105Da);所有果胶半乳糖醛酸含量均高于80%,超过国标65%的要求;酯化度均大于50%,柠檬果胶属于高甲氧基果胶;FTIR显示,不同方法提取的果胶均具有果胶的特征官能团,说明不同提取方法不会对果胶结构产生影响;不同方法所得的果胶中,MAE、UHPAE、UAE及EE随角频率增加tanε先小于1后大于1,表现出弱凝胶性,具有贮藏稳定性;果胶的表观黏度、粒径、Zeta电位及乳化稳定性等的大小具有相同的顺序:MAE>UHPAE>UAE>EE>TAE>CLP,即5种提取方法得到的果胶流变及乳化特性均高于商品果胶,且其它4种提取方法所得果胶又好于酸法,说明在传统酸提取基础进行上改进,采用一定的现代技术辅助酸法提取柠檬果胶有助于提高其的理化性、流变性和乳化特性,这为研究不同方法提取柠檬果胶在食品工业中的进一步应用提供了一定基础。
[1] 谢明勇,李精,聂少平. 果胶研究与应用进展[J]. 中国食品学报,2013,13(8):1-14.
[2] ADETUNJI L R, ADEKUNLE A, ORSAT V, et al. Advances in the pectin production process using novel extraction techniques: A review[J]. Food Hydrocolloids, 2017, 62:239-250.
[3] EMAGA T H, RABETAFIKA N, BLECKER C S, et al. Kinetics of the hydrolysis of polysaccharide galacturonic acid and neutral sugars chains from flaxseed mucilage[J]. Biotechnologie Agronomie Société Et Environnement, 2012, 16(2):139-147.
[4] 苏艳玲, 巫东堂. 果胶研究进展[J]. 山西农业科学, 2009, 37(6):82-86.
[5] 高健,马路山,胡建军,等. 果胶提取技术研究进展[J]. 食品工业科技,2014,35(6):368-372.
[6] YAPO B M. Pineapple and banana pectins comprise fewer homogalacturonan building blocks with a smaller degree of polymerization as compared with yellow passion fruit and lemon pectins Implication for gelling properties[J]. Biomacromolecules, 2009, 10(4):717-721.
[7] 刘江,张诗琪,雷激,等.柠檬皮渣干燥工艺探讨[J].食品与发酵工业,2019,45(7):242-249.
[8] LUO C Z, ZHANG H, ZHENG H, et al. Optimization of glucosinolates extracted from Maca(Lepidium meyenii) by combined ultrasonic and microwave extraction with response surface methodology[J]. Advanced Materials Research, 2012, 550-553:1 893-1 899.
[9] 李加兴,石春诚,马浪,等. 黄秋葵果胶理化特性的研究[J].食品科学,2015,36(17):104-108.
[10] 张晓阳,袁驰,周春丽,等.不同提取方法对胡萝卜皮渣果胶理化性质影响[J].食品工业,2015,36(5):56-60.
[11] 孙元琳,崔武卫,顾小红,等.傅里叶变换红外光谱法测定当归果胶多糖的酯化度[J].光谱学与光谱分析,2009,29(3):682-685.
[12] 顾晓俊, 金邦荃,陈晓楠,等. 猕猴桃果胶黏度特性与流变性分析[J]. 食品科学, 2017,38(3):125-130.
[13] 黄鑫. 不同制备条件对甜菜果胶理化特性的影响及其应用研究[D]. 2018:25-29.
[14] 陈倩茜,张萌,王海燕,等.高场强超声处理对柑橘果胶分子结构及其功能特性的影响[J].食品与发酵工业,2019,45(2):87-94.
[15] 梅新, 木泰华,郭庆. 甘薯果胶的乳化特性研究[J]. 中国农业科学, 2010, 43(13):2 759-2 766.
[16] YEOH S, SHI J, LANGRISH T A G, Comparisons between different techniques for water-based extraction of pectin from orange peels[J]. Desalination,2008, 218(6) 229-237.
[17] 彭小燕, 木泰华,孙红男,等. 超高压处理对甜菜果胶结构及乳化特性的影响[J]. 中国农业科学, 2015, 48(7):1 405-1 414.
[18] SHARIF H R, WILLIAMS P A, SHARIF M K, et al. Current progress in the utilization of native and modified legume proteins as emulsifiers and encapsulants-A review[J]. Food Hydrocolloids, 2018,76:2-16.
[19] 万国福. 柠檬果胶原料预处理方法的研究[D]. 成都:西华大学, 2006.
[20] YAPO B M, ROBERT C, ETIENNE I, et al. Effect of extraction conditions on the yield, purity and surface properties of sugar beet pulp pectin extracts[J]. Food Chemistry, 2007,100(4): 1 356-1 364.
[21] 赵光远,刁华娟,荆利强. 不同分子量和不同酯化度苹果果胶的研究[J]. 食品与机械,2011,27(6):47-50.
[22] OOSTERVELD A, BELDMAN G, SCHOLS H A, et al. Characterization of arabinose and ferulic acid rich pectic polysaccharides and hemicelluloses from sugar beet pulp[J]. Carbohydrate Research, 2000, 328(2):185-197.
[23] 卢锦丽, 傅玉颖,武肖,等. 添加黄原胶的纯胶乳液稳定性及流变特性研究[J]. 中国粮油学报, 2014, 29(6):93-98;103.
[24] 陈浩,张凯华,刘世永,等.甜菜果胶乳化活性及稳定性[J].食品科学,2018,39(1):65-72.
[25] JOSHI M, ALDRED P, PANOZZO J F, et al. Rheological and microstructural characteristics of lentil starch-lentil protein composite pastes and gels[J]. Food Hydrocolloids, 2014, 35(1):226-237.