海藻糖(Trehalose, α-D-glucopyranosyl-α- D-glucopyranoside)是由两个葡萄糖残基组成的非还原性二糖,天然存在于低等植物、细菌、真菌、昆虫及无脊椎动物中[1-3]。在冷冻、干燥、加热等逆性环境下,海藻糖被认为能够与生物大分子形成氢键或在其周围形成玻璃质,从而起到保护作用,是新型食品加工与保鲜的重要保护剂[4-5]。海藻糖在保存脂类、蛋白质等生物大分子以及干细胞、组织和器官等方面的应用,也受到研究者的关注[6]。
海藻糖的定量分析是对其进行研究和应用的技术基础。目前常用的海藻糖定量分析方法包括比色法、高效液相色谱(HPLC)法和酶法。比色法是基于蒽酮与碳水化合物的颜色反应进行定量,不具有特异性[7-8]。HPLC法是目前定量分析海藻糖的主要方法,但其对样品处理要求较高,且受特定设备条件限制[9-14]。酶法检测利用海藻糖酶特异性水解海藻糖生成两分子葡萄糖,通过对反应过程参数[12]或对其酶解产物葡萄糖的检测[13, 15-18]而间接定量海藻糖,是亟待发展的海藻糖快速简便检测方法。
ANTONLLI等[14 ]使用海藻糖酶、己糖激酶和葡萄糖-6-磷酸脱氢酶,通过检测NADPH生成量间接定量海藻糖,检测限可达6.3 μmol/L;NEVES等[16]使用海藻糖酶、葡萄糖氧化酶和过氧化氢酶,依据染料吸光度变化测定生成的O2,以此定量海藻糖检测限可达50 μmol/L。此类方法特异性高,操作相对简便,但较高的用酶成本限制其推广应用。
鉴于葡萄糖快速定量检测技术已经十分成熟,以固定化酶微电极为基础的葡萄糖生物传感分析仪已在我国发酵、食品研究及生产领域得到广泛应用。为此,本文在前期获得优秀海藻糖酶酶分子的基础上,利用海藻糖酶对海藻糖的专一水解,结合葡萄糖生物传感分析仪对海藻糖水解产物的快速定量检测,建立起一种海藻糖快速检测方法,并就其检测特征与可能的应用价值进行了分析。
1 材料与方法
1.1 材料与试剂
海藻糖标准品购于Sigma公司;海藻糖酶(120 u/mL,一个酶活力单位定义为在pH 4.0和55 ℃条件下,每分钟水解1 μmol海藻糖所需的酶量)为本实验室前期制备与保存,另文发表;所用的其他化学品均为分析纯。
大肠杆菌(Escherichia coli) B0013-1031H、JC31和JC41,为本课题组前期构建。B0013-1031H 菌株的乙酸、乳酸、甲酸和琥珀酸的合成途径被阻断[19],在此基础上,删除海藻糖分解途径获得突变株JC31,进一步强化海藻糖合成途径获得突变株JC41[20]。
1.2 实验方法
1.2.1 酶-生物传感分析仪法检测海藻糖含量
酶解反应体系(0.4 mL)包含适度稀释的待测样品(0.2 mL)、12 u海藻糖酶酶液(0.1 mL)和pH 4.0的磷酸氢二钠-柠檬酸缓冲液(0.1 mL);反应在55 ℃及pH 4.0条件下进行10 min。反应完成后快速冷却,取样用生物传感分析仪(SBA-40C型,山东省科学院生物研究所)测定葡萄糖含量。由葡萄糖换算海藻糖含量如公式(1)所示:
CT=0.95×(C2-C1)
(1)
式中:CT,酶解反应体系中海藻糖含量,mg/mL;C1,酶解前葡萄糖含量,mg/mL;C2,酶解后葡萄糖含量,mg/mL;0.95,海藻糖与葡萄糖含量换算系数。
1.2.2 检测方法的专一性
向1.0 mg/mL的海藻糖标准品中分别添加不同浓度的葡萄糖、果糖、麦芽糖、乳糖和蔗糖,用1.2.1中方法检测海藻糖含量。
1.2.3 检测范围的确定
取不同浓度的海藻糖标准品,用1.2.1中方法检测海藻糖,以样品海藻糖含量为横坐标(X)、所测葡萄糖含量为纵坐标(Y)绘制拟合曲线。
1.2.4 回收率的计算
取不同浓度的海藻糖标准品,用1.2.1中方法检测海藻糖,用以下公式计算回收率:
(2)
式中:R,回收率,%;Cc,计算得出的海藻糖浓度,mg/mL;CK,已知的海藻糖浓度,mg/mL。
1.2.5 检测方法的稳定性
取不同浓度海藻糖标准品,每个浓度做6个平行测定,计算6次检测结果的相对标准偏差(RSD)。
1.2.6 HPLC法检测海藻糖
参照GB/T 23529—2009推荐的方法[21],选择Luna 5u NH2 100A色谱柱(250 mm×4.6 mm,5 μm),流动相为乙腈∶水=70∶30(体积比),流速1 mL/min,柱温30 ℃,示差折光检测器,进样量10 μL。
1.2.7 大肠杆菌胞内海藻糖含量测定
各菌株划线接种于LB平板,37 ℃过夜培养。挑单菌落接种于50 mL LB液体培养基,37 ℃、200 r/min培养12 h后,8 000 r/min离心5 min收集菌体,接种50 mL M9液体培养基(含5 g/L葡萄糖),至OD600为0.1。再于37 ℃、200 r/min培养12 h后,不添加压力因素,或分别添加葡萄糖和乙醇至终浓度为80 g/L和10 g/L,继续培养4 h。同上离心收集菌体并洗涤,以去离子水重悬细胞,于-70 ℃冷冻过夜。取冻存细胞煮沸20 min,冷却后12 000 r/min离心15 min,上清液即为细胞溶解产物。以本研究建立的方法检测胞内海藻糖含量。
2 结果
2.1 海藻糖检测专一性
在1.0 mg/mL的海藻糖溶液中分别添加不同浓度的葡萄糖、果糖、麦芽糖、蔗糖和乳糖,测定海藻糖的含量,结果汇总于表1。在其他外源糖存在的情况下,检测海藻糖的回收率为99.12%~102.28%,5种外源添加糖分子对海藻糖的检测结果均无影响。可见,本法的专一性能够满足海藻糖的特异性检测要求。
表1 外源糖存在条件下海藻糖的回收率
Table 1 Recovery rate of trehalose in the presence of other saccharides

外源糖不同浓度外源糖存在下海藻糖的回收率/%0.1mg/mL1mg/mL10mg/mL葡萄糖99.12±0.5599.75±1.64101.33±5.48果糖99.43±1.1099.12±1.4599.75±0.95麦芽糖100.38±0.55100.70±0.00102.28±1.98蔗糖99.75±0.00100.07±0.5599.75±0.95乳糖99.75±0.00100.07±0.55100.07±0.55
2.2 海藻糖检测范围
生物传感分析仪可检测葡萄糖的最低浓度为0.01 mg/mL,对应样品中海藻糖的检测限为0.019 mg/mL。用本方法检测系列浓度的海藻糖标准品并计算相对标准偏差,结果表明,海藻糖浓度在0.1 mg/mL以上时,检测RSD小于10 %,根据MILLER[22]建议原则,此方法检测海藻糖的定量限为0.1 mg/mL。
以样品海藻糖含量为横坐标,以检测所得葡萄糖含量为纵坐标,绘制拟合曲线如图1所示。在海藻糖浓度为0.1~150.0 mg/mL范围内,样品海藻糖含量与检测所得葡萄糖含量具有良好的线性关系。在此范围内,检测回收率在98.80%~101.33%。
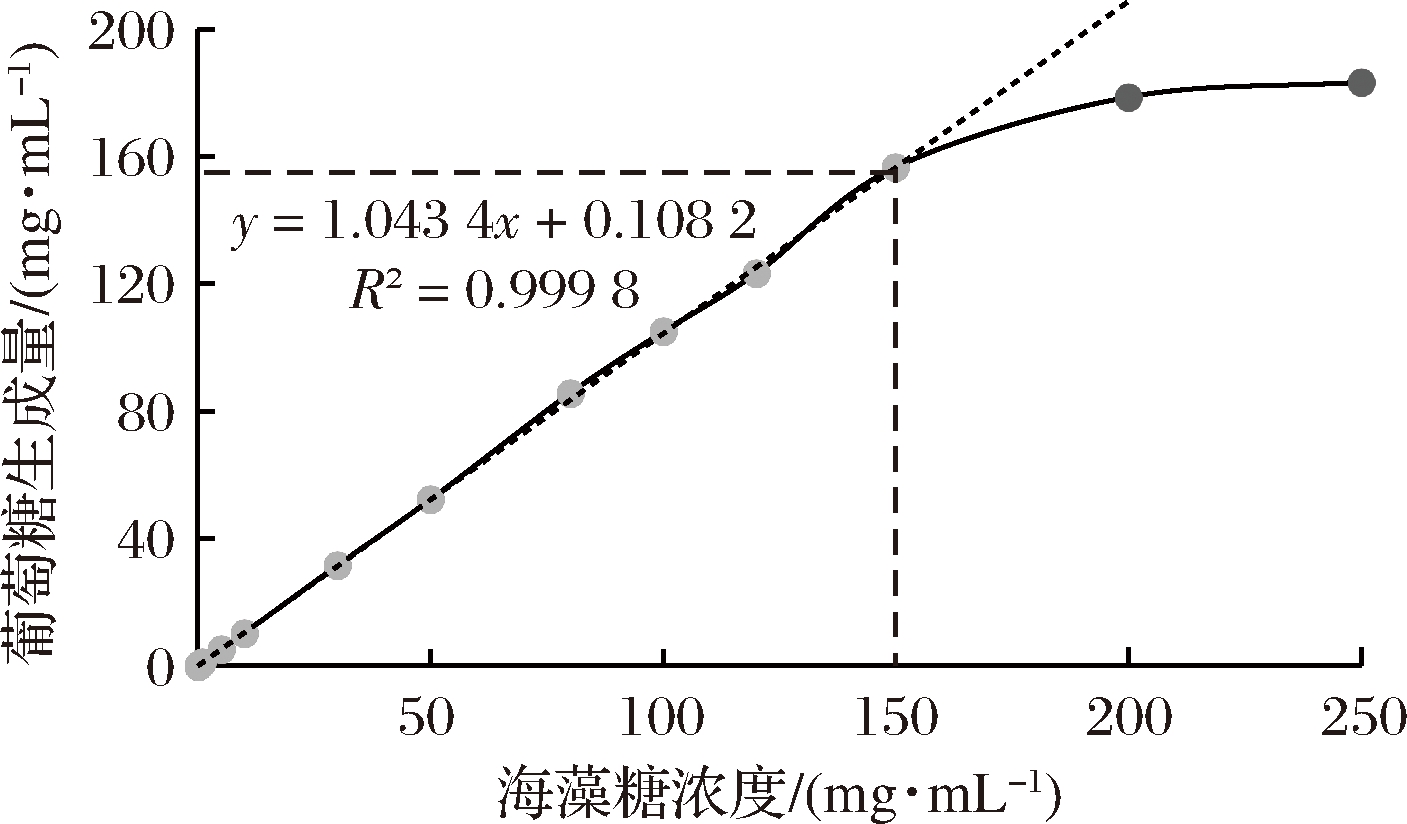
图1 海藻糖含量与葡萄糖释放量之间的线性关系
Fig.1 Linearity between trehalose content and detected glucose content
本检测方法使用12 u海藻糖酶,在最适条件下反应10 min,理论可水解最高浓度约为200 mg/mL的海藻糖样品。结果显示样品海藻糖浓度在150 mg/mL范围内,能够被完全水解为葡萄糖,通过生物传感分析仪实现定量检测;样品海藻糖浓度高于150 mg/mL时,在此检测条件下海藻糖不能被完全转化为葡萄糖,无法实现海藻糖定量检测。实际应用中,可根据样品海藻糖浓度或检测操作要求,调整海藻糖酶用量或反应时间,以降低检测成本,提高检测效率。
2.3 稳定性试验
取低浓度(1.0 mg/mL)、中间浓度(10.0 mg/mL)及高浓度(100.0 mg/mL)3种海藻糖标准品,做平行检测,结果汇总于表2。各浓度标准品6次平行检测确定的相对标准偏差均小于3%。
表2 本研究方法检测海藻糖的稳定性
Table 2 Stability analysis of currently established method for trehalose determination
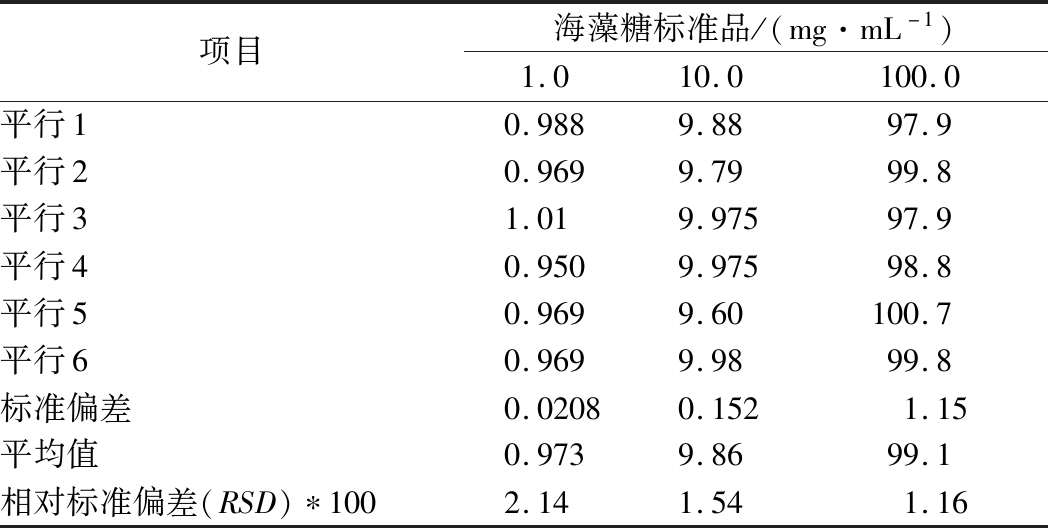
项目海藻糖标准品/(mg·mL-1)1.010.0100.0平行10.9889.8897.9平行20.9699.7999.8平行31.019.97597.9平行40.9509.97598.8平行50.9699.60100.7平行60.9699.9899.8标准偏差0.02080.1521.15平均值0.9739.8699.1相对标准偏差(RSD)∗1002.141.541.16
2.4 本法与HPLC法的比较
采用本研究建立的方法,同时采用HPLC法对已知浓度的海藻糖标准品(5.0 mg/mL)进行检测,测定结果汇总于表3。
表3 两种方法检测海藻糖的差异性分析 单位:mg/mL
Table 3 Analysis of differences between two trehalose determination methods
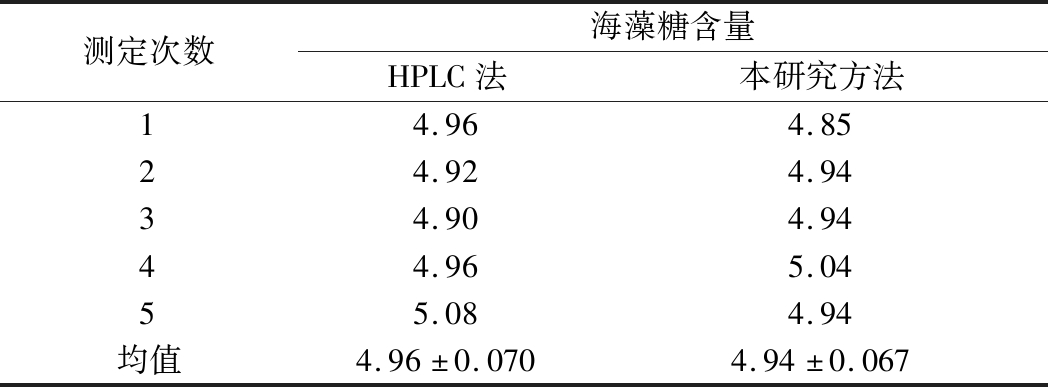
测定次数海藻糖含量HPLC法本研究方法14.964.8524.924.9434.904.9444.965.0455.084.94均值4.96±0.0704.94±0.067
经t检验分析,在95%的置信区间下,二者无显著差异(P>0.05)。HPLC法测定往往需要对样本进行前处理,在多糖混合情况下还需对流动相组成进行合理优化才能将结构相似的糖类分开。本研究方法样品前处理相对简单,在保证准确性的同时极大地提高了检测的时效性。
2.5 大肠杆菌胞内海藻糖含量分析
利用本研究建立的方法,对海藻糖代谢途径遗传修饰后大肠杆菌胞内海藻糖含量进行了分析,结果汇总于表4。运用本研究方法,可检测到胞内海藻糖含量为2.35~83.39 mg/g (细胞干重)。海藻糖分解途径删除的突变株JC31以及在海藻糖分解途径删除的基础上进一步强化海藻糖合成途径的突变株JC41,在无渗透压压力或80 g/L葡萄糖下,突变株JC31和JC41的胞内海藻糖合成与积累水平显著提高;在体积分数1%乙醇条件下,突变株JC31和JC41的胞内海藻糖合成与积累水平也显著提高,但提升幅度不如80 g/L葡萄糖下显著[20]。
表4 E. coli B0013-1031H及其突变株在不同培养条件下的胞内海藻糖含量 单位:mg/g
Table 4 Intracellular trehalose content of E. coli B0013-1031H and its mutants under different stress conditions

菌株海藻糖含量无压力80g/L葡萄糖1%乙醇B0013-1031H2.35±0.845.61±1.152.52±1.39JC318.28±2.0283.39±1.4411.88±2.47JC4128.03±3.1664.24±1.5711.62±3.28
3 讨论
本文利用特异性海藻糖酶水解海藻糖生成葡萄糖,结合生物传感分析仪测定葡萄糖含量,成功建立起一种海藻糖的快速定量检测方法。此方法对海藻糖的检测限为0.019 mg/mL,定量限为0.1 mg/mL。在0.1~150.0 mg/mL范围内,海藻糖含量与所测葡萄糖含量具有良好线性关系,回收率范围为98.80%~101.33%。本方法操作简便快捷,对样品预处理无特殊要求,具有高特异性、较好的回收率和重复性,检测结果与HPLC法无显著差异,可以替代HPLC法用于海藻糖含量的快捷定量分析。
现有文献显示,海藻糖是环境胁迫下生物体自我保护的重要相容性溶质[23-24],也是若干新鲜食物材料的基本组成和可能的重要营养物质[2, 25]。通过本研究获得的海藻糖快捷定量分析方法,可以辅助若干工业菌种的选育过程,也可以在相关食品原材料的海藻糖含量分析与检测中发挥重要作用。
[1] TERAMOTO N, SACHINVALA N D, SHIBATA M. Trehalose and trehalose-based polymers for environmentally benign, biocompatible and bioactive materials[J]. Molecules, 2008, 13(8):1 773-1 816.
[2] RICHARDS A B, KRAKOWKA S, DEXTER L B, et al. Trehalose: a review of properties, history of use and human tolerance, and results of multiple safety studies[J]. Food & Chemical Toxicology, 2002, 40(7):871-898.
[3] ELBEIN A D. The metabolism of α, α-trehalose[J]. Advances in Carbohydrate Chemistry and Biochemistry, 1974, 30:227-256.
[4] OTTING G, LIEPINSH E, WUTHRICH K. Protein hydration in aqueous solution[J]. Science, 1991, 254(5 034):974-980.
[5] FRANKS F, HATLEY R H M, MATHIAS S F. Material science and the production of shelf-stable biologicals[J]. Biopharmaceuticals, 1991, 4:38-42.
[6] OHTAKE S, WANG Y J. Trehalose: current use and future applications[J]. Journal of Pharmaceutical Sciences, 2011, 100(6):2 020-2 053.
[7] YEMM E W, WILLIS A J. The estimation of carbohydrates in plant extracts by anthrone[J]. Biochemical Journal, 1954, 57(3):508-514.
[8] FERREIRA J C, PASCHOALIN V M F, PANEK A D, et al. Comparison of three different methods for trehalose determination in yeast extracts[J]. Food Chemistry, 1997, 60(2):251-254.
[9] EL-BASHITI T, HAMAMC H, ÖKTEM H A, et al. Biochemical analysis of trehalose and its metabolizing enzymes in wheat under abiotic stress conditions[J]. Plant Science, 2005, 169(1):47-54.
[10] ACKER J P, LU X M, YOUNG V, et al. Measurement of trehalose loading of mammalian cells porated with a metal-actuated switchable pore[J]. Biotechnology and Bioengineering, 2003, 82(5):525-532.
[11] MURRAY D B, HAYASHIDA Y, NISHIMURA K. Trehalose analysis using ion exchange HPLC coupled with electrochemical detection[J]. Biotechnology Techniques, 1997, 11(4):269-270.
[12] WANNET W J B, HERMANS J H M, VAN DER DRIFT C, et al. HPLC detection of soluble carbohydrates involved in mannitol and trehalose metabolism in the edible mushroom Agaricus bisporus[J]. Journal of Agricultural and Food Chemistry, 2000, 48(2):287-291.
[13] KRETSCHMER P M, BANNISTER A M, O'BRIEN M K, et al. A liquid chromatography-tandem mass spectrometry assay for the detection and quantification of trehalose in biological samples[J]. Journal of Chromatography B, 2016, 1033:9-16.
[14] ANTONELLI M L, LELO D, TORNELLI R F. A microcalorimetric enzymatic method for trehalose determination in food[J]. Journal of Thermal Analysis & Calorimetry, 2009, 97(3):835-838.
[15] MEYER ZU DÜTTINGDORF H D, BACHMANN B, BUCHHOLZ M, et al. Determination of trehalose by flow injection analysis using immobilized trehalase[J]. Analytical Biochemistry, 1997, 253(1):8-12.
[16] NEVES M J, TERENZI H F, LEONE F A, et al. Quantification of trehalose in biological samples with a conidial trehalase from the thermophilic fungus Humicola grisea var. thermidea[J]. World Journal of Microbiology & Biotechnology, 1994, 10(1):17-19.
[17] KIENLE I, BURGERT M U, HOLZER H. Assay of trehalose with acid trehalase purified from Saccharomyces cerevisiae[J]. Yeast, 1993, 9(6):607-611.
[18] 王兰, 肖冬光,张正. 酶-DNS比色法测定酵母海藻糖的研究[J]. 工业微生物, 2002(2):18-21.
[19] 孙金凤, 田康明,沈微,等.底物选择性大肠杆菌共发酵葡萄糖和木糖产生乙醇[J].食品与发酵工业,2018, 44(12):1-7.
[20] 王惊春, 田康明,苗佳,等. 增强海藻糖胞内积累提高大肠杆菌耐受性与乙醇产率[J/OL]. 食品与发酵工业:1-9[2019-09-05]. https://doi.org/10.13995/j.cnki.11-1802/ts.020729.
[21] GB/T 23529—2009, 海藻糖[S]. 北京:中国标准出版社, 2009.
[22] MILLER J N. Basic statistical methods for analytical chemistry. part 2. calibration and regression methods. a review[J]. Analyst, 1991, 116(1): 3-14.
[23] SHUKLA E, THORAT L J, NATH B B, et al. Insect trehalase: physiological significance and potential applications[J]. Glycobiology, 2015, 25(4):357-367.
[24] CAI X, SEITL I, MU W, et al. Biotechnical production of trehalose through the trehalose synthase pathway: current status and future prospects[J]. Applied Microbiology and Biotechnology, 2018,102(7):2 965-2 976.
[25] ROSER B. Trehalose, a new approach to premium dried foods[J]. Trends in Food Science & Technology, 1991, 2(7):166-169.