淡豆豉(semen sojae praepatum)由豆科植物大豆的成熟种子辅以青蒿、桑叶发酵而成,具有解表、除烦、宣发郁热的功效[1]。豆豉是我国传统的大豆发酵食品[2],具有多种药理活性[3-7]。经过发酵,大豆中的大分子蛋白质可降解为游离氨基酸,其既是营养物质,也是生成生物胺、类黑精等活性物质的成分[8,9],又是风味的基础[10]。二者多为自然发酵制得,不同环境生产的产品中游离氨基酸含量差异较大,能够影响产品质量[11-13]。2015年版《中国药典》淡豆豉标准明确规定了氨基酸的检查和鉴别项[1],因此,考察淡豆豉和豆豉纯种发酵过程游离氨基酸的含量变化,对优化发酵工艺和提升产品质量具有重要意义。
氨基酸多为无色晶体且不带有紫外或者荧光基团,不易检测,使用衍生试剂进行柱前或柱后衍生,可间接测出氨基酸的含量[14-16]。AccQ·Tag法是以6-氨基喹啉基-N-羟基-琥珀酰亚胺基甲酸酯(AQC)为柱前衍生试剂测定氨基酸的方法,此方法衍生化产物稳定、分离度好,被广泛应用于科研领域[17-19]。
目前,尚未见应用AQC柱前衍生检测淡豆豉、豆豉发酵过程中游离氨基酸的相关报道。本研究以伞枝梨头霉纯种发酵制备淡豆豉和豆豉,采用Accq·Tag柱前衍生-高效液相色谱法分析其动态发酵过程17种游离氨基酸的含量变化,为后续药效学研究提供依据。
1 材料与方法
1.1 试剂与材料
17种氨基酸水解标样混合液:天冬氨酸(Asp)、丝氨酸(Ser)、谷氨酸(Glu)、甘氨酸(Gly)、组氨酸(His)、精氨酸(Arg)、苏氨酸(Thr)、丙氨酸(Ala)、脯氨酸(Pro)、胱氨酸(Cys)、酪氨酸(Tyr)、缬氨酸(Val)、蛋氨酸(Met)、赖氨酸(Lys)、异亮氨酸(Ile)、亮氨酸(Leu)、苯丙氨酸(Phe)。含氨基酸摩尔浓度为2.5 mmol/L(半胱氨酸摩尔浓度为2.5 mmol/L相当于胱氨酸1.25 mmol/L);AccQ·Fluor衍生剂:硼酸盐缓冲液、衍生剂粉末和衍生剂稀释液、AccQ·Tag Eluent A(三水乙酸钠-磷酸钠洗脱液)、乙腈(色谱纯)。
青蒿和桑叶,河北祁新中药颗粒饮片有限公司;黑豆,北京本草方源药业集团有限公司。经黑龙江省中医药科学院鉴定,桑叶和青蒿分别为桑科植物桑Morus alba L.的干燥叶和菊科植物黄花蒿Artemisia annua L.的干燥地上部分,黑豆为豆科植物大豆Glycine max (L.)Merr.的干燥成熟种子。
菌株来源:DDC-SP11 分离自市售淡豆豉饮片,经鉴定为Absidia corymbifera(Cohn)Saccardo&Trotter (伞枝梨头霉)。
1.2 仪器与设备
Waters Alliance 2489高效液相色谱仪,美国Waters公司;BSA224S型赛多利斯电子天平,德国赛多利斯科学仪器有限公司。
1.3 实验方法
1.3.1 溶液的配制与柱前衍生
AccQ·Fluor衍生剂的配制:将衍生剂稀释液于55 ℃预热,吸取1 mL注入装有AccQ·Fluor衍生剂粉末的瓶中,混匀,于55 ℃加热直至溶解。
柱前衍生17种氨基酸混合标样:将17种氨基酸混合水解标样稀释至100 μmol/L,取20 μL加入60 μL硼酸盐缓冲液至内衬管中,混匀,再加入20 μL衍生剂,立即混匀,在室温下放置1 min,于55 ℃加热10 min,即得。
1.3.2 色谱条件
AccQ·Tag高效Nova-PakTM C18柱(3.9 mm×150 mm,4 μm);流动相A为V(Waters AccQ·Tag Eluent A)∶V(超纯水)=1∶10配制的水溶液,流动相B为乙腈,流动相C为超纯水;流速1 mL/min。荧光检测:Ex激发波长250 nm,Em发射波长395 nm;进样量2 μL;柱温37 ℃;洗脱程序参照顾伟钢等[15]方法略作修改,如表1。
表1 梯度洗脱程序
Table 1 Program of gradient elution
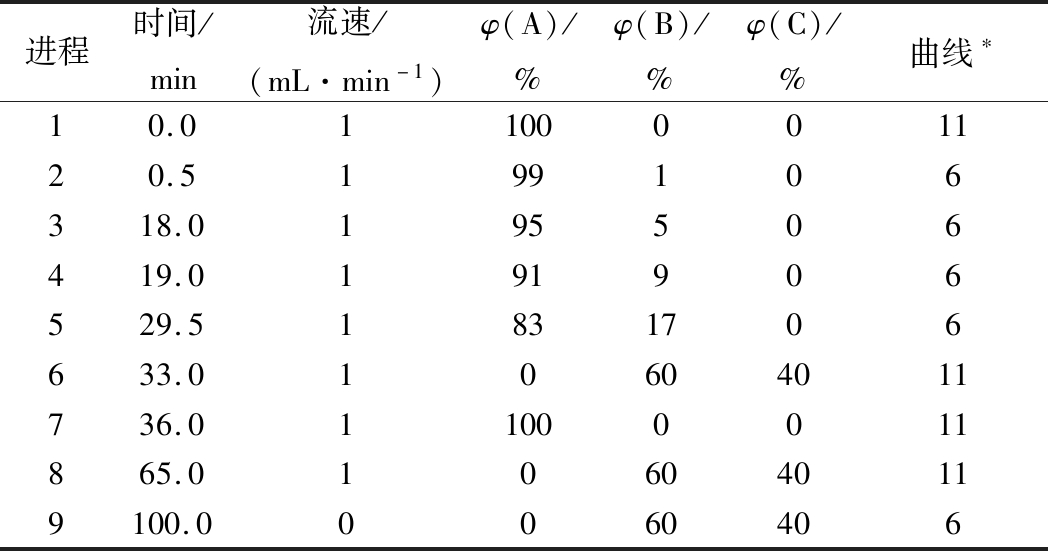
进程时间/min流速/(mL·min-1)φ(A)/%φ(B)/%φ(C)/%曲线∗10.01100001120.5199106318.0195506419.0191906529.51831706633.010604011736.011000011865.0106040119100.00060406
注:曲线6表示线性换向;曲线11表示瞬时换向。
1.3.3 淡豆豉和豆豉样品的制备
参照2015年版《中国药典》淡豆豉制备方法[1],按照质量比为1∶1∶10称取青蒿、桑叶和黑豆,青蒿、桑叶加入10倍体积的水煎煮2次,每次1 h,合并滤液,浓缩至与黑豆液固比为0.8 mL∶1 g。工艺流程:黑豆→清洗浸泡(淡豆豉用青蒿和桑叶水提液浸泡,豆豉用水浸泡)→分装→灭菌→接种(DDC-SP11菌液,106个孢子/mL,接种量为2%)→培养(28 ℃)→发酵样品→干燥(60 ℃)→测定水分(水分含量≤10%)→淡豆豉或豆豉。
分别于0、6、12、24、48、72、120、168 h收集各发酵阶段样品,60 ℃干燥,粉碎过三号筛,备用。
1.3.4 样品游离氨基酸的提取及测定
参考李萍萍等[20]的方法,略作改动。分别精密称取各样品200 mg,加入0.1 mol/mL的盐酸10 mL,混匀,超声40 min,8 000 r/min离心,取1 mL上清液用0.45 μm滤膜过滤,用1.3.1的方法做衍生处理,待测。
2 结果与分析
2.1 标准品混合液和样品的HPLC-FLD色谱图
图1为Accq·Tag法衍生的氨基酸混合标样的荧光色谱图,除半胱氨酸(峰11)外,其他16种氨基酸都有较高的响应值。图2、图3分别为不同发酵期淡豆豉、豆豉氨基酸衍生后的色谱图,随着发酵时间的延长,精氨酸(峰7)的峰面积逐渐减小,脯氨酸(峰10)的峰面积逐渐增大。

1-Asp;2-Ser;3-Glu;4-Gly;5-His;6-NH3;7-Arg;8-Thr;9-Ala;10-Pro;11-Cys;12-Tyr;13-Val;14-Met;15-Lys;16-Ile;17-Leu;18-Phe。下同。
图1 氨基酸混合标准品的HPLC-FLD色谱图
Fig.1 HPLC-FLD chromatogram of amino acid mixed standards
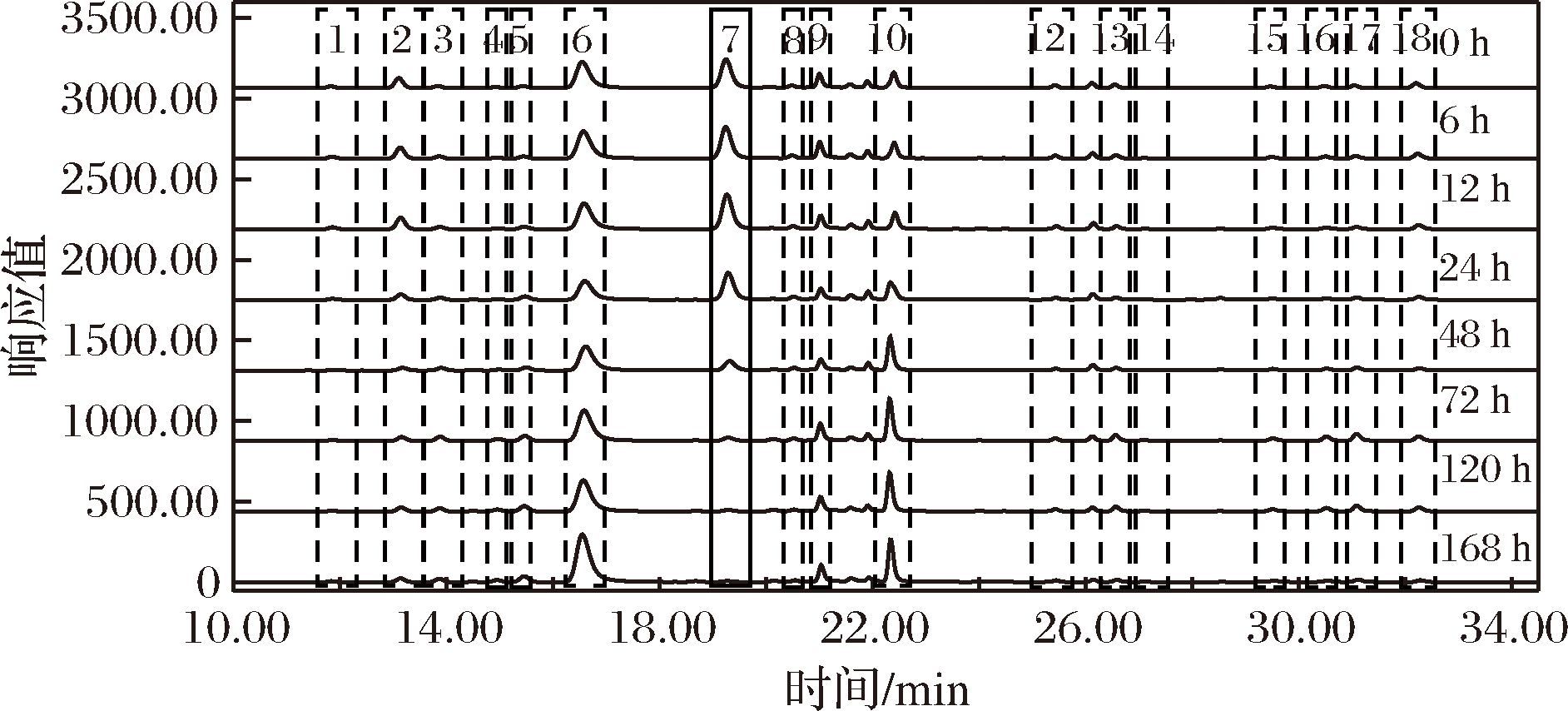
图2 不同发酵期淡豆豉的HPLC-FLD色谱图
Fig.2 HPLC-FLD chromatogram of semen sojae praepar-atum at different fermentation stages
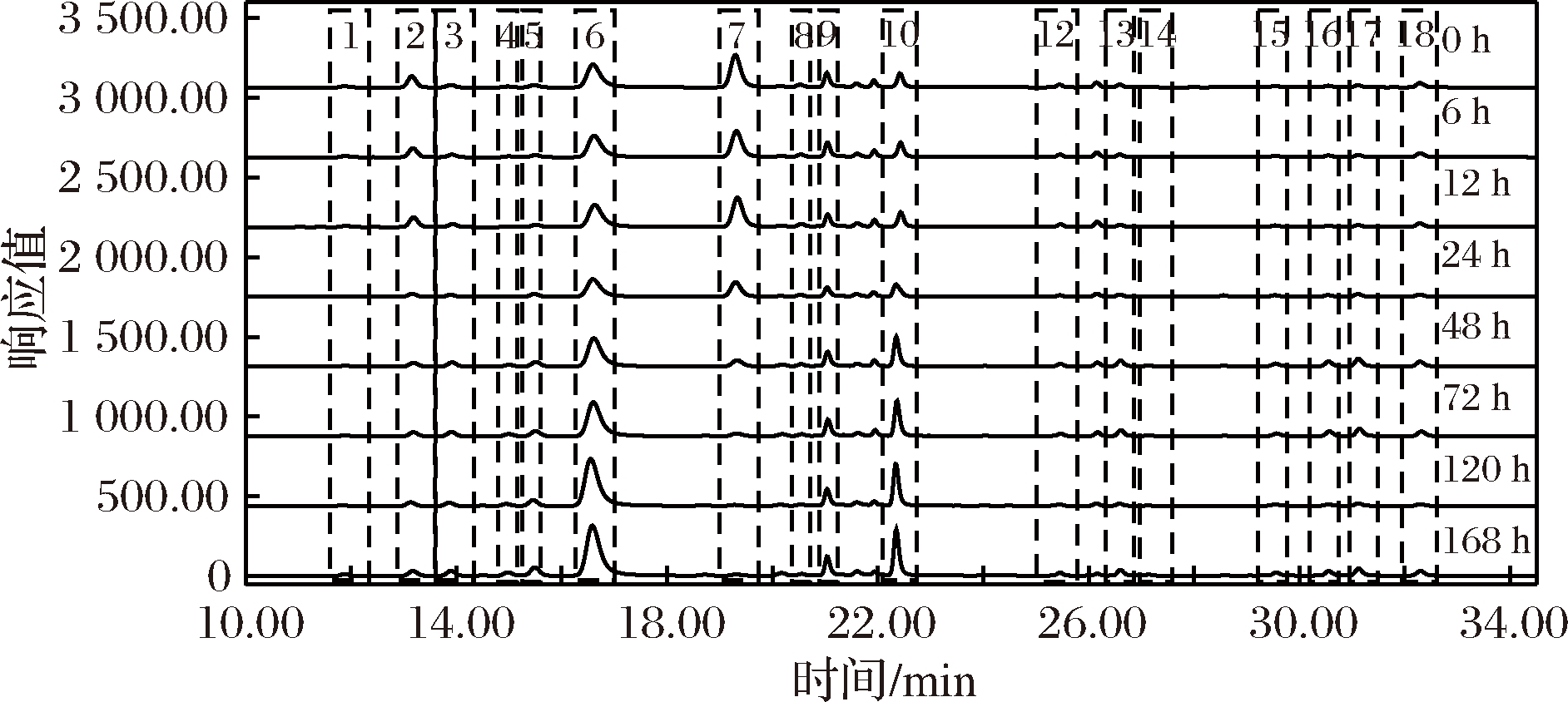
图3 不同发酵期豆豉的HPLC-FLD色谱图
Fig.3 HPLC-FLD chromatogram of fermented black beans at different fermentation stages
2.2 线性关系
将17种氨基酸的标准品混合液用衍生剂稀释液稀释成100、75、50、25、12.5、10、5 μmol/L的溶液,按照1.3.1的方法柱前衍生处理,依次进样。以氨基酸的峰面积为纵坐标(Y),浓度为横坐标(X)作线性回归方程,结果见表2。17种氨基酸在5~100 μmol/L的浓度范围时,各氨基酸的峰面积与浓度呈良好线性关系,R2在0.994 1~0.998 0。
表2 17种氨基酸的线性回归方程
Table 2 Linear regression equation of 17 kinds of amino acids

氨基酸种类回归方程R2AspY=32893X-851980.9950SerY=46335X-539670.9962GluY=36848X-943980.9942GlyY=42818X-76300.9961HisY=671116X-1152840.9975ArgY=60575X-1082930.9966ThrY=59974X-1135850.9967AlaY=70855X+9900680.9952ProY=37700X-474370.9941CysY=9028.3X+141600.9960TyrY=71039X+105190.9976ValY=110277X-1921160.9965MetY=98971X-1621460.9973LysY=78097X+3351070.9962IleY=152323X-2329790.9969LeuY=156869X-3455960.9964PheY=195944X+1749730.9980
2.3 精密度、稳定性和加标回收率
衍生后的17种氨基酸标准品混合液,以1.3.2项下条件连续进样6次,RSD均为1.01%~2.63%,精密度良好;制备衍生后的样品溶液,在室温下放置0、3、7、12、18、24 h后分别进样测定,RSD为1.29%~2.48%,样品中17种氨基酸的衍生物在24 h内稳定。
精密称取30 mg的黑豆样品6份,按照1.3.4方法,分别吸取10 μL样品溶液,加入10 μL氨基酸标准品溶液,衍生化后测定,计算加标回收率,结果见表3,加标回收率为91.29%~109.02%,RSD为0.2%~1.3%。
2.4 淡豆豉和豆豉动态发酵过程游离氨基酸的含量变化
结果如表4、表5所示,以水浸泡黑豆(0 h,未接菌)精氨酸含量为4.32 mg/g,脯氨酸为1.18 mg/g,丝氨酸为0.93 mg/g,其它氨基酸含量在0~0.4 mg/g(其中胱氨酸在所有样品中均未出现色谱峰),黑豆采用青蒿、桑叶水提液浸泡,各氨基酸含量变化不大。淡豆豉在发酵168 h时精氨酸含量由3.885 mg/g降低至0.209 mg/g,而脯氨酸含量则增长3.7倍,组氨酸、谷氨酸和甘氨酸含量均提高了2~5倍,丝氨酸含量则由0.836 mg/g降低至0.337 mg/g,其余的氨基酸未发生明显变化。豆豉和淡豆豉发酵过程中17种游离氨基酸含量变化趋势一致,且豆豉各发酵期的17种游离氨基酸含量略高于淡豆豉,可能是由于淡豆豉所用辅料青蒿、桑叶具有抑菌作用[21-22],使该菌对蛋白质的降解能力减弱,从而游离氨基酸的含量相对较低。
表3 黑豆中17种氨基酸的加标回收率(n=3)
Table 3 Scaling recovery of 17 amino acids in black beans (n=3)

氨基酸种类加入量/(μmol·L-1)测得量/(μmol·L-1)回收率/%RSD/%Asp100105.05105.051.2Ser10092.5192.511.0Glu100107.64107.641.2Gly10091.2991.290.9His10091.8391.830.8Arg10096.9496.941.1Thr100106.24106.241.1Ala10091.3491.341.3Pro10096.7396.731.2Cys5054.51109.021.1Tyr10092.4992.490.7Val10097.0297.021.1Met10095.7895.781.0Lys10091.4691.460.2Ile10092.0592.050.8Leu10094.7794.770.9Phe10098.4198.410.5
发酵72 h之前氨基酸变化明显,然后趋于平稳,可能与发酵菌的生长代谢规律相关。微生物生长一般分为适应期、对数生长期、平稳期和衰老期,对数生长期微生物蛋白酶、水解酶等活性较高,蛋白质迅速水解促使一些游离氨基酸含量不断上升,到达平稳期后,微生物蛋白酶活力减弱,游离氨基酸的生成速率降低;一些氨基酸在发酵过程中经脱羧酶催化脱羧生成生物胺或发生美拉德反应生成类黑精,也会使发酵产物游离氨基酸含量降低[8-9]。
表4 淡豆豉动态发酵过程17种游离氨基酸的含量 单位:mg/g
Table 4 The content of 17 kinds of free amino acids of semen sojae praeparatum during the dynamic fermentation
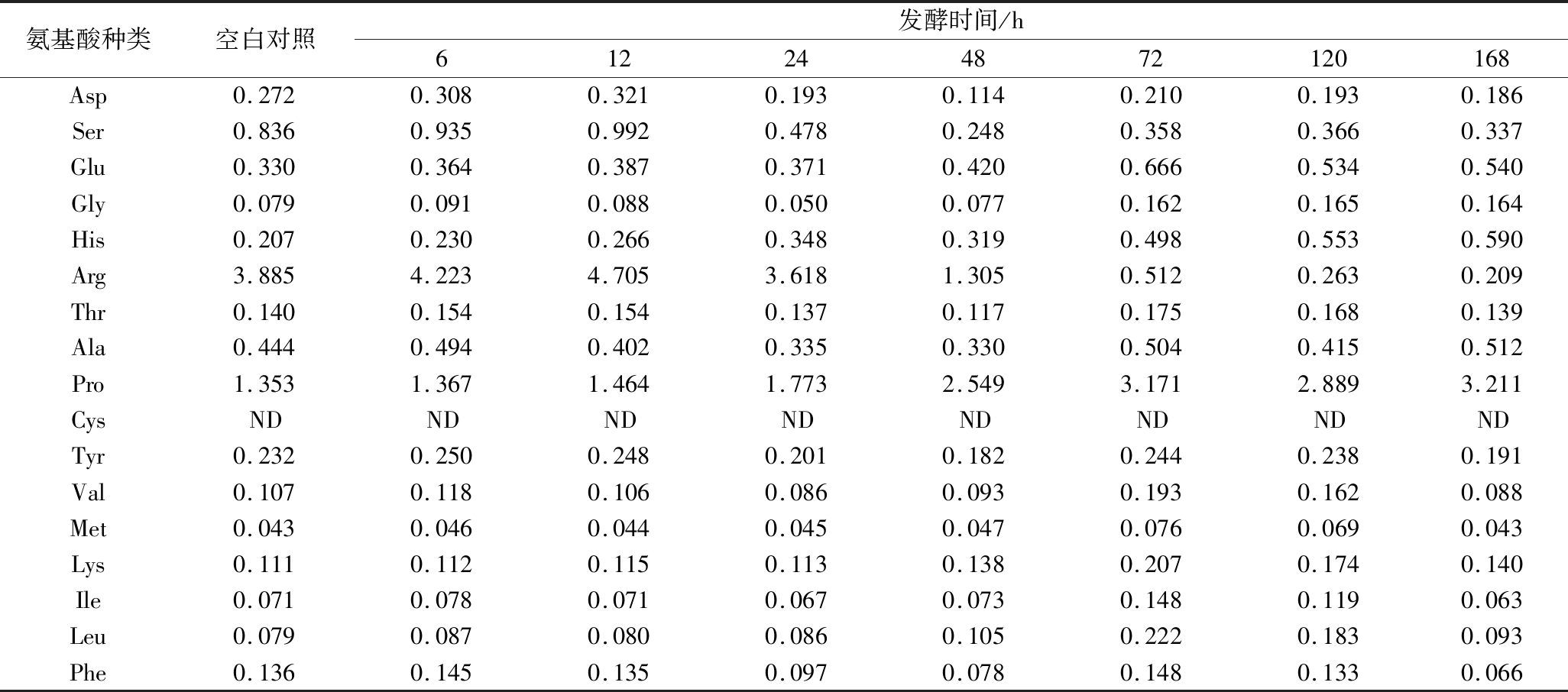
氨基酸种类空白对照发酵时间/h612244872120168Asp0.2720.3080.3210.1930.1140.2100.1930.186Ser0.8360.9350.9920.4780.2480.3580.3660.337Glu0.3300.3640.3870.3710.4200.6660.5340.540Gly0.0790.0910.0880.0500.0770.1620.1650.164His0.2070.2300.2660.3480.3190.4980.5530.590Arg3.8854.2234.7053.6181.3050.5120.2630.209Thr0.1400.1540.1540.1370.1170.1750.1680.139Ala0.4440.4940.4020.3350.3300.5040.4150.512Pro1.3531.3671.4641.7732.5493.1712.8893.211CysNDNDNDNDNDNDNDNDTyr0.2320.2500.2480.2010.1820.2440.2380.191Val0.1070.1180.1060.0860.0930.1930.1620.088Met0.0430.0460.0440.0450.0470.0760.0690.043Lys0.1110.1120.1150.1130.1380.2070.1740.140Ile0.0710.0780.0710.0670.0730.1480.1190.063Leu0.0790.0870.0800.0860.1050.2220.1830.093Phe0.1360.1450.1350.0970.0780.1480.1330.066
注:*ND表示在此条件下未检测到,下同。
表5 豆豉动态发酵过程17种游离氨基酸的含量 单位:mg/g
Table 5 The content of 17 kinds of free amino acids of fermented black beans during the dynamic fermentation

氨基酸种类空白对照发酵时间/h612244872120168Asp0.2080.2160.2070.0800.1790.2130.3100.290Ser0.9260.7650.8220.2590.3440.3630.4390.474Glu0.3950.4130.4560.3160.6420.6670.7820.866Gly0.0740.0700.0580.0450.1310.1720.2580.386His0.2500.2280.2180.2880.4520.5210.8330.941Arg4.3233.5073.9141.9880.8920.4440.2610.245Thr0.1530.1400.1250.1000.1760.1850.2430.225Ala0.4010.4090.3510.2740.4090.4460.5450.866Pro1.1841.2301.2251.2402.2392.6743.4314.310CysNDNDNDNDNDNDNDNDTyr0.2260.2110.1940.1410.2390.2360.2870.266Val0.0960.0950.0760.0780.1970.1950.2030.147Met0.0490.0420.0280.0390.0750.0660.0860.077Lys0.1140.1170.1110.1310.2220.2010.2280.232Ile0.0650.0650.0530.0630.1560.1450.1530.121Leu0.0690.0720.0590.0890.2290.2150.2270.153Phe0.1360.1230.1100.0730.1530.1400.1630.125
3 结论
本研究考察了伞枝梨头霉发酵制备淡豆豉和豆豉游离氨基酸含量的动态变化,结果表明,随着发酵时间的延长,精氨酸和丝氨酸含量呈下降趋势,脯氨酸、组氨酸、谷氨酸和甘氨酸的含量呈上升趋势,其余氨基酸变化不明显。本研究仅以伞枝梨头霉作为发酵菌种进行考察,而不同菌种产生酶的种类及活性不同对大豆蛋白的降解能力也存在差异,利用其它菌种发酵制备淡豆豉和豆豉游离氨基酸的变化有待进一步研究。
[1] 国家药典委员会.中华人民共和国药典,一部[S].北京:化学工业出版社,2015:328.
[2] 范俊峰,李里特,张艳艳,等.传统大豆发酵食品的生理功能[J].食品科学,2005(1):250-254.
[3] 贺欢,张硕,张敏,等.豆豉溶栓激酶DCK的体内溶栓抗栓作用[J].中国实验方剂学杂志,2016,22(14):135-138.
[4] MALGWI I S, TANKO Y, KAWU M U, et al. Lipid peroxidation and antioxidant enzymes evaluation in lactating female albino rats following supplementation with fermented soya bean and vitamin C[J].Advances in Enzyme Research,2017,5(2):24-31.
[5] 郭瑞华,翟丽,刘正猛,等.豆豉及其多糖对α-葡萄糖苷酶抑制作用的研究及豆豉中降糖有效成分的初步分析[J].中药材,2005(1):38-40.
[6] ZHANG Y, SUN Q, LI Z W, et al. Fermented soybean powder containing Bacillus subtilis SJLH001 protects against obesity in mice by improving transport function and inhibiting angiogenesis[J].Journal of Functional Foods,2019,59(5):60-70.
[7] CHO B O, SHIN J Y, KIM J S, et al. Soybean fermented with Bacillus amyloliquefaciens (Cheonggukjang) ameliorate atopic dermatitis-like skin lesion in mice by suppressing infiltration of mast cells and production of IL-31 cytokine in skin lesions[J]. Journal of microbiology and biotechnology,2019,29(5):827-837.
[8] 刘敏,张仁凤,陈光静,等.霉菌纯种制曲豆豉在传统后发酵中的成分变化及其与生物胺相关性的研究[J].食品与发酵工业,2019,45(5):51-60.
[9] 韩佳冬.永川豆豉蛋白水解产物与黑色素形成机理的研究[D].重庆:西南大学, 2013.
[10] 陈清婵.米曲霉发酵豆豉挥发性风味成分及其在加工过程中变化研究[D].武汉:华中农业大学,2011.
[11] 陈丽艳,刘青,孙银玲,等.不同产地淡豆豉优势发酵菌群的筛选及酶活性分析[J].中国药房,2017,28(31):4 359-4 361.
[12] 柴川,周礼明,崔小兵,等.基于液质联用技术对不同产地淡豆豉核苷和氨基酸类成分的分析[J].中国实验方剂学杂志,2016,22(23):60-67.
[13] ZHOU P, ZHAO F, CHEN M, et al. Determination of 21 free amino acids in 5 types of tea by ultra-high performance liquid chromatography coupled with tandem mass spectrometry (UHPLC-MS/MS) using a modified 6-aminoquinolyl-N -hydroxysuccinimidyl carbamate (AQC) method[J].Journal of Food Composition and Analysis,2019,81(1):46-54.
[14] 张蕾,段正康,朱宏文,等.柱前衍生高效液相色谱法测定二乙醇胺脱氢产物亚氨基二乙酸和甘氨酸[J].色谱,2017,35(11):1 165-1 170.
[15] 顾伟钢,张进杰,辛梅,等.柱前衍生-反相高效液相色谱法测定不同方法煮制的猪肉及其汤汁中的游离氨基酸[J].色谱,2011,29(10):1 041-1 045.
[16] 陈蓉,张超,顾倩,等.柱前衍生-HPLC法同时测定不同产地茯苓中18种氨基酸含量[J].药物分析杂志,2017,37(2):297-303.
[17] 刘博,韩晓东,张敏婷,等.AQC柱前衍生化高效液相色谱法测定宝乐果中的游离氨基酸[J].中山大学学报(自然科学版),2013,52(4):100-104.
[18] 侯松嵋,孙敬,何红波,等.AQC柱前衍生反相高效液相色谱法测定土壤中氨基酸[J].分析化学,2006(10):1 395-1 400.
[19] 马晓丽,孟磊,巴吐尔,等.两种柱前衍生反相高效液相色谱法测定血液和尿液中游离氨基酸[J].氨基酸和生物资源,2012,34(3):19-24.
[20] 李萍萍,崔元璐,蒋庆峰.柱前衍生RP-HPLC法分析淡豆豉和大豆中氨基酸[J].中草药,2013,44(9):1 199-1 202.
[21] 徐杰,邓龙兴,胡国元,等.青蒿素衍生物抗菌机理研究[J].天然产物研究与开发, 2018,30(5):725-730.
[22] 梁薇,梁莹,应惠芳.桑叶水提物及醇提物抗菌作用的研究[J].时珍国医国药, 2005,16(8):753-753.