葡聚糖分为α-葡聚糖(α-glucan)和β-葡聚糖(β-glucan),是谷物类等生物中极为重要的一类膳食纤维[1]。其中,β-葡聚糖是一种水溶性/非水溶性的非淀粉均多糖,主要由β-1,3、β-1,4、β-1,6糖苷键连接组成,部分有支链结构,也有环状结构[2]。β-葡聚糖具有抗肿瘤[3]、镇痛[4]、降血糖血脂[5]及调节免疫[6]等生理功效。其吸水性较强,具有较好的凝胶性能和水合作用,可作为食品添加剂和药物载体[7-8]。近年来,关于β-葡聚糖的国内发明专利超过200项,国外发明专利超过30项,对β-葡聚糖的结构、性质、生理功效,以及β-葡聚糖对产品品质的影响、加工条件对β-葡聚糖理化性质的影响等方面有了较深入的研究[2,8]。研究发现,β-葡聚糖的分子质量、结构、含量、性质及功效等与其来源、生长环境等因素有关。另外,β-葡聚糖也作为一种益生元,在人体上消化道不能被消化吸收利用,只能通过肠道中的微生物降解作用,产生有利于人体的功能性成分,实现其各自生理功能。然而,不适当的加工手段会破坏食物中的β-葡聚糖结构,影响其功能发挥。因此,充分了解不同来源的β-葡聚糖理化特性,β-葡聚糖在生物体肠道中的代谢途径及其机理,了解加工方式对食物中β-葡聚糖分子结构和理化特性的影响,有助于富含β-葡聚糖功能食品的开发和利用。
1 β-葡聚糖的来源及结构特征
β-葡聚糖广泛存在于植物、真菌、细菌及无脊椎动物中,尤其在谷物类和真菌的细胞壁、子实体、菌丝体及细胞壁中比较常见,含量也相对较高[2]。β-葡聚糖含量、聚合度、分子质量、分子构型等会受来源、生长环境及加工方法等因素的影响,因而其功能与性质也存在差异[9]。
1.1 谷物类β-葡聚糖
谷物类如青稞、大麦、燕麦等多种谷物中均含有β-葡聚糖,其结构一般由β-1,3和β-1,4两种糖苷键构成,无支链结构(图1),分子质量差异明显(表1)。其中,β-1,4糖苷键与β-葡聚糖的规则结构有关,形成致密区,而β-1,3糖苷键主要形成无规则结构,该区域结构相对疏松而具有柔性[10]。3-O-β-纤维二糖基-D-葡萄糖(3-O-β-cellobiosyl-D-glucose, DP3)和3-O-β-纤维三糖基-D-葡萄糖(3-O-β-cellotriosyl-D-glucose, DP4)是β-葡聚糖主要水解产物,前者为三聚体、后者为四聚体,是β-葡聚糖的重要结构特征,其比例(DP3/DP4)可构成β-葡聚糖的指纹图谱,是表征β-葡聚糖结构的重要参数。谷物β-葡聚糖分子中的其他低聚体单元(DPn,5≤n≤20)的比例也因谷物的种类、遗传及环境因素的差异而不同[10-11]。
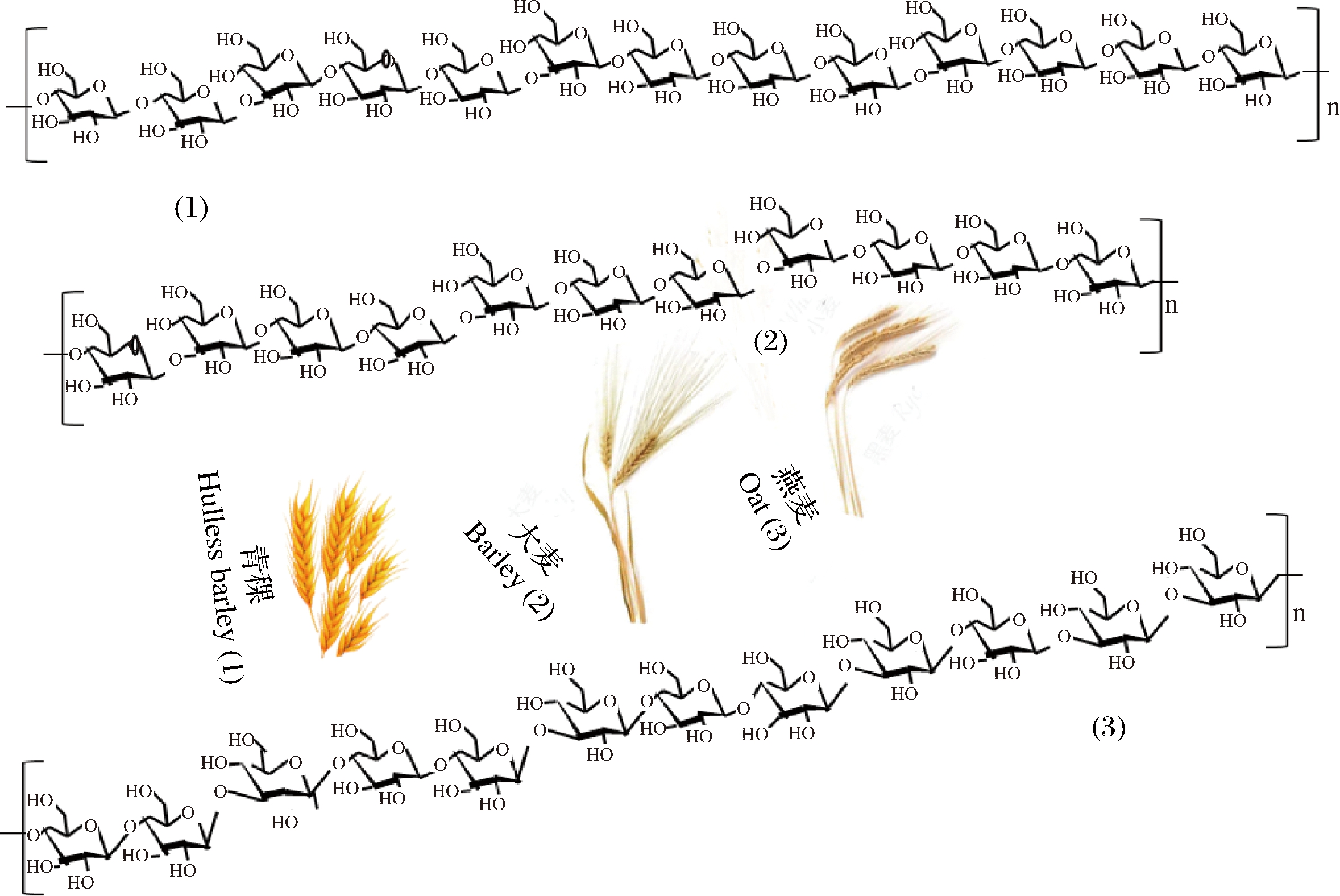
图1 谷物β-葡聚糖的一般结构
Fig.1 General structure of β-glucans from cereals
表1 谷物β-葡聚糖的含量与结构特征
Table 1 Content and structure characteristic of β-gulcans
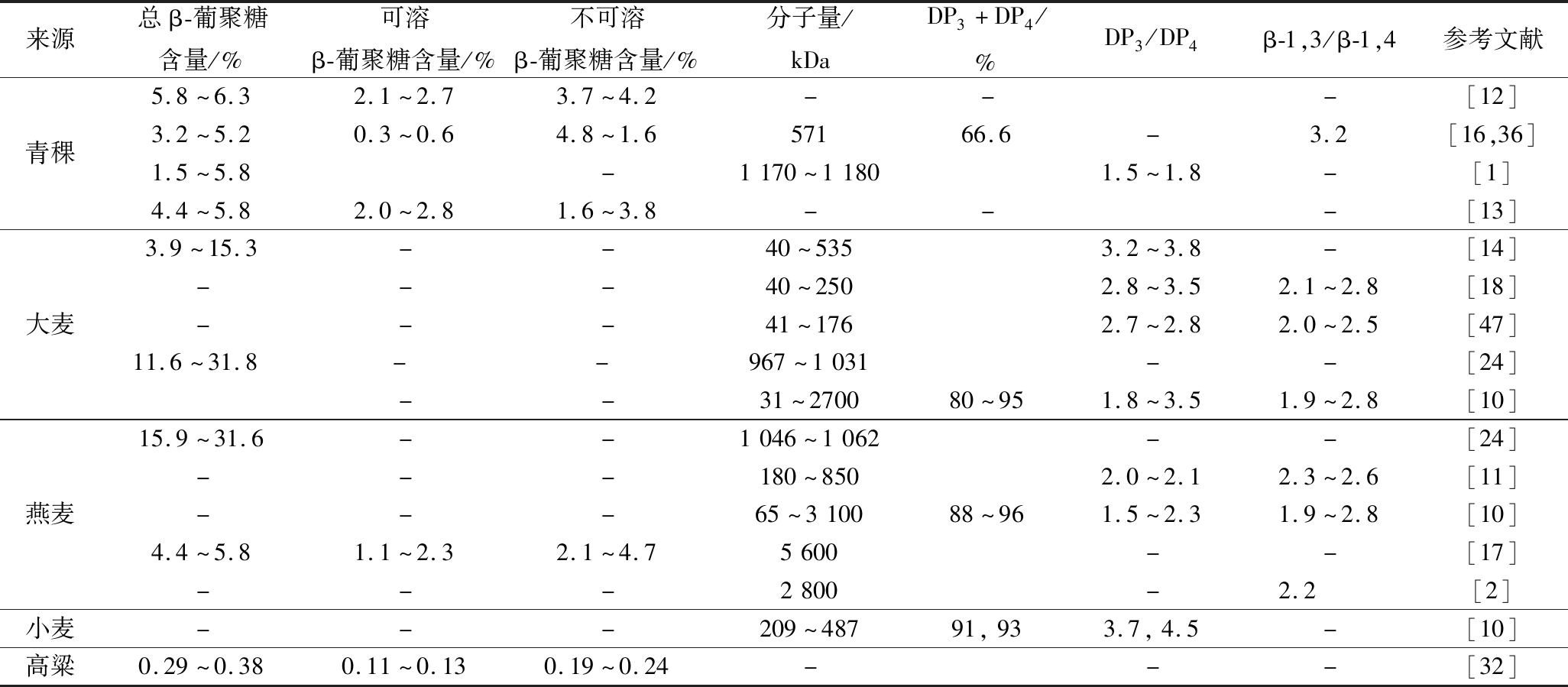
来源总β-葡聚糖含量/%可溶β-葡聚糖含量/%不可溶β-葡聚糖含量/%分子量/kDaDP3+DP4/%DP3/DP4β-1,3/β-1,4参考文献青稞5.8~6.32.1~2.73.7~4.2---[12]3.2~5.20.3~0.64.8~1.657166.6-3.2[16,36]1.5~5.8-1170~11801.5~1.8-[1]4.4~5.82.0~2.81.6~3.8---[13]大麦3.9~15.3--40~5353.2~3.8-[14]---40~2502.8~3.52.1~2.8[18]---41~1762.7~2.82.0~2.5[47]11.6~31.8--967~1031--[24]--31~270080~951.8~3.51.9~2.8[10]燕麦15.9~31.6--1046~1062--[24]---180~8502.0~2.12.3~2.6[11]---65~310088~961.5~2.31.9~2.8[10]4.4~5.81.1~2.32.1~4.75600--[17]---2800-2.2[2]小麦---209~48791,933.7,4.5-[10]高粱0.29~0.380.11~0.130.19~0.24---[32]
注:“-”表示未检测出。下同。
1.1.1 青稞
青稞有黑色、蓝色及白色青稞之分,白色青稞较为常见。青稞β-葡聚糖的含量与其基因、生长环境、颗粒部位、处理方式等因素有关,总含量在3.7%~16.9%,高海拔地区的含量高于低海拔地区。例如,西藏不同颜色青稞(海拔高度>4 000 m)的总β-葡聚糖含量在5.80%~6.29%,其中黑青稞中平均总β-葡聚糖和可溶性葡聚糖含量最高,分别为6.29%和2.72%,其次为蓝青稞,而白青稞含量最低,分别为5.80%和2.06%,且均显著高于低海拔(97~3 500 m)地区的青稞品种[12]。相比低海拔地区(97~126 m),高海拔(1 200~1 500 m)地区的青稞总β-葡聚糖要高7.5%~30.8%[13]。青稞皮中的β-葡聚糖含量在4.7%~6.3%,而精粉含量在3.4%~4.4%,且高原青稞皮中的β-葡聚糖含量要比平原地区的高7.5%~28.3%。如印度不同地区的9个青稞品种、青稞表皮及精粉中的β-葡聚糖含量存在显著差异,其中麸皮中的β-葡聚糖含量在4.6%~6.2%,而精粉中的含量在3.4%~4.5%。虽然高海拔地区青稞品种的β-葡聚糖含量更高,但相应地减少了青稞精粉的得率[7]。在土耳其不同地方不同品种青稞中也有类似规律,β-葡聚糖含量在3.73%~5.18%[1]。青稞中的β-葡聚糖由β-1,3和β-1,4糖苷键构成,平均分子质量在(117~188)×104 Da,甚至更高,DP3/DP4比例在1.5~1.8[1]。总之,不同品种青稞中β-葡聚糖的含量及结构差异显著,高海拔地区的含量高于低海拔地区,青稞皮中的含量高于青稞精粉。
1.1.2 大麦
大麦有黑麦、糯大麦、多棱裸大麦、稃大麦等多个种类。大麦β-葡聚糖分布在其种皮、胚子叶、糊粉层、亚糊粉层、淀粉胚乳等细胞壁中。大麦总β-葡聚糖含量在0.5%~15.3%,其中大麦亚糊层细胞中的含量最高,胚乳细胞壁中也有较高的含量(约占胚乳细胞壁总多糖的75%),而大麦胚乳细胞中的β-葡聚糖比邻于细胞内容物[2]。同样地,不同品种大麦中β-葡聚糖的含量及分子质量差异明显,如干重含量高的可达11.8%~15.3%,低的含量仅有3.9%~4.9%,甚至更低;分子质量高的达2 400 kDa,低的仅有40 k~110 kDa;DP3/DP4在3.2 ~3.8[14]。例如,糯大麦中β-葡聚糖含量在5.4%~6.3%[15];黑麦β-葡聚糖含量仅有1.9%左右;小黑麦β-葡聚糖含量更少,在0.5%~1.0%之间[11]。文献显示,大麦、麦麸及脱淀粉大麦中β-葡聚糖的平均分子质量分别为188、9和21 kDa[16]。由此说明,大麦中的β-葡聚糖含量相对较高,不同品种的含量及分子质量大小存在显著差异,糖苷键类型与青稞β-葡聚糖相同。
1.1.3 燕麦
在燕麦中,β-葡聚糖主要存在于籽粒亚糊粉层,麸皮中也含有一定的含量。燕麦总β-葡聚糖含量在3.2%~11.3%,其中燕麦麸中含量在6.6%~11.3%,去皮燕麦粉中含量在3%~5.4%,水溶性β-葡聚糖占22%~40%,可溶性膳食纤维4.7%~8.9%,不溶性膳食纤维3.9%~9.1%,均受燕麦品种、地理位置、降水量及平均日照温度等因素的影响[17]。例如,加拿大不同地区的8种燕麦中总β-葡聚糖含量在4.37%~5.82%,不同品种和地区之间的差异显著[17]。芬兰13种燕麦β-葡聚糖含量在3.9%~6.6%[18]。英国的部分燕麦β-葡聚糖的含量在2.8%~5.5%[19]。燕麦β-葡聚糖与青稞、大麦β-葡聚糖类似,均由β-1,3和β-1,4糖苷键连接,属于无支链的黏性多糖[17]。燕麦β-葡聚糖平均分子量在79.3~1 067 kDa,也有分子质量达2 000 kDa和5 600 kDa的报道[14]。燕麦的DP3/DP4在1.5~2.3,其差异主要受品种、生长环境及其相互作用的影响[10]。
1.1.4 其他谷物
高粱中β-葡聚糖含量较低,总β-葡聚糖含量一般小于0.5%,其差异主要取决于高粱种类。高粱粉中的含量在0.3%~0.4%,其中非水溶性含量在0.19%~0.24%,水溶性含量在0.11%~0.13%。高粱胚芽中总β-葡聚糖含量在0.17%~0.27%,水溶性的含量也低于非水溶性的含量[20]。另外,小麦(<1%)及大米(0.09±0.01)%中也含有极少量的β-葡聚糖[21]。这些谷物β-葡聚糖的分子结构特征与青稞、大麦及燕麦β-葡聚糖类似,均由β-1,3和β-1,4糖苷键组成。
1.2 微生物β-葡聚糖
在食用菌、酵母及细菌中,β-葡聚糖主要作为其细胞壁的成分而存在,多具有支链结构。其中β-1,3葡聚糖是真菌细胞壁的主要成分,主要贡献是形成细胞壁的刚性骨架而赋予其抗机械力性能,其螺旋结构对维持真菌细胞壁的弹性有着重要作用。另外,微生物β-葡聚糖的含量及结构因其种类而各异(表2)。
表2 微生物β-葡聚糖的结构特征
Table 2 the structure characteristic of beta-gulcans from bacteria
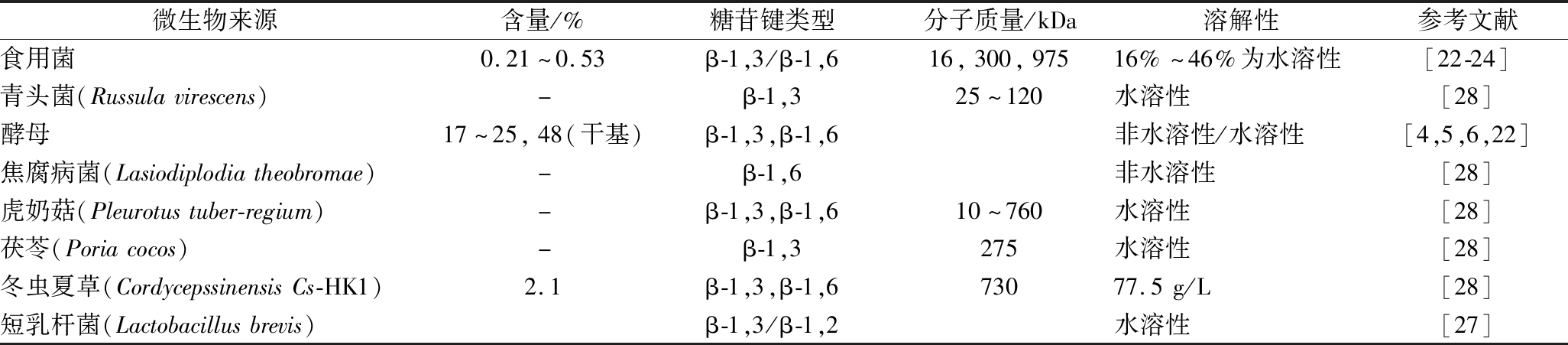
微生物来源含量/%糖苷键类型分子质量/kDa溶解性参考文献食用菌0.21~0.53β-1,3/β-1,616,300,97516%~46%为水溶性[22-24]青头菌(Russulavirescens)-β-1,325~120水溶性[28]酵母17~25,48(干基)β-1,3,β-1,6非水溶性/水溶性[4,5,6,22]焦腐病菌(Lasiodiplodiatheobromae)-β-1,6非水溶性[28]虎奶菇(Pleurotustuber-regium)-β-1,3,β-1,610~760水溶性[28]茯苓(Poriacocos)-β-1,3275水溶性[28]冬虫夏草(CordycepssinensisCs-HK1)2.1β-1,3,β-1,673077.5g/L[28]短乳杆菌(Lactobacillusbrevis)β-1,3/β-1,2水溶性[27]
1.2.1 真菌
(1)真菌子实体。食用菌及部分药用真菌的子实体中含有较为丰富的β-葡聚糖,如侧香菇、耳担子菌、茯苓及青头菌等。其中双孢蘑菇、平菇、鸡腿蘑的β-葡聚糖的平均含量分别为8.5%、14.2%及17.0%[22]。侧耳担子菌β-葡聚糖在冷水中可溶,呈凝胶状,主链由β-1,3糖苷键构成,O-6被葡萄糖单体取代,主链上平均2~3个残基就有1个分子质量为9.75×105 g/mol的支链[23]。食用菌中β-葡聚糖的一般结构如图2所示,主链由β-1,3,1,4糖苷键组成,支链由1个或多个葡萄糖分子组成,支链与主链之间靠β-1,6糖苷键连接。凤尾菇中的β-葡聚糖分子主链由β-1,3糖苷键连接,每4个分子通过β-1,6糖苷键结合1个支链分子[24]。灰树花菌β-葡聚糖的粗得率1.7%左右,分子量约300 kDa,主链由β-1,3糖苷键组成,每3个主链分子连接1个支链葡萄糖分子,支链与主链由β-1,6糖苷键连接[25]。栎迷孔菌β-葡聚糖的分子质量为3~3 000 kDa,平均为16 kDa,分子结构与其他食用菌类似,支链由3个葡萄糖经β-1,3糖苷键连接组成[2]。而光帽鳞伞及其他食用菌β-葡聚糖的主要区别在于分子质量大小、支链结构比例及支链分子的聚合度[26]。由于食用菌β-葡聚糖分子质量总体较低,且具有支链结构,因此会比较黏稠而具有滑腻感。
(2)酵母、曲霉菌。酵母细胞壁中,β-葡聚糖的含量达50%~65%,主链由β-1,3糖苷键构成,支链与主链由β-1,6糖苷键连接而成。酵母中β-葡聚糖的黏度较高,水溶性较差,高浓度条件可形成凝胶[5-6]。胶红酵母中的β-葡聚糖主要由β-1,3糖苷键构成,平均分子质量78.2 kDa,平均聚合度480[4]。
1.2.2 细菌
啤酒中的短乳杆菌可产生2种β-葡聚糖,一种属于胞外多糖,另一种属于荚膜多糖,可导致啤酒变质而使其黏液呈丝状。该类β-葡聚糖由β-1,3、β-1,2糖苷键及末端残基构成,其中β-1,3糖苷键的比例约23.6%,每2个主链分子中的2号位就会与1个葡萄糖分子形成1个支链[27]。根瘤菌胞质间有一种环状β-葡聚糖(图2),分子由10~13个D-葡萄糖分子构成,具有非还原性末端残基,其中主要成分由12个分子(Mw=1945.363 Da)构成,糖苷键为β-1,3或β-1,6,两者比例约为1∶2[2]。焦腐病菌的胞外β-葡聚糖具有半螺旋结构(图2),与其他细菌β-葡聚糖结构相比,其分子结构比较独特,主要由β-1,6糖苷键组成,无支链结构,因而水溶性比较差[28]。
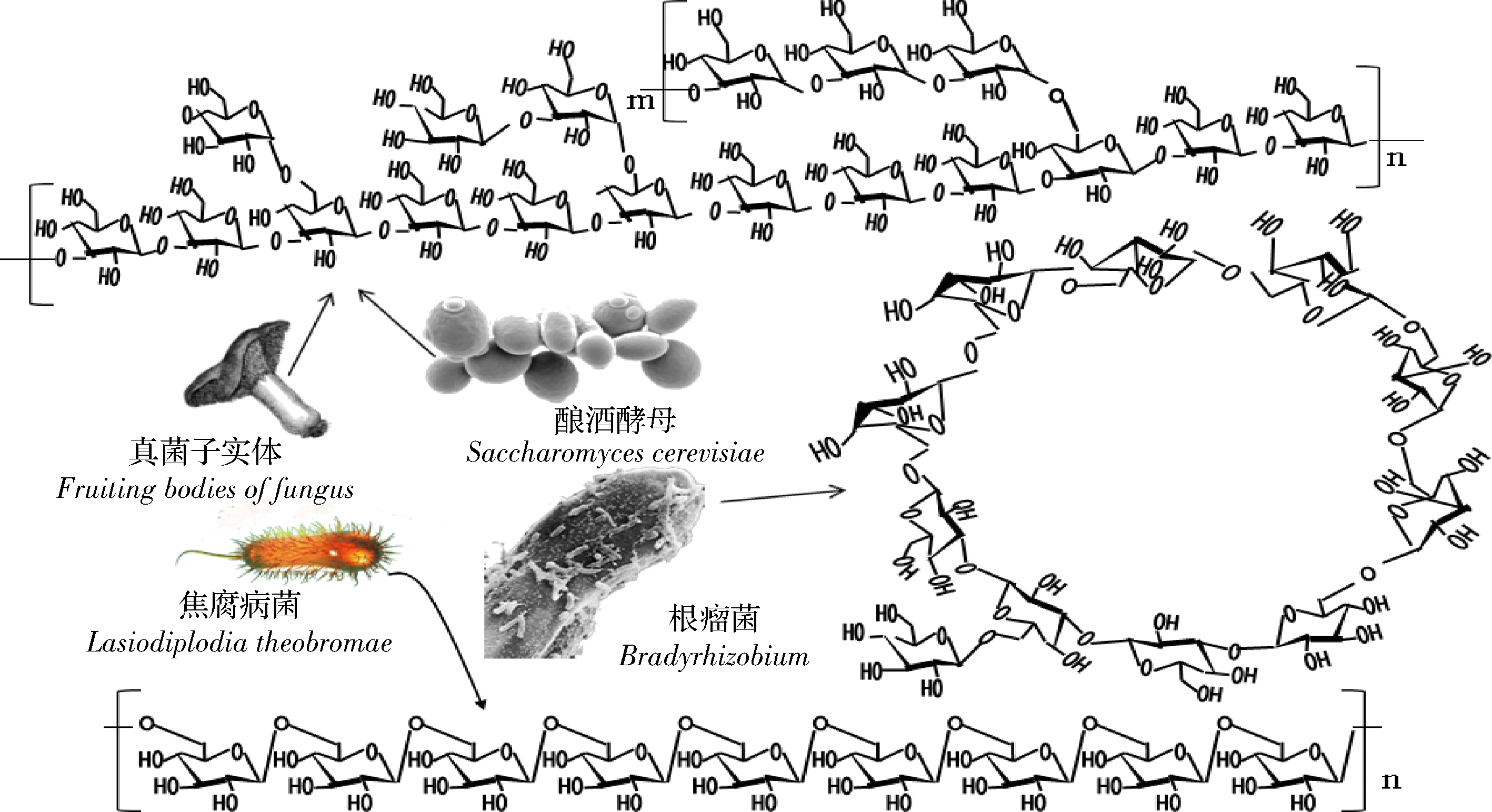
图2 微生物β-葡聚糖的分子结构
Fig.2 Structure of microbial β-glucans
综上所述,可以发现谷物类β-葡聚糖含量和结构可能受品种及环境的影响而存在显著差异,但总体而言,谷物类β-葡聚糖的含量呈青稞>大麦>燕麦>黑麦>小麦>高粱>大米的排列顺序,非水溶性β-葡聚糖含量及分子量更高,而水溶性的分子量相对较低,且一般为直链结构,由β-1,3、β-1,4糖苷键组成,无支链结构。β-1,3糖苷键位于不同聚合度的连续性β-1,4糖苷键之间而呈非连续性排列;同等分子量时,β-1,3/β-1,4糖苷键的比例越高,低聚合结构如DP3与DP4的总量及其比例就越高,整个分子链的线性越低,分子链间的相互作用就越低,聚合作用越低,而溶解性越强。反之,如果DP3与DP4所占比例越低,β-葡聚糖分子链线性越强,分子间的空间阻碍越弱,越容易通过分子间氢键作用而聚集,形成网络结构而易形成胶体和薄膜。从目前的数据来看,青稞β-葡聚糖分子的线性特性似乎更强,聚合状态的结构比较紧密,大麦β-葡聚糖次之,燕麦β-葡聚糖的β-1,3/β-1,4比例较高而线性较差,聚集态结构比较分散而疏松;单纯比较大麦与燕麦β-葡聚糖分子量时,前者较低,扩散速率更高,聚合作用更强,网状结构更坚实[12-29]。总之,分子量及β-1,3/β-1,4糖苷键的比例是影响β-葡聚糖结构和功能性质的最关键因素。其他植物类β-葡聚糖主要由β-1,3、β-1,4、β-1,6糖苷键组成,有支链结构。微生物中β-葡聚糖含量较高,主要为细胞壁成分,不同来源的结构差异显著,分子量越大,溶解性越差,主要由β-1,3糖苷键和β-1,6糖苷键单独或/和混合构成,而β-1,4糖苷键相对较少,支链与主链之间通常由β-1,6糖苷键构成,支链度越高,黏度越大。尽管不同来源β-葡聚糖之间的分子量及结构差异显著,但其性质与结构之间的规律具有一定的相似性。
2 不同来源β-葡聚糖的物理特性
β-葡聚糖的理化性质主要包括水合特性(持水性及溶胀性等)、流变性质、发泡性质及乳化性质等,其中流变性质包括黏度、凝胶化、剪切变稀、黏弹性等,其性质的差异主要取决于结构和浓度等条件。β-葡聚糖作为增稠剂、乳化剂等,常用于食品加工业,也可作为载体、敷料、护肤品而被应用于医药行业。
2.1 β-葡聚糖的水合特性
多糖因其含有大量的游离羟基而具有较强的亲水性。β-葡聚糖与其他多糖类似,具有一定的吸水性,能够控制水分移动的能力而可用作食品增稠剂。由表3可知,燕麦β-葡聚糖具有较好的水合能力,溶胀能力在12.1~15.1 g/g[30-31]。而高黏大麦β-葡聚糖持水力约2.9 g/g,在其浓度≤0.1%范围内呈现均质性,但当浓度≥0.25%时,则表现出不同程度的微观非均质性和微观黏度行为[32]。青稞β-葡聚糖的持水力可达4.2~4.9 g/g,脂肪结合能力2.1~2.4 g/g,胆汁酸结合能力21.8%~34.2%[33]。相对而言,青稞与燕麦中β-葡聚糖水合性质较强,这可能与其分子量及分子结构之间的差异有关。
相比谷物类,微生物β-葡聚糖的溶胀能力更强,但水合能力、发泡能力、发泡稳定性和脂肪结合能力较低。如酵母细胞壁中的β-葡聚糖的溶胀能力可达5.5 g/g,有的甚至高达19.59 g/g,而持水能力仅有0.73~1.74 g/g,且明显低于大麦和燕麦β-葡聚糖[5]。鸡腿蘑菇β-葡聚糖的平均溶胀能力4.59 g/g,脂肪结合能力6.65 g/g,均大于双孢蘑菇和平菇β-葡聚糖,而平菇的平均起泡能力和起泡稳定性效果最好,分别为10.20%和9.16%[34]。由此可知,不同来源的β-葡聚糖,其水合性质差异较大,可能是影响β-葡聚糖其他功能性质(如胶凝性质、黏度等)的重要因素。
2.2 β-葡聚糖的胶凝性质
β-葡聚糖的胶凝作用是分子间通过聚合作用而形成三维网状结构的过程,而这一过程一般都是热可逆性的。目前,扩散限制簇聚集(diffusion limited cluster aggregation,DLCA)和碰撞限制簇聚集(reaction limited cluster aggregation,RLCA)被认为是凝胶分子相互聚集的通用理论模型,前者认为多糖分子通过分子扩散相互聚集形成分支,新生产的分支阻止邻近分子进入团簇中心而形成另一个团簇,这种不断重复的扩散运动最终导致凝胶的形成;后者认为凝胶是依靠2个分子间的概率性碰撞而形成团簇,团簇分子进一步碰撞而形成分子簇,最终形成凝胶。且一般认为,β-葡聚糖分子间之所以能够相互聚合,与分子间形成的氢键有关,而氢键的形成主要依靠β-葡聚糖分子的纤维素样连接区(DP>3)和纤维三糖基连接区(DP=3)的羟基。在稀溶液中,分子间距离较大,扩散速率对聚合作用的影响比单体分子的结构特征更重要,DP3/DP4的比值越高,分子刚性构象越多,扩散性越差,聚合度就越低;相反,同等条件下,DP3/DP4的比值越低,β-1,4糖苷键的比例越高,β-葡聚糖分子的线性特性越强,分子间的相互作用越强,分子间的缔合作用也越强,凝胶形成速率越快,稳定性越好,凝胶强度也越高[35]。而在高浓度条件下,分子间的重叠降低了其扩散的重要性,DP3/DP4构成的刚性效应可以忽略,分子链上反应位点的可用性更加重要,因此,DP3/DP4越高的β-葡聚糖形成凝胶的能力越强。另外,分子量越小,水力半径越小,分子移动速度越快,这种高移动性增加了分子聚合的几率,聚合度越高,反之亦然[36]。因此,谷物类β-葡聚糖的凝胶性质除与其分子结构相关外,还与分子量大小、分子量分布、浓度、储存时间及温度有关。整体而言,谷物β-葡聚糖的胶凝能力顺序为:小麦>大麦>燕麦>青稞,前3者在常温下能形成凝胶,而青稞β-葡聚糖分子中的β-1,3糖苷键比例较低,导致其在常温下难以形成凝胶样结构,仅能在较低温度(<5 ℃)下形成微弱凝胶;对于同一种谷物β-葡聚糖,分子链中DP>5的比例越低,凝胶形成越快,这可能与分子链中相邻连续单元联合形成延伸区进而形成的螺旋结构有关[37-38]。另外,相比静态胶凝过程,由于动态受力胶凝过程中β-葡聚糖的分散作用受到影响,使得分子间的聚合作用受到破坏,所得凝胶较小[10]。
真菌中的β-葡聚糖具有高度支链结构,易与水分子及其他分子之间形成氢键,具有凝胶样结构和剪切变稀的流变性质,且凝胶结构对温度(5~60 ℃)具有较强的稳定性,粗品和纯品的流变行为类似,可作为增稠剂应用到食品工业中[2]。但灵芝β-葡聚糖在低浓度(≤0.5%)及低临界剪切速率条件下展现出剪切变稀及液体样行为,不具有牛顿流体,其临界浓度仅有0.79 g/L,远低于其他多数多糖,但可形成微弱的凝胶结构,这可能与其刚性构象有关[39]。某些腐败菌也能分泌黏性β-葡聚糖形成微凝胶样结构,从而使食品变稠、变质[27]。
2.3 β-葡聚糖的流体流动性质
研究显示,中性多糖的特性黏度遵循Hggins方程,即
ηsp=C[η]+k[η]2C2
(1)
刚性多糖的特性黏度则遵循方程
ηsp=C[η]+kC[η]sp
(2)
式中:ηsp,特性黏度;C,浓度;[η],固有黏度;k为常数。
但后者仅在特性黏度为1.2~2范围适用,因为特性黏度大于2时,多糖分子间的相互作用的影响将不可忽略。动态黏度(η*)与表观黏度(η)之间的关系遵循Cox-Merz定律,即:
|η*(w)|w→0=|η(γ)|γ→0
式中:w,角频率,rad/s;γ,剪切速率,1/s。
该方程多与凝胶状态结构有关,在稳定剪切试验中会断裂,使得η*>η,但在高浓度时,两者的变化几乎是平行的,且η*>η[38]。固有黏度([η])与分子量(M)之间的关系遵循Mark-Houwink-Sakurada方程,即
指数α因β-葡聚糖的不同来源而异[35]。而β-葡聚糖溶液的剪切变稀行为可用交叉模型描述,即:
η0,零剪切速率黏度;η∞表示无穷大剪切速率黏度;γ,剪切速率;K为常数;n表示取决于β-葡聚糖浓度的幂指数[39]。
总体而言,β-葡聚糖溶液的黏度受其来源、分子量、温度、浓度及溶剂等因素的影响,其中β-葡聚糖的结构为最主要的影响因素。以谷物β-葡聚糖为例,β-1,4糖苷键具有半螺旋结构特征,而β-1,3糖苷键具有弯曲变形的结构效应,同等分子量情况下,两者比例越高,DP4/DP3的比例也越高,葡聚糖分子的内部相互作用越强,线性β-葡聚糖分子间的缔合趋势越强,抗流性作用越明显,黏度也就越大。相比大麦水溶性β-葡聚糖,燕麦β-葡聚糖分子链中β-1,4/β-1,3比例及DP4/DP3的比例更高,抗流性更强,因而黏度更高[35]。在同等浓度下,燕麦β-葡聚糖的黏度随其分子量的增加而增大,在低浓度时表现为牛顿流体,在高浓度时具有假塑性[40]。青稞β-葡聚糖还具有热弹性流变行为,即剪切速率越大,表观黏度越低,在同等剪切速率下,浓度越高,黏度越大。这可解释为β-葡聚糖在溶液中是一种动态纠缠网络结构,同时,β-葡聚糖分子羟基形成的分子间和分子内氢键也会强化这种网状结构,这种结构会限制β-葡聚糖分子链的移动,但会随外界条件的改变而变化。另外,浓度增加1%,表观黏度约增加10倍,黏弹性模量与温度呈负相关性[37]。大麦与燕麦β-葡聚糖具有青稞β-葡聚糖相似的表观密度变化规律,分子量越大,表观密度越低,但两者在溶液中的聚合构象却是不同的,前者比较有序和固定,后者分布较广而比较疏松[41]。灵芝β-葡聚糖在低浓度时也表现为牛顿流体,且临界浓度随分子量的增加而降低,其剪切行为也遵循交叉模型[39]。
表3 不同来源β-葡聚糖的理化性质
Table 3 The physicochemical property of β-glucan from different resouces
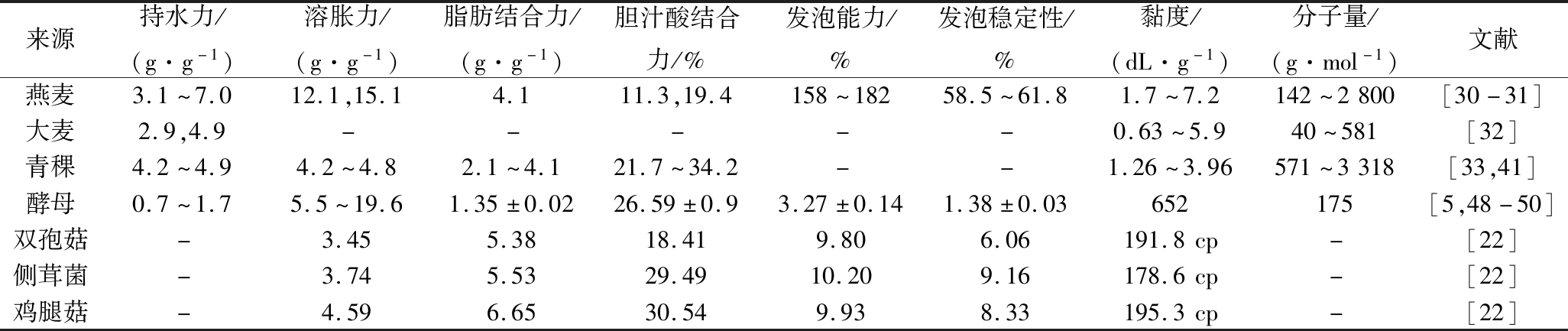
来源持水力/(g·g-1)溶胀力/(g·g-1)脂肪结合力/(g·g-1)胆汁酸结合力/%发泡能力/%发泡稳定性/%黏度/(dL·g-1)分子量/(g·mol-1)文献燕麦3.1~7.012.1,15.14.111.3,19.4158~18258.5~61.81.7~7.2142~2800[30-31]大麦2.9,4.9-----0.63~5.940~581[32]青稞4.2~4.94.2~4.82.1~4.121.7~34.2--1.26~3.96571~3318[33,41]酵母0.7~1.75.5~19.61.35±0.0226.59±0.93.27±0.141.38±0.03652175[5,48-50]双孢菇-3.455.3818.419.806.06191.8cp-[22]侧茸菌-3.745.5329.4910.209.16178.6cp-[22]鸡腿菇-4.596.6530.549.938.33195.3cp-[22]
3 β-葡聚糖在生物体内的降解机理及代谢途径
β-葡聚糖作为一种膳食纤维,具有多种生物活性,如抗肿瘤、调节免疫、改善糖尿病症状及肥胖症等[42]。一方面,β-葡聚糖与其他水溶性膳食纤维类似,可诱导肠道上皮细胞产生免疫应答进而提高宿主的免疫能力;另一方面,β-葡聚糖由于其结构复杂,且人体消化系统无相应的消化酶,仅能通过肠道微生物发酵转变为多种生物活性成分。然而,β-葡聚糖具有β-1,2/β-1,3/β-1,4/β-1,6多种糖苷键,因而需要不同的酶进行降解[42-43]。研究证实,人类肠道中发酵利用β-葡聚糖的微生物主要包括革兰氏阴性拟杆菌门和革兰氏阳性厚壁菌门,且两者在维持肠道菌群稳定和人体健康方面具有重要作用[41]。其中,谷物β-葡聚糖主要被拟杆菌门细菌中的B. ovatus降解和利用,且长期缺乏膳食纤维将不可逆地改变肠道微生物生态,因而,膳食纤维及肠道菌群对人体健康具有不可替代的作用[42]。因此,了解肠道微生物如何将β-葡聚糖分解而转化为人体所需要的各种生物活性成分具有重要意义。
3.1 β-葡聚糖在生物体内的降解过程及机理
由于不同来源的β-葡聚糖在结构(如分子量、糖链长度、糖苷键类型及比例、DP2:DP3:……DPn、支链、聚合形态)上存在诸多差异,因而其在肠道微生物的降解过程及机制也不同。微生物降解β-葡聚糖的能力由其葡糖苷酶的种类及活性决定,而这些酶又由相应的基因编码而成,因而肠道微生物的基因决定了其代谢特征。反之,膳食纤维的种类也会影响微生物的种类和分布[43]。目前,将肠道微生物降解β-葡聚糖及其他多糖的基因归于碳水化合物基因家族(carbohydrate-active enzymes, CAZymes)成员之一,其中降解β-葡聚糖的酶系统可分为结合家族、降解家族及转运家族3类[44-45]。研究表明,谷物β-葡聚糖的降解场所位于细菌细胞表面,主要由CBM(carbohydrate-binding modules, CBM)结合家族、GH(glycoside hydrolase family, GH)糖苷降解家族及转运家族完成。以B. ovatus为例,该类微生物具有一套相对完整的β-糖苷酶系统,这套系统类似于原型多形类杆菌(Bacteroides thetaiotaomicron)的淀粉利用系统(starch utilization system,SUs)。谷物β-葡聚糖在B. ovatus细胞表面,首先与CBM家族蛋白特异性结合,再由GH家族酶降解为葡萄糖,最终经转运蛋白将葡萄糖分子转入细胞内。因而,β-葡聚糖降解为葡萄糖的过程可分为3个阶段,即捕获(结合)、分解、转运(如图2所示)。捕获阶段(图3-A),β-葡聚糖分子靠自身的移动(Motility)、其他大分子或细菌的趋化作用(Chemotaxis)、蛋白受体及相关糖蛋白的特异性结合共同介导了细胞表面酶与底物的特异结合,为β-葡聚糖的降解做好准备;降解阶段(图3-B)由BACOVA-02741基因编码的BoGH16(GH16)酶家族和BACOVA-02745基因编码的BoGH3(GH3)酶家族完成,其中GH16特异性降解β-1,4糖苷键,GH3家族降解β-1,3糖苷键。该阶段的初期,由通过N端半胱氨酸残基的酯化作用固定于细胞膜的GH16酶家族完成。
由于GH16对β-1,3/β-1-4混合型葡聚糖具有很高的特异性,它首先通过内切作用将谷物β-葡聚糖的β-1,4糖苷键分解,产物为较大的低聚糖,然后逐步水解次级产物的β-1,4糖苷键将其转变为分子量更小的低聚糖,最终被降解为限制性消化三糖(G4G3G)和/或四糖(G4G4G3G),前者由3个葡萄糖

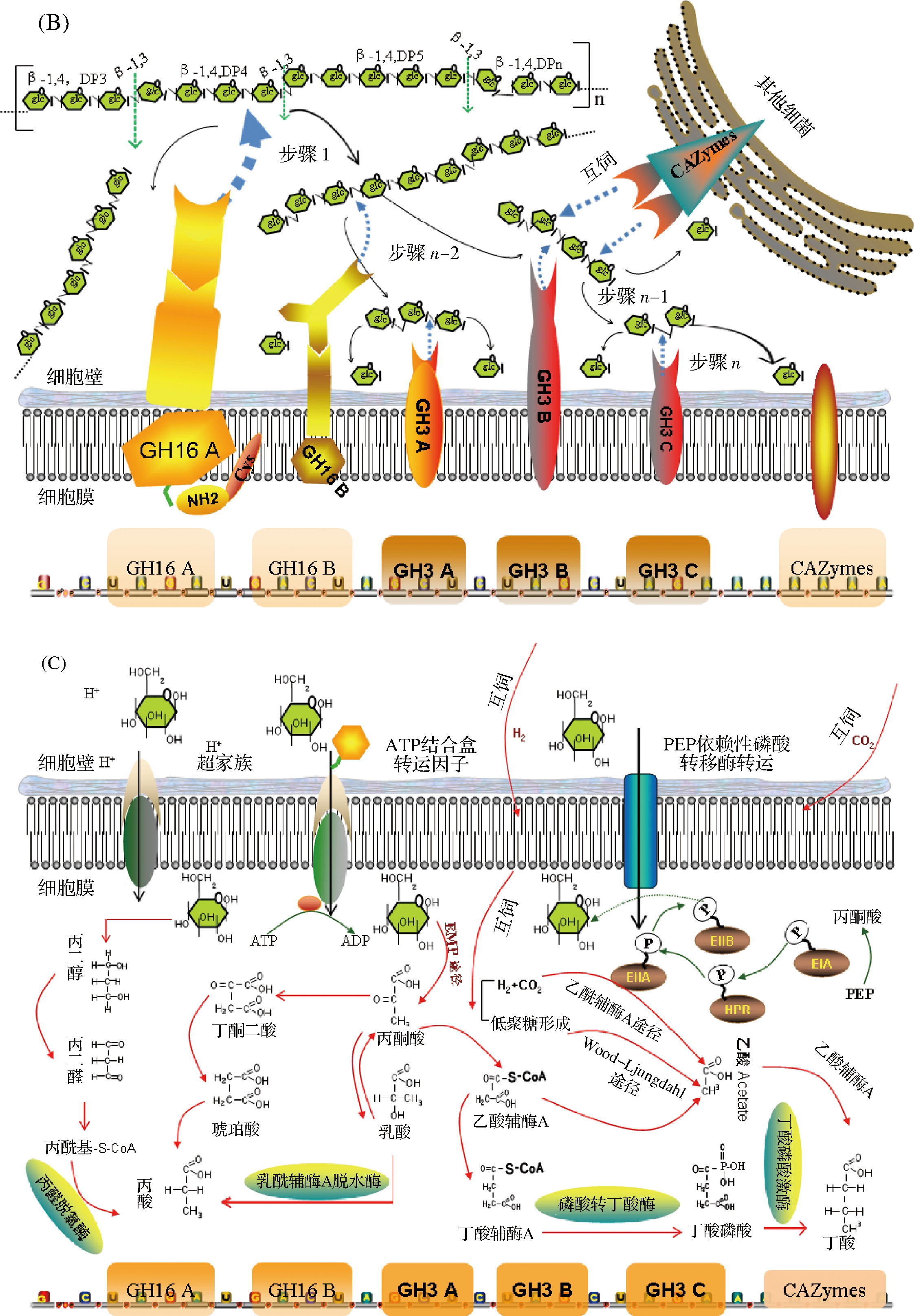
A-识别过程;B-降解过程:C-转运及代谢过程
图3 β-葡聚糖在肠道的降解途径及机理
Fig.3 Pathway and mechanism of β-glucan degradation in intestinal tract
分子经1个β-1,3和β-1-4糖苷键连接而成,后者由4个葡萄糖分子经2个β-1,4和1个β-1-3糖苷键连接,这些限制性消化三糖和四糖则由GH3家族先从非还原性末端逐步将β-1,4糖苷键水解,每水解1次释放1个葡萄糖分子,GH3可完全将GH16不能水解的低聚糖水解为葡萄糖,且仅有G3G(即β-1,3葡聚二糖)为新的中间产物;转运阶段(图3-C),该阶段可通过多种模式进入微生物细胞内:(1)ATP主动运输;(2)ABC转运体(ATP binding cassette transporter, ABC transporter);(3)离子连接运输(major facilitator superfamily);(4)PEP依赖性磷酸转移酶转运(PEP: carbohydrate phosphotransferase system)[43-46]。值得注意的是,在β-葡聚糖的降解的过程中,微生物之间存在竞争关系,为了维持肠道微生态系统的稳定,某些中间产物可被其他微生物利用,这种称之为互饲(cross-feeding)共生作用,对保持肠道各种菌群的相对丰度有重要作用[43]。例如,在β-葡聚糖的降解过程中,部分中间产物可被其他厌氧微生物利用产生H2等终产物,生成的H2与CO2可被甲烷菌利用而生成甲烷,同时,H2的消耗有利于降解β-葡聚糖的微生物继续生长和繁殖。甲烷再经醋酸菌或双歧杆菌发酵生成乙酸或经硫酸盐还原菌产生H2S,乙酸再经乳酸菌发酵可生产丁酸(图3-C),这些生成的SCFAs对宿主具有多种生理功效。研究显示,SCFAs包括乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸及己酸,其中丙酸和丁酸的生物活性较强,SCFAs能与肠道上皮屏障的完整性、肠道免疫,可减少肠道NH3的释放。生产的丙酸、丁酸等活性物质可通过血液循环进入宿主细胞改善各种代谢性疾病和调节免疫能力[45-46]。
因此,β-葡聚糖被降解为葡萄糖、二糖及低聚糖,进入微生物细胞内后,并不会立即被微生物直接利用,而是需要进一步参与微生物细胞内的代谢作用才能产生微生物自身所需要的能量和营养物质。其中葡萄糖可参与EMP等多条途径,或与其他微生物之间的共生关系产生SCFAs(图3-C)[47]。目前,关注较多的SCFAs为乙酸、丙酸和丁酸,其中乙酸含量可占总SCFAs的一半以上,丰度最高,其代谢主要有2条途径,肠原杆菌通过乙酸辅酶途径(acetyl-CoA pathway)将H2和CO2或蚁酸合成乙酸,该路径合成的乙酸占多数;多聚乙酰细菌(acetogenic bacteria)通过Wood-Ljungdahl途径(Wood-Ljungdahl pathway)将低聚糖降解为乙酸,该途径生成的乙酸约占1/3。然而,丙酸和丁酸受到更多的关注,丙酸可通过3条途径形成,琥铂酸途径(succinate pathway):甲基丙二酸单酰辅酶A经脱羧作用变为丙酰辅酶A,该途径在厚壁菌门和拟杆菌门细菌中均有存在;丙烯酸酯途径(acrylate pathway):乳酸经过乳酸脱水酶及后续酶反应生成丙酸;丙二醇经丙二醛脱氢酶还原为丙二醛,辅酶A依赖的丙醛脱氢酶将丙二醛转变为丙酰基辅酶A,再经后续反应转化为丙酸,其中琥铂酸途径为主导途径。丁酸生成途径主要包括丁酸激酶途径和丁酸辅酶A:乙酸辅酶A转移酶途径,前者利用磷酸转丁酸酶(phosphotransbutyrylase)和丁酸激酶(butyrate kinase enzymes)将丁酸辅酶A转变为丁酸,该途径不是常见代谢方式,主要限于一些粪球菌属(Coprococcus species),而后者中丁酸辅酶A经过一步酶反应即转变为丁酸,该途径存在于肠道大多数产丁酸细菌(如Faecalibacterium, Eubacterium,及Roseburia)[45-47]。值得注意的是,同时产丁酸和丙酸的微生物并不多见,仅在少许厌氧菌中出现。
4 加工对β-葡聚糖理化性质的影响
β-葡聚糖具有多种生理功效因而其具有较好的应用前景,如可用作伤口敷料、牙周炎等药物载体、饲料、化妆品和食品增稠剂等[2, 4]。但在加工中,β-葡聚糖的结构与性质会受到加工方式的影响(表4),如热处理、机械加工、非热处理、生物处理等。
表4 加工方式对β-葡聚糖理化性质的影响
Table 4 Effect of processing methods on the physicochemical property of β-glucans

加工方式释放率(得率)分子量结构分布黏度溶解性功能特性热处理降低增加不显著不显著增加增强乳化特性、脂肪结合能力等增强非热处理增加降低破坏-降低增强溶胀力降低,乳化性、起泡性、发泡性等增强机械加工增加降低DP3/DP4增加降低增加增强持水力降低酶处理增加降低---增强持水力降低,溶胀力、脂肪结合能力增强
4.1 热处理对β-葡聚糖理化性质的影响
研究表明,蒸煮、高压加热、微波、红外、焙烤等等热处理对总β-葡聚糖的含量无显著影响,但其理化性质如分子量、水合作用及黏度等会受到不同程度的影响。
常压蒸汽、高压蒸汽、热风焙烤及红外焙烤热处理不会影响β-葡聚糖的含量及分布,但可增加β-葡聚糖分子量[10]。燕麦皮β-葡聚糖粗品与燕麦粉、燕麦片(β-葡聚糖含量均为0.5%)相比,在未煮制之前,其β-葡聚糖的释放率分别为55.2%、55.0%、50.2%,煮制之后释放率分别为55.2%、28.2%、21.6%;当β-葡聚糖含量增加到1.0%时,煮制后其释放率均显著低于未煮制的释放率,但重均分子量呈增加趋势;煮制之后粗燕麦β-葡聚糖在体外消化过程中的黏度降低,燕麦片和燕麦粉的黏度增加,但3者的最终黏度基本相同[49-50]。在用糯大麦制得的意大利面条中,总β-葡聚糖含量在9.7%~9.9%,原粉可溶性β-葡聚糖占57.7%。加热煮制之前,新鲜面条和干燥面条中可溶性β-葡聚糖分别占18.7%和9.6%,而黏度仅有17 cp,相当于大麦原粉的1/17;加热煮制后,其含量在新鲜面条和干燥面条中分别占83.1%和67.3%,后者的平均分子量达1163×103 g/mol,比在大麦原粉中的分子量高122%,黏度相当于大麦原粉的4倍[51]。说明常规加热处理不会影响β-葡聚糖的总含量,但会增加其溶解性和分子量,不过分子有聚集效应而降低其释放度。也有研究表明,焙烤对面包中β-葡聚糖的分子量及结构没有显著影响[1]。另外,在长时间(40 h)加热条件下,β-葡聚糖可与食品体系中的氨基酸或多肽发生美拉德反应而形成复合物,该复合物的表观溶胀黏度、乳化特性、溶胀能力、脂肪结构能力均得到显著增强[52]。
4.2 非热处理对β-葡聚糖理化性质的影响
燕麦β-葡聚糖经γ-射线辐照(15 kGy)后,其分子量由自然状态的200 kDa降低到45 kDa,黏度降低,持水力、溶解性、抗氧化性、抗肿瘤作用及降低餐后血糖作用均增强,且在正常细胞中无毒性[3]。焙烤酵母β-葡聚糖的平均分子量、溶胀能力、粘度均随着辐射剂量(5~50 kGy)的增加而降低,而脂肪结合能力、乳化性质、起泡性质、胆汁酸结合能力及抑菌活性却增强[49]。酶结合超声处理可提高β-葡聚糖的得率[10]。
4.3 机械加工对β-葡聚糖理化性质的影响
粉碎、挤压、搅拌及辊压是常采用的机械加工方式,粉碎物料粒度对β-葡聚糖的释放和分子量大小分布也有影响,颗粒越小,β-葡聚糖的释放度越高[50]。相比于粗糙颗粒,含有小颗粒燕麦麸皮的面包中,β-葡聚糖得率和黏度较高,但分子量较小,聚合度较低。将青稞全麦颗粒粉碎并进行分级,小颗粒粉所得β-葡聚糖的峰值分子量较低,即过度研磨会降低β-葡聚糖的分子量;辊压、挤压与粉碎类似,可以增加β-葡聚糖的得率,但会降低其分子量[53]。在加工含β-葡聚糖面包时,面团混合搅拌时间与β-葡聚糖的分子量呈负相关性,DP3/DP4的比例会适当增加[1];超细粉碎可提高燕麦β-葡聚糖的分子量和溶解性,但会降低持水能力和多分散性系数[54]。说明机械加工不仅对β-葡聚糖含量有一定影响,对其理化性质也有影响。
4.4 生化处理对β-葡聚糖理化性质的影响
淀粉酶的水解可使颗粒表面的淀粉分散并吸收外围的水分,从而增加了β-葡聚糖释放量,但长时间的水解会使β-葡聚糖内源酶溶出而降低β-葡聚糖的分子量[50]。同样,纤维素酶可以增加燕麦β-葡聚糖的溶解度,但会使其持水能力降低[54]。发酵也会对β-葡聚糖分子量及结构产生一定的影响[1]。焙烤酵母中的β-葡聚糖经热水、蛋白酶及脂肪酶处理后,其溶胀能力、水合能力及脂肪吸附能力最高可增加252.9%、138.4%和138.8%。与酶降解相比,酸水解可降低β-葡聚糖水解产物的聚合度[5]。
总体而言,热处理可降低-β葡聚糖的得率,增加分子量,增强乳化特性、黏度及溶解性;非热处理可增加得率和溶解度,降低分子量,理化特性也得到增强;机械加工与酶处理的影响比较类似,均可增强得率,而降低分子量及理化特性。这说明加工处理有利于β-葡聚糖分子从其体系中溶出,提高得率,其机理可能是细胞壁与细胞膜因高温而被破坏,增加了β-葡聚糖从细胞中释放的几率,同时,高温可使淀粉颗粒糊化及蛋白分子变性,降低了淀粉分子、蛋白分子与葡聚糖分子间的相互作用,从而增加了β-葡聚糖分子量的得率。但加工过程会改变其结构及理化性质,主要机理可能是在加工过程中,其长链分子发生断裂,分子间的缔合作用因加工而失去部分驱动力,分子的线性特性减弱,从而使其分子量降低,分子量分布范围也随之降低,分子分散性更强,暴露出更多的羟基,溶解性增强而持水力降低[1,49,51,54]。同时,较好的溶解性或构象的变化增强了其在生命体内的移动性,能高效地被生命体肠道微生物利用,从而增强了其生物活性。另外,热处理之所以会降低得率,可能是因为热处理如焙烤会使原料发生一定的炭化,而黏度的增加可能是因为热处理迫使其分子间发生聚合作用,抗流性增强[55-56]。
随着现代食品加工技术和设备的发展,用于富含β-葡聚糖的食物的加工方式会越来越多,如:物理加工技术中的蒸汽热处理、干热处理、高压、挤压、辐照、微波、红外、超声波等,化学加工技术中的酸碱处理、有机修饰等,以及生物技术中的发酵及酶处理。这些加工处理技术对食物中的β-葡聚糖是否产生分解破坏,分解的作用机理如何,分解产物对食品品质和食用安全性是会产生什么样的影响,都需要进一步深入研究。
5 展望
β-葡聚糖广泛分布在天然植物和微生物中,是一种具有抗肿瘤、抗炎、调节免疫、降血糖、降血脂等多种生物学活性的多糖,受到国内外广大科技工作者和健康行业的关注,被应用于医药、功能性食品、食品添加剂、化妆品添加剂、饲料添加剂等健康产业中。天然植物和微生物中β-葡聚糖含量、结构、理化性质、生物活性等受原料种类、品种、生长环境的影响而存在显著差异,这种差异对β-葡聚糖生理功效和应用特性有何影响,还需进一步深入研究。同时,富含β-葡聚糖的原料在加工过程中,由于受到物理、化学、生物等因素的影响,其分子结构、理化特性、生物活性均会受到不同程度的改变。但这些改变的化学机理、生物学机理以及对食品品质和食用安全性的影响,也是值得进一步深入研究,以提高富含β-葡聚糖食品的食用品质、营养品质和消费者的接受度。
[1] ANDERSSON A A M, ARMÖ E, GRANGEON E, et al. Molecular weight and structure units of (1-3, 1-4)-β-glucans in dough and bread made from hull-less barley milling fractions[J]. Journal of Cereal Science, 2004, 40(3): 195-204.
[2] ZHU Fengmei, DU Bin, XU Baojun. A critical review on production and industrial applications of beta-glucans[J]. Food Hydrocolloids, 2016, 52:275-288.
[3] HUSSAIN P R, RATHER S A, SURADKAR P P. Structural characterization and evaluation of antioxidant, anticancer and hypoglycemic activity of radiation degraded oat (Avena sativa) β- glucan[J]. Radiation Physics & Chemistry, 2018,144:218-230.
[4] GILDOMAR L V J, Flávia O DL, ELISANGELA F B, et al. Extraction optimization and antinociceptive activity of (1-3)-β-D-glucan from Rhodotorula mucilaginosa [J].Carbohydrate Polymers, 2014, 105(1): 293-299.
[5] BORCHANI C, FONTEYN F, JAMIN G, et al. Physical, functional and structural characterization of the cell wall fractions from baker’s yeast Saccharomyces cerevisiae[J].Food Chemistry, 2016,194: 1 149-1 155.
[6] MORENOMENDIETA S, GUILLÉN D, HERN NDEZPA-NDO R, et al. Potential of glucans as vaccine adjuvants: A review of the α-glucans case[J]. Carbohydrate Polymers, 2017, 165:103-114.
NDEZPA-NDO R, et al. Potential of glucans as vaccine adjuvants: A review of the α-glucans case[J]. Carbohydrate Polymers, 2017, 165:103-114.
[7] PARK J S, LIM Y M, BAIK J, et al. Preparation and evaluation of β-glucan hydrogel prepared by the radiation technique for drug carrier applications[J]. International Journal of Biological Macromolecules, 2018, 118(Pt A). DOI: 10.1016/j.ijbiomac.2018.06.068.
[8] ZHU F, DU B, XU B. A critical review on production and industrial applications of beta-glucans[J]. Food Hydrocolloids, 2016, 52:275-288.
[9] IZYDORCZYK M S, STORSLEY J, LABOSSIERE D, et al. Variation in total and soluble beta-glucan content in hulless barley: effects of thermal, physical, and enzymic treatments[J]. Journal of Agricultural and Food Chemistry, 2000, 48(4):982-989.
[10] LAZARIDOU A, BILIADERIS C G. Molecular aspects of cereal β-glucan functionality: Physical properties, technological applications and physiological effects[J]. Journal of Cereal Science, 2007, 46(2):101-118.
[11] SKENDI A, BILIADERIS C G, LAZARIDOU A, et al. Structure and rheological properties of water soluble β-glucans from oat cultivars of Avena sativa and Avenabysantina[J]. Journal of Cereal Science, 2003, 38(1):15-31.
[12] LIN S, GUO H, GONG J D B, et al. Phenolic profiles, β-glucan contents, and antioxidant capacities of colored Qingke (Tibetan hulless barley) cultivars[J]. Journal of Cereal Science, 2018, 68(81):69-75.
[13] MOZA J, GUJRAL H S. Starch digestibility and bioactivity of high altitude hulless barley[J]. Food Chemistry, 2016, 194:561-568.
[14] MIKKELSEN M S, MEIER S, JENSEN M G, et al. Barley genotypic β-glucan variation combined with enzymatic modifications direct its potential as a natural ingredient in a high fiber extract[J]. Journal of Cereal Science, 2017, 67(75):45-53.
[15] BENITO-ROM N
N  , ALONSO E, COCERO M J. Pressurized hot water extraction of β-glucans from waxy barley[J]. Journal of Supercritical Fluids, 2013, 73:120-125.
, ALONSO E, COCERO M J. Pressurized hot water extraction of β-glucans from waxy barley[J]. Journal of Supercritical Fluids, 2013, 73:120-125.
[16] TEO C C, TAN S N, YONG J W, et al. Pressurized hot water extraction (PHWE)[J]. Journal of Chromatography A, 2010, 1217(16):2 484-2 494.
[17] SALGADO M, RODR GUEZ-ROJO Soraya, REIS R L, et al. Preparation of barley and yeast β-glucan scaffolds by hydrogel foaming: Evaluation of dexamethasone release[J]. The Journal of Supercritical Fluids, 2017(127):158-165.
GUEZ-ROJO Soraya, REIS R L, et al. Preparation of barley and yeast β-glucan scaffolds by hydrogel foaming: Evaluation of dexamethasone release[J]. The Journal of Supercritical Fluids, 2017(127):158-165.
[18] SAASTAMOINEN M, HIETANIEMI V, PIHLAVA J M, et al. β-Glucan contents of groats of different oat cultivars in official variety, in organic cultivation, and in nitrogen ferilization trials in Finland[J]. Agricultural & Food Science, 2004, 13(1):68-79.
[19] ROBERT W. WELCH, JANET D. Lloyd. Kernel (1-3) (1-4)-β- D -glucan content of oat genotypes[J]. Journal of Cereal Science, 1989, 9(1):35-40.
[20] CHRISTIAN I. ABUAJAH, AUGUSTINE C. OGBONNA, et al. Variety and germination time effect on total β-glucan, water-insoluble β-glucan, water-soluble β-glucan components and β-glucanase levels in improved sorghum varieties SK5912, KSV8 and ICSV400 before and after malting and their relationships to wort viscosity[J]. Journal of the Institute of Brewing, 2016, 122(1):93-101.
[21] TAMURA M, IMAIZUMI R, SAITO T, et al. Studies of the texture, functional components andinvitrostarch digestibilityof rolled barley[J].Food Chemistry, 2019, 274:672-678.
[22] KHAN A A, GANIA A, MASOODI F A, et al. Structural, rheological, antioxidant, and functional properties of β-glucan extracted from edible mushrooms Agaricusbisporus, Pleurotusostreatus and Coprinusattrimentarius[J].Bioactive Carbohydrates and Dietary Fibre, 2017,11:67-74.
[23] CARBONERO E R, RUTHES A C, FREITAS C S, et al. Chemical and biological properties of a highly branched β-glucan from edible mushroom Pleurotussajor-caju[J]. Carbohydrate Polymers, 2012, 90(2):814-819.
[24] BAGGIO C H, FREITAS C S, MARCON R, et al. Antinociception of β-d-glucan from Pleurotus pulmonarius is possibly related to protein kinase C inhibition[J]. International Journal of Biological Macromolecules, 2012, 50(3): 872-877.
[25] FANG J, WANG Y, LV X, et al. Structure of a β-glucan from Grifolafrondosa and its antitumor effect by activating Dectin-1/Syk/NF- B signaling[J]. Glycoconjugate Journal, 2012, 29(5-6): 365-377.
B signaling[J]. Glycoconjugate Journal, 2012, 29(5-6): 365-377.
[26] SOVRANI V, DE JESUS L I, SIMAS-TOSIN F F, et al. Structural characterization and rheological properties of a gel-like β-D-glucan from Pholiota nameko[J]. Carbohydrate Polymers, 2017, 169:1-8.
[27] FRAUNHOFER M E, GEISSLER A J, WEFERS D, et al. Characterization of β-glucan formation by Lactobacillus brevis TMW 1.2112 isolated from slimy spoiled beer[J]. International Journal of Biological Macromolecules, 2018, 107:874-881.
[28] BAI Junying, REN Yikai, LI Yan, et al. Physiological functionalities and mechanisms of β-glucans[J]. Trends in Food Science & Technology, 2019,88: 57-66.
[29] LI W, CUI S W, WANG Q, et al. Studies of aggregation behaviours of cereal β-glucans in dilute aqueous solutions by light scattering: Part I. Structure effects[J]. Food Hydrocolloids, 2011, 25(2):189-195.
[30] AHMAD A, ANJUM F, ZAHOOR T, et al. Extraction and characterization of beta-D-glucan from oat for industrial utilization[J]. International Journal of Biological Macromolecules, 2010, 46(3):304-309.
[31] KUREK M A, KARP S, STELMASIAK A. Effect of natural flocculants on purity and properties of β-glucan extracted from barley and oat[J]. Carbohydrate Polymers, 2018, 188:60-67.
[32] XU J, INGLETT G E, LIU S X, et al. Micro-heterogeneity and micro-rheological properties of high-viscosity barley β-glucan solutions studied by diffusing wave spectroscopy (DWS)[J]. Food Biophysics, 2016, 11(4):1-6.
[33] HUAN G, SHANG L, MIN L, et al. Characterization, in vitro binding properties, and inhibitory activity on pancreatic lipase of β-glucans from different Qingke (Tibetan hulless barley) cultivars[J]. International Journal of Biological Macromolecules, 2018, 120:2 517-2 522.
[34] AHMED J, THOMAS L, ARFAT Y A. Effects of high hydrostatic pressure on functional, thermal, rheological and structural properties of β-D-glucan concentrate dough[J]. LWT-Food Science and Technology, 2016(70): 63-70.
[35] LI W, CUI S W, WANG Q, et al. Studies of aggregation behaviours of cereal β-glucans in dilute aqueous solutions by light scattering: Part I. Structure effects[J]. Food Hydrocolloids, 2011, 25(2):189-195.
[36] AHMAD M, GANI A, SHAH A, et al. Germination and microwave processing of barley (Hordeum vulgare L.) changes the structural and physicochemical properties of β-D-glucan & enhances its antioxidant potential[J]. Carbohydrate Polymers, 2016(153): 696-702.
[37] VAIKOUSI H, BILIADERIS C G, IZYDORCZYK M S. Solution flow behavior and gelling properties of water-soluble barley (1→3,1→4)-β-glucans varying in molecular size[J]. Journal of Cereal Science, 2004, 39(1):119-137.
[38] LIU Y, ZHANG J, TANG Q, et al. Rheological properties of β-d-glucan from the fruiting bodies of Ganoderma lucidum[J]. Food Hydrocolloids, 2016, 58:120-125.
[39] AGBENORHEVI J K, KONTOGIORGOS V, KIRBY A R, et al. Rheological and microstructural investigation of oat β-glucan isolates varying in molecular weight[J]. International Journal of Biological Macromolecules, 2011, 49(3):0-377.
[40] ZIELKE C, STRADNER A, NILSSON L. Characterization of cereal β-glucan extracts: Conformation and structural aspects[J]. Food Hydrocolloids, 2018, 79: 218-227.
[41] MESSIA M C, ORIENTE M, ANGELICOLA M, et al. Development of functional couscous enriched in barley β-glucans[J]. Journal of Cereal Science, 2019, 85:137-142.
[42] ANNE Salonen, WILLEM M. de Vos. Impact of diet on human intestinal microbiota and health[J]. Annual Review of Food Science and Technology, 2014 (5): 239-262.
[43] MARTENS E C, KELLY A G, TAUZIN A S, et al. The devil lies in the details: how variations in polysaccharide fine-structure impact the physiology and evolution of gut microbes[J]. Journal of Molecular Biology, 2014, 426(23):3 851-3 865.
[44] GONG L, CAO W, CHI H, et al. Whole cereal grains and potential health effects: Involvement of the gut microbiota[J]. Food Research International, 2018, 103:84-102.
[45] TAMURA K, HEMSWORTH G R, DÉJEAN Guillaume, et al. Molecular Mechanism by which prominent human gut bacteroidetes utilize mixed-linkage beta-glucans, major health-promoting cereal polysaccharides[J]. Cell Reports, 2017, 21(7):417-430.
[46] COCKBURN D W, KOROPATKIN N M. Polysaccharide degradation by the intestinal microbiota and its influence on human health and disease[J]. Journal of Molecular Biology, 2016:3 231-3 250.
[47] R OS-COVI
OS-COVI N David, PATRICIA R M, ABELARDO M, et al. Intestinal short chain fatty acids and their link with diet and human health[J]. Frontiers in Microbiology, 2016(7):1-6.
N David, PATRICIA R M, ABELARDO M, et al. Intestinal short chain fatty acids and their link with diet and human health[J]. Frontiers in Microbiology, 2016(7):1-6.
[48] THAMMAKITI S, SUPHANTHARIKA M, PHAESUWAN T, et al. Preparation of spent brewer’s yeastb-glucans for potential applications in the food industry [J]. International Journal of Food Science and Technology, 2004, 39: 21-29.
[49] ASMA A K, ADIL G, MASOODI F A, et al. Structural, thermal, functional, antioxidant & antimicrobial properties of β-d-glucan extracted from baker's yeast (Saccharomyces cereviseae)-Effect of γ-irradiation[J]. Carbohydrate Polymers, 2016, 140(442): 442-450.
[50] GRUNDY M M L, QUINT J, RIEDER A, et al. Impact of hydrothermal and mechanical processing on dissolution kinetics and rheology of oat β-glucan[J]. Carbohydrate Polymers, 2017, 166:387-397.
[51] PAULA R D, ABDEL-AAL E S M, MESSIA M C, et al. Effect of processing on the beta-glucan physicochemical properties in barley and semolina pasta[J]. Journal of Cereal Science, 2017, 75:124-131.
[52] SUN T, QIN Y Y, XIE J, et al. Effect of Maillard reaction on rheological, physicochemical and functional properties of oat β-glucan[J]. Food Hydrocolloids, 2019,89: 90-94.
[53] DJURLE S, ANDERSSON A A M, ANDERSSON R. Milling and extrusion of six barley varieties, effects on dietary fibre and starch content and composition[J]. Journal of Cereal Science, 2016, 72:146-152.
[54] LIU R, LI J, WU T, et al. Effects of ultrafine grinding and cellulase hydrolysis treatment on physicochemical and rheological properties of oat (Avena nuda, L.) β-glucans[J]. Journal of Cereal Science, 2015, 65:125-131.
[55] YAN X, YE R, CHEN Y. Blasting extrusion processing: The increase of soluble dietary fiber content and extraction of soluble-fiber polysaccharides from wheat bran[J]. Food Chemistry, 2015, 180:106-115.
[56] REGAND A, TOSH S M, WOLEVER T M S, et al. Physicochemical properties of beta-glucan in differently processed oat foods influence glycemic response[J]. Journal of Agricultural and Food Chemistry, 2009, 57(19):8 831-8 838.