细菌芽孢因其特有的结构,对物理、化学等胁迫条件具有极强抗性,常见单一杀菌方法和条件都很难将其杀灭[1-4]。热处理是一项传统杀菌技术,因其高效、清洁、成本低廉的特点,至今仍被广泛应用。
但是过高的杀菌温度往往会改变食品质构,甚至劣化食品的风味或品质[5-8]。使用中温热杀菌能够避免以上情况发生,但杀菌效果较差。乙醇亦是常见的杀菌剂,存在于许多食品中,它能够使细菌细胞膜脱水、钝化与生理活动相关的蛋白质,进而影响细胞活性使之死亡[9-11]。
热处理和乙醇处理能够改变酶的活性,方志超等[12]研究发现热处理可以有效抑制酶活性,且作用时间越长效果越明显,热处理后多酚氧化酶分子结构被破坏。刘玉芳[13]研究蛋白酶在乙醇溶液中的性质和结构发现,随着乙醇体积分数的增大,2种蛋白酶稳定性均呈下降趋势,蛋白酶二三级结构均发生改变。就枯草芽孢杆菌皮层裂解酶而言,其分离纯化方法已较为成熟[14],但关于热和乙醇处理对其影响的相关报道较少。研究表明,中温(80 ℃)加热或乙醇处理的单一方法并不能杀灭芽孢,而中温结合乙醇处理却能够杀灭芽孢[3]。因此,猜想中温结合乙醇处理能够灭活芽孢皮层裂解酶等或降低其活性,使得芽孢无法萌发,进而使细菌死亡。为证实这一猜想,本文以枯草芽孢杆菌芽孢皮层裂解酶为研究对象,研究中温结合乙醇处理对其活性和结构的影响,为进一步阐明芽孢杀灭机理奠定基础。
1 材料与方法
1.1 主要材料与试剂
枯草芽孢杆菌(Bacillus subtilis),编号As 1.433,中国普通微生物菌种保藏管理中心(CGMCC);枯草芽孢杆菌芽孢皮层裂解酶(纯度>95%),南京钟鼎生物技术公司;营养琼脂,北京奥博星生物公司;促芽孢生长锰盐营养琼脂培养基,向营养琼脂中加入MnSO4·H2O(Mn2+质量浓度为50 mg/L),调节pH值至中性后灭菌备用;平板计数琼脂(plate count agar, PCA),青岛海博生物技术公司;Tris-HCl缓冲液,北京索莱宝科技公司;2-巯基乙醇(分析纯),上海海曲化工公司;无水乙醇(分析纯),天津元力化学试剂公司;十二烷基硫酸钠(分析纯),上海阿拉丁公司;磷酸氢二钠、磷酸二氢钠、四硼酸钠(均为分析纯),天津大茂化学试剂厂;溴化钾,上海广诺化学科技公司。
1.2 主要仪器与设备
AL204型电子天平,梅特勒-托利多仪器(上海)有限公司;DSX-280B型高压灭菌锅,上海申安医疗器械厂;LRH系列生化培养箱,上海一恒科学仪器公司;Scientz-1LS真空冷冻干燥仪,宁波新芝生物科技公司;TG16-W医用离心机,湖南湘仪实验室仪器开发公司;HWS-12型电子恒温水浴锅,上海合恒仪器设备公司;FE28型PH计,梅特勒-托利多(上海)公司;970 CRT荧光分光光度计,上海仪电分析仪器公司;Spectrum Two型傅立叶变换红外光谱仪,美国PerkinElmer公司。
1.3 实验方法
1.3.1 芽孢悬浮液的制备
芽孢的制备参照GAO[15]的方法,将已活化的枯草芽孢杆菌接入营养琼脂培养基,在灭菌后的促芽孢生长锰盐营养琼脂试管斜面上划线培养,37 ℃恒温培养7 d后,使用无菌蒸馏水洗涤并收集菌体,离心后再洗涤3次(4 ℃、8 000 r/min、15 min),离心浓缩(8 000 r/min、15 min)重悬于无菌蒸馏水中的芽孢,测定菌液吸光度并调节芽孢浓度约为1.5×109 CFU/mL,4℃保存,使用时稀释芽孢浓度至108 CFU/mL,一个月内使用。
1.3.2 中温结合乙醇处理枯草芽孢杆菌及芽孢皮层裂解酶
吸取1 mL按1.3.1步骤处理的芽孢悬浮液至50 mL聚四氟乙烯离心管,分别加入9 mL体积分数为30%、75%的乙醇溶液,设置温度梯度为4、37、50和80 ℃;对照组加入9 mL Tris-HCl(pH=8.0,0.1 mol/L)缓冲液,设置温度为常温及80 ℃;恒温水浴处理20 min后立即取出置于冰水浴中冷却至常温。
称取1.5 mg芽孢皮层裂解酶冻干粉,加入1mL Tris-HCl缓冲液,分别加入体积分数为30%、75%的乙醇溶液4 mL,使得酶液终浓度为0.3 mg/mL,设置温度梯度为4、37、50和80 ℃。对照组则加入5 mL Tris-HCl缓冲液,设置温度为常温及80 ℃;恒温水浴处理20 min后立即取出置于冰水浴中冷却至常温。
1.3.3 中温结合乙醇处理杀灭枯草杆菌芽孢效果
取1.3.2处理后的枯草芽孢杆菌悬浮液,以缓冲液常温处理组为对照,参考食品安全国家标准GB4789.2—2016《食品微生物学检验菌落总数测定》[16],进行倾注计数并计算菌落总数对数值及杀灭率。
1.3.4 芽孢皮层裂解酶的活性测定
1.3.4.1 脱芽孢衣芽孢的制备
脱芽孢衣芽孢的制备在文献[17]基础上进行了改进。用pH值为10.0,浓度为0.1 mol/L的硼酸盐缓冲液(含有30 mmol/L十二烷基硫酸钠、0.2 mol/L 2-巯基乙醇)在40 ℃处理枯草芽孢杆菌芽孢,8 h后用无菌蒸馏水离心(8 000 r/min,4 ℃,15 min)洗涤至净。
1.3.4.2 皮层裂解酶活性测定
酶活性分析参照MAKINO[18]和MIYATA[19]方法,将脱孢衣芽孢悬浮液预先于32 ℃恒温水浴20 min。取脱孢衣芽孢悬浮液2 mL与2 mL经不同处理的酶液混合,32 ℃反应80 min后测定OD600值,计算酶活。对照组为2 mL无菌水和2 mL脱芽孢衣芽孢悬浮液。酶活性通过脱芽孢衣芽孢悬浮液的OD600值的减少量来测定,即以每分钟OD600值变化0.001所需的酶量为一个活性单位(U)。计算公式为:
(1)
式中:X,酶活,U/L;V,参与反应的酶量,mL;t,反应时间,min。
1.3.5 皮层裂解酶的荧光光谱测定
取1.3.2处理后的皮层裂解酶2.5 mL在280 nm激发波长(λex),波长范围295~450 nm,扫描速度240 nm/min,发射和激发光路的狭缝宽度均为10 nm条件下测定皮层裂解酶溶液的荧光光谱。
1.3.6 皮层裂解酶的傅立叶红外变换光谱(fourier transform infrared spectroscopy, FTIR)扫描
采用傅立叶变换红外光谱仪对皮层裂解酶进行光谱采集。称取2 mg的1.3.2处理后的皮层裂解酶溶液,冻干,于玛瑙研钵中磨粉,再与干燥的溴化钾粉末(100 mg,粒度200目)混合均匀,压片后待测。设置扫描范围为4 000~400 cm-1,分辨率为4 cm-1,波数精度为0.01 cm-1,平衡时间为300 s,扫描次数为32次。使用Peakfit version 4.12软件在酰胺I带校正基线,Gaussian法去卷积,做二阶导数拟合,多次拟合使残差最小[20]。计算枯草杆菌皮层裂解酶二级结构含量。
1.4 数据处理与分析
使用Office 2010计算数据,Origin 2018作图,SPSS 25.0进行数据分析。所有实验重复3次,实验结果均以平均值±标准差表示。
2 结果与讨论
2.1 中温结合乙醇处理对枯草芽孢杆菌的杀灭效果
中温结合乙醇处理后枯草芽孢杆菌的活菌数变化见图1,缓冲液常温及80 ℃处理20 min后,活菌数分别为2.9×108、2.8×108 CFU/ml。可见,单一的80 ℃热处理灭菌方式并不能有效杀灭枯草芽孢杆菌。郭全有等[21]研究了虾源地衣芽孢杆菌在不同温度水浴杀菌前后孢子数量变化,发现80、85 ℃水浴条件下,孢子存活率仅下降了1.26%、1.18%。李素等[22]研究发现,采用90 ℃及95 ℃对凝结芽孢杆菌芽孢热胁迫致死效果较差,加热40 min后致死率仅为47.55%、54.18%。芽孢杆菌较高的耐热性在上述文献和本文实验中都得到再次印证。随着温度升高,菌落数总体呈现下降趋势,除50 ℃时体积分数为30%、75%乙醇处理组无显著差异外(P<0.05),4、37、80 ℃温度条件下75%乙醇(体积分数)处理的灭菌效果优于30%(体积分数)处理组。杀灭率依次为19.2%、9.2%、45.6%、92.7%、28.7%、23.5%、43.9%和94.8%。与37 ℃相比,4 ℃时芽孢处于休眠状态,增殖率低下,从而表现出杀灭率较高的状态。80 ℃时,体积分数为30%、75%乙醇处理组的活菌数最低,说明此时杀菌效果最强。
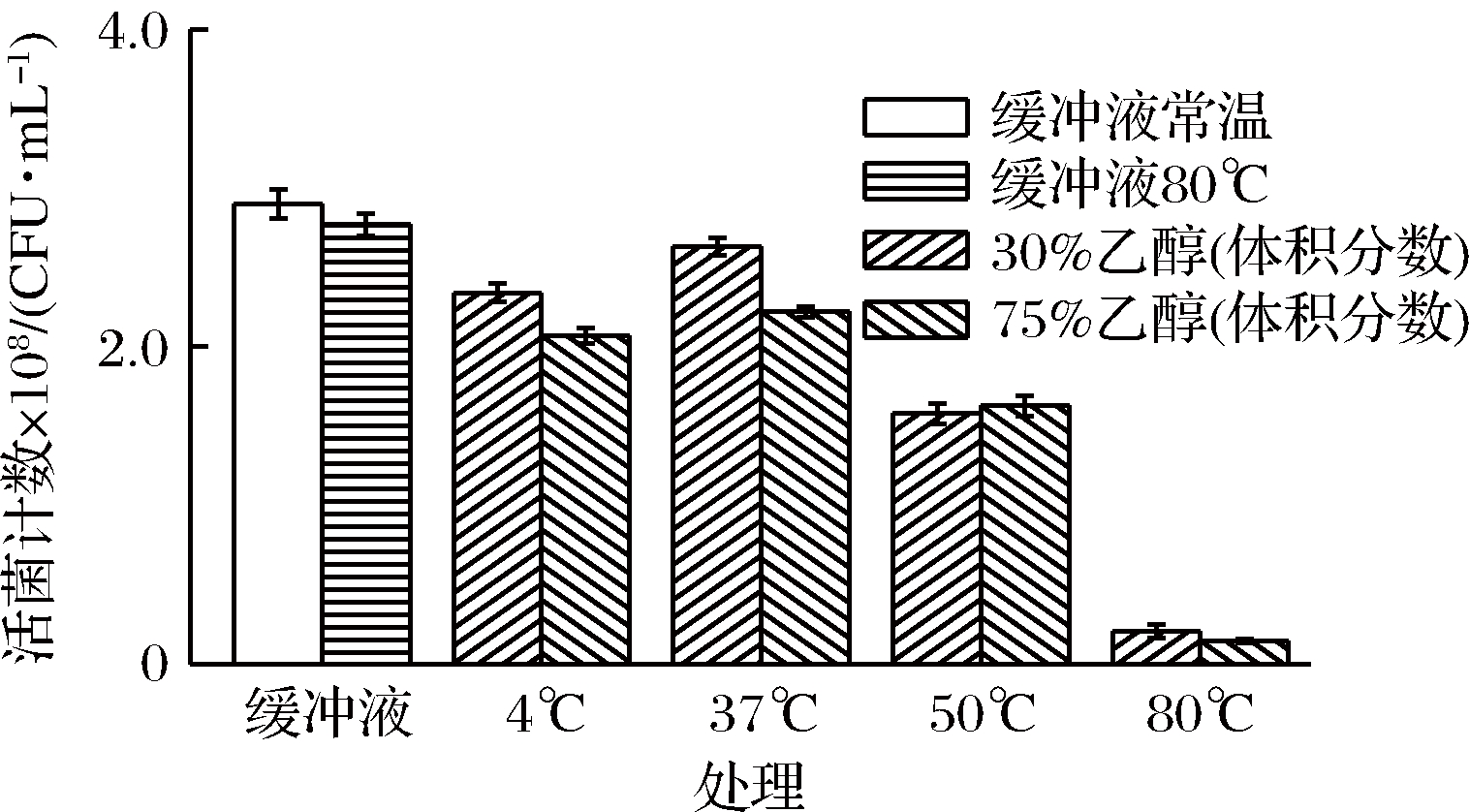
图1 中温结合乙醇杀灭枯草芽孢杆菌效果
Fig.1 Effect of medium temperature and ethanol treatment to kill Bacillus subtilis
2.2 中温结合乙醇处理对枯草芽孢杆菌皮层裂解酶活性的影响
温度结合体积分数为30%、75%乙醇处理后枯草芽孢杆菌皮层裂解酶的活性变化如图2所示。
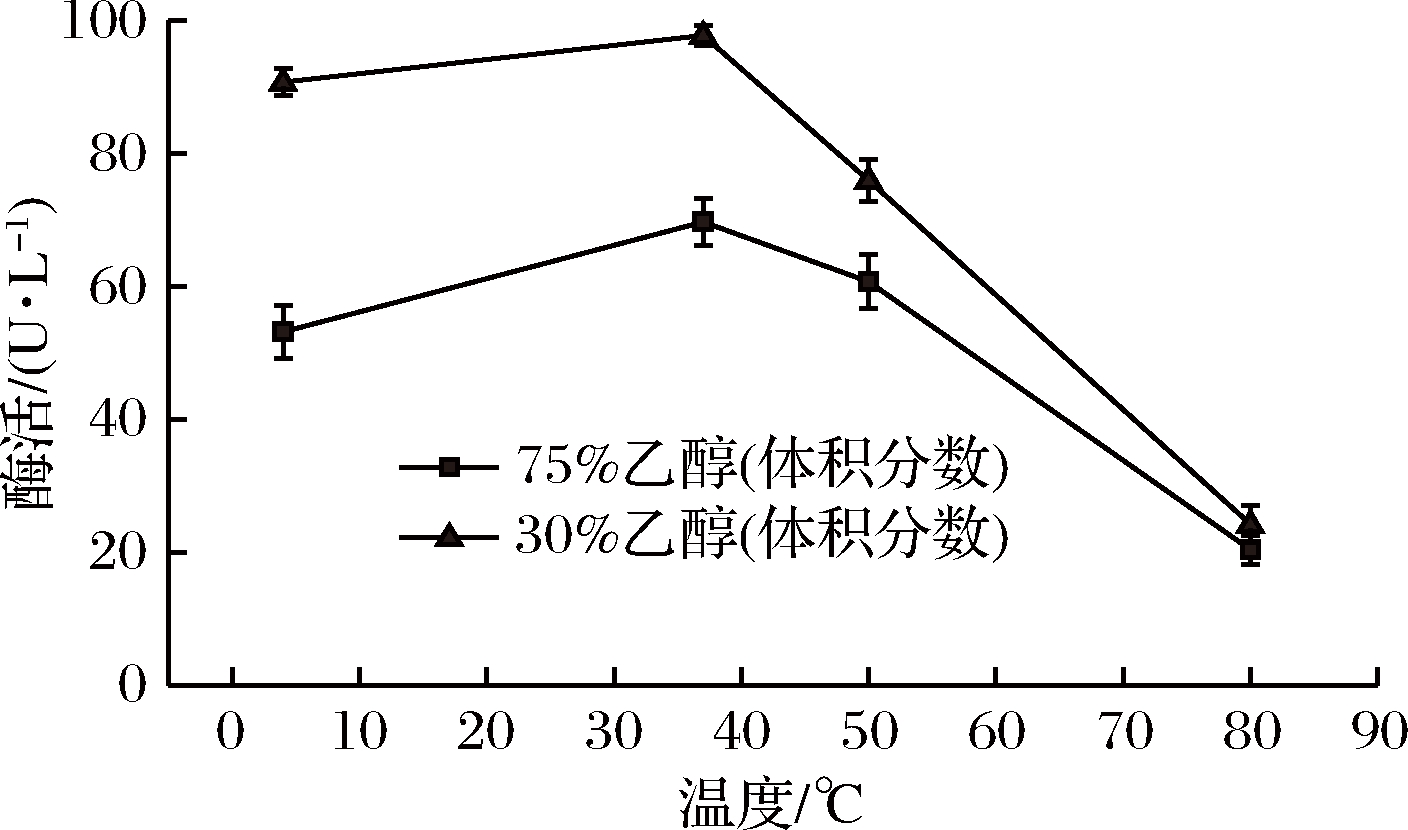
图2 中温结合乙醇对皮层裂解酶的活性的影响
Fig.2 Effect of medium temperature and ethanol treatment on cortex-lytic enzyme activity
可以看出,温度为4 ℃时,30%、 75%的乙醇溶液中皮层裂解酶活性分别为(90.8±2.07)、(53.2±4.04) U/L;37 ℃处理时,体积分数为30%、75%的乙醇溶液中皮层裂解酶活性均为最佳,活性分别为(97.8±1.54)、(69.8±3.56) U/L;当温度超过50 ℃时,皮层裂解酶活性迅速下降,分别降至(76.0±3.20)、(60.8±4.07) U/L;温度80 ℃时,皮层裂解酶基本失活,活度仅为(24.3±2.73)、(20.4±2.17) U/L。随着处理温度的升高,酶活性呈现先增加后下降的趋势,与图1中灭菌效果基本一致。以缓冲液常温处理为对照组,仅缓冲液80 ℃处理后,枯草芽孢杆菌皮层裂解酶的活性下降为(62.5±1.39) U/L,酶活性显著下降(P<0.05),但此时酶活性仍明显高于80 ℃结合不同体积分数乙醇处理组,结果表明,中温结合乙醇处理能够更为有效地抑制皮层裂解酶活性。
陈娟等[23]研究发现随着热处理温度升高或时间的延长,椰子水中氧化物酶和多酚氧化酶的相对酶活力均随之降低,90 ℃和95 ℃热处理4 min后,活力分别降低90%以上。吴秋昊[24]通过微波加热处理核桃仁后,其脂氧合酶、过氧化物酶和过氧化氢酶的活性均比未处理样品的酶活性显著降低(P<0.05),微波功率越大,酶活性降低越快。酶类物质大多对温度较敏感,高温和低温都能降低其活性,但加入乙醇处理时酶活性的变化则不尽相同。如用乙醇处理西蓝花后酸性转化酶、蔗糖合酶、蔗糖磷酸合酶活性有增加也有下降[25]。同样,乙醇处理后的蓝莓中苯丙氨酸解氨酶呈现上升趋势[26]。
2.3 中温结合乙醇处理对枯草芽孢杆菌皮层裂解酶荧光光谱的影响
荧光光谱的变化与酶分子色氨酸和酪氨酸等生色基团的微环境等多方面因素相关。分子中从Tyr残基到Trp残基之间发生了能量转移,从而导致Tyr残基的荧光熄灭和Trp残基的荧光增加,其峰位在325~350 nm之间[27]。中温结合乙醇的皮层裂解酶荧光光谱见图3。
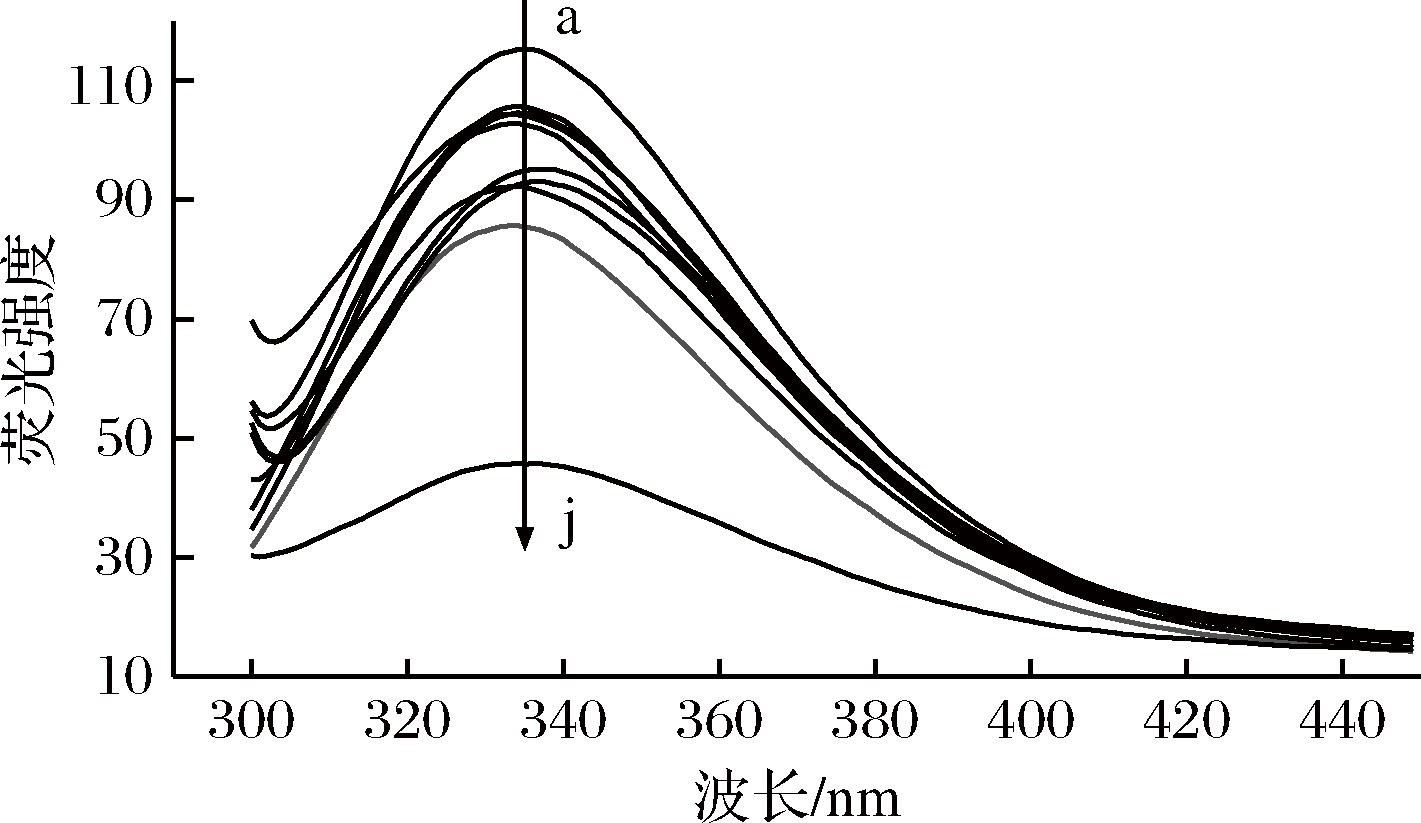
a-缓冲液、常温;b-30%乙醇、4 ℃;c-30%乙醇、37 ℃;d-30%乙醇、50 ℃;e-缓冲液、80 ℃;f-75%乙醇、4 ℃;g-30%乙醇、80 ℃;h-75%乙醇、37 ℃;i-75%乙醇、50 ℃;j-75%乙醇、80 ℃(乙醇浓度均为体积分数,下同)
图3 中温结合乙醇处理的皮层裂解酶荧光光谱图
Fig.3 Fluorescence spectra of cortex-lytic enzyme after medium temperature and ethanol treatment
如图3所示,色氨酸最大吸收峰位置红移了3 nm。与缓冲液常温处理相比,缓冲液80 ℃处理时皮层裂解酶荧光强度出现下降,表明中温处理在一定程度上改变了其结构。但改变幅度并不如加入乙醇处理后的荧光强度降低剧烈,说明乙醇的加入是改变皮层裂解酶结构的重要因素。中温结合30%乙醇(体积分数)处理组的皮层裂解酶荧光强度高于中温结合75%乙醇(体积分数)处理组,且不同温度处理后的皮层裂解酶荧光强度顺序为:80 ℃<50 ℃<37 ℃<4 ℃,表明随着处理温度的增加皮层裂解酶结构变化程度逐渐加剧。研究认为,随着乙醇体积分数的增大,酸性酶发生微弱的红移,分子中酪氨酸和色氨酸残基附近的微环境发生变化,酶结构发生变化[28]。中温结合乙醇处理后的荧光光谱变化亦表明皮层裂解酶分子结构发生了变化,且75%乙醇(体积分数)对皮层裂解酶结构的影响更大。
2.4 中温结合乙醇处理对皮层裂解酶红外光谱的影响
中温结合乙醇处理后的皮层裂解酶红外光谱如图4。与对照组相比,处理后的皮层裂解酶红外光谱酰胺Ⅰ带(1 700~1 600 cm-1)出现2个吸收峰;1 666 cm-1附近的吸收峰未发生变化。1 626 cm-1处吸收峰红移至1 630 cm-1。酰胺Ⅱ带(1 600~1 500 cm-1)处无峰;酰胺Ⅲ带(1 301~1 229 cm-1)吸收峰从1 293 cm-1红移至1 296 cm-1。温度结合乙醇浓度处理破坏了分子内氢键,使峰位向高波数移动。
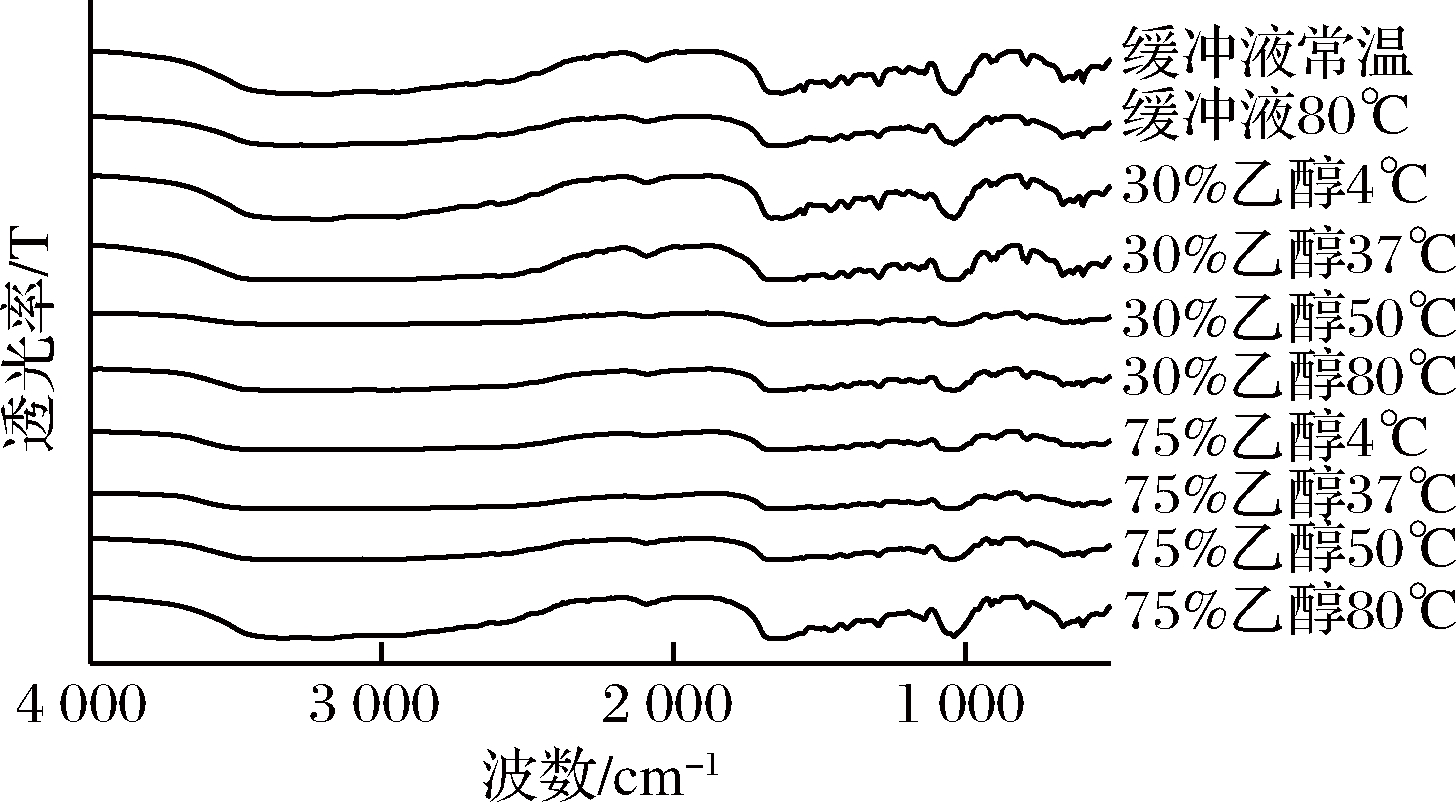
图4 中温结合乙醇处理对皮层裂解酶傅立叶红外光谱的影响
Fig.4 Effects of medium temperature and ethanol treatment on the FTIR of cortex-lytic enzyme
对处理后的皮层裂解酶红外光谱酰胺I带进行拟合,得到拟合曲线见图5。枯草芽孢杆菌皮层裂解酶蛋白酰胺Ⅰ带是多氨基酸残基经重叠形成的宽峰。利用二阶导数及Gaussian法去卷积拟合得到10个子吸收峰。对各子峰进行确认,计算峰面积及含量,结果见表1。
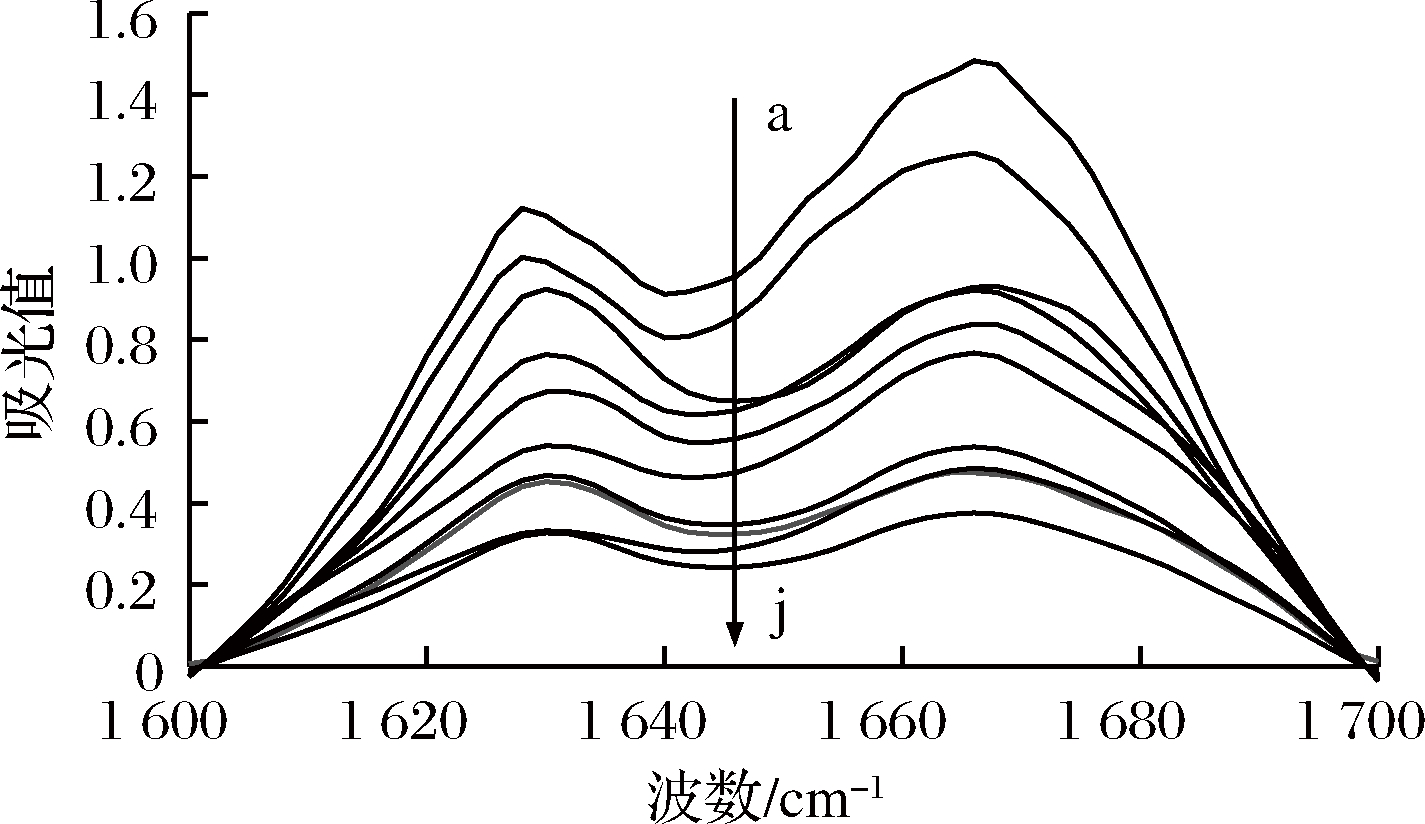
a-缓冲液、常温;b-30%乙醇、4 ℃;c-30%乙醇、37 ℃;d-30%乙醇、50 ℃;e-缓冲液、80 ℃;f-30%乙醇、80 ℃;g-75%乙醇、4 ℃;h-75%乙醇、37 ℃;i-75%乙醇、50 ℃;j-75%乙醇、80 ℃
图5 中温结合乙醇处理皮层裂解酶酰胺I带曲线拟合谱图
Fig.5 Curve fitting spectra of cortex-lytic enzyme amide I treated with medium temperature and ethanol
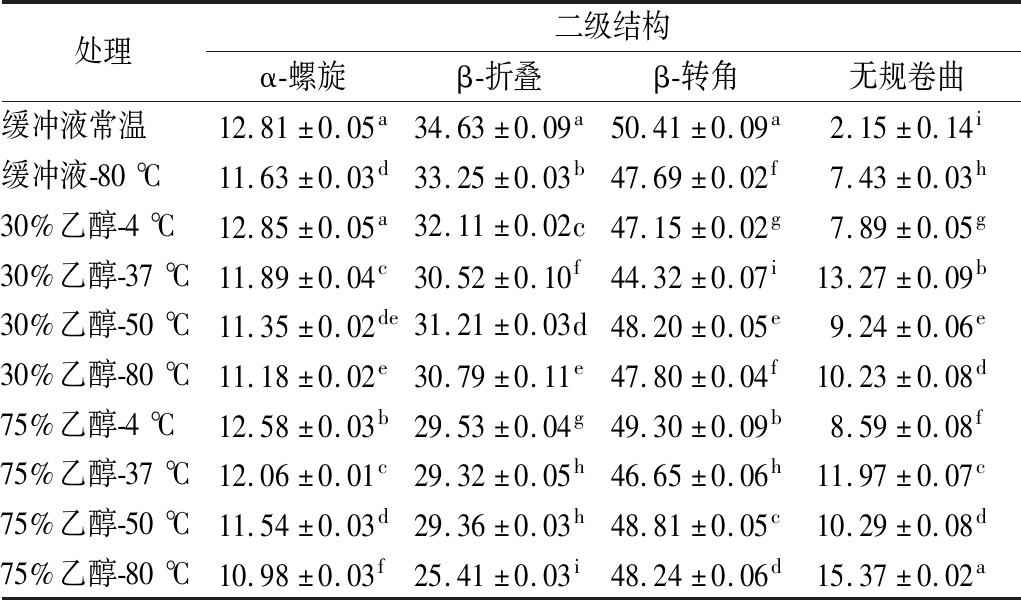
由表1可知,与缓冲液常温处理相比,缓冲液80 ℃处理后,皮层裂解酶α-螺旋显著减少,其余二级结构也有不同程度的增加,但对皮层裂解酶二级结构改变效果明显不如相同温度结合乙醇的处理组显著,说明中温能够改变皮层裂解酶二级结构。有机溶剂处理会导致脂肪酶的二级结构发生一定程度的变化,且极性越强效果越明显[29]。中温结合不同浓度乙醇处理后皮层裂解酶的α-螺旋含量均减少,且随着处理温度和乙醇体积分数的升高,减少的趋势更明显,说明热和乙醇处理后,皮层裂解酶中氢键发生断裂导致解螺旋发生[30]。β-折叠结构含量总体呈下降趋势,β-转角含量并无明显的升降规律。以上实验结果均表明中温结合乙醇处理后皮层裂解酶二级结构发生变化,最终导致酶活力的改变。
表1 中温结合乙醇处理对皮层裂解酶二级结构的影响 单位:%
Table 1 Effects of medium temperature and ethanol treatment on secondary structures of cortex-lytic enzyme
处理二级结构α-螺旋β-折叠β-转角无规卷曲缓冲液常温12.81±0.05a34.63±0.09a50.41±0.09a2.15±0.14i缓冲液-80℃11.63±0.03d33.25±0.03b47.69±0.02f7.43±0.03h30%乙醇-4℃12.85±0.05a32.11±0.02c47.15±0.02g7.89±0.05g30%乙醇-37℃11.89±0.04c30.52±0.10f44.32±0.07i13.27±0.09b30%乙醇-50℃11.35±0.02de31.21±0.03d48.20±0.05e9.24±0.06e30%乙醇-80℃11.18±0.02e30.79±0.11e47.80±0.04f10.23±0.08d75%乙醇-4℃12.58±0.03b29.53±0.04g49.30±0.09b8.59±0.08f75%乙醇-37℃12.06±0.01c29.32±0.05h46.65±0.06h11.97±0.07c75%乙醇-50℃11.54±0.03d29.36±0.03h48.81±0.05c10.29±0.08d75%乙醇-80℃10.98±0.03f25.41±0.03i48.24±0.06d15.37±0.02a
注:同列小写字母不同表示差异显著(P<0. 05)。
3 结论
中温(80 ℃)结合乙醇能够杀灭芽孢,显著减少活菌数,芽孢皮层裂解酶在体积分数为30%和75%的乙醇溶液结合中温80 ℃处理时,皮层裂解酶基本失活。荧光光谱显示,体积分数为30%、75%乙醇协同温度处理得皮层裂解酶发生明显红移,三级结构发生变化,乙醇协同热处理能使皮层裂解酶钝化,且高浓度乙醇和较高温度处理更易改变皮层裂解酶三级结构。红外光谱显示,皮层裂解酶二级结构中α-螺旋、β-折叠、β-转角、无规卷曲含量均发生变化。综上,中温结合乙醇处理后皮层裂解酶结构发生变化,从而导致酶活力的改变。
[1] 章中,杨宏伟,胡济美,等. 化学物质辅助超高压处理对枯草杆菌芽孢的作用[J]. 中国食品学报, 2015,15(5):47-53.
[2] 冯杰, 王振华,潘康成. 枯草芽孢杆菌芽孢表面展示外源功能蛋白的应用[J]. 动物营养学报, 2017,29(11):3 893-3 898.
[3] 章中. 热和化学因素辅助超高压对枯草杆菌芽孢的灭活研究[D]. 北京:中国农业大学, 2013.
[4] 黄甜甜, 陆利霞,姚丽丽,等. 食品中芽孢杀灭新技术[J]. 食品工业科技, 2012,33(3):391-394.
[5] BARNETT S M, SABLAM S S, TANG J, et al. Utilizing Herbs and Microwave-Assisted Thermal Sterilization to Enhance Saltiness Perception in a Chicken Pasta Meal.[J]. Journal of food science, 2019,84(8):2 313-2 324.
[6] 肖容雍, 赵鹤飞,李铭. 常温即食食品的主要杀菌技术研究进展[J]. 农产品加工, 2018(12):64-69.
[7] 孔祥琪. 番木瓜果汁香气成分及其在热杀菌后的变化研究[D]. 海口:海南大学, 2016.
[8] 陈斌. 热杀菌及添加物对罗非鱼鱼糜肠质构的影响[D]. 广州:华南理工大学, 2012.
[9] 陈巧, 廖金花,林丽蓉,等. 乙醇对鲍鱼碱性磷酸酶活力与构象的影响[J]. 厦门大学学报(自然科学版), 2005(4):563-565.
[10] 初志战, 黄卓烈,巫光宏,等. 乙醇溶液对木瓜蛋白酶催化活性的影响[J]. 热带亚热带植物学报, 2005(4):329-332.
[11] 谢晓兰, 潘小芳,龚丽芬,等. 有机溶剂对猪红细胞SOD的活力与构象影响[J]. 泉州师范学院学报, 2010,28(4):47-50.
[12] 方志超. 乳酸—热处理对多酚氧化酶活性与构象的影响[D]. 南昌:南昌大学, 2014.
[13] 刘玉芳, 王淼. 蛋白酶在乙醇溶液中的性质及构象[J]. 食品与发酵工业, 2011,37(10):31-35;40.
[14] 曾朝玮, 孙静,马慧娇,等. 枯草杆菌芽孢皮层裂解酶的分离纯化以及酶学结构分析[J]. 食品工业科技, 2019,40(9):160-165;223.
[15] GAO Y, JU X, JIANG H. Studies on inactivation of Bacillus subtilis spores by high hydrostatic pressure and heat using design of experiments[J]. Journal of Food Engineering, 2006,77(3):672-679.
[16] GB 4789.2—2016 食品微生物学检验菌落总数测定[S].
[17] GOMBAS D E, LABBE R G. Extraction of spore-lytic enzyme from Clostridium perfringens spores[J]. Journal of General Microbiology, 1981,126(1):37-44.
[18] MAKINO S, ITO N, INOUE T, et al. A spore-lytic enzyme released from Bacillus cereus spores during germination[J]. Microbiology, 1994,140(Pt 6):1 403-1 410.
[19] MIYATA S, MORIYAMA R, SUGIMOTO K, et al. Purification and partial characterization of a spore cortex-lytic enzyme of Clostridium perfringens S40 spores[J]. Biosci Biotechnol Biochem, 1995,59(3):514-515.
[20] 刘志明, 高闽光,徐亮,等. 去卷积和高斯拟合方法在FTIR光谱处理中的应用[J]. 光谱实验室, 2007(3):486-489.
[21] 郭全友, 王晓晋,姜朝军. 微波杀灭虾源地衣芽孢杆菌孢子特性及效果[J]. 农业工程学报, 2018,34(21):281-287.
[22] 李素, 张顺亮,潘晓倩,等. 中温乳化肠中凝结芽孢杆菌芽孢萌发及热致死规律[J]. 肉类研究, 2017,31(4):10-16.
[23] 陈娟, 邓福明,陈卫军. 热处理对椰子水过氧化物酶和多酚氧化酶活力及色泽变化的影响[J]. 热带作物学报, 2016,37(4):817-821.
[24] 吴秋昊, 贾利蓉,陈安特,等. 热处理对核桃仁脂氧化酶类活性的影响[J]. 食品与机械, 2017,33(2):145-147;204.
[25] 王慧倩. 乙醇预处理对鲜切西兰花品质和抗氧化活性影响[D]. 南京:南京农业大学, 2014.
[26] 黄晓杰. 采后处理对蓝莓果实衰老的作用及机理研究[D]. 沈阳:沈阳农业大学, 2016.
[27] 李阳, 赵怡,谢丽思,等. 荧光光谱分析超氧化物歧化酶的构象变化及其功能[J]. 光谱实验室, 2011,28(6):2 763-2 769.
[28] CHEN Q X, ZHANG R Q, YANG P Z, et al. Effect of ethanol on the activity and conformation of Penaeus penicillatus acid phosphatase[J]. Int J Biol Macromol, 1999,26(2-3):103-107.
[29] 杨红, 高修功,曹淑桂,等. 用傅立叶变换红外光谱研究有机溶剂对脂肪酶构象的影响[J]. 无锡轻工大学学报, 1997(2):44-48.
[30] 王晓琳, 朱力杰,陈妍婕,等. 不同干热处理对花生蛋白二级结构及乳化性的影响[J]. 食品与发酵工业, 2016,42(5):86-90.