自由基能够破坏人体细胞,引起衰老效应和各种慢性疾病[1]。大豆蛋白酶解产物与花青素作为天然抗氧化剂均具有良好的自由基清除功效[2]。SPI氨基酸分数与动物蛋白相近,具有较高的营养价值,因此经常作补充剂[2]。花青素属于天然的黄酮类植物色素,是一种小分子活性物质,由于具有抗炎、抗氧化等生物活性而被广泛应用于医药、保健食品领域[3]。花青素具有较强的蛋白亲和性,可与蛋白质复合形成具有功能特性的复合体系[4]。
蛋白质与多酚在食品体系中存在共价、非共价2种作用形式[5]。在共价作用中碱性条件可诱导多酚羟基去质子化以得到醌,醌再与蛋白质发生亲核反应[6]。非共价作用,包括蛋白与多酚间的氢键、π键、范德华力、疏水作用和离子作用[7]。
提高食品的营养与功能特性已逐渐成为食品研究热点,在食品加工生产中,蛋白质等生物大分子与多酚等小分子物质能够发生相互作用,目前已有文献对多酚与蛋白复合物的生物活性及消化性进行研究。TANG等[8]发现牛血清白蛋白与白藜芦醇的非共价作用能够掩盖白藜芦醇的DPPH自由基清除能力。GALLO等[9]发现可可多酚与乳蛋白组分共价作用时游离多酚的含量降低,通过ABTS法测定的游离多酚抗氧化性也降低。ZHANG等[10]发现热变性的SPI与花青素的非共价作用能够促进SPI的消化率。STOJADINOVIC等[11]发现β-乳球蛋白与茶、咖啡和可可的多酚提取物之间的非共价作用均会抑制蛋白消化。
由于消化极为复杂,多酚与蛋白的互作类型可能影响蛋白的消化性及生物活性,而现有文献对比共价/非共价作用中复合物消化性及生物活性的研究较少,SPI-花青素复合物的相应研究更是空白[12]。因此,本文主要研究共价/非共价SPI-花青素复合物在体外模拟消化过程中分子量分布、蛋白水解度及抗氧化性等变化,为开发高消化性、高抗氧化性的蛋白质-多酚复合类食品提供理论基础。
1 材料与方法
1.1 材料与试剂
SPI,自制;黑米花青素提取物,天之润生物科技有限公司;6-羟基-2,5,7,8-四甲基色烷-2-羧酸(Trolox)、胃蛋白酶(600 U/mg)、1,1-二苯基-2-三硝基苯肼(DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、胰液素,美国Sigma-aldrich;乙酸乙酯、正己烷、甲醇,北科化学品有限公司;邻苯二甲醛、K2HPO4、KH2PO4、HCl、NaOH,新光化工试剂厂;其他化学试剂均为分析纯。
1.2 仪器与设备
AL204型分析天平,梅勒特-托利多仪器有限公司;GL-25MS超速高速冷冻离心机,上海盛析仪器设备有限公司;FD5-3型冷冻干燥机,美国SIM公司;旋转蒸发仪,上海皖宁精密科学仪器有限公司;WAT023635高效液相色谱仪,美国Waters公司;C18反向色谱柱(250 mm×4.6 mm, Sunfire),美国Waters公司;JJ-1增力电动搅拌器,江苏金城国胜仪器厂;PHS-25型酸度计,上海仪电科学仪器股份有限公司;恒温水浴震荡摇床,常州恩培仪器制造有限公司;Tecan Infinite 200 Pro酶标仪,瑞士帝肯公司;排阻色谱柱(300 mm×4.6 mm,Wilmington),美国安捷伦科技有限公司。
1.3 实验方法
1.3.1 SPI制备
参考江连洲等[13]的方法,过60目筛的大豆粉与正己烷按料液比1∶3(g∶mL)混合,进行3次脱脂后以1∶10(g∶mL)加去离子水,用NaOH(1 mol/L)调节溶液pH为8.0,搅拌2 h后于4 ℃下9 500×g离心30 min,用HCl(2 mol/L)调节上清液pH至4.5后静置2 h,以6 500×g离心30 min得蛋白沉淀,经3次蒸馏水溶解并离心得蛋白沉淀物,蛋白沉淀溶解后调pH至中性。最后将此蛋白溶液预冻24 h(-40 ℃)冻干,即可得SPI。
1.3.2 花青素提纯
参考SUI等[14]的方法,用蒸馏水溶解黑米提取物,进行减压抽滤后取滤液通过固相萃取柱,将花青素滤液、体积分数0.01%的盐酸、乙酸乙酯、甲醇以体积比1∶2∶2∶4依次通过固相萃取柱,得到含花青素的甲醇溶液并将其40 ℃旋转蒸发,利用高效液相色谱法[18]测定提纯后花青素纯度为(91.17±0.04)%。
1.3.3 SPI-花青素复合物的样品制备
参考NAGY等[15]方法制备SPI-花青素非共价复合物的样品,首先将SPI溶解在pH为7.0的0.01 mol/L磷酸盐缓冲液(phosphate buffered saline, PBS)中,得到10 g/L的SPI溶液,溶解不同比例的花青素并使其质量浓度依次为0.17、0.25、0.50 g/L,最后在室温避光隔氧条件下搅拌2 h即可制得SPI-花青素非共价复合物溶液。
参考JIA等[16]的方法制备SPI-花青素共价复合物的样品,用pH为7.0的0.01 mol/L PBS溶液溶解SPI以得到10 g/L的SPI溶液,溶解不同比例的花青素并使其质量浓度依次为0.17、0.25、0.50 g/L,用0.5 mol/L NaOH调pH为9.0,于室温条件下避光搅拌24 h后制得SPI-花青素共价复合物的溶液,调节最终pH为7.0。空白对照为未处理的SPI溶液。将上述SPI-花青素共价/非共价复合物的溶液放入透析袋(8~10 kDa)中48 h,8 h换水1次,透析液冻干后得到SPI-花青素共价/非共价复合物的样品。
1.3.4 模拟胃肠消化
参考JIANG等[17]的方法,对其进行体外消化模拟。将 6组共价/非共价SPI-花青素复合物的样品及SPI样品分别溶于0.01 mol/L、pH 7.0的PBS溶液中得到蛋白含量为50 mg/mL的样品溶液,等体积混合50 mL样品溶液和含0.1 mmol/L MgCl2·6H2O,25 mmol/L NaHCO3,6.9 mmol/L KCl,0.9 mmol/L KH2PO4,0.5 mmol/L (NH4)2CO3和47.2 mmol/L NaCl的模拟胃环境溶液(其中添加25 μL的0.3 mol/L CaCl2·2H2O,并用1 mol/L HCl调节pH为3.0),最后加入胃蛋白酶,使其达到2 000 U/mL。水浴振荡摇床在170 r/min、37 ℃下处理混合溶液,保持pH为3.0,2 h后用NaHCO3(0.5 mol/L)调节消化液的pH为中性,胃消化结束。
等体积混合胃消化样品溶液(100 mL)与含38.4 mmol/L NaCl,85 mmol/L NaHCO3,0.8 mmol/L KH2PO4,6.8 mmol/L KCl和 0.33 mmol/L MgCl2·6H2O的模拟肠环境溶液(添加12.5 mL 160 mmol/L猪胆盐和0.2 mL 0.3 mol/L的CaCl2·2H2O,再用1 mol/L NaOH调节pH至7.0),最后添加适量胰液素,使胰蛋白酶达到100 U/mL。样品在170 r/min,37 ℃的水浴振荡摇床内,期间保持pH为7.0,于消化终点处0 ℃下保持30 min灭酶,以结束小肠消化。在胃肠消化180 min内,每30 min取样并灭酶,按1.3.6方法测定蛋白水解度。将180 min胃肠消化后的消化液进行离心(20 min,10 000×g),冷冻干燥所得上清液,得到粉末状复合物消化产物。
1.3.5 分子量分布测定
分子量分布用体积排阻色谱法测定[13]。将复合物或复合物消化产物溶解于pH 7.0、0.01 mol/L的PBS溶液中,使其质量浓度达到1 mg/mL,过滤膜(0.45 μm)。流动相为pH 7.0、150 mmol/L PBS溶液;色谱柱为250 mm×4.6 mm,5 μm;进样量为10 μL,流量为0.3 mL/min,柱温为25 ℃,运行时间为30 min,检测波长为220 nm。蛋白分子量标准线由核糖核酸酶(13.7 kDa)、鸡白蛋白(44 kDa),牛血清白蛋白(67 kDa),VB12(1.35 kDa),胰岛素(5.5 kDa)制得。
1.3.6 结合率测定
参考孙红波等[18]的方法,测定结合率。将共价/非共价SPI-花青素复合物再放入透析袋(8~10 kDa)并置于4 ℃的蒸馏水。取24 h后的透析液在520 nm测量吸光度以计算花青素含量。计算公式如下:
结合率![]()
(1)
每毫克SPI结合花青素量![]()
(2)
式中:总花青素量、游离花青素量、每毫克SPI结合花青素量,μg。
1.3.7 蛋白水解度的测定
参考刘英杰等[19]的方法,取适量胃肠消化中的消化物溶液溶解于0.01 mol/L,pH为7.0的PBS溶液中,控制样品蛋白含量10 mg/mL。丝氨酸标准液:取丝氨酸标准品50 mg溶解于0.01 mol/L,pH为7.0的PBS溶液中,得到0.952 meqv/L的标准液。分别混合样品溶液,PBS溶液或丝氨酸标准液400 μL与邻苯二甲醛3 mL,2 min后在340 nm处测溶液的吸光度。水解度(degree of hydrolysis, DH)测定如公式(3)、(4)、(5)所示。
(3)
(4)
(5)
式中:Serine-NH2,丝氨酸氨基在每克SPI中摩尔数,mmol/g;m,样品质量,g;P,SPI的百分比含量,%;0.1,样品溶液体积数,L;β,0.342;α,0.97;htot,7.80。
1.3.8 抗氧化活力测定-ABTS法
参照RE等[20]的方法并稍作修改,在pH 7.0的PBS溶液(0.01 mol/L)中加入0.067 g过硫酸钾和0.38 g ABTS后于暗处反应12~16 h制得ABTS储备液。并用上述PBS溶液稀释至734 nm下吸光度为0.7±0.02。取100 μL,5 mg/mL的SPI、SPI-花青素复合物(胃肠消化前后)或复合物中对应含量的花青素(结合花青素)样品溶液,与100 μL ABTS储备液在暗处反应7 min后测吸光度。以PBS溶液作对照,Trolox为当量,得到Trolox浓度(x)与吸光度(y)的标准曲线:y=-178.21x+0.318 9,R2=0.99。
1.3.9 抗氧化活力测定-DPPH法
参照BRAND-WILLIAMS等[21]的方法并稍作修改,取上述5 mg/mL样品溶液100 μL与等量DPPH溶液于暗处反应,30 min后在517 nm处测吸光度。以PBS溶液作对照,Trolox为当量,得到Trolox浓度(x)与吸光度(y)的标准曲线:y=-49.113x+0.074 0,R2=0.99。
1.3.10 数据统计及分析
每组实验重复3次,利用IBM SPSS Statistics软件进行相关性分析(P<0.05)及差异显著性检验(ANOVA),后采用Origin 2018 64 Bit软件制图。
2 结果与分析
2.1 复合物的分子量分布分析
体积排阻色谱可用于蛋白质分子量测定,依据色谱柱内凝胶的排阻效应,通过凝胶的微孔对不同半径的蛋白分子进行分离[13]。如表1所示,与SPI相比,共价机制下复合物CC1、CC2、CC3分子量>100 kDa的组分所占比例显著增加(P<0.05),而非共价机制下复合物NCM1、NCM2、NCM3无显著变化(P>0.05),这说明共价作用机制下有大分子衍生物生成[18]。上述现象可能是由于在共价机制下(碱性条件),花青素被氧气分子氧化后与SPI发生亲核反应[6],这种互作能够对SPI产生显著影响并生成大分子衍生物,使共价机制下复合物样品的分子量分布产生明显变化。
表1 SPI及SPI-花青素复合物的样品分子量分布
Table 1 Molecular weight distribution of SPI and SPI-anthocyanin complexes

样品分子量分布/%>100kDa10~100kDa5~10kDa<5kDaSPI80.13±0.12d11.91±0.31b5.93±0.03a2.03±0.08aNCM180.37±0.33d17.37±0.13a2.25±0.01b0.01±0.002cNCM280.71±0.37d17.21±0.08a2.07±0.02c0.01±0.003cNCM380.94±0.35d17.01±0.11a2.03±0.01d0.02±0.003cCC189.82±0.41c10.15±0.47c0.02±0.09e0.01±0.27cCC291.19±0.33b8.76±0.58d0.03±0.17e0.02±0.18cCC393.06±0.78a5.10±0.35e0.01±0.09e1.83±0.04b
注:非共价机制下的SPI-花青素复合物样品:NCM1(0. 17 g/L花青素);NCM2(0. 25 g/L花青素);NCM3(0. 50 g/ L花青素)。共价机制下的SPI-花青素复合物样品:CC1(0. 17 g/L花青素);CC2(0. 25 g/L花青素);CC3(0. 50 g/L花青素);标注不同字母表明样品间差异显著(P<0.05),下同。
2.2 复合物结合程度分析
由图1可知,共价机制下SPI与花青素的结合率范围为95.0%~97.1%,而非共价机制下两者的结合率则为68.7%~79.3%,样品CC1、CC2、CC3的结合率和结合量均分别显著高于NCM1、NCM2、NCM3(P<0.05),其中样品CC2、CC3每毫克SPI结合花青素量分别比样品NCM2、NCM3高30.43%、42.86%。这主要因为对于共价作用机制,在pH 9时花青素可被碱性环境诱导为醌,与SPI侧链中的氨基和巯基形成C—N、C—S化学键,在此机制下两者的结合较稳定[22];而对于非共价作用机制,在中性pH时非共价作用先由疏水作用产生,随后由酚羟基与SPI形成氢键,此非共价键较弱且不稳定[7],因此共价机制下同浓度花青素与SPI的结合率、结合量都显著高于非共价。无论是共价/非共价机制下,随着花青素添加量增多,SPI结合花青素量也越高。

图1 SPI-花青素复合物的样品花青素结合量、结合率
Fig.1 Anthocyanin binding amount and binding rate of SPI-anthocyanin complex
2.3 体外模拟消化水解度(DH)分析
DH是评估体外消化的重要指标[23]。如图2所示,全部样品的DH在体外消化期间呈现出大致相同的上升趋势,且在胃或小肠消化阶段,前30 min内DH上升速度较快,30 min后DH上升速度均减缓。这可能是因为在胃或小肠消化阶段内,随着时间的推移,胃蛋白酶、胰酶的活性降低,水解所得消化物积累造成的[24]。
根据图2还可观察到,共价机制下复合物DH在消化过程中均较SPI高,促进SPI消化;非共价则较SPI低,SPI消化被抑制,且随着复合物结合花青素量升高,DH变化越明显。与上述现象相似,STOJADINOVIC等[11]发现β-乳球蛋白与可可多酚的非共价作用抑制蛋白消化。JIANG等[17]发现共价处理后花青素能够促进SPI的消化率。推测花青素对SPI消化产生不同影响的原因有2种:第一可能是与酶的可及性有关,SPI具有较紧密的空间结构,不利于酶的催化作用[23]。在非共价作用机制下,花青素的羟基与SPI中氨基酸残基通过氢键结合,形成的结构使酶与SPI在空间上的结合有阻碍[25],这可能导致蛋白的DH降低;共价作用机制下,花青素与SPI中巯基、氨基酸的结合会改变SPI的紧密结构,使酶更易于与SPI接触[26],酶的可及性增强,催化作用被促进,蛋白质的DH升高。第二可能是与消化酶本身有关,胃蛋白酶、胰酶等消化酶是蛋白质[27]。在非共价作用机制下由于结合能力较弱,花青素易从复合物上脱落与消化酶互作[28],消化酶可能因此不易与蛋白结合,进而降低蛋白的DH;而共价作用机制下由于结合较稳定[29],花青素被SPI牢牢绑定而不易从蛋白脱落,与消化酶发生互作机会小,DH较高。由于消化本身极为复杂,对于酚类与蛋白质形成的复合物,其消化性还可能与蛋白质及酚类的种类、相互作用类型有关[10]。

图2 SPI及SPI-花青素复合物的样品体外消化水解度
Fig.2 In vitro digestion and hydrolysis degree of SPI and SPI-anthocyanin complex samples
2.4 复合物消化产物的分子量分布分析
由表2可知,与SPI相比,样品CC1、CC2、CC3分子量>100 kDa的消化产物所占比例显著降低,分子量<5 kDa所占比例显著升高(P<0.05);相反的,与SPI相比,样品NCM1、NCM2、NCM3分子量>100 kDa的消化产物所占比例显著升高,分子量<5 kDa所占比例显著降低(P<0.05),越高浓度花青素与SPI互作时,上述现象越明显,这说明SPI与花青素在共价机制下互作有助于蛋白消化,能够促进SPI胃肠消化水解为分子量更小的蛋白或多肽[24],非共价则产生相反效果。上述情况出现的原因可能是在共价作用机制下,花青素中醌的C与SPI侧链中巯基的S、氨基酸的N发生不可逆转的共价结合,SPI因此而发生的结构变化使其更易与消化酶接触,有利于SPI的消化[17]。而非共价作用机制下,由于花青素的羟基与SPI产生可逆的氢键,氢键的不稳定结合使SPI的消化受到阻碍[7],最终导致复合物消化产物的分子量分布产生差异。而花青素浓度越高,其结合量也越高,花青素对SPI的作用越强,对SPI消化的影响越大,这与上述水解度指标得到的结论是一致的。
表2 SPI及SPI-花青素复合物消化产物样品的分子量分布
Table 2 Molecular weight distribution of SPI and SPI-anthocyanin complex digested product samples
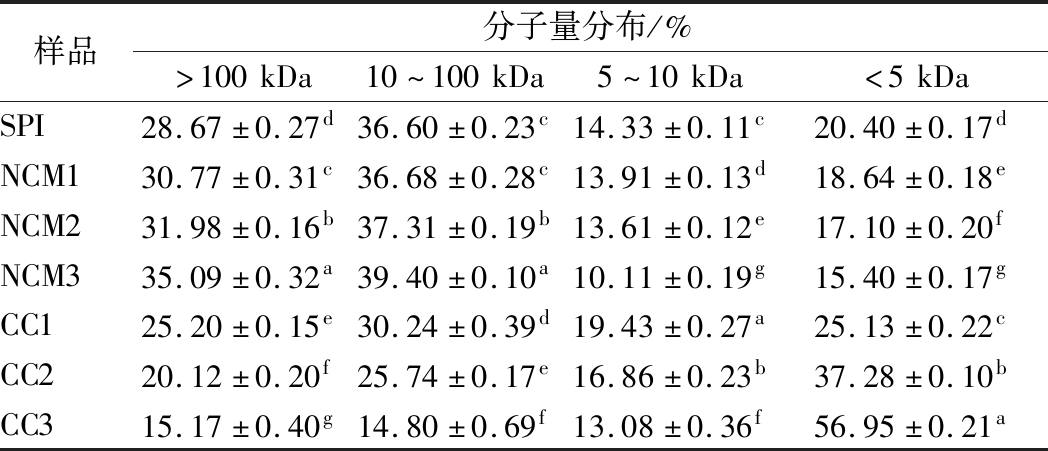
样品分子量分布/%>100kDa10~100kDa5~10kDa<5kDaSPI28.67±0.27d36.60±0.23c14.33±0.11c20.40±0.17dNCM130.77±0.31c36.68±0.28c13.91±0.13d18.64±0.18eNCM231.98±0.16b37.31±0.19b13.61±0.12e17.10±0.20fNCM335.09±0.32a39.40±0.10a10.11±0.19g15.40±0.17gCC125.20±0.15e30.24±0.39d19.43±0.27a25.13±0.22cCC220.12±0.20f25.74±0.17e16.86±0.23b37.28±0.10bCC315.17±0.40g14.80±0.69f13.08±0.36f56.95±0.21a
2.5 抗氧化性测定-ABTS法
由图3可知,在消化前,SPI-花青素复合物的样品抗氧化性均高于SPI,其中样品CC3抗氧化性最高,比SPI抗氧化性高出47.63%,且随着SPI所结合的花青素抗氧化性增强,复合物的抗氧化性显著升高(P<0.05),这表明花青素的结合对复合物ABTS自由基清除能力的增强有积极作用,但复合物抗氧化性的升高幅度小于花青素抗氧化性的升高幅度,这可能是由于花青素抗氧化性主要来源于羟基[3],而花青素的羟基与SPI的氨基酸残基或巯基、氨基形成共价/非共价键[6],使得花青素与SPI结合后赋予复合物的抗氧化性较低。消化前样品CC1、CC2、CC3抗氧化性分别比样品NCM1、NCM2、NCM3高18.95%、12.89%、21.32%。这是共价作用机制下SPI结合花青素的量更多造成的,这与2.2中复合物结合程度分析的结果相一致。LIU等[30]用ABTS法测定共价作用的玉米醇溶蛋白-多酚复合物抗氧化性强于非共价与本实验结果一致。

图3 ABTS法测消化前后SPI及SPI-花青素复合物的样品抗氧化性
Fig.3 Antioxidant properties of SPI and SPI-anthocyanin complex samples before and after digestion by ABTS
消化后样品的抗氧化性比消化前高,主要是因为SPI经胃消化阶段将SPI酶解为肽段后,肠消化阶段含多种消化酶的胰酶将肽段最终水解成具有抗氧化性的多肽[25]。
2.6 抗氧化性测定-DPPH法
如图4可知,与SPI相比,花青素与SPI的相互作用使得复合物的抗氧化性均升高。此外,复合物的抗氧化性均显著高于SPI,且随结合花青素的抗氧化性增强而增强(P<0.05),这表明复合物的抗氧化性主要来源于所结合的花青素,这可能是由于花青素具有良好的抗氧化能力[30]。使用相同浓度花青素制备样品时,共价比非共价机制下复合物的抗氧化性高。SPI与花青素共价作用机制下的花青素结合量高,这使得SPI被赋予的抗氧化性高,从而产生上述现象。ROHN等[22]发现共价作用下槲皮素与牛血清白蛋白的抗氧化性决定于槲皮素的结合量。
经胃肠体外消化后全部样品的抗氧化性均增强,根据胃蛋白酶与胰酶的消化特性,抗氧化性增强的原因是SPI经水解生成具有抗氧化性的肽[13]。
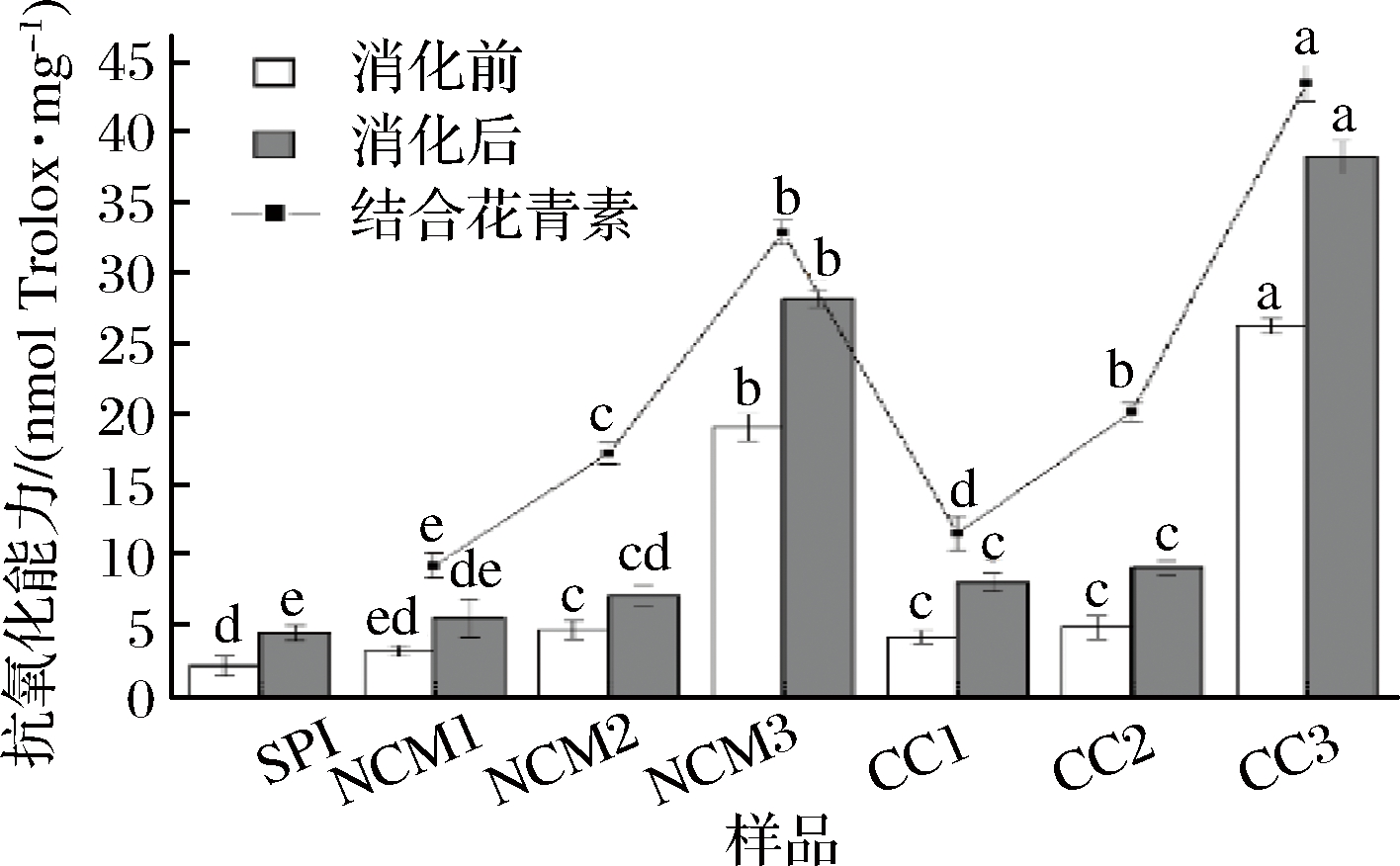
图4 DPPH法测消化前后SPI及SPI-花青素复合物的样品抗氧化性
Fig.4 Antioxidant properties of SPI and SPI-anthocyanin complex samples before and after digestion by DPPH method
3 结论
复合物分子量分布、结合率分析共价/非共价作用机制下SPI与花青素间互作强度差异。分子量分布表明在共价作用机制下生成大分子衍生物,而非共价无显著现象。用同质量浓度花青素制备复合物时,共价机制下结合率、每毫克SPI结合花青素量均显著高于非共价。
复合物消化产物的水解度、分子量分布表明,SPI与花青素在共价作用机制下的互作对复合物体外消化有促进作用,非共价则对其有抑制作用,且复合物结合花青素量越高,对体外消化影响越明显。
抗氧化性指标(ABTS法和DPPH法)测定表明,SPI与花青素互作使SPI的抗氧化性升高,且共价作用机制下复合物的抗氧化性升高更显著,复合物抗氧化性随花青素结合量升高而升高,而复合物消化后的抗氧化性比消化前高。
[1] 张翠利, 付丽娜,杨小云,等. 活性氧自由基与细胞衰老关系的研究进展[J]. 广州化工, 2015, 43(19): 5-7.
[2] 江连洲, 陈思,李杨,等. 大豆分离蛋白-花青素复合物的制备及其蛋白结构与功能性质分析[J]. 食品科学, 2018, 39(10): 20-27.
[3] FAN L L, WANG Y, XIE P J, et al. Copigmentation effects of phenolics on color enhancement and stability of blackberry wine residue anthocyanins: Chromaticity, kinetics and structural simulation[J]. Food Chemistry, 2019,275:299-308.
[4] DE FREITAS V, MATEUS N. Structural features of procyanidin interactions with salivary proteins[J]. Journal of Agricultural and Food Chemistry, 2001, 49(2): 940-945.
[5] 姚其凤, 吴正奇,陈小强. 茶多酚-蛋白质相互作用的研究进展[J]. 食品工业科技,40(8):337-342.
[6] PRIGENT S V E, VORAGEN A G J, VISSER A, et al. Covalent interactions between proteins and oxidation products of caffeoylquinic acid chlorogenic acid[J]. Journal of the Science of Food & Agriculture, 2010, 87(13): 2 502-2 510.
[7] 刘英杰, 陈红宇,李子微,等. 花青素共价交联大豆蛋白对其表面疏水性及功能性的影响[J]. 食品工业科技, 2019, 40(7):11-16.
[8] TANG F, XIE Y X, CAO H, et al. Fetal bovine serum influences the stability and bioactivity of resveratrol analogues: A polyphenol-protein interaction approach[J]. Food Chemistry, 2017, 219: 321-328.
[9] GALLO M, VINCI G, GRAZIANI G, et al. The interaction of cocoa polyphenols with milk proteins studied by proteomic techniques[J]. Food Research International, 2013, 54(1): 406-415.
[10] ZHANG Y, CHEN S, QI B K, et al. Complexation of thermally-denatured soybean protein isolate with anthocyanins and its effect on the protein structure and in vitro digestibility[J]. Food Research International, 2018, 106: 619-625.
[11] STOJADINOVIC M, RADOSAVLJEVIC J, OGNJENOVIC J, et al. Binding affinity between dietary polyphenols and beta-lactoglobulin negatively correlates with the protein susceptibility to digestion and total antioxidant activity of complexes formed[J]. Food Chemistry, 2013, 136(3-4): 1 263-1 271.
[12] OZDAL T, CAPANOGLU E, ALTAY F. Review on protein-phenolic interactions and associated changes[J]. Food Research International, 2013, 51(2): 954-970.
[13] 江连洲, 李佳妮,邹晓霜,等. 花青素对大豆蛋白体外胃消化结构的影响[J]. 食品科学, 2018, 39(20): 34-42.
[14] SUI X N, SUN H B, QI B K, et al. Functional and conformational changes to soy proteins accompanying anthocyanins: Focus on covalent and non-covalent interactions[J]. Food Chemistry, 2017, 245:871-878.
[15] NAGY K, COURTET-COMPONDU M C, WILLIAMSON G, et al. Non-covalent binding of proteins to polyphenols correlates with their amino acid sequence[J]. Food Chemistry, 2012, 132(3): 1 333-1 339.
[16] JIA Z B, ZHENG M, TAO F, et al. Effect of covalent modification by (-)-epigallocatechin-3-gallate on physicochemical and functional properties of whey protein isolate[J]. LWT-Food Science and Technology, 2016, 66: 305-310.
[17] JIANG L Z, LIU Y J, LI L, et al. Covalent conjugates of anthocyanins to soy protein: Unravelling their structure features and in vitro gastrointestinal digestion fate[J]. Food Research International, 2019,120:603-609.
[18] 孙红波, 李杨,王立敏,等. 大豆分离蛋白与花青素非共价及共价作用对蛋白构象变化的影响[J]. 食品科学, 2018, 39(12): 33-39.
[19] 刘英杰,蒋悦,黄国,等.花青素共价交联大豆蛋白对其结构及营养吸收特性的影响[J].食品科学,2019,40(12):1-8.
[20] RE R, PELLEGRINI N, PROTEGGENTE A, et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J]. Free Radic Biol Med, 1999, 26(9-10): 1 231-1 237.
[21] BRAND-WILLIAMS W M, CUVELIER M E, BERSET C L W T. Use of free radical method to evaluate antioxidant activity[J]. LWT-Food Science and Technology, 1995, 28(1): 25-30.
[22] ROHN S, RAWEL H M, KROLL J. Antioxidant activity of protein-bound quercetin[J]. Journal of Agricultural and Food Chemistry, 2004, 52(15): 4 725-4 729.
[23] NIELSEN P M, PETERSEN D, DAMBMANN C. Improved method for determining food protein degree of hydrolysis[J]. Journal of Food Science, 2001, 66(5): 642-646.
[24] 佟晓红, 王欢,刘宝华,等. 生物解离大豆蛋白酶解物体外模拟消化抗氧化性变化[J]. 食品科学,40(15):50-56.
[25] REN C,XIONG W,PENG D, et al. Effects of thermal sterilization on soy protein isolate/polyphenol complexes: Aspects of structure, in vitro digestibility and antioxidant activity[J]. Food Research International (Ottawa, Ont.),2018,112: 284-290.
[26] RAWEL H M, CZAJKA D, ROHN S, et al. Interactions of different phenolic acids and flavonoids with soy proteins[J]. International Journal of Biological Macromolecules, 2002, 30(3): 137-150.
[27] 苑博. 果汁多酚的加工稳定性及与蛋白质作用对体外消化的影响[D].无锡:江南大学, 2011.
[28] HUANG H, KWOK K C, LIANG H. Effects of tea polyphenols on the activities of soybean trypsin inhibitors and trypsin[J]. Journal of the Science of Food and Agriculture, 2004, 84(2):121-126.
[29] LE B C, RENARD C M. Interactions between polyphenols and macromolecules: quantification methods and mechanisms[J]. Critical Reviews in Food Science & Nutrition, 2012, 52(3):213-248.
[30] LIU F G, MA C C, MCCLEMENTS D J, et al. A comparative study of covalent and non-covalent interactions between zein and polyphenols in ethanol-water solution[J]. Food Hydrocolloids, 2017, 63: 625-634.