香气是衡量葡萄酒品质的重要指标之一,在葡萄酒发酵过程中,酿酒微生物种群组成及变化对挥发性香气化合物的产生具有重要影响[1-2]。早期研究认为,非酿酒酵母(non-Saccharomyces)在酿造过程中酒精耐受力差,且发酵能力有限,可能会产生不良代谢产物,因而不适宜酿造葡萄酒[3]。但近年研究表明,non-Saccharomyces菌株可在发酵早期接种,并与S. cerevisiae混合发酵有利于增加葡萄酒香气的复杂性和风格的独特性[4-6]。EBRU等[7]研究表明,戴尔有孢圆酵母(Torulaspora delbrueckii)和S. cerevisiae混合发酵显著增加了Narince葡萄酒中高级醇和酯类物质含量,提高了葡萄酒的香气强度和复杂性。HERRAIZ等[8]研究发现T. delbrueckii和S. cerevisiae混合发酵可以减少挥发酸、乙醛等不良风味化合物的生成,并使苯乙醇、萜烯类和酯类化合物含量明显增加。AZZOLINI等[9]研究表明,T. delbrueckii和S. cerevisiae顺序接种发酵有利于Amarone葡萄酒中高级醇、酯类、脂肪酸和内酯的合成,且对Amarone葡萄酒的风味影响显著。原苗苗等[10]研究发现,T. delbrueckii与S. cerevisiae混合发酵明显提高了赤霞珠葡萄酒中乙基酯类的含量,增加了葡萄酒中的果香味和复杂性。目前,国内对T. delbrueckii在葡萄酒发酵中的研究相对较少,尤其对甘肃河西走廊产区干红葡萄酒品质的影响还需进一步研究。
赤霞珠(Cabernet Sauvignon)和梅鹿辄(Merlot)是甘肃河西走廊产区栽植面积最大的红葡萄品种,由于河西葡萄酒生产企业通常选用单一的商业酿酒酵母(Saccharomyces cerevisiae)进行纯种发酵,从而造成葡萄酒品质缺乏特色和典型性。葡萄酒中的挥发性香气物质主要是在酒精发酵过程中酵母菌株通过糖代谢、氨基酸代谢等途径合成,而不同品种的葡萄其碳源、氮源、氨基酸等营养物质含量差异较大,直接影响酒精发酵过程中挥发性香气化合物的合成与释放[11]。李记明等[12]研究表明,菌株NX11424和NX8422发酵的不同品种葡萄酒中的香气组成差异较大。本试验以甘肃河西走廊产区酿酒葡萄赤霞珠和梅鹿辄为原料,选用T. delbrueckii和RC212进行顺序接种发酵,通过HS-SPME-GC-MS测定挥发性香气物质,研究T. delbrueckii和RC212顺序接种发酵对赤霞珠和梅鹿辄干红葡萄酒中香气影响的差异,以期为提升甘肃河西产区干红葡萄酒香气品质提供理论依据。
1 材料与方法
1.1 试验材料
酿酒葡萄:赤霞珠和梅鹿辄,2018年采自甘肃武威莫高葡萄基地(N103°19' N37°42′),含糖量约为220和230 g/L,可滴定酸(以酒石酸计)为6.95和7.54 g/L。
供试酵母:酿酒酵母Lalvin RC212购自烟台曼森商贸有限公司;T. delbrueckii购自法国Lallemand公司。
1.2 仪器与试剂
生化试剂:果胶酶(EX-V),购自法国Lallemand公司;2-辛醇(色谱纯)标品,购自美国Sigma公司;偏重亚硫酸钠、无水乙醇、NaCl、斐林试剂、10 g/L次甲基蓝指示液、10 g/L酚酞指示液、福林-丹尼斯等试剂,购于天津市光复精细化工研究所。
主要仪器:TRACE 1310气相色谱仪、ISQ型单四级杆质谱仪、色谱柱DB-WAX(60 m×2.5 mm×0.25 μm),美国Thermo Scientific公司;顶空固相微萃取装置(HS-SPEM)、二乙基苯/碳分子筛/聚二甲基硅萃取头(50/30 μm),美国Supelco公司;HH-S型恒温水浴锅,金坛市恒丰仪器厂;160350 D型酒精测定仪,法国Dujardin Salleron公司;GZX-GF 101-II型电热恒温鼓风干燥箱,上海跃进医疗器械有限公司。
1.3 试验方法
1.3.1 酵母活化
非酿酒酵母的活化:将T. delbrueckii(200 mg/L)活性干粉溶于10倍体积的双蒸水中,30℃恒温水浴15 min;再分别加入同等体积的赤霞珠和梅鹿辄葡萄汁,28℃恒温水浴15 min。
酿酒酵母的活化:将RC212(200 mg/L)活性干粉溶于10倍体积的双蒸水中,37℃恒温水浴15 min;再分别加入同等体积的赤霞珠和梅鹿辄葡萄汁,28℃恒温水浴15 min。
1.3.2 接种处理方式
接种non-Saccharomyces 48 h后接种S. cerevisiae,具体接种方式见表1。
表1 接种处理方式
Table 1 Inoculation treatment

酵母菌种组别CXZ-CKCXZ-MIXML-CKML-MIXT. delbrueckii-200-200RC212200200200200
注:表中CXZ-CK表示赤霞珠单菌发酵酒样;CXZ-MIX表示赤霞珠顺序接种发酵酒样;ML-CK表示梅鹿辄单菌发酵酒样;ML-MIX表示梅鹿辄顺序接种发酵酒样;单位均为mg/L。下同。“-”表示没有接种。
1.3.3 酿造工艺
酿酒葡萄→除梗破碎(添加40 mg/L SO2、20 mg/L果胶酶)→低温浸渍48 h→接种T. delbrueckii→22~25 ℃控温发酵48 h→接种酿酒酵母RC212→25℃酒精发酵
待酒精发酵结束后,除去皮渣分别取‘赤霞珠’和‘梅鹿辄’酒样于15 mL离心管中,于-80℃密封保存待测挥发性香气化合物,每组处理重复3次。
1.4 测定方法
1.4.1 理化指标检测
pH、残糖、酒精度、挥发酸、总酸及游离SO2的测定均参照GB/T 15038—2006方法。
1.4.2 挥发性化合物检测
香气成分的萃取与GC-MS分析条件参照祝霞等[13]的方法。具体操作如下。
香气成分的富集:将8 mL待测香气的酒样置于15 mL顶空瓶中,加入2.4 g NaCl和10 μL内标2-辛醇(质量浓度为88.2 mg/L),加磁力搅拌转子,密封并摇匀,置于恒温磁力搅拌器中,40 ℃下水浴平衡30 min后顶空萃取30 min。
色谱条件:色谱柱DB-WAX(60 m×2.5 mm×0.25 μm);升温程序:40 ℃保持5 min,以3.5℃/min升至180 ℃,保持15 min;载气(He)流速1 mL/min;进样口温度240 ℃;不分流进样。
质谱条件:电子轰击离子源(EI);电子能量70 eV;传输线温度180℃;离子源温度200℃;质谱扫描范围(m/z)50~350。
定性与定量:在质谱全离子扫描模式下,采用保留指数(RI)和NIST-11、Wiley及香精香料谱库检索比对进行定性分析,谱库比对时要求匹配度大于700。采用内标法进行半定量分析,内标为2-辛醇。计算如公式(1):
(1)
式中:X,香气物质的质量浓度,μg/L;f,内标物的校正因子,f=1;A,测得香气物质的峰面积;C,内标物的质量浓度,μg/L;A0,测得内标物的峰面积。
1.4 感官评价
参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》,试验在甘肃农业大学食品科学与工程学院标准葡萄酒品尝实验室中进行。对各酒样进行随机编号,然后由9名经过专业培训或具有丰富葡萄酒品尝经验的专家对酒样进行盲品,品评共进行3轮,分别从外观、香气和风味三大方面进行。使用8分结构化数值尺度来量化,0~8分表示感觉强烈程度逐渐增大(表2)。
表2 赤霞珠和梅鹿辄干红葡萄酒感官评价标准
Table 2 Criterion for sensory evaluation of Cabernet
Sauvignon and Merlot dry red wine

评价项目评价角度评价要求外观澄清度、色泽赤霞珠:自然深宝石红、宝石红、紫红或石榴红;美乐:颜色稍浅的鲜亮宝石红;澄清度:澄清透明,无明显悬浮物香气花果香、脂肪味、浓郁度具有纯正、优雅、和谐的花果香,脂肪奶油味淡薄,香气浓郁风味甜味、酸度、整体接受度酸甜度协调、酒体丰满圆润
1.6 数据分析
使用Microsoft Excel 2007对试验所得数据进行整理,使用IBM SPSS Statistics 19.0进行多重比较(Duncan,P<0.05)和主成分分析,试验结果以平均值±标准偏差表示。
2 结果与分析
2.1 赤霞珠和梅鹿辄干红葡萄酒的基本理化指标
由表3可知,各理化指标均在国标范围内,对于同种葡萄,处理组与对照组的理化指标间不存在显著性差异。而由于品种差异,不同品种间的pH、总酸、挥发酸、游离SO2均存在显著性差异。与对照相比,CXZ-MIX和ML-MIX酒样中酒精度均降低,可能是由于混合发酵时non-Saccharomyces代谢了一部分的糖产生香气物质,与韩姗姗等[14]的研究结果一致。
表3 赤霞珠和梅鹿辄干红葡萄酒基本理化指标
Table 3 Basic physicochemical indexes of Cabernet Sauvignon and Merlot dry red wine

发酵类型酒精度/(%vol)pH总糖/(g·L-1)总酸/(g·L-1)挥发酸/(g·L-1)游离SO2/(mg·L-1)CXZ-CK12.90±0.04ab3.73±0.10b2.80±0.04b6.50±0.09a0.18±0.08b19.00±0.12aCXZ-MIX12.20±0.07b3.78±0.15b2.90±0.01b6.50±0.03a0.18±0.05b20.00±0.09aML-CK13.60±0.11a3.88±0.14a3.20±0.00a5.60±0.15b0.21±0.12a16.00±0.13bML-MIX13.20±0.02a3.93±0.07a3.10±0.15a5.40±0.28b0.21±0.04a14.00±0.38b
注:不同小写字母代表差异显著性,P<0.05。
2.2 赤霞珠和梅鹿辄干红葡萄酒中香气成分GC-MS分析
2.2.1 酯类化合物
酯类物质是酒精发酵过程中产生的次级代谢物,由脂肪酸和醇在酯酶催化下形成[15],是葡萄酒的特征果香成分之一[16]。如表4所示,赤霞珠酒样中共检测到23种酯类化合物,其中CXZ-CK、CXZ-MIX酒样中分别检测到19、23种酯类物质,总含量分别为4 475.2和6 722.3 μg/L。与CXZ-CK相比,CXZ-MIX酒样中10种酯类物质乙酸乙酯、己酸乙酯、辛酸乙酯、癸酸乙酯、丁二酸二乙酯、乙酸苯乙酯、月桂酸乙酯、癸酸异戊酯、9-十六碳烯酸乙酯及辛酸3-甲基丁酯含量显著增加。梅鹿辄干红葡萄酒中共检测到20种酯类,ML-CK、ML-MIX酒样中分别检测到15、18种酯类物质,总含量为2 566.6和7 060.1 μg/L。与ML-CK相比,ML-MIX酒样中乙酸乙酯、乙酸异戊酯、己酸乙酯、辛酸甲酯、辛酸乙酯、癸酸乙酯、月桂酸乙酯、3-羟基己酸乙酯、棕榈酸乙酯9种酯类物质含量显著增加。
T. delbrueckii与RC212顺序接种发酵使赤霞珠和梅鹿辄葡萄酒中酯类物质总量显著增加,且具有较强的产脂肪酸乙酯的能力,其中乙酸乙酯(果香、甜香味)、辛酸乙酯(玫瑰、橙子等清凉水果香)、己酸乙酯(青苹果、花香、紫罗兰香味)、癸酸乙酯(椰子味)及月桂酸乙酯(花果香、奶香味)含量均显著增加。原苗苗等[10]研究表明,T. delbrueckii具有较强的产乙基酯能力,主要是乙酸乙酯、辛酸乙酯和癸酸乙酯。HERRAIZ等[8]研究表明,T. delbrueckii和S. cerevisiae混合发酵可增加酯类化合物含量,特别是乙酸乙酯、己酸乙酯和辛酸乙酯等。综上所述,乙酸乙酯和辛酸乙酯很可能是T. delbrueckii的特征香气。
T. delbrueckii与RC212顺序接种发酵对赤霞珠和梅鹿辄干红葡萄酒中酯类物质种类及含量的影响存在较大差异。与对照相比,ML-MIX(2.75倍)中酯类物质总量的增加量明显高于CXZ-MIX(1.50倍);与ML-CK相比,4种OAV>1的酯类物质辛酸乙酯、己酸乙酯、癸酸乙酯、月桂酸乙酯在ML-MIX酒样中分别增加了2.80、3.30、3.68、4.71倍,而在CXZ-MIX中仅增加了1.44、1.85、1.14、1.89倍;且乙酸异戊酯(OAV>1)的含量在CXZ-MIX酒样中略有减少,而在ML-MIX酒样中增加了49.2%。T. delbrueckii对梅鹿辄干红葡萄酒中酯类化合物的影响更大,可能是由于酒精发酵过程中酯类合成途径虽然相同,但酵母发酵的外部环境,如营养成分、不饱和脂肪酸以及含氧量均对葡萄酒中酯类含量存在重要影响[17]。
表4 赤霞珠和梅鹿辄干红葡萄酒中酯类物质含量
Table 4 The contents of esters in Cabernet Sauvignon and Merlot dry red wine

编号香气成分RI(DB-WAX)阈值/(μg·L-1)感官描述香气成分含量/(μg·L-1)CXZ-CKCXZ-MIXML-CKML-MIXA1乙酸乙酯8407 500甜果味557.9±14.1b1 050.4±7.2a334.7±12.0b936.3±31.2aA2乙酸异戊酯1 12030香蕉、甜水果394.2±18.0a368.5±11.7a78.5±2.2c117.2±4.8bA3己酸乙酯1 2355青苹果、花香、紫罗兰47.8±1.3b88.4±2.7a25.5±1.7b84.2±5.5aA4庚酸乙酯1 334300水果香、脂肪味2.6±0.1b17.4±0.3b97.8±6.3aNDA5辛酸甲酯1 390200甜橙味、水果味7.6±0.2a7.5±0.1a3.3±0.5b8.6±1.6aA6辛酸乙酯1 4352玫瑰味、橙子味、清凉水果味1 404.1±45.5c2 025.1±79.5b1 173.6±27.6c3 285.8±83.9aA7壬酸乙酯1 5351 300哈密瓜味、草莓味9.4±0.6a12.4±2.6a10.2±1.2a13.49±3.8aA8癸酸乙酯1 634100椰子味1 087.8±31.7b1 243.6±55.0a344.6±17.6c1 268.0±53.9aA9丁二酸二乙酯1 6876 000生青味、果香256.0±34.7b686.5±23.7a189.1±9.0b166.9±2.5bA10苯乙酸乙酯1 785250花香、果香16.7±1.2a15.4±2.0aND5.4±0.7bA11乙酸苯乙酯1 840250花果香、蜜糖味、含羞草香122.4±9.0b176.3±7.2a49.0±4.5c55.1±3.2cA12月桂酸乙酯1 84883花果香、奶香208.3±14.8c393.1±10.2b101.6±7.7d478.7±32.7aA13癸酸异戊酯1 865-玫瑰香29.9±9.4b76.9±4.5aND32.6±8.1bA14肉豆蔻酸乙酯2 0552 000椰子、蜂蜡香60.0±4.3a69.7±7.2a30.2±1.0b31.0±0.3bA153-羟基己酸乙酯1 679-果香味21.0±1.2a25.7±2.7a4.4±0.3c13.8±1.5bA16棕榈酸乙酯2 2481 500花香、香蕉味、梨味218.4±10.8b229.1±17.0b105.6±40.2c546.9±59.1aA179-十六碳烯酸乙酯2 277--8.9±1.6b61.6±5.0aND1.5±0.6bA18丙酸烯丙酯--果香味ND1.7±0.2NDNDA19γ-丁内酯1 641--2.2±0.6b16.4±7.0aND8.4±0.9abA20丁酸乙酯1 04020香蕉、菠萝、草莓味20.1±3.4a3.9±0.6b18.8±1.9aNDA21辛酸3-甲基丁酯1 659125梨味、蜡味、肥皂味ND130.9±13.4NDNDA22肉桂酸乙酯2 144-甜橙味、樱桃味、花香味ND17.4±2.2aND6.3±1.3bA23丁酸苯乙酯1 960-水果、玫瑰甜香味ND4.6±1.0NDND总量4 475.2±307.9b6 722.3±423.6a2 566.6±223.6c7 060.1±449.2a
注:不同小写字母代表差异显著性,P<0.05;ND表示低于检测限或未检出;-表示未查阅到相关资料。下同。
2.2.2 醇类化合物
高级醇是酵母酒精发酵过程中形成的次级代谢产物,可通过氨基酸代谢途径合成,当含量低于300 mg/L时,对葡萄酒香气具有正面贡献[18-19]。由表5可知,赤霞珠酒样中共检测到11种醇类物质,CXZ-CK、CXZ-MIX酒样中分别检测到8、11种醇类物质,分别占香气总量的54%和58%。与CXZ-CK相比,CXZ-MIX酒样中高级醇的总量显著增加了1.55倍,且正戊醇、1-辛醇、壬醇及苯乙醇含量显著增加。梅鹿辄酒样中共检测到11种醇类物质,ML-CK、ML-MIX酒样中分别检测到10和11种醇类物质,分别占香气总量的69%和66%。与ML-CK相比,ML-MIX酒样中高级醇的含量显著增加了1.86倍,其中异丁醇、正戊醇、苯乙醇、苯甲醇、肉豆蔻醇、正庚醇、1-己醇及2-甲基辛醇等8种物质含量显著增加。
T. delbrueckii与RC212顺序接种发酵有利于葡萄酒中醇类物质的产生,使赤霞珠和梅鹿辄葡萄酒中高级醇含量显著升高,尤其是苯乙醇(玫瑰香、蜂蜜味、蔷薇花香)含量分别比对照增加了1.71和2.14倍,可能与T. delbrueckii中β-葡萄糖苷酶的活性有关,也可能是酵母中β-葡萄糖苷酶与L-苯丙氨酸的代谢共同作用的结果[10],与COMITINI等[5]的研究结果一致。
T. delbrueckii与RC212顺序接种发酵对赤霞珠和梅鹿辄干红葡萄酒中醇类物质种类及含量的影响存在一定差异。与CXZ-CK相比,CXZ-MIX酒样中高级醇种类增加了3种(正庚醇、肉豆蔻醇和月桂醇),且OAV>1的醇类物质1-辛醇(茉莉香、柠檬味)和壬醇(酒果香、蔷薇香)含量分别比CXZ-CK增加了32.6%和33.6%,对赤霞珠葡萄酒的香气品质的提高具有一定的贡献;而与ML-CK相比,ML-MIX酒样中醇类物质仅增加了1种,且OAV>1的苯甲醇(杏仁味、胡桃味)含量较ML-CK增加了14.5倍。这可能与不同品种葡萄中氨基酸的种类组成不同相关[20]。
表5 赤霞珠和梅鹿辄干红葡萄酒中醇类物质含量
Table 5 The contents of alcohols in Cabernet Sauvignon and Merlot dry red wine
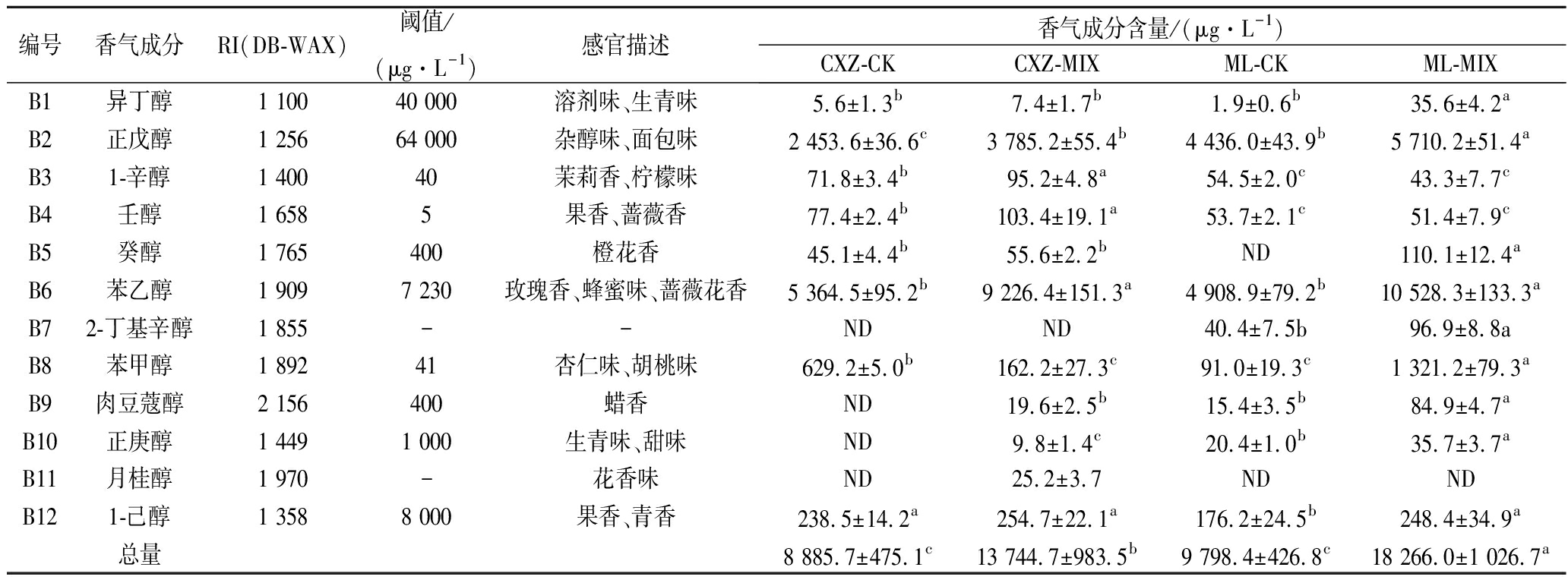
编号香气成分RI(DB-WAX)阈值/(μg·L-1)感官描述香气成分含量/(μg·L-1)CXZ-CKCXZ-MIXML-CKML-MIXB1异丁醇1 10040 000溶剂味、生青味5.6±1.3b7.4±1.7b1.9±0.6b35.6±4.2aB2正戊醇1 25664 000杂醇味、面包味2 453.6±36.6c3 785.2±55.4b4 436.0±43.9b5 710.2±51.4aB31-辛醇1 40040茉莉香、柠檬味71.8±3.4b95.2±4.8a54.5±2.0c43.3±7.7cB4壬醇1 6585果香、蔷薇香77.4±2.4b103.4±19.1a53.7±2.1c51.4±7.9cB5癸醇1 765400橙花香45.1±4.4b55.6±2.2bND110.1±12.4aB6苯乙醇1 9097 230玫瑰香、蜂蜜味、蔷薇花香5 364.5±95.2b9 226.4±151.3a4 908.9±79.2b10 528.3±133.3aB72-丁基辛醇1 855--NDND40.4±7.5b96.9±8.8aB8苯甲醇1 89241杏仁味、胡桃味629.2±5.0b162.2±27.3c91.0±19.3c1 321.2±79.3aB9肉豆蔻醇2 156400蜡香ND19.6±2.5b15.4±3.5b84.9±4.7aB10正庚醇1 4491 000生青味、甜味ND9.8±1.4c20.4±1.0b35.7±3.7aB11月桂醇1 970-花香味ND25.2±3.7NDNDB121-己醇1 3588 000果香、青香238.5±14.2a254.7±22.1a176.2±24.5b248.4±34.9a总量8 885.7±475.1c13 744.7±983.5b9 798.4±426.8c18 266.0±1 026.7a
2.2.3 酸类化合物
葡萄酒中大多酸类物质来源于酵母菌和乳酸菌代谢的副产物,低浓度时散发奶酪和奶油的风味,而在高浓度时有醋酸味、腐败和刺激味[16]。如表6所示,赤霞珠酒样中共检测到11种酸类物质,CXZ-CK、CXZ-MIX酒样中分别检测到10、9种酸类物质,含量分别为2 699.2和2 544.2 μg/L。梅鹿辄酒样中共检测到9种酸类物质,ML-CK、ML-MIX酒样中分别检测到8、7种酸类物质,含量分别为1 695.4和2 124.3 μg/L。
表6 赤霞珠和梅鹿辄干红葡萄酒中酸类物质含量
Table 6 The contents of acids in Cabernet Sauvignon and Merlot dry red wine
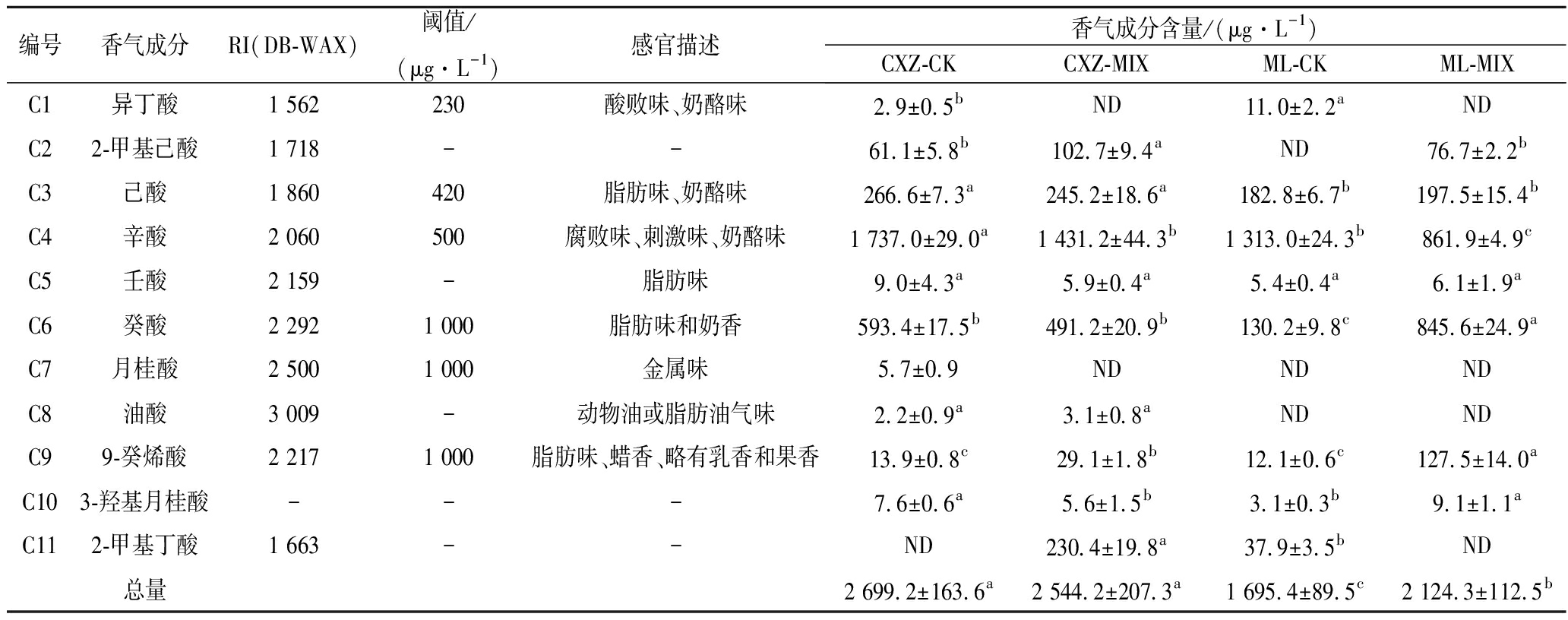
编号香气成分RI(DB-WAX)阈值/(μg·L-1)感官描述香气成分含量/(μg·L-1)CXZ-CKCXZ-MIXML-CKML-MIXC1异丁酸1 562230酸败味、奶酪味2.9±0.5bND11.0±2.2aNDC22-甲基己酸1 718--61.1±5.8b102.7±9.4aND76.7±2.2bC3己酸1 860420脂肪味、奶酪味266.6±7.3a245.2±18.6a182.8±6.7b197.5±15.4bC4辛酸2 060500腐败味、刺激味、奶酪味1 737.0±29.0a1 431.2±44.3b1 313.0±24.3b861.9±4.9cC5壬酸2 159-脂肪味9.0±4.3a5.9±0.4a5.4±0.4a6.1±1.9aC6癸酸2 2921 000脂肪味和奶香593.4±17.5b491.2±20.9b130.2±9.8c845.6±24.9aC7月桂酸2 5001 000金属味5.7±0.9NDNDNDC8油酸3 009-动物油或脂肪油气味2.2±0.9a3.1±0.8aNDNDC99-癸烯酸2 2171 000脂肪味、蜡香、略有乳香和果香13.9±0.8c29.1±1.8b12.1±0.6c127.5±14.0aC103-羟基月桂酸---7.6±0.6a5.6±1.5b3.1±0.3b9.1±1.1aC112-甲基丁酸1 663--ND230.4±19.8a37.9±3.5bND总量2 699.2±163.6a2 544.2±207.3a1 695.4±89.5c2 124.3±112.5b
T. delbrueckii与RC212顺序接种对赤霞珠和梅鹿辄干红葡萄酒中酸类物质种类及含量的影响存在一定差异。与对照相比,CXZ-MIX酒样中酸类物质总量不存在显著性差异,而ML-MIX酒样中酸类物质总量显著增加。CXZ-MIX和ML-MIX酒样中辛酸(OAV>1)含量较对照均显著降低,有利于减少葡萄酒中的酸败味。综上所述,T. delbrueckii与RC212顺序接种降低了酸类物质对干红葡萄酒的负面影响。
2.2.4 萜烯类化合物
萜烯类赋予葡萄酒花香果香特性,由于其感官阈值低,且能直接刺激人的嗅觉细胞,突出葡萄酒的品种香气。如表7所示,赤霞珠酒样中共检测到12种萜烯类化合物,CXZ-CK、CXZ-MIX中分别检测出10、11种,总含量依次为216.0和348.2 μg/L。梅鹿辄干红葡萄酒中共检测到10种萜烯类化合物,ML-CK、ML-MIX酒样中分别检测到7、9种,总含量为112.2和321.6 μg/L。
表7 赤霞珠和梅鹿辄干红葡萄酒中萜烯类物质含量
Table 7 The contents of terpenes in Cabernet Sauvignon and Merlot dry red wine
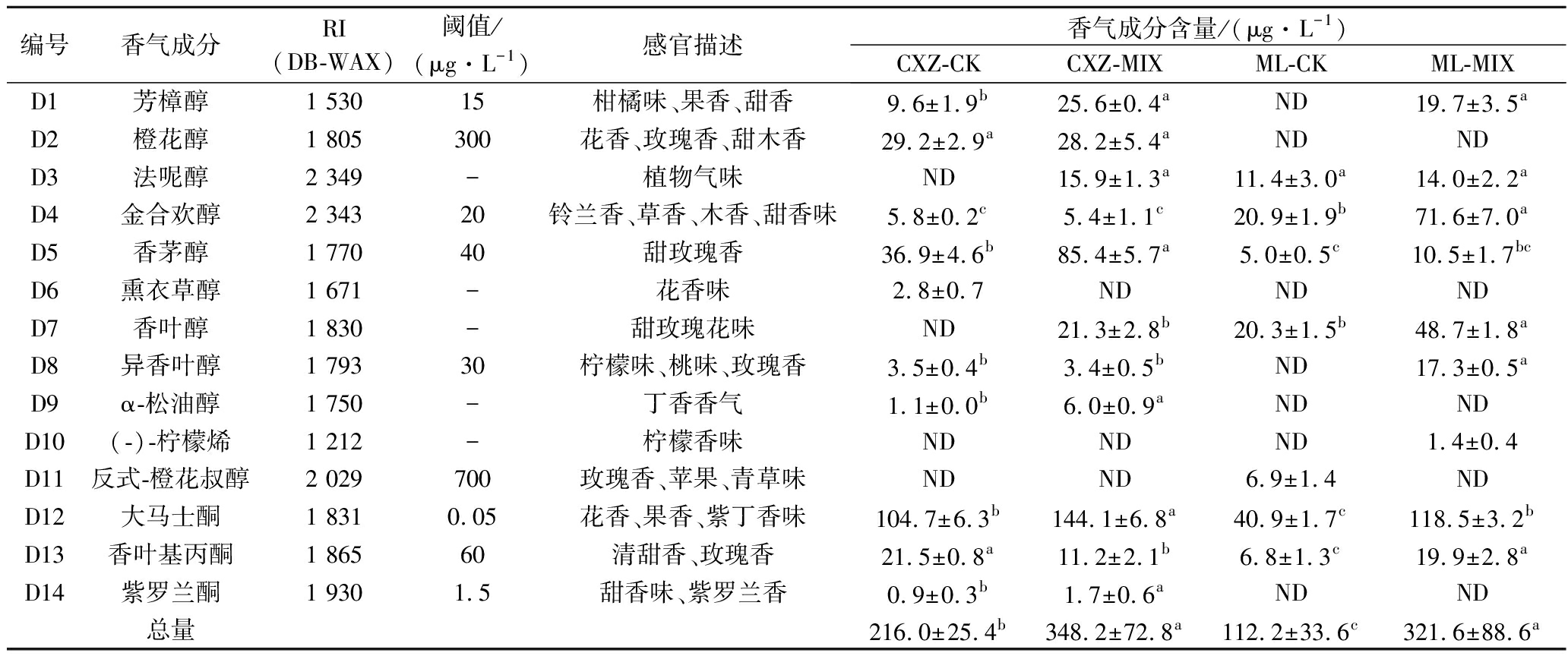
编号香气成分RI(DB-WAX)阈值/(μg·L-1)感官描述香气成分含量/(μg·L-1)CXZ-CKCXZ-MIXML-CKML-MIXD1芳樟醇1 53015柑橘味、果香、甜香9.6±1.9b25.6±0.4aND19.7±3.5aD2橙花醇1 805300花香、玫瑰香、甜木香29.2±2.9a28.2±5.4aNDNDD3法呢醇2 349-植物气味ND15.9±1.3a11.4±3.0a14.0±2.2aD4金合欢醇2 34320铃兰香、草香、木香、甜香味5.8±0.2c5.4±1.1c20.9±1.9b71.6±7.0aD5香茅醇1 77040甜玫瑰香36.9±4.6b85.4±5.7a5.0±0.5c10.5±1.7bcD6熏衣草醇1 671-花香味2.8±0.7NDNDNDD7香叶醇1 830-甜玫瑰花味ND21.3±2.8b20.3±1.5b48.7±1.8aD8异香叶醇1 79330柠檬味、桃味、玫瑰香3.5±0.4b3.4±0.5bND17.3±0.5aD9α-松油醇1 750-丁香香气1.1±0.0b6.0±0.9aNDNDD10(-)-柠檬烯1 212-柠檬香味NDNDND1.4±0.4D11反式-橙花叔醇2 029700玫瑰香、苹果、青草味NDND6.9±1.4NDD12大马士酮1 8310.05花香、果香、紫丁香味104.7±6.3b144.1±6.8a40.9±1.7c118.5±3.2bD13香叶基丙酮1 86560清甜香、玫瑰香21.5±0.8a11.2±2.1b6.8±1.3c19.9±2.8aD14紫罗兰酮1 9301.5甜香味、紫罗兰香0.9±0.3b1.7±0.6aNDND总量216.0±25.4b348.2±72.8a112.2±33.6c321.6±88.6a
CXZ-MIX和ML-MIX酒样中萜烯类物质分别是对照的1.50和3.05倍;可见T. delbrueckii与RC212顺序接种发酵有利于赤霞珠和梅鹿辄葡萄酒中萜烯类物质的产生。这可能是因为T. delbrueckii可产生活性更高且更稳定的β-葡萄糖苷酶,促进了挥发性香气成分的释放[21]。VIANA等[22]研究表明,T. delbrueckii和S. cerevisiae混合发酵的长相思葡萄酒与S. cerevisiae单菌发酵酒样相比,萜烯类化合物含量显著增加。HERRAIZ等[8]研究表明T. delbrueckii和S. cerevisiae混合发酵使萜烯类化合物含量明显增加,与本研究结果相似。
萜烯类化合物大多源于葡萄果实[16],由于葡萄品种差异,T. delbrueckii与RC212顺序接种发酵对赤霞珠和梅鹿辄干红葡萄酒中萜烯类物质的影响存在较大差异。与CXZ-CK相比,CXZ-MIX酒样中芳樟醇、香茅醇、大马士酮、紫罗兰酮及α-松油醇含量显著增加,尤其使芳樟醇、紫罗兰酮和香茅醇的OAV>1,突出赤霞珠干红葡萄酒的花香、果香味。与ML-CK相比,ML-MIX酒样中金合欢醇、大马士酮、香叶基丙酮和香叶醇含量显著增加,且芳樟醇(OAV>1)在ML-CK中未检测到。综上所述,T. delbrueckii与RC212顺序接种发酵对梅鹿辄干红葡萄酒中萜烯类物质的影响大于赤霞珠干红葡萄酒。
2.2.5 其他挥发性化合物
如表8所示,本试验中还检测到5种其他种类化合物,T. delbrueckii与RC212顺序接种发酵使赤霞珠和梅鹿辄酒样中这些化合物含量显著增加。其中与CXZ-CK相比,CXZ-MIX中OAV>1的两种物质苯乙醛(花香、蜜香味)、癸醛(橘皮味)含量均增加,对赤霞珠干红葡萄酒香气复杂性具有一定的贡献。与ML-CK相比,ML-MIX酒样中癸醛(OAV>1)含量显著提高,赋予葡萄酒橘皮味,有利于梅鹿辄干红葡萄酒香气品质的提高。
表8 赤霞珠和梅鹿辄干红葡萄酒中其他挥发性物质含量
Table 8 The contents of other volatile compounds in Cabernet Sauvignon and Merlot dry red wine

编号香气成分RI(DB-WAX)阈值/(μg·L-1)感官描述香气成分含量/(μg·L-1)CXZ-CKCXZ-MIXML-CKML-MIXE1苯乙醛1 5611花香、蜜香36.3±3.1b47.2±2.1a4.7±0.2c5.95±0.0cE2癸醛1 4990.1橘皮味5.2±0.4c7.7±1.5c14.6±3.6b49.8±4.6aE3苯甲醛1 524-杏仁气味6.2±1.1ND3.3±0.6aNDE42,4-二叔丁基苯酚2 323200石炭酸味56.3±4.0b132.5±9.2a7.8±1.6d27.2±1.8cE5壬醛1 3941柑橘味ND16.9±3.0NDND总量104.1±5.2b204.2±21.9a30.4±14.2c82.9±25.4b
2.3 赤霞珠和梅鹿辄干红葡萄酒中香气的主成分分析
气味活性值(OAV)是评价单一香气化合物对葡萄酒整体香气的贡献程度,OAV>1的香气物质常作为葡萄酒主要的呈香物质,此外还有研究指出,OAV>0.1的香气物质可作为葡萄酒的潜在呈香物质,它们主要是与其性质相似的香气物质通过叠加作用而对葡萄酒香气产生积极效果[12],故逐一计算表4~表8中各香气物质的OAV,其中OAV>0.1的香气物质如表9所示。
表9 赤霞珠和梅鹿辄干红葡萄酒中挥发性物质(OAV>0.1)
Table 9 The volatile compounds in Cabernet Sauvignon and Merlot dry red wine
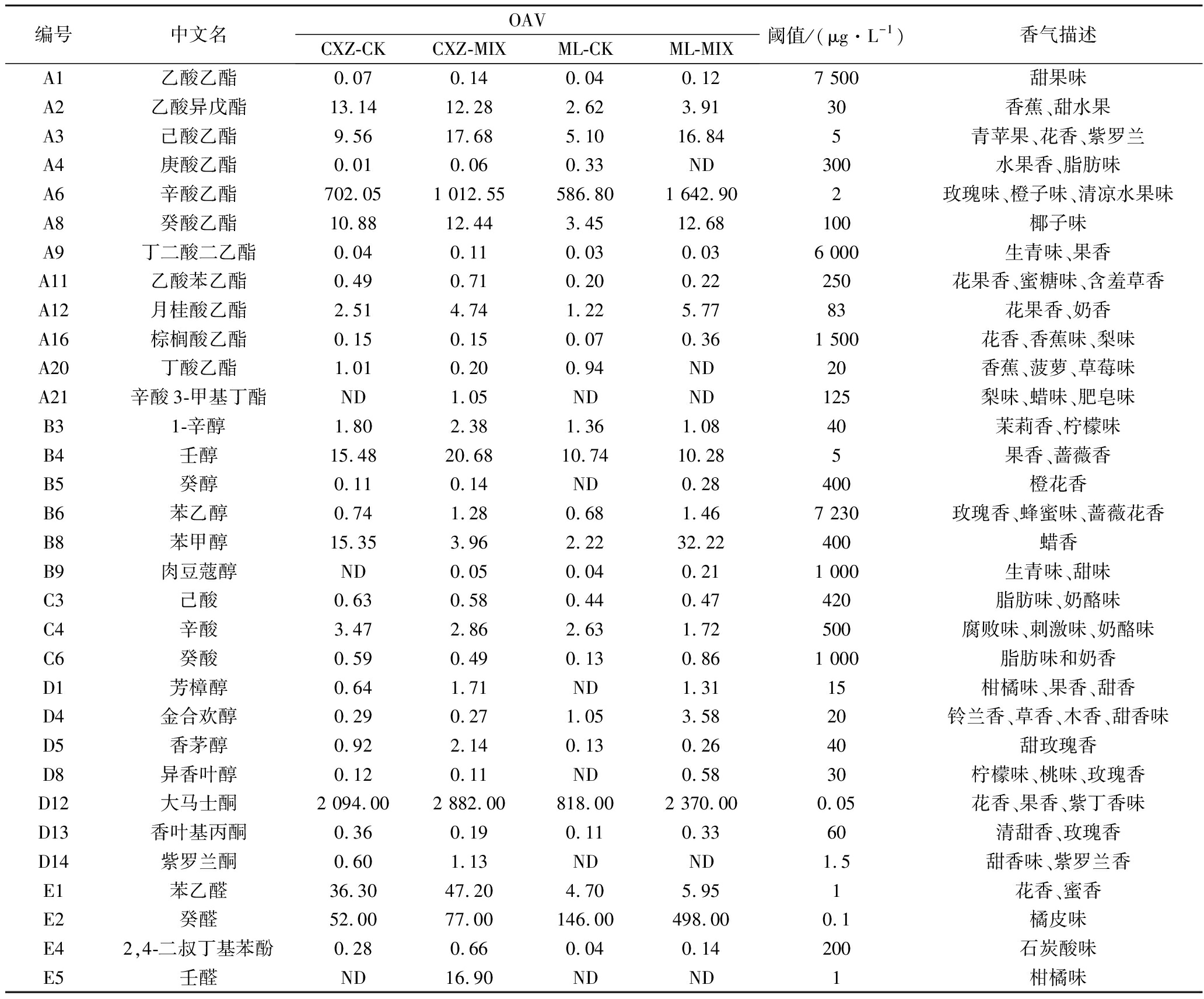
编号中文名OAVCXZ-CKCXZ-MIXML-CKML-MIX阈值/(μg·L-1)香气描述A1乙酸乙酯0.070.140.040.127 500甜果味A2乙酸异戊酯13.1412.282.623.9130香蕉、甜水果A3己酸乙酯9.5617.685.1016.845青苹果、花香、紫罗兰A4庚酸乙酯0.010.060.33ND300水果香、脂肪味A6辛酸乙酯702.051 012.55586.801 642.902玫瑰味、橙子味、清凉水果味A8癸酸乙酯10.8812.443.4512.68100椰子味A9丁二酸二乙酯0.040.110.030.036 000生青味、果香A11乙酸苯乙酯0.490.710.200.22250花果香、蜜糖味、含羞草香A12月桂酸乙酯2.514.741.225.7783花果香、奶香A16棕榈酸乙酯0.150.150.070.361 500花香、香蕉味、梨味A20丁酸乙酯1.010.200.94ND20香蕉、菠萝、草莓味A21辛酸3-甲基丁酯ND1.05NDND125梨味、蜡味、肥皂味B31-辛醇1.802.381.361.0840茉莉香、柠檬味B4壬醇15.4820.6810.7410.285果香、蔷薇香B5癸醇0.110.14ND0.28400橙花香B6苯乙醇0.741.280.681.467 230玫瑰香、蜂蜜味、蔷薇花香B8苯甲醇15.353.962.2232.22400蜡香B9肉豆蔻醇ND0.050.040.211 000生青味、甜味C3己酸0.630.580.440.47420脂肪味、奶酪味C4辛酸3.472.862.631.72500腐败味、刺激味、奶酪味C6癸酸0.590.490.130.861 000脂肪味和奶香D1芳樟醇0.641.71ND1.3115柑橘味、果香、甜香D4金合欢醇0.290.271.053.5820铃兰香、草香、木香、甜香味D5香茅醇0.922.140.130.2640甜玫瑰香D8异香叶醇0.120.11ND0.5830柠檬味、桃味、玫瑰香D12大马士酮2 094.002 882.00818.002 370.000.05花香、果香、紫丁香味D13香叶基丙酮0.360.190.110.3360清甜香、玫瑰香D14紫罗兰酮0.601.13NDND1.5甜香味、紫罗兰香E1苯乙醛36.3047.204.705.951花香、蜜香E2癸醛52.0077.00146.00498.000.1橘皮味E42,4-二叔丁基苯酚0.280.660.040.14200石炭酸味E5壬醛ND16.90NDND1柑橘味
由于葡萄酒香气成分复杂、差异较大,为直观展示4个酒样的香气特点,故对表9中的数据进行主成分分析(PCA),并以特征值>1进行主成分抽提,得到PC1和PC2解释总方差分别为45.87%和43.03%,即前两个主成分可以反映原数据88.90%的变异。图1为各香气物质在PC1和PC2上的因子载荷图,由图1可知,PC1正半轴上主要分布着能赋予葡萄酒水果香味以及花香的酯类及萜烯类化合物,如丁二酸二乙酯(A9)、乙酸苯乙酯(A11)、香茅醇(D5)、紫罗兰酮(D14)等,而PC1负半轴上分布的香气信息较少。PC2正半轴主要反映醇香味和果香味浓郁的高级醇及酯类香气物质,如辛酸乙酯(A6)、棕榈酸乙酯(A16)、癸醇(B5)、苯甲醇(B8)、肉豆蔻醇(B9)等,其负半轴得分较高的有丁酸乙酯(A20)、辛酸(C4)等。
由图2可知,4个酒样在PC1、PC2所形成的二维平面上能被明显区分,其中CXZ-CK、ML-CK酒样在PC1和PC2上的得分均相对较低,因而其香气寡淡、特点不突出。CXZ-MIX酒样在PC1正半轴得分较高,其花香、水果香气浓郁,ML-MIX酒样在PC2正半轴得分较高,即该酒样的醇香、果香特点突出。此外,ML-CK与ML-MIX间的空间距离大于CXZ-CK与CXZ-MIX间的距离,表明混菌发酵对梅鹿辄葡萄酒香气的改善更为明显。综合分析可知,混菌发酵有利于改善葡萄酒香气品质单一、特点不突出等问题,并且混菌发酵对不同葡萄品种酒的改善效果也有较大差异。
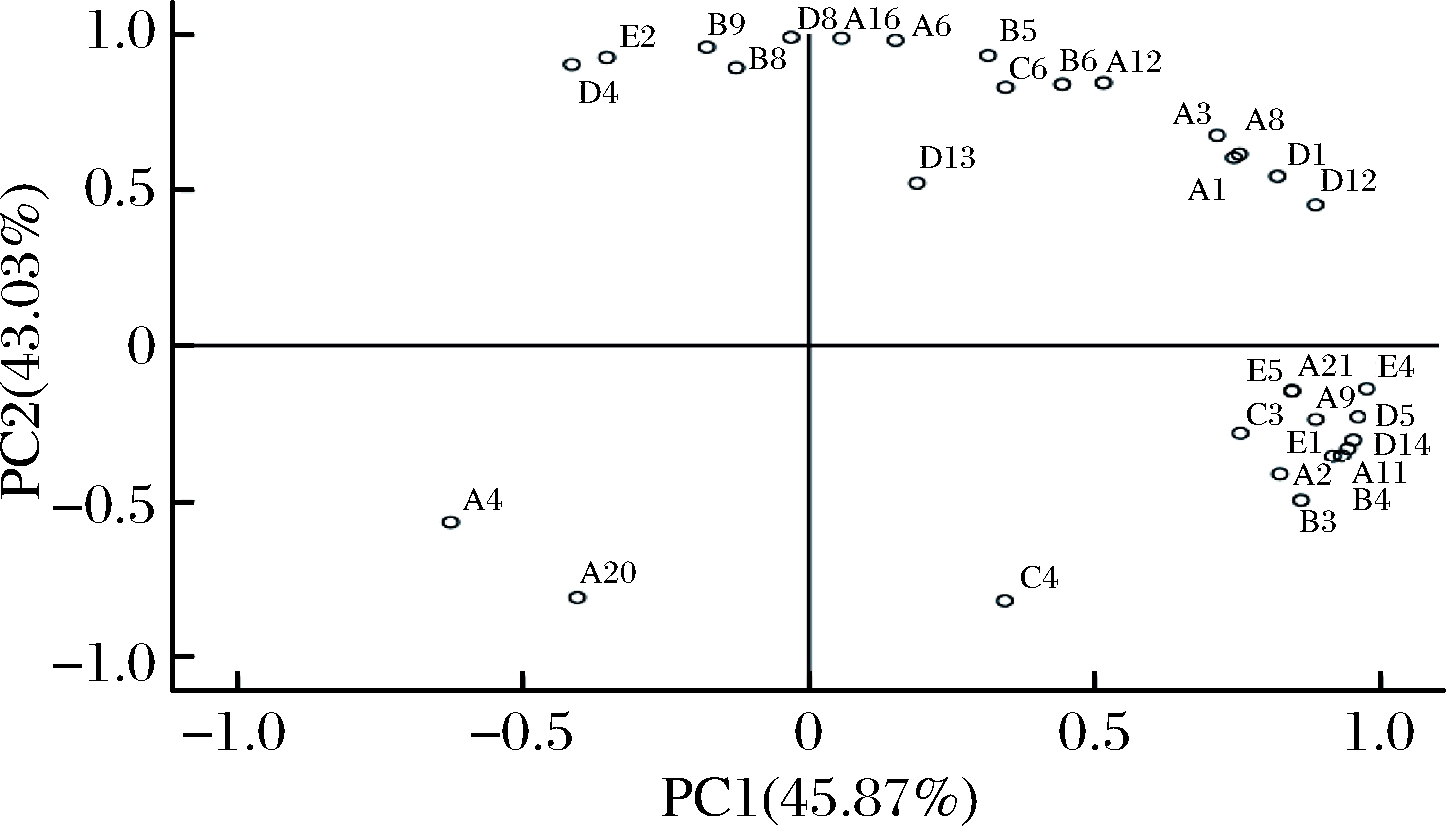
图1 香气化合物PCA因子载荷图
Fig.1 Factor loading plot of PCA for aroma compounds
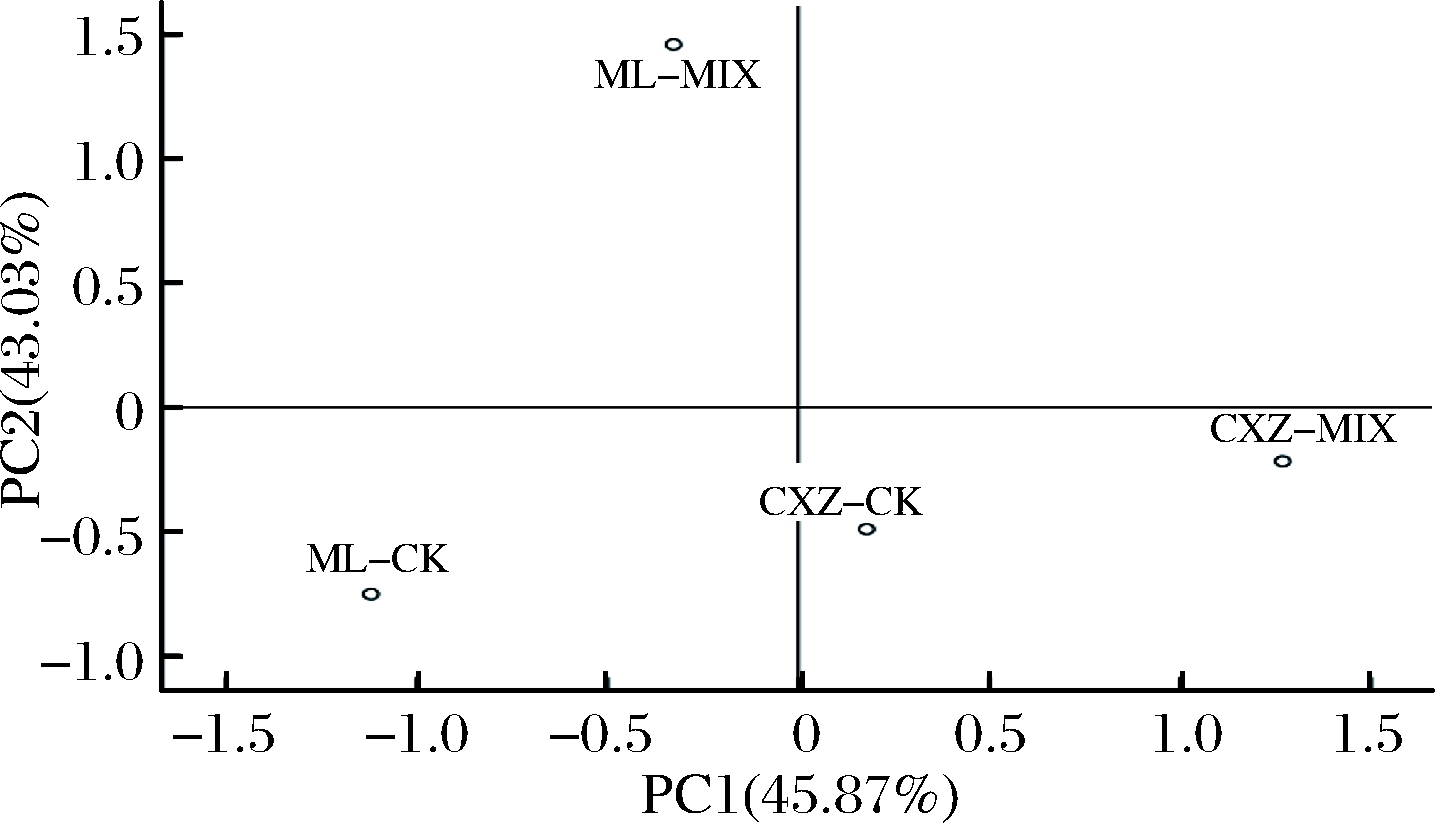
图2 不同酒样香气PCA分布图
Fig.2 Distribution of PCA for aroma compounds
produced with different wine sample
2.4 赤霞珠和梅鹿辄干红葡萄酒的感官评价
图3为赤霞珠和梅鹿辄干红葡萄酒的感官分析雷达图。T. delbrueckii与RC212顺序接种发酵对酒样外观(色泽、澄清度)及口味(甜度、酸度)并无较大影响。香气方面,赤霞珠和梅鹿辄顺序接种酒样中花香、果香的评分明显高于对照,是由于T. delbrueckii与RC212顺序接种发酵显著增加了赤霞珠和梅鹿辄干红葡萄酒中萜烯类物质及酯类物质的含量。RENAULT等[23]已经证实,葡萄酒的果香味及复杂性与non-Saccharomyces在发酵过程中产生的酯类物质密切相关,同时,AZZOLINI等[24]研究表明,花香、果香是提高酒体香气复杂性的重要因素。总体来看,T. delbrueckii与RC212顺序接种发酵使赤霞珠和梅鹿辄葡萄酒酒体更丰满,浓郁度、整体接受度更高,且对梅鹿辄干红葡萄酒花香、果香味的提高更为明显。

图3 赤霞珠和梅鹿辄干红葡萄酒感官分析雷达图
Fig.3 Radar map of sensory analysis of Cabernet Sauvignon and Merlot dry red wine
3 结论
本试验选用甘肃河西产区赤霞珠和梅鹿辄葡萄为原料,研究T. delbrueckii与RC212顺序接种发酵对不同品种干红葡萄酒中香气物质的影响,结果表明T. delbrueckii与RC212顺序接种发酵有利于干红葡萄酒中酯类、高级醇、萜烯类化合物的合成,尤其是脂肪酸乙酯(辛酸乙酯、己酸乙酯、癸酸乙酯和月桂酸乙酯)的生成,提高了干红葡萄酒中的花香、果香味;但对于不同品种葡萄酒中的香气影响差异较大。PCA分析表明,T. delbrueckii与RC212顺序接种发酵有利于改善葡萄酒香气品质单一、特点不突出等问题,并且对梅鹿辄干红葡萄酒香气特点影响更明显。因此,本试验研究结果可为提升甘肃河西产区干红葡萄酒香气品质提供理论依据。
[1] 李艺凡,薛逸轩,赵璐,等.一株非酿酒酵母分离鉴定及多菌种混菌发酵对葡萄酒香气的影响研究[J].食品工业科技,2018,39(11):113-120.
[2] PETRUZZI L,CAPOZZI V,BERBEGAL C,et al.Microbial resources and enological significance: Opportunities and benefits[J].Front Mircobiol,2017,8:995.
[3] VEL ZQUEZ R,ZAMORA E,
ZQUEZ R,ZAMORA E, LVAREZ M L,et al.Effects of new Torulaspora delbrueckii killer yeasts on the must fermentation kinetics and aroma compounds of white table wine[J].Frontiers in Microbiology,2015,6:1 222.
LVAREZ M L,et al.Effects of new Torulaspora delbrueckii killer yeasts on the must fermentation kinetics and aroma compounds of white table wine[J].Frontiers in Microbiology,2015,6:1 222.
[4] LOIRA I,VEJARANO R,BA UELOS M A,et al.Influence of sequential fermentation with Torulaspora delbrueckii and Saccharomyces cerevisiae on wine quality[J].LWT-Food Science and Technology International,2014,59(2):915-922.
UELOS M A,et al.Influence of sequential fermentation with Torulaspora delbrueckii and Saccharomyces cerevisiae on wine quality[J].LWT-Food Science and Technology International,2014,59(2):915-922.
[5] COMITINI F,GOBBI M,DOMIZIO P,et al.Selected non-Saccharomyces wine yeasts in controlled multistarter fermentations with Saccharomyces cerevisiae[J].Food Microbiology,2011,28(5):873-882.
[6] CLEMENTE-JIM NEZ J M,MINGORANCE-CAZORLA L,MART
NEZ J M,MINGORANCE-CAZORLA L,MART NEZ-RODR
NEZ-RODR GUEZ S,et al.Molecular characterization and oenological properties of wine yeasts isolated during spontaneous fermentation of six varieties of grape must[J].Food Microbiol.2004,21(2):149-155.
GUEZ S,et al.Molecular characterization and oenological properties of wine yeasts isolated during spontaneous fermentation of six varieties of grape must[J].Food Microbiol.2004,21(2):149-155.
[7] EBRU A,ELIK ZEYNEP,TURGUT C,et al.Effects of pure and mixed autochthonous Torulaspora delbrueckii and Saccharomyces cerevisiae on fermentation and volatile compounds of narince wines[J].Foods,2018,7(9):147.
[8] HERRAIZ T,REGLERO G,HERRAIZ M,et al.The influence of the yeast and type of culture on the volatile composition of wines fermented without sulfur dioxide[J].American Journal of Enology and Viticulture,1990,41(4):313-318.
[9] AZZOLINI M,FEDRIZZI B,TOSI E,et al.Effects of Torulaspora delbrueckii and Saccharomyces cerevisiae mixed cultures on fermentation and aroma of Amarone wine[J].European Food Research and Technology,2012,235(2):303-313.
[10] 原苗苗,姜凯凯,孙玉霞,等.戴尔有孢圆酵母对葡萄酒香气的影响[J].食品科学,2018,39(4):99-105.
[11] 刘宁.本土酿酒酵母对葡萄酒质量的影响及优良菌株的筛选[D].杨凌:西北农林科技大学,2015.
[12] 李记明,宋长冰,贺普超.葡萄与葡萄酒芳香物质研究进展[J].西北农业大学学报,1998,26(5):105-109.
[13] 祝霞,王媛,刘琦,等.混菌发酵对贵人香低醇甜白葡萄酒的香气影响[J].食品与发酵工业,2019,45(4):95-102.
[14] 韩姗姗,刘树文,张振文.发酵过程中添加柠檬形克勒克酵母对葡萄酒的影响研究[J].食品工业科技,2008,29(11):98-102.
[15] 韦广鑫,杨笑天,周永文,等.葡萄酒中酯类化合物研究进展[J].食品工业科技,2015,36(14):394-399.
[16] 王方,王树生.葡萄酒中的香味物质的来源[J].中外葡萄与葡萄酒,2005(5):50-51.
[17] QUILTER M G,HURLEY J C,LYNCH F J,et al.The production of isoamyl acetate from amyl alcohol by Saccharomyces cerevisiae[J].Journal of the Institute of Brewing,2003,109(1):34-40.
[18] CAPECE A,ROMANIELLO R,PIETRAFESA R,et al. Indigenous Saccharomy cescerevisiae yeasts as a source of biodiversity for the selection of starters for specific fermentations[C].BIO Web Conf,2014,2(3):1-6.
[19] SWIEGERS J H,BARTOWSKY E J,HENSCHKE P A,et al.Yeast and bacterial modulation of wine aroma and flavour[J].Grape Wine Res,2005,11(2):139-173.
[20] 成冰,张京芳,王月晖,等.酿酒白葡萄氨基酸组成特征分析[J].食品科学,2013,34(20):174-177.
[21] 陶永胜,朱晓琳,马得草,等.葡萄汁有孢汉逊酵母糖苷酶增香酿造葡萄酒的潜力分析[J].农业机械学报,2016,47(10):280-286.
[22] VIANA F, GIL J V,GENOV S S,et al.Rational selection of non-Saccharomyces wine yeasts for mixed starters based on ester formation and enological traits[J].Food Microbiology,2008,25(6):778-785.
S S,et al.Rational selection of non-Saccharomyces wine yeasts for mixed starters based on ester formation and enological traits[J].Food Microbiology,2008,25(6):778-785.
[23] RENAULT P,COULON J,DE REVEL G,et al.Increase of fruity aroma during mixed T. delbrueckii/S. cerevisiae wine fermentation is linked to specific esters enhancement[J].International Journal of Food Microbiology,2015,207:40-48.
[24] AZZOLINI M,TOSI E,LORENZINI M,et al.Contribution to the aroma of white wines by controlled Torulaspora delbrueckii cultures in association with Saccharomyces cerevisiae[J].World Journal of Microbiology & Biotechnology,2015,31(2):277-293.