中华鲟(Acipenser sinensis)是个体最大、寿命最长的淡水鱼类,具有较高经济价值和科研价值[1]。鲟鱼产业主要集中在鱼卵的加工,其鱼卵经过盐渍后制作的鱼籽酱具有巨大的经济价值,被称作“黑色软黄金”[2]。然而,作为加工副产物的鱼肉占鲟鱼总量的90%以上,具有肉厚、无骨刺等特点,是制作鱼糜制品的理想材料[3]。鱼糜制品为鱼肉或者冷冻鱼糜经过斩拌、凝胶、熟化等加工过程,制成的具有特殊风味和弹性口感的鱼肉产品[4]。即食鱼糜制品是一种开袋即食的休闲食品,与传统的冷藏鱼糜制品在加工工艺上最大的区别在于即食鱼糜制品必须经过杀菌处理以保证在常温下有较长的保质期。
热杀菌是现代食品工业化中最有效的杀菌方法之一,广泛应用于各类食品加工行业[5]。在热杀菌过程中,首先要确保杀菌的有效性,即使食品达到商业无菌的效果。F值表示在一定的杀菌温度下使食品中特定微生物死亡所需的时间,常用于评价热杀菌过程的有效性。由于食品包装及贮藏方式的不同,在热杀菌过程中所选择的特定微生物的种类有所差异,故其F值不尽相同。在水产加工制品中,李斯特菌和肉毒梭状芽孢杆菌是2种需重视的潜在污染微生物[6]。相关研究表明,在真空包装且常温储存的即食鱼糜制品热杀菌处理中,肉毒芽孢杆菌是主要的杀菌对象,通常以杀菌F值大于3.6 min认为理论安全[7]。但考虑到鱼糜制品中含有丰富的碳水化合物、脂肪及蛋白质等营养成分,易对微生物及其芽孢形成保护作用从而增强微生物的耐热性,以及在生产中可能产生的误差,在实际应用中,通常将F值取≥ 5 min。然而,鱼糜制品经过高温处理(≥ 100 ℃)易导致肌球蛋白重链降解,引起凝胶强度下降[8],且随着杀菌温度升高,其蛋白凝胶三四级结构被破坏,形成聚集现象,同时网状结构空隙增大[9]。所以在保证商业无菌的前提下,选择最佳的热杀菌条件至关重要。目前,针对罐头食品在相同F值杀菌条件下食品感官及营养品质变化的研究较多。高涵等[10]在相同F值条件下,研究恒温与变温2种杀菌工艺对鲣鱼罐头品质的影响。但未针对即食鱼糜制品感官及品质变化进行研究[11-12]。
本实验以鲟鱼鱼糜为原料,在相同的F值条件下,研究3种不同的杀菌方式对即食鱼糜制品的凝胶强度、持水性、巯基(—SH)与有效赖氨酸含量、凝胶溶解性及挥发性风味成分的影响,以期为优化即食鱼糜制品的热杀菌工艺提供理论支持。
1 材料与方法
1.1 材料与试剂
鲟鱼鱼糜,浙江源泰水产食品有限公司;硼酸钠、β-巯基乙醇、赖氨酸、NaCl和KCl,国药集团(上海)化学试剂有限公司;小麦淀粉、尿素、EDTA、5,5′-二硫代双(2-硝基苯甲酸)(DTNB),上海生物工程公司;十二烷基硫酸钠(SDS)、乙二胺四乙酸(EDTA)和邻苯二甲醛(OPA),美国Sigma-Aldrich公司;所有试剂均为分析纯。
1.2 仪器与设备
TMS-PRO食品物性分析仪,美国FTC公司;JLD-DJ18打浆机,厦门金润达机械有限公司;手动式灌肠机,临沂百斯特食品机械有限公司;格兰特雪花制冰机,宁波南洋酒店制品有限公司;分光光度计,美国Thermo Fisher公司;AL-204电子天平,梅特勒-托利多利有限公司;JOANLAB BHS-4水浴锅,宁波群安实验仪器有限公司。
1.3 实验方法
1.3.1 鱼糜凝胶制品制备
工艺流程:
鱼糜切片→空斩→盐斩→混合斩→灌肠→凝胶→杀菌→烘干→储藏
将冷冻鱼糜置于0~4 ℃解冻并切片,使用斩拌机低速空斩3 min,再加入2% NaCl中速斩拌3 min,最后加入8%小麦淀粉高速斩拌5 min制成均匀的鱼糜凝胶。斩拌过程中使用碎冰控制温度≤ 10 ℃,并调节最终水分为70%~75%。将鱼糜凝胶通过灌肠机定型为直径30 mm、长度为5 cm鱼肠状,并置于(45±1)℃水浴凝胶1 h,再置于(95±1)℃熟化20min。将其采用不同杀菌方式杀菌后放入热风干燥箱中以(30±5)℃热风干燥10 min,并置于常温储存。
1.3.2 杀菌程序
标准F值为在恒定温度下杀灭一定数量的微生物或者芽孢菌所需的加热时间,标准F值常被用作判别某一杀菌条件的合理性。肉毒芽孢杆菌为鱼糜制品热杀菌过程中的主要杀菌对象,其理论安全F值应不低于3.6 min;考虑到仪器设备误差,实际杀菌F值取5 min。参照赵艾东[13]报道的F值计算方法,确定3种不同杀菌方法的杀菌程序,如表1所示。升降温阶段过程的致死率未计入本次F值计算,因此实际杀菌效果优于理论值。
1.3.3 微生物分析
3种热杀菌鲟鱼鱼糜制品中细菌总数均依照《食品安全国家标准》中规定的方法[14]。
1.3.4 凝胶强度测定
质构仪采用TPA方法测定破裂强度和凹陷深度(选用Φ5.0 mm球形探头,穿刺速度60 mm/s,穿刺深度20 mm)[15]。凝胶强度计算如式(1):
凝胶强度/(g·cm)=破裂强度×凹陷深度
(1)
表1 三种不同杀菌方法的杀菌程序
Table 1 Sterilization procedures of three sterilization
methods

杀菌方式F值致死率(F=1.0, Z=18℃)温度/℃时间/min高温短时杀菌4.870.974 71215中温长时杀菌4.880.024 4105200分段式杀菌4.890.048 9108250.244 811515
1.3.5 持水性测定
将样品切成高5 mm薄片并精确称重记为X,样品下层放置3张滤纸,上层放置2张滤纸。将5 kg标准砝码置于样品顶部2 min,取出滤纸并将样品称重记为Y。持水性(WHC,water holding capcting)计算如式(2):
(2)
1.3.6 巯基(—SH)含量测定
根据BENJAKUL等[16]方法,将1 g鱼糜蛋白样品添加入10 mL 0.2 mol/L的Tris-HCl缓冲液(8 mol/L尿素、2% SDS、10 mmol/L EDTA,pH 6.8),取4 mL振荡混合均匀,向其加入0.4 mL 0.1% DTNB溶液,置于40 ℃反应25 min,反应结束后于412 nm处测定吸光值,同时以0.6 mol/L KCl溶液为空白参照。巯基含量以每克鱼糜蛋白中巯基的质量摩尔浓度表示,单位为μmol/L/g,试验重复3次。
1.3.7 有效赖氨酸含量测定
采用邻苯二甲醛(OPA)法[17]测定鱼糜制品中有效赖氨酸含量。配制2 mL 80 mg/L的OPA乙醇溶液、50 mL 0.1 mol/L硼酸钠缓冲液(pH 9.0)、5 mL 20% SDS、0.2 mL β-巯基乙醇,将上述溶液混合后定容至100 mL即为OPA溶液,同时以2% SDS溶液作为空白对照,用赖氨酸对照品绘制标准曲线。取100 mg样品溶于10 mL纯水中,搅拌均匀后以4 000 r/min离心30 min取上清液,将上清液稀释到一定浓度(吸光度在0.2~0.8)后吸取100 μL与4 mL OPA试剂混合均匀,于20 ℃反应2 min,在340 nm波长下测定吸光度并利用标准曲线换算得到有效赖氨酸含量。
1.3.8 凝胶溶解性测定
取2 g鱼糜制品,分别与10 mL的0.05 mol/L NaCl(SA)、0.6 mol/L NaCl(SB)、0.6 mol/L NaCl+1.5 mol/L尿素(SC)和0.6 mol/L NaCl+8 mol/L尿素(SD)混合并均质,均质液在4 ℃下静置1 h后以9 000 r/min离心20 min。用双缩脲法测定上清液中蛋白质的含量,其中离子键以溶解于SB与SA溶液中蛋白质含量差表示;氢键以溶解于SC与SB溶液中蛋白质含量差表示;疏水相互作用以溶解于SD与SC溶液中蛋白质含量差表示[18]。
1.3.9 挥发性物质测定
SPME条件:称取鱼糜制品5 g,放入顶空进样瓶中,并用硅胶垫片与铝圈密封,于60 ℃条件下平衡10 min后,将老化后的50/30 μm二乙烯基苯/碳分子筛/聚二甲基硅氧烷(DVB/CAR/PDMS)涂层萃取头插入进样瓶,恒温吸附30 min后取出萃取头,并将其插入GC进样口,250 ℃解吸3 min后取出,用于GC-MS分析测定。
GC条件:色谱柱:TR-35 MS (30 m × 0.25 mm, 0.25 μm);进样模式:不分流;载气:高纯氦气;进样口温度: 250 ℃,升温程序:柱初温40 ℃,保持3 min,以5 ℃/min升至90 ℃,而后以10 ℃/min升至230 ℃,保持7 min。
MS条件:传输线温度250 ℃;离子源(EI)温度200 ℃;检测器温度280 ℃;电子能量70 eV;质量扫描范围m/z 30~500。
化合物分析:实验数据经Xcalibur软件处理完成,挥发性物质通过NIST 2.0谱库中做自动检索分析,且仅当正反匹配度(SI/RSI)均大于800(最大值为1 000)的鉴定结果才予以保留。并以2,4,6-三甲基吡啶作为内标物,对样品中有效的挥发性物质进行定量分析,计算方法详见相关参考文献[19-20]。
1.4 数据处理
实验数据统计值以x±SD形式表示,用Microsoft Word、Origin 7.5及Excel进行图表绘制采用SPSS 13.0和Excel进行数据处理,并采用Simca-p 14.0进行主成分分析。
2 结果与分析
2.1 微生物指标
3种不同加热方式杀菌后的鲟鱼鱼糜制品中细菌总数≤1 000 CFU/g,大肠菌群≤30 MPN/100 g,未检出致病菌,且经分段式杀菌方式处理后的鱼糜制品中细菌总数与大肠菌群数量最少。结果表明在本实验设定F值下均能有效对鲟鱼鱼糜制品杀菌,且分段式杀菌方式杀菌效果最佳。
2.2 凝胶强度
不同杀菌方式对鲟鱼鱼糜制品质构特性的影响如图1所示。由图1可知,3种杀菌方式均会导致凝胶强度显著下降,其中高温短时杀菌样品的凝胶强度下降最为显著,降低了38.30%,而分段式杀菌样品的凝胶强度降低较少,为22.99%。鱼糜凝胶化现象是由肌原纤维肌丝中的F肌动蛋白与肌球蛋白于一定温度下发生架桥现象,形成的富有弹性的三维网状结构[21]。架桥结构的化学作用力主要由疏水键和二硫键组成,同时氢键也起到辅助作用[22]。在高温条件下,疏水基团容易从蛋白质内侧翻出,导致蛋白质三维结构变化,推测这是凝胶强度下降的主要原因。ZHANG等[23]研究发现,高温会破坏具有“异构肽”的蛋白质,导致鱼糜中的蛋白质三维网状结构破坏,引起凝胶强度下降。而中温杀菌时间过长,过量水蒸气侵入鱼糜组织,导致结构溃散。

图1 杀菌方式对鱼糜凝胶强度的影响
Fig.1 Effect of sterilization method on jelly strength
of surimi products
2.3 持水性
鱼糜凝胶中形成的三维网状结构可以将自由水封锁在网目中,在挤压过程中防止水分外渗,故持水性能较有效地反映鱼糜凝胶网状结构的紧密型和交联强度,是反映鱼糜凝胶质构的重要指标[24]。不同杀菌方式对鲟鱼鱼糜制品质构特性的影响如图2所示。杀菌过程会导致鲟鱼鱼糜持水性降低,分段式杀菌方法制得的鲟鱼鱼糜凝胶持水性优于中温长时和高温短时杀菌。ZHANG等[25]研究发现,增加鱼糜凝胶疏水作用可以增强鱼糜制品的凝胶强度及持水性。但在高温杀菌处理过程中会导致鱼糜凝胶中疏水键打开[26],疏水作用力减弱,导致由疏水基团包裹住的水分流失,引起持水性下降。
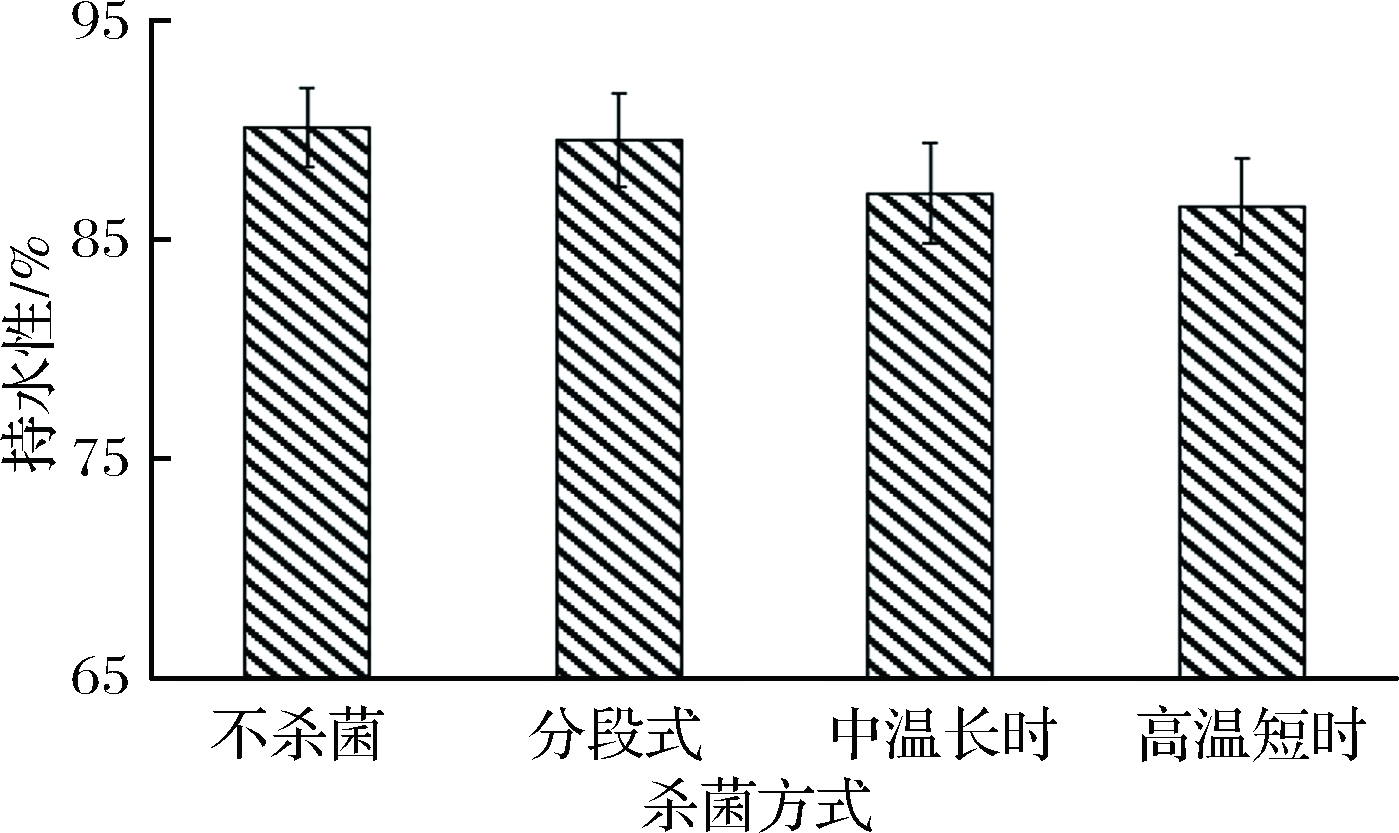
图2 不同杀菌方式对鱼糜凝胶持水性的影响
Fig.2 The effect of sterilization methods on the
water-holding capacity of surimi products
2.4 巯基与有效赖氨酸含量
不同杀菌方式对鲟鱼鱼糜制品的巯基与有效赖氨酸含量的影响如图3所示。由图3可知,未杀菌样品的活性巯基较少,而经高温杀菌处理后的鱼糜样品中活性巯基逐渐增多。活性巯基是由于二硫键在高温条件下降解生成的,可反应样品中二硫键的存在状态[27]。二硫键是蛋白凝胶形成的最重要的共价键,影响蛋白质的结构稳定性[28]。ZHANG等[25]研究发现,鱼糜凝胶形成过程中巯基含量的下降和肌原纤维蛋白的空间折叠相关。吴雪薇等[29]通过葡萄糖酸内酯诱导提高二硫键交联程度可以增强鱼糜凝胶强度。由图3可知,分段式杀菌方法对鲟鱼鱼糜凝胶中二硫键的损失最小。此外,杀菌过程会增加鲟鱼鱼糜中的有效赖氨酸含量。鱼糜制品的网状结构的由转谷氨酰酶(TGase酶)催化形成,TGase酶的主要作用是催化肌球蛋白重链与更多的ε-(γ-谷氨酰基)赖氨酸共价交联,从而提高凝胶强度[30]。当温度过高时会导致ε-(γ-谷氨酰基)赖氨酸共价键部分断裂,使赖氨酸重新暴露,引起凝胶强度下降。由图3可知,3种杀菌方法均会引起ε-(γ-谷氨酰基)赖氨酸共价键断裂,其中经分段式杀菌处理后的样品中ε-(γ-谷氨酰基)赖氨酸共价键断裂较少,即有效赖氨酸含量最少。
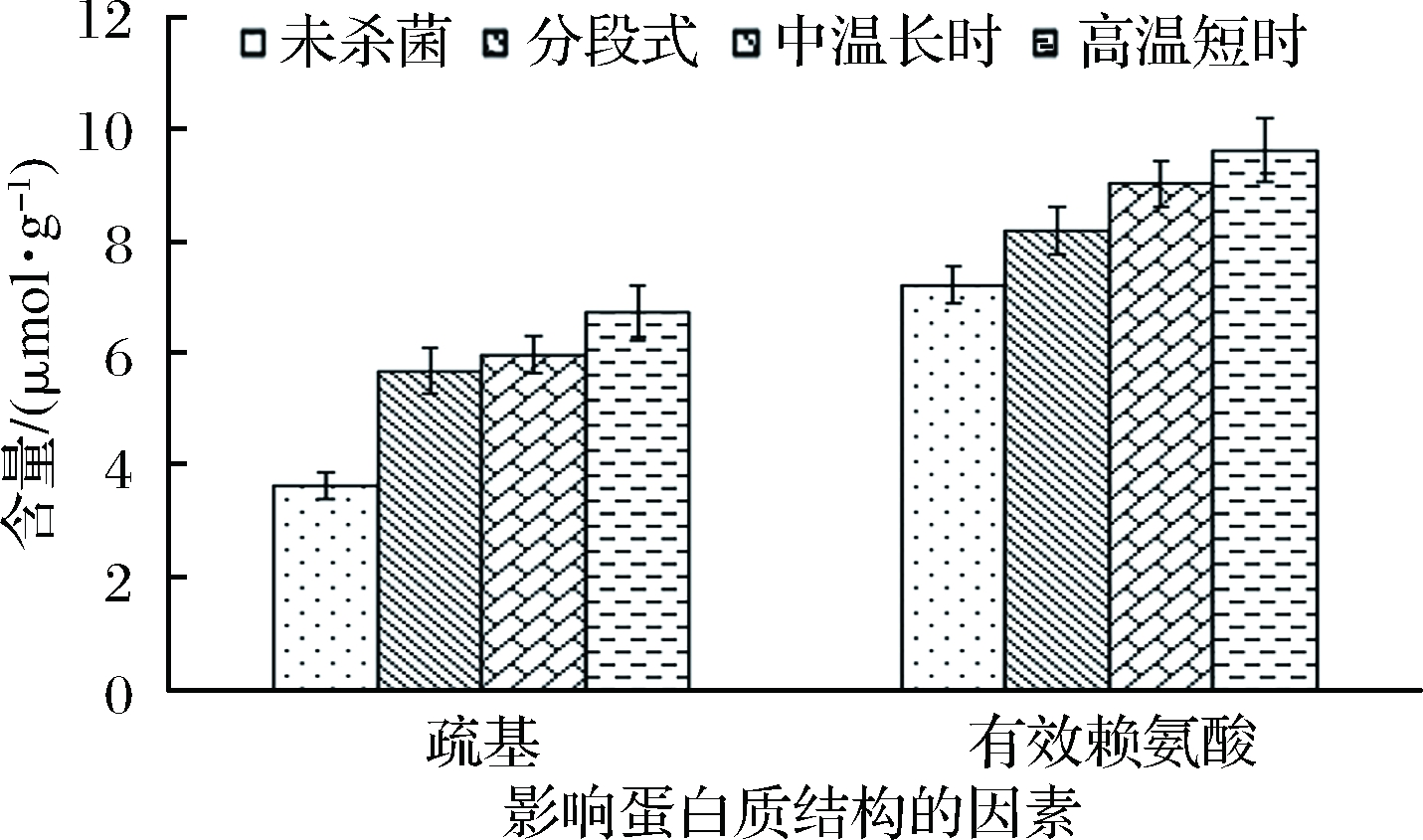
图3 不同杀菌方式对鱼糜凝胶巯基和有效赖氨酸含量
的影响
Fig.3 The effect of sterilization methods on the contents
of -SH and available lysine
2.5 其他化学作用力
影响鱼糜凝胶形成的重要化学作用力包括离子键、氢键、疏水作用力及共价键[31]。图4为离子键、氢键和疏水作用对不同杀菌方式鲟鱼鱼糜凝胶形成的影响。由图4可知,鲟鱼鱼糜在不同杀菌过程中离子键和氢键变化不显著,而疏水作用显著降低,其中分段式杀菌方式优于其他2种杀菌方式。对比未杀菌样品,分段式杀菌过程引起疏水作用力下降49.40%,可以推测杀菌过程主要破坏鱼糜凝胶中的疏水作用力。鱼糜在凝胶蛋白形成过程中,肌动球蛋白分子形成架桥结构,而蛋白分子的三级结构和四级结构是由疏水键和氢键维持的,疏水基团的破坏导致网状结构破坏,这与鱼糜制品的冷冻变性原理相似。KOBAYASHI等[32]利用红外及拉曼光谱研究不同斩拌条件下鱼糜蛋白空间结构的变化,发现凝胶形成随着疏水键的增加而增强,并随疏水键的减少而减弱。本实验结果基本与上述文献中所报道的结果相一致。
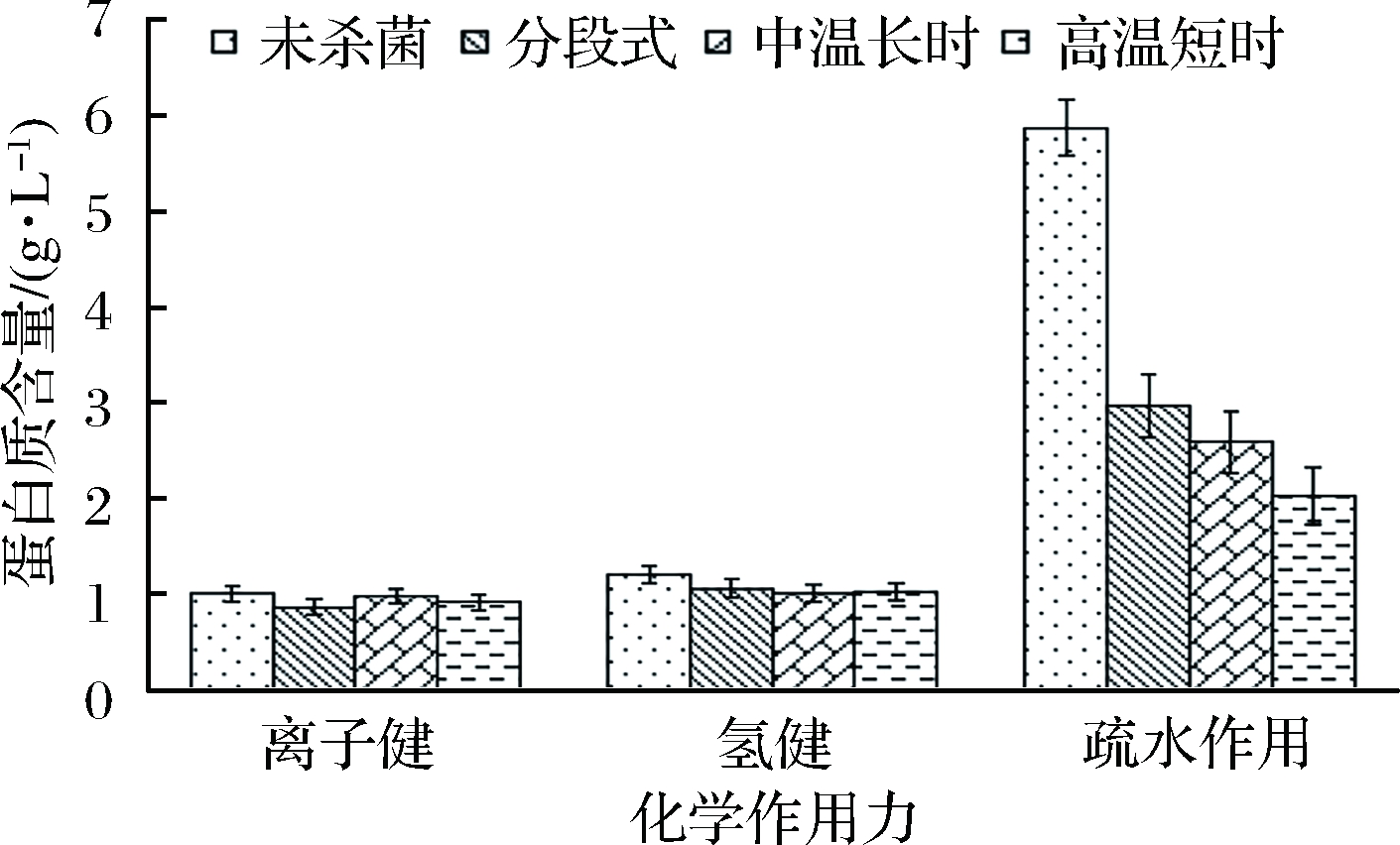
图4 不同杀菌方式对鱼糜凝胶化学作用力的影响
Fig.4 The effect of sterilization methods on the
chemical interactions of surimi products
2.6 鱼糜制品挥发性成分分析
本文采用顶空固相微萃取和气质联用技术(GC/MS),以2,4,6-三甲基吡啶作为内标物对未杀菌及经分段式、高温短时、中温长时杀菌处理后的4种鱼糜中挥发性物质进行定量分析,结果如表2所示。鱼糜中共鉴定出30种挥发性物质,包括醇类4种、醛类8种、酮类4种、酯类2种、烃类8种及芳香族化合物4种。评定即食鱼糜制品品质的好坏,首先其风味是可以被消费者所接受的。不同来源的鱼糜以及加工方式的不同都会造成鱼糜制品风味的差异。
醛类化合物通常是脂质氧化产生,其感觉阈值一般很低,对整体风味贡献大[33]。经中温长时杀菌处理后的鱼糜制品中醛类化合物含量最高,达48.46 mg/kg,主要为戊醛、庚醛、辛醛、壬醛、癸醛、月桂醛等直链醛。直链醛的气味随着分子质量的增加而变化,C5~C9醛呈现脂香、蜡香及青草香,而C10~C12醛则具有柑橘香与花香。该鱼糜中己醛、壬醛的含量最高,且感官阈值低,分别为4.5和1.0 μg/kg。己醛和壬醛具有特殊的脂香味、鱼腥味,含量越高,气味越强烈。有研究发现,己醛广泛存在于海鱼及淡水鱼中,可为鱼糜制品提高脂香味与甜橙味。此外,经分段式、高温短时杀菌处理后的鱼糜中醛类化合物总含量相差不明显(P>0.05),而未杀菌鱼糜中醛类总含量最低,仅为39.72 mg/kg。烃类化合物是鱼糜中含量仅次于醛类的挥发性物质,其主要是由于脂肪酸烷基自由基的断裂产生。大多数直链烃类(C14~C20)的感觉阈值通常较高。而部分支链烃类,如2,6,10-三甲基十四烷、2,6,10,14-四甲基十五烷可能对整体风味有辅助作用,可赋予加工鱼糜甜香与清香。醇类化合物是由于脂肪酸二级氢过氧化物的降解或羰基化合物还原生成,可分为饱和醇类与不饱和醇类。相比之下,不饱和醇类的感觉阈值更低,对整体风味贡献更大[34]。1-辛烯-3-醇是鱼糜种含量最高的不饱和醇类化合物,具有鱼腥味、青草味等特征风味[35]。在4种鱼糜中,分段式杀菌处理的鱼糜醇类含量最高(12.71 mg/kg),呈现淡淡的脂香和鱼肉香味,而经中温长时杀菌处理的鱼糜仅含10.72 mg/kg的醇类化合物,有“蒸煮味”。酮类化合物的产生机制与醛、醇类化合物类似,其感觉阈值较低,对鱼油整体风味的影响较大。在检测到的化合物中,3-辛酮、2-壬酮、2-十一酮和(E, E)-3,5-辛二烯-2-酮具有较低的感觉阈值,分别为50.3、5.5、6.1、10.0 μg/kg。这些酮类化合物具有花香味、脂香味、青草味、蘑菇香味等。未经杀菌处理的鱼糜中酮类含量最多,达3.93 mg/kg;而经中温长时杀菌处理的鱼糜中含量最少,仅有2.52 mg/kg。酯类化合物种类最少,仅有己酸乙烯酯和棕榈酸乙酯。己酸乙烯酯是由低级饱和单羧酸与低级不饱和醇反应所形成的酯类,具有愉快的水果香气,而棕榈酸乙酯分子质量大、挥发性小,其对鱼糜整体风味贡献小。4种鱼糜的酯类含量几乎相等。芳香族化合物为总含量最少的一类化合物,包括苯甲醛、邻二甲苯、苯乙烯和萘。芳香族化合物具有特殊的气味,原本苯的气味并不使人愉悦,但当羟基接入苯环上后,其气味便会有所改变。经杀菌处理后,鱼糜中芳香族化合物含量有较明显的增加,中温长时杀菌处理后的鱼油中含量最高(2.05 mg/kg),高温短时次之(1.27 mg/kg),而分段式杀菌最少(0.81 mg/kg)。
表2 鱼糜样品中挥发性成分变化
Table 2 Volatile flavor profiles of surimi with different sterilization methods

No.挥发性成分RI感觉阈值/(μg·kg-1)风味描述[33-35]挥发性物质浓度/ (mg·kg-1)未杀菌分段式杀菌高温短时杀菌中温长时杀菌醛类1戊醛776脂香0.32±0.03 d0.44±0.07 b0.40±0.08 c0.54±0.04 a22-甲基丁醛7320.2苦杏仁味0.81±0.07 d1.03±0.15 b0.89±0.10 c1.21±0.10 a3己醛8805.0青草味、鱼腥味14.11±0.43 b12.02±0.23 d13.45±0.35 c15.01±0.35 a4庚醛9922.9草香味7.03±0.22 d8.00±0.16 c8.87±0.19 ab8.92±0.19 a5辛醛1 0900.6脂香、水果味4.28±0.15 d4.76±0.17 b4.53±0.21 c5.32±0.21 a6壬醛1 2001.1青草味、脂香9.52±0.37 d10.93±0.30 b10.15±0.33 c13.24±0.33 a7癸醛1 3022青草味2.90±0.12 c3.02±0.12 b2.88±0.15 d3.21±0.15 a8月桂醛1 390柑桔香、皂香0.75±0.13 d0.89±0.05 b0.81±0.08 c1.01±0.08 a总含量39.72±0.34 d41.09±0.49 c41.98±0.52 b48.46±0.61 a醇类91-戊烯-3-醇790350焦香味、鱼腥味0.95±0.17 ab0.99±0.15 a0.82±0.10 c0.61±0.15 d102-乙基己醇1 120270 000蘑菇味0.83±0.13 b0.92±0.10 a0.77±0.09 c0.55±0.07 d111-辛烯-3-醇1 0901鱼腥味、青草味8.74±0.31 b8.91±0.42 a8.53±0.24 c8.16±0.43 d12庚醇1 0205坚果味、脂香味1.91±0.25 a1.89±0.14 b1.75±0.20 c1.40±0.12 d总含量12.43±0.46 b12.71±0.31 a11.85±0.29 c10.72±0.25 d酮类133-辛酮1 16050.3花香味0.75±0.09 bc0.82±0.11 a0.76±0.14 b0.61±0.10 d
续表2
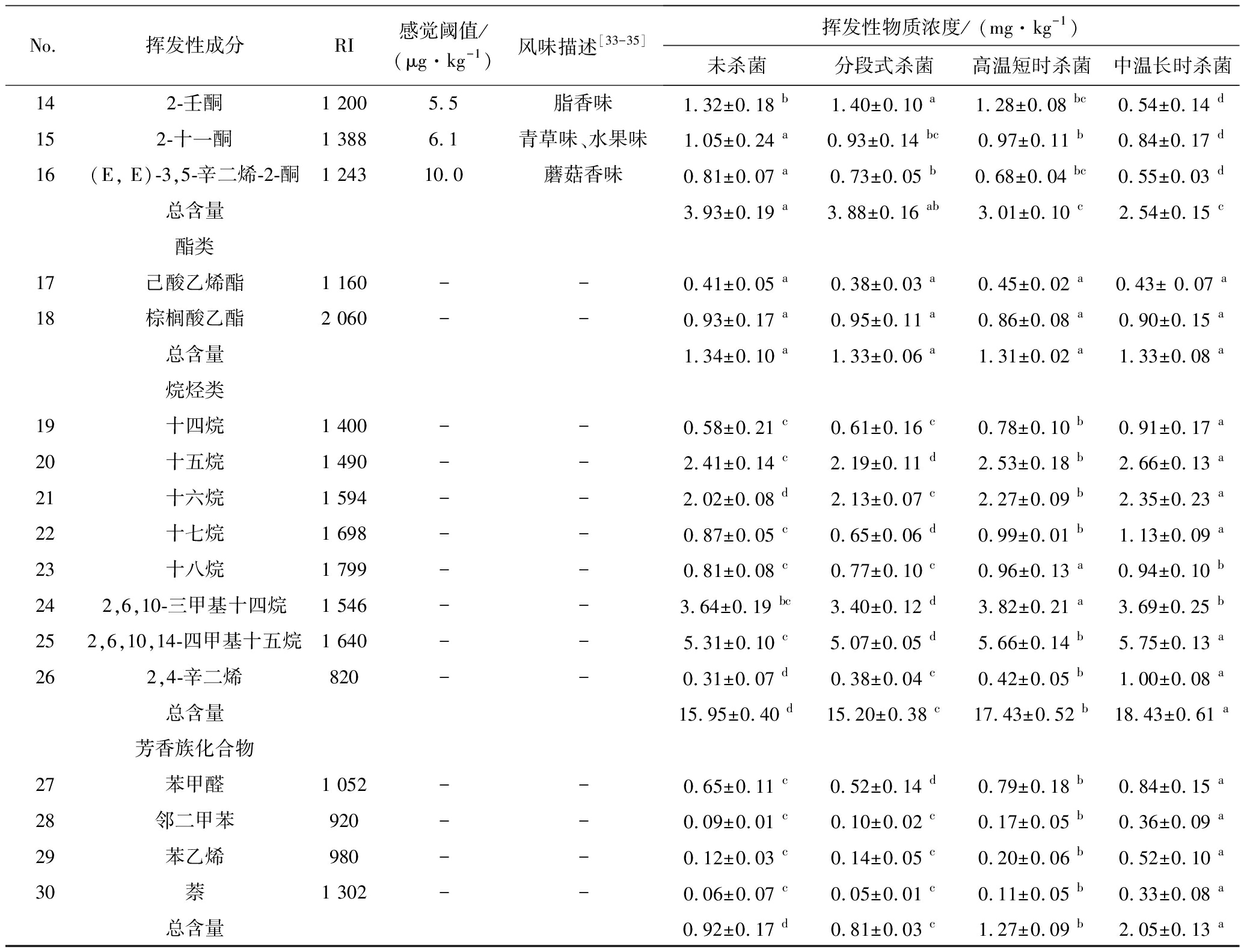
No.挥发性成分RI感觉阈值/(μg·kg-1)风味描述[33-35]挥发性物质浓度/ (mg·kg-1)未杀菌分段式杀菌高温短时杀菌中温长时杀菌142-壬酮1 2005.5脂香味1.32±0.18 b1.40±0.10 a1.28±0.08 bc0.54±0.14 d152-十一酮1 3886.1青草味、水果味1.05±0.24 a0.93±0.14 bc0.97±0.11 b0.84±0.17 d16(E, E)-3,5-辛二烯-2-酮1 24310.0蘑菇香味0.81±0.07 a0.73±0.05 b0.68±0.04 bc0.55±0.03 d总含量3.93±0.19 a3.88±0.16 ab3.01±0.10 c2.54±0.15 c酯类17己酸乙烯酯1 160--0.41±0.05 a0.38±0.03 a0.45±0.02 a0.43± 0.07 a18棕榈酸乙酯2 060--0.93±0.17 a0.95±0.11 a0.86±0.08 a0.90±0.15 a总含量1.34±0.10 a1.33±0.06 a1.31±0.02 a1.33±0.08 a烷烃类19十四烷1 400--0.58±0.21 c0.61±0.16 c0.78±0.10 b0.91±0.17 a20十五烷1 490--2.41±0.14 c2.19±0.11 d2.53±0.18 b2.66±0.13 a21十六烷1 594--2.02±0.08 d2.13±0.07 c2.27±0.09 b2.35±0.23 a22十七烷1 698--0.87±0.05 c0.65±0.06 d0.99±0.01 b1.13±0.09 a23十八烷1 799--0.81±0.08 c0.77±0.10 c0.96±0.13 a0.94±0.10 b242,6,10-三甲基十四烷1 546--3.64±0.19 bc3.40±0.12 d3.82±0.21 a3.69±0.25 b252,6,10,14-四甲基十五烷1 640--5.31±0.10 c5.07±0.05 d5.66±0.14 b5.75±0.13 a262,4-辛二烯820--0.31±0.07 d0.38±0.04 c0.42±0.05 b1.00±0.08 a总含量15.95±0.40 d15.20±0.38 c17.43±0.52 b18.43±0.61 a芳香族化合物27苯甲醛1 052--0.65±0.11 c0.52±0.14 d0.79±0.18 b0.84±0.15 a28邻二甲苯920--0.09±0.01 c0.10±0.02 c0.17±0.05 b0.36±0.09 a29苯乙烯980--0.12±0.03 c0.14±0.05 c0.20±0.06 b0.52±0.10 a30萘1 302--0.06±0.07 c0.05±0.01 c0.11±0.05 b0.33±0.08 a总含量0.92±0.17 d0.81±0.03 c1.27±0.09 b2.05±0.13 a
注:-为未检测到该物质;同行不同字母表示差异显著(P < 0.05)。
2.7 主成分分析
主成分分析(principal component analysis, PCA),又称主变量分析,是一种简化数据集的数理统计方法。通过线性变换,将一组可能存在相关性的变量转换成线性不相关的变量,并称转换后的变量为主成分。本文采用Simca-p 14.0软件对20个经不同方式处理后的样品中主要的挥发性成分进行PCA,结果如图5所示。第一与第二主成分贡献率分别为43.10 %和24.30 %,总贡献率为67.40 %,可见PCA能较好地反映不同杀菌方式处理后的鱼糜中挥发性风味的特征信号。由图5可知,20个即食鲟鱼鱼糜制品信息被分成4个有统计学意义的集群,即未杀菌、分段式杀菌、高温短时杀菌及中温长时杀菌,并分布在不同区域。未杀菌鱼糜能与经杀菌处理后的鱼糜较明显地区分开,说明3种杀菌方法对鱼糜中挥发性风味成分产生影响。根据GC/MS分析结果可知,分段式杀菌对鱼糜中挥发性风味成分的影响最小,其在PCA散点图上与未杀菌鱼糜距离最近。经中温长时杀菌处理后的鱼糜中挥发性成分变化最大,其远离未杀菌鱼糜,说明差异最大。而高温短时杀菌处理后的鱼糜则处于两者之间。PCA分析结果与挥发性成分分析结果基本一致。
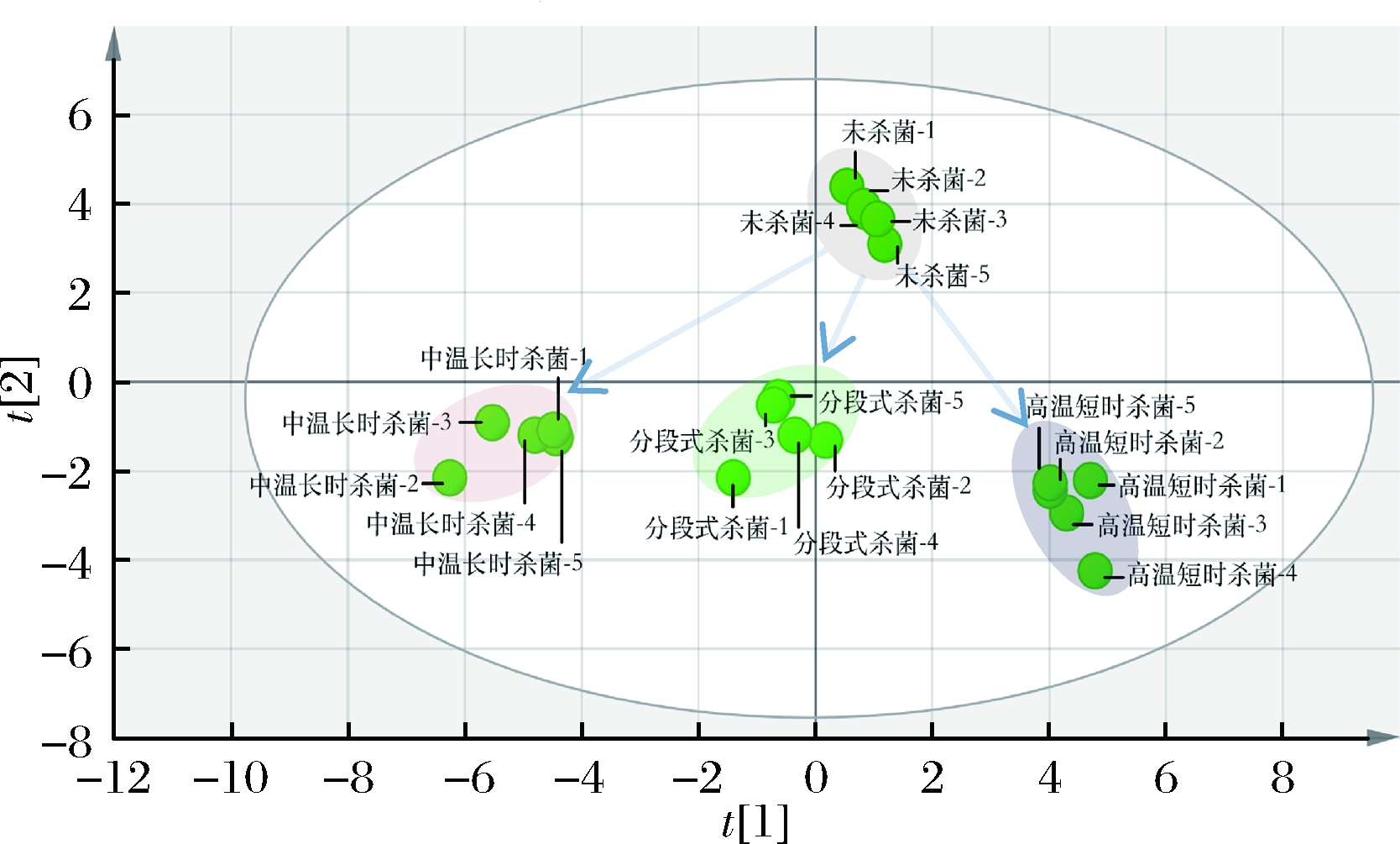
图5 不同杀菌方法处理后的鱼糜样品主成分分析散点图
Fig.5 The PCA scatter plot of the surimi processed by
different sterilization methods.
3 讨论
即食鱼糜制品具有良好的食用方便性和市场流通性,深受广大消费者的喜爱。但鱼糜蛋白经高强度的热杀菌处理(≥ 100 ℃)后凝胶强度、硬度、挥发性风味等指标会显著下降,严重影响鱼糜制品品质,如何选择最佳的热杀菌方式以保持即食鱼糜制品良好的凝胶特性及风味至关重要[36]。本文在相同F值(约5 min)条件下,研究分段式(108 ℃,25 min;115 ℃,15 min)、高温短时(121 ℃,5 min)及中温长时(105 ℃,200 min)杀菌对即食鲟鱼鱼糜品质的影响。
121 ℃是目前应用最为广泛的杀菌温度,鱼糜制品在121 ℃条件下杀菌较短时间就能有效地杀灭有害微生物从而达到商业无菌的条件,但过长时间的高温杀菌极易引起鱼糜制品品质的劣变。有研究表明,在121 ℃杀菌条件下,加热时间超过30 min后,鱼糜凝胶强度、硬度及拉伸度会迅速下降,甚至会产生不良风味物质(如硫化氢)。但适当降低热杀菌温度,则需延长加热时间。在鱼糜凝胶热杀菌过程中,随着加热时间的延长,其凝胶强度会明显下降,这可能与有效巯基基团数量因裂解或氧化成胍而减少引起的。故在实际热杀菌过程中,必须合理控制杀菌温度与加热时间。
分段式杀菌,前期温度较低(108 ℃,25 min),然后分段式升温,在确保即食鱼糜商业无菌的前提下,根据F值适当减少121 ℃杀菌条件下所需要的加热时间。通过对经3种热杀菌方式处理后鱼糜的凝胶强度、持水性、巯基(—SH)与有效赖氨酸含量、凝胶溶解性及挥发性风味成分的测定分析,分段式杀菌效果最优,鱼糜品质最好。本实验利用在相同F值条件下,分析3种不同杀菌方法对即食鱼糜具有一定的创新性,其实验结果可为食鱼糜制品的热杀菌工艺提供理论支持。但未对分段式杀菌方法中的杀菌温度与加热时间进行系统的优化,对于工艺参数的选择相对单一。在今后应开展分段式杀菌工艺参数的优化等实验,进一步完善F值叠加杀菌技术。
4 结论
本研究通过在相同杀菌效果(F值≈ 5 min)下,采用不同杀菌方式对鲟鱼鱼糜制品杀菌处理,并探索对凝胶强度及挥发性风味的影响及其机理。研究发现,热杀菌会导致鲟鱼鱼糜凝胶强度与持水性降低、巯基和有效赖氨酸含量增加以及离水键、氢键、疏水作用等化学力的作用效果减弱,从而影响鱼糜品质。在3种热杀菌方式中,F值叠加分段式杀菌方式对鱼糜中挥发性风味成分的影响最小,能较好地保持鱼糜制品品质。
[1] LI Jiuxuan, LIU Dongqi, MA Qingzhen, et al. Erratum to: Discriminating Dabry’s sturgeon (Acipenser dabryanus) and Chinese sturgeon (A. sinensis) based on DNA barcode and six nuclear markers[J]. Hydrobiologia, 2015,762(1):267-268.
[2] WANG Peifang, SHEN Yaxiong, WANG Chao, et al. An improved habitat model to evaluate the impact of water conservancy projects on Chinese sturgeon (Acipenser sinensis) spawning sites in the Yangtze River, China[J]. Ecological Engineering, 2017,104:165-176.
[3] 李晓燕,郝淑贤,李来好,等. 热熏鲟鱼加工过程中的品质变化[J]. 食品工业科技, 2015,36(19):73-77.
[4] 米红波,千春录,傲特海,等. 淡水鱼鱼糕加工适性和微冻特性的研究[J].中国食品学报, 2012,12(3):84-95.
[5] SEVENICH R, BARK F, KLEINSTUECK E, et al. The impact of high pressure thermal sterilization on the microbiological stability and formation of food processing contaminants in selected fish systems and baby food puree at pilot scale[J]. Food Control, 2015,50:539-547.
[6] 陈斌.热杀菌及添加物对罗非鱼鱼糜肠质构的影响[D].广州:华南理工大学,2012.
[7] 黄菊青,方婷,陈锦权. 酱汁鲍鱼硬罐头杀菌工艺及流变学性质研究[J]. 食品科学, 2011, 32(14):67-71.
[8] 韦依侬,张涛,李苗苗,等. 即食鱼糜制品贮藏过程中的品质稳定性研究[J]. 食品工业科技, 2017, 38(16):285-290.
[9] ZHANG Lili, ZHANG Fengxiang, WANG Xia. Changes of protein secondary structures of pollock surimi gels under high-temperature (100 ℃ and 120 ℃) treatment[J]. Journal of Food Engineering, 2016,171:159-163.
[10] 高涵,王玉,郭全友,等. 鲣鱼罐头的变温与恒温杀菌工艺比较[J]. 食品科学,2012,37(8):81-85.
[11] 曾宪泽,李汴生,梅灿辉,等. 即食梅香黄鱼热杀菌过程中的品质变化[J]. 食品科学, 2012, 33(18):113-117.
[12] ZHANG L, ZHANG Fengxiang, WANG Xia. Effects of hydrolyzed wheat gluten on the properties of high-temperature (≥100 ℃) treated surimi gels[J]. Food Hydrocolloids, 2015,45:196-202.
[13] 赵艾东. 水产软罐头食品的高温杀菌F值计算[J]. 海洋渔业,1987(3):106-109.
[14] GB 4789.3—2016 食品安全国家标准食品微生物学检验大肠杆菌计数[S].北京:中国标准出版社,2016.
[15] CANDO D, BORDER AS A J, MORENO H M. Influence of amino acid addition during the storage life of high pressure processed low salt surimi gels[J]. LWT - Food Science and Technology, 2017,75:599-607.
AS A J, MORENO H M. Influence of amino acid addition during the storage life of high pressure processed low salt surimi gels[J]. LWT - Food Science and Technology, 2017,75:599-607.
[16] BENJAKUL SENJAKUL, SEYMOUR THOMAS, MORRISSEY MICHAEL, et al. Physicochemical changes in pacific whiting muscle proteins during iced storage[J]. Journal of Food Science, 2010,62(4):729-733.
[17] CHARLES C, SWAISGOOD H, CATIGNANI G. A fluorimetric assay for available lysine in proteins[J]. Analytical Biochemistry, 1981,115(1):203-211.
[18] YU Nannan, XU Yanshun, JIANG Qixing, et al. Molecular forces involved in heat-induced freshwater surimi gel: Effects of various bond disrupting agents on the gel properties and protein conformation changes[J]. Food Hydrocolloids,2017,69:193-201.
[19] 许刚. 南极磷虾凝胶性能及其加工产品挥发性风味的研究[D]. 杭州:浙江工商大学,2016.
[20] GIRI A, OASKO K, OHSHIMA T. Identification and characterisation of headspace volatiles of fish miso, a Japanese fish meat based fermented paste, with special emphasis on effect of fish species and meat washing[J]. Food Chemistry, 2010,120(2):621-631.
[21] 沈月新. 水产食品学[M].北京:中国农业出版社,2010:217-218.
[22] PRAMUALKIJJA T, PIRAK T, KERDSUP P. Effect of salt, rice bran oil and malva nut gum on chemical, physical and physico-Chemical properties of beef salt-Soluble protein and its application in low fat salami[J]. Food Hydrocolloids, 2016,53:303-310.
[23] ZHANG Tao, XUE Yong, LI Zhaojie, et al. Effects of deacetylation of konjac glucomannan on Alaska Pollock surimi gels subjected to high-temperature (120 ℃) treatment [J]. Food Hydrocolloids, 2015,43:125-131.
[24] GANI A, BENJAKUL S, NUTHONG P. Effect of virgin coconut oil on properties of surimi gel[J]. Journal of Food Science and Technology, 2018,55(2):496-505.
[25] ZHANG Longteng, LI Qian, SHI Jing, et al. Changes in chemical interactions and gel properties of heat-induced surimi gels from silver carp (Hypophthalmichthys molitrix) fillets during setting and heating: Effects of different washing solutions[J]. Food Hydrocolloids, 2018,75:116-124.
[26] YANG Chen, WANG Yixiang, VASANTHAN Thava, et al. Impacts of pH and heating temperature on formation mechanisms and properties of thermally induced canola protein gels[J]. Food Hydrocolloids, 2014, 40:225-236.
[27] WEN Qinghui, TU Zongcai, ZHANG Lu, et al. Effect of high intensity ultrasound on the gel and structural properties of ctenopharyngodon idellus myofibrillar protein[J]. Journal of Food Biochemistry, 2017, 41(1):1-10.
[28] HOSSAIN M, ITOH Y, MORIOKA K, et al. Contribution of the polymerization of protein by disulfide bonding to increased gel strength of walleye pollack surimi gel with preheating time[J]. Fisheries Science, 2001,67:710-717.
[29] 吴雪微,姜启兴,许艳顺,等. 酸诱导鱼糜凝胶的酸化条件研究及凝胶特性分析[J]. 食品与机械, 2016,32(12):17-21.
[30] 贾丹,刘茹,刘明菲,等. 转谷氨酰胺酶对鳙鱼糜热诱导胶凝特性的影响[J]. 食品科学, 2013,34(9):37-41.
[31] LIU Haimei, GAO Linlin, REN Yunxing, et al. Chemical interactions and protein conformation changes during silver carp (Hypophthalmichthys Molitrix) surimi gel formation[J]. International Journal of Food Properties, 2014,17(8):1 702-1 713.
[32] KOBAYASHI Y, MAYER S, PARK J. FT-IR and Raman spectroscopies determine structural changes of tilapia fish protein isolate and surimi under different comminution conditions[J]. Food Chemistry, 2017,226:156-164.
[33] SONG Gongshuai, DAI Zhiyuan, SHEN Qing, et al. Analysis of the changes in volatile compound and fatty acid profiles of fish oil in chemical refining process[J]. European Journal of Lipid Science and Technology, 2017:41(2):55-65.
[34] SONG Gongshuai, ZHANG Mengna, PENG Xi, et al. Effect of deodorization method on the chemical and nutritional properties of fish oil during refining[J]. LWT - Food Science and Technology, 2018,96:560-567.
[35] LU F, BRUHEIM I, HAUGSGJERD B, et al. Effect of temperature towards lipid oxidation and non-enzymatic browning reactions in krill oil upon storage[J]. Food Chemistry,2014,157(26):398-407.
[36] 周绪霞,陈红,陈婷,等. 脂质对食品中蛋白质凝胶特性的影响及其作用机制[J]. 核农学报,2018,32(9):1 808-1 813.