鹿茸为鹿科动物梅花鹿或马鹿雄鹿未骨化密生茸毛的幼角,具有壮肾阳,益精血,强筋骨,调冲任,托疮毒的功效[1]。磺胺类药物(sulfonamides, SAs) 是由化学合成一类抗生素,主要用来预防和治疗细菌感染性疾病。具有稳定的化学性质、抗菌高效、低毒、价格便宜和使用方便等优点而被广泛应用到畜牧业上,并越来越受到养殖户的重视。但磺胺类药物在动物体内代谢时间较长,食用含有磺胺类药物的动物产品易在人体内蓄积,当蓄积浓度超过一定值时会对人体健康产生危害[2]。人长期摄入含磺胺类药物的动物性产品后,药物不断在人体内蓄积,损害肾脏、耐菌株大量繁殖、破环肠胃道微生物平衡等[3]。国际食品法典委员会和欧盟等规定食品中的磺胺总量不能超过100 μg/kg,我国农业农村部235号文件中规定磺胺类药物的总残留量最高为100 μg/kg[4]。
目前,磺胺类药物残留的检测方法主要有气相色谱-质谱法(GC-MS)[5-6]、高效液相色谱法(HPLC)[7-10]、毛细管电泳法[11-13]、酶联免疫分析法[14-16]、以及高效液相色谱-串联质谱法(HPLC-MS/MS)[17-20]等。HPLC法灵敏度低,抗干扰能力差;GC-MS法样品需经衍生化处理,操作复杂;毛细管电泳法由于进样量少,因而制备能力差,灵敏度较低;酶联免疫分析法重复性较低、稳定性较差以及存在交叉反应等;超高效液相色谱-串联质谱(ultra performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)法具有选择性强,灵敏度高,检测限低等优点,是目前最常采用的兽药残留的检测方法。
QuEChERS(quick、easy、cheap、effective、rugged、safe),是近年来国际上最新发展起来的一种快速检测的样品前处理技术,具有快速、准确、高效的特点[21-23]。目前, QuEChERS结合UPLC-MS/MS法测定鹿茸中磺胺类药物的检测方法未见报道。本研究采用QuEChERS法提取鹿茸中的磺胺类药物,以PSA、C18和中性氧化铝为净化剂,优化了最优提取和净化条件,并通过UPLC-MS/MS以外标法对市售鹿茸中的18种磺胺进行了含量测定。该方法具有操作简便,净化效果显著,灵敏度高、准确性好、检出限低等优点,可用于梅花鹿鹿茸中18种磺胺的检测。本方法的建立为鹿茸的质量评价研究提供了坚实的理论基础。
1 材料与方法
1.1 仪器与设备
超高效液相色谱-串联四极杆质谱联用仪(XEVO TQ-MS质谱仪),美国Waters公司;多样平行蒸发仪(Syncore101),瑞士步琪公司;超纯水器(Milli-Q Advantage A10),美国密理博公司;电子天平(XS205DU),梅特勒-托利多公司;高速冷冻离心机(3-30k),德国Sigma公司;涡旋振荡器(MVT-100),杭州奥盛仪器有限公司;超声波清洗仪,上海易净超声波仪器有限公司。
1.2 材料与试剂
甲醇、乙腈、正己烷、乙酸乙酯,均购于赛默飞世尔科技公司,纯度均>99.99%;PSA粉末、C18粉末中性氧化铝粉末(40~63 μm),分析纯,上海安谱科技股份有限公司;无水Na2SO4、NaCl(分析纯),国药集团化学试剂有限公司;磺胺醋酰(sulfacetamide),磺胺吡啶(sulfapyridine),磺胺嘧啶(sulfadiazine),磺胺甲恶唑(sulfamethoxazole),磺胺噻唑(sulfathiazole),磺胺甲基嘧啶(sulfamerazine),磺胺二甲恶唑(sulfamoxol),磺胺异恶唑(sulfisoxazole),磺胺甲噻二唑(sulfamethizole),磺胺苯酰(sulfabenzamide),磺胺二甲嘧啶(sulfamethazine),磺胺甲氧哒嗪(sulfamethoxypyridazine),磺胺间甲氧嘧啶(sulfamonomethoxine),磺胺氯哒嗪(sulfachloropyridazine),磺胺喹恶啉(sulfachinoxalin),磺胺邻二甲氧嘧啶(sulfadoxine),磺胺间二甲氧嘧啶(sulfadimethoxypyrimidine),磺胺苯吡唑(sulfaphenazole),纯度均98%以上,德国Dr.Ehrensorfer公司;超纯水,由超纯水机制备,电阻率≥18.25 MΩ。
鹿茸二杠茸样品采集自吉林省,共计54支,经中国农业科学院特产研究所李春义研究员鉴定为梅花鹿Cervus nippon Temminck二杠茸。将鹿茸样品进行编号,粉碎后保存于4℃的冰箱中待测
1.3 试验方法
1.3.1 标准溶液的配制
精密称取各磺胺标准品10.0 mg(精确到0.1 mg)置于50 mL的容量瓶中,用甲醇定容,配制成200 μg/mL的混合标准品溶液,于4℃保存。
1.3.2 供试品溶液的制备
1.3.2.1 提取
准确称取鹿茸粉1.00 g(精确到0.01 g),置于50 mL玻璃试管中,加入10 mL乙腈,漩涡2 min,使其充分混匀,置于超声仪中超声提取15 min后,静止3 min后,倒入50 mL的聚丙烯离心管中,残渣中加入10 mL乙腈重复上述步骤提取2次,合并提取液,置于离心机中,10 000 r/min离心10 min,取上清液,置于蒸发仪中蒸发近干,待复溶净化。
1.3.2.2 净化
加4 mL的甲醇-水(1∶4,体积比)复溶,加10 mL正己烷除脂,涡旋混匀,静置待分层后取下清液转移到装有100 mg的C18、70 mg PSA和50 mg的中性氧化铝的10 mL离心管中,涡旋5 min充分混匀,置于4℃的离心机中,以15 000 r/min离心15 min,取上清液经0.22 μm水系滤膜超滤后上机测定。
1.3.3 色谱条件
色谱柱为ACQUITYBEHC18(2.1 mm×100 mm,1.7 μm);柱温为35℃;流速为0.3 mL/min;进样量3 μL;流动相A为25 mmol/L甲酸乙腈,B为水。梯度洗脱程序见表1。
表1 18种磺胺的流动相梯度表
Table 1 Flow phase gradient table of 18 sulfonamides

时间/min流速/(mL·min-1)流动相A/%流动相B/%00.399110.399140.3168460.3247690.33565100.3901010.50.39010110.3991140.3991
1.3.4 质谱条件
电离方式:正离子模式(ESI+);扫描方式:多反应监测(MRM);毛细管电压:3 kV;离子源温度:150℃;脱溶剂温度:450℃;碰撞气流量:0.19 mL/min;脱溶剂气流量:1 000 L/h。
2 结果与分析
2.1 提取剂的选择与优化
试验先对乙腈、乙酸乙酯、甲醇、正己烷4种提取溶剂进行考察,结果表明,以强极性的甲醇为提取溶剂时,浓缩后瓶上附着有大量蛋白质变性产物,形成较大的颗粒状物质,复溶时无法除尽,致使回收率下降,说明颗粒状物质包裹了目标物;用正己烷,乙酸乙酯提取时,净化后有较多絮状脂肪难于分离沉淀,不利于过膜超滤;乙腈为提取溶剂时,能很好地分离沉淀蛋白质和脂肪,降低了杂质的干扰。同时为检验酸碱提取对磺胺类药物的影响,试验对0.5 g Na2SO4和0.5 g NaCl乙腈、0.1%甲酸乙腈、0.2%甲酸乙腈,0.1%氨水乙腈,0.2%氨水乙腈5种提取液进行考察比较,综合发现加盐、酸或加碱后磺胺的回收率均低于纯乙腈,这可能是加盐、酸或碱后,不利于目标物的电离,故选择纯乙腈作为提取液,简化了试验步骤及成本。
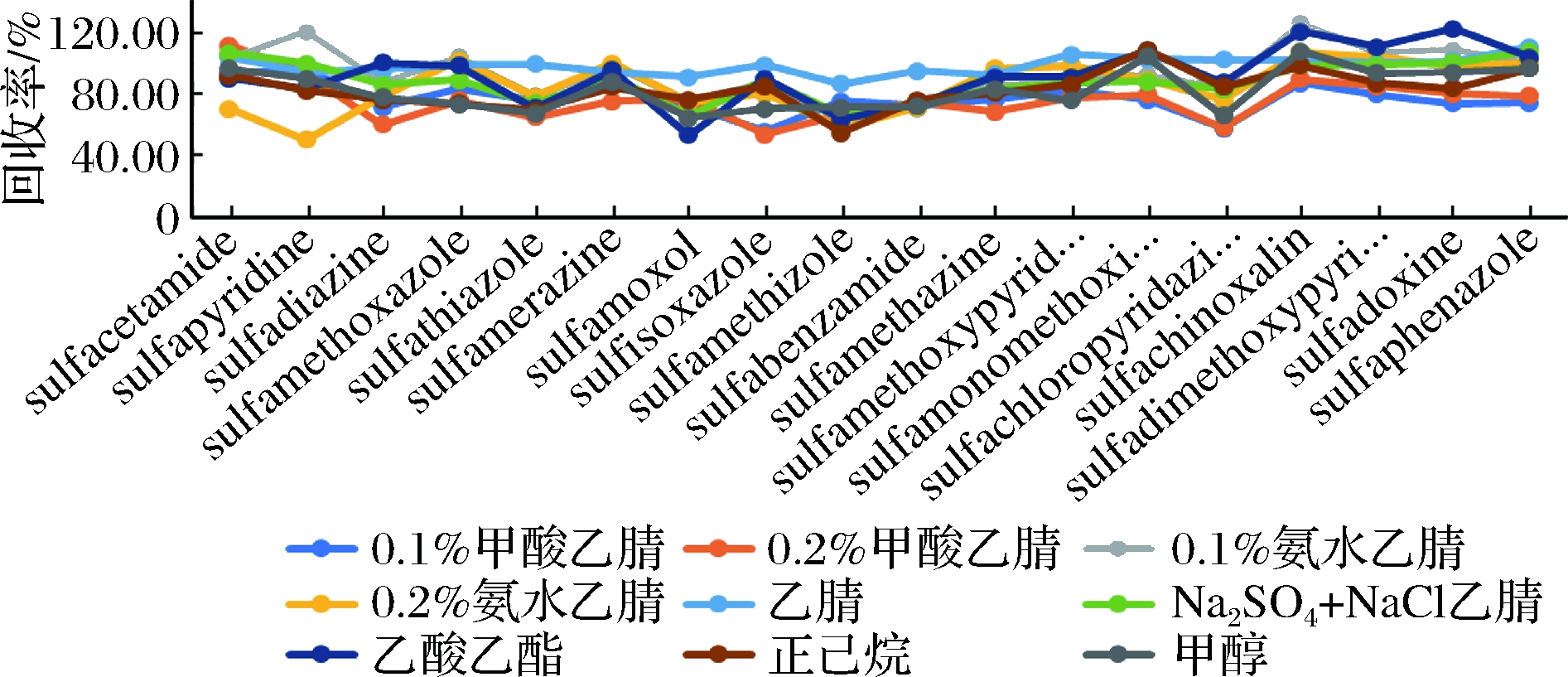
图1 不同提取剂对18种磺胺回收率的影响
Fig.1 Effect of different extractants on the recovery
rate of 18 sulfonamides
2.2 提取条件的选择与优化
试验对涡旋振荡法与超声提取法进行考察,方法如表2所示。部分结果见图2。结果显示,18种磺胺回收率在方法3条件下提取均略高于其他提取方法。超声提取时,对比2种容器中的提取液,玻璃试管中的比较浑浊,表明超声波对玻璃试管穿透力强,有利于目标物的提取。当超声时间为15~20 min时,18种磺胺的回收率较高,采用9.4 SAS软件分析,P值大于0.65,差异性不显著,故选取超声15 min为提取时间。
表2 不同提取方法条件的设置
Table 2 Setting of conditions for different extraction
methods

方法提取方法容器提取时间/min方法1涡旋振荡法聚丙烯离心管5,10,15,20方法2超声提取法聚丙烯离心管5,10,15,20方法3超声提取法50 mL玻璃试管5,10,15,20

图2 提取15min时,18种磺胺的回收率
Fig.2 Recovery of 18 sulfonamides at 15 minutes
of extraction
2.3 净化剂的选择与优化
常用的净化剂有PSA、C18、中性氧化铝、石墨碳化黑和无水硫酸镁等。无水硫酸镁常用于吸附水分,石墨碳化黑可以有效的去除色素,对鹿茸中的脂类、糖类无净化作用; C18能除去基质中的脂肪、蛋白质和PSA可以除去鹿茸中的脂肪、糖类物质、有机酸等杂质,中性氧化铝可以除去一部分的脂肪。本试验采用分散固相萃取技术进行净化,根据鹿茸的主要成分及目标物的性质,以PSA(50,70,90,110 mg)与C18(50,100,150,200 mg)中性氧化铝50 mg组合,通过加样回收率考察最优净化条件。结果表明,以70 mg PSA、100 mg C18、50 mg中性氧化铝净化时为最优净化条件,18种磺胺的回收率为86.4%~106.5%,均能满足试验需求。随着PSA与C18用量的增加,18种磺胺的回收率反而降低,这可能是过量的PSA与C18会吸附一部分的磺胺,致使回收率降低。结果如图3所示,16种净化组合的18种磺胺的总体平均回收率。

图3 16种净化组合的18种磺胺的总体平均回收率
Fig.3 Total average recovery of 18 sulfonamides
from 16 purification combinations
2.4 质谱条件的优化
根据磺胺类药物的结构,通过正离子、负离子扫描模式对比发现,[M+H]+产生的子离子丰度相对稳定,响应值比较高,保证了定量结果的准确性。采用针泵连续直接进样,选择[M+H]+为母离子进行调谐,分别对碰撞电压、锥孔电压等条件进行了优化,具体参数见表3。
2.5 色谱条件的优化
流动相是影响色谱峰形和分离效果的一个重要条件。试验考察了乙腈-水、25 mmol/L甲酸乙腈-水、乙腈-25 mmol/L甲酸3种流动相,以25 mmol/L甲酸乙腈-水按1.3.3条件下洗脱时,18种磺胺的响应值高、干扰少、峰形好、检出限低,因此最终选定25 mmol/L甲酸乙腈-水为流动相。图4为18种磺胺的总离子流图。
表3 18种磺胺的的MRM质谱参数
Table 3 MRM Mass Spectrometric Parameters
of 18 Sulfonamides
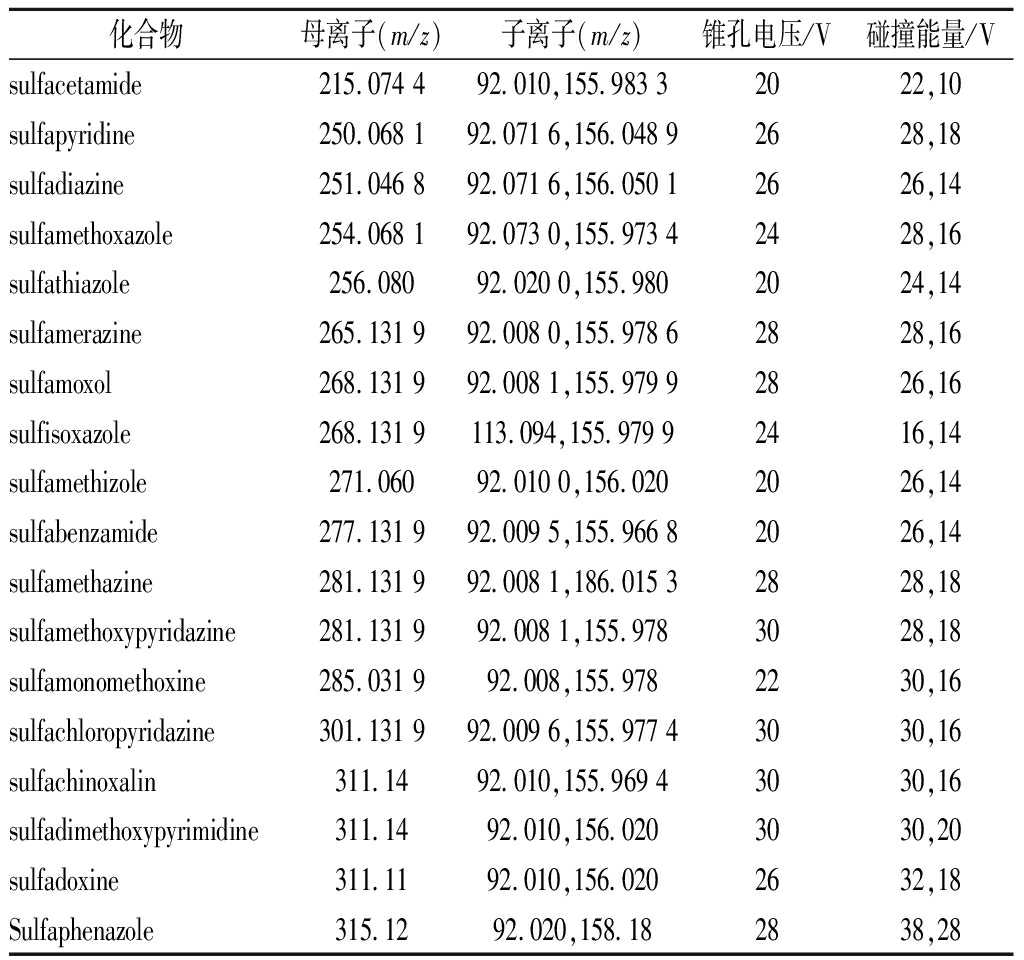
化合物母离子(m/z)子离子(m/z)锥孔电压/V碰撞能量/Vsulfacetamide215.074 492.010,155.983 32022,10sulfapyridine250.068 192.071 6,156.048 92628,18sulfadiazine251.046 892.071 6,156.050 12626,14sulfamethoxazole254.068 192.073 0,155.973 42428,16sulfathiazole256.08092.020 0,155.9802024,14sulfamerazine265.131 992.008 0,155.978 62828,16sulfamoxol268.131 992.008 1,155.979 92826,16sulfisoxazole268.131 9113.094,155.979 92416,14sulfamethizole271.06092.010 0,156.0202026,14sulfabenzamide277.131 992.009 5,155.966 82026,14sulfamethazine281.131 992.008 1,186.015 32828,18sulfamethoxypyridazine281.131 992.008 1,155.9783028,18sulfamonomethoxine285.031 992.008,155.9782230,16sulfachloropyridazine301.131 992.009 6,155.977 43030,16sulfachinoxalin311.1492.010,155.969 43030,16sulfadimethoxypyrimidine311.1492.010,156.0203030,20sulfadoxine311.1192.010,156.0202632,18Sulfaphenazole315.1292.020,158.182838,28
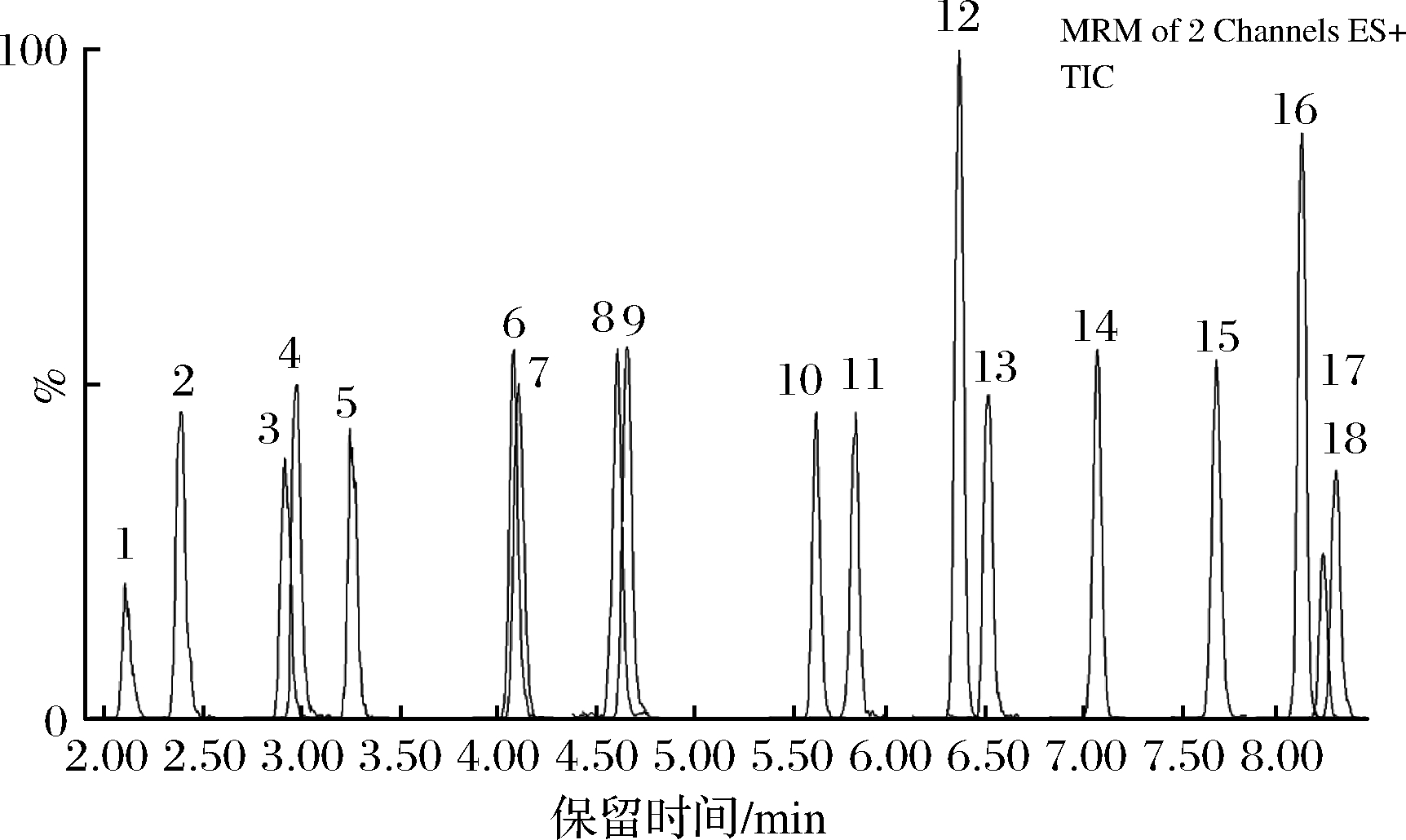
1-sulfacetamide;2-sulfapyridine;3-sulfadiazine;4-sulfamethoxazole;
5-Sulfathiazole;6-sulfamerazine;7-sulfamoxol;8-sulfisoxazole;
9-Sulfamethizole;10-sulfabenzamide;11-sulfamethazine;
12-sulfamethoxypyridazine;13-sulfamonomethoxine;
14-sulfachloropyridazine;15-sulfachinoxalin;
16-Sulfadimethoxypyrimidine;17-sulfadoxine;18-Sulfaphenazole
图4 18种磺胺的总离子流图
Fig.4 MRM mass spectrums of 18 kinds of sulfonamides
2.6 方法学考察
2.6.1 线性关系、检出限和定量限
将混合标准品溶液用甲醇进行梯度稀释,配成浓度为0.025,0.075,0.25,0.5,1,2,5,10,25,50 ng/mL的混合标准品溶液,以峰面积(Y)为纵坐标,标准品浓度(X)为横坐标绘制标准曲线。将18种磺胺混合对照品溶液用甲醇逐级稀释后,以信噪比(S/N)的3倍的溶液浓度为检出限(LOD),S/N的10倍溶液浓度为定量限(LOQ)。18种磺胺的回归方程、线性范围、检出限和定量限见表4。18种磺胺在0.025~50 ng/mL线性关系良好,相关系数R2均大于0.999 1,其中7种磺胺的LOD为0.025 μg/kg,LOQ为0.075 μg/kg,11种磺胺的LOD为0.075 μg/kg,LOQ为0.25 μg/kg。
表4 18种磺胺的线性方程、相关系数、线性范围、
检出限、定量限
Table 4 18 linear equations, coefficients, linear ranges,
LOD and LOQ of 18 sulfonamides
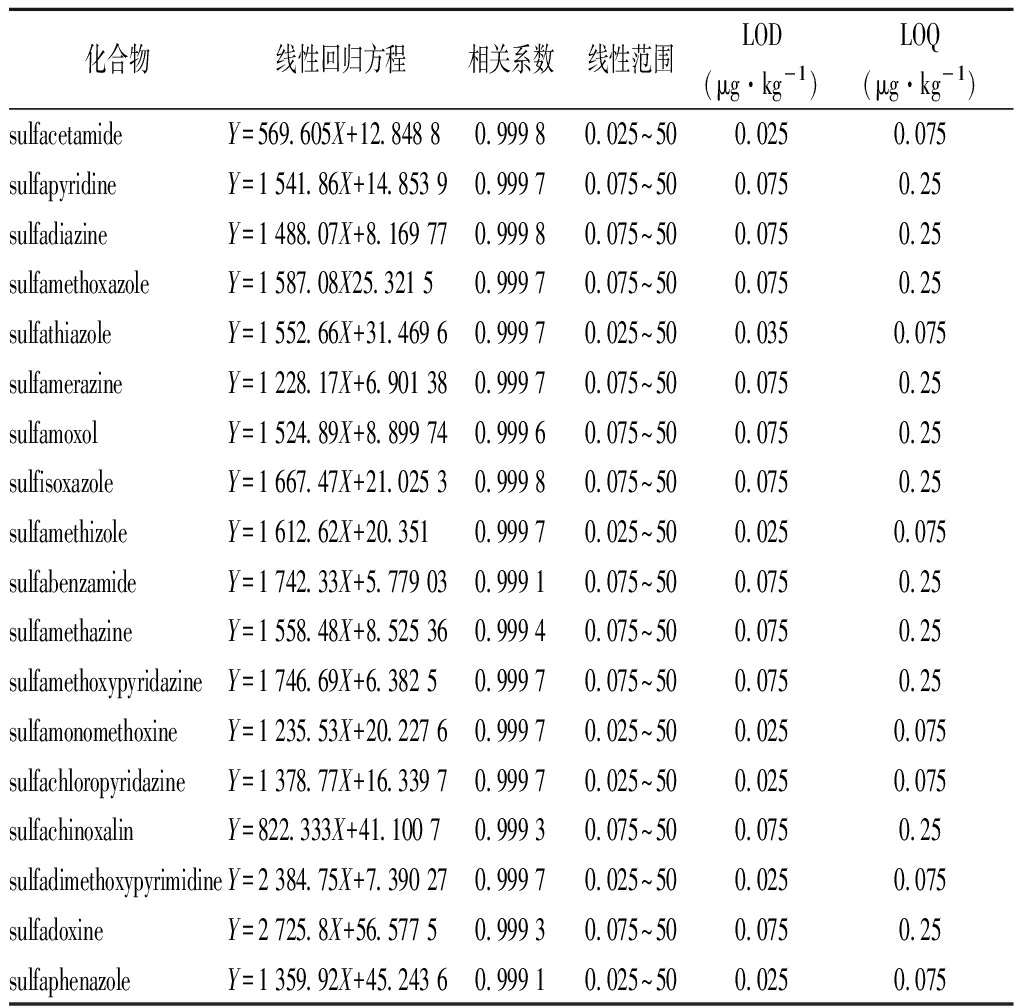
化合物线性回归方程相关系数线性范围LOD(μg·kg-1)LOQ(μg·kg-1)sulfacetamideY=569.605X+12.848 80.999 80.025~500.0250.075sulfapyridineY=1 541.86X+14.853 90.999 70.075~500.0750.25sulfadiazineY=1 488.07X+8.169 770.999 80.075~500.0750.25sulfamethoxazoleY=1 587.08X25.321 50.999 70.075~500.0750.25sulfathiazoleY=1 552.66X+31.469 60.999 70.025~500.0350.075sulfamerazineY=1 228.17X+6.901 380.999 70.075~500.0750.25sulfamoxolY=1 524.89X+8.899 740.999 60.075~500.0750.25sulfisoxazoleY=1 667.47X+21.025 30.999 80.075~500.0750.25sulfamethizoleY=1 612.62X+20.3510.999 70.025~500.0250.075sulfabenzamideY=1 742.33X+5.779 030.999 10.075~500.0750.25sulfamethazineY=1 558.48X+8.525 360.999 40.075~500.0750.25sulfamethoxypyridazineY=1 746.69X+6.382 50.999 70.075~500.0750.25sulfamonomethoxineY=1 235.53X+20.227 60.999 70.025~500.0250.075sulfachloropyridazineY=1 378.77X+16.339 70.999 70.025~500.0250.075sulfachinoxalinY=822.333X+41.100 70.999 30.075~500.0750.25sulfadimethoxypyrimidineY=2 384.75X+7.390 270.999 70.025~500.0250.075sulfadoxineY=2 725.8X+56.577 50.999 30.075~500.0750.25sulfaphenazoleY=1 359.92X+45.243 60.999 10.025~500.0250.075
2.6.2 精密度试验
精密吸取10 ng/mL的18种磺胺混合对照品溶液3 μL,按1.3.3和1.3.4质谱和液相条件进样分析,连续进样6次,测定峰面积,计算18种磺胺的RSD。结果表明,18种磺胺的峰面积RSD为1.21%~3.67%,均小于5%,表明仪器精密度良好。
2.6.3 稳定性试验
精密称取1.00 g鹿茸样品,按1.3.2项下制备供试品溶液,分别在0、2、4、8、16、24、48 h按1.3.3和1.3.4液相和质谱条件进样分析,每次进样3 μL,18种磺胺的峰面积RSD为1.29%~2.35%,均小于5%,表明仪器稳定性良好。
2.6.4 重复性试验
称取同一鹿茸样品6份,按1.3.2项下制备供试品溶液,按1.3.3和1.3.4项下质谱和液相条件进样分析,每次进样3 μL,测定峰面积,计算18种磺胺含量和RSD,结果18种磺胺的RSD为1.24%~3.31%,表明本试验重复性良好。
2.6.5 加样回收试验
精密称取9份已知18种磺胺的鹿茸样品粉末1.00 g,按照低、中、高剂量加入适量的18种磺胺标准品,按1.3.2制备供试品溶液,按1.3.3和1.3.4质谱和液相条件进样分析,每次进样3 μL,测定峰面积,计算18种磺胺含量和回收率及RSD。结果表明,18种磺胺的平均加标回收率为89.2%~96.1%,RSD为2.9%~3.9%,表明本试验准确度较高。
表5 18种磺胺的回收率与精密度
Table 5 Recovery and precision of 18 sulfonamides

化合物0.5 μg/kg1 μg/kg5 μg/kg回收率/%RSD/%回收率/%RSD/%回收率/%RSD/%sulfacetamide87.64.397.43.7104.62.4sulfapyridine84.33.288.32.598.31.8sulfadiazine82.14.283.13.494.13.2sulfamethoxazole80.44.784.43.290.53.5sulfathiazole83.63.588.63.298.62.5sulfamerazine87.44.296.44.197.23.4sulfamoxol81.33.887.33.192.33.1sulfisoxazole80.74.196.23.6102.13.6sulfamethizole84.44.290.43.2103.42.6sulfabenzamide81.63.388.32.798.62.3sulfamethazine87.34.487.43.297.54.1sulfamethoxypyridazine82.43.592.33.192.83.5sulfamonomethoxine85.14.290.13.295.83.3sulfachloropyridazine80.84.687.44.294.23.2sulfachinoxalin82.63.588.63.398.43.1sulfadimethoxypyrimidine83.14.297.44.2107.22.4sulfadoxine83.23.492.33.1102.33.5Sulfaphenazole80.43.295.13.7100.12.8
2.7 实际样品检测
实验对54个鹿茸样按1.3.2进行前处理,按1.3.3和1.3.4质谱和液相条件进样分析。结果4份检出磺胺甲恶唑,含量为0.15、0.24、0.31、0.42 μg/kg, 3份检出磺胺异恶唑,含量分别为0.19、0.20、0.24 μg/kg;1份检出磺胺甲噻二唑,含量为0.28 μg/kg;2份检出磺胺邻二甲氧嘧啶,含量为0.32、0.36 μg/kg;4份检出磺胺间二甲氧嘧啶,含量为0.24、0.28、0.34、0.37 μg/kg,目前针对中药材兽药残留尚未有既定的标准,按照严格的食品标准,所检出的磺胺含量均未超标。
3 结论
本试验以乙腈为提取溶剂、超声提取,PSA、C18与中性氧化铝净化,建立以UPLC-MS/MS法检测梅花鹿鹿茸中18种磺胺的检测方法。该方法具有操作简便,净化效果显著,灵敏度高、准确性好、检出限低等优点,可用于梅花鹿鹿茸中18种磺胺的检测。本方法的建立为鹿茸的质量评价研究提供了坚实的理论基础。
[1] 国家药典委员会. 中华人民共和国药典: 2015年版. 一部[S]. 北京:中国医药科技出版社,2015: 323-324.
[2] 孙亚奇,郭京超,潘源虎,等. 磺胺类药物代谢与残留消除以及检测方法研究进展[J]. 中国兽药杂志,2019,53(2):66-75.
[3] 于淼. 养殖业中磺胺类药物残留的危害及现状[J]. 现代畜牧科技,2015,29(2):133.
[4] 中华人民共和国农业农村部.动物性食品中兽药最高残留限量(农业农村部2002年235号公告)[EB/OL].[2012-12-24]. http://moa.gov.cn/gk/tzgg-1/gg/200302/t20030226.59300.htm.
[5] 赵晓凤,杨中. 气相色谱-串联质谱法检测猪肉组织中的磺胺二甲嘧啶残留量[J]. 饲料工业,2007,28(2):54-57.
[6] 廖春蓉,郭雅蓉. 气相色谱-串联质谱法检测葡萄中苯氟磺胺和甲苯氟磺胺残留量[J]. 医学动物防制,2017,33(2):236-238.
[7] 李仪,张炎,张雅婷,等. 微萃取超高效液相色谱检测磺胺类药物的研究[J]. 华东师范大学学报(自然科学版),2019,204(2):156-163.
[8] 杨舒婷,林伟锐,梁建华,等. 固相萃取-高效液相色谱法测定水中磺胺二甲基嘧啶、磺胺甲基异噁唑的方法探究[J]. 肇庆学院学报,2019,40(2):46-50.
[9] 段羚. 高效液相色谱法测定饮料中乙酰磺胺酸钾含量的不确定度分析[J]. 现代食品,2018,31(20):91-95.
[10] 冯涛,刘道中,章安源,等. 高效液相色谱法测定恩诺沙星注射液中的磺胺类药物[J]. 山东畜牧兽医,2019,40(1):3-5.
[11] 周靖雯,吴友谊,殷斌. 中空纤维膜液相微萃取-毛细管电泳法测定环境水样中的4种磺胺类药物[J]. 理化检验-化学分册,2018,54(6):627-633.
[12] 陈建,杨灵芝,张金金,等. 毛细管电泳法分离9种磺胺类药物[J]. 分析仪器,2018,42(3):51-56.
[13] 韩燕祯,朱怀娇,石红梅,等. 高效毛细管电泳法测定泳池中尿液指示物乙酰磺胺酸钾[J]. 分析测试学报,2018,37(7):854-857.
[14] 黄学泓,陈燕勤,林文. 酶联免疫分析法测定猪肠衣中磺胺二甲基嘧啶残留量[J]. 检验检疫学刊,2011,21(4):21-22;52.
[15] 刘超,韩世泉,刘一兵. 广谱检测磺胺类药物的酶联免疫分析方法的建立[J]. 标记免疫分析与临床,2012,19(5):286-290.
[16] 蒋文晓. 动物性食品中喹噁啉类药物代谢物和磺胺类—喹诺酮类药物多残留免疫分析方法研究[D]. 北京:中国农业大学,2014.
[17] 王欣梅,徐桂菊,王晓利,等. 三聚氰胺/邻苯二甲醛共价有机骨架材料结合固相萃取-液相色谱串联质谱检测环境水样中痕量磺胺类抗生素[J]. 分析化学,2018,46(12):149-155.
[18] 刘小燕,高仕谦,丁阳杰,等. 离子液体磁性石墨烯-超高效液相色谱串联质谱法测定水中的磺胺类抗生素[J]. 现代化工, 2019,54(5):246-250;252.
[19] 刘桂英,宋广军,王召会,等. 固相萃取-超高效液相色谱串联质谱法测定水产品中磺胺类药物残留[J]. 食品安全质量检测学报,2019,25(8):2 240-2 246.
[20] 钱卓真,汤水粉,梁焱,等. QuEChERS-高效液相色谱-串联质谱法同时测定水产养殖环境沉积物中磺胺类、喹诺酮类、大环内酯类抗生素[J]. 质谱学报,2019,30(4):356-368.
[21] KIM L, LEE D, CHO H, et al. Review of the QuEChERS method for the analysis of organic pollutants: Persistent organic pollutants, polycyclic aromatic hydrocarbons, and pharmaceuticals[J]. Trends in Environmental Analytical Chemistry, 2019, 25(12):2 247-2 256.
[22] PERESTRELO R, SILVA P, PORTO-FIGUEIRA P, et al. QuEChERS - Fundamentals, relevant improvements, applications and future trends[J]. Analytica Chimica Acta,2019, 33(18):2 140-2 146.
[23] DUALIE P, PARDO O, FERN NDEZ S F, et al. Determination of four parabens and bisphenols A, F and S in human breast milk using QuEChERS and liquid chromatography coupled to mass spectrometry[J]. Journal of Chromatography B,2019, 1 114:154-166.
NDEZ S F, et al. Determination of four parabens and bisphenols A, F and S in human breast milk using QuEChERS and liquid chromatography coupled to mass spectrometry[J]. Journal of Chromatography B,2019, 1 114:154-166.