氯霉素(chloroamphenicol,CAP)是一种价格低廉且高效的广谱抗生素,对多种有害细菌有较好的抑制作用,在水产品养殖业中得到广泛的应用[1-2]。但氯霉素有较强的副作用和毒性,当动物源性食品随着食物链被人体长期摄入,可引发多种疾病[3-4]。为了保护消费者健康,我国农业部在2002年12月第235号公告《动物性食品中兽药最高残留限量》中规定氯霉素为禁用药物,在动物性食品中不得检出[5-6]。
目前,水产品中氯霉素残留检测的主要方法有色谱方法、胶体金免疫层析法和ELISA等方法。色谱方法一般需要昂贵的检测仪器,检测成本高,不适合基层检测。胶体金可以用于基层检测但不能定量,ELISA则需要反应时间过长。时间分辨免疫层析技术兼具了胶体金和ELISA的优点,广泛应用于药物残留的检测当中。时间分辨荧光免疫分析技术(time-resolved fluoroimmunoassay,TRFIA)是以镧系元素(包括Eu、Tb、Sm、Dy等)作为标记物,综合免疫反应的高特异性和镧系元素标记的高灵敏性相结合而建立的一种新型非放射性免疫检测技术[7-9]。张艺等[10]利用直接竞争时间分辨荧光免疫法检测牛奶中氯霉素的含量,测得该方法的灵敏度为0.01%,但在水产品中还没有应用此方法,由于水产品基质复杂,需要建立一种快速、灵敏度高的方法来检测水产品中氯霉素残留。
本研究拟利用铕微球作为抗体标记物建立一种简单、快速、高灵敏的鱼、虾和蟹中氯霉素残留的荧光定量免疫层析检测方法,并对所建立方法的灵敏度,准确性和精密度等指标进行评价,以期提供一种适用于水产品中氯霉素痕量残留的快速检测方法,保障水产品的质量安全和消费者健康。
1 材料与方法
1.1 实验材料
1.1.1 仪器
液相色谱-串联质谱仪,美国Thermo Fisher Scientific公司;样品粉碎机(九阳JYL-C090),购自九阳公司;检测卡恒温孵育器(WH-400)和时间分辨荧光免疫定量分析仪(FQ-S2,365 nm/610 nm),由维德维康生物技术有限公司研制。
1.1.2 试剂
甲醇、乙腈、K2HPO4、HCl、NaOH、吐温20、乙酸乙酯和正己烷等,购自国药集团化学试剂有限公司;牛血清蛋白(BSA),购自美国Amresco公司;200 nm羧基化铕微球(365/610 nm, λex/λem),购自美国Creative Diagnostics公司;硝酸纤维素膜(NC膜),购自美国Millipore公司;样品垫、吸收垫、PVC底板,均购自上海良信科技有限公司。
氯霉素标准品,购自美国Sigma公司;储备液配制:准确称取1.0 mg氯霉素标准品,用甲醇溶解并定容至10 mL,配制成100 mg/L的标准品储备液,于-20 ℃保存,备用。
氯霉素单克隆体G375-5与羊抗鼠二抗,由北京维德维康生物技术有限公司制备。
1.1.3 食品样品
鱼、虾、蟹水产品,购自石家庄市的某超市和农贸市场。
1.2 试验方法
1.2.1 荧光微球的抗体标记
本研究采用200 nm羧基化时间分辨荧光微球,在抗体标记方法[11]的基础之上,进行了优化。具体标记方法如下:(1)50 μL荧光微球中加入450 μL活化缓冲液(0.05 mol/L MES,pH 5.0),超声5 min;(2)然后,向微球溶液中依次加入EDC和NHS溶液使其终浓度为分别为0.1和0.2 mmol/L,室温振荡反应30 min,15 000×g离心10 min,弃去上清液;(3)将沉淀用500μL偶联缓冲液(0.04 mol/L PB,pH 8.0)复溶,超声5 min,加入10 μL 2 mg/mL氯霉素单克隆抗体,室温振荡反应2 h,15 000×g离心5 min;(4)向沉淀中加入500 μL封闭缓冲液(0.01 mol/L PB,2%BSA,pH 8.0),4℃振荡反应过夜;(5)将反应液以15 000×g离心5 min,弃去上清,加入1 mL的Tris-HCl(1% BSA,0.5% Tween-20,0.02% Proclin-300,pH 7.0)复溶沉淀,超声5 min,4℃避光保存备用。
1.2.2 试纸条的组装
用划膜仪将氯霉素抗原(1.8 μg/mL,1∶6稀释)和羊抗鼠IgG(17.5 μg/mL,1∶10稀释)包被于NC膜上作为检测线(T线,0.7 μL/cm)和质控线(C线,0.7 μL/cm),置于37℃烘箱中过夜干燥。将羧基化铕微球标记的氯霉素单抗喷于释放垫上,喷量为3.0 μL/cm,置于37℃烘箱中干燥2 h。然后,将样品垫、释放垫、硝酸纤维素膜、吸水垫依次粘PVC底板上,并用切割机切成3.95mm宽度的试纸条。
1.2.3 样本前处理
取鱼、虾、蟹可食用肌肉组织的样本,称取 3 g均质后的样品置于50 mL离心管中,加入 6 mL的乙酸乙酯,涡动1 min,放到摇床上(300 r/min)振摇10 min。取出后离心(4 000×g)10min,取4 mL上层乙酸乙酯置于新的离心管中,50~60 ℃水浴条件下氮气吹干;向吹干的离心管中加入2 mL正己烷,充分涡动10s,再加入1 mL 10 mmol/L PB(2% BSA,0.5% Tween-20,1%蔗糖),低速涡动 1 min后(4 000×g以上),离心 5 min,完全弃去上层正己烷及中间层杂质,取50 μL下层溶液进行检测。
1.2.4 检测步骤
取100 μL稀释后的样本提取液滴加至氯霉素免疫荧光层析装置(图1)中的样本垫上,40℃检测卡恒温孵育器中准确反应5 min后,取出并使用荧光免疫定量分析仪检测。
1.2.5 标准曲线的绘制
取鱼、虾、蟹阴性样品各8份(每份不少于100g),向其中添加氯霉素标准溶液使其终浓度分别为:0.00,0.05,0.10,0.20,0.40,0.80和1.60 μg/kg充分混匀后,按照1.2.3进行样本提取。然后,按照1.2.4进行检测。每个浓度重复检测5次,取平均值,以添加样本中氯霉素的终浓度为X轴,检测线T荧光信号值与质控线C荧光信号值的比值(T/C)为Y轴,用Origin 8.0 (OriginLab Corp., Northampton, MA, USA)做非线性拟合分析,形成四参数拟合曲线如公式(1)所示:
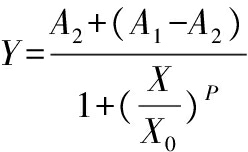
(1)
1.2.6 最低检测限
取经仪器方法[12]确证为氯霉素阴性的鱼、虾、蟹样品各20份,按照上述所建立的样本前处理和氯霉素时间分辨荧光免疫层析方法进行检测。分别计算20份鱼、虾、蟹的平均值和标准差,平均值加上9倍标准差,即为定量限。
1.2.7 准确度和精密度
分别取均质后的鱼、虾、蟹空白样品各20份,分别加入氯霉素溶液,并使其终浓度为0.1、0.2、0.4和0.8 μg/kg,每个浓度梯度添加5个平行;分别按照1.2.3和1.2.4进行样本提取和检测。最后,依据添加回收数据对所建立时间分辨荧光免疫层析定量分析方法的准确度和精密度进行分析。
1.2.8 实际样品与HPLC-MS/MS检测结果的比对
取鱼、虾、蟹样品各10份,每份分别采用所建立的时间分辨荧光免疫层析定量分析法和GB/T 22338—2008《动物源性食品中氯霉素类药物残留量测定》中液相色谱-质谱方法进行检测,并对两种方法检测结果的一致性进行分析。
2 结果与分析
2.1 标准曲线
通过测试数据的拟合表明,所建立的氯霉素时间分辨荧光免疫层析定量检测方法对应鱼、虾和蟹样本的标准曲线(图1)依次分别如公式(2)、(3)、(4)所示:
(2)
(3)
(4)
2.2 定量限
利用所建立的氯霉素时间分辨荧光免疫层析检测方法对鱼、虾和蟹真实样本的测试数据如表1所示,依据20个样本的所测平均值和标准差计算得到该方法对鱼、虾和蟹样本中氯霉素的定量检测限依次分别为:0.084,0.096和0.091 μg/kg。为了避免假阳性的发生,将水产中定量限均定为0.1 μg/kg。
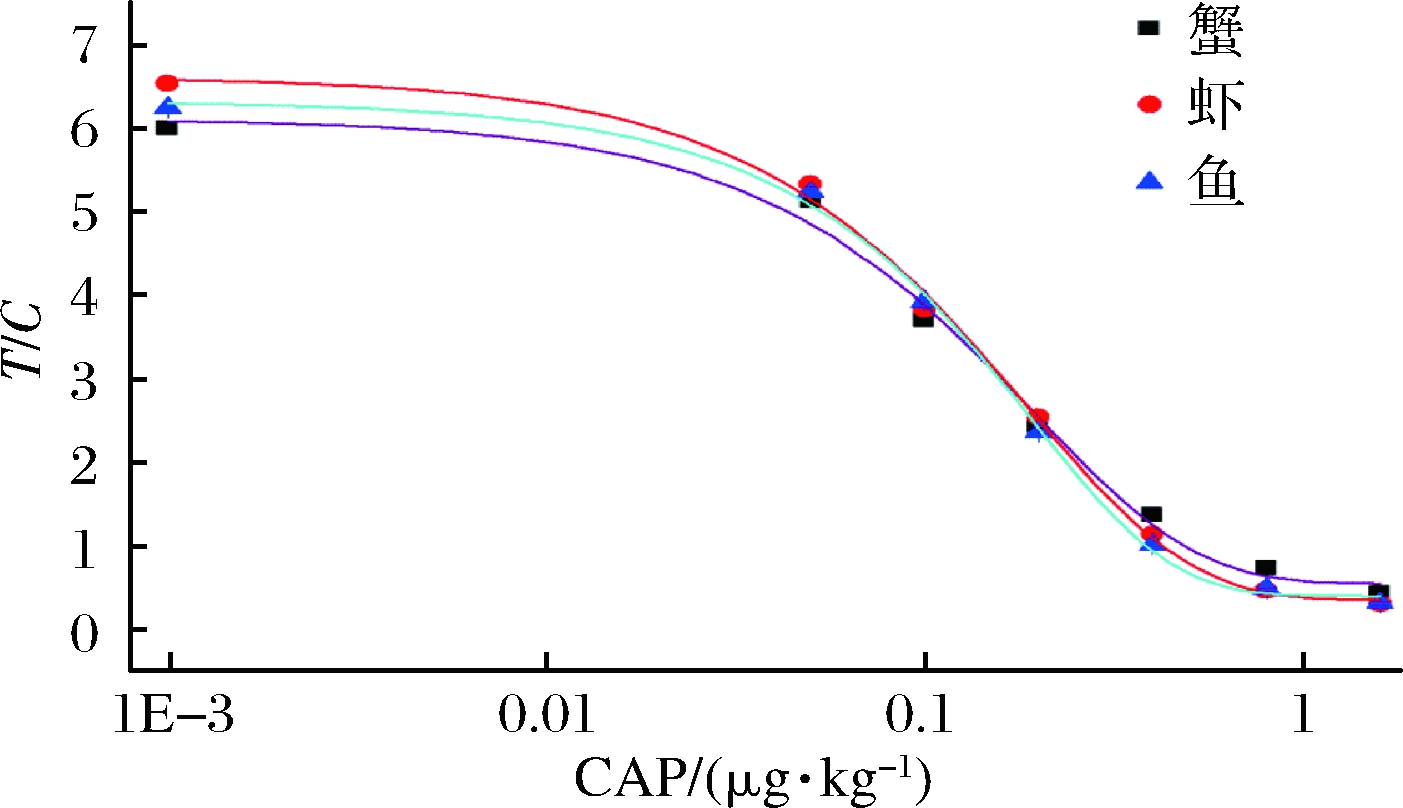
图1 鱼、虾、蟹样本标准曲线的建立
Fig.1 Establishment of a standard curve for fish,
shrimp and crab samples
表1 鱼、虾和蟹空白样品的氯霉素测定结果 单位:μg/kg
Table 1 Determination of chloramphenicol in fish, shrimp and crab blank samples by using TRFIA
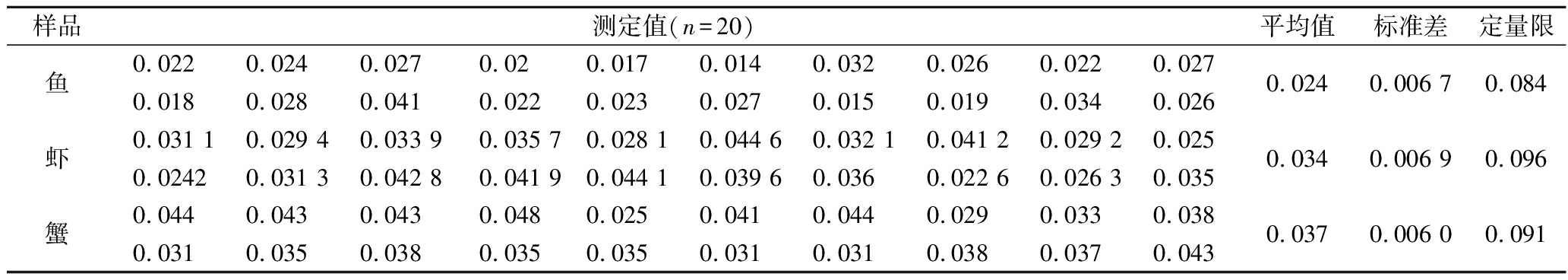
样品测定值(n=20)平均值标准差定量限鱼0.0220.0240.0270.020.0170.0140.0320.0260.0220.0270.0240.006 70.0840.0180.0280.0410.0220.0230.0270.0150.0190.0340.026虾0.031 10.029 40.033 90.035 70.028 10.044 60.032 10.041 20.029 20.0250.0340.006 90.0960.02420.031 30.042 80.041 90.044 10.039 60.0360.022 60.026 30.035蟹0.0440.0430.0430.0480.0250.0410.0440.0290.0330.0380.0370.006 00.0910.0310.0350.0380.0350.0350.0310.0310.0380.0370.043
2.3 方法的准确度和精密度
在鱼、虾、蟹样本中依次添加LOQ、2LOQ、4LOQ、8LOQ的CAP标准物质。确定免疫层析方法对添加了不同浓度氯霉素鱼、虾和蟹样本的检测数据。分析结果显示,本文对水产品中氯霉素的添加回收率为73.5%~114.2%,变异系数3.9%~11.5%,表明该方法具有较好的准确度和精密度。
2.4 与HPLC-MS/MS国标方法对比
同时使用本研究所建立的时间分辨荧光免疫层析方法和国标HPLC-MS/MS法对添加了0.1、0.2、0.4和0.8 μg/kg的鱼、虾、蟹样本进行了测定,其测试结果如图2所示。上述两种方法检测结果的线性相关方程为:Y=0.02+1.07X,相关系数R2=0.973。由此可知,2种方法对鱼、虾和蟹中氯霉素检测结果一致性较高。
3 讨论
氯霉素是一种广谱的抗菌药物,对革兰氏阴性菌和阳性菌均具有较强的抑制作用。鉴于其高效、广谱的抗菌活性,氯霉素在水产动物细菌性疾病的防治过程中发挥了重要作用[13-14]。氯霉素的水产养殖过程中的使用,可能会引起水产品中氯霉素残留的产生。氯霉素可通过抑制骨髓造血机能而引起人类非剂量依懒性再生障碍性贫血。为了防止水产品中氯霉素的残留危害消费者健康,目前美国和欧共体已禁止在食用性动物中使用氯霉素,并规定在动物源性食品中不得检出;我国农业部在2002年12月第235 号公告《动物性食品中兽药最高残留限量》中规定氯霉素为禁用药物,在动物性食品中不得检出。为了能够更加简单、高效地对水产品中氯霉素残留进行检测,本研究建立了一种水产品氯霉素时间分辨荧光免疫层定量检测方法。本研究使用镧系元素铕(365 nm/610 nm, λex/λem)的羧基微球作为抗体标记物建立免疫层析方法。铕元素具有较大的Stokes位移(>200 nm),因此检测过程中激发的信号不会对发射光的荧光信号造成干扰;另外,镧系元素的荧光寿命相对比较长,可达1~2 ms,故而可待其他荧光信号消失之后再行检测,以达到降低背景信号干扰的目的。Stokes位移大和荧光寿命长两个方面的优势极大地提高了时间分辨荧光免疫分析方法的灵敏度。
表2 准确性和精密度实验结果 单位:μg/kg
Table 2 The results of accuracy and precision of
experimental
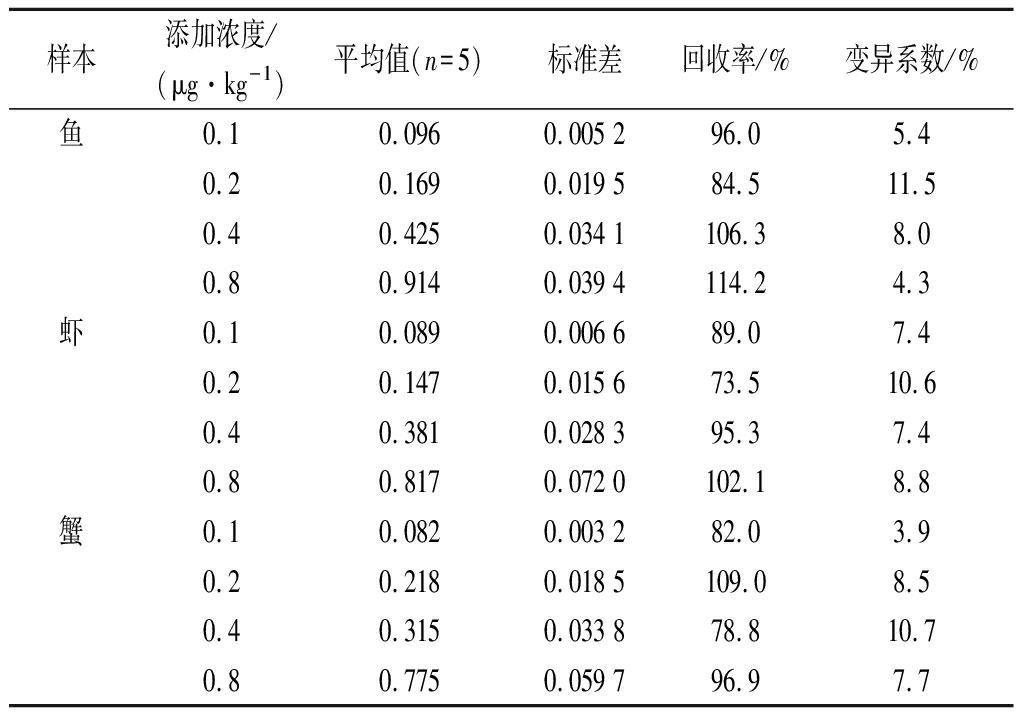
样本添加浓度/(μg·kg-1)平均值(n=5)标准差回收率/%变异系数/%鱼0.10.0960.005 296.05.40.20.1690.019 584.511.50.40.4250.034 1106.38.00.80.9140.039 4114.24.3虾0.10.0890.006 689.07.40.20.1470.015 673.510.60.40.3810.028 395.37.40.80.8170.072 0102.18.8蟹0.10.0820.003 282.03.90.20.2180.018 5109.08.50.40.3150.033 878.810.70.80.7750.059 796.97.7
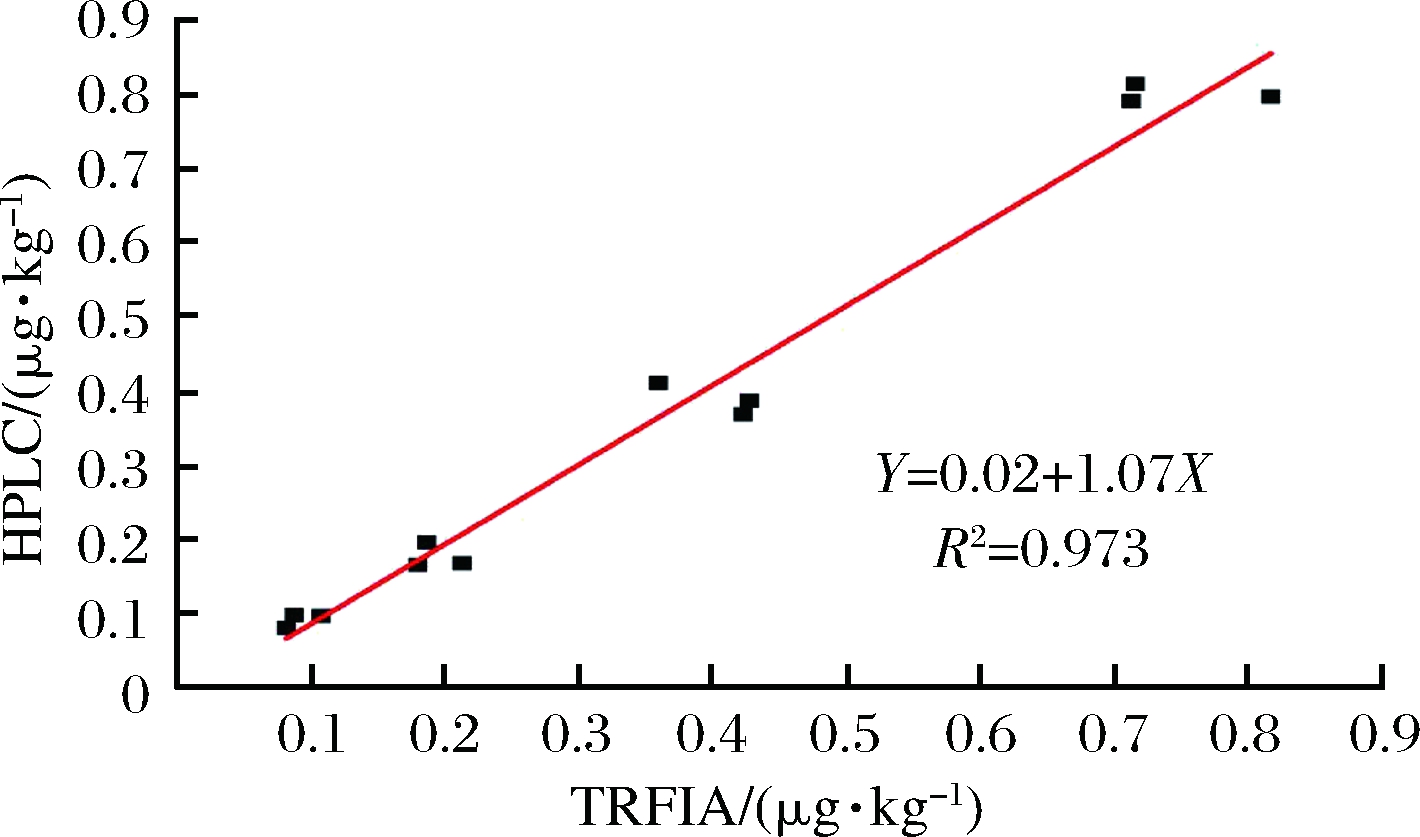
图2 氯霉素时间分辨荧光免疫层析与HPLC-MS/MS
检测结果
Fig.2 Detection results of TRFIA and HPLC-MS/MS
同传统的胶体金免疫层析方法相比,本研究所建立时间分辨荧光免疫层析方法具有更高的灵敏度,且可以对水产品中氯霉素进行定量检测。ZHOU等[15]用胶体金免疫层析法检测水产品中氯霉素残留物,检测其检测限为0.5 μg/kg。桑丽雅等[16]利用胶体金免疫层析技术研制了一种水产品(鱼和虾等)中氯霉素定性检测方法,其检测限为0.3 μg/kg。另外,张燕等[17]针对猪肉、鸡肉和鳕鱼样本中氯霉素残留优化建立了渗滤式和侧流式两种胶体金标记的免疫竞争快速筛选方法,两种方法的定性检测限分别为0.8 μg/L和1 μg/L。本研究所建立的时间分辨荧光免疫层析定量检测方法的定量检测限为0.1 μg/kg,显著地低于胶体金的定性检测限。
另外,本研究所建立的荧光免疫层析检测方法基本达到了酶联免疫吸附法(ELISA)的灵敏度水平。PENG等[18]采用间接竞争酶联免疫吸附法检测鱼肉中氯霉素的残留量,其鱼肉中的检出限为0.126 μg/kg,回收率超过88.1%。ZHANG等[19]采用ELISA和GICA的方法检测水产品中氯霉素的残留量,测得检出限为1.000 μg/kg。李晓云等[20]建立的直接竞争ELISA检测氯霉素残留的方法,对猪肉、鸡肉和蜂蜜中氯霉素的检测限达到0.1 μg/L,线性范围0.1~100 μg/L,回收率61.0%~102.0%。萨仁托雅等[21]建立了水产品中氯霉素残留的酶联免疫方法,结果显示该方法的检出限为0.05 μg/kg,线性范围为0.05~4.05 μg/kg,回收率为85.3%~111.3%。相比于ELISA方法,荧光免疫层析的操作更为简单,检测时间短(8~10 min),对检测人员的技术要求相对较低;同时,简单的操作可以避免一些认为实验误差带来的结果不准确。
WU等[22]使用基于石墨烯的SPE结合HPLC-MS/MS测定水产品中的氯霉素,测定其线性范围为0.510 0 ng/mL,回收率为92.3%至103.4%。吴明媛等[23]利用毛细管电子捕获气相色谱法测定鱼肉中氯霉素的残留量,该方法对鱼肉中氯霉素的检出限为0.1 μg/L,线性范围为1.0~200 μg/L,线性相关系数R2>0.996。上述仪器方法与本研究建立的时间分辨荧光免疫层析的灵敏度基本一致,但这些方法一般需要昂贵的大型仪器,技术要求和检测成本高,且检测时间较长,不适合大量的样品检测,而荧光免疫层析的方法操作简单易学,检测成本低,易于上手。
4 结论
综上所述,本研究采用时间分辨荧光免疫分析技术建立了一种水产品中氯霉素残留量的快速检测方法。方法的检测灵敏度(定量限0.1 μg/kg)优于传统的胶体金荧光免疫层析技术,达到了酶联免疫吸附方法和仪器方法的灵敏度水平;该方法对水产品中氯霉素的添加回收率(73.5%~114.2%)和变异系数3.9%~11.5%均能满足检测要求,与国标仪器检测方法的符合率较高。因此,本研究建立的时间分辨荧光免疫层析方法在水产品氯霉素检测工作具有较高应用价值和应用前景。
[1] 朱模忠.肉食品毒理学[M].上海:上海科学技术出版社, 1992:184-185.
[2] 钟崇泳.广东省水产品流通领域中违禁药物的检测和研究[D]. 广州:华南理工大学,2015.
[3] 覃志英,唐振柱,苏小川,等.消毒牛奶中氯霉素残留状况与分析[J].广西医学,2008,30(1):75-76.
[4] 马晓苗,高朋,彭媛媛.药物性再生障碍性贫血临床探讨[J].医药论坛杂志,2008,29(1):90;92.
[5] SHAKILA R J, VYLA S A P, KUMAR R S, et al.Stability of chloramphenicol residues in shrimp subjected to heat processing treatments[J]. Food Microbiology,2006, 23(1):47-51.
[6] TAJIK H, MALEKINEJAD H, RAZAVI-ROUHANI S M,et al.Chloramphenicol residues in chicken liver, kidney and muscle: A comparison among the antibacterial residues monitoring methods of four plate test, ELISA and HPLC[J].Food and Chemical Toxicology, 2010,48(8-9):2 464-2 468.
[7] FIET J,GITON F,BOUDOU P,et al. A new specific and sensitive time resolved-fluoroimmunoassay of 11-deoxycortisol in serum [J]. J Steroid Biochem Mol Biol,2001,77 (2-3):143-150.
[8] HEMMILA I,DAKUBU S,MUKKALA V M,et al.Europium as a label in time-resolved immunofluorometric assays[J]. Anal Biochem,1984,137 (2):335-343.
[9] MAPLE P A C,JONES C S,ANDREWS N J. Time resolved fluorometric immunoassay,using europium labelled antihuman IgG,for the detection of human tetanus antitoxin in serum[J]. J Clin Pathol, 2001,54 (10):812-815.
[10] 张艺,黄飚,王柯,等.氯霉素的直接竞争时间分辨荧光免疫检测法. 安徽农业科学, 2009, 37(27): 12 912-12 914.
[11] 赵义良,李云,桑丽雅,等.呋喃唑酮代谢物时间分辨荧光免疫快速检测试剂卡的研制及应用[J].食品安全质量检测学报, 2018,9(19):167-174.
[12] GB/T 22338—2008 动物源性食品中氯霉素类药物残留量测定[S].北京:中国标准出版社,2008.
[13] VAN DE RIET J M, POTTER R A,CHRISTIE-FOVGERE M, et al. simultaneous determination of residues of chloramphenicol, thiamphenicol, florfenicol, and florfenicol amine in farmed aquatic species by liquid chromatography/mass spectrometry[J]. Journal of Aoac International, 2003, 86(3):510-514.
[14] BALBI H J. Chloramphenicol- A review[J]. Pediatrics in Review, 2004, 25(8):284-288.
[15] ZHOU C, ZHANG X, HUANG X,et al.Rapid detection of chloramphenicol residues in aquatic products using colloidal gold immunochromatographic assay[J].Sensors,2014,14 (11):21 872-21 888.
[16] 桑丽雅,吴茂生,黄奕雯,等.氯霉素胶体金快速检测试剂条的研制及在水产品中的应用[J]. 食品科学, 34(12):351-355.
[17] 张燕,王玮,刘俊伟,等.免疫胶体金法快速检测动物源性食品中氯霉素残留的研究[J]. 中国食品学报, 2009, 9(1):196-200.
[18] PENG Y P,GIW,TANG H B, et al. Detection the residues of chloramphenicol in fish meat and honey using enzyme- linked immunosorbent assay[J]. Modern Food Science and Technology, 2010,26(12):1 414-1 415.
[19] ZHANG X,LI Y, KONG L, et al.Comparison of rapid detection of chloramphenicol residues in aquatic products on by ELSIA and GICA[J]. Acta Agriculturae Zhejiangensis,2005,17(4):216-218.
[20] 李晓云,石德时,王喜亮,等.直接竞争ELISA检测氯霉素残留的方法建立及初步应用[J].中国兽医学报,2007,27(5):723-727.
[21] 萨仁托雅,张峰,郑有虎,等.化学发光免疫分析与酶联免疫分析法检测水产品药物残留的比较研究[J].大连海洋大学学报, 2014, 29(5):486-491.
[22] WU J, CHEN L, MAO P, et al. Determination of chloramphenicol in aquatic products by graphene-based SPE coupled with HPLC-MS/MS[J]. Journal of Separation Science, 2012, 35(24):3 586-3 592.
[23] 吴明媛,杨姝丽,黎小正,等.毛细管电子捕获气相色谱法同时测定水产品中氯霉素、甲砜霉素和氟甲砜霉素残留[J].南方农业学报,2009, 40(5):567-570.