人体内细胞在代谢过程中产生大量自由基和活性氧,而抗氧化系统可以有效地清除自由基。当自由基产生过多或抗氧化系统失效时,这种平衡就会被打破,机体将处于氧化应激状态,这种情况会导致细胞损伤[1]。已有研究认为持续的氧化应激反应是神经退行性疾病[2-3]、癌症[4]、肝损伤[1]、衰老[5]、心血管疾病[6-7]、慢性胰腺炎[8]等疾病的诱因。细胞一般通过预防、修复、产生抗氧化剂或摄入膳食中的抗氧化剂[9-10]来保护自己免受氧化损伤。内源性抗氧化剂包括细胞内酶——过氧化物歧化酶和过氧化氢酶。已知的膳食抗氧化剂包括抗坏血酸,VE,多酚类物质和类胡萝卜素等。
人工合成的抗氧化剂虽然具有很强的抗氧化活性,但在机体内存在潜在的风险,于是人们把目光转向了天然的抗氧化剂。其中乳清蛋白因其较强的抗氧化活性而备受关注,乳清是在干酪和干酪素的生产过程中产生的副产品。一般10 kg牛奶可以生产1~3 kg干酪,排出7~9 kg乳清。而乳清蛋白是乳清的主要成分之一,具有较高的营养价值和功能特性,被广泛的应用于各种食品中。乳清蛋白主要由β-乳球蛋白、α-乳白蛋白、免疫球蛋白、乳铁蛋白以及其他多种活性成分组成。其中,β-乳球蛋白、α-乳白蛋白分别约占乳清蛋白的43.6%、19.7%,氨基酸序列见图1。乳清蛋白富含的必需支链氨基酸,包括亮氨酸、异亮氨酸和缬氨酸,在代谢、血糖稳态和神经功能中发挥着重要作用。乳清蛋白产品可以分为乳清浓缩蛋白(whey protein concentration,WPC),乳清分离蛋白(whey protein isolates,WPI)等。乳清蛋白是制备抗氧化肽的良好来源,本文对乳清蛋白源抗氧化肽的酶法制备及抗氧化活性的评价方法进行了综述,以期为进一步综合利用乳清蛋白产品提供思路。

图1 α-乳白蛋白和β-乳球蛋白氨基酸序列
Fig.1 Amino acid sequence of α-lactalbumin and
β-lactoglobulin
1 乳清蛋白源抗氧化肽的酶法制备
酶解是从完整的蛋白质序列中释放生物活性肽的有效途径,可以使肽键断裂形成更小的肽或游离氨基酸。具有水解条件温和、对蛋白质底物破坏较小等优点,是生产食品级蛋白质水解物的理想方法。
1.1 酶法制备
不同的蛋白酶和反应条件(pH、温度、时间、酶底比)会产生含有不同肽段和不同抗氧化活性的水解产物。目前制备乳清蛋白源抗氧化肽多选用碱性蛋白酶、胰蛋白酶、胃蛋白酶、风味蛋白酶、木瓜蛋白酶等内切酶(表1)。GAD等[11]发现乳清蛋白的抗氧化活性与浓度有关。为了提高乳清蛋白水解产物的抗氧化活性,MAUX等[12]发现用木瓜蛋白酶水解WPC时,将pH控制在7时的水解产物抗氧化活性明显高于不控制pH条件的水解产物抗氧化活性。这是由于pH值影响酶的三级结构,因此pH值的微小变化也可能影响酶的构象。许多研究表明,碱性蛋白酶水解WPC得到的水解产物比其他蛋白酶水解的乳清蛋白水解产物(whey protein hydrolysates,WPH)具有更强的抗氧化活性[13-15]。这是由于蛋白酶酶切位点的不同造成了抗氧化肽结构和活性的差异。并且水解WPC前在95 ℃条件下预热5~10 min,有助于蛋白质球状结构的展开,使疏水区域更容易被酶利用[16-17]。PENG等[18]研究了不同水解时间对碱性蛋白酶WPH抗氧化活性的影响,发现过长的水解时间会导致水解出过多的游离氨基酸,从而导致抗氧化活性降低。水解是一个动态的过程,肽段不断地形成和降解,因此如何选择和优化水解条件以最大程度释放出抗氧化肽是至关重要的。
表1 酶法制备乳清蛋白源抗氧化肽
Table 1 Preparation of whey protein source antioxidant peptides by enzymatic method
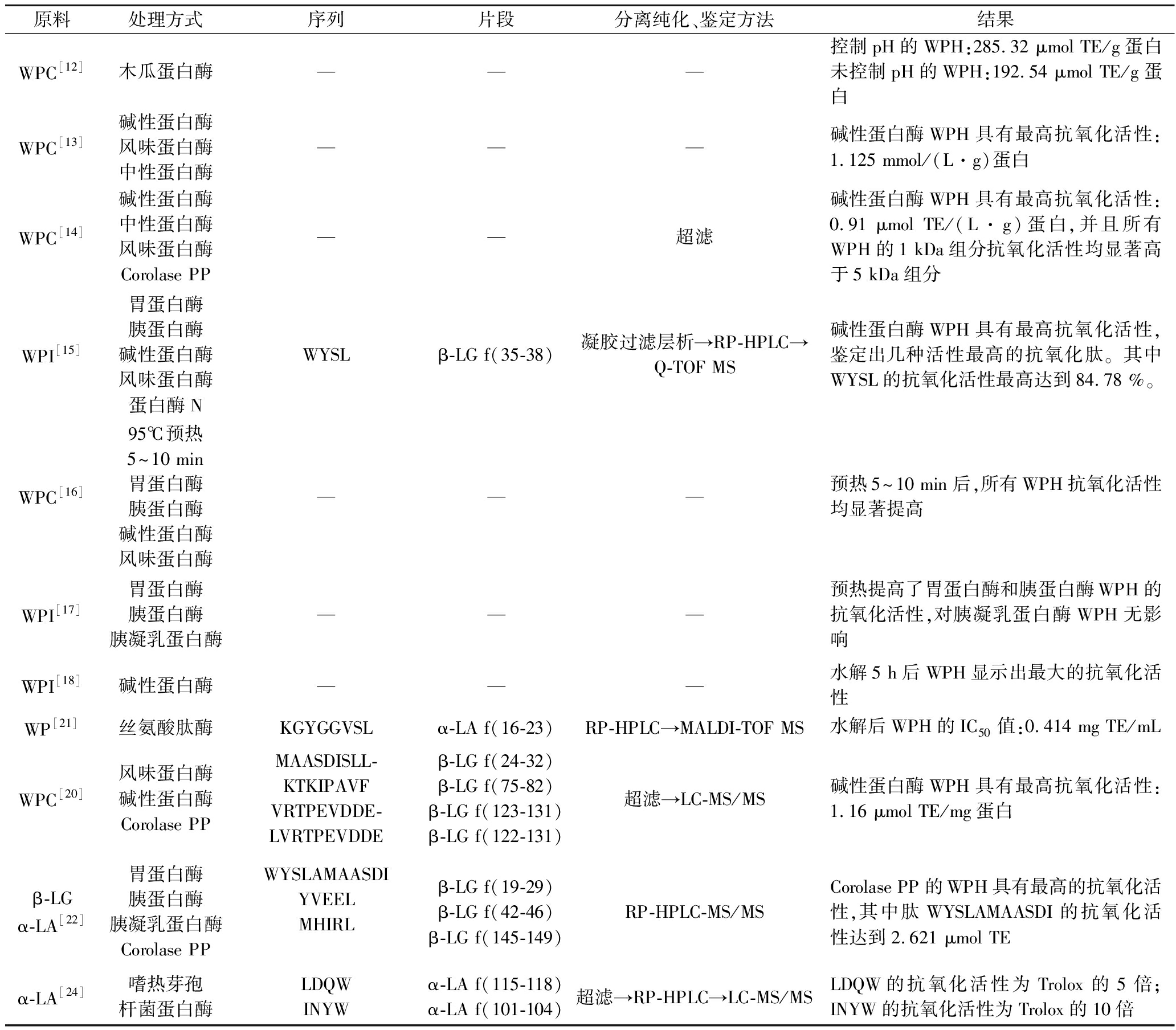
原料处理方式序列片段分离纯化、鉴定方法结果WPC[12]木瓜蛋白酶———控制pH的WPH:285.32 μmol TE/g蛋白未控制pH的WPH:192.54 μmol TE/g蛋白WPC[13]碱性蛋白酶风味蛋白酶中性蛋白酶———碱性蛋白酶WPH具有最高抗氧化活性:1.125 mmol/(L·g)蛋白WPC[14]碱性蛋白酶中性蛋白酶风味蛋白酶Corolase PP——超滤碱性蛋白酶WPH具有最高抗氧化活性:0.91 μmol TE/(L·g)蛋白,并且所有WPH的1 kDa组分抗氧化活性均显著高于5 kDa组分WPI[15]胃蛋白酶胰蛋白酶碱性蛋白酶风味蛋白酶蛋白酶NWYSLβ-LG f(35-38)凝胶过滤层析→RP-HPLC→Q-TOF MS碱性蛋白酶WPH具有最高抗氧化活性,鉴定出几种活性最高的抗氧化肽。其中WYSL的抗氧化活性最高达到84.78 %。WPC[16]95℃预热5~10 min胃蛋白酶胰蛋白酶碱性蛋白酶风味蛋白酶———预热5~10 min后,所有WPH抗氧化活性均显著提高WPI[17]胃蛋白酶胰蛋白酶胰凝乳蛋白酶———预热提高了胃蛋白酶和胰蛋白酶WPH的抗氧化活性,对胰凝乳蛋白酶WPH无影响WPI[18]碱性蛋白酶———水解5 h后WPH显示出最大的抗氧化活性WP[21]丝氨酸肽酶KGYGGVSLα-LA f(16-23)RP-HPLC→MALDI-TOF MS水解后WPH的IC50值:0.414 mg TE/mLWPC[20]风味蛋白酶碱性蛋白酶Corolase PPMAASDISLL-KTKIPAVFVRTPEVDDE-LVRTPEVDDEβ-LG f(24-32)β-LG f(75-82)β-LG f(123-131)β-LG f(122-131)超滤→LC-MS/MS碱性蛋白酶WPH具有最高抗氧化活性:1.16 μmol TE/mg蛋白β-LGα-LA[22]胃蛋白酶胰蛋白酶胰凝乳蛋白酶Corolase PPWYSLAMAASDIYVEELMHIRLβ-LG f(19-29)β-LG f(42-46)β-LG f(145-149)RP-HPLC-MS/MSCorolase PP的WPH具有最高的抗氧化活性,其中肽WYSLAMAASDI的抗氧化活性达到2.621 μmol TEα-LA[24]嗜热芽孢杆菌蛋白酶LDQWINYWα-LA f(115-118)α-LA f(101-104)超滤→RP-HPLC→LC-MS/MSLDQW的抗氧化活性为Trolox的5倍;INYW的抗氧化活性为Trolox的10倍
注:WPI,乳清分离蛋白;WPC,乳清浓缩蛋白;WPH,乳清蛋白水解物;TE,Trolox等价物;“—”表示所引文献的研究中未鉴定具体多肽序列;RP-HPLC,反相高效液相色谱;Q-TOF MS,三重四级杆-飞行时间质谱;MALDI-TOF MS,基质辅助激光解析电离飞行时间质谱;LC-MS/MS,液相色谱质谱/质谱联用。
据报道,抗氧化肽都是一些分子质量比较小的肽,并且WPH中得到的肽的种类比较多,肽的分子质量比较接近,因此分离纯化较困难,一般将多种分离技术连用进行分离。抗氧化肽的粗分离一般使用超滤技术,按照分子质量的大小进行膜过滤,从而实现分离。有研究者[14,19]发现含有小分子质量肽段的水解产物(<3 kDa)比那些含有大分子质量肽段的水解产物具有更高的抗氧化活性。但超滤技术仅仅是按照分子质量的大小进行分离,如果需要纯度更高的肽,需要进一步采用柱层析结合高效液相色谱等手段进行分离,得到纯度比较高的抗氧化肽后,再通过质谱鉴定其氨基酸序列(表1)。部分研究者在酶解乳清蛋白水解产物中鉴定出了几种来自于β-乳球蛋白的抗氧化肽,其中大部分肽都在f(42-61)、f(77-110)和f(123-135)范围内[20-21]。HERNANDEZLEDESMA等[22]用Corolase PP酶水解β-乳球蛋白,在水解产物3 kDa的组分中鉴定出了几种肽和氨基酸。合成了MHIRL, YVEEL,和WYSLAMAASDI 3种多肽,分别测定其抗氧化活性,发现3种合成肽的抗氧化活性高于等摩尔对应游离氨基酸的混合物,其中WYSLAMAASDI的抗氧化活性与合成的抗氧化剂丁基羟基乙醚相当,约是植物多酚儿茶素和槲皮素的1/4左右。NONGONIERMA等[23]在α-乳白蛋白和乳铁蛋白中发现了一种合成二肽WC,其IC50值为0.26 mmol/L,相当于17.2 nmol/L的Trolox。此外,SADAT等[24]用嗜热芽孢杆菌蛋白酶水解α-乳白蛋白得到纯化肽LDQW、INYW,抗氧化活性分别为相同条件下Trolox的5和10倍。
1.2 抗氧化肽作用机理
目前,抗氧化肽的构效关系及其机理尚未完全阐明。但已有的研究表明,抗氧化肽的活性与肽的氨基酸组成、序列、结构和疏水性有关。抗氧化肽中的疏水性氨基酸如丙氨酸、缬氨酸、亮氨酸等的非极性脂肪烃侧链能够加强抗氧化肽与疏水性多不饱和脂肪酸互作,使肽与氧结合或抑制脂质中氢的释放,从而保护脂质体系、膜质的完整性,起到抗氧化作用[25]。而抗氧化肽中带有芳香环结构的残基如酪氨酸、色氨酸、苯丙氨酸由于酚羟基和吲哚基团可以作为氢供体而具有较强的抗氧化活性,因为酚羟基和吲哚基团的自由基与简单的过氧自由基相比,具有稳定性更高,寿命更长的特点。其中酪氨酸的苯环是共轭体系,邻、对位基团易受侧链基团影响,是典型的氢供体。酪氨酸的诱导效应是给电子,使酚羟基的密度进一步增大,并使其脱掉质子后形成更稳定的自由基中间体[26]。
单纯的氨基酸也有某些抗氧化活性,但大多数情况下低于其组成的抗氧化肽的活性。因此,可以认为抗氧化肽的高生物活性源于肽链内氨基酸之间的短程相互作用。含巯基的半胱氨酸作为抗氧化剂能够和自由基直接作用,对肽的抗氧化活性具有重要贡献。组氨酸的咪唑基团与其金属螯合、供氢和脂质过氧化能力有关,含组氨酸的抗氧化肽的活性受物理环境的影响,特别是疏水化合物的存在可以增加对疏水自由基的接近性[27]。CHEN等[25]发现抗氧化肽的活性依赖于肽段His-His,去除C端His残基,使得抗氧化活性降低约50%,而去除N端Leu则对抗氧化活性无影响。有研究[28]用统计建模方法对抗氧化肽的结构特征进行分析,发现抗氧化肽的N和C端氨基酸是抗氧化活性的重要预测因子,N末端氨基酸的疏水性对肽段的抗氧化活性有重要影响,迄今发现的抗氧化肽中有一半以上在N端有疏水残基。C末端氨基酸的电荷性质(即净电荷、分子极性)也是抗氧化活性的重要预测因子。这个位置是一个极性区域,受其静电势的影响,色氨酸、谷氨酸、亮氨酸、异亮氨酸、甲硫氨酸、缬氨酸和酪氨酸经常出现。与C端相邻的第二个氨基酸被认为是抗氧化活性的主要贡献者,如果该氨基酸具有较大的氢键和空间性质,疏水性较低,则将增加潜在的抗氧化活性。乳清蛋白肽在这个位置通常是谷氨酸、精氨酸或天门冬氨酸。根据氨基酸的理化性质可以对其活性机制进行分类,如图2所示[29],抗氧化剂通过提供氢原子和提供电子两种途径清除自由基。在提供氢原子途径中,抗氧化剂脱去一个H·给自由基A·,生成稳定化合物AH,而抗氧化剂转变为比较稳定的自由基B·,不易引发新的自由基链式反应,从而使链反应终止。而在提供电子的途径中,则需要进行电子转移和质子转移两步反应[29]。
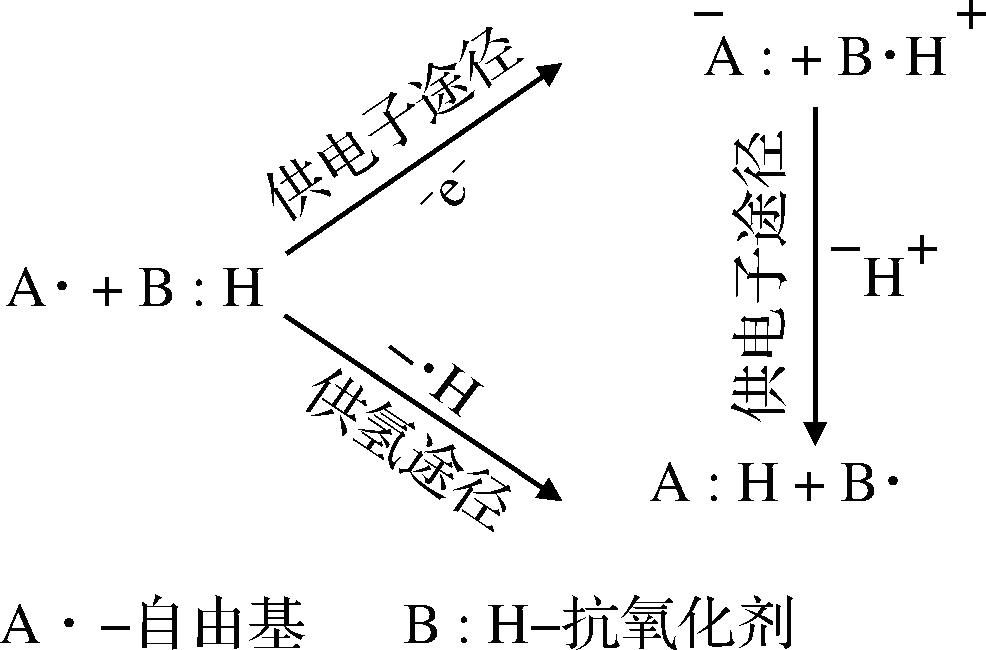
图2 抗氧化剂与自由基反应机制
Fig.2 Mechanisms of antioxidant reacting with free radical
总体来说,乳清蛋白源抗氧化肽的活性可能是由上述部分或全部机制的联合作用或者协同作用决定的。因此,在进行活性评价时,评估每种类型的活性对于更好的理解相关机制至关重要。
2 评价方法
乳清蛋白/肽的抗氧化活性,需要用不同的方法进行评估。目前常用的方法主要有体外化学法、体外细胞培养法和体内动物实验法(表2)。
表2 不同评价方法的对比
Table 2 Comparison of different evaluation methods

评价方法优点缺点机制适用条件体外化学法成本低、可操作性强测定方法原理各异,结果具有局限性,化学反应环境与生物机体内部存在较大差异,抗氧化指标与体内抗氧化作用的关系尚不明确通过化学方法测定抗氧化指标适用于前期筛选、评价具有较强抗氧化活性的乳清蛋白/肽体外细胞培养法具有一定的生物学代表性目标细胞只会暴露在从肠道进入血液的乳清成分中,在体外细胞环境中具有抗氧化活性的乳清蛋白/肽在体内不一定能继续保持其活性通过细胞模型评价抗氧化能力适用于评价经前期筛选后具有一定化学抗氧化活性的乳清蛋白/肽体内动物实验法直接、清晰的评价乳清蛋白/肽的抗氧化能力生物标志物有限制,成本高,周期长,有潜在的安全风险通过饮食干预实验,测定血液或组织中谷胱甘肽、过氧化氢酶水平,评估体内抗氧化作用适用于经前期筛选及体外细胞筛选后具有一定化学抗氧化活性的乳清蛋白/肽
2.1 体外化学法
体外测定抗氧化活性是评价水解蛋白或多肽制剂抗氧化潜力的关键。由于抗氧化剂的复杂性,没有一种单一的方法可以测量一种物质的总抗氧化活性。因此,在进行体外活性评价时应尽可能的全面,或着重评价实验重点关注的抗氧化指标,选择合适的试验方法。目前测定乳清蛋白/肽的体外抗氧化活性的方法主要有1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力, 2,2′-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid,ABTS)自由基清除能力,铁离子还原能力(ferric-reducing antioxidant power,FRAP),氧自由基清除能力(oxygen radical absorbance capacity,ORAC)等。其中,DPPH和ABTS方法的机理是抗氧化化合物与自由基之间发生电子转移。DPPH是一种稳定的自由基,在氮桥的一个原子上有一个不成对电子。溶液呈深紫色,样品中的抗氧化化合物通过与孤电子配对,使得深紫色的DPPH自由基被还原成黄色。并且DPPH的褪色程度与其所接受的电子数量呈定量关系。因此较高的DPPH值代表着较高的抗氧化活性[30]。ABTS经活性氧氧化后可以生成稳定的蓝绿色的阳离子ABTS+·,样品中的抗氧化化合物可以与ABTS+·反应,从而使体系褪色。ABTS自由基清除活性可以体现在将ABTS转化为无色产物的能力,这与氢供体或链断裂性能有关[29]。FRAP法的原理是基于氧化还原的比色法,属于电子转移途径。Fe3+-TPTZ(三吡啶三嗪)在酸性条件下被样品中的抗氧化化合物还原成Fe2+-TPTZ,溶液变成深蓝色。其变色程度与还原能力呈定量关系[31]。ORAC法属于氢原子转移途径,2,2-偶氮二(2-甲基丙基咪)二盐酸盐分解生成的过氧自由基与荧光探针反应生成非荧光产物。而样品中的抗氧化化合物可以抑制探针氧化,从而保持荧光。随着时间的推移,荧光产物的形成速率和数量决定了抗氧化化合物的能力,ORAC值表示为荧光衰减曲线的净面积[32]。
2.2 体外细胞培养法
体外抗氧化活性分析的结果具有一定的局限性,因为这些分析不能反应细胞的生理条件。因此,越来越多的研究者使用体外细胞培养法评估乳清蛋白/肽。其中体外细胞一般选择经常暴露于氧化应激的靶器官(如肝脏、大脑或肌肉)细胞。据报道,机体的抗氧化防御系统主要依赖于细胞中抗氧化剂的含量(谷胱甘肽(glutathione,GSH)、过氧化氢酶(catalase,CAT)、过氧化物歧化酶(superoxide dismutase,SOD)),这些抗氧化剂具有许多预防氧化的功能。通过饮食提高细胞中GSH、CAT、SOD的含量有助于健康和长寿。
2.2.1 谷胱甘肽活性
GSH在细胞水平上可以通过氢原子转移直接作用于自由基,并且可以促进氨基酸的运输,通过减少细胞内的一些活性氧自由基使抗氧化剂(如VC和VE)恢复其功能形式。为了证明乳清蛋白/肽对细胞的影响,最近的研究中,TSENG等[33]用WPC预处理大鼠肾细胞PC12,之后用乙醇刺激细胞,每毫克蛋白产生了59.4 mmol/L GSH,未预处理的细胞则每毫克蛋白产生29.9 mmol/L GSH(P<0.05)差异显著。这表明,当受到氧化应激刺激时,乳清蛋白可以为细胞提供保护。PYO等[34]用WPC预处理人类肝细胞HepG2,之后用叔丁基过氧化氢刺激细胞,发现WPC预处理增加了未受刺激细胞的GSH水平,并将受刺激细胞的GSH水平恢复了80%。为了鉴定出乳清蛋白中增加GSH的具体片段OKEEFFE等[14]用3种酶水解的WPH处理人脐静脉内皮细胞HUVEC,并监控GSH水平,将水解产物用不同孔径大小的膜进行分离。与未处理的细胞相比,用WPH处理细胞后,细胞内GSH水平显著增加,其中枯草杆菌蛋白酶水解产物中的1 kDa组分使HUVEC细胞中GSH含量比未处理细胞提高了153%。
2.2.2 过氧化氢酶活性和过氧化物歧化酶活性
为了研究乳清蛋白是否能增加细胞中的CAT活性和SOD活性,XU等[35]用WPC80处理H2O2氧化诱导损伤的C2C12肌肉细胞发现WPC80可以使细胞CAT活性和SOD活性显著提高,此外,还使未受H2O2刺激的细胞的SOD活性明显提高。OKEEFFE等[14]用Corolase PP水解的WPH中1 kDa组分处理H2O2氧化诱导损伤的HUVEC细胞,与未处理的细胞相比,CAT活性增加了141%,差异极显著。KONG等[36]用枯草杆菌蛋白酶水解的WPH处理H2O2氧化诱导损伤的肺成纤维细胞MRC-5后,细胞CAT活性从每毫克蛋白25 U增长到65 U,细胞SOD活性增加了248%。
PURPURA等[37]发现在摄入WPI后,血浆中氨基酸浓度最高,表明乳清蛋白在胃肠道中会快速被消化为游离氨基酸。POWER-GRANT等[38]对完整的WPC进行模拟胃肠消化,然后用ORAC测定其抗氧化活性。胃消化WPC后,其ORAC值较未消化WPC增加2.5倍。为了测定置于经胃消化后的乳清制品环境下的肠道细胞的抗氧化活性,PICCOLOMINI等[39]用胃消化的WPI处理H2O2氧化诱导损伤的肠上皮细胞Caco-2,与对照组相比,用胃消化的WPI处理后,Caco-2细胞的活性氧(reactive oxygen species,ROS)活性降低了32.5%。CORROCHANO等[40]对WPI进行模拟胃肠消化,并经Caco-2/HT-29细胞转运,最终鉴定并合成了几种乳清蛋白肽,其中肽ALPM, GDLE, VGIN和AVEGPK显著降低了氧化诱导损伤细胞C2C12和HepG2的氧化水平。此外,JOUBRAN等[41]对α-乳白蛋白分别进行婴儿胃肠模拟消化和成人胃肠模拟消化后发现,婴儿十二指肠消化样品比成人十二指肠消化样品具有更高的抗氧化活性,但是成人的胃消化样品抗氧化活性高于婴儿时期。这说明乳清蛋白在肠道运输过程中的抗氧化活性不仅受肠道位置的影响,还可能和年龄阶段有关。
体外细胞培养法是将细胞直接置于乳清蛋白/肽中,但是乳清蛋白/肽通常是作为食物被摄入体内的,目标细胞只会暴露在从肠道进入血液的乳清成分中,在体外环境中具有抗氧化活性的乳清蛋白/肽在体内不一定能保持其活性,因此这类试验的生物学意义还有待证实。
2.3 体内动物实验法
乳清蛋白/肽能否在机体内部发挥活性,需要通过体内实验验证,也是活性评估中最重要的一环,但是到目前为止,只有少数研究使用人体或者动物的饮食干预试验评估乳清蛋白/肽的有效性。虽然生物标志物是有限制的,但人体或动物的饮食干预试验仍是目前最好的评估体内抗氧化作用的方法。
2.3.1 动物实验
动物实验一般采用不同的小鼠模型进行短期或长期的饮食干预实验,通过比较饮食干预前后小鼠血液或组织中GSH、CAT水平评估乳清蛋白/肽的有效性。GOLD[42]给17~20月大的老年C7BL/6NIA雄性小鼠喂食富含WPC的食物3个月。之后测量小鼠肝脏和心脏的GSH水平。食用WPC的小鼠肝脏和心脏的GSH水平明显高于同期食用富含酪蛋白的食物或对照食物的小鼠,这表明富含谷胱甘肽氨基酸前体(如Cys)的饮食可以促进细胞GSH的产生。ASHOUSH等[43]发现添加10 %乳清粉的食物可以保护Wistar大鼠抵抗CCl4肝毒性,他们认为这种抗性是由于血浆中GSH水平增加。KIM等[44]将Sprague-Dawley大鼠作为氧化应激模型,一组喂食富含铁的食物,另一组在喂食同样富含铁的食物外,额外喂食10 %的乳清蛋白食物,持续6周,发现含有乳清蛋白食物组的大鼠红细胞中GSH含量有所增加,但是CAT活性却没有显著提高。而ATHIRA等[45]观察到,接受枯草杆菌蛋白酶水解的WPH腹腔注射的瑞士白化小鼠的肝脏CAT水平与未接受WPH注射的小鼠相比显著升高。HARAGUCHI等[46]还发现富含乳清蛋白的饮食似乎可以延长老年小鼠的生存时间。
2.3.2 人体实验
人体饮食干预实验可以更好地反映乳清蛋白/肽的有效性,目前的研究一般选择特殊人群如持续高强度训练的人群、超重人群或患病人群进行饮食干预实验。MIDDLETON等[47]对18名接受高强度有氧训练的男性参与者进行了6周以上的血液中GSH水平的评估,他们每天补充与体重对应比例的WPI。在进行运动的受试者中,血液中GSH水平明显低于没有进行运动的受试者。说明在运动方案中添加WPC可以防止血液中GSH的消耗。SHEIKHOLESLAMI等[48]观察到,在30名体重超重的年轻男性中,服用WPI并进行8周的运动训练后,血浆GSH水平增加。CHITAPANARUX等[49]发现,与补充WPI前相比,持续补充WPI 12周的肝病患者血浆中GSH水平也增加了23 %。而在ZAVORSKY等[50]进行的另一项人体试验中,每天服用45 g WPI的受试者血液淋巴细胞的GSH水平比没有服用WPI的受试者高24 %。
血浆中GSH水平是检测乳清产品体内抗氧化作用最常用的指标之一。血浆低GSH水平与氧化应激诱发的疾病(如心血管疾病、多囊卵巢综合征和自闭症)之间存在正相关[51]。然而,血浆GSH水平不太可能反映经常暴露于氧化应激的靶器官(如肝脏、大脑或肌肉)细胞内的GSH水平。因此,记录与疾病发生和发展有关的特定蛋白质的氧化水平,将在细胞检测和饮食干预试验中提供更多相关的生物标志物。
3 结论和展望
乳清和乳清蛋白具有抗氧化活性,并可通过酶解释放生物活性肽提高活性。一些来源于β-乳球蛋白和α-乳白蛋白的合成肽证明了抗氧化活性。乳清蛋白抗氧化的效果一般不如乳清蛋白源抗氧化肽,但是后者制备的成本比较高,因此如何工业化生产以及商业化应用也是目前亟待解决的问题。乳清蛋白/肽活性的测定方法有很多,但是并没有统一的标准,使得不同研究者得到的结论缺乏可比性,应进一步制定一个相对统一的标准。乳清蛋白/肽体外活性的研究相对较多,而对于体内抗氧化机制的研究相对较少,应进一步进行动物实验和临床实验等研究抗氧化肽的体内活性,并比较体内与体外活性之间的差异及相互联系。最重要的是,抗氧化肽对人体产生有益作用的同时,也可能有一些副作用,这些副作用(细胞毒性、变态反应等)可能是抗氧化肽本身具有的,未来要进行更深层次的研究。
[1] LI S,TAN H Y,WANG N, et al. The role of oxidative stress and antioxidants in liver diseases[J]. International Journal of Molecular Sciences, 2015, 16(11): 26 087-26 124.
[2] GILGUN-SHERKI Y,MELAMED E,OFFEN D. Oxidative stress induced-neurodegenerative diseases: the Need for Antioxidants That Penetrate the Blood Brain Barrier[J]. Neuropharmacology, 2001, 40(8): 959-975.
[3] KLEIN J A,ACKERMAN S L. Oxidative stress, cell cycle, and neurodegeneration[J]. Journal of Clinical Investigation, 2003, 111(6): 785-793.
[4] WARIS G,AHSAN H. Reactive Oxygen Species: Role in the Development of Cancer and Various Chronic Conditions[J]. Journal of Carcinogenesis, 2006, 5(1): 14.
[5] LEE J,KOO N,MIN D B. Reactive Oxygen Species, Aging, and antioxidative nutraceuticals[J]. Comprehensive Reviews in Food Science and Food Safety, 2004, 3(1): 21-33.
[6] LOENN M E,DENNIS J M,STOCKER R. Actions of "antioxidants" in the protection against atherosclerosis[J]. Free Radical Biology and Medicine, 2012, 53(4): 863-884.
[7] SUGAMURA K,KEANEY J F. Reactive oxygen species in cardiovascular disease[J]. Free Radical Biology and Medicine, 2011, 51(5): 978-992.
[8] ZHOU D,WANG W,CHENG X, et al. Antioxidant therapy for patients with chronic pancreatitis: A systematic review and meta-analysis[J]. Clinical Nutrition, 2015, 34(4): 627-634.
[9] VALKO M,LEIBFRITZ D,MONCOL J, et al. Free radicals and antioxidants in normal physiological functions and human disease[J]. The International Journal of Biochemistry & Cell Biology, 2007, 39(1): 44-84.
[10] NIKI E. Assessment of antioxidant capacity in vitro and in vivo[J]. Free Radical Biology and Medicine, 2010, 49(4): 503-515.
[11] GAD A S,KHADRAWY Y A,EI-NEKEETY A A, et al. Antioxidant activity and hepatoprotective effects of whey protein and spirulina in rats[J]. Nutrition, 2011, 27(5): 582-589.
[12] LE-MAUX S,NONGONIERMA A B,BARRE C, et al. Enzymatic generation of whey protein hydrolysates under pH-controlled and non pH-controlled Conditions: Impact on physicochemical and bioactive properties[J]. Food Chemistry, 2016, 199: 246-251.
[13] DRY KOV
KOV A,PIHLANTO A,MARNILA P, et al. Antioxidant properties of whey protein hydrolysates as measured by three methods[J]. European Food Research and Technology, 2010, 230(6): 865-874.
A,PIHLANTO A,MARNILA P, et al. Antioxidant properties of whey protein hydrolysates as measured by three methods[J]. European Food Research and Technology, 2010, 230(6): 865-874.
[14] O′KEEFFE M B,FITZGERALD R J. Antioxidant effects of enzymatic hydrolysates of whey protein concentrate on cultured human endothelial cells[J]. International Dairy Journal, 2014, 36(2): 128-135.
[15] ZHANG Q X,WU H,LING Y F, et al. Isolation and Identification of antioxidant peptides derived from whey protein enzymatic hydrolysate by consecutive chromatography and Q-TOFf MS[J]. Journal of Dairy Research, 2013, 80(3): 367-373.
[16] LIN S,TIAN W,LI H, et al. Improving antioxidant activities of whey protein hydrolysates obtained by thermal preheat treatment of pepsin, trypsin, alcalase and flavourzyme: Improve antioxidant activities of whey protein[J]. International Journal of Food Science and Technology, 2012, 47(10): 2 045-2 051.
[17] ADJONU R,DORAN G,TORLEY P, et al. Screening of whey protein isolate hydrolysates for their dual functionality: Influence of heat pre-treatment and enzyme specificity[J]. Food Chemistry, 2013, 136(3-4): 1 435-1 443.
[18] PENG X,KONG B,XIA X, et al. Reducing and radical-scavenging activities of whey protein hydrolysates prepared with alcalase[J]. International Dairy Journal, 2010, 20(5): 360-365.
[19]  NAY-UCAR E,ARDA N,PEKMEZ M, et al. Comparison of antioxidant capacity, protein profile and carbohydrate content of whey protein fractions[J]. Food Chemistry, 2014, 150: 34-40.
NAY-UCAR E,ARDA N,PEKMEZ M, et al. Comparison of antioxidant capacity, protein profile and carbohydrate content of whey protein fractions[J]. Food Chemistry, 2014, 150: 34-40.
[20] MANN B,KUMARI A,KUMAR R, et al. Antioxidant activity of whey protein hydrolysates in milk beverage system[J]. Journal of Food Science & Technology, 2015, 52(6): 3 235-3 241.
[21] BERTUCCI J I,LIGGIERI C S,COLOMBO M L, et al. Application of peptidases from maclura pomifera fruit for the production of active biopeptides from whey protein[J]. Lwt - Food Science and Technology, 2015, 64(1): 157-163.
[22] HERN NDEZ-LEDESMA B,D
NDEZ-LEDESMA B,D VALOS A,BARTOLOM
VALOS A,BARTOLOM B, et al. Preparation of antioxidant enzymatic hydrolysates from α-lactalbumin and β-lactoglobulin. Identification of active peptides by HPLC-MS/MS[J]. Journal of Agricultural and Food Chemistry, 2005, 53(3): 588-593.
B, et al. Preparation of antioxidant enzymatic hydrolysates from α-lactalbumin and β-lactoglobulin. Identification of active peptides by HPLC-MS/MS[J]. Journal of Agricultural and Food Chemistry, 2005, 53(3): 588-593.
[23] NONGONIERMA A B,FITZGERALD R J. Inhibition of dipeptidyl peptidase Iv (dpp-iv) by tryptophan containing dipeptides[J]. Food & Function, 2013, 4(12): 1 843-1 849.
[24] SADAT L,CAKIR-KIEFER C,N’NEGUE M A, et al. Isolation and identification of antioxidative peptides from bovine α-lactalbumin[J]. International Dairy Journal, 2011, 21(4): 214-221.
[25] CHEN H,MURAMOTO K,YAMAUCHI F, et al. Antioxidative properties of histidine-containing peptides designed from peptide fragments found in the digests of a soybean protein[J]. Journal of Agricultural and Food Chemistry, 1998, 46(1): 49-53.
[26] POWER O,JAKEMAN P,FITZGERALD R J. Antioxidative peptides: Enzymatic production, in vitro and in vivo antioxidant activity and potential applications of milk-derived antioxidative peptides[J]. Amino Acids, 2013, 44(3): 797-820.
[27] CHAN K M,DECKER E A, FEVSTMAN C. Endogenous skeletal muscle antioxidants[J]. Critical Reviews in Food Science & Nutrition, 1994, 34(4): 403-426.
[28] YAO-WANG L,BO L,JIGUO H, et al. Structure-activity relationship study of antioxidative peptides by qsar modeling: the amino acid next to C-terminus affects the activity[J]. Journal of Peptide Science, 2011, 17(6): 454-462.
[29] LIANG N,KITTS D D. Antioxidant property of coffee components: Assessment of methods that define mechanisms of action[J]. Molecules, 2014, 19(11): 19 180-19 208.
[30] CORR A APF,DAROIT D J,COELHO J G, et al. Antioxidant, antihypertensive and antimicrobial properties of ovine milk caseinate hydrolyzed with a microbial protease[J]. Journal of the Science of Food and Agriculture, 2011, 91(12): 2 247-2 254.
A APF,DAROIT D J,COELHO J G, et al. Antioxidant, antihypertensive and antimicrobial properties of ovine milk caseinate hydrolyzed with a microbial protease[J]. Journal of the Science of Food and Agriculture, 2011, 91(12): 2 247-2 254.
[31] BENZIE I F F,STRAIN J J. The ferric reducing ability of plasma (frap) as a measure of "antioxidant power": The FRAP assay[J]. Analytical Biochemistry, 1996, 239(1): 70-76.
[32] OU B,HAMPSCH-WOODILL M,PRIOR R L. Development and validation of an improved oxygen radical absorbance capacity assay using fluorescein as the fluorescent probe[J]. Journal of Agricultural and Food Chemistry, 2001, 49(10): 4 619-4 626.
[33] TSENG Y M, LIN S K,HSIAO J K, et al. Whey protein concentrate promotes the production of glutathione (gsh) by gsh reductase in the Pc12 cell line after acute ethanol exposure[J]. Food & Chemical Toxicology, 2006, 44(4): 574-578.
[34] PYO M C,YANG S Y,CHUN S H, et al. Protective effects of maillard reaction products of whey protein concentrate against oxidative stress through an Nrf2-dependent pathway in Hepg2 cells[J]. Biological & Pharmaceutical Bulletin, 2016, 39(9): 1 437.
[35] XU R,LIU N,XU X, et al. Antioxidative effects of whey protein on peroxide-induced cytotoxicity[J]. Journal of Dairy Science, 2011, 94(8): 3 739-3 746.
[36] KONG B,PENG X,XIONG Y L, et al. Protection of lung fibroblast mrc-5 cells against hydrogen peroxide-induced oxidative damage by 0.1-2.8 KDA antioxidative peptides isolated from whey protein hydrolysate[J]. Food Chemistry, 2012, 135(2): 540-547.
[37] PURPURA M,LOWERY R P,JOY J M, et al. A comparison of blood amino acid concentrations following ingestion of rice and whey protein isolate: A double-blind, crossover study[J]. J Nutr Health Sci, 2014, 1(3): 306.
[38] POWER-GRANT O,BRUEN C,BRENNAN L, et al. In vitro bioactive properties of intact and enzymatically hydrolysed whey protein: Targeting the enteroinsular axis[J]. Food & Function, 2015, 6(3): 972-980.
[39] PICCOLOMINI A F,ISKANDAR M M,LANDS L C, et al. High hydrostatic pressure pre-treatment of whey proteins enhances whey protein hydrolysate inhibition of oxidative stress and Il-8 secretion in intestinal epithelial cells[J]. Food & Nutrition Research, 2012, 56(1): 17 549.
[40] CORROCHANO A R,FERRARETTO A,ARRANZ E, et al. Bovine whey peptides transit the intestinal barrier to reduce oxidative stress in muscle cells[J]. Food Chemistry, 2019, 288: 306-314.
[41] JOUBRAN Y,MOSCOVICI A,LESMES U. Antioxidant activity of bovine alpha lactalbumin maillard products and evaluation of their in vitro gastro-duodenal digestive proteolysis[J]. Food & Function, 2015, 6(4): 1 229-1 240.
[42] GOLD P. The influence of dietary whey protein on tissue glutathione and the diseases of aging[J]. Clin Invest Med, 1989, 12(6): 343-349.
[43] ASHOUSH I S,EL-BATAWY O I,EL-SHOURBAGY G A. Antioxidant activity and hepatoprotective effect of pomegranate peel and whey powders in rats[J]. Annals of Agricultural Sciences, 2013, 58(1): 27-32.
[44] KIM J,PAIK H D,YOON Y C, et al. Whey protein inhibits iron overload-induced oxidative stress in rats[J]. Journal of Nutritional Science and Vitaminology, 2013, 59(3): 198-205.
[45] ATHIRA S,MANN B,SHARMA R, et al. Ameliorative potential of whey protein hydrolysate against paracetamol-induced oxidative stress[J]. Journal of Dairy Science, 2013, 96(3): 1 431-1 437.
[46] HARAGUCHI F K,SILVA M E,NEVES L X, et al. Whey protein precludes lipid and protein oxidation and improves body weight gain in resistance-exercised rats[J]. European Journal of Nutrition, 2011, 50(5): 331-339.
[47] MIDDLETON N,JELEN P,BELL G. Whole blood and mononuclear cell glutathione response to dietary whey protein supplementation in sedentary and trained male human subjects[J]. International Journal of Food Sciences and Nutrition, 2004, 55(2): 131-141.
[48] SHEIKHOLESLAMI D V,AHMADI F K G. Changes in antioxidant status and cardiovascular risk factors of overweight young men after six weeks supplementation of whey protein isolate and resistance training[J]. Appetite, 2012, 59(3): 673-678.
[49] CHITAPANARUX T,TIENBOON P,POJCHAMARNWIPUTH S, et al. Open-labeled pilot study of cysteine-rich whey protein isolate supplementation for nonalcoholic steatohepatitis patients[J]. Journal of Gastroenterology and Hepatology, 2009, 24(6): 1 045-1 050.
[50] ZAVORSKY G S,KUBOW S,GREY V, et al. An Open-label dose-response study of lymphocyte glutathione levels in healthy men and women receiving pressurized whey protein isolate supplements[J]. International Journal of Food Sciences and Nutrition, 2007, 58(6): 429-436.
[51] SHIMIZU H,KIYOHARA Y,KATO I, et al. Relationship between plasma glutathione levels and cardiovascular disease in a defined population: The hisayama study[J]. Stroke, 2004, 35(9): 2 072-2 077.