中国白酒按香型主要分为13种,每种香型都有着其独特的风味。浓香型白酒窖香浓郁、绵甜醇厚、香味协调、尾净余长,是最受消费者喜爱的白酒之一,市场占有率长期保持在70%以上[1]。浓香型白酒以谷物为原料,大曲为糖化发酵剂,经窖池密封自然发酵后蒸馏而得。其白酒风味形成与大曲质量息息相关,在酿造过程中,大曲为白酒发酵提供大量的细菌、酵母菌和霉菌等原核、真核微生物,这些菌群是白酒发酵过程中降解大分子物质和生成发酵产物的重要生力军[2-3]。大曲制作发酵采用自然发酵,所含微生物很大部分取决于自然环境,不同地域环境微生物不同,最终生产的大曲质量也不同。
谭崇尧等利用高通量测序法对不同地域浓香型大曲微生物的结构进行分析,发现不同区域浓香型大曲优势菌群存有差别[4];施思等利用高通量测序法对浓香型大曲贮藏过程中糖化力发酵力变化及真菌多样性分析,发现大曲在储藏过程真菌群落结构不断调整,且随着时间的推移,大曲发酵力逐渐升高,糖化力由高变低再升高[5],罗惠波等采用PCR-SSCP技术对浓香型大曲不同发酵阶段原核微生物群落变化进行研究,发现不同阶段大曲原核微生物群落相似,不同菌群间具有复杂的协调和制约作用[2]。目前对于浓香型大曲的研究多集中在大曲的工艺、微生物群落结构变化等研究[6-9],而对不同区域大曲生产的环境微生态研究依然较少。
PLFA图谱分析法是近几年来发展的研究微生物群落结构的一种新方法,它可定量分析微生物群落的生物量和群落结构。PLFA作为活体微生物质膜重要的组成成分,具有很高的生物学特异性[10-14],其数量和种类随微生物的改变而变化,并且在自然生理条件下相对恒定;但在微生物细胞死亡后磷脂脂肪酸会迅速代谢降解[14-15]。因此相对于目前流行的高通量测序技术,PLFA图谱分析法检测微生物群落结构变化不仅操作简单快捷,同时还能对样品中微生物群落结构变化进行很好的跟踪[16-18],具有时效性的优势;此外,采用PLFA分析法研究微生物群落能避免植物DNA的干扰和微量微生物DNA的丢失。
本文采用Corolis μ空气生物采样器采集曲房空气微生物,采用PLFA图谱分析法,以四川绵阳市和泸州市两不同区域的浓香型大曲及其对应曲房空气为研究对象,探索不同地域浓香型大曲及曲房空气微生物群落的相关性,同时也为研究不同地域同种香型白酒风味差异提供理论依据。
1 材料与方法
1.1 材料与试剂
试验材料:分别采自四川绵阳和四川泸州两家浓香型酒厂不同发酵阶段的大曲及其对应曲房空气为样品。同一生产阶段大曲及对应曲房空气采取3个平行,利用Corolis μ空气生物采样器采集曲房空气,再将其转入装有无菌水的玻璃瓶中;无菌采集大曲后装入无菌的自封袋中,置于冰盒中迅速运回,粉碎后混匀,用于PLFA分析。各阶段样品取样环境参数如表1、表2所示。
表1 绵阳浓香型大曲样品编号
Table 1 Sample lable of Luzhou-flavour Daqu in Mianyang
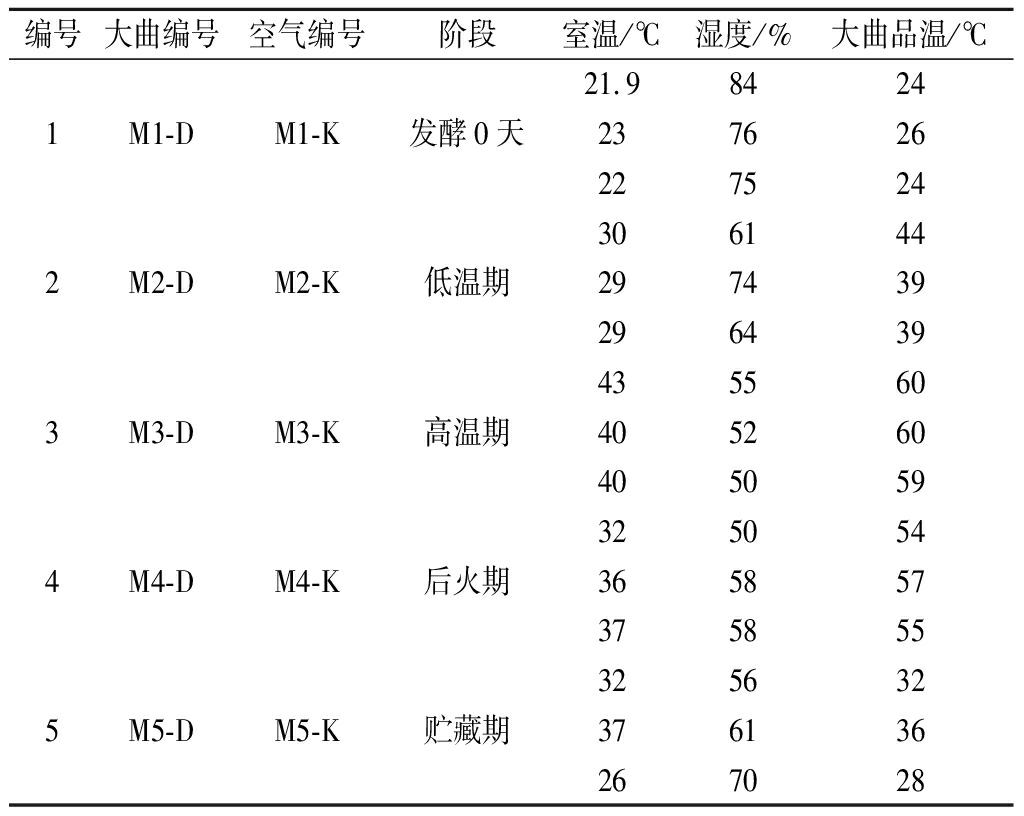
编号大曲编号空气编号阶段室温/℃湿度/%大曲品温/℃21.984241M1-DM1-K发酵0天2376262275243061442M2-DM2-K低温期2974392964394355603M3-DM3-K高温期4052604050593250544M4-DM4-K后火期3658573758553256325M5-DM5-K贮藏期376136267028
表2 泸州浓香型大曲样品编号
Table 2 Sample lable of Luzhou-flavour Daqu in Luzhou
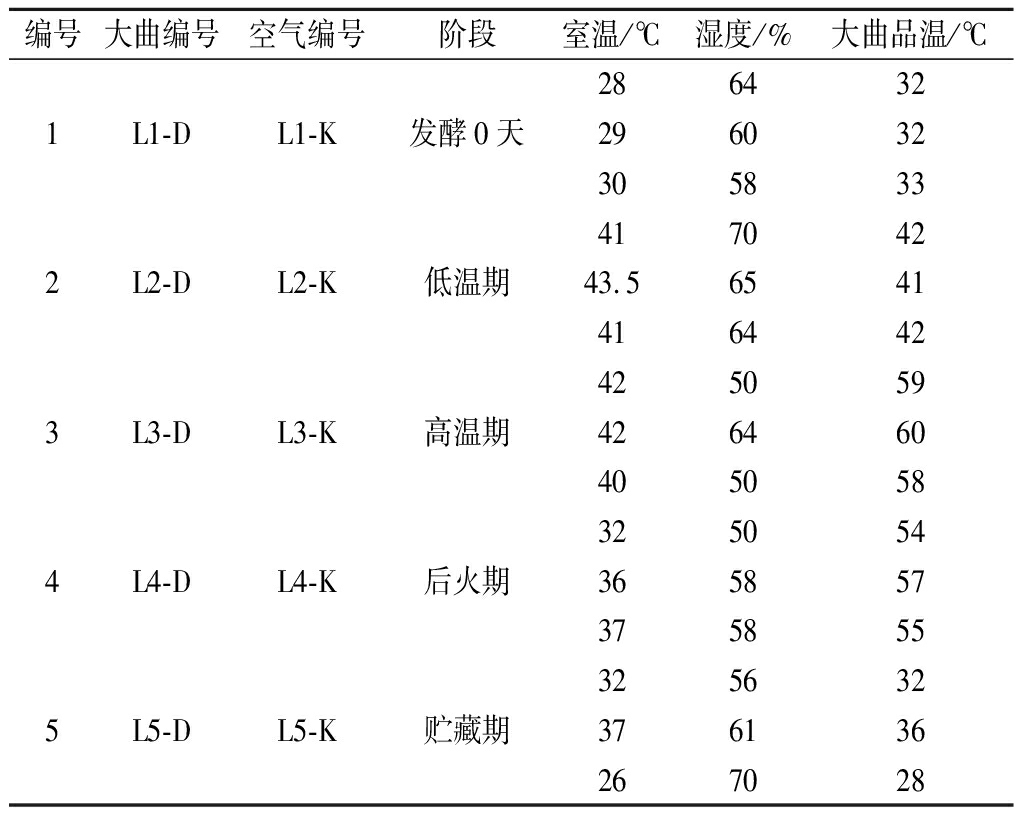
编号大曲编号空气编号阶段室温/℃湿度/%大曲品温/℃2864321L1-DL1-K发酵0天2960323058334170422L2-DL2-K低温期43.565414164424250593L3-DL3-K高温期4264604050583250544L4-DL4-K后火期3658573758553256325L5-DL5-K贮藏期376136267028
实验试剂:甲基叔丁基醚(色谱纯),Telia Company;正己烷(色谱纯),Fisher Scientific Company;甲醇(色谱纯),Darmstadt Germany;三氯甲烷、甲苯、醋酸和丙酮(均为分析纯),成都市科龙化工试剂厂。
1.2 仪器与设备
恒温培养振荡器,中国上海智城公司;GC6890气相色谱仪,美国Agilent公司;微生物鉴定系统,美国MIDI公司;高速离心机,德国Eppendorf公司;空气生物采样器,法国Bertin公司;超低温冰箱,美国Thermo公司;氮气吹干仪,中国北京八方公司。
1.3 方法
1.3.1 PLFA提取及甲基化
将空气滤膜或称取8 g的大曲样品于50 mL的离心管中,参照文献[18]进行PLFA的提取及甲基化。
1.3.2 PLFA命名及微生物群落的表征[18-19]
磷脂脂肪酸分析主要检测碳链长度C9~C24的PLFA,一般将这些PLFA分为直链脂肪酸(straight)、支链饱和脂肪酸(branched)、单不饱和脂肪酸(PUFA)、多不饱和脂肪酸(MUFA)、环化脂肪酸(cyclo)、羟基脂肪酸(hydroxy)、10-甲基脂肪酸(10-methyl)以及二甲缩醛化脂肪酸(DMA)。不同磷脂脂肪酸所表征微生物见表3。
表3 微生物种群PLFA标记物
Table 3 The PLFA biomarkers of microbial populations

生物分类PLFA标志革兰氏阴性细菌单不饱和脂肪酸革兰氏阳性细菌支链饱和脂肪酸放线菌10-甲基脂肪酸厌氧菌二甲缩醛化脂肪酸嗜热解氢芽孢杆菌18∶0真菌18∶2ω6,9、18∶1ω9
1.3.3 PLFA气相色谱分析
气相色谱仪,配备分流进样口,Agilent GC6890气相色谱化学工作站和氢火焰离子化检测器(FID);进样口温度为250 ℃;分流比为10∶1;进样量为1 μL;初始柱温40 ℃,保持2 min,再以5 ℃/min升至220 ℃,保持9 min。
1.4 数据分析
实验中理化数据结果以![]() 表示,每组重复3次。采用美国MIDI公司的Sherlock MIS 4.5 系统进行PLFA的分析与鉴定。对所得的数据采用SPSS 19.0软件的一般线性模型单因素Duncan法进行方差分析,并对相关数据进行主成分分析和相关性分析,并将所得的数据在Origin 8.0中编辑作图。
表示,每组重复3次。采用美国MIDI公司的Sherlock MIS 4.5 系统进行PLFA的分析与鉴定。对所得的数据采用SPSS 19.0软件的一般线性模型单因素Duncan法进行方差分析,并对相关数据进行主成分分析和相关性分析,并将所得的数据在Origin 8.0中编辑作图。
2 结果与分析
2.1 大曲及曲房空气细菌群落PLFA种类变化规律
采用PLFA图谱分析法分对四川绵阳、泸州两地区酒厂不同发酵时间的浓香型大曲及其曲房空气细菌群落的PLFA种类进行研究。结果表明,在整个发酵过程中,大曲与对应曲房空气细菌群落PLFA种类数变化相反,且大曲PLFA种类数高于对应曲房空气(图1)。这可能是由于大曲营养丰富且菌种来源广泛,使得大曲富集的细菌微生物种类多于曲房空气,且随着发酵时间的延长,大曲营养成分、理化性质发生改变,部分微生物种类可能无法适应大曲当前环境而迁移至曲房空气中,当大曲环境适合于微生物生长时,空气微生物再次被富集于大曲中,导致大曲与其曲房空气微生物种类存在一种此消彼长的变化趋势。
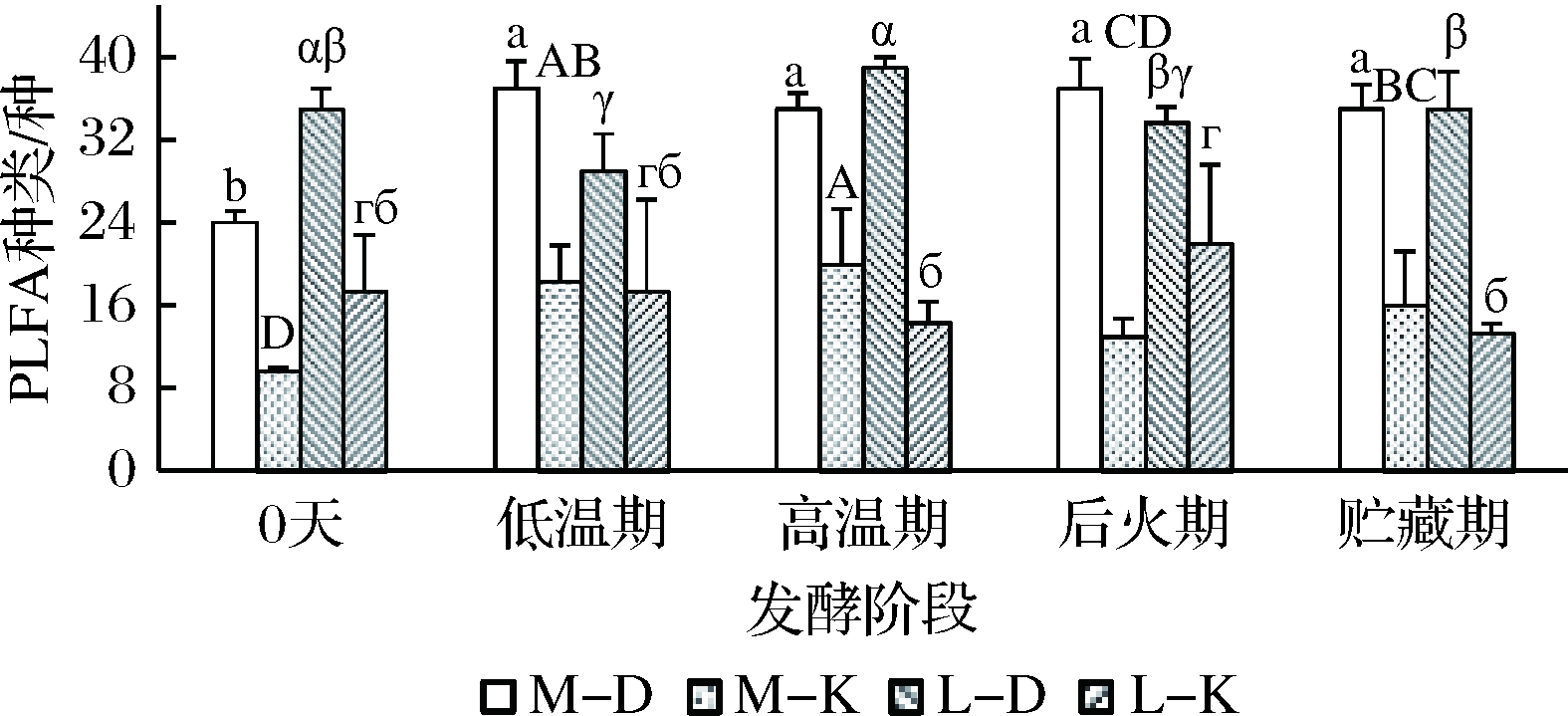
图1 不同区域大曲及其曲房空气细菌PLFA种类数变化
Fig.1 Changes in the number of bacteria PLFA species
in Daqu and its air of stacking workshop in different regions
注:图中不同字母代表差异显著。下同。
两地大曲细菌种类数在23~39,低温前期变化较大且变化趋势相反,发酵后期细菌PLFA种类趋于稳定。绵阳大曲细菌群落PLFA种类数在低温期增至最大值37,显著高于发酵0天(P<0.05),后期趋于稳定。泸州大曲在低温期细菌PLFA种类数显著降低(P<0.05),高温期迅速增至最大值(39),显著高于低温期(P<0.05),后期趋于稳定。这可能是由于两地制曲所用的原料、水、母曲以及制曲工艺、环境因素等的不同,使得两地大曲微生物消长有其特殊性[20]。两地曲房空气细菌PLFA种类数在9~22,绵阳曲房空气细菌PLFA种类在发酵前期持续上升,高温期达到最大值(20种),后期迅速降低,且显著低于高温期(P<0.05);泸州曲房空气细菌PLFA种类数在高温期前趋于稳定,高温期后显著上升(P<0.05),后火期达到最大值(22种),贮存期开始下降。这可能与曲房空气温度有关,绵阳地区曲房温度在高温期达到最大值,泸州地区曲房温度在低温期就已经达到最大值,发酵前期大曲营养丰富,生长温度适宜,多种微生物种类生长繁殖使曲房微生物种类增加,曲房空气温度升高后,不适合高温的微生物被淘汰导致曲房细菌群落种类降低[21]。
2.2 不同地区大曲及曲房空气细菌群落PLFA种类组成分析
采用PLFA图谱分析法对绵阳和泸州两地区酒厂浓香型大曲及其厂房空气细菌群落的磷脂脂肪酸种类组成进行分析(图2~图4)。结果表明,两地大曲及曲房空气以革兰氏阳性菌和革兰氏阴性菌为主要菌群,且曲房空气中检测到的PLFA种类在对应大曲中大致都能被检测。此外,不同区域大曲及曲房空气的PLFA种类具有差异性,皆含有其特有微生物种类。泸州大曲特有PLFA种类包括表征革兰氏阴性菌的13∶1ω4、22∶1ω9和表征革兰氏阳性菌的a17∶1ω7;绵阳大曲特有PLFA种类为表征革兰氏阴性菌的14∶0 20H、15∶1ω8、21∶1ω5、22∶1ω3和表征厌氧菌的18∶1ω9DMA。泸州曲房空气特有PLFA种类为表征革兰氏阴性菌的10∶0 20H、18∶1ω8、18∶1ω9,绵阳曲房空气特有PLFA为表征革兰氏阴性菌的17∶1ω4和表征革兰氏阳性菌的a12∶0以及表征厌氧菌的18∶1ω7 DMA、18∶1ω9 DMA。此外,磷脂脂肪酸c17∶0ω9、17∶1ω8、c20∶0ω6、20∶1ω9、22∶1ω5、16∶1ω7(均表征革兰氏阴性菌);a13∶0、a14∶0、a15∶0、a17∶0、i15∶0、i16∶0、i17∶0、i18∶0(表征革兰氏阳性菌);18∶0DMA、20∶1ω9(表征厌氧菌)、18∶0(表征嗜热芽孢杆菌)代表的微生物种类为两地大曲及曲房空气共有微生物种类,这些微生物种类可能是影响浓香型大曲风格的重要菌种,其结果与赵金松等[22]的研究结果相似。
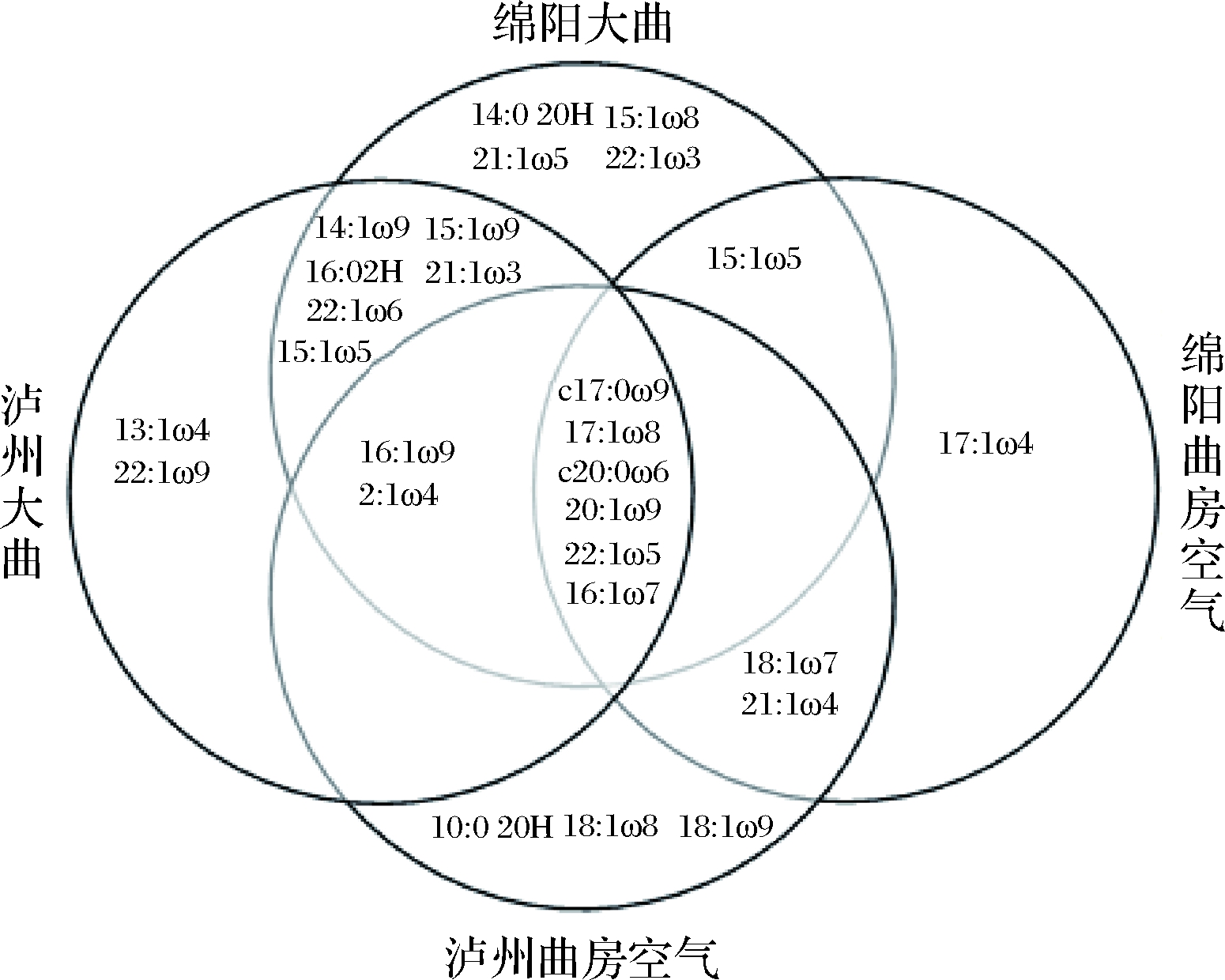
图2 不同区域大曲和曲房空气革兰氏阴性菌PLFA组成
Fig.2 PLFA composition of Gram-negative bacteria
in the Daqu and the air of stacking room in different regions
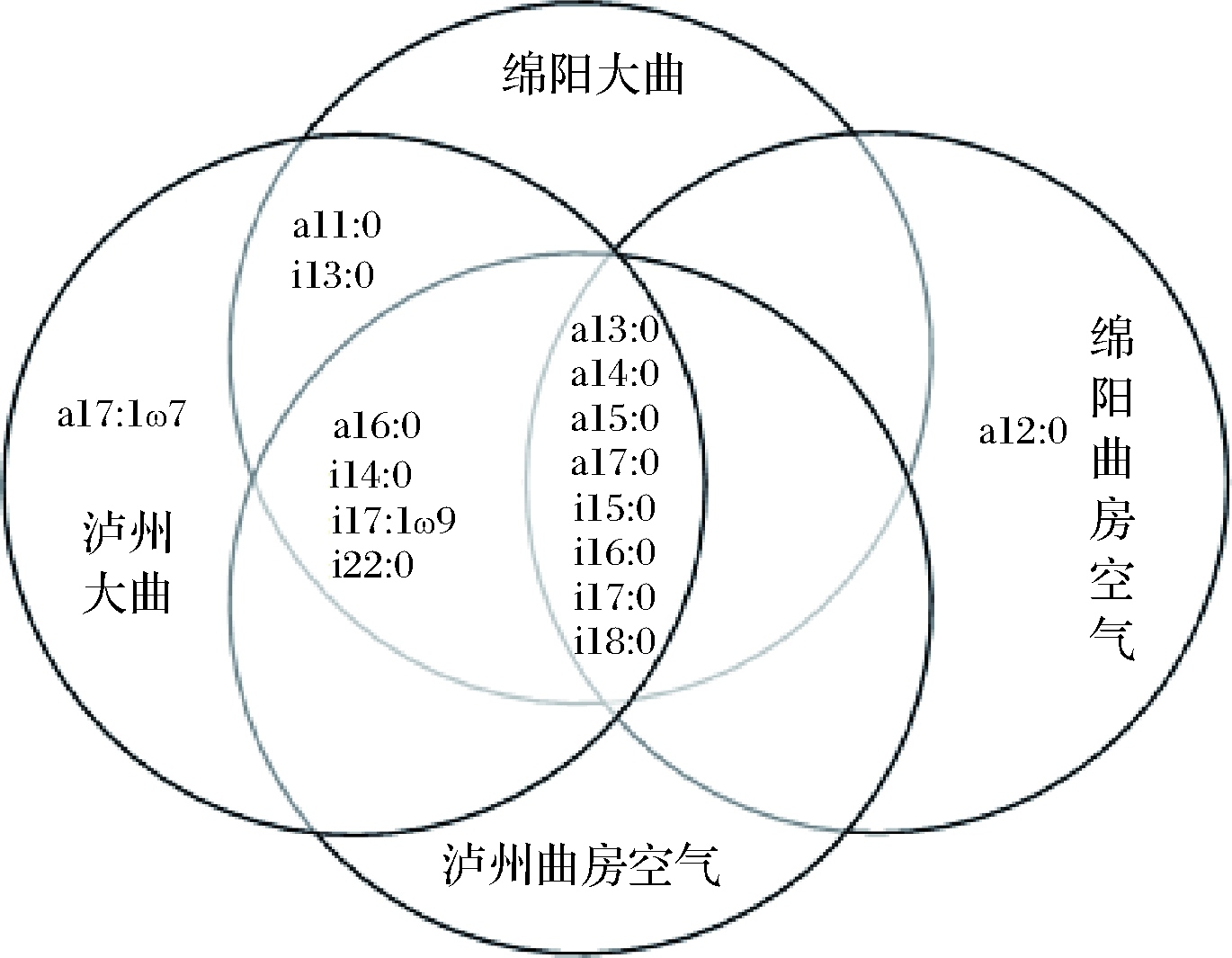
图3 不同区域大曲和曲房空气革兰氏阳性菌PLFA组成
Fig.3 PLFA composition of Gram-positive bacteria in the
Daqu and the air of stacking room in different regions

图4 不同区域大曲和曲房空气厌氧菌及嗜热芽孢杆菌
PLFA组成
Fig.4 PLFA composition of anaerobic bacteria and
Bacillus thermophilus in the Daqu and the air of stacking
room in different regions
2.3 大曲及曲房空气细菌群落生物量变化趋势
采用PLFA法分别对绵阳、泸州地区不同发酵阶段的浓香型大曲及厂房空气细菌群落生物量变化趋势进行研究。结果表明,在发酵过程中,绵阳、泸州大曲及其曲房空气细菌生物量均呈先上升、后降低的趋势变化,且大曲生物量高于对应曲房空气生物量(图5),这说明大曲与曲房微生物具有一定的相关性,曲房环境对大曲细菌群落影响巨大。绵阳、泸州两地大曲及曲房空气细菌生物量均在后火期达到最大值,其绵阳大曲为94.18 nmol/m3、泸州大曲为78.09 nmol/m3、绵阳曲房空气为54.58 nmol/m3以及泸州曲房空气为6.24 nmol/m3。绵阳大曲细菌生物量在发酵前期保持稳定(P>0.05),后火期迅速增加,显著高于其他发酵阶段(P<0.05),贮存期开始下降;曲房空气细菌生物量在发酵前期持续上升,后火期达到最大值(P<0.05),贮存期生物量有所降低。泸州大曲细菌生物量变化趋势与绵阳曲房空气变化一致,后火期显著高于其他发酵阶段;曲房空气细菌生物量在高温期前缓慢降低,高温期达到最低值,后火期迅速上升达到最大值(P<0.05),显著高于其他各阶段,贮存期生物量降低。两地大曲及曲房细菌微生物群落均在后火期达到最大值,这可能是由于浓香型大曲及其曲房空气在发酵过程中升温速度较缓慢,未被淘汰的耐高温微生物能快速适应高温环境成为优势菌群,在高温阶段也能生长繁殖[23],直至后火期生物量达到顶峰,进入贮藏期后大曲及曲房空气中微生物生长所需的水、营养物质等降低导致细菌生物量降低。

a-绵阳和泸州大曲细菌生物量;b-绵阳和泸州曲房空气细菌生物量
图5 大曲及曲房空气细菌生物量随发酵时间的变化
趋势图
Fig.5 The trend of bacterial biomass in Daqu and air
as a function of fermentation time
2.4 大曲及曲房空气细菌群落变化趋势
对绵阳、泸州不同地区的浓香型大曲及其厂房空气的细菌群落结构进行研究分析(如图6)。结果表明,两地大曲优势菌群主要为嗜热解氢杆菌、革兰氏阴性菌和革兰氏阳性菌,曲房空气优势菌群主要为革兰氏阳性菌和革兰氏阴性菌,其结果与谭崇尧等、陈玲等利用高通量测序法测得的川派浓香型大曲结果较为相同[4,24]。泸州大曲在退火期前以革兰氏阴性菌为优势菌群,革兰氏阳性菌群丰富度总体呈递增趋势,嗜热芽孢杆菌和厌氧菌丰富度保持相对稳定,进入贮藏期,以嗜热芽孢杆菌为优势菌群;其曲房空气在发酵0 d以革兰氏阳性菌为优势菌群,低温期和后火期相对丰度降低以厌氧菌为优势菌群,进入贮藏期,革兰氏阴性菌丰度增加成为优势菌群。绵阳大曲发酵初期以革兰氏阴性菌为优势菌群,低温期转为革兰氏阳性菌,中后期嗜热解氢杆菌、革兰氏阴性菌丰富度增加,贮藏期后以革兰氏阴性菌为优势菌群;其曲房空气在发酵0 d以革兰氏阳性菌为优势菌群,后期以革兰氏阴性菌为优势菌群,在整个发酵过程中只有在低温期检测到少量厌氧菌。这可能是由于绵阳丰谷大曲的并曲工艺使曲房空气的含氧量增加,使得厌氧菌无法生长[18]。
在发酵前期,绵阳大曲和其曲房空气中革兰氏阳性菌、革兰氏阴性菌以及嗜热解氢杆菌的相对丰度呈相反的趋势变化;泸州大曲中厌氧菌和革兰氏阳性菌的相对丰度变化趋势与曲房空气相反。这可能是因为大曲和曲房空气中的微生物相互迁移所造成的,微生物在空气中因为营养物质和水分的缺乏不能较好地繁殖,但却栖息着大量的孢子,大曲刚放入曲房、并曲、翻曲以及移库均会增加空气中的流动性,此时孢子会随着空气的流动四处传播,在适宜的条件下生长繁殖,随后又被卷入空气中,如此循环、交替[25]。

a-泸州大曲与曲房空气细菌群落;b-绵阳大曲与曲房空气细菌群落
图6 大曲及曲房空气中细菌群落的分布
Fig.6 Distribution of bacterial community in Daqu and air
2.5 大曲及曲房空气细菌群落结构的主成分分析
采用主成分分析法(PCA)对绵阳、泸州两区域浓香型大曲及其曲房空气不同发酵阶段的微生物PLFA种类进行分析。结果表明,绵阳地区各阶段大曲及其曲房空气细菌群落在发酵0 d、低温期和退火期组成相似,与高温期和储藏期大曲细菌群落组成差异较大(图7),这表明绵阳大曲与曲房空气细菌群落存在相互影响,且高温期的高温和储存期的低水分对细菌群落结构组成可能有较大影响。泸州地区浓香型大曲及其曲房空气细菌群落组成在整个发酵过程中对应组成相似,其中L1-K、L1-D、L2-K、L2-D、L3-K、L3-D在PC1上距离接近,L4-K、L4-D、L5-K、L5-D在PC2上距离接近(图8),表明泸州大曲与曲房空气在整个发酵过程中存在重要相互作用。两地大曲及其曲房空气细菌群落微生物皆在发酵0 d、低温期组成相似,大曲前期是大曲经过微生物自然接种后进行培菌的重要时期之一,这说明曲房空气细菌的群落对大曲的发酵有着重要的影响,与罗惠波等[26]研究的结果基本一致。

图7 绵阳大曲及其曲房空气PLFA的主成分分析
Fig.7 Principal component analysis of PLFA in
the Daqu and air of stacking room of Mianyang

图8 泸州大曲及其曲房空气PLFA的主成分分析
Fig.8 Principal component analysis of PLFA
in the Daqu and the air of stacking room of Luzhou
3 结论
利用磷脂脂肪酸(PLFA)技术对绵阳、泸州两地大曲及曲房空气在发酵过程中的微生物群落进行研究,并对两者之间细菌群落结构的差异进行分析,结果如下:(1)两地大曲及其曲房空气微生物PLFA种类呈现此消彼长的变化趋势,且大曲各阶段的微生物PLFA种类数高于对应空气中PLFA种类数,在曲房中能检测到PLFA种类在对应阶段大曲中大致都能检测到。(2)两地大曲及其曲房空气的细菌生物量均呈先升高后降低的趋势变化,在后火期达到最高值,绵阳大曲曲房空气细菌生物量在整个发酵过程中均高于泸州曲房空气。(3)通过相对丰度比较和主成分分析发现,两地大曲的优势菌群表现为嗜热解氢杆菌、革兰氏阴性菌和革兰氏阳性菌,曲房空气优势菌群表现为革兰氏阳性菌和革兰氏阴性菌,且泸州地区曲房空气在发酵过程中厌氧菌相对含量较高;绵阳地区浓香型大曲及曲房空气细菌群落在发酵前期对应组成相似,泸州地区浓香型大曲及其曲房空气在整个发酵阶段对应组成相似,表明浓香型大曲及其曲房空气细菌群落存在重要相互影响,且主要发生在发酵前期。
综合研究结果可得,曲房空气微生物与大曲微生物在整个发酵过程中处于一种相互转移的状态,且可能主要发生在大曲发酵前期,转移微生物主要表现为革兰氏阳性菌和革兰氏阴性菌。此外,不同区域浓香型大曲曲房空气微生物群落组成变化具有其特殊性,这可能是两地浓香型白酒口感差异的原因之一。曲房空气微生物对大曲微生物的多样性具有重要影响,深入研究曲房空气微生物和对提升大曲质量具有重大意义。
[1] 张杰,程伟,潘天全,等.浓香型白酒风味成分研究现状及展望[J].酿酒,2019,46(1):29-32.
[2] 罗惠波,黄治国,李浩,等. 浓香型大曲原核微生物群落的PCR-SSCP解析[J]. 微生物学通报, 2009, 32(9):1 363-1 367.
[3] 张文学,乔宗伟,胡承,等. 浓香型白酒糟醅中真菌菌群的多样性分析[J]. 四川大学学报(工程科学版), 2006, 38(5):97-101.
[4] 谭崇尧,徐军. 高通量测序法对不同地域浓香型大曲微生物结构的分析[J]. 酿酒科技, 2018, 291(9):118-122.
[5] 施思,彭智辅,乔宗伟,等. 浓香型大曲贮藏过程中糖化力发酵力变化及真菌多样性分析[J]. 食品与发酵工业, 2017, 43(5):76-79.
[6] 陈彬,何宏魁,刘国英,等.大小曲及发酵方式对清香型白酒风味的影响[J].食品与发酵工业,2018,44(8):166-171.
[7] ZHANG H, ZHANG X, ZHAO J, et al. Analysis of the microbial communities of three kinds of Fen-Daqu by PLFAs[J]. Journal of the Institute of Brewing, 2016, 122(1):34-41.
[8] 张春林. 泸州老窖大曲的质量、微生物与香气成分关系[D]. 无锡:江南大学, 2012: 3-5.
[9] 李丹宇. 浓香型大曲制备过程中理化指标及微生物群落演替规律的研究[D]. 自贡:四川轻化工大学, 2013: 7-9.
[10] ADAM I K U, MILTNER A, K STNER M. Degradation of C-labeled pyrene in soil-compost mixtures and fertilized soil[J]. Applied Microbiology & Biotechnology, 2015, 99(22): 9 813-9 824.
STNER M. Degradation of C-labeled pyrene in soil-compost mixtures and fertilized soil[J]. Applied Microbiology & Biotechnology, 2015, 99(22): 9 813-9 824.
[11] HE R, WOOLLER M J, POHLMAN J W, et al. Methane-derived carbon flow through microbial communities in arctic lake sediments[J]. Environmental Microbiology, 2015, 17(9):3 233-3 250.
[12] HELFRICH M, LUDWIG B, THOMS C, et al. The role of soil fungi and bacteria in plant litter decomposition and macroaggregate formation determined using phospholipid fatty acids[J]. Applied Soil Ecology, 2015, 96(8):261-264.
[13] 李翠霞. 新老制曲环境中微生物分布情况的初步研究[J]. 酿酒, 2009, 36(4):30-31.
[14] ZHANG H, ZHANG X, ZHAO J, et al. Analysis of the microbial communities of three kinds of Fen‐Daqu by PLFAs[J]. Journal of the Institute of Brewing, 2016, 122(1):34-41.
[15] 余素林,吴晓磊,钱易. 环境微生物群落分析的T-RFLP技术及其优化措施[J]. 应用与环境生物学报, 2006, 12(6):861-868.
[16] DING X, WU C, HUANG J, et al. Interphase microbial community characteristics in the fermentation cellar of Chinese Luzhou -flavor liquor determined by PLFA and DGGE profiles[J]. Food Research International, 2015, 72(4):16-24.
[17] ZHENG J, LIANG R, ZHANG L, et al. Characterization of microbial communities in strong aromatic liquor fermentation pit muds of different ages assessed by combined DGGE and PLFA analyses[J]. Food Research International, 2013, 54(1):660-666.
[18] 曹宇,翟磊,信春晖,等. 芝麻香型白酒高温大曲制曲过程中微生物群落结构特征的磷脂脂肪酸(PLFA)分析[J]. 酿酒科技, 2016(3):33-36;41.
[19] 刘波.微生物脂肪酸生态学[M]. 北京:中国农业科学技术出版社,2011.
[20] 余有贵.生态酿酒新技术[M]. 北京:中国轻工业出版社,2016.
[21] 于学健.冯慧军,翟磊,等.芝麻香型白酒高温大曲中高温放线菌及其功能基因的动态变化规律[J].食品与发酵工业,2019,45(13):71-77.
[22] 赵金松,郑佳,沈才洪,等.基于磷脂脂肪酸分析技术的大曲微生物群落结构多样性研究[J].食品工业科技,2017,38(1):160-164.
[23] 徐泽江. 芝麻香型白酒酿造微生物多样性分析[D]. 杭州:浙江理工大学, 2012.
[24] 陈玲,袁玉菊,曾丽云, 等. 16S rDNA克隆文库法与高通量测序法在浓香型大曲微生物群落结构分析中的对比研究[J]. 酿酒科技, 2015(12):33-36;40.
[25] 胡桂林. 空气及空气中的微生物对清香型白酒发酵的影响[D]. 呼和浩特:内蒙古农业大学, 2008.
[26] 罗惠波,唐玉明,卓毓崇. 制曲车间空气微生物及其对曲药质量的影响研究[J]. 中国酿造, 2004(8):19-22.