胍基丁胺(agmatine)作为一种重要的生物胺,具有很大的生理功能和医药价值。1994年LI等认为CDS物质便是胍基丁胺[1],从此对该物质的研究逐渐增多。胍基丁胺由精氨酸脱羧酶(arginine decarboxylase,ADC)催化底物精氨酸脱羧产生[2]。血液中胍基丁胺的质量浓度为0.2~0.4 ng/mL,胍基丁胺在体内几乎分布于所有的器官[3],在亚细胞水平上,胍基丁胺存在于距内质网和线粒体很近的大密度核心囊泡中[4]。胍基丁胺能抑制细胞内多胺的合成,促进多胺的降解,从而降低细胞内多胺的水平[5];在中枢神经系统,胍基丁胺可作为一种抗抑郁的药物,减缓耐药性的发生和改善急性吗啡停药综合征[6];此外,胍基丁胺还能促进记忆的巩固[7];胍基丁胺能抑制多种细胞的增殖(包括肝癌细胞、血管平滑肌细胞、星型胶质细胞、内皮细胞和肾小管上皮细胞等)[8-9]。在食品、医药等领域国内外需求巨大,市场应用前景广阔。
目前我国胍基丁胺的制备主要来自化学方法,化学法合成胍基丁胺步骤繁琐、效率低、污染重。利用生物法合成胍基丁胺因具有操作简便、反应速率快、无污染等优点,受到了人们的关注。AKASAKA等[10]利用米曲霉固态发酵生产胍基丁胺,产量只有8.3 mmol/L,ZHANG等[11]利用固定化基因重组大肠杆菌催化精氨酸合成胍基丁胺,其产量可以达到20 g/L;SUN等[12]利用基因重组大肠杆菌表达ADC,然后利用该酶催化精氨酸反应,使得胍基丁胺的产量提高到69.22 g/L。本文应用构建的1株基因工程菌发酵表达ADC,通过在摇瓶上对最基本的发酵诱导培养温度、转化pH、辅酶加量及发酵培养基的优化,ADC酶活水平得到提高。15L发酵罐放大实验验证,胍基丁胺产量明显提高。
1 材料与方法
1.1 材料
1.1.1 菌种
含有pET-28a(+)质粒的重组大肠杆菌K12(Escherichia coli K12,E.coli K12),为本实验室构建保藏,革兰氏阴性菌。
1.1.2 培养基
种子培养基(g/L):蛋白胨10,酵母粉5,NaCl 10。pH自然,121 ℃高温灭菌20min。
初始发酵培养基(g/L):甘油10(单消),蛋白胨12,酵母粉8,Na2HPO4·12H2O 15,K2HPO4·3H2O 10,KH2PO4 3,柠檬酸2,NH4Cl 1,MgSO40.5,NaCl 0.5,柠檬酸铁铵0.3,pH 7.0,121 ℃灭菌20 min。
优化后发酵培养基(g/L):甘油7(单消),蛋白胨15,酵母粉5,Na2HPO4·12H2O 18,K2HPO4·3H2O 13,KH2PO45,NaCl 1,MgSO41。pH 7.0,121 ℃灭菌20 min。
1.2 实验方法
1.2.1 检测方法
1.2.1.1 菌体浓度[13]
取一定量的发酵液用纯化水稀释一定的倍数,用UV-1200分光光度计在600 nm下测定其吸光值OD600。取一定体积发酵液离心去上清并烘干至恒重得菌体干重(dry cell weight,DCW)。
1.2.1.2 胍基丁胺
胍基丁胺含量使用岛津LC-20AT高效液相色谱仪测定,色谱柱为Inertsil ODS-C18色谱柱(4.6 mm×250 mm,5 μm);检测波长为210 nm;流动相为0.03 mol/L NaH2PO4,用磷酸调节pH值至3.0;柱温为25 ℃;进样量为20 μL;分析时间为20 min。
1.2.1.3 酶活[14]
酶活检测反应体系组成为:4 mL 0.2 mol/L的KH2PO4缓冲液,200 μL L-Arg母液(125 g/L),200 μL磷酸吡哆醛(phosphopyridoxal,PLP)母液(4.13 g/L),200 μL MgSO4母液(25 g/L)。混合后置37 ℃水浴锅中预热15 min,再加入200 μL粗酶悬液反应5 min,离心取上清,检测胍基丁胺浓度计算酶活。
1.2.2 重组菌构建
采用细菌基因组提取试剂盒提取Escherichia coli的基因组,以其为模板,PCR扩增精氨酸脱羧酶基因。所用脱精氨酸羧基之基因乃adiA非speA[15],载体pet-28a(+)。所用引物如下:
正向引物F:5′-CGGGATCCCGTACTTTCATAATTAACAAC-3′;反向引物R:5′-CGAGCTCGAATGCGA-AAGTGCGTGTATTG-3′。
PCR反应体系和条件如下:
(1)PCR扩增体系:DNA聚合酶 25 μL;正向引物 2.0 μL;反向引物 2.0 μL;模板DNA 2.0 μL;dd H2O 19 μL。
(2)PCR扩增条件:预变性:95℃,3min;变性:95℃,15s;退火:55℃,15s;延伸:72℃,15 s;循环30次;延伸:72℃,10min;4℃保存。
载体与脱羧基基因所连接处,用BamHI与SacI限制性内切酶处理6 h,用T4DNA连接酶将二者于16℃条件下过夜连接。然后将重组质粒导入感受态E.coli K12细胞中,随之将其涂布于含有50 μg/mL硫酸卡那霉素的LB平板培养基上过夜培养。挑取单菌落,由通用生物进行基因序列的测定以验证其正确性,从而获得正确构建的工程菌株。
1.2.3 摇瓶试验
1.2.3.1 发酵培养与诱导
甘油管保藏菌接种于平板进行活化,37 ℃倒置培养24 h,置4 ℃冰箱保存备用。从平板挑取一环菌苔入摇瓶种子培养基中(50 mL/250 mL锥形瓶),37 ℃、180 r/min恒温气浴摇床中培养16 h得到种子培养液,以3%接种量接种于发酵培养基中(50 mL/500 mL锥形瓶),同时添加体积分数为50%的甘油,在37 ℃、180 r/min恒温气浴摇床中培养6 h,再加入终浓度为0.5 mmol/L的IPTG开始诱导,并补加甘油,30 ℃培养16 h后结束发酵。
1.2.3.2 酶转化
转化体系组成为100 g/L L-Arg,8 g/L辅酶PLP,5 g/L MgSO4。转化温度37℃,转化pH 5.0,转化时间:5 h。
1.2.3.3 培养基优化
利用SAS JMP软件对重组菌发酵培养基各成分(A-甘油、B-蛋白胨、C-酵母粉、D-Na2HPO4、E-K2HPO4、F-KH2PO4、G-NaCl、H-NH4Cl、I柠檬酸、J-柠檬酸铁铵、K-MgSO4)进行定制实验设计,实验选取11因素2水平进行。
1.2.4 放大实验
1.2.4.1 发酵
采用上海保兴BIOTECH 15L发酵罐进行补料分批发酵[16],当罐内底料中碳源与氮源耗尽后,开始流加甘油与氨水,流加速率vC、vN见图1。
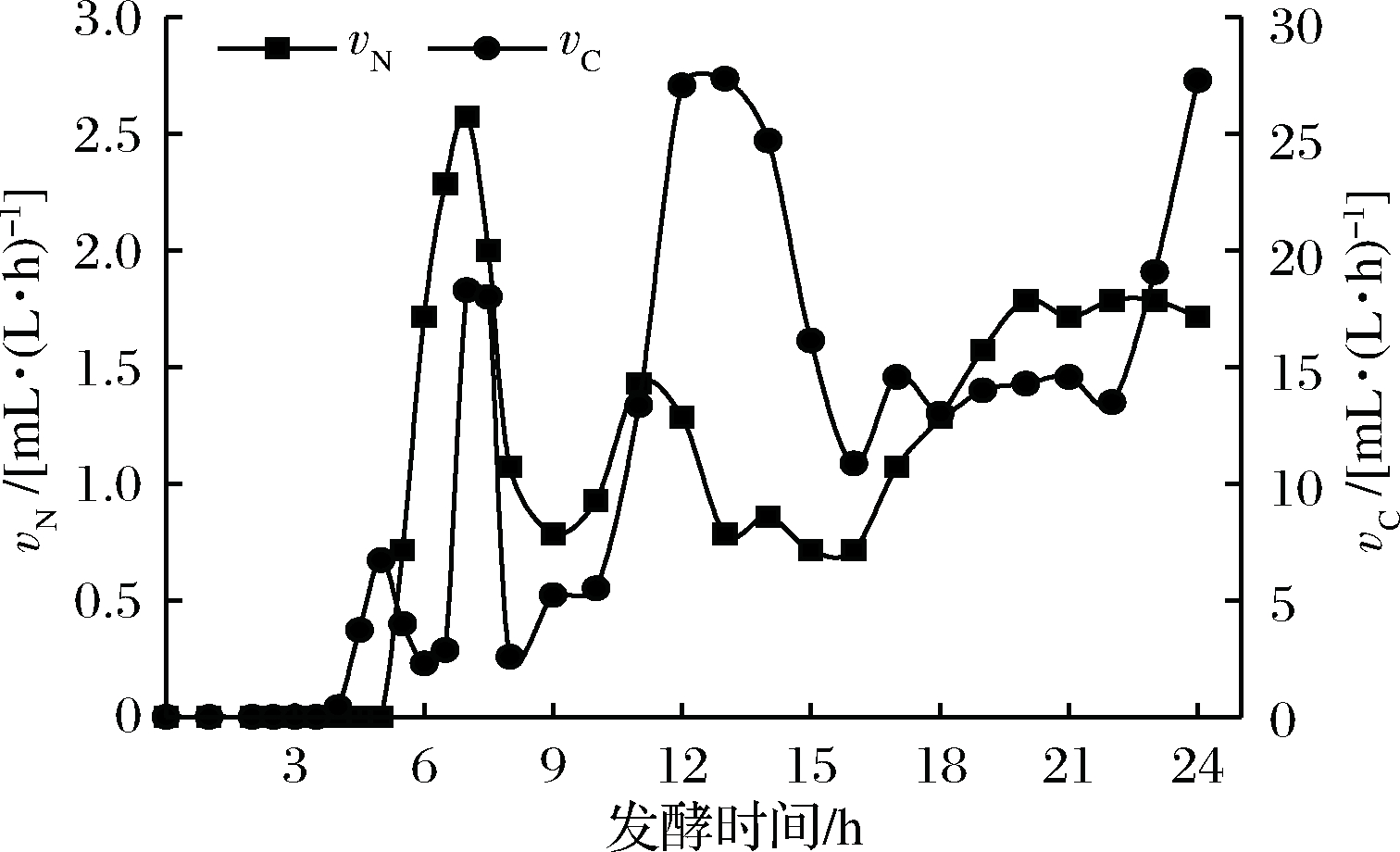
图1 甘油与氨水流加曲线
Fig.1 The flow curve of glycerol and ammonia
1.2.4.2 酶转化
发酵结束后用50 nm陶瓷膜对发酵液进行浓缩和洗涤,收集菌体浓缩液,并加入L-Arg、PLP及MgSO4,然后加水定容至原发酵液体积,制得转化液,稀H2SO4调节pH至5.0开始反应,反应期间补加L-Arg以提高产物浓度。
2 结果与分析
2.1 ADC发酵诱导温度的选择[17]
为了确定重组E.coli K12发酵的最佳诱导培养温度,本文在摇瓶培养条件下考察了4种不同温度对菌体细胞生长和酶活的影响,实验结果见图2,所用发酵培养基为1.1.2中的初始发酵培养基,IPTG诱导之前的培养方法见1.2.3.1。

图2 不同的诱导培养温度对生物量和酶活的影响
Fig.2 The effect of different temperature to the
biomass and enzyme activity
由图2可知,不同的诱导培养温度,对菌体生长和ADC的活性大小有一定影响,30 ℃为最适诱导培养温度,此温度有利于酶蛋白形成正确的空间构象,提高了酶活;25 ℃时酶活与OD600值均低,这是因为低温下参与重组蛋白表达的各种酶的活性有所降低,减缓了ADC的表达速率,低温不利于菌体生长,使得产生酶蛋白的数量不足而影响酶活。37 ℃对OD600值影响虽然较小,但对重组蛋白表达速率影响较大,因而酶活较低。
2.2 不同pH条件下ADC对转化效果的影响
转化时pH控制在5个范围(如图3所示)。由于胍基丁胺是精氨酸在ADC催化下脱掉羧基生成的,随着反应的进行,转化体系的pH会随之升高,需要不断调节pH以维持酶的高转化活性。反应结束后检测胍基丁胺与精氨酸浓度计算出酶活与转化率。由图3可以看出pH控制在5.0时胍基丁胺浓度最高,相应的转化率也最高。
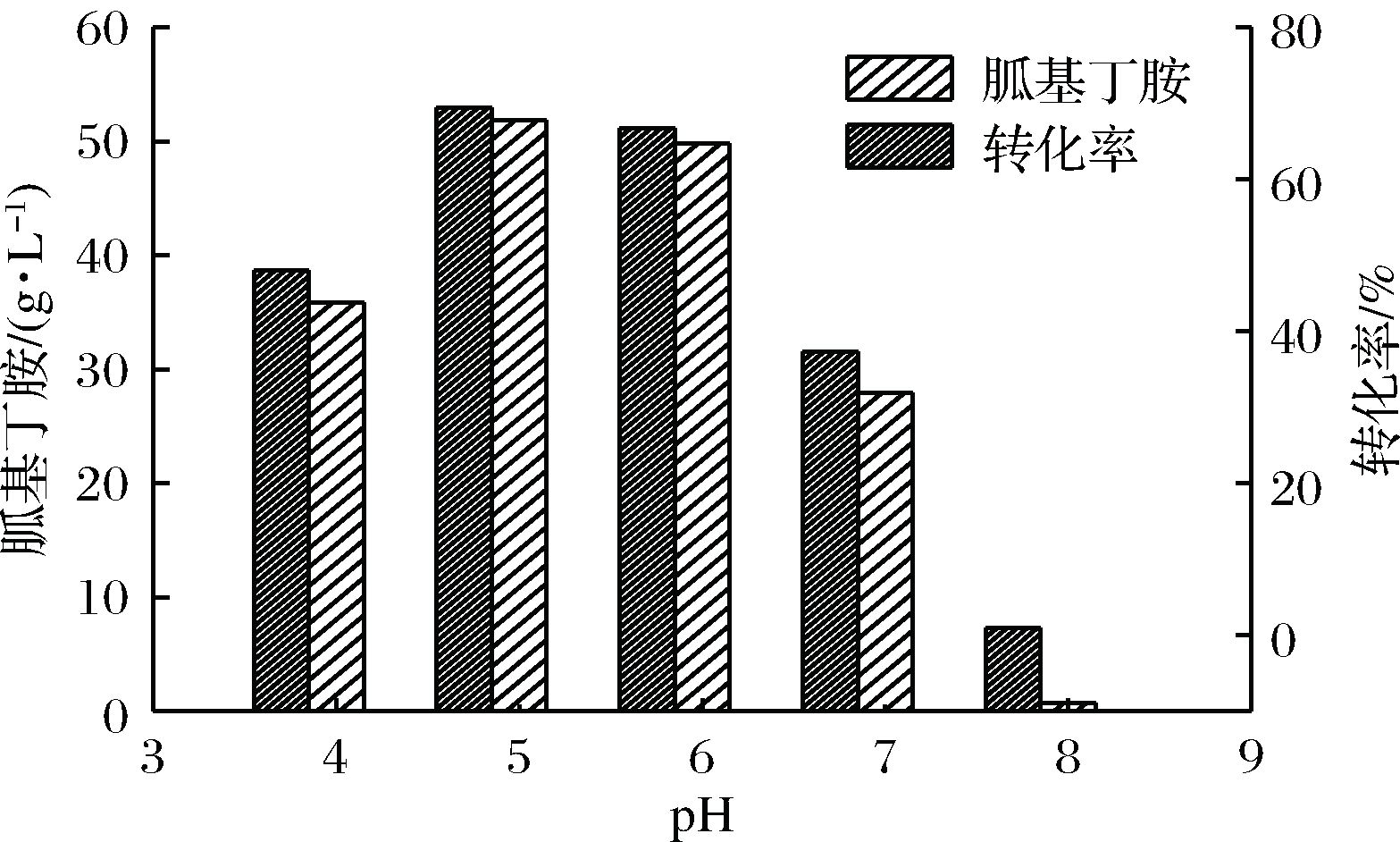
图3 不同酸碱性条件对转化效果的影响
Fig.3 The effect of acid-base condition to the conversion
2.3 重组菌发酵培养基优化
实验设计及响应值见表1,根据结果筛选出影响ADC活性的显著性因素,得到酶活的预测表达式。从表1中可以看出,在误差允许范围内,酶活实测值与预测值是相符的。
表1 实验设计与结果
Table 1 The design of experiment and response values
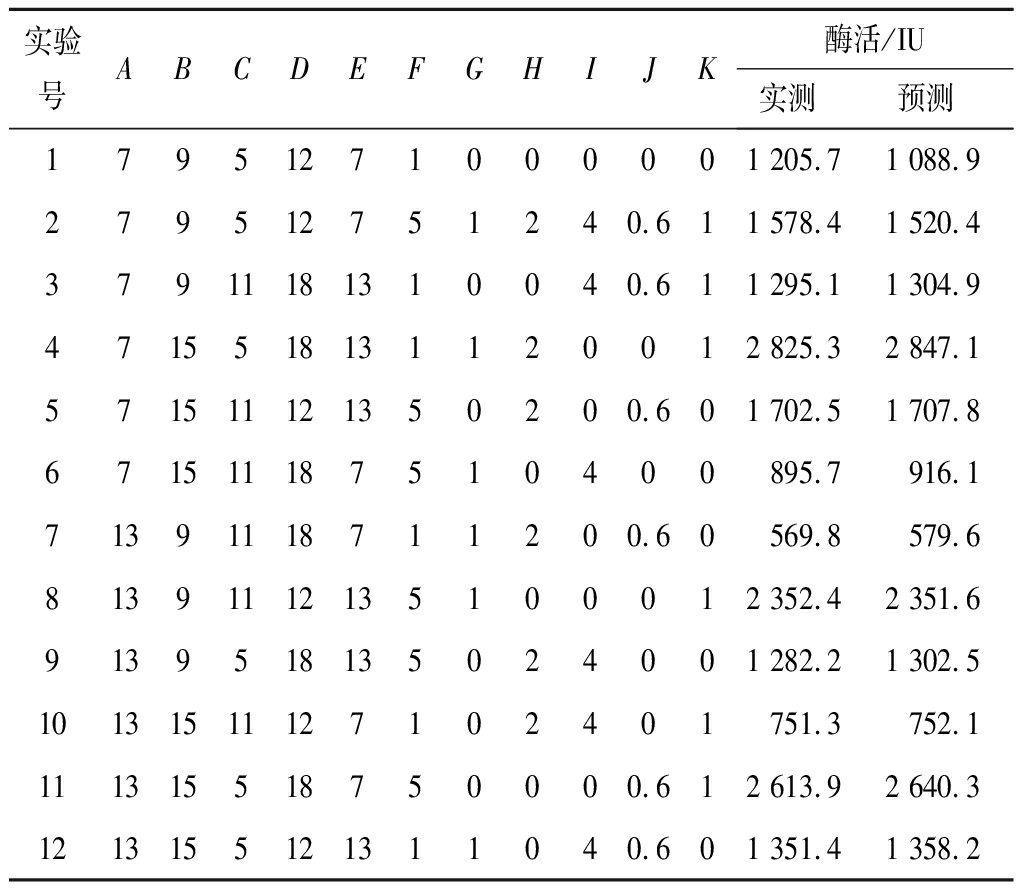
实验号ABCDEFGHIJK酶活/IU实测预测17951271000001 205.71 088.9279512751240.611 578.41 520.437911181310040.611 295.11 304.94715518131120012 825.32 847.1571511121350200.601 702.51 707.8671511187510400895.7916.171391118711200.60569.8579.681391112135100012 352.42 351.69139518135024001 282.21 302.510131511127102401751.3752.1111315518750000.612 613.92 640.31213155121311040.601 351.41 358.2
回归参数及效应检验见表2,在P值为0.1的条件下进行参数分析,结果表明,因素K、I、C、E是显著性影响因子,在实验范围内对ADC的活性影响最大[18]。通过影响因素筛选,得到以ADC活性Y为响应值的回归方程:
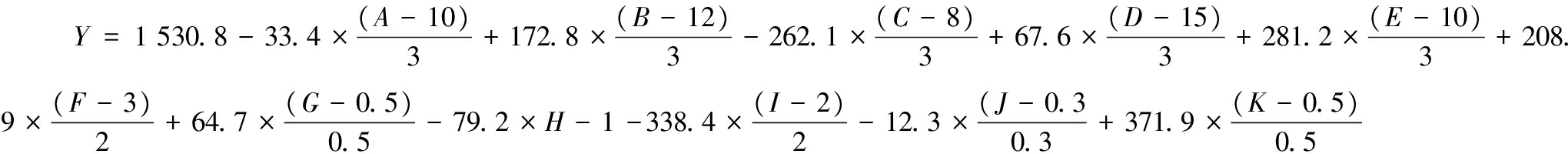
该模型的R2=0.997,一般认为,R2至少应该为0.80[19],说明实测值和预测值之间的相关性很好。在表1高低水平之间,将Y最大化,得到最优培养基(g/L):甘油7,蛋白胨15,酵母粉5,Na2HPO4·12H2O 18,K2HPO4·3H2O 13,KH2PO4 5,NaCl 1,MgSO4 1。
2.4 最优发酵培养基验证
将上述优化培养基与表1中的4号、11号培养基和初始培养基进行对比实验[20],结果显示最优培养基酶活达到3 552.99 IU,是优化前的2.23倍(图4)。
表2 回归参数及效应检验
Table 2 Regression parameter and effect test
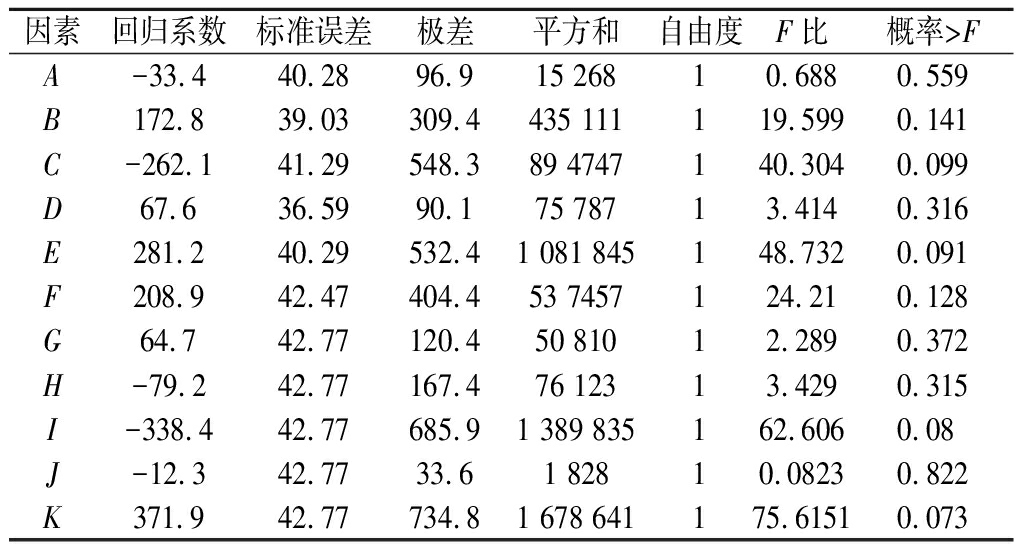
因素回归系数标准误差极差平方和自由度F比概率>FA-33.440.2896.915 26810.6880.559B172.839.03309.4435 111119.5990.141C-262.141.29548.389 4747140.3040.099D67.636.5990.175 78713.4140.316E281.240.29532.41 081 845148.7320.091F208.942.47404.453 7457124.210.128G64.742.77120.450 81012.2890.372H-79.242.77167.476 12313.4290.315I-338.442.77685.91 389 835162.6060.08J-12.342.7733.61 82810.08230.822K371.942.77734.81 678 641175.61510.073

图4 不同培养基的酶活水平
Fig.4 The enzyme activity of different medium
2.5 PLP浓度对转化产物的影响
选取了6个梯度对辅酶PLP的用量进行优化(见图5)。经过试验将PLP的用量由原来的8 g/L减少至1 g/L,仍可以达到相同的转化效果。当PLP的质量浓度降至1g/L以下时胍基丁胺的浓度明显降低,即辅酶质量浓度为1 g/L时ADC与PLP的结合位点已经饱和,无需再增加辅酶用量。
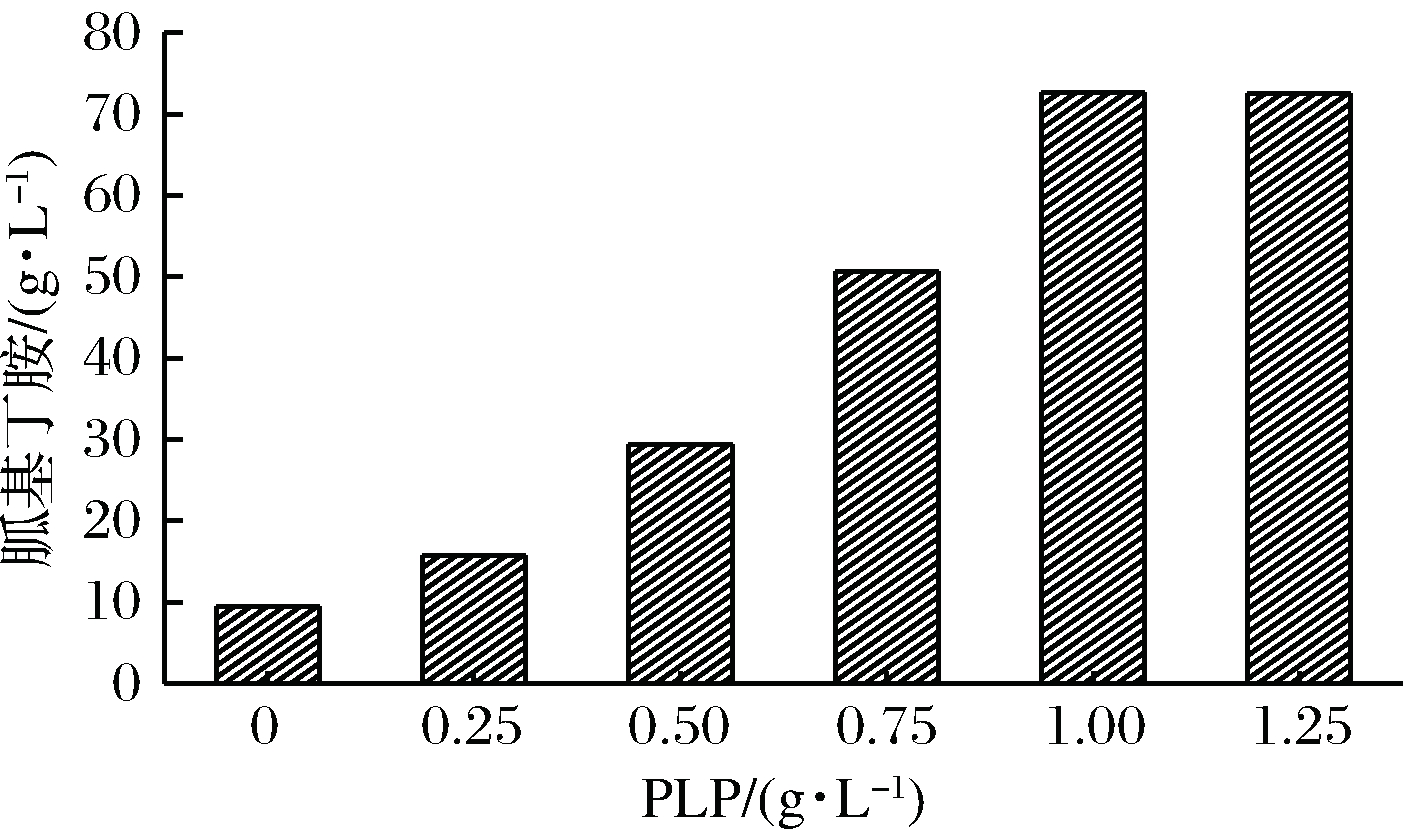
图5 PLP浓度对转化液中胍基丁胺产量的影响
Fig.5 The effect of PLP on the amount of
agmatine in conversion liguid
2.6 重组菌发酵与胍基丁胺转化放大实验
发酵过程中随着碳源的消耗会产生大量的CO2及有机酸,这时发酵液的pH值会降低,从而带动了氮源的补入及消耗,维持了菌体生长及目的蛋白表达所需的碳氮比。由图6可知,发酵过程中随着菌体的生长,溶氧逐渐降低,当溶氧降低至20%以下时,体系pH急速下降,重组蛋白表达停止,这是由于菌体产生的大量乙酸产生抑制作用造成[21]。当溶氧稳定在20%的水平时,抑制作用解除,菌体恢复正常。当菌体干重达到5.68 g/L时,将37 ℃培养温度降为30 ℃诱导温度,并加入终浓度为0.5 mmol/L的IPTG进行诱导。
由图6可知,发酵时间5~8 h,μ(比生长速率)开始回升,vX(生长速率)达到整个发酵周期的最大值,表明此时处于对数生长期。至24 h发酵结束时,DCW为33.44 g/L,菌体的vX维持在1 g/(L·h)左右,表明该重组菌具有高密度培养的潜力。
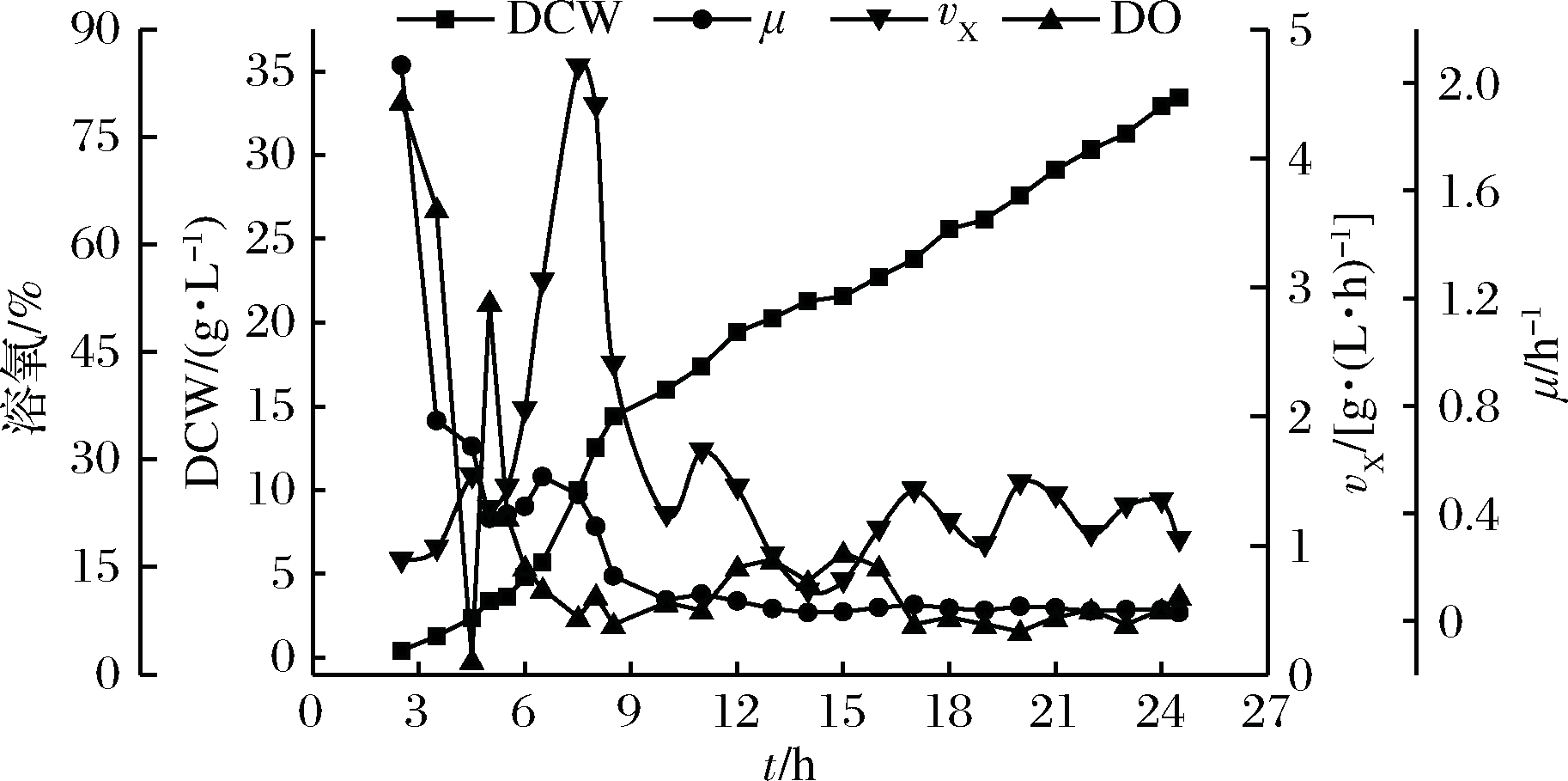
图6 发酵过程菌体生长曲线
Fig.6 The curve of bacterial growth during fermentation
经检测最终转化液中胍基丁胺的浓度为279.21 g/L,精氨酸转化率98%(胍基丁胺HPLC检测图谱见图7)。为下一步浓缩结晶工艺奠定了基础。

图7 胍基丁胺HPLC检测图谱
Fig.7 The detection chromatogram of agmatine
3 结论
本研究以重组E.coli发酵表达ADC,经过实验,确定了该酶在30 ℃诱导培养优于在其他温度条件下诱导培养表达效果,该酶的最适pH在弱酸性范围内。通过实验设计确定了最优的发酵培养基组成,优化后的发酵培养基ADC活性是优化前的2.23倍。PLP价格较贵,经优化后用量减少数倍,可使生产成本明显降低。发酵与转化放大实验结果表明,最终胍基丁胺质量浓度为279.21 g/L,转化率达到了98%,相较资料报道达到了较高水平。该研究结果对于酶法制备胍基丁胺的产业化具有重要指导作用。
[1] LI G,REGUNATHAN S,BARROW C J,et al.Agmatine:An endogenous clonidine displacing substance in the brain[J].Science, 1994,263(5 149):966-969.
[2] FREITAS A E.Agmatine,a potential novel therapeutic strategy for depression[J].European Neuropsychopharmacology,2016,26(12):1 885-1 899.
[3] RAASCH W,REGUNATHAN S,LI G,et al.Agmatine,the bacterial amine,is widely distributed in mammalian tissues[J].Life Sciences, 1995,56(26):2 319-2 330.
[4] FAIRBANKS C A, SCHREIBER K L,BREWER K L,et al.Agmatine reverses pain induced by inflamma- tion,neuropathy,and spinal cord injury[J].PNAS,2000,97(19):10 584-10 589.
[5] DUDKOWSKA M,LAI J,GARDINI G,et al.Agmatine modulates the in vivo biosynthesis and interconversion of polyamines and cell proliferation[J].Biochimica et Biophysica Acta(BBA)-General Subjects,2003,1 619(2):159-166.
[6] ARICIOGLU-KARTAL F, REGUNATHAN S.Effect of chronic morphine treatment on the biosynthesis of agmatine in rat brain and other tissues[J].Life Sciences,2002,71(14):1 695-1 701.
[7] ARTENI N S, LAVINSKY D.Agmatine facilitates memory of an inhibitory avoidance task in adult rats[J].Neurobiology of Learning and Memory,2002,78:465-469.
[8] REGUNATHAN S,FEINSTEIN D L, REIS D J.Anti-proliferative and anti-inflammatory actions of imidazoline agents: Are imidazoline receptors involved[J].Annals of the New York Academy of Sciences,1999,881(1):410-419.
[9] GARDINI G, CRAVANZOLA C,AUTELLI R,et al.Agmatine inhibits the proliferation of rat hepatoma cells by modulation of polyamine metabolism[J].Journal of Hepatology,2003,39(5):793-799.
[10] AKASAKA N, KATO S, KATO S,et al.Agmatine production by Aspergillus oryzae is elevated by low pH during solid-state cultivation[J].Applied and Environmental Microbiology,2018,84(15):e00 722-18.
[11] ZHANG Weiguo, ZHAO Genhai, LIU Junzhong,et al.Enzymatic synthesis of agmatine by immobilized Escherichia coli cells with arginine decarboxylase activity[J].Chemical Research in Chinese Universities,2011,27(6):992-995.
[12] SUN A, SONG W, QIAO W H,et al. Efficient agmatine production using an arginine decarboxylase with substrate-specific activity[J].Journal of Chemical Technology & Biotechnology,2017,92(9):2 383-2 391.
[13] 张言慧,李晓雪,张悦,王永红.利用响应面方法优化产L-乳酸的合成培养基[J].中国酿造, 2012, 31(5):15-20.
[14] SUN Xia, SONG Wei, LIU Liming. Enzymatic production of agmatine by recombinant arginine decarboxylase[J]. Journal of Molecular catalysis B:Enzymatic, 2015,121(12):1-8.
[15] 王鹏.氨基酸脱羧酶重组表达及应用研究[D].南京:南京大学,2015.
[16] XU D Q, ZHANG L R.Increasing agmatine production in Escherichia coli through metabolic engineering[J]. Journal of Agriculture and Food Chemistry,2019,67(28):7 908-7 915.
[17] 郭文文,陈献忠,沈微,等.重组毕赤酵母产果糖基转移酶发酵条件的优化[J].食品与发酵工业,2016,42(10):39-43.
[18] 张悦,王泽建,王永红,等.拟干酪乳杆菌发酵L-乳酸合成培养基的优化[J].生物加工过程,2011,9(5):32-37.
[19] NOR N M, MOHAMAD R, FOO H L,et al.Improvement of folate biosynthesis by lactic acid bacteria using response surface methodology[J].Food Technol and Biotech,2010,48(2):243-250.
[20] DEESUTH O, LAOPAIBOON P,JAISIL P,et al.Optimization of nitrogen and metal ions supplementation for very high gravity bioethanol fermentation from sweet sorghum juice using an orthogonal array design[J].Energies,2012,5(9):3 178-3 197.
[21] FARMER W R, LIAO J C.Reduction of aerobic acetate production by Escherichia coli[J].Applied and Environmental Microbiology,1997,63(8):3 205-3 210.