辣椒(Capsicum annuum L),原产于拉丁美洲和北美而后传入我国[1]。辣椒营养价值高,富含VC。辣椒的主要种植地主要集中在陕西、河北、河南等地区,但在我国南方吃辣椒的人较多,以著名的食辣大省湖南为例,湖南的辣椒产量约占全国5%,而消费量已经达到全国总量的10%[2]。剁辣椒是湖南发酵辣椒中一种颇具特色的传统食品和调味品,是发酵辣椒制品的典型代表[3],其特点是发酵菌种丰富,充分利用了微生物资源,产品风味柔和、酱香味浓。但传统发酵辣椒发酵时间较长,发酵质量不稳定,存在亚硝酸盐超标的安全隐患[4]。通过选育优良菌种,利用人工接种发酵可以有效的改善这一状况,在保持传统发酵辣椒良好风味的同时控制发酵,防止其他杂菌的生长[5]。
传统的发酵辣椒是将新鲜辣椒剁碎后加之一定量的食盐搅拌均匀后,装入杀菌处理后的泡菜坛封口发酵而成。辣椒表面附着的微生物利用其生成的代谢产物以及形成的低氧环境成为发酵过程中的优势菌。同时乳酸菌发酵产生的醇、醛、酮和有机酸等物质,赋予了发酵辣椒中特殊的乳酸发酵香味[2-5]。发酵辣椒中担当主要任务的微生物为乳酸菌,以辣椒本身带有的乳酸菌在密闭的泡菜坛中快速繁殖发酵产生香味[6]。作者团队利用高通量测序及宏转录组技术发现发酵辣椒中优势乳酸菌Lactobacillus plantarum、Weissella paramesenteroides和Lactococcus lactis是线椒自然发酵过程中的3种关键微生物[7]。产香微生物的选育研究在其他发酵产品中较多[8-10],产香酵母在酿酒香味的研究一直都是产香微生物的研究热点[11-15],但关于发酵辣椒中产香微生物的研究鲜有报道。
本研究主要是从湖南传统发酵辣椒中筛选出产香优异的乳酸菌,进行鉴定。研究菌种产香能力、耐酸、耐盐、产酸等生理生化特性,为后期深入研究菌种产香机理和制备发酵性能优异的发酵剂做准备。
1 材料与方法
1.1 材料与试剂
实验室自制发酵辣椒,市售发酵辣椒,农家发酵辣椒。
MRS肉汤培养基,MC培养基,广东环凯微生物科技有限公司;乙偶姻标准品,上海恒斐生物科技有限公司;细菌DNA提取试剂盒,TaKaRa公司;PCR引物,派森诺生物公司;API 50CH,法国生物梅里埃;其他均为国产分析纯和化学纯。
1.2 仪器与设备
奥林巴斯显微镜(CX31RBSFA),奥林巴斯有限公司;紫外/可见光分光光度计(UV-1801),北京北分瑞利分析仪器有限责任公司;Haier超净工作台(HCB-1300V),青岛海尔生物医疗股份有限公司;高速冷冻离心机,奥斯特罗德分公司。
1.3 方法
1.3.1 样品采集
从湖南各地区采集特色发酵辣椒,将样品用100 mL已杀菌处理的离心管密封带回实验室4 ℃冰箱保存等待菌种分离并记录采样时间、地点、温度及样品来源。
1.3.2 乳酸菌的分离与纯化
将采集回的样品取适量用0.9%生理盐水做10倍梯度稀释,均匀涂布MRS平板上,培养箱中37 ℃培养48 h。根据各菌落的形态、颜色和湿润程度等菌落特征判断出不同的菌落,用接种针挑取外部特征不同的菌落到MRS液体培养基中培养24 h,接种环蘸取菌液于MC固体培养基上画线培养24 h,挑取有溶钙圈的菌落再次MRS液体培养基中培养,为革兰氏染色生理生化试验做准备[16]。
1.3.3 产香乳酸菌的筛选
将分离纯化保藏的菌株取出活化培养3代后,人工接种到减菌处理[17]后的辣椒汁中发酵7 d,每份样品选取5位具有感官鉴评经验的人员打分,鉴评标准参照表1。同时参考JI等[18]和高文睿等[19]用肌酸比色法测定发酵液中乙偶姻的含量,综合两者筛选出产香优异的乳酸菌。
表1 剁椒感官质量评定标准[20]
Table 1 Sensory evaluation criteria of chopped hot pepper
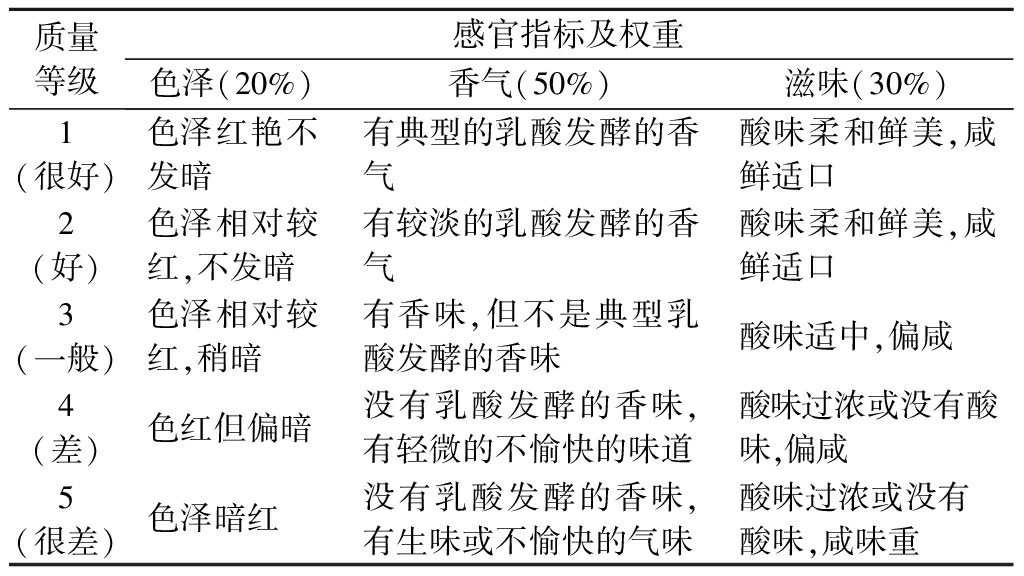
质量等级感官指标及权重色泽(20%)香气(50%)滋味(30%)1(很好)色泽红艳不发暗有典型的乳酸发酵的香气酸味柔和鲜美,咸鲜适口2(好)色泽相对较红,不发暗有较淡的乳酸发酵的香气酸味柔和鲜美,咸鲜适口3(一般)色泽相对较红,稍暗有香味,但不是典型乳酸发酵的香味酸味适中,偏咸4(差)色红但偏暗没有乳酸发酵的香味,有轻微的不愉快的味道酸味过浓或没有酸味,偏咸5(很差)色泽暗红没有乳酸发酵的香味,有生味或不愉快的气味酸味过浓或没有酸味,咸味重
1.3.4 乳酸菌的鉴定
将1.3.3筛选出的菌株进行形态学观察,接触酶试验、吲哚试验、硫化氢试验以及16S rDNA测序,用NCBI Blast程序将拼接后的序列文件与NCBI 16S数据库中的数据进行比对,得到与待测物种序列相似性最大的物种信息,即为鉴定结果[21]。将测序得到的基因序列利用MEGA 5.05对所有序列进行系统发育树的构建,测序由上海桑尼生物科技有限公司提供。
1.3.5 乳酸菌生理生化试验
1.3.5.1 API试纸条试验
按照API试纸条使用手册将活化后菌株接种到试纸中,无菌液体石蜡封口,37 ℃培养24 h后记录结果于梅里埃官网系统比对结果[5]。
1.3.5.2 菌株生长曲线及产酸试验
将活化好的菌株调节菌悬液浓度调节为0.5的麦氏比浊管,接种1%到MRS液体培养基中,以空白培养基作为空白,每2 h测定OD600值,同时测定发酵液pH,每份样品做3份平行,测定3次。
1.3.5.3 菌株耐酸试验
将活化好菌株接种按照1.3.5.2接种方法接种到pH为2.0、2.5、3.0、3.5、4.0的液体培养基中,以未接种培养基作为空白,每隔12 h测定OD600值,每组做3次平行。
1.3.5.4 菌株耐盐试验
菌种活化好后,接种1%到分别含有60、80、100、120 g/L NaCl的MRS液体培养基中培养24 h,每隔12 h以未接种培养基作为空白测定OD600值,每组做3次平行。
1.3.5.5 菌株耐胆盐试验
菌种活化好后,接种1%到分别含有3、5、7、10 g/L牛胆盐的MRS液体培养基中培养24 h,以未接种培养基作为空白,每隔12 h测定OD600值,每组做3次平行。
2 结果与分析
2.1 产香乳酸菌筛选结果
乙偶姻是发酵辣椒中一种重要的羰基化合物香味物质[4],研究也表明乙偶姻与双乙酰、乙醛、丙酮酸、丁二酮等风味物质转化有关,因此这一指标的测定也在一定程度上反映了其他风味物质的代谢与积累[22-23]。在碱性条件下3-羟基丁酮与含胍基的化合物反应生成红色化合物,甲萘酚的存在可以促进并加速红色物质生成,该化合物在500~600 nm有光吸收,其吸光度在一定浓度范围内与3-羟基丁酮浓度成正比[23]。从86份发酵辣椒样品中分离纯化,经革兰氏染色阳性,接触酶阴性且有溶钙圈,初步鉴定为乳酸菌菌株486株,用于后续筛选试验。将486株菌种进行初步感官鉴评试验,筛除感官评定较差,产异味、不生长发酵菌株,选取乙偶姻产量最高25株菌,其乙偶姻测定结果见图1。
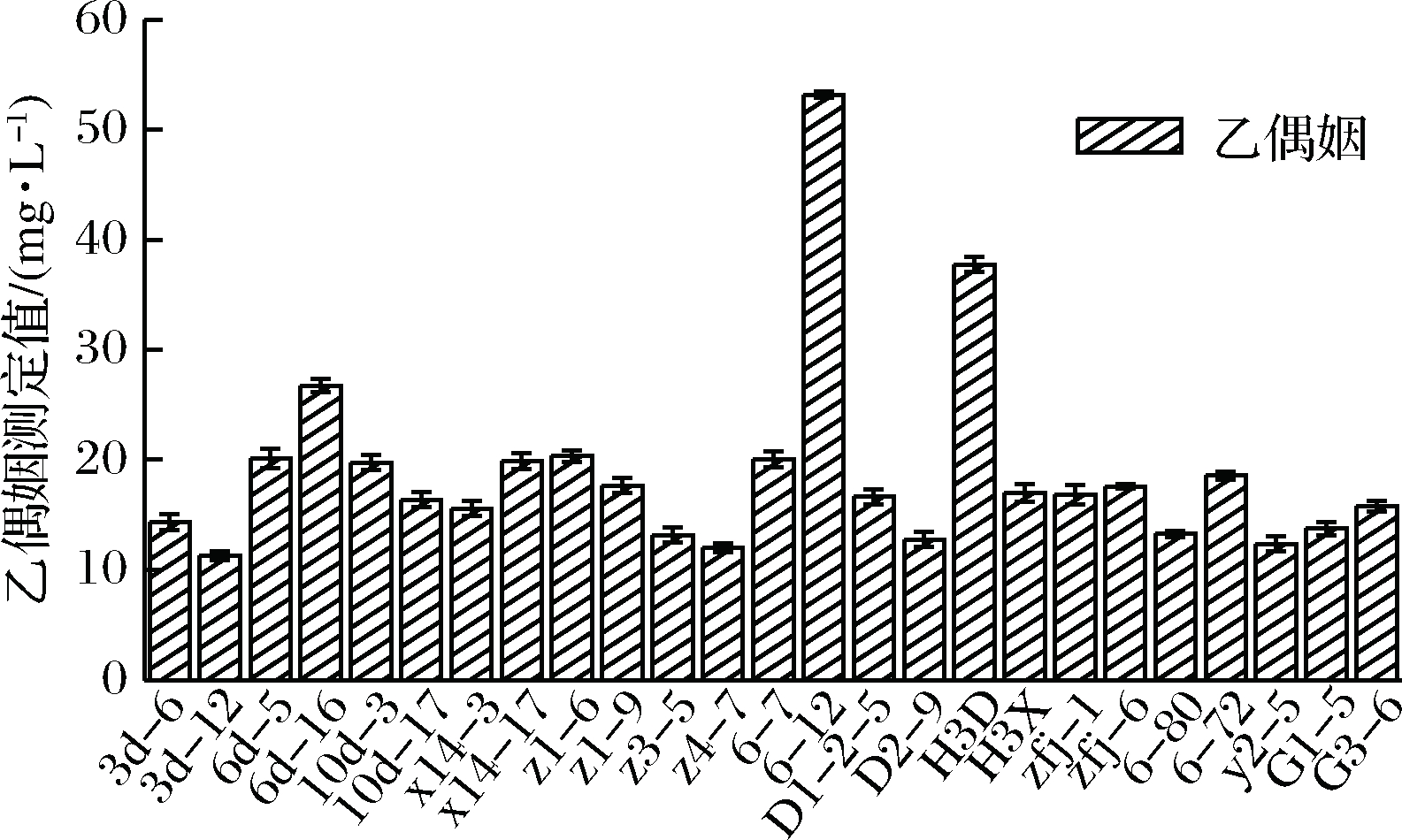
图1 25株菌种乙偶姻测定值
Fig.1 25 strains of acetoin measured value
将分离纯化的菌株按照1.3.3方法筛选,选出了综合产香优异,编号为H3D、6d-16、6-12,其感官评分及乙偶姻测定值结果见图2。3株菌株人工接种发酵辣椒感官评分均在93分以上,其24 h发酵液中乙偶姻浓度分别为37.737、53.160、26.716 mg/L。ZHAO等[24]在西藏灵菇中筛选出4株产香乳酸菌乙偶姻产量最高为43.72 mg/L,田怀香等[8]筛选1株产香乳酸菌,其乙偶姻产量为38.92 mg/L,杨铭等[25]通过全基因组测序发现6个与乙偶姻有关基因,其菌株产乙偶姻为8.92 μg/mL。H3D、6d-16、6-12 三株菌乙偶姻产量最高为53.160 mg/L较之同类乳酸菌乙偶姻产量更高,具备高产香能力可用于后续实验。

图2 单菌株发酵感官评分及乙偶姻测定值
Fig.2 Single strain fermentation sensory score and acetoin value
2.2 菌株的鉴定
2.2.1 菌种形态检测
将2.1中筛选的菌株,进行革兰氏染色显微镜观察菌种形态,其形态学特征见图3。由图3可见,3株菌种菌落形态皆为圆形光滑,凸起,边缘整齐不透明。革兰氏染色皆为阳性,1 000倍镜头下,6-12菌种菌体形态为球状,H3D与6d-16菌体形态为成对杆状。
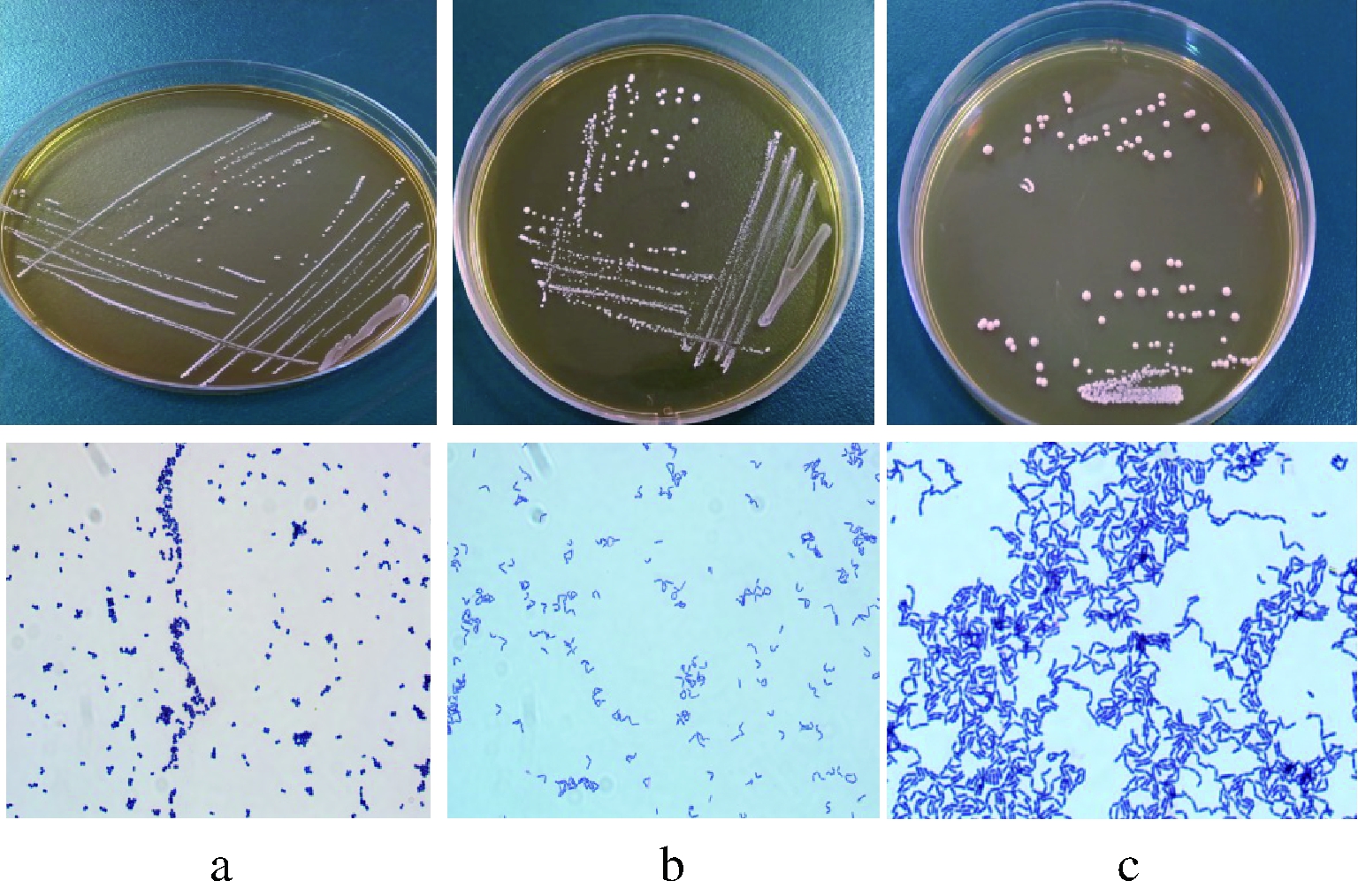
a- 6-12;b- H3D;c-6d-16
图3 菌株菌落及菌体形态
Fig.3 Strains of colonies and cell morphology
2.2.2 16S rDNA测序结果
测序完成后将测序结果,用NCBI Blast程序将拼接后的序列文件与NCBI 16S数据库中的数据进行比对。6-12与Pediococcus pentosaceus的同源性为99%初步鉴定为戊糖片球菌,H3D与Lactobacillus plantarum同源性为99%初步鉴定为植物乳杆菌,6d-16与Lactobacillus pentosus同源性为100%初步鉴定为戊糖乳杆菌。将测序得到的基因序列利用MEGA 5.05对所有序列进行系统发育树的构建,系统发育树见图4。

图4 菌株系统发育树
Fig.4 Strain phylogenetic tree
2.2.3 API试纸条试验结果
由于H3D植物乳杆菌与6d-16戊糖乳杆菌两者亲缘关系较近,利用API试纸条可以通过碳源发酵产酸将其进一步区分。API试纸条结果见表2,在法国梅里埃公司官网利用API LABPlus自动判读系统对其进行鉴定,鉴定结果为:H3D为植物乳杆菌(Lactobacillus plantarum),6d-16为戊糖乳杆菌(Lactobacillus pentosus)。
2.3 菌株生长曲线及产酸试验结果
活化后的菌株按1.3.5.2培养后,其生长曲线及产酸测定结果见图5。由图可见,3株菌均在2~4 h后进入生长对数期,12 h后进入平稳期,H3D与6d-16生长曲线几乎同步,较强于6-12。37℃培养24 h,菌种H3D OD600达到2.16 9,菌种6d-16 OD600达到2.175,菌种6-12 OD600为2.050。同时也可看出菌株产酸与生长同步,在4~12 h时pH快速下降。37 ℃培养24 h,H3D最终pH为3.44,6d-16 pH为3.63,6-12 pH为4.0。生长产酸速度对菌株今后作为辣椒发酵人工接种菌株也较为重要,3株菌在2 h后便开始进入生长对数期,同时开始大量产酸,奠定了初期发酵辣椒中优势地位,抑制其他杂菌的生长,保证了发酵辣椒的质量。
表2 API试纸条试验结果
Table 2 API test strip test results

试验名称菌种编号H3D6d-16甘露醇-+赤藻糖醇--D-阿拉伯糖--L-阿拉伯糖++D-核糖++D-木糖-+L-木糖--D-侧金盏花醇l--甲基-β-D-吡喃木糖苷--D-半乳糖++D-葡萄糖++D-果糖++D-甘露糖++D-山梨糖--L-鼠李糖-+卫矛醇--肌醇--甘露醇++山梨醇++甲基-α-D-吡喃甘露糖苷+-甲基-α-D-吡喃葡萄糖苷-+N-乙酰葡萄糖苷++苦杏仁苷++ARBULIN+-七叶灵柠檬酸铁++水杨苷++D-纤维二糖++D-麦芽糖++D-乳糖++D-密二糖+-D-蔗糖++D-海藻糖++菊粉--D-松三糖+-D-棉子糖--淀粉--糖原--木糖醇--D-龙胆二糖++D-土伦糖+-D-来苏糖--D-塔格糖--D-岩藻糖--L-岩藻糖--D-阿拉伯醇--L-阿拉伯醇--葡萄糖酸钾--2-酮基葡萄糖酸钾--5-酮基葡萄糖酸钾--
注:“+”表阳性;“-”表阴性。
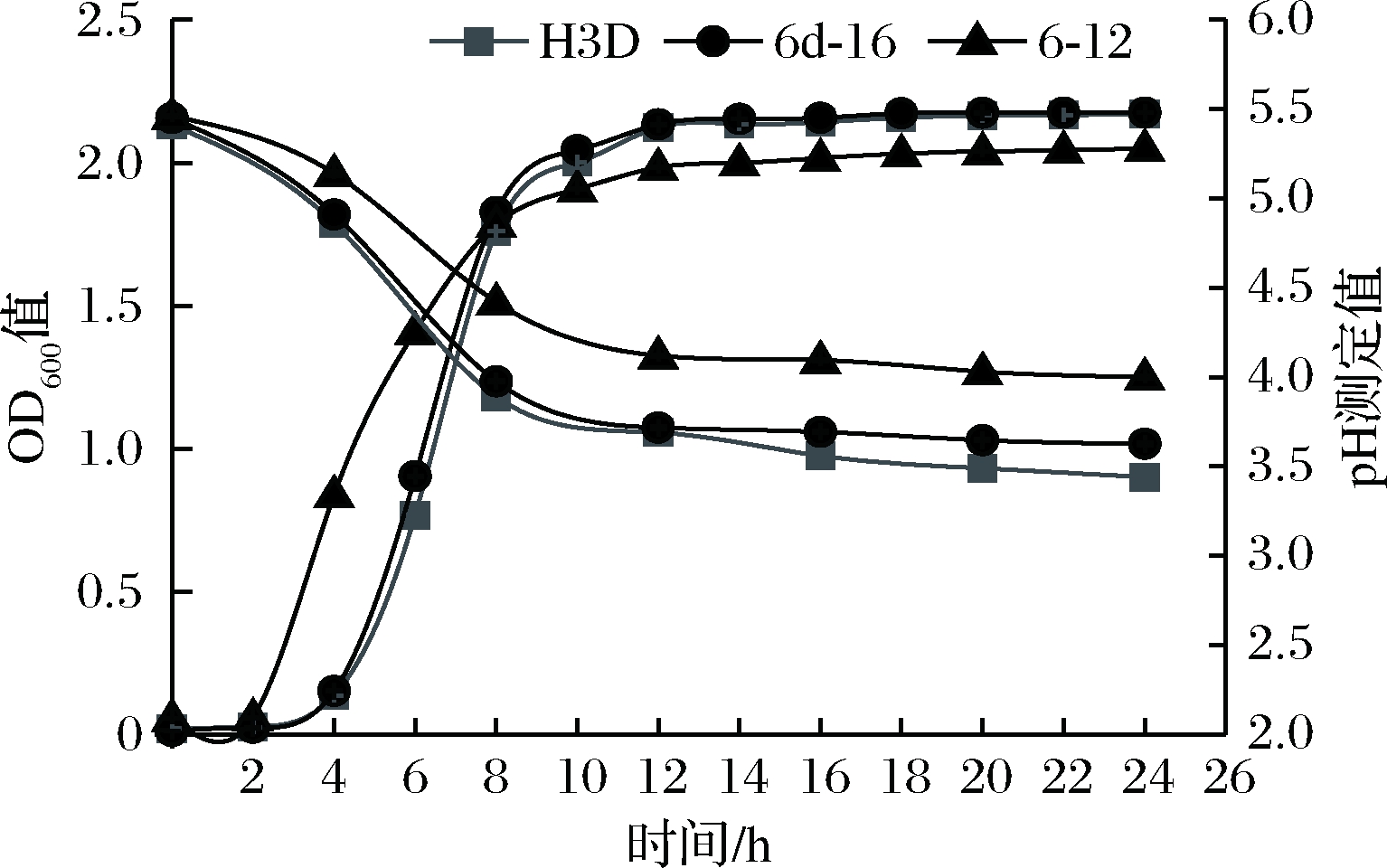
图5 菌株生长曲线及pH测定
Fig.5 Strain growth curve and pH determination
2.4 菌株生理生化试验结果
生理生化试验中,3株菌株在过氧化氢试验、吲哚试验、硫化氢试验、明胶液化试验中结果均为阴性,符合乳酸菌的生理生化特征。
表3 菌种生理生化试验
Table 1 Physiological and biochemical test of strains
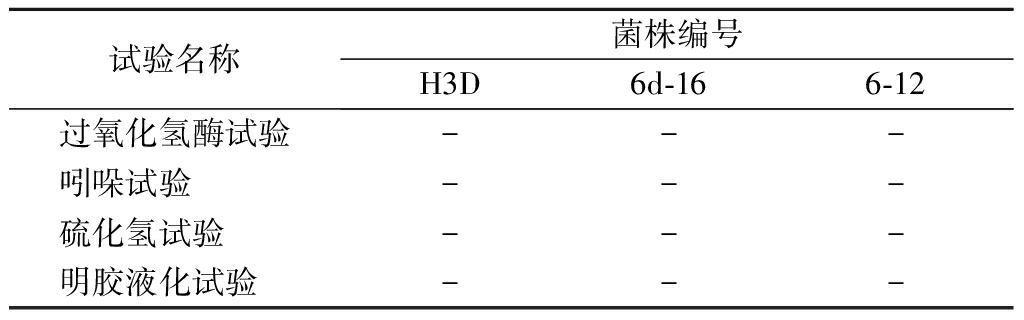
试验名称菌株编号H3D6d-166-12过氧化氢酶试验---吲哚试验 ---硫化氢试验 ---明胶液化试验 ---
注: “+”表阳性;“-”表阴性。
2.5 菌株对不同pH、盐浓度及胆盐浓度适应性
为了进一步了解菌株的特性,对3株菌种耐酸、耐盐、耐胆盐进行测定,为后期应用到发酵辣椒产品制备做准备。在耐酸试验中,由图6可见,H3D耐受较强,在pH 2.0时也具备一定耐受性,在pH 3.0中H3D和6d-16都能较好的生长繁殖,pH 3.5中基本对H3D与6d-16无影响,6-12在pH 3.5中具有一定耐受性。
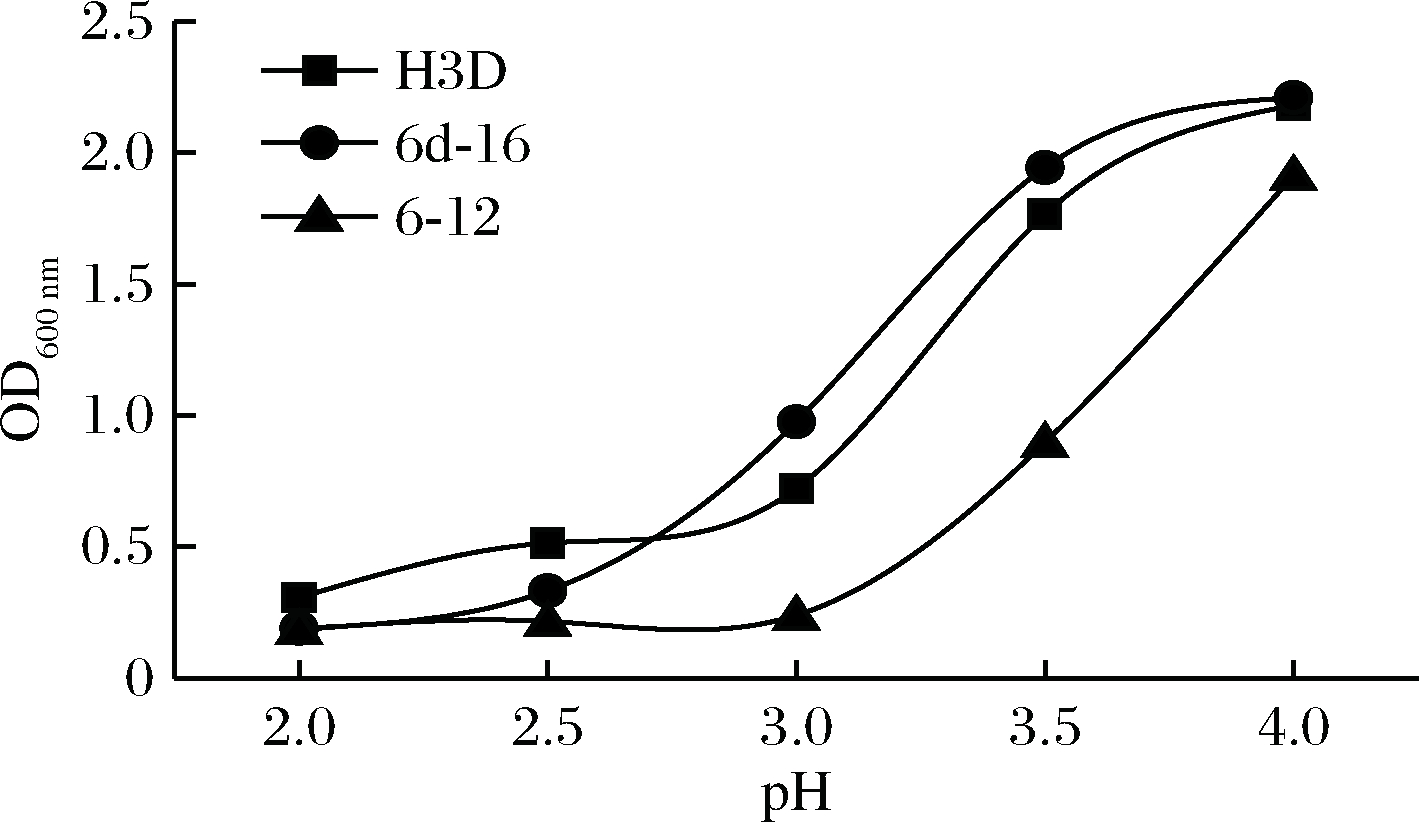
图6 不同pH值下菌株生长情况
Fig.6 The OD value of strain under different pH values
在耐盐试验中,如图7所示,60 g/L NaCl对3株菌株生长几乎无影响,菌株H3D与6d-16在120 g/L NaCl中具备一定耐受性,这对于后期作为人工接种发酵菌株可作为参考,一般发酵辣椒的制作含盐量在60~80 g/L[26]。
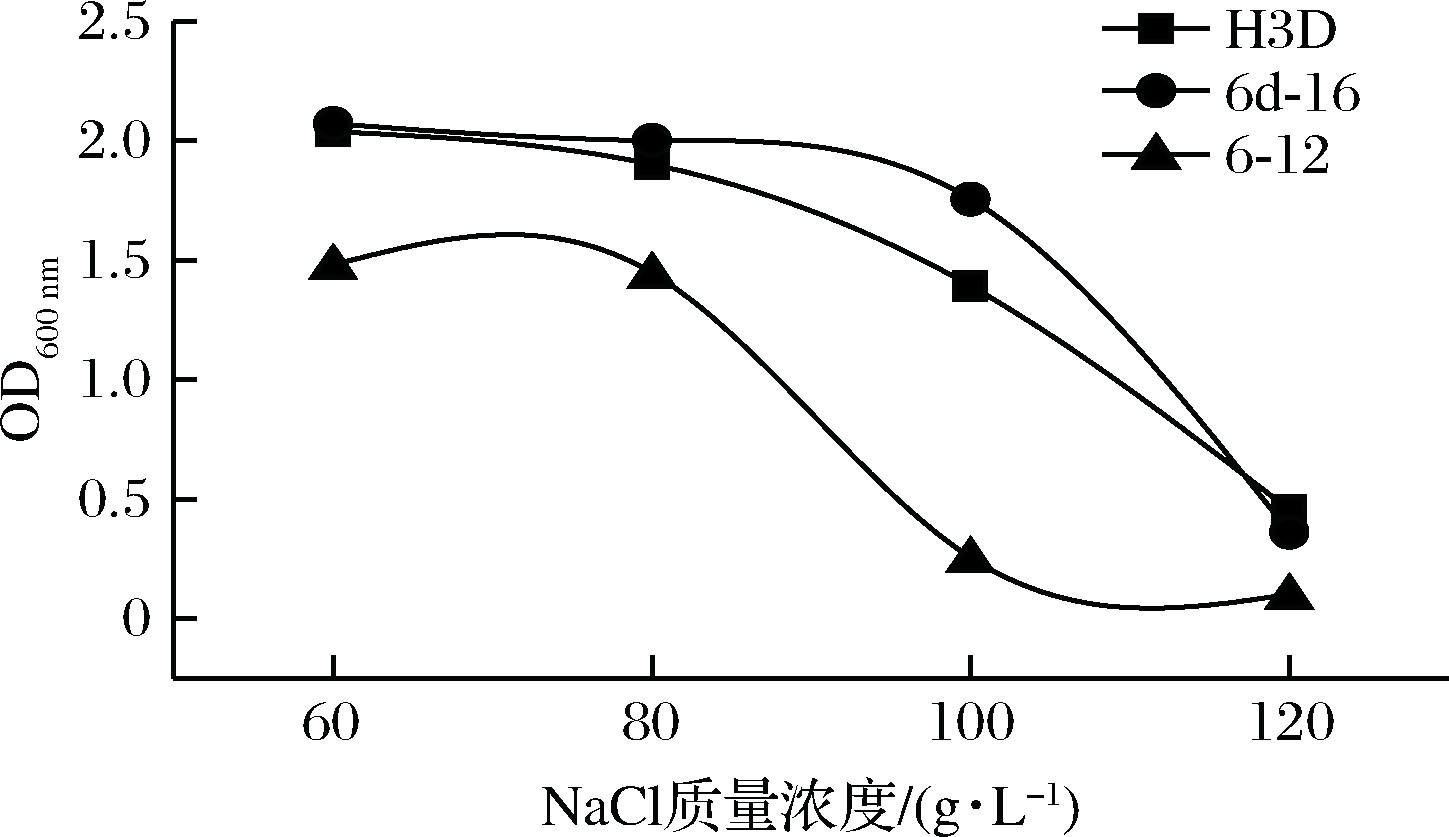
图7 不同盐浓度下菌株生长情况
Fig.7 The OD value of strains under different
salt concentrations
胆盐耐受实验中,由图8可见3 g/L的胆盐对3株菌对其生长影响不大,菌株H3D与6d-16在5 g/L的胆盐中也具备一定耐受性,这一特性有利于菌株作为益生菌作用,保证了其在小肠胆盐浓度下还可以存活,人体小肠胆盐浓度在0.003 ~0.03 g/L[27]。3株菌种对酸、NaCl、胆盐均具备一定的耐受性,其中H3D与6d-16表现较为优异,这也保证了将来应用到发酵辣椒中的存活率。
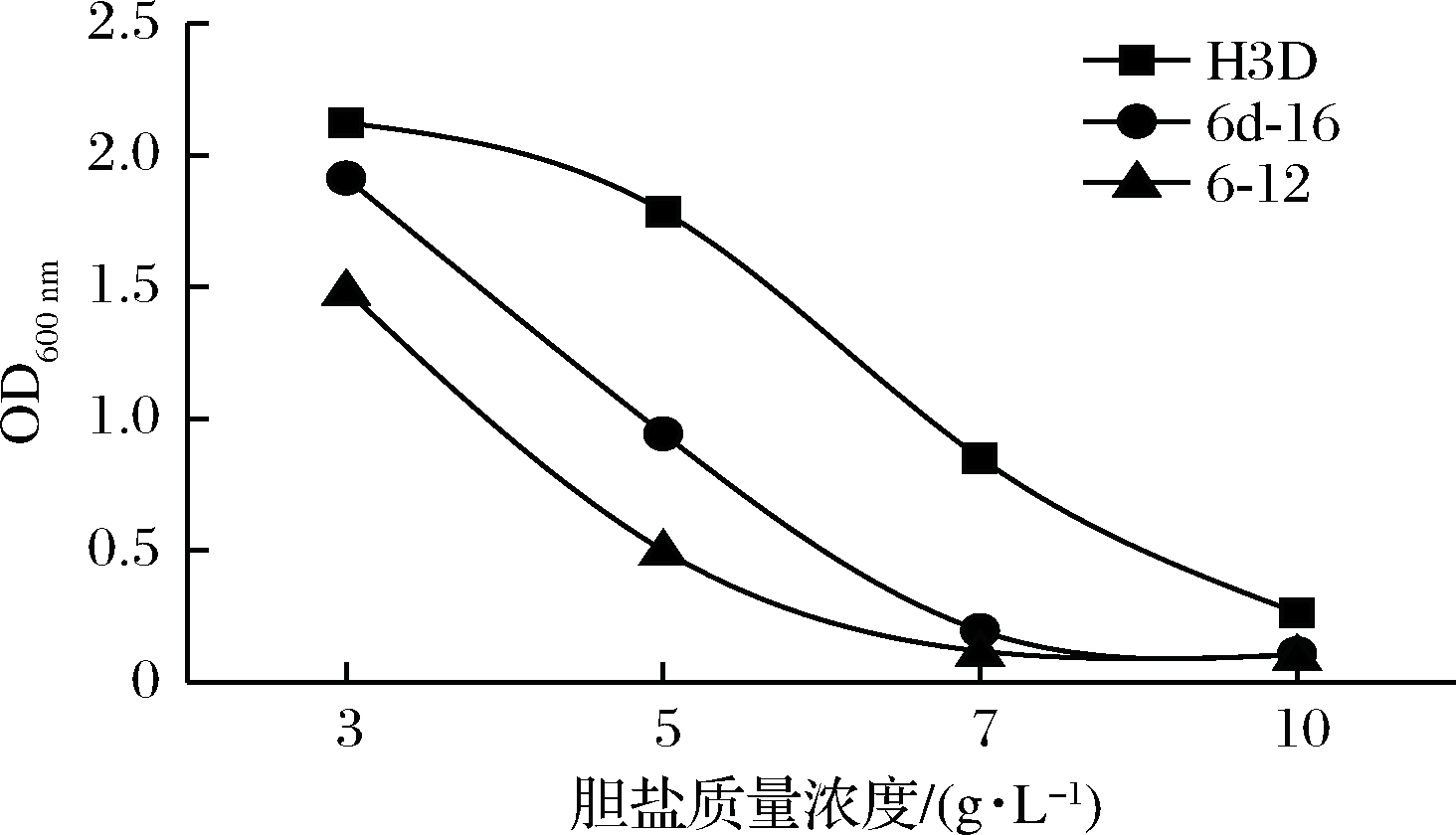
图8 不同胆盐浓度下菌株生长情况
Fig.8 The OD value of strains under different bile
salt concentrations
3 结论
本研究从86份传统发酵辣椒中分离纯化得到486株乳酸菌,以接种发酵辣椒感官评分值与发酵液中乙偶姻测定值为筛选指标,筛选出了3株产香优异的乳酸菌,编号为H3D、6d-16、6-12。其感官评分均在93分以上,3株菌种24 h发酵液乙偶姻测定值分别为37.737、53.160、26.716 mg/L。
根据3株菌种的菌落、菌体形态,16S rDNA鉴定,H3D为植物乳杆菌,6d-16为戊糖乳杆菌,6-12为戊糖片球菌。由于H3D植物乳杆菌,6d-16戊糖乳杆菌,两者亲缘关系较近,进一步利用API试纸对其进行碳源产酸试验,最终确定H3D为植物乳杆菌,6d-16为戊糖乳杆菌。3株菌株生长繁殖、产酸速度快,在耐酸、耐盐、耐胆盐试验中均有一定的耐受性,具备良好的生理生化特性适合作为发酵剂制备菌株。
现在大多数工厂为延长辣椒原料贮藏期,常采用盐胚脱盐发酵法,其加工工艺简单且成本低廉,但风味、滋味和营养物质在较长的贮存期和水洗脱盐过程中损失严重[28]。人工接种发酵可以很好控制产品质量,从而保证发酵风味,以期最大程度达到传统发酵辣椒的良好风味。3株菌种来源于传统发酵辣椒,具备优异产香特质,作为制作发酵辣椒发酵剂的制备具有发展前景,同时对于后期深入研究菌株产香机理也奠定了研究基础。
[1] 张婷,刘慧琴,章心惠,等.辣椒果实主要营养成分及测定方法评价[J].浙江农业科学,2016,57(9):1 506-1 517.
[2] 陈耿,彭荣锋,伍泰旭.我国辣椒品种市场需求变化趋势及育种对策[J].农业与技术,2019,39(3):50-51.
[3] 罗凤莲,夏延斌,夏晓凤,等.剁辣椒发酵过程中滋味物质的变化[J].食品科学,2013,34(3):21-24.
[4] 叶陵,李勇,周辉,等.我国传统发酵蔬菜中乳酸菌多样性的研究进展[J].食品科学,2018,39(15):296-301.
[5] 翟磊,谢九艳,姚粟,等.菌株CICC 6294生物学特性及其在辣椒发酵中的应用[J].食品与发酵工业,2018,44(7):116-121.
[6] XIONG T, SONG S, HUANG X, et al. Screening and identification of functional Lactobacillus specific for vegetable fermentation[J]. Journal of Food Science, 2013, 78(1):M84-M89.
[7] 赵玲艳. 自然发酵辣椒微生物多样性及其宏转录组研究[D].长沙:湖南农业大学,2017.
[8] 田怀香,史雨桦,张燕,等.西藏灵菇中高产双乙酰乳酸菌分离筛选及产香特性研究[J].食品与发酵工业,2019,45(4):42-47.
[9] YAN Shoubao, CHEN Xiangsong,XIANG Xingben. Improvement of the aroma of lily rice wine by using aroma-producing yeast strain Wickerhamomyces anomalus HN006[J]. AMB Express,2019,9(1):M82-M89.
[10] 富志磊,范光森,马超,等.老白干酒曲中一株高产β-苯乙醇酵母菌的分离、鉴定及其产香特性研究[J].中国食品学报,2019,19(1):207-215.
[11] 姚博,贠建民,艾对元,等.浆水中产香酵母菌菌株的筛选及其增殖培养基优化[J].食品科学,2018,39(6):107-115.
[12] 王伟,俞志敏,侯英敏,等.产香酵母Pichia myanmarensis LX15的分离纯化及对精酿啤酒风味物质形成的影响[J].微生物学杂志,2018,38(4):34-40.
[13] 罗小叶,邱树毅,陆安谋,等.酱香大曲产香酵母的分离及鉴定[J].食品与发酵工业,2016,42(12):26-31.
[14] 李宇辉,郭安民,刘成江,等.伊犁牧区传统发酵乳制品中产香酵母菌的分离及香气成分分析[J].食品与发酵工业,2016,42(11):179-184.
[15] 剧柠,赵梅梅,柯媛,等.枸杞果酒用非酿酒酵母的分离筛选及香气成分分析[J].食品与发酵工业,2017,43(11):125-131.
[16] 凌代文.乳酸细菌分类鉴定及实验方法[J].微生物学通报,1999(1):23-24.
[17] 母应春,曾海英,谭书明,等.辣椒不同减菌化预处理效果对比研究[J].食品科学,2008,29(11):250-255.
[18] JI X J, HUANG H, LI S, et al. Enhanced 2,3-butanediol production by altering the mixed acid fermentation pathway in Klebsiella oxytoca[J]. Biotechnology Letters, 2008, 30(4):731-734.
[19] 高文睿,贠建民.凉州熏醋中高产乙偶姻菌株的分离筛选及发酵特性初探[J].农业科技与信息,2015(16):26-29.
[20] 胡璇,夏延斌.基于模糊数学的剁椒感官综合评价方法[J].食品科学,2011,32(1):95-98.
[21] WEI G, PAN L, DU H, et al. ERIC-PCR fingerprinting-based community DNA hybridization to pinpoint genome-specific fragments as molecular markers to identify and track populations common to healthy human guts[J]. Journal of Microbiological Methods, 2004, 59(1):91-108.
[22] WESTERFELD W W. A colorimetic determination of blood acetoin [J]. Journal of Biological Chemistry, 1945, 161-164.
[23] CHENG Hefa. Volatile flavor compounds in yogurt: A review[J]. Critical Reviews in Food Science and Nutrition, 2010, 50(10):938-950.
[24] ZHAO L, LI Y, JIANG L, et al. Determination of fungal community diversity in fresh and traditional Chinese fermented pepper by pyrosequencing[J]. FEMS Microbiology Letters, 2016, 363(24):273-277.
[25] 杨铭,郝晓娜,罗天淇,等.功能基因分析辅助筛选产双乙酰和乙偶姻乳酸菌[J/OL].食品科学:1-11[2019-09-05].http://kns.cnki.net/kcms/detail/11.2206.TS.20190826.1610.027.html.
[26] HARTY D W S, PATRIKAKIS M, KNOX K W. Identification of Lactobacillus strains isolated from patients with infective endocardi tis and comparison of their surface-associated properties with those of other strains of the same species[J]. Microbial Ecology in Hralth and Disease, 1993, 6(4):191-201.
[27] 郭志华,张兴桃,段腾飞,等.泡菜中降解亚硝酸盐乳酸菌的筛选及生物学特性研究[J].食品与发酵工业,2019,45(17):66-72.
[28] 叶陵. 植物乳杆菌W-4的分离鉴定及其发酵剁辣椒研究[D].长沙:湖南农业大学,2017.