《中华人民共和国药典》对β-内酰胺酶定义为:能裂解青霉素和头孢菌素类抗生素的β-内酰胺环,使其灭活的水解酶称为β-内酰胺酶[1]。1929年β-内酰胺类抗生素——青霉素的发现被认为是医学史上的一个里程碑,它在20世纪40年代被广泛使用,彻底改变了人们治疗细菌感染的能力,但也极大地刺激了细菌产生β-内酰胺酶的能力[2]。随着核苷酸序列信息的增多,已鉴定的β-内酰胺酶的数量已接近指数增长,β-内酰胺酶数据库含有超过4 300种经过不同程度表征的酶[3-4]。
目前国内外对β-内酰胺酶的研究主要针对医学方面,即应用抗生素产生的耐药性,临床耐药菌株的分离、表型筛选及基因的分析,新型β-内酰胺酶抑制剂的研究等方面,在β-内酰胺酶的分离纯化、酶学特性、毒理学危害,产酶菌株发酵条件优化,以及β-内酰胺酶应用方面的研究报道还是很少[5-8]。β-内酰胺酶因其具有水解β-内酰胺类抗生素中β-内酰胺环的特点不仅应用在医疗器械、环境中抗生素的消除,前药的开发与抗体定向酶前药治疗领域,也可与生物传感器、ELISA检测等结合运用检测乳及乳制品中残留的抗生素[9-11]。在食品安全的检测中,抗生素残留是国内外极为重视的内容,特别是牛乳及乳制品,欧洲每个成员国都实施了国家监测和控制计划,以监测食品中的抗生素残留[12-13]。
本研究从上海临港地区分离、筛选产β-内酰胺酶的菌株,对其中1株酶活力较高的菌株运用分子生物学方法和生理生化试验鉴定其种属,并进一步研究酶学性质,以期为进一步工业化开发利用性状稳定且高产β-内酰胺酶的菌株提供借鉴,为工业生产β-内酰胺酶及其应用提供参考依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种来源
2018年8~10月于上海市第六人民医院东院(临港地区)采集样品,用无菌采样器采集水面下30~100 cm的水样品及3~10 cm深的土壤样品(三点采样法),样品采集后2 h内送回实验室处理分析。
1.1.2 试剂
青霉素G钠(USP级 1 603 u/mg),上海源叶生物科技有限公司;蛋白胨、酵母浸粉、PCR扩增试剂盒,生工生物工程(上海)股份有限公司;DNA提取试剂盒,天根生化科技(北京)有限公司;NaCl、K2HPO4·3H2O、MgSO4·7H2O及其他实验所用试剂均为国产分析纯,国药集团化学试剂有限公司。
1.1.3 培养基
分离纯化培养基(g/L):蛋白胨 10,牛肉粉 3,NaCl 5,琼脂 15,调pH 7.2~7.4。
种子培养基(g/L):蛋白胨 10,酵母浸粉 5,NaCl 5,调pH 7.0。
发酵培养基(g/L):葡萄糖 20,蛋白胨 5,酵母浸粉 10,NaCl 2,MgSO4·7H2O 0.5,K2HPO4·3H2O 4,调pH 7.5。
1.2 仪器与设备
AC2-S超净工作台,苏净集团安泰公司;GHP-9 270隔水式恒温培养箱、THZ-300恒温培养摇床,上海一恒科学仪器有限公司;HWT-20C恒温水浴箱,天津市恒奥科技发展有限公司;DGG-9 203AD型电热恒温鼓风干燥箱,上海森信实验仪器有限公司;pH730台式pH精密测试仪,德国WTW;TGL-16G高速台式离心机,上海安亭科学仪器厂;AL204精密电子天平,梅特勒-托利多仪器上海有限公司;CX41RF显微镜,东京奥林匹斯公司;PTC-200 PCR仪,美国Bio-Rad公司;GelDoc XR凝胶成像系统,美国Bio-Rad公司。
1.3 实验方法
1.3.1 产β-内酰胺酶菌株的初步筛选
取土样10 g或水样10 mL加入到90 mL含有玻璃珠的无菌水中,振摇10 min使样品充分分散。吸取1 mL接种到装有99 mL营养肉汤培养基的三角瓶中,于37 ℃,160 r/min摇床振荡培养24 h。取0.2 mL(500单位)青霉素于培养皿中,将适当稀释后的培养液吸取0.1 mL接入含有青霉素的培养皿中,倒入冷却至50 ℃左右的营养琼脂培养基,混匀,37 ℃培养24~48 h。筛选平板上的单菌落菌株,经过3~5次平板划线纯化,最后将得到的单菌落菌株转接到营养琼脂斜面培养基并编号于4 ℃保藏,即为所需的抗青霉素菌株。
1.3.2 产β-内酰胺酶菌株的鉴定(碘量法)
取新鲜配制浓度为6 000 μg/mL的青霉素0.1 mL 于一小试管中,加入培养18~24 h的菌液制成浓厚菌悬液(109CFU/mL)于37 ℃恒温水浴中放置30 min,不时摇动。再加入新鲜配制的10 g/L可溶性淀粉溶液500 μL,摇匀。再加入碘液20 μL并在37 ℃恒温水浴中放置10 min,不断摇晃,在10 min内能使蓝色完全消退的菌株即为β-内酰胺酶阳性,不消退者为阴性[14]。
1.3.3 β-内酰胺酶活力测定方法
β-内酰胺酶活力测定:参考《中华人民共和国药典》(2015年第四版);1个酶活力单位定义为:在37 ℃条件下,1 mL发酵酶液每小时分解青霉素活性单位的量,用U表示[1]。
粗酶液制备:发酵液经高速离心机以9 000 r/min离心10 min,所得上清液经0.22 μm微孔滤膜过滤除菌,其过滤液即为无菌粗酶液。酶活测定如公式(1)所示:
E=(B-A)×M×F×D×100
(1)
式中:E,青霉素酶活力,单位U/(mL·h);B,空白滴定所消耗的上述硫代硫酸钠滴定液的容量(mL);A,样品滴定所消耗的上述硫代硫酸钠滴定液的容量(mL);M,硫代硫酸钠滴定液的浓度(mol/L);F,相同条件下,每1 mL的硫代硫酸钠滴定液(0.01 mol/L),相当于青霉素的单位数,其值为742;D,青霉素酶稀释的倍数。
1.4 菌种鉴定
1.4.1 形态学鉴定
将活化后的菌种经适当稀释后,取适量稀释液涂布到营养琼脂平板中,37 ℃培养24~48 h,观察菌落形态并进行革兰氏染色镜检观察。
1.4.2 生理生化鉴定
根据《伯杰氏系统细菌学手册(第九版)》[15]和《常见细菌系统鉴定手册》[16]对所筛出的菌株进行生理生化特征鉴定。
1.4.3 16S rRNA基因序列分析和构建系统发育树
根据细菌总DNA提取试剂盒说明提取目标菌株的DNA,采用通用引物27F (5′-AGAGTTTGATCCTGGCTCAG-3′)和1 492R(5′-TACGGCTACCTTGTTACG ACTT-3′)进行PCR(polymerase chain reaction)扩增,扩增产物送至生工生物工程(上海)股份有限公司进行测序。将测序结果登入NCBI(national center for biotechnology information)进行BLAST比对,获取16S rRNA基因序列同源性较高的相关菌株并在GenBank库中下载其模式菌株,用MEGA-X软件中的邻接法(neighbor-joining,NJ)[17]构建系统发育树,并对其分析鉴定。将菌株B03鉴定的16S rRNA基因的部分序列通过Bankit向GenBank申请登录号(GenBank accession)。
1.5 酶学性质初步研究
1.5.1 酶最适作用温度及热稳定性影响
酶最适作用温度:用配制好的pH 7.0的PBS缓冲液稀释粗酶液及配制青霉素钠溶液,设定20、30、40、50、60、70、80 ℃,7个温度梯度。按照1.3.3酶活力测定方法测定上述不同温度下β-内酰胺酶活力,以酶活力最高者为100%,计算相对酶活力,确定酶最适作用温度。
酶的热稳定性:取适量无菌粗酶液分装于EP管中,分别在4、20、40、50、70 ℃,5个温度条件下保温2~5 d,分别定点取样进行酶活力测定,以未保温处理的酶活值为100%,计算相对酶活力,确定酶的热稳定性。
1.5.2 酶最适作用pH及pH稳定性影响
酶最适作用pH值:分别配制50 mmol/L pH 3.0~5.0 的柠檬酸盐缓冲液、pH 6.0~7.5的PBS缓冲液、pH 8.0~9.0的Tris-HCl缓冲液,并用不同pH值的缓冲液稀释粗酶液及配制青霉素钠溶液,于最适温度下处理30 min,按照1.3.3酶活力测定方法测定上述不同pH下β-内酰胺酶活力,以酶活力最高者为100%,计算相对酶活力,确定酶最适作用pH。
酶的pH稳定性:将用不同pH值(3.0~9.0)的缓冲液稀释的粗酶液于最适温度下处理1、2 h,按照1.3.3酶活力测定方法分别测定不同pH下β-内酰胺酶活力,以酶活力最高者为100%,计算相对酶活力,确定酶的pH稳定性。
1.5.3 金属离子对酶活力的影响
配制浓度50 mmol/L的不同金属离子(K+、Ca2+、Zn2+、Mg2+、Mn2+、Cu2+、Fe2+、Fe3+、Al3+)溶液,分别取适量与粗酶液混匀,于最适反应条件下处理30 min,按照1.3.3酶活力测定方法测定β-内酰胺酶活力,以未添加金属离子的酶液为对照组,定义酶活力为100%,计算不同金属离子影响下的相对酶活力。
1.5.4 β-内酰胺酶酶液保存稳定性研究
分别配置质量浓度为20、50、100 g/L的NaCl溶液和50、100、150 g/L的甘油,与适量的粗酶液1∶1(体积比)混匀经微孔滤膜过滤除菌后分装于EP管中,另以不加辅料的无菌粗酶液为对照,一同放置于4 ℃冰箱中保存,每隔5 d取样测1次酶活力,以未进行保温处理的酶液为100%,计算相对酶活力。
2 结果与分析
2.1 菌种筛选
将富集后的菌液稀释混合倾注于添加适当单位浓度抗生素的平板上培养18~24 h,通过抗生素平板筛选得到60株单菌落菌株,再通过碘量法鉴定所筛选得到的菌株,在10 min内能使蓝色完全消退的菌株得到8株,即为β-内酰胺酶阳性。将酶活较高的菌株B03(见表1)作为目标菌株,做进一步研究。
表1 产β-内酰胺酶菌株筛选结果
Table 1 The screening results of β-lactamase
producing strains
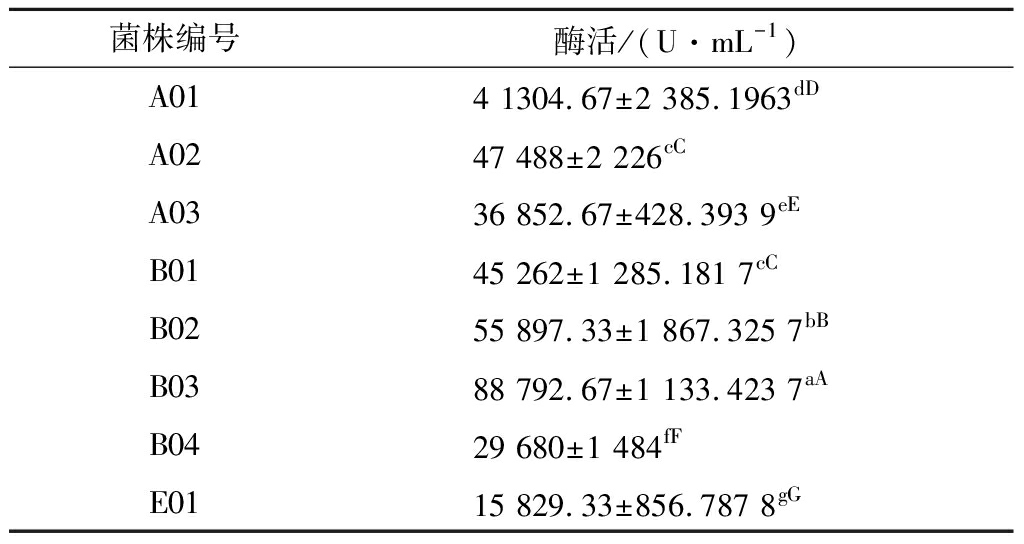
菌株编号酶活/(U·mL-1)A014 1304.67±2 385.1963dDA0247 488±2 226cCA0336 852.67±428.393 9eEB0145 262±1 285.181 7cCB0255 897.33±1 867.325 7bBB0388 792.67±1 133.423 7aAB0429 680±1 484fFE0115 829.33±856.787 8gG
注:小写和大写字母分别表示在0.05和0.01水平下Duncan新复级差检测结果。
2.2 菌种鉴定
2.2.1 菌种形态观察
菌株B03经革兰氏染色后在油镜下观察结果如图1所示。染色结果为革兰氏阳性,菌体成杆状,以成对或链状堆积排列,判定为杆菌。菌株B03形态特征见表2。菌株B03于营养琼脂平板上生长时菌落呈灰白色,不透明,表面不光滑,干燥,边缘不整齐。
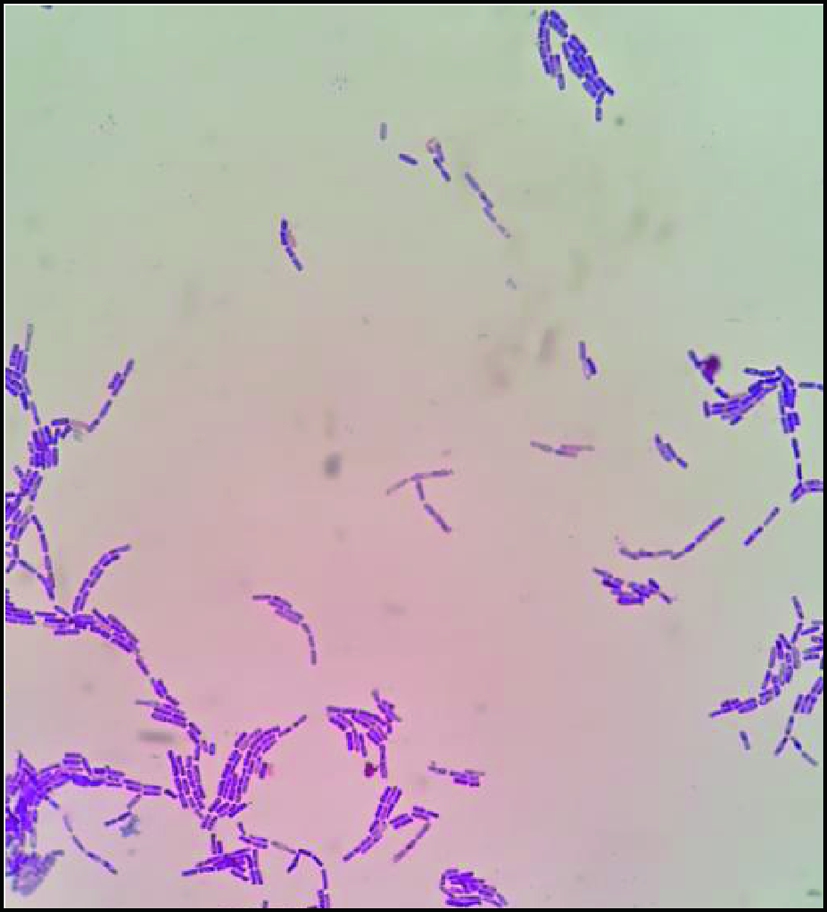
图1 菌株B03在油镜下的细胞形态
Fig.1 The cell morphology of strain B03 under oil
immersion lens
2.2.2 生理生化鉴定
根据《伯杰氏系统细菌学手册》、《常见细菌系统鉴定手册》对菌株B03进行生理生化特征鉴定。生理生化鉴定结果见表3。菌株B03为革兰氏阳性菌,并且有芽孢,过氧化氢酶、V-P反应、M.R反应呈阳性,可水解淀粉、明胶,但不产生吲哚,利用柠檬酸盐,发酵葡萄糖产酸不产气,据此确定该菌株属于芽孢杆菌属(Bacillus)。
表2 菌株B03的形态特征
Table 2 Morphological characteristics of strain B03

菌落形态B03形态特征菌落形态形状圆形大小4~6 mm颜色白色表面不光滑透明度不透明隆起环状隆起边缘不整齐个体形态菌体形状杆状革兰氏染色G+芽孢染色+
注:“+”表示阳性,“G+”表示革兰氏阳性。
表3 菌株B03的生理生化特征
Table 3 Biochemical characteristics of strain B03

鉴定项目鉴定结果鉴定项目鉴定结果明胶液化+酪氨酸水解+淀粉水解+吲哚-产过氧化氢酶+生长pH:5.7营养肉汤+V-P测定+生长pH:6.8营养肉汤+M.R试验+20 g/LNaCl+甘露醇-50 g/LNaCl+葡萄糖产酸+70 g/LNaCl+葡萄糖产气-100 g/LNaCl-利用柠檬酸盐+
注:“+”表示阳性,“-”表示阴性。
2.2.3 16S rRNA鉴定及系统发育树构建
PCR产物的电泳结果如图2所示。PCR扩增出的条带大小约1 500 bp,扩增产物经测序得到的16S rRNA序列为1 479 bp。PCR产物序列通过NCBI中的BLAST程序比对后,得到Ident值97%以上的菌株近100株,说明与此菌株序列相似的菌株较多。从GenBank数据库中下载8个与菌株B03同源性较高且已定名的模式菌株的16S rRNA基因序列,进行序列比对,并进行系统发育分析,通过MEGA-X的Neighbor-Joining(NJ)法构建系统发育树(见图3)[18-19]。由图3可知,菌株B03和Bacillus cereus(AY138 275)在同一分支上,说明两者同为芽孢杆菌属(Bacillus)。Bootstrap检验值为99,说明发育树所表示的两种菌株之间的进化关系可信[20]。结合形态学鉴定和生理生化鉴定可确定菌株B03为蜡状芽孢杆菌(Bacillus cereus)。将菌株B03的核酸序列通过Bankit向GenBank申请的登录号(GenBank Accession)为MK568 460。
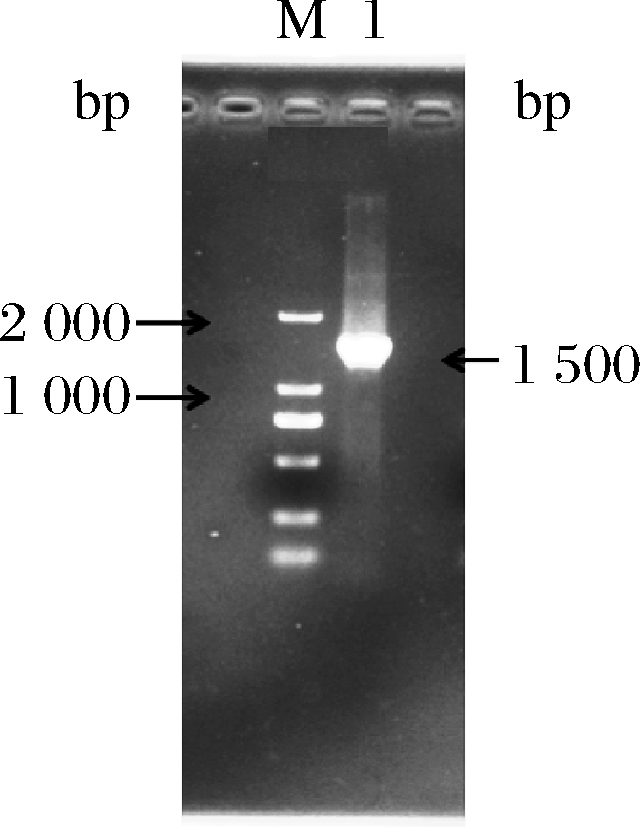
图2 菌株B03的16S rRNA PCR产物电泳图
Fig.2 The electrophoresis result of 16S rRNA PCR
products of strain B03
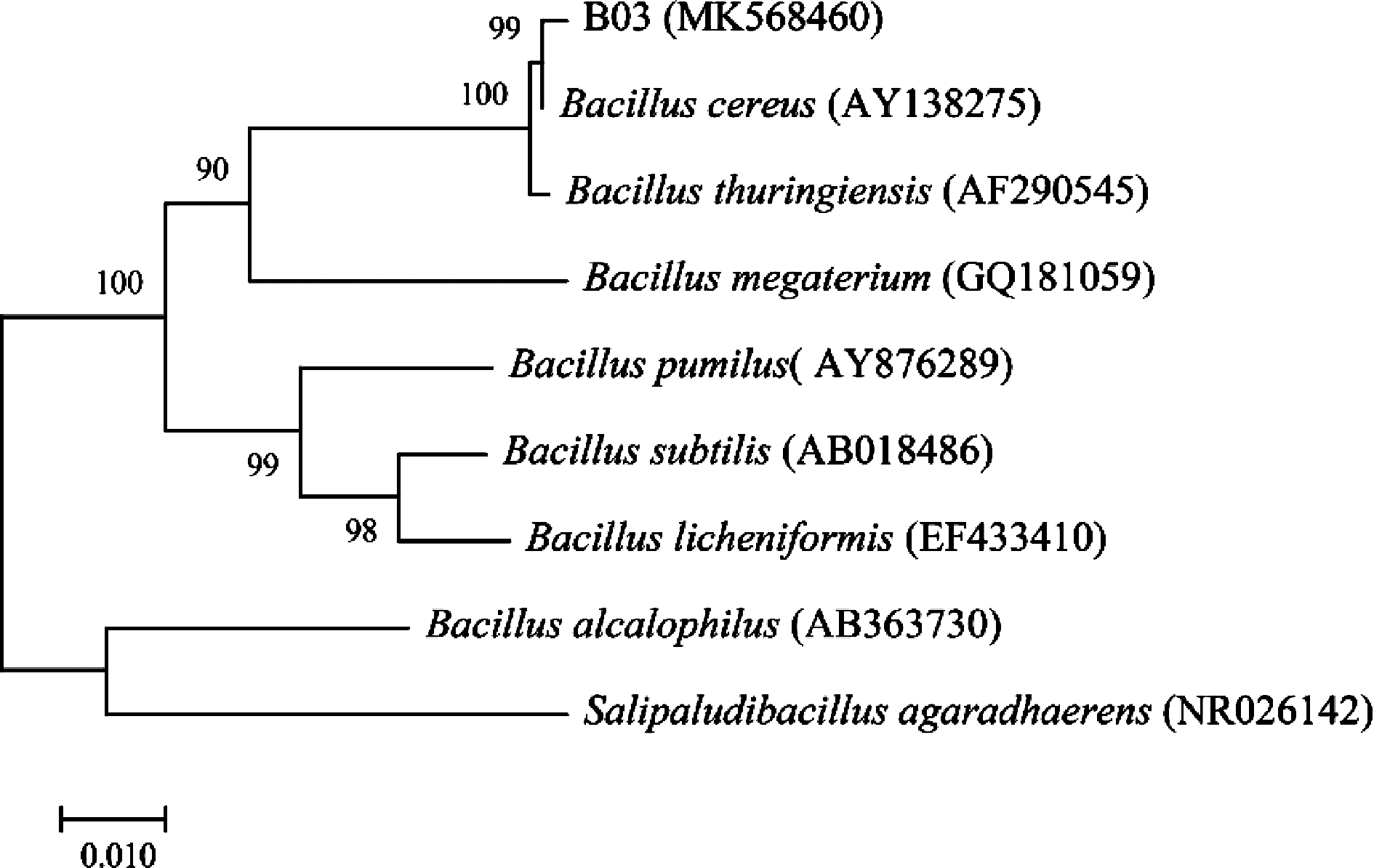
图3 基于16S rRNA序列分析的菌株B03的系统发育树
Fig.3 Phylogenetic tree of strain B03 based on
16S rRNA sequence analysis
注:节点上的数字为1 000次重复的支持率;标尺0.010所示长度为
1%核苷酸置换率。
2.3 菌株B03酶学性质初步研究
2.3.1 酶最适作用温度及热稳定性影响
温度对B03所产β-内酰胺酶活力的影响结果如图4-a所示,在40 ℃时相对酶活力达到最高,即酶的最适作用温度为40 ℃。40~50 ℃相对酶活力皆保持在90%以上,当温度高于50 ℃时,酶活力急剧下降,80 ℃时仅保留最大酶活力的10%。酶活热稳定性如图4-b所示,温度70、50 ℃时,酶活力下降很快。温度40 ℃时,保温48 h,酶活力下降一半多。温度20 ℃时,保温24 h,依然有90%左右的酶活力,120 h后剩余60%以上的酶活力。4 ℃条件下,保存120 h酶活力还能剩余93%左右。所以,在4~20 ℃酶活热稳定性较好。
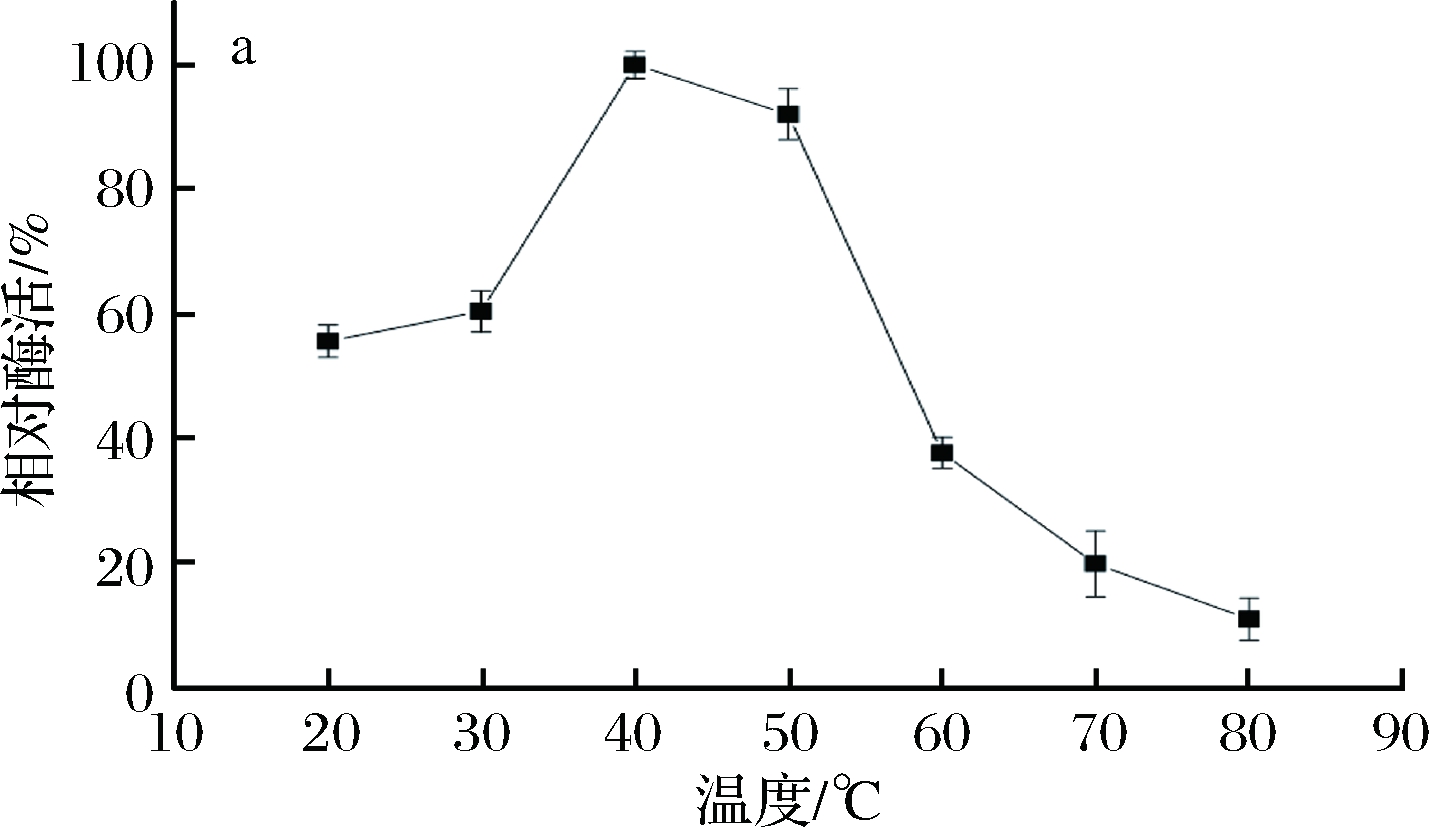
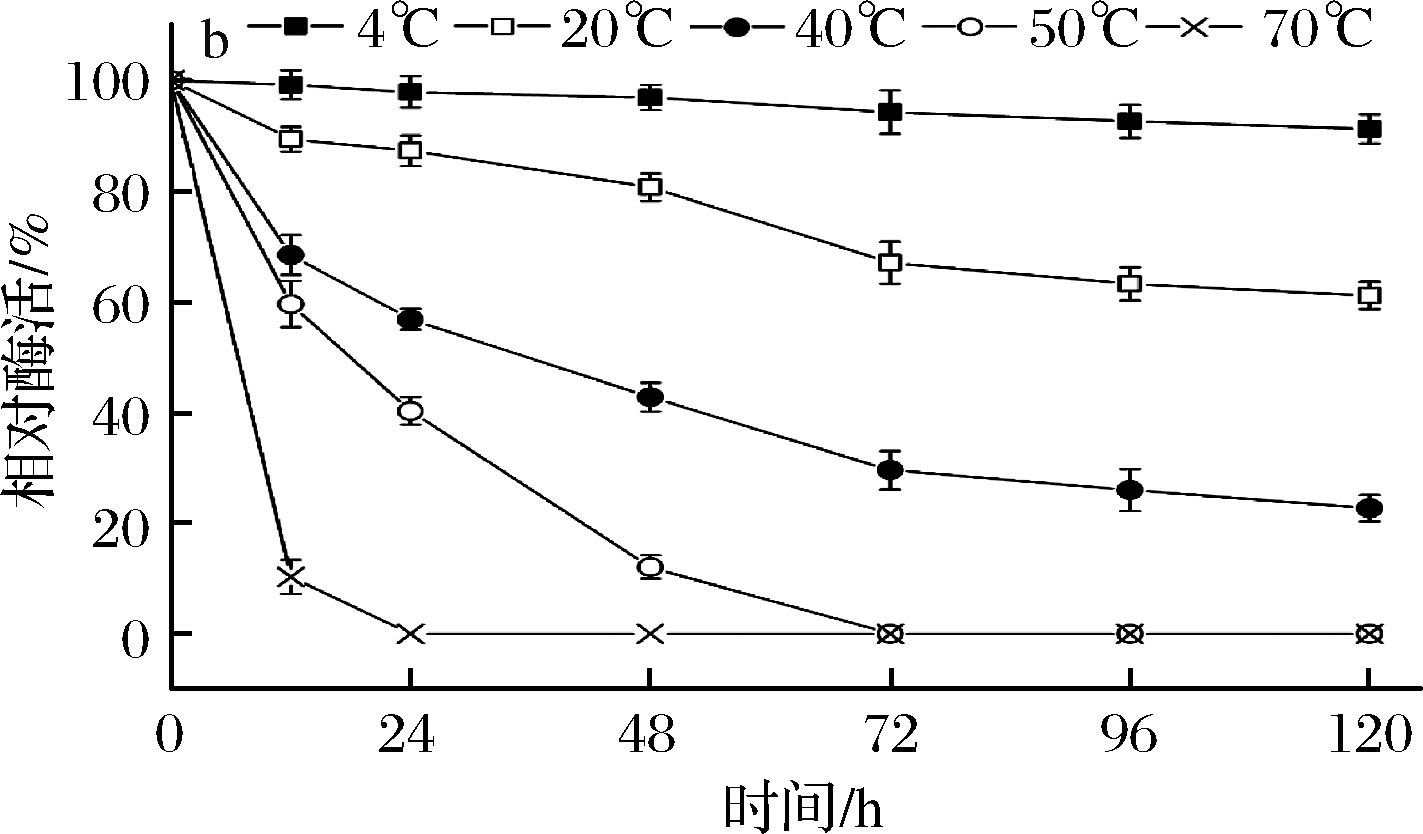
a-酶活力;b-稳定性
图4 温度对B03所产β-内酰胺酶活力和稳定性的影响
Fig.4 Effects of temperature on the activity and stability of
β-lactamase produced by B03
2.3.2 酶最适作用pH及pH稳定性影响
由图5-a可知,β-内酰胺酶的最适作用pH为7.0,该酶属于中性酶。在pH 4.0~7.5能保持较高酶活力,皆在最高酶活力的60%以上,pH低于4.0 或高于7.5以后,酶活力迅速下降。由图5-b可知,在pH 5.0~7.5,处理2 h相对酶活力保持在50%以上,稳定性较好。当pH低于5.0或高于7.5时,酶活稳定性明显下降,pH 3.0和pH 9.0处理2 h后相对酶活力分别约为17%和28%。
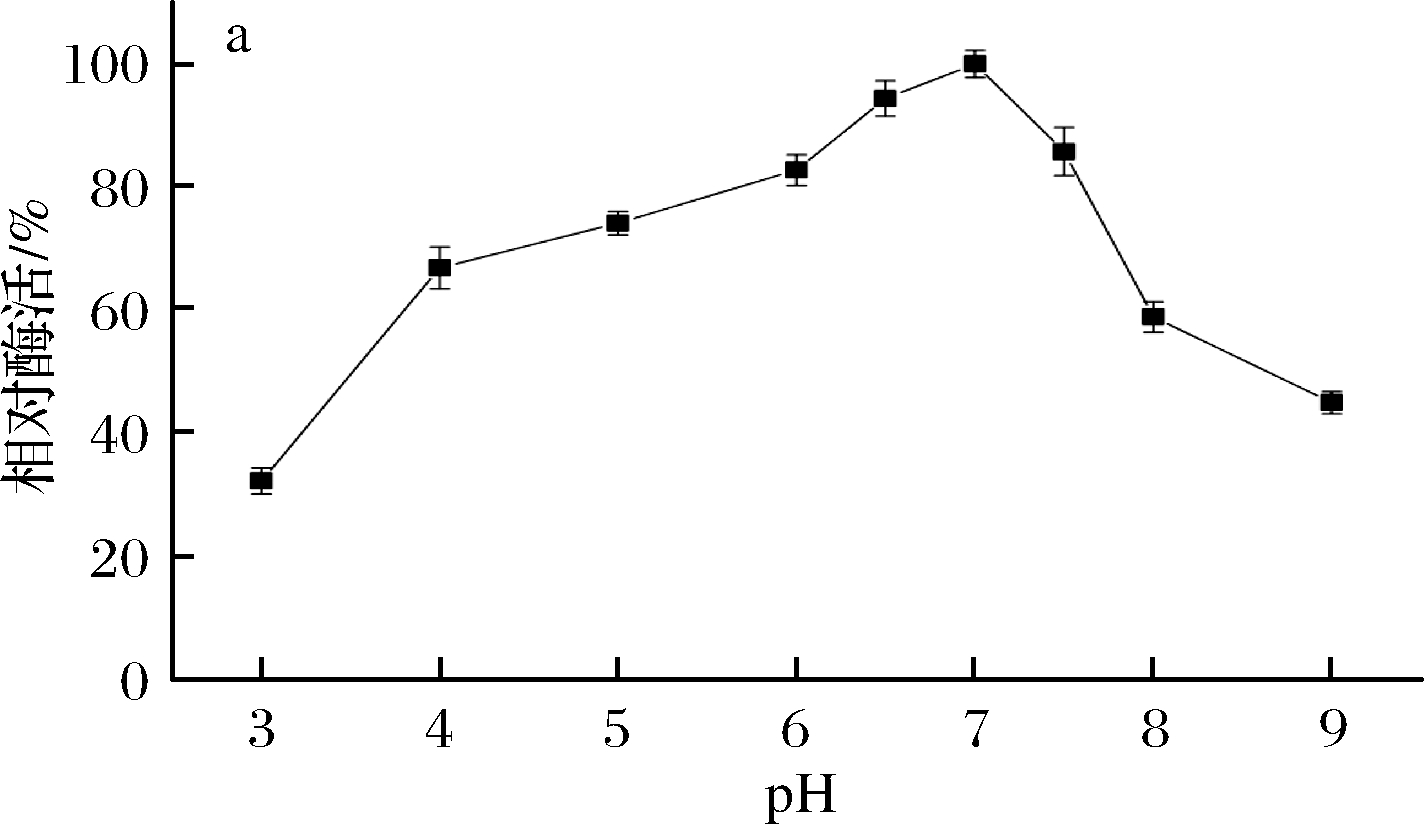
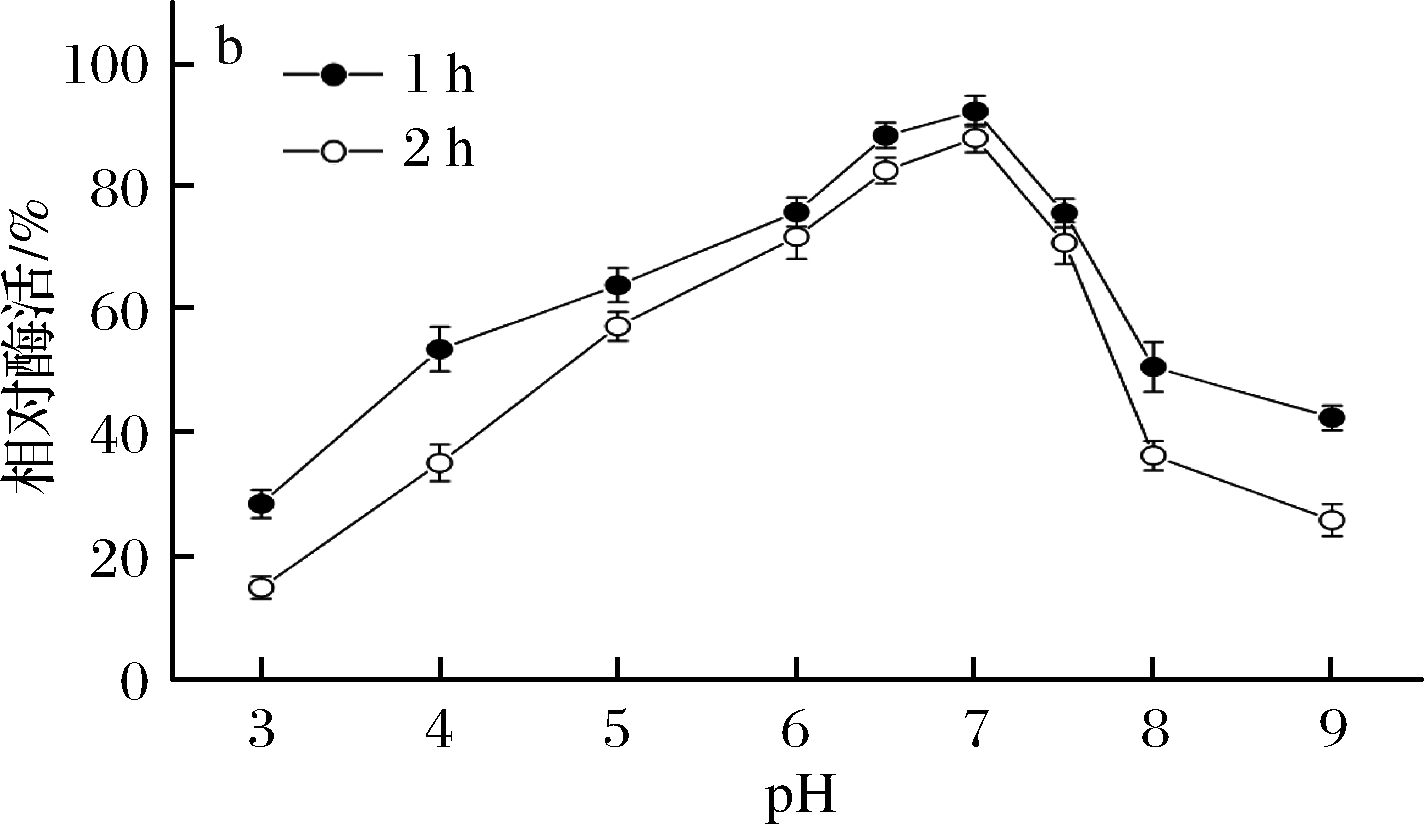
a-酶活力;b-稳定性
图5 pH对B03所产β-内酰胺酶稳定性的影响
Fig.5 Effects of pH on the activity and stability of
β-lactamase produced by B03
2.3.3 金属离子对酶活的影响
由图6可知,Mg2+、Fe2+和Mn2+对酶有不同程度的激活作用,其中Mg2+对酶的激活作用最强,相对酶活约为对照组的1.3倍。Cu2+、Al3+和Fe3+对酶有不同程度的抑制作用,其中Al3+对酶的抑制作用最强,抑制了60%左右的酶活性。可能是Cu2+、Al3+和Fe3+等离子与蛋白的作用区域结合导致酶活受到抑制[21]。K+、Ca2+、Zn2+对酶活力的影响作用不是很明显。
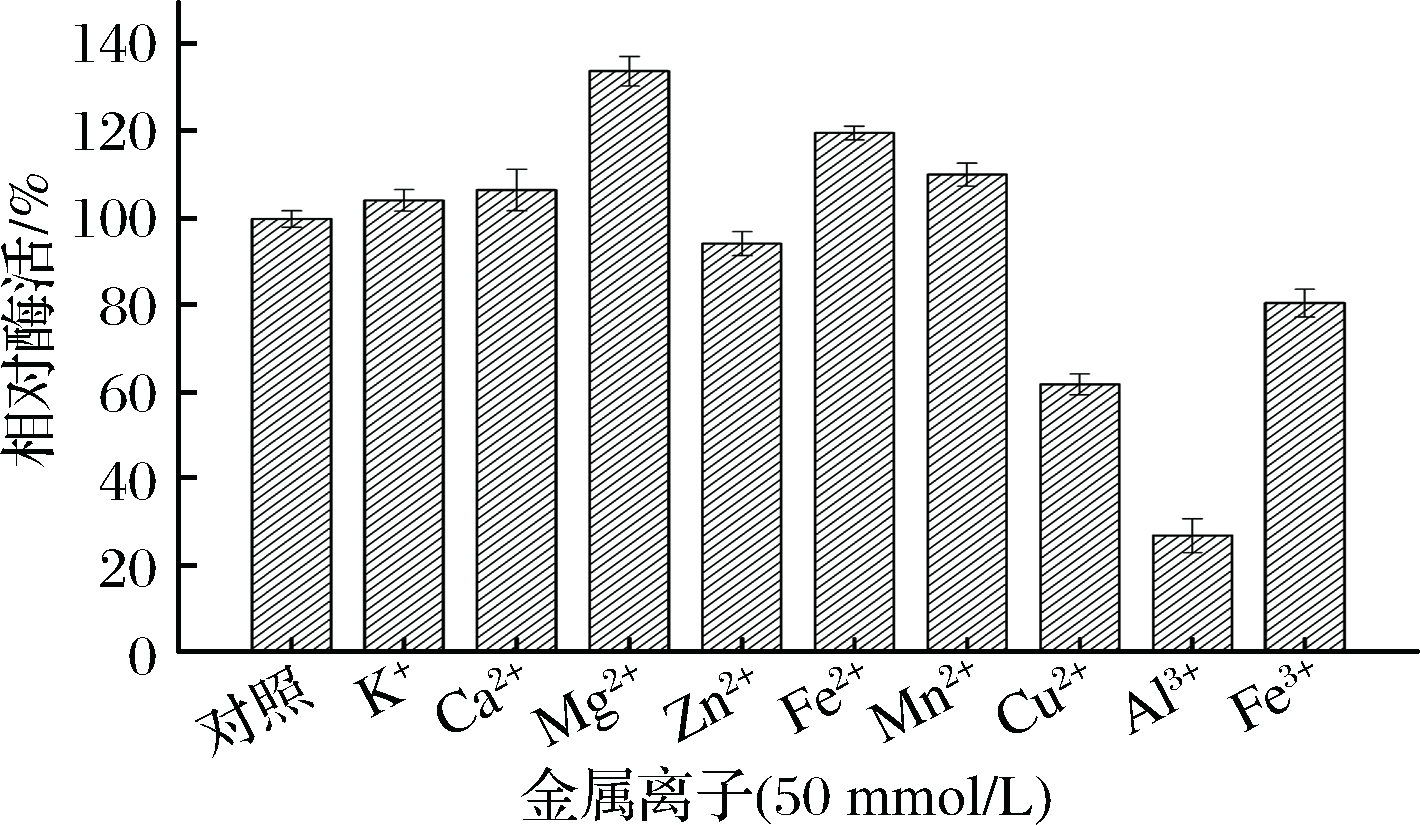
图6 金属离子对β-内酰胺酶活力的影响
Fig.6 Effects of metal ions on the β-lactamase activity
2.3.4 β-内酰胺酶酶液保存稳定性
经0.22 μm微孔滤膜过滤除菌得到的无菌粗酶液,对其不同的保存方法进行研究以提高保存稳定性,结果见表4。由表4可知,4 ℃条件下,未添加任何辅料的酶液保存5 d后酶活力能保留93%左右,30 d后酶活力仅余60.8%。添加20、50、100 g/L NaCl的酶液保存30 d基本上依然都保留90%以上的酶活力,从表中可以看出,稳定性效果由高到底依次为:50 g/L NaCl>100 g/L NaCl>20 g/L NaCl。同期添加50、100、150 g/L甘油的酶液保存30 d皆都保留90%以上的酶活力,稳定性效果由高到底依次为:100 g/L甘油>50 g/L甘油>150 g/L甘油。综上,由原液的保存5 d剩余93%左右的酶活力向其中添加50 g/L NaCl或100 g/L甘油后延长到了30 d,稳定性效果提升了6倍,因此向酶液中添加50 g/L NaCl或100 g/L甘油可以更好地提高酶液保存的稳定性。
3 讨论
本实验利用抗生素平板法和碘量法(定性)从上海临港地区分离出1株高产β-内酰胺酶的菌株B03,对此菌株进行16S rRNA测序分析,将其基因序列进行BLAST比对,构建系统发育树,并结合形态学特征、生理生化试验确定该菌株为蜡状芽孢杆菌(Bacillus cereus),命名为Bacillus cereus B03。1999年,中国药品生物制品检定所在我国最先分离出1株能产生青霉素酶的蜡状芽孢杆菌CMCC (B) 63 301,此菌已被收入《中华人民共和国药典》[22]。将菌株B03的核酸序列通过Bankit向GenBank申请的登录号(GenBank Accession)为MK568 460。
表4 无菌粗酶液保存稳定性研究
Table 4 The storage stability of sterile crude enzyme solution
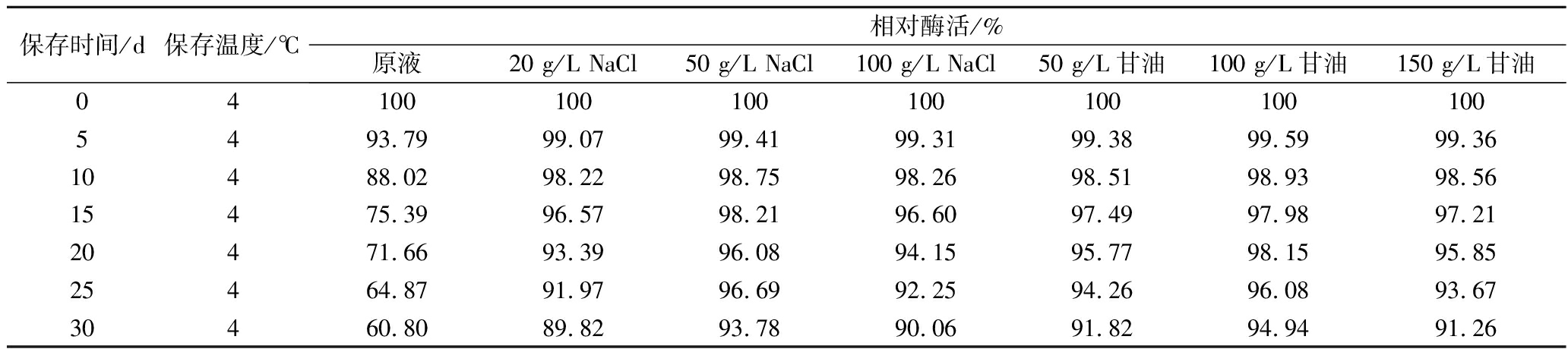
保存时间/d保存温度/℃相对酶活/%原液20 g/L NaCl50 g/L NaCl100 g/L NaCl50 g/L甘油100 g/L甘油150 g/L甘油041001001001001001001005493.7999.0799.4199.3199.3899.5999.3610488.0298.2298.7598.2698.5198.9398.5615475.3996.5798.2196.6097.4997.9897.2120471.6693.3996.0894.1595.7798.1595.8525464.8791.9796.6992.2594.2696.0893.6730460.8089.8293.7890.0691.8294.9491.26
酶学性质研究表明,该酶的最适反应温度为40 ℃,最适反应pH为7.0,该酶在4~20 ℃、pH 5.0~7.5稳定性较好。本研究中该酶的最适反应温度高于戚薇等[23]、刘翔[24]所研究的酶的最适反应温度(37 ℃),该酶50 ℃剩余相对酶活力90%左右也远远高于他们所研究的70%、40%左右的剩余相对酶活力,说明此酶有更好的温度耐受性,可能由酶的基因表型不同造成的,但皆属于中温酶的范畴[25]。Mg2+、Fe2+和Mn2+对酶有不同程度的激活作用,Cu2+、Al3+和Fe3+对酶有不同程度的抑制作用。在β-内酰胺酶酶液保存稳定性研究中,向无菌粗酶液中添加50 g/L NaCl或100 g/L甘油后,由原酶液的保存5 d剩余相对酶活力93%左右延长到了30 d,稳定性效果提升了6倍。
中国是生产和使用抗生素的大国,每年生产抗生素的总量可达到21万t,使用量可达到18.9万t[26]。目前,β-内酰胺类抗生素由于药效快、作用范围广、毒性低等优点,已被广泛应用在食品加工、畜牧饲养和水产养殖等与人类生活息息相关的各个领域。β-内酰胺酶不仅可以清除环境中抗生素的残留,也用于食品(特别是乳及乳制品)、饮用水和环境中残留抗生素的检测,为食品安全及公众健康提供重要的保障。因此,对β-内酰胺酶的分离纯化及酶学特性的研究具有重要意义,本研究分离得到的产β-内酰胺酶的菌株B03,下一步将研究此产酶菌株的发酵条件优化,以期为进一步工业化开发利用性状稳定且高产β-内酰胺酶的菌株提供借鉴,为工业生产β-内酰胺酶及其应用提供参考依据。
[1] 国家药典委员会.中华人民共和国药典(2015年版)(四部) [M].北京:化学工业出版社,2015.
[2] FLEMING A.On the antibacterial action of cultures of a penicillium with special reference to their use in the isolation of B. influenzae[J].Bulletin of the World Health Organization,2001,79(8):780-790.
[3] NAAS T,OUESLATI S,BONNIN R A,et al.Beta-lactamase database (BLDB)-structure and function[J]. Enzyme Inhib Med Chem,2017,32(1):917-919.
[4] GAUDIN V.Advances in biosensor development for the screening of antibiotic residues in food products of animal origin -A comprehensive review[J].Biosensors and Bioelectronics,2017,90(4):363-377.
[5] DOCQUIER J D,MANGANI S.An update on β-lactamase inhibitor discovery and development[J].Drug Resistance Updates,2018,36:13-29.
[6] VALENZA G,WERNER M,EISENBERGER D,et al.First report of the new emerging global clone ST1193 among clinical isolates of extended-spectrum β-lactamase (ESBL)-producing Escherichia coli from Germany[J].Journal of Global Antimicrobial Resistance,2019,17:305-308.
[7] 张雨晨,王春艳,查渝,等.临床多药耐药鲍氏不动杆菌分布及β-内酰胺酶基因型分析[J].中华医院感染学杂志,2019,29(1):1-5.
[8] 苏敏,王利刚,张磊,等.乳及乳制品中β-内酰胺酶抑制剂检测方法的研究进展[J].食品安全质量检测学报,2018,9(4):769-775.
[9] TANG X P,CAI T W,WANG P G.Synthesis of beta-lactamase activated nitric oxide donors[J].Bioorganic & Medicinal Chemistry Letters,2003,13(10):1 687-1 690.
[10] ALLAN R N,KELSO M J,RINEH A,et al.Cephalosporin-NO-donor prodrug PYRRO-C3D shows β-lactam-mediated activity against Streptococcus pneumoniae biofilms[J].Nitric Oxide,2017,65(1):43-49.
[11] LI H,XU B,WANG D Q,et al.Immunosensor for trace penicillin G detection in milk based on supported bilayer lipid membrane modified with gold nanoparticles[J].Journal of Biotechnology,2015,203:97-103.
[12] DOPRADOA T M,FOGUEL M V,GONSALVES L M,et al.β-Lactamase-based biosensor for the electrochemical determination of benzylpenicillin in milk[J].Sensors and Actuators B: Chemical,2015,210:254-258.
[13] 严兵,彭开松,薛秀恒,等.青霉素酶特异性抗血清间接ELISA方法的建立[J].动物医学进展,2010,31(9):47-50.
[14] 赵旺胜,吴桂荣,刘家喜,等.四种检测β-内酰胺酶方法的实验比较[J ].南京医科大学学报,1997,11(6):648.
[15] GARRITY G M,BELL J A,LILBURN T G.Bergey’s Manual of Systematic Bacteriology[M].Ninth Edition. New York: Springer New York Berlin Heidelberg,2004.
[16] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[17] THOMPSON J D,HIGGINS D G,GIBSON T J.CLUSTAL W: Improving the sensitivity of progressive multiple sequence alignment through sequence weighing, position-specific gap penalties and weight matrix choice[J].Nucleic Acids Research,1994,22(22):4 673-4 680.
[18] SCHLEIFER K H.Microbial diversity: facts, problems and prospects[J].Syst Appl Microbiol,2004,27(1):3-9.
[19] PATHAK D,LONE R,KHAN S,et al.Isolation, screening and molecular characterization of free-living bacteria of potato (Solanum tuberosum L.) and their interplay impact on growth and production of potato plant under Mycorrhizal association[J].Scientia Horticulturae,2019,252:388-397.
[20] 王艳华,丁涓,李帅军,等.一株海藻酸降解菌产酶条件的优化[J].中国酿造,2018,37(9):100-104.
[21] GUPTA R,GIGRAS P,MOHAPATRA H,et al.Microbial α-amylase:A biotechnological perspective[J].Process Biochem,2003,38 (11):1 599-1 616.
[22] 张凤凯,张枫.蜡样芽孢杆菌CMCC(B)63301产生青霉素酶的特性及其应用的研究[J].药物分析杂志,1999,19(3):14-17.
[23] 戚薇,王晓媛,王建玲,等.青霉素酶分离纯化及酶学性质研究[J].中国抗生素杂志,2007(8):466-469.
[24] 刘翔. 重组青霉素酶TEM-1的克隆表达、纯化及酶学性质研究[D].杭州:浙江大学,2015.
[25] CHAVES J,LADONA M G,SEGURA C,et al.SHV-1 beta-lactamase is mainly a chromosomally encoded species-specific enzyme in Klebsiella pneumoniae[J].Antimicrob Agents Chemother,2001,45(10):2 856-2 861.
[26] 刘元望,李兆君,冯瑶,等.微生物降解抗生素的研究进展[J].农业环境科学学报,2016,35(2):212-224.