目前,捕捞鲣鱼的主要渔场位于中西部太平洋水域,至2008年,该水域鲣鱼产量已达170万t[1]。鲣鱼属低值金枪鱼,由于肉质较酸,腥味重,口感差,红肉含量高[2]等缺点,严重限制其开发与利用。但鲣鱼富含蛋白质(26.14%)[3],而蛋白质的凝胶性是食品加工过程中的一个热动力学特性。在肉制品加工中,蛋白质凝胶的形成严重影响成品的质构特性和感官特性。其中肌原纤维蛋白是形成凝胶的主要成分,占鱼肌肉总蛋白含量的55%~60%,或骨骼肌质量的10%[4]。蛋白质凝胶结构的形成分为变性和聚合两步,凝胶结构及其物理化学性质取决于蛋白质变性和聚集的相对速率,当蛋白质聚集速率低于展开速率时,有利于形成细致的凝胶网状结构,当蛋白质聚集速率高于展开速率时,有利于形成无序、粗糙的凝胶结构[5]。影响蛋白质热成胶的因素有很多,如蛋白质种类、蛋白质浓度、温度、pH值、外源添加物等都会影响蛋白质的凝胶质构和强度。其中pH值对蛋白质凝胶有很重要的影响,pH值通过影响蛋白质氨基酸侧链的解离程度,改变凝胶过程中蛋白质的溶解度及蛋白质-蛋白质的相互作用,进而影响蛋白质的凝胶特性。当pH值接近蛋白质的等电点时,变性蛋白质会因为疏水相互作用而形成随机聚集物。当pH值远离等电点时,静电斥力会阻止形成随机聚集,导致形成线性多聚体[6]。因此,对鱼肉肌原纤维蛋白进行改性,改善其凝胶强度和持水性对鱼肉制品的加工具有重要意义。
由预试验得出结论:超声波处理能提升肌原纤维蛋白溶解度、乳化性等功能性质,超声3、6 min提高凝胶预备阶段但不利于凝胶的形成。为实现超声波对鲣鱼肌原纤维蛋白性质的全面改善,可以结合其他手段对蛋白质进行改性。本实验以超声3 min为例,对鲣鱼肌原纤维蛋白进行超声波(3 min,振幅40%)处理及超声波(3 min,振幅40%)结合酸(ultrasonic combined acid, GDL)处理后加热,得到静态聚集体,观察超声波及超声波结合酸处理后,鲣鱼肌原纤维蛋白流变性、质构、持水性以及溶解度的变化。
1 材料与仪器
1.1 材料与试剂
鲣鱼(Katsuwonus pelamis)(2015年购于浙江黄罐食品公司,-60 ℃冰箱冷藏);三羟甲基氨基甲烷(Tris)、顺丁烯二酸(maleicacid)、曲拉通(triton-100)、NaCl、KCl、酒石酸钾钠、无水CuSO4、Na2HPO4、NaH2PO4等均为分析纯。
1.2 仪器与设备
LRH-100 CL型低温培养箱,上海一恒科学仪器有限公司;D-130 电动匀浆机,Wiggens有限公司;GL-20B 高速冷冻离心机,上海安亭科学仪器厂;MCR301流变仪,奥地利安东帕公司;UV1100型紫外分光光度计,广州罡然机电设备有限公司;SG2-ELK研究用酸度计,梅特勒-托利多公司;FA2004型电子分析天平,南京东迈科技仪器有限公司;AL104-IC型分析天平,梅特勒-托利多国际贸易(上海)有限公司; VC 750超声波破碎仪,美国科尔帕默仪器有限公司; TA.XT Plus质构仪,北京微讯超技仪器技术有限公司。
2 实验方法
2.1 肌原纤维蛋白的提取
肌原纤维蛋白的提取参考KATOH等[7]并作适当的修改。准确称取5 g鱼肉,加40 mL 40 mmol/L Tris-Maleat缓冲液(内含0.16 mol/L KCl,20%TritonX-100,pH 7.5),均质(12 000 r/min,每次30 s,间隔1 min,重复4次),离心(4 ℃,5 000 r/min,15 min),除上清液,继续加40 mL 40 mmol/L Tris-Maleat缓冲液(内含0.16 mol/L KCl, pH 7.5)清洗沉淀。均质-离心重复2次。用4倍体积0.1 mol/L NaCl溶液清洗沉淀,离心弃上清液用8倍体积的0.1 mol/L NaCl清洗沉淀,纱布过滤,滤液离心,沉淀即为肌原纤维蛋白样品,碎冰冷藏。
2.2 肌原纤维蛋白浓度的测定
双缩脲法测肌原纤维蛋白的浓度[8]。
2.3 超声波处理肌原纤维蛋白[9]
将肌原纤维蛋白稀释至所需浓度,取适量蛋白样品于玻璃烧杯中,将烧杯置于超声波细胞破碎仪(超声探头为频率 20 kHz,直径 15 mm的钛金属探头),设置超声振幅为40%,超声时间为 3 min(超声过程中工作时间和间歇时间分别为1 s和4 s)冰水浴控制样品温度为4~10 ℃,处理后的样品于4 ℃冰箱内储存,24 h内使用。
2.4 样品凝胶的制备
鲣鱼肌原纤维蛋白凝胶的制备参考田金河[10]的方法并做适当改动。将60 mg/mL的肌原纤维蛋白溶液转移至 25 mL的烧杯中,每个烧杯中样品各 20 mL。为防止凝胶劣化现象的出现,凝胶样品的制备采用二步加热法,即先在 40 ℃水浴稳定1 h,然后再 90 ℃水浴稳定30 min,制备静态聚集体,静态聚集体立即置于冰水中冷却30 min,然后于 4 ℃条件下平衡24 h,备用。
将60 mg/mL的肌原纤维蛋白溶液超声处理3 min后,凝胶制备方法同上。
在超声处理后的肌原纤维蛋白溶液中加入GDL,调整蛋白质pH为5.7,搅拌充分溶解后,凝胶制备方法同上。
2.5 温度扫描
上述2.4中制备的MP样品(60 mg/mL)的流变特性的测定参考常海霞[11]的方法,温度扫描测试选用平行锥板(PP50,d=49.985 mm),测试应变力为0.02,频率0.1 Hz,缝隙1 mm,扫描温度范围为20~80 ℃,升温速率为1 ℃/min,记录G′的变化。
2.6 TPA测定
将2.4中制备的凝胶于室温下平衡0.5 h(28~30 ℃),采用TA.XT Plus质构仪测定凝胶样品的质构特性。测定参数参考张自业的方法[12]:采用P/6探头,测前速度:5.0 mm/s,测试速度:1.0 mm/s,测后速度:5 mm/s,下压距离1 mm,触发值10 g,数据采集速度100 pps。重复检测5次。
2.7 持水性测定
持水性(water holding capacity, WHC)参考KOCHER等[13]的方法。将制备好的凝胶于4 ℃下10 000×g离心10 min,离心完成后,离心管倒置晾干,残留的水分用干燥滤纸小心吸干,离心管质量以及离心前后离心管和凝胶的总质量精确称重。WHC按公式(1)计算:
WHC/%![]() ×100
×100
(1)
式中:W为离心管的质量,g;W1为离心前凝胶和离心管的总质量,g;W2为离心后凝胶和离心管的总质量,g。每个处理3次重复。
2.8 溶解度的测定
肌原纤维蛋白溶液的溶解度测定方法如下:取5 mg/mL的MP溶液于离心管中,5 000 r/min,离心40 min后,用双缩脲法测定上清液中吸光度值,BSA做为标准蛋白。
溶解度/%![]() ×100
×100
(2)
2.9 数据处理
实验数据由SPSS 18.0进行分析处理;绘图采用Origin 8.0软件。
3 结果与讨论
3.1 温度扫描分析
如图1可知,未经处理的肌原纤维蛋白的G′(弹性模量)在整个加热过程中分成3个阶段,20~38 ℃为凝胶的准备阶段。38~47 ℃为凝胶劣化阶段。47~80 ℃为凝胶强化阶段。通过超声波处理后的样品其流变曲线同样分为3个阶段:20~38 ℃为凝胶预备区,38~47 ℃为凝胶劣化区,但与原样相比, 47~80 ℃样品的G′不再随着温度的上升而增加。而超声波结合酸处理后的样品其流变曲线变化趋势与原样相比,明显增强了凝胶预备阶段,随着温度的升高,凝胶强化阶段的G′略高于未处理的样品组,明显高于单一超声波处理组。由凝胶劣化阶段可以看出,超声波处理后的肌原纤维蛋白劣化现象非常严重,凝胶强化阶段G′无明显上升可能与劣化程度有关。而超声波结合酸处理后,降低了凝胶劣化程度,使凝胶强化阶段的G′迅速回升。因此综合上述结论,超声波结合酸处理对肌原纤维蛋白的改性要比单一的超声波处理凝胶效果更好。
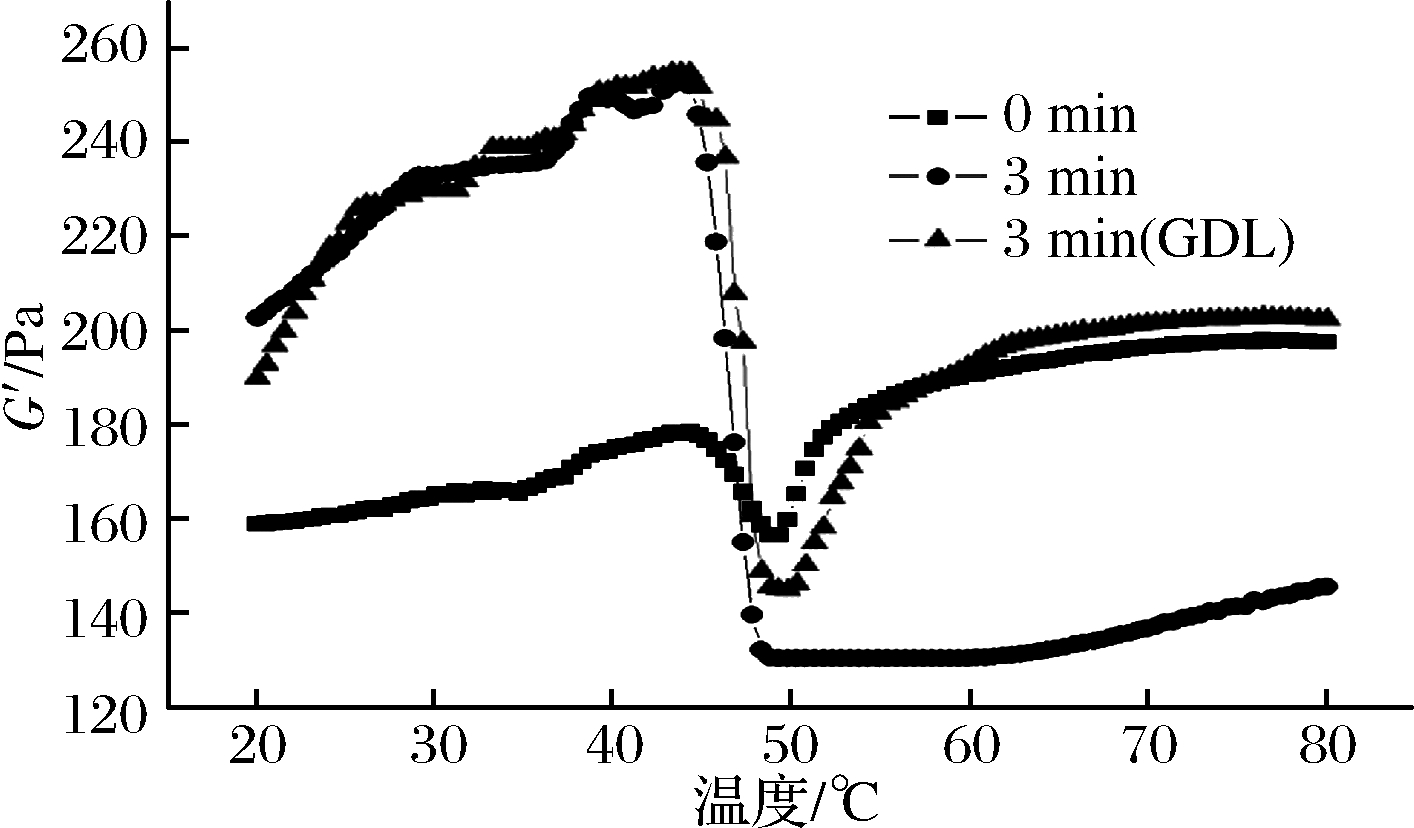
图1 不同处理方式对鲣鱼肌原纤维蛋白流变性的影响
Fig.1 Effects of different treatment methods on the
rheological properties of myofibrillar protein of skipjack
3.2 质构(硬度、弹性、凝聚性、咀嚼性)分析表
肌原纤维蛋白超声处理后制备热诱导凝胶,采用质构仪测定凝胶的硬度、弹性、凝聚性、咀嚼性等质构特性,探讨超声处理及超声波结合酸处理对肌原纤维蛋白凝胶的质构特性的影响,结果如表1所示。
表1 不同处理后肌原纤维蛋白质构特性差异
Table 1 The difference of structural properties of myofibrillar protein after different treatments

质构特性是凝胶的一个重要特性,决定了凝胶的品质,由表1可知,超声3 min处理后的肌原纤维蛋白的凝胶硬度、弹性、凝聚性、咀嚼性等各项质构特性明显低于未处理的肌原纤维蛋白样品的质构特性,且差异性很显著(P<0.05)。这也与上述的流变曲线对比趋势相吻合,单一的超声波处理不利于肌原纤维蛋白凝胶的形成。可能是因为聚集体的结构及其物理化学性质取决于蛋白质分子变性和聚集的相对速率。蛋白在加热过程中会部分构象改变,随后分成2种途径,部分改变构象的蛋白质要么发生聚集,要么进一步变性展开,超声波处理促使了蛋白质分子进一步展开,提高了蛋白质的溶解度,增加了蛋白质与水之间的吸引力,阻碍了蛋白质之间的纵向交联,导致形成凝胶的能力减弱。超声波结合酸处理后制备的凝胶,其凝胶硬度、弹性与原样相比,几乎无明显差别(P>0.05),但凝聚性、咀嚼性呈明显增加(P<0.05)。可能是由于当pH值接近蛋白质的等电点时有利于蛋白质-蛋白质相互作用,会因为疏水作用而形成随机聚集物,导致形成凝胶的能力增强。
3.3 持水性分析
当鲣鱼肌原纤维蛋白样品超声处理3 min后,二次加热后冷却,观察到肌原纤维蛋白不能形成较大的聚集网络,测其持水性为87.83%(如图2),可能是由于超声波产生的瞬时高温使部分蛋白质变性,结构受到破坏,溶解度增加,增强了蛋白质与水之间的结合,导致保水性增加。
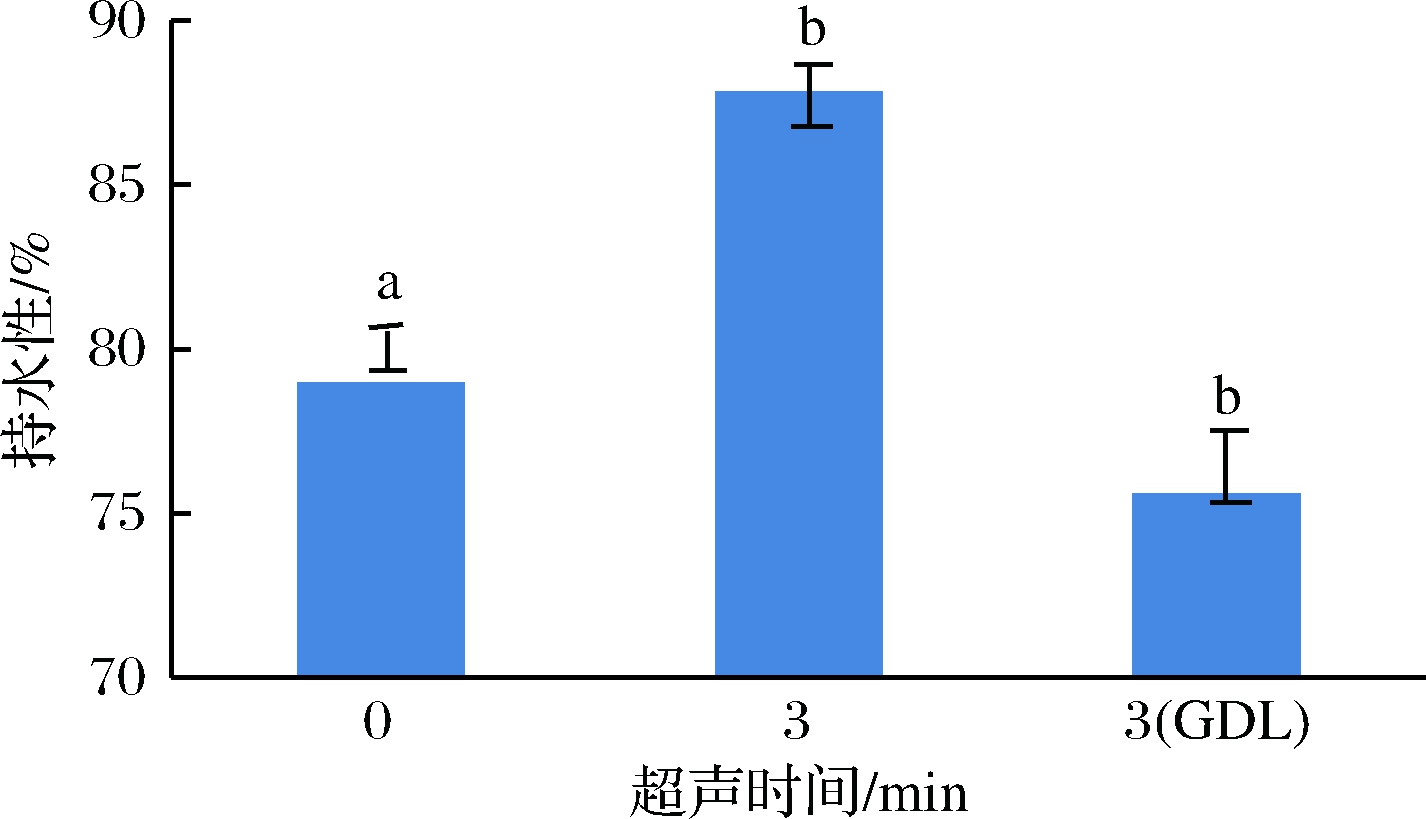
图2 不同处理方式对鲣鱼肌原纤维蛋白持水性的影响
Fig.2 Effects of different treatment methods on the water
retention of myofibrillar protein of skipjack
此结果也与CLEMENTS[14]的研究结果吻合,超声波处理有利于肌原纤维蛋白的释放,提升肉制品的持水性、嫩度等。而蛋白质保留太多的水分在结构中,就阻止了蛋白质与蛋白质之间的纵向交联,不利于凝胶形成。而超声波结合酸处理后,样品的持水性与单一超声波处理相比有明显降低。可能是因为当pH值接近等电点时,溶解度降低;随着pH值偏离蛋白等电点,蛋白质带有净电荷,增大了蛋白质与水分子间的吸引力,生成更多的空间,使更多的水保留其中,导致蛋白质溶解度增大,凝胶保水性增强。此结果与FEI[15]、吴烨[16]的结果相类似,pH值偏离蛋白等电点,肌原纤维蛋白凝胶的保水性增强。
3.4 溶解度分析
经不同方式处理后,鲣鱼MP的溶解度变化如图所示(图3),超声3 min时,蛋白质的溶解度从8.95%(未处理的MP)增加到25.1%(超声3 min),出现明显差异(P<0.05)。而超声3 min并结合酸处理后, MP样品的溶解度为23.4%,与单一超声波处理相比稍微降低但无明显差别(P>0.05),可能是因为pH值接近等电点时,蛋白的溶解度降低,但相比未处理组样品的溶解度还是明显增加。说明超声波结合酸处理在提高肌原纤维蛋白凝胶性的同时也能促进肌原纤维蛋白的溶解,比单一的超声波处理更有优势。
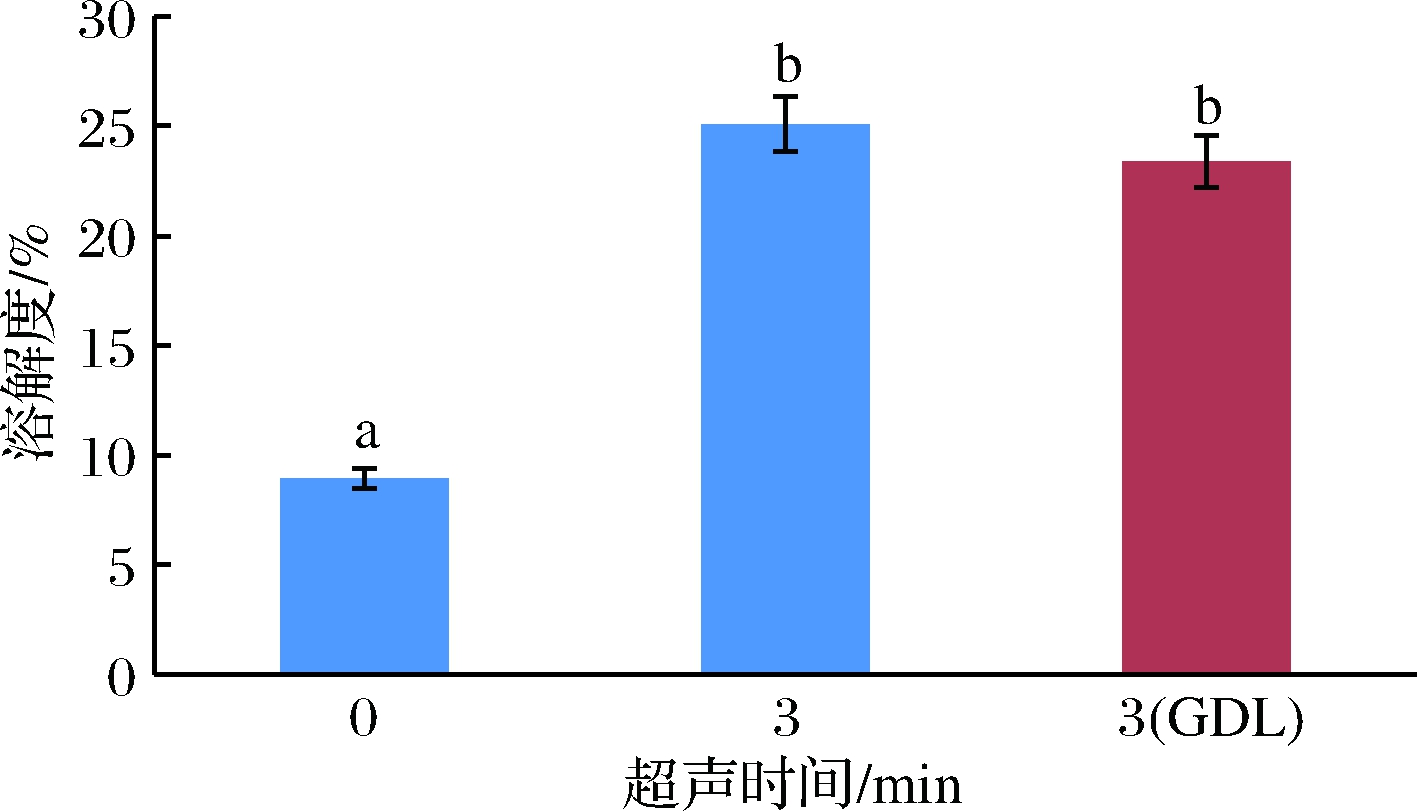
图3 不同处理方式对鲣鱼肌原纤维蛋白溶解度的影响
Fig.3 Effects of different treatment methods on the
solubility of myofibrillar protein of skipjack
4 结论
本实验探究超声波及超声波结合酸处理后鲣鱼肌原纤维蛋白流变性、质构、持水性、溶解度等性质的变化,结果表明:超声波结合酸处理后,明显增强了MP凝胶预备阶段,随着温度的升高,凝胶强化阶段的G′略高于单一超声波处理的样品组;单一超声波处理的肌原纤维蛋白明显降低了质构特性且差异性很显著(P<0.05),超声波结合酸处理后制备的凝胶,凝胶硬度、弹性与原样相比,几乎无明显差别(P>0.05),但凝聚性、咀嚼性呈明显增加(P<0.05);超声波结合酸处理后,样品的持水性与单一超声波处理相比有明显增加,但与未处理组相比偏低。说明随着pH值偏离蛋白等电点,保水性增加;超声波结合酸处理后的样品的溶解度与原样相比明显增加,与单一的超声波处理无明显差别。本文在超声波及超声波结合酸处理对鲣鱼肌原纤维蛋白部分功能性质的影响方面取得了初步的进展,但是仍有许多研究内容需要进一步的深入研究。例如:本文只研究了二次加热法,即先在 40 ℃水浴稳定 1 h,然后再 90 ℃水浴稳定 30 min制备鲣鱼肌原纤维蛋白凝胶,对其凝胶制备的加热条件(时间和温度)有待进一步优化。
参考文献
[1] 姚玉静,杨晓泉,邱礼平,等. 食品蛋白质化学改性研究进展[J]. 粮食与油脂, 2006(7): 10-12
[2] LIU J, RU Q, DING Y. Glycation a promising method for food protein modification:Physicochemical properties and structure, a review[J]. Food Research International, 2012, 49(1):170-183.
[3] FU X, HAYAT K, LI Z, et al. Effect of microwave heating on the low-salt gel from silver carp (Hypophthalmichthys molitrix) surimi[J]. Food Hydrocolloids, 2012, 27(2): 301-308.
[4] ASGHAR A, SAMEJIMA K, YASUI T. Functionality of muscle proteins ingelation mechanisms of structured meat products[J]. CRC Crit Rev Food Sci Nutr,1985,22:27-106.
[5] 徐幸莲. 兔骨骼肌肌球蛋白热诱导凝胶特性及成胶机制研究[D]. 南京:南京农业大学, 2003.
[6] BOYE J I, ALU I, ISMAIL A A, et al. Factors affecting molecular characteristics of whey protein gelation[J].International Dairy Journal,1995, 5(4): 337-53.
[7] KATOH N. A new method for evaluation of the quality of frozen surimi from Alaska pollack: relationship between myofibrillar ATPase activity and kamaboko forming ability of frozen surimi[J]. Nippon Suisan Gakkaishi, 1979, 45(8): 1 027-1 032.
[8] GORNALL A G, BARDAWILL C J, David M M. Determination of serum proteins by means of the biuret reaction[J]. Journal of Biological Chemistry, 1949, 177(2): 751-766.
[9] ZHAO Y Y, WANG P, ZOU Y F, et al. Effect of pre-emulsification of plant lipid treated by pulsed ultrasound on the functional properties of chicken breast myofibrillar protein composite gel[J]. Food Research International, 2014, 58(4): 98-104.
[10] 田金河.高强度超声波辅助制备罗非鱼分离蛋白及其凝胶特性的研究[D].广州:华南理工大学,2015.
[11] 常海霞. 超声波技术对草鱼肌原纤维蛋白营养和结构性质的影响[D]. 南昌:南昌大学, 2015.
[12] 张自业. 盐和超高压处理对肌原纤维蛋白凝胶特性与作用力的影响及调控机理研究[D]. 南京:南京财经大学, 2016.
[13] KOCHER P N, FOEGEDING E A. Microcentrifuge-based method for measuringwater-holding of protein gels [J]. Journal of Food Science, 1993, 58(5): 1 040-1 046.
[14] MCCLEMENTS D J. Advances in the application of ultrasound in food analysis and processing[J]. Trends in Food Science & Technology, 1995, 6(9): 293-299.
[15] FEI Y, HAN M Y, YANG L H, et al, Studies on the secondary structure and heat-induced gelation of pork myofibrillar proteins as affected by pH[J]. Scientia Agricultura Simca, 2010, 43(1): 164-170.
[16] 吴烨,许柯,徐幸莲,等.低场核磁共振研究pH值对兔肌球蛋白热凝胶特性的影响[J].食品科学,2010, 31(9):6-11.