在中国和东南亚地区,鸭蛋的消费量约占蛋制品消耗总量的30%[1],但咸鸭蛋清是食品生产过程中利用咸蛋黄之后产生的下脚料,由于咸度太高等原因,利用受限,常常被丢弃,造成了优质蛋白资源的极大浪费。因此,将咸鸭蛋清合理利用,并使其增值是一个值得研究的课题。蛋白质经脱酰胺改性后,使其中天冬酰胺和谷氨酰胺的酰胺基团转变为羧基,导致其配位基团增多[2]。目前,关于蛋白质脱酰胺的方法主要包括酸法[3]、碱法[4]和酶法[5-6]3种。其中对于酸法脱酰胺的研究较多,且多集中于通过脱酰胺改善蛋白的溶解性、乳化性、起泡性、持水性等功能性质方面的研究[7],而以获得更多钙结合位点为目的,对蛋白进行盐酸法脱酰胺的研究目前尚未见文献报道。
在提高蛋白或多肽携钙能力方面的研究中,对多肽直接进行脱酰胺修饰的研究较多,且研究发现,对肽进行脱酰胺修饰是提高其携钙能力的有效手段,酪蛋白以及大豆肽经脱酰胺修饰所得产物的Ca2+螯合能力明显提高[8-9]。赵宁宁等[10]曾采用谷氨酰胺酶对鸭蛋蛋清肽进行脱酰胺改性,其改性产物的可溶性钙结合量达7.51 mgCa/g肽,相比于未脱酰胺改性的鸭蛋蛋清肽(5.84 mgCa/g肽)提升了21.58%,且通过红外光谱的结果证实鸭蛋清肽中的羧基是Ca2+的有效结合位点。此外,袁兴宇等[11]研究发现,大豆肽与钙的结合位点主要是其肽链中天冬氨酸及谷氨酸上的羧基。脱酰胺反应中,在天冬酰胺和谷氨酰胺转变成天冬氨酸和谷氨酸的过程中,蛋白质链上的羧基不断增多;而体系中的羧基越多(即脱酰胺程度越高),与Ca2+结合的位点越多,从而使其钙结合能力越强。目前对于促钙吸收肽的修饰方面的研究多集中于对多肽直接修饰,而先对蛋白进行脱酰胺改性,再将脱酰胺蛋白酶解制肽,从而提高其产物携钙能力的研究目前尚未见文献报道。
本研究首先用电渗析法[12]使咸鸭蛋清脱盐,再利用盐酸对鸭蛋蛋清蛋白进行脱酰胺处理,并以脱酰胺度为指标,优化了鸭蛋蛋清蛋白的脱酰胺反应条件,得到具有高脱酰胺度的鸭蛋蛋清蛋白。再对脱酰胺蛋清蛋白进行酶解,旨在制得具有高携钙能力的脱酰胺鸭蛋蛋清肽,为咸鸭蛋清的高值化利用提供依据。
1 材料与方法
1.1 材料与试剂
咸鸭蛋清,湖北神丹健康食品有限公司提供;苯酚、亚硝基铁氰化钠、氢氧化钠、次氯酸钠溶液、硫酸铵、浓盐酸、硼酸、浓硫酸、碱性蛋白酶、中性蛋白酶、复合蛋白酶、胰蛋白酶、木瓜蛋白酶、氯化钙、磷酸二氢钠、磷酸氢二钠、钙标准溶液(1 000 μg/mL)、氧化镧、硝酸、高氯酸,以上试剂均为国产分析纯。
1.2 仪器与设备
小型实验用特种电驱动膜分离器,浙江千秋环保水处理有限公司;PB-10 Sartorius标准型pH计,德国赛多利斯股份公司;Prepscale 1.6L超滤设备,美国Millipore公司;截留分子质量为1、3、5、6 kDa的中空卷式再生纤维素膜包(膜面积均为0.09 m2),美国Millipore公司;AA-6300C原子吸收分光光度仪,日本岛津公司;UV-1750紫外可见分光光度计,日本Shimadza公司。
1.3 实验方法
1.3.1 咸鸭蛋蛋清蛋白的提取
参照赵宁宁的方法制备脱盐鸭蛋蛋清蛋白粉,置于干燥皿中备用[10]。
1.3.2 鸭蛋蛋清蛋白的盐酸法脱酰胺处理
将鸭蛋蛋清蛋白分散于一定浓度的盐酸溶液中,配制成蛋白浓度为3%的蛋白分散液,在一定的温度下进行脱酰胺反应。反应结束后,冷却反应液,并用10 mol/L的NaOH溶液调pH至中性,考察盐酸浓度、反应温度和时间等因素对蛋清蛋白脱酰胺度的影响。
1.3.3 脱酰胺度的测定
通过对样品溶液中的游离氨浓度进行测定,进而计算出反应后样品的脱酰胺度。参照文献[8]的实验方法进行测定。
总酰胺含量的测定:参照文献[13]的测定方法。脱酰胺度的计算公式如下:
脱酰胺度/%![]() ×100
×100
(1)
1.3.4 脱酰胺鸭蛋蛋清肽的制备
1.3.4.1 脱酰胺蛋清肽的制备流程
脱酰胺蛋清蛋白粉→按一定料液比加蒸馏水→沸水浴搅拌30 min→冷却后放入恒温水浴磁力搅拌器中→设定温度为所需用酶的最适温度,并调至该酶的最适pH→加一定量的酶→滴加1 mol/L NaOH使酶解过程中pH维持在最适条件,并记录碱消耗量→沸水浴灭酶15 min→冷却后离心(3 800 r/min,15 min)→将上清液旋蒸、冻干得到脱酰胺蛋清肽→测定可溶性钙结合量
以水解度和可溶性钙结合量为指标,考查5种蛋白酶(碱性蛋白酶、中性蛋白酶、复合蛋白酶、胰蛋白酶和木瓜蛋白酶)对脱酰胺蛋清蛋白的酶解效果。5种蛋白酶的最适反应条件(厂家推荐值)见表1。
1.3.4.2 水解度(DH)测定
采用pH-stat法计算水解度:
DH/%![]() ×100
×100
![]() ×B×N×
×B×N×![]() ×
×![]() ×100
×100
(2)
其中,Htot即原料蛋白中的肽键数,对鸭蛋清而言取11.1 mmol/g。
表1 蛋白酶的最适反应条件
Table 1 The optimal reaction conditions of the selected
proteases

1.3.4.3 可溶性钙结合量的测定
将20 mmol/L pH7.8的磷酸缓冲液与5 mmol/L的CaCl2溶液按一定比例混合,在37 ℃下水浴加热15 min生成CaCO3沉淀,再加入一定量的脱酰胺蛋清肽,在37 ℃下恒温2 h,反应结束后冷却,10 000 r/min离心15 min,取4 mL上清液并加入20 mL混合酸(硝酸∶高氯酸=4∶1),在220~250 ℃电热板上加热进行消化,直至消化液清亮,加入5 mL去离子水赶酸。待消化液剩余2~3 mL时,取下冷却,用20 g/L的氧化镧定容到50 mL,用0.22 μm的水系滤器过滤后用原子吸收法测定离子钙含量。
钙标准曲线的测定:将钙标准溶液(1 000 μg/mL)配制成10 μg/mL的钙溶液,再将其分别稀释成质量浓度为2、4、6、8、10 μg/mL的钙溶液,用原子吸收分光光度法进行测定,并绘制标准曲线。
1.3.4.4 不同级分脱酰胺蛋清肽结合钙能力比较
用截留分子质量分别为6 k、5 k、3 k、1 kDa的超滤膜将脱酰胺鸭蛋清蛋白酶解液(正交试验最优条件下制得)分成5个不同分子质量的级分,即>6 kDa、5~6 kDa、<5 kDa、<3 kDa、<1 kDa,旋蒸后冷冻干燥,用原子吸收分光光度法分别测定不同级分的脱酰胺蛋清肽的钙结合能力。
1.4 统计分析
采用SPSS 17.0、WPS表格2016等软件进行实验数据处理,所有的数据都以![]() ±SD表示,采用方差分析法进行显著性分析(显著水平为P<0.05)。
±SD表示,采用方差分析法进行显著性分析(显著水平为P<0.05)。
2 结果与分析
2.1 盐酸法脱酰胺单因素试验
2.1.1 温度对鸭蛋蛋清蛋白脱酰胺度的影响
在蛋白含量为3%,盐酸浓度0.3 mol/L,反应时间为4 h时,考察温度对蛋清蛋白脱酰胺度的影响,结果如图1所示。鸭蛋蛋清蛋白的脱酰胺度随着温度的升高逐渐增大,温度为70~80 ℃时,脱酰胺程度增加缓慢;当温度升到80 ℃以上时,蛋清蛋白的脱酰胺程度增大更加明显。这可能是由于脱酰胺反应涉及天冬酰胺和谷氨酰胺的残基侧链上酰胺基团化学键的断裂[14](脱酰胺),此过程需消耗较高能量,因此,反应温度越高,蛋清蛋白的脱酰胺度越高,该结果与郑建冰等[15]对大米蛋白进行脱酰胺改性的研究结果一致。
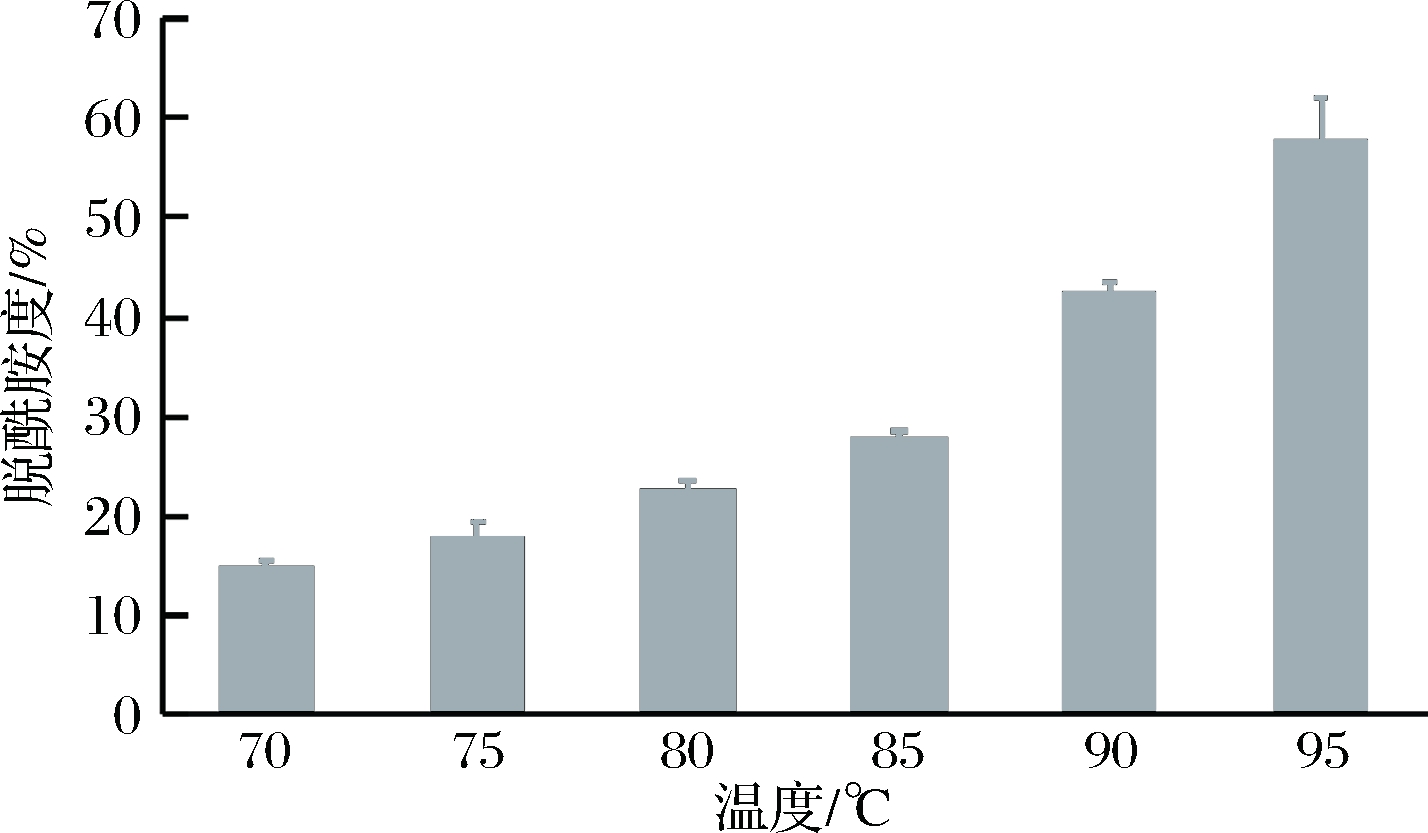
图1 温度对脱酰胺度的影响
Fig.1 The effect of temperatures on the deamidization
degrees
2.1.2 反应时间对鸭蛋蛋清蛋白脱酰胺度的影响
在蛋白含量为3%,盐酸浓度0.3 mol/L,温度70 ℃的条件下,考察反应时间对蛋清蛋白脱酰胺度的影响,结果如图2所示。鸭蛋蛋清蛋白的脱酰胺度随着反应时间的延长呈现先增大再逐渐减小的趋势。当反应时间为2~5 h时,蛋清蛋白的脱酰胺度明显增大,当继续反应达到6、7 h时,脱酰胺度的变化不明显,因此选用反应时间为5 h较为合适。
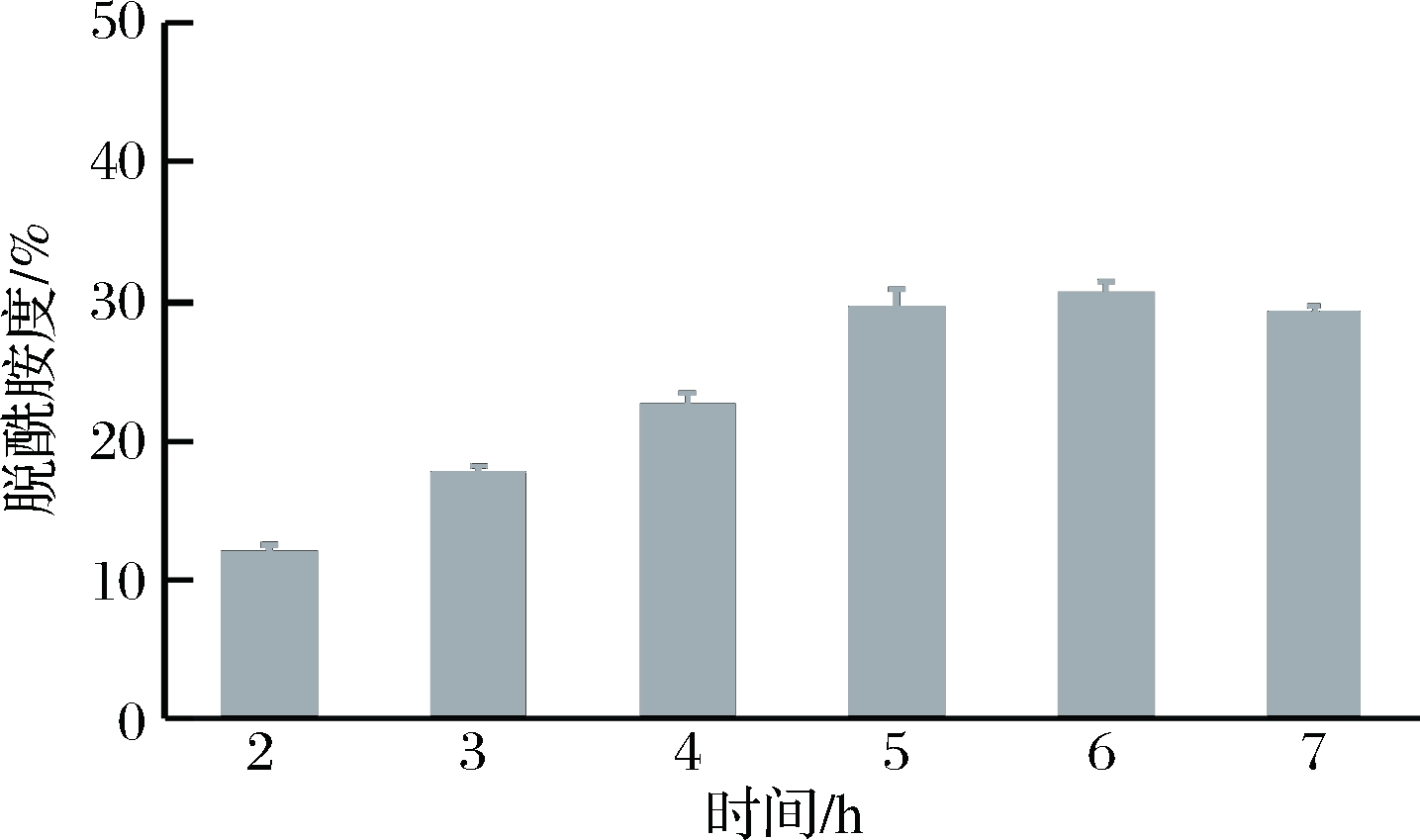
图2 反应时间对脱酰胺度的影响
Fig.2 The effect of reaction time on the deamidization degrees
2.1.3 盐酸浓度对鸭蛋蛋清蛋白脱酰胺度的影响
在蛋白含量为3%,温度70 ℃,反应时间4 h,考察盐酸浓度对蛋清蛋白脱酰胺度的影响,结果如图3所示。鸭蛋蛋清蛋白的脱酰胺度随着盐酸浓度的升高呈现先增大后减小的趋势,盐酸浓度较低时,酰胺基团转化为羧基的数量较少,当盐酸浓度为0.4 mol/L时,脱酰胺度最高,盐酸浓度过高时,脱酰胺度反而下降。这是因为在蛋白脱酰胺的过程中会伴随着肽键的断裂,过高的盐酸浓度除了催化脱酰胺外,同时还会对(主链上)肽键的断裂起到催化作用[16],故使其脱酰胺度不一定增大,该结果与胡庆玲等[17]对小麦面筋蛋白进行盐酸法脱酰胺的研究结果一致。因此,选择盐酸浓度为0.4 mol/L较为合适。

图3 盐酸浓度对脱酰胺度的影响
Fig.3 The effect of hydrochloric acid concentration on
the deamidization degrees
2.2 盐酸脱酰胺正交试验结果分析
在上述单因素试验的基础上,分别以温度、时间和盐酸浓度作为因素变量,设计3因素3水平正交试验,试验设计及结果见表2。
表2 正交试验设计及脱酰胺度
Table 2 Orthogonal test design and the deamidization
degrees
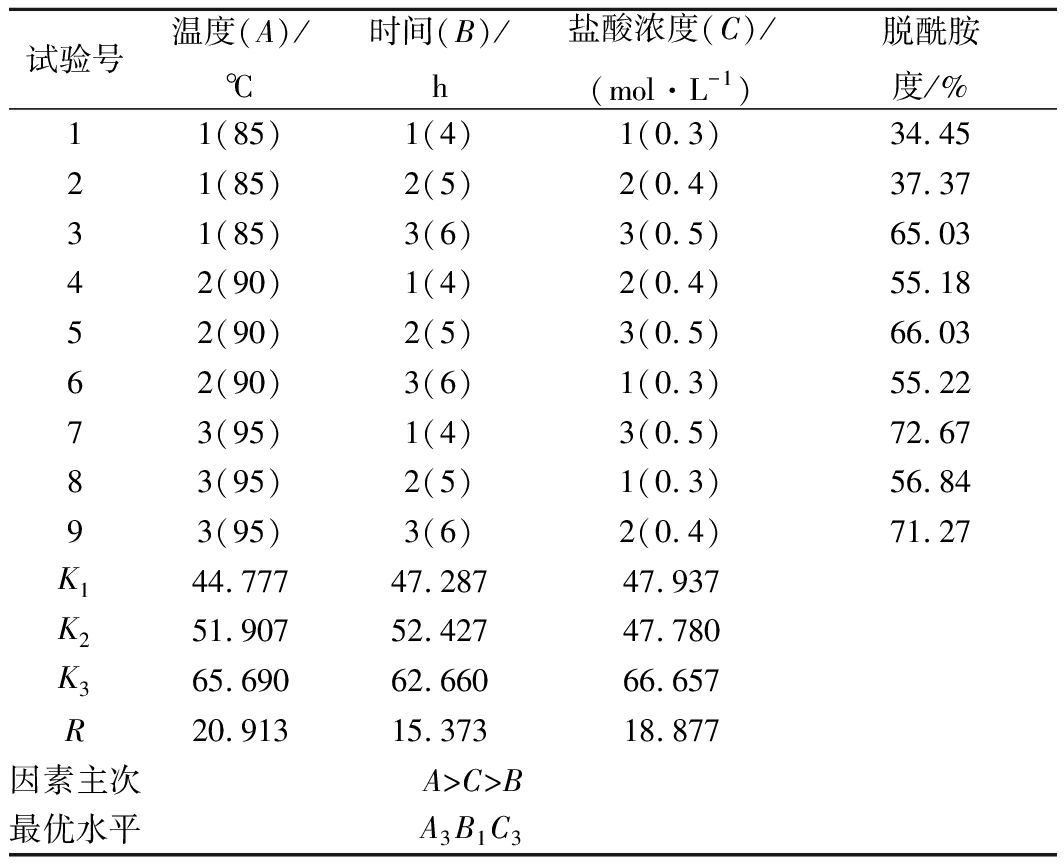
由表2极差分析可知,影响鸭蛋蛋清蛋白脱酰胺的因素主次排序为:温度>盐酸浓度>时间,其中最佳方案为A3B3C3,即脱酰胺温度95 ℃,时间6 h,盐酸浓度0.5 mol/L。在此条件下进行了验证实验,结果表明产物的脱酰胺度为73.77%,鉴于该实验结果与A3B1C3的结果(72.67%)基本相当,且由方差分析结果(表3)可知,反应时间对脱酰胺度无显著性影响,而温度和盐酸浓度对脱酰胺度影响显著(P<0.05),故从节省能源、时间和成本考虑,后续实验选用A3B1C3的实验条件,即脱酰胺温度95 ℃,时间4 h,盐酸浓度0.5 mol/L对蛋清蛋白进行脱酰胺处理。
正交试验的方差分析结果如表3所示:
表3 方差分析表
Table 3 Table of variance analysis
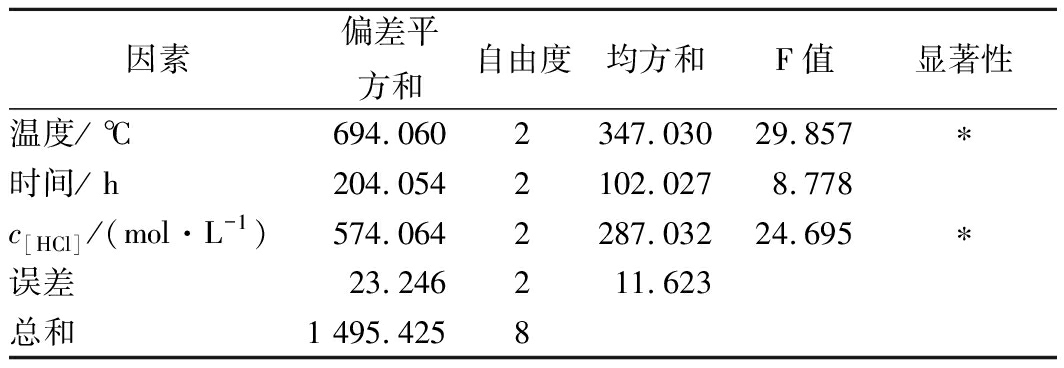
注:F0.05(2,2)=19.00;F0.01(2,2)=99.00
2.3 高携钙能力鸭蛋蛋清肽制备用酶筛选实验
以脱酰胺鸭蛋蛋清蛋白为底物,以可溶性钙结合量和水解度作为测定指标,对促钙吸收鸭蛋蛋清肽制备用酶进行筛选,在五种蛋白酶的最适温度、pH(厂家推荐)以及料液比3%、酶解时间3 h、酶的质量分数为0.3%的反应条件下,比较其酶解效果。由表4可知,就水解度而言,经复合蛋白酶处理后,水解度达11.91%,显著高于其他四种蛋白酶酶解物(P<0.05),而中性蛋白酶和胰蛋白酶的水解度仅有3.95%和3.88%。就可溶性钙结合量而言,经过木瓜蛋白酶处理的脱酰胺鸭蛋蛋清蛋白水解物其可溶性钙结合量达8.68 mgCa/g肽,显著高于其他四种蛋白酶酶解物(P<0.05);而水解度较高的碱性蛋白酶和复合蛋白酶的可溶性钙结合量均较低,仅为2.06%和3.56%,这说明蛋白水解物的促钙吸收活性与水解度并非呈正相关的关系。本研究以制备高携钙能力蛋清肽为主要目的,以可溶性钙结合量作为考虑的主要指标,综合考虑最终选木瓜蛋白酶为本实验用酶。
表4 五种蛋白酶酶解效果的比较
Table 4 Comparison of the duck egg white hydrolyzed by
different proteases

注:组内相同字母代表差异不显著(P>0.05),不同字母代表差异显著(P<0.05)。
2.4 酶解单因素试验
2.4.1 酶的质量分数对酶解脱酰胺鸭蛋蛋清蛋白的影响
在木瓜蛋白酶最适温度50 ℃、最适pH 6.5以及料液比3%、酶解时间为3 h时,考察酶的质量分数对脱酰胺鸭蛋蛋清蛋白酶解效果的影响,结果如图4所示,随着酶的质量分数的增加,水解度不断增大;而可溶性钙结合量先增大,在酶的质量分数为0.3%时达到最大,之后又逐渐降低。这可能是由于酶的质量分数继续增加,使适合螯合钙离子的肽段进一步水解,故可溶性钙结合量呈下降趋势。因此,酶解条件宜选酶的质量分数为0.3%。

图4 酶的质量分数对酶解脱酰胺蛋清蛋白的影响
Fig.4 Effects of quality fraction of enzyme on the enzymo-
lysis of the deamidization duck egg white
2.4.2 料液比对酶解脱酰胺蛋清蛋白的影响
当pH为6.5、酶解温度为50 ℃、酶的质量分数为0.3%、酶解时间为3 h时,考察料液比对脱酰胺鸭蛋蛋清蛋白酶解效果的影响,结果如图5所示,随着料液比的增加,水解度先快速增加,后缓慢增加;可溶性钙结合量先增大,在料液比为4%时达到最大,之后又迅速降低。由图5可知,水解度与可溶性钙结合量并非呈完全的正相关关系。因此,料液比选4%为宜。
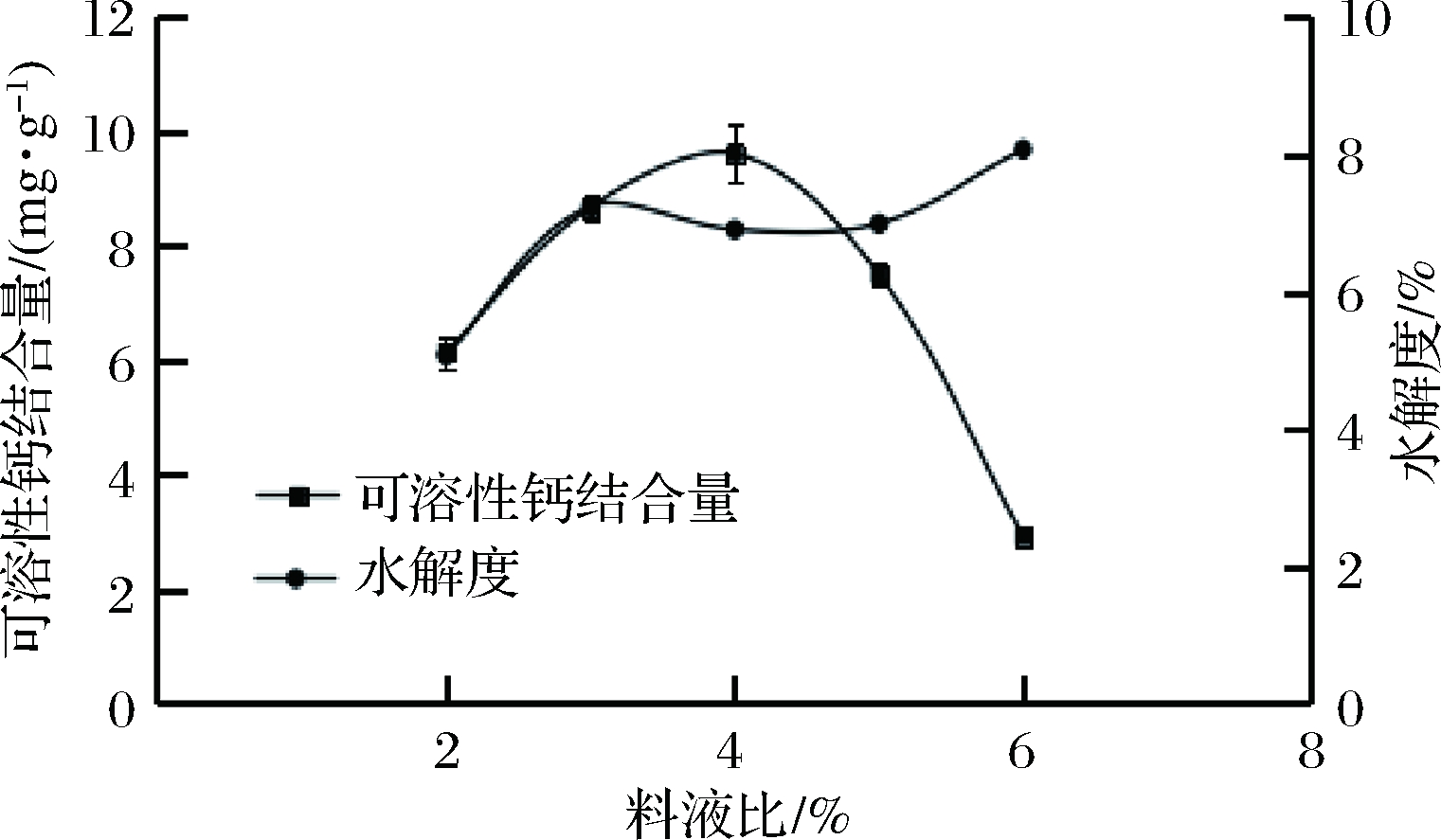
图5 料液比对酶解脱酰胺蛋清蛋白的影响
Fig.5 Effects of substrate concentration on the enzymolysis
of the deamidization duck egg white
2.4.3 酶解时间对酶解脱酰胺鸭蛋蛋清蛋白的影响
当pH为6.5、温度为50 ℃、料液比为3%、酶的质量分数为0.3%时,考察酶解时间对脱酰胺鸭蛋蛋清蛋白酶解效果的影响,结果如图6所示,随着酶解时间的增加,水解度先增加,在3 h后基本不变;而可溶性钙结合量先增大,在3 h时达到最大,之后逐渐下降。其原因可能为随着酶解时间的增加,底物蛋白中先不断释出高钙结合能力的肽段,使得可溶性钙结合量增加。继续酶解又将合适的肽段降解,导致可溶性钙结合量反而降低,因此,酶解时间选3 h为宜。
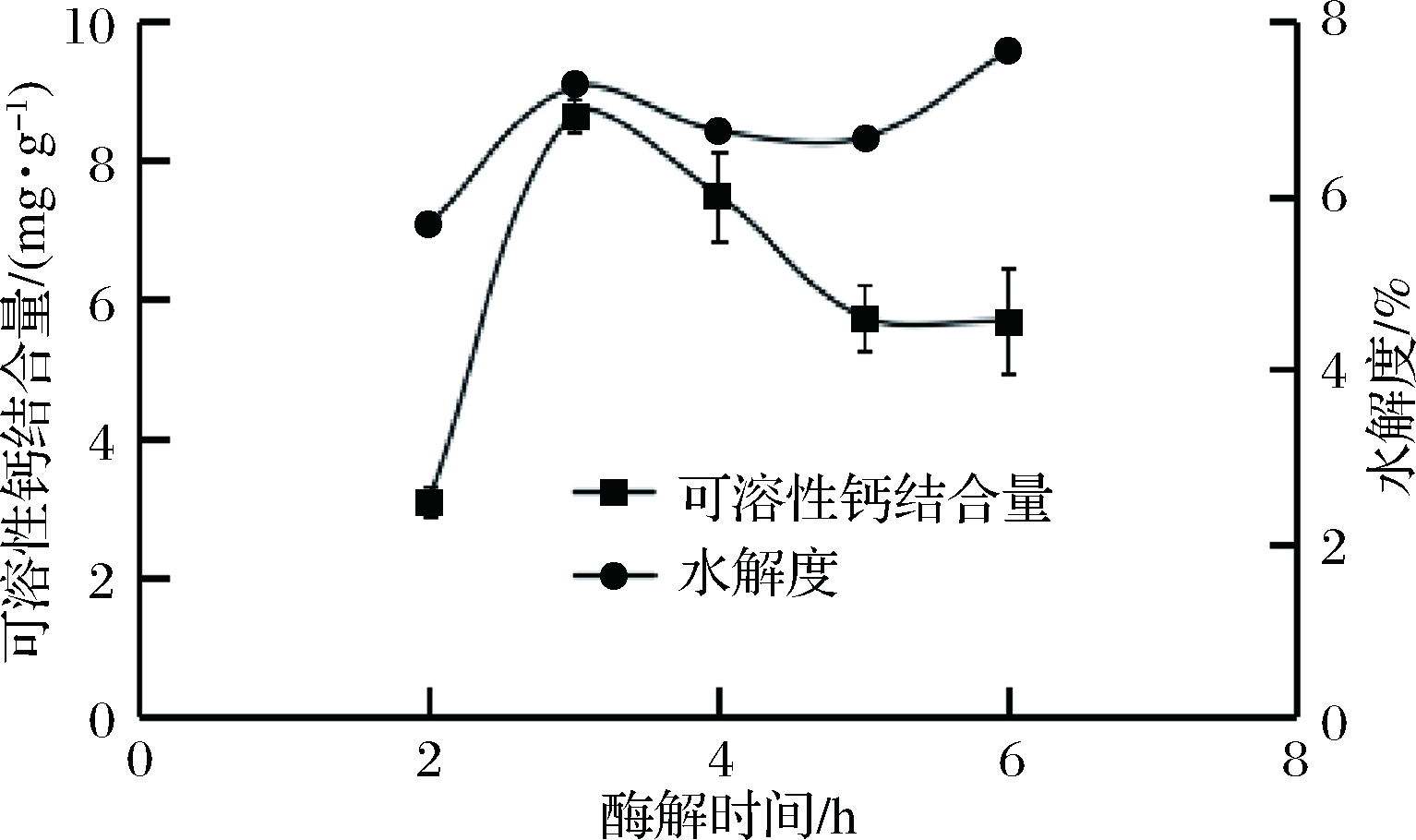
图6 酶解时间对酶解脱酰胺蛋清蛋白的影响
Fig.6 Effects of hydrolysis time on the enzymolysis of the
deamidization duck egg white
2.5 酶解正交试验结果
在酶解单因素试验的基础上,分别以酶的质量分数、料液比和酶解时间作为因素变量,设计3因素3水平正交试验,试验设计及结果见表5。
表5 酶解正交试验设计
Table 5 Enzymolysis orthogonal test design
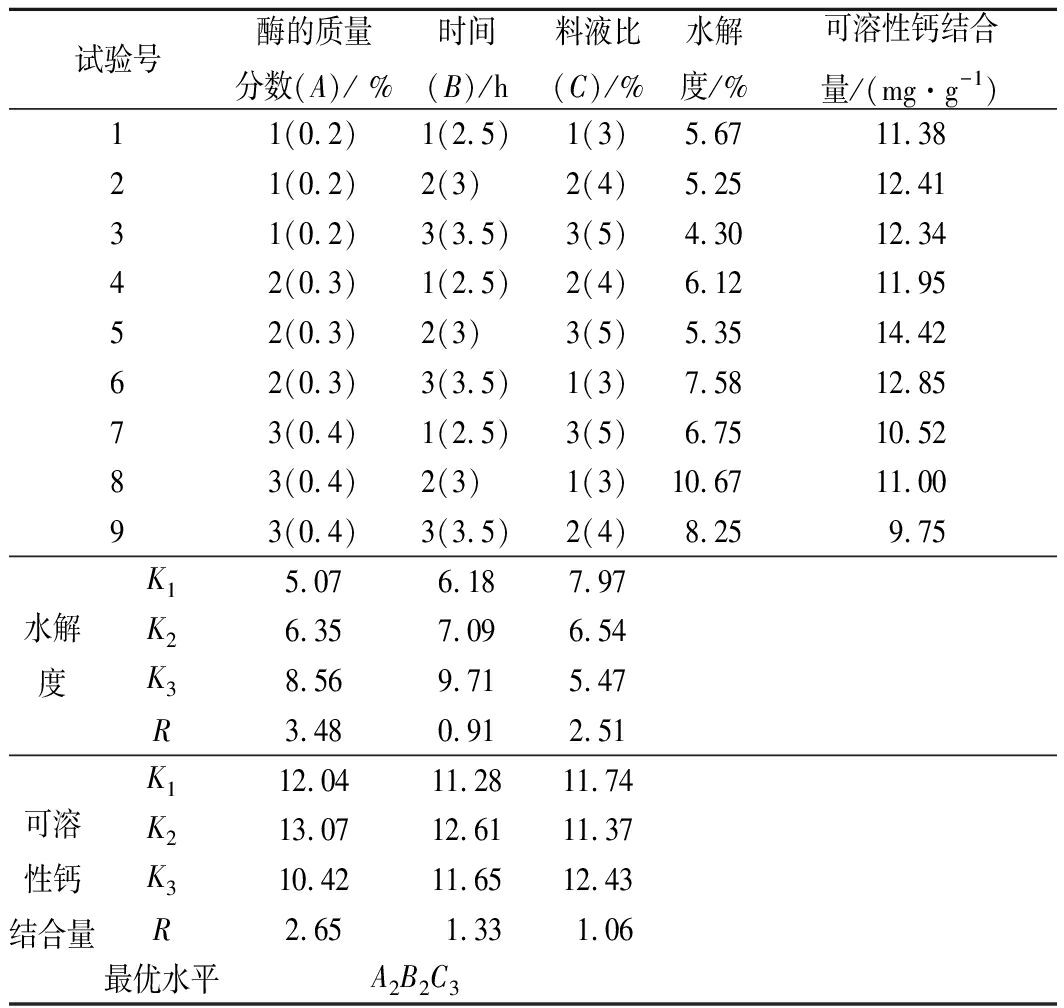
由表5极差分析结果可知,就水解度而言,影响其大小的因素依次为A>C>B,最佳工艺为A3B2C1;影响可溶性钙结合量大小的因素依次为A>B>C,最佳酶解工艺为A2B2C3。由方差分析结果(表6)可知,就水解度而言,时间和料液比的影响均不显著,而酶的质量分数对水解度的影响显著(P<0.05);对可溶性钙结合量而言,酶解时间和料液比对酶解效果的影响均显著(P<0.05),而酶的质量分数对可溶性钙结合量有极显著影响(P<0.01)。综上,制备高携钙能力鸭蛋蛋清肽的最佳酶解条件为A2B2C3,即脱酰胺蛋清蛋白酶解温度50 ℃、pH 6.5、料液比5%、酶的质量分数0.3%、酶解时间3 h。在此条件下,得到的脱酰胺鸭蛋蛋清肽携钙能力最强,此时水解度为5.35%,可溶性钙结合量为14.42 mgCa/g肽。
正交试验的方差分析结果见表6。
表6 酶解正交试验方差分析表
Table 6 Variance analysis of enzymolysis orthogonal test
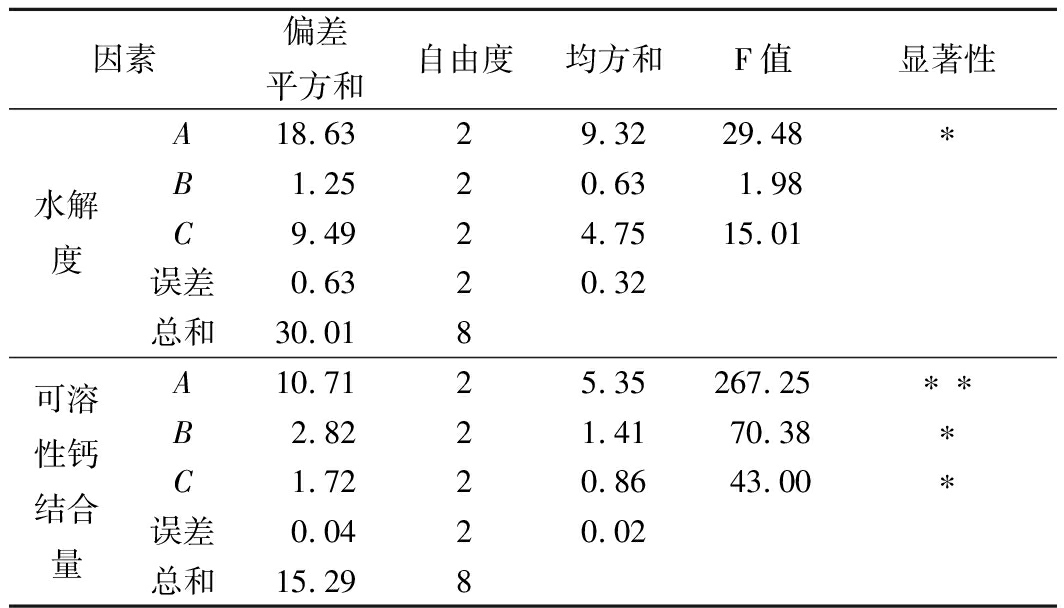
注:F0.05(2,2)=19.00;F0.01(2,2)=99.00
2.6 不同级分脱酰胺蛋清肽结合钙能力比较
由图7可知,与未分级的脱酰胺蛋清肽比较,分子质量<3 k和<1 k的级分,其钙结合能力均增强,且分子质量较小的级分(分子质量<1 kDa)其钙结合能力更高,可溶性钙结合量达14.93 mgCa/g肽;而高分子质量级分(分子质量>6 kDa、5~6 kDa)的可溶性钙结合量均显著低于未经分级肽。该结果提示,短链肽更易与Ca2+结合,这可能是由于短链肽的空间位阻较小,且与钙的配位基团增多,从而导致其具有较高的携钙能力。
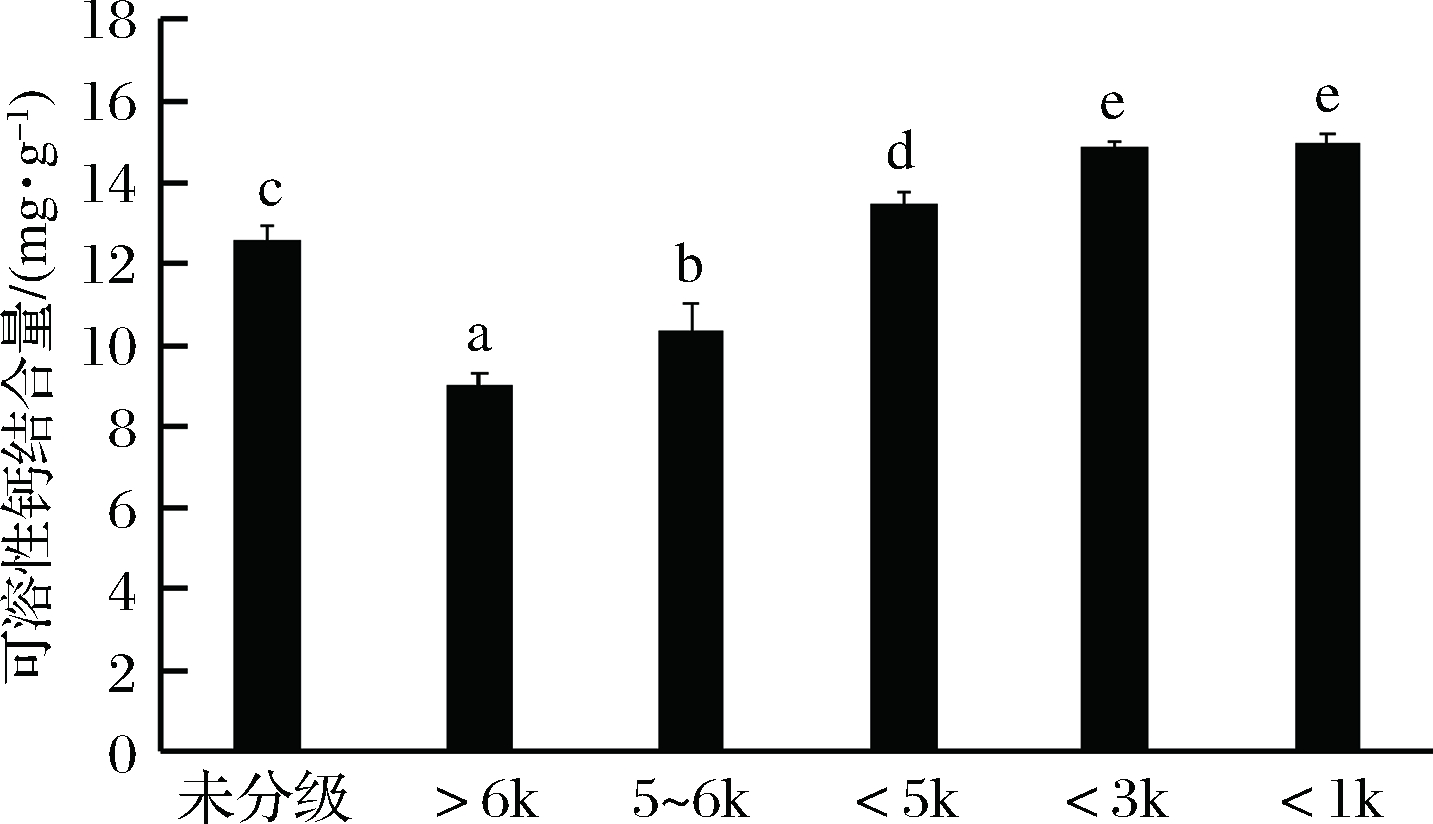
图7 不同级份脱酰胺蛋清肽可溶性钙结合量比较
Fig.7 Calcium-binding ability of different ultrafiltration
fractions from deamidization DPs
注:组内相同字母代表差异不显著(P>0.05),
不同字母代表差异显著(P<0.05)
3 结论与讨论
通过盐酸对鸭蛋蛋清蛋白脱酰胺单因素以及正交试验,确定了盐酸法脱酰胺的最适条件为:温度95 ℃,反应时间4 h,盐酸浓度0.5 mol/L,在此条件下制备出的脱酰胺鸭蛋蛋清蛋白的脱酰胺度高达72.67%。
经筛选后从5种蛋白酶中选出木瓜蛋白酶为本实验用酶,通过单因素以及正交试验,确定了脱酰胺鸭蛋蛋清蛋白的酶解条件为:温度50 ℃、pH 6.5、料液比5%、酶的质量分数0.3%、酶解时间3 h。在此条件下,得到的脱酰胺鸭蛋蛋清肽水解度为5.35%,可溶性钙结合量为14.42 mgCa/g肽。经过超滤分级后,发现分子量小的级分其钙结合能力更强。
在前期进行蛋白质脱酰胺的预实验中,我们分别采用有机酸(柠檬酸)、盐酸以及酶法(谷氨酰胺酶)3种方法进行脱酰胺,结果发现盐酸法、柠檬酸法的脱酰胺度高于酶法,且盐酸法得率高于柠檬酸法,并且其成本较低,故本实验的脱酰胺方法选择了盐酸法。与赵宁宁用酶法对鸭蛋蛋清肽进行脱酰胺所得产物的钙结合能力(7.51 mgCa/g肽)相比,经盐酸法脱酰胺的鸭蛋蛋清蛋白再酶解制肽,其可溶性钙结合能力又有显著提高。廉雯蕾等[18]曾采用盐酸法对米蛋白先进行脱酰胺再酶解所得产物具有较高亚铁螯合能力,这是其螯合能力提高的佐证。分析其可能的原因是:盐酸法脱酰胺与酶法脱酰胺相比,反应条件更加剧烈,能够获得更高的脱酰胺度,即能产生更多的Ca2+结合位点——羧基;另外,先将蛋白酶解成肽,再进行脱酰胺处理时,会使某些溶解性不够高的未被酶解的蛋白在离心过程中被沉淀除去,从而导致脱酰胺作用靶点减少;而本实验对蛋白先进行脱酰胺再酶解制肽,使其脱酰胺位点增多,且蛋白质在脱酰胺的过程中,盐酸也会使部分蛋白链上发生断键,使蛋白质链变短,更利于后期酶解反应的进行。综上所述,本实验所采用的先对蛋白质进行脱酰胺处理,再进行酶解的方法可使鸭蛋蛋清肽的可溶性钙结合量大幅提高(P<0.05),为今后提高蛋白水解物——肽的携钙能力拓展了新的方法。
参考文献
[1] PINGEL H.Waterfowl production for food security[J].Lohmann Information,2011:32-42.
[2] LI X,COURNOYER J J,LIN C,et al.Use of 18O labels to monitor deamidation during protein and peptide sample processing[J].Journal of the American Society for Mass Spectrometry,2008,19(6):855-864.
[3] 仇超颖,廖兰,崔春,等.琥珀酸脱酰胺对小麦面筋蛋白酶解特性的影响[J].食品工业科技,2010,31(8):74-77.
[4] 李传雯,袁江兰,柳旺,等.大米谷蛋白碱法脱酰胺条件优化[J].食品科技,2016,37(10):143-146.
[5] 刘永乐,王发祥,周小玲,等.酶法脱酰胺对米谷蛋白分子微观结构的影响[J].食品科学,2011,32(17):69-71.
[6] ZHAO M,JING Z,ZHAO Y,et al.Deamidization and double enzyme synergetic hydrolysis increasing hydrolysis effeciency of wheat gluten[J].Transactions of the Chinese Society of Agricultural Engineering,2016.DOI:10.13982/j.mfst.1673-9078.2016.3.029.
[7] 易翠平,姚惠源.大米浓缩蛋白脱酰胺研究(II)酸法脱酰胺改性对大米蛋白功能特性及营养性质的影响[J].食品科学,2005,26(3):79-83.
[8] 李丹,赵新淮.酪蛋白的谷氨酰胺酶水解及其产物的金属离子螯合能力[J].食品与发酵工业,2010,36(11):21-25.
[9] 包小兰,郭顺堂,焉华娟,等.脱酰胺化对大豆蛋白水解物可溶性钙结合量的影响[J].农产品加工(学刊),2006(8):63-66.
[10] 赵宁宁.脱盐咸鸭蛋清促钙吸收肽的制备、修饰及增加骨密度作用研究[D].武汉:华中农业大学,2014.
[11] 袁兴宇,冯文君,包小兰.脱酰胺对葵花籽蛋白酶解肽的钙结合量及体外消化性的影响[J].中国粮油学报,2017,32(10):73-77.
[12] 董华伟,何慧,陈伯雍,等.电渗析脱盐对咸鸭蛋蛋清理化性质的影响[J].食品科学,2013,34(7):129-134.
[13] WAGNER J R,GUEGUEN J.Effects of dissociation,deamidation, and reducing treatment on structural and surface active properties of soy glycinin[J].Journal of Agricultural & Food Chemistry,1995,43(8):1 993-2 000.
[14] 李小艳,李高阳,任国谱.小麦面筋蛋白脱酰胺改性研究进展[J].食品工业科技,2014,35(8):390-393.
[15] 郑建冰,王立,易翠平,等.大米蛋白酸法脱酰胺改性及对蛋白性质的影响[J].食品工业科技,2007,28(2):102-105.
[16] KATO A,TANAKA A,MATSUDOMI N,et al.Deamidation of food proteins by protease in alkaline pH[J].Journal of Agricultural & Food Chemistry,1987,35(2):224-227.
[17] 胡庆玲.脱酰胺对小麦面筋蛋白酶解敏感性及产物特性的影响[D].广州:华南理工大学,2014.
[18] 廉雯蕾,王韧,王莉,等.酸法脱酰胺结合酶解制备米蛋白肽及其与亚铁螯合工艺研究[J].中国粮油学报,2016,31(7):58-63.