红葡萄酒的酿造过程主要由酵母菌完成的酒精发酵(alcoholic fermentation, AF)和乳酸菌主导的苹果酸-乳酸发酵(简称苹乳发酵,Malolactic fermentation, MLF)两部分组成。MLF是AF结束后,在乳酸菌的作用下将酒中的二元酸L-苹果酸脱羧降解为一元酸L-乳酸和CO2而启动的二次发酵[1-2]。MLF能够降低葡萄酒的酸度,使新(生)葡萄酒的粗糙、酸涩等特征消失,酒体变得圆润、柔和,同时还会通过乳酸菌自身的代谢活动释放挥发性香气,改善葡萄酒的风味,提高葡萄酒的质量[3-5]。
在AF结束后,酒体较高的酒精度、较低的pH值与残糖量使乳酸菌发酵受到抑制,发酵周期延迟,故在发酵结束时由MLF产生的酯等风味物质含量减少,降低葡萄酒的风味质量[6];另外,在AF结束后,酒体中存在的噬菌体也会造成MLF推迟或被抑制,腐败菌发酵产生异香和异味,导致葡萄酒病害的发生[7-8]。
植物乳杆菌是葡萄酒中进行MLF常见的乳酸菌之一,由于植物乳杆菌可以在葡萄酒高酒精含量、低pH值、高温等苛刻的条件下生长,具有潜在启动MLF的能力,成为近几年研究的新一代可以代替酒类酒球菌的理想的MLF发酵剂[9-10]。本文通过对比分析于酒精发酵不同时间接入植物乳杆菌时,酵母和乳酸菌混合发酵对葡萄酒发酵周期和风味物质的影响,确定接入植物乳杆菌的最佳时间,从而提高葡萄酒的风味质量。
1 材料与方法
1.1 材料、试剂及仪器
1.1.1 菌株
本实验室保藏的葡萄汁酵母(Saccharomyces uvarum)编号为WY1;由实验室从玫瑰香葡萄中筛选得到的植物乳杆菌(Lactobacillus plantarum)编号为ZL1。无营养缺陷标记。
1.1.2 培养基
YEPD培养基:蛋白胨20 g/L,葡萄糖20 g/L,酵母粉10 g/L,pH自然,115 ℃灭菌20 min。
MRS培养基:葡萄糖20 g/L,酵母浸粉4 g/L,MgSO4·7H2O 0.2 g/L,MnSO4·4H2O 0.05 g/L,胰蛋白胨15 g/L,醋酸钠5 g/L,牛肉膏5 g/L,柠檬酸铵2 g/L,吐温-80体积分数为0.1%,调节pH至4.8左右,121 ℃灭菌20 min。
发酵培养基:葡萄汁糖质量浓度为210 g/L。
1.1.3 仪器及试剂
FA2004电子天平,上海精密科学仪器有限公司;LRH-150生化培养箱,上海一恒科技有限公司;IS-RDS3恒温摇床,上海制成仪器制品有限公司;YXQ-LS-75SⅡ高压灭菌锅,上海博讯实业有限公司;7890A气相色谱仪,北京安捷伦科技有限公司;1100LC高效液相色谱仪,美国Agilent公司;L-苹果酸试剂盒(Megazyme),爱尔兰Megazyme公司。
1.2 实验方法
1.2.1 种子液培养
酵母:一级种子培养液,挑取1环酵母接种于装有5 mL YEPD试管;二级种子培养液,将一级种子按5%(V/V)接到装有50 mL YEPD液体培养基的三角瓶中,30 ℃,180 r/min,至细胞浓度2.0×109CFU/mL。
植物乳杆菌:一级种子培养液,挑取1环植物乳杆菌于装有MRS培养基中培养至对数末期;二级种子培养液,以5%(V/V)接种量接种于50 mL培养基中,37 ℃静置培养至细胞浓度1.2×107 CFU/mL。
1.2.2 葡萄酒发酵
用蔗糖调节葡萄汁初糖浓度至210 g/L,用酒石酸调节pH至 3.51,SO2添加量为80 mg/L;将酵母种子培养液按5%(V/V)接种量接入装有190 mL葡萄汁的250 mL三角瓶中,25 ℃生化培养箱中发酵,在酒精发酵第1天、第2天…第5天分别以5%(V/V)接种量接入植物乳杆菌ZL1。每1天的发酵做3个平行试验。
1.3 分析方法
1.3.1 发酵速率的测定
CO2失重法:发酵过程中每隔24 h称重并记录数据,计算发酵瓶累积失重量(即CO2的释放量)。然后以发酵瓶累积失重为纵坐标,发酵时间为横坐标,绘制发酵速率曲线。
1.3.2 L-苹果酸含量测定
L-苹果酸试剂盒(Megazyme)检测:准备2个干净试管,1根试管加入2.1 mL的蒸馏水(空白对照),另外1根加入2 mL的蒸馏水和0.1 mL的发酵液(稀释F倍),分别依次加入0.1 mL的溶液1(缓冲液)、0.1 mL的溶液2(NAD+/PVP)和0.02 mL的溶液3 (草酰乙酸氨基转移酶),混匀后反应3 min,在335 nm波长处,用1 cm比色皿测定样品吸光度A1,分别加入0.02 mL的溶液4(L-苹果酸脱氢酶),混匀后反应3 min,在相同条件下测定样品吸光度A2。
ρ(L-苹果酸)/(g·L-1)=0.498 0×(A2-A1)×F
(1)
1.3.3 pH值的测定
应用酸度计检测发酵后发酵液的pH值。
电极活化:第1次使用或长期停用的酸度计电极,使用前在饱和的氯化钾溶液中浸泡24 h,对电极进行活化。
标定:用蒸馏水清洗电极,插入已配好的pH值为6.86的缓冲溶液中,调节仪器使显示读数与该缓冲溶液当时温度下的pH值相一致,然后用蒸馏水清洗电极后,插入pH值为4.01的标准缓冲溶液中,调节仪器使显示读数与标准缓冲溶液当时温度下的pH值相一致。
样品测定:蒸馏水清洗电极后用发酵液清洗2~3次,将电极插入发酵液中,玻璃棒搅拌溶液,在显示屏上读出发酵液的pH值。
1.3.4 酒精度的测定
应用酒精比重计法测定发酵后葡萄酒的酒精度:准确量取100 mL发酵液于1 000 mL的蒸馏瓶中,并同时加入等量的蒸馏水置于电炉上蒸馏,接入冷凝管,用冰浴的量筒收集100 mL馏出液后,测定酒精度和相应温度,然后换算成20 ℃时的酒精度[11]。
1.3.5 还原糖的测定
斐林试剂法测定发酵液中还原糖的含量:
斐林试剂标定:吸取斐林试剂液(0.1 g/mL NaOH溶液)、乙液(0.05 g/mL CuSO4溶液)各5 mL,置于150 mL三角瓶中,准确加入10 mL蒸馏水,摇匀,待加热至沸腾后,用1 g/L标准葡萄糖溶液滴定至蓝色或紫红色消失,记下滴定葡萄糖溶液的体积。
样品测定:吸取斐林甲、乙溶液各5 mL于150 mL三角瓶中,加入1 mL样品稀释液和9 mL蒸馏水,其余操作同上。还原糖含量按公式(2)计算。
![]()
(2)
式中:X,样品中还原糖的含量,g/L;V0,空白液消耗标准葡萄糖溶液的体积,mL;V,样品稀释液消耗标准葡萄糖溶液的体积,mL;ρ,标准葡萄糖溶液的质量浓度,g/L;n,样品稀释倍数;Vs,所取试样稀释液体积,mL。
1.3.6 风味物质的测定[6]
高效气相色谱法:葡萄酒发酵液经蒸馏后采用气相色谱法测定。内标物为乙酸正戊酯;色谱柱19091N-213:30 m×320 μm×0.5 μm,配FID检测器;载气为高纯氮,流速2.5 mL/min。初始柱温50 ℃,保持2 min,以5 ℃/min的升温速度升至80 ℃,保持2 min,最后以10 ℃/min的升温速度升至100 ℃。检测器温度为250 ℃,进样口温度为230 ℃,进样量0.4 μL,分流比20∶1。
1.3.7 有机酸的测定
高效液相色谱法:葡萄酒发酵液经0.22 μm的纤维滤膜过滤后用高效液相色谱测定。色谱柱为Bio-Rad HPX-87H,300 mm×7.8 mm;检测器为示差折光检测器(RID);流动相为5 mmol/L硫酸,流速为0.6 mL/min;检测器温度为45 ℃,柱温为65 ℃,进样量为20 μL。
1.3.8 数据统计与分析
实验取3次重复试验平均值,数据以(平均值±标准差)形式表示,P<0.05表示差异有显著性;并使用Origin 8.5和Excel分别进行图和表的绘制。
2 结果与分析
2.1 发酵速率测定
发酵过程中每隔24 h称重并记录数据,计算CO2累积失重量(即发酵瓶累积失重量)。然后以CO2累积失重为纵坐标,发酵时间为横坐标,绘制发酵速率曲线(如图1)。

图1 不同接菌时间下发酵速率比较
Fig.1 Comparison of fermentation speed of different
timing of bacterial inoculation
由图1可知,随着接种植物乳杆菌时间的延后葡萄酒发酵速率逐渐变慢,第1天接入植物乳杆菌时,葡萄酒发酵速率远远快于其他接菌时间的发酵速率,其中未加植物乳酸菌时发酵速率最慢(P<0.05)。因此,选择在发酵第1天接入植物乳杆菌使酵母乳酸菌混合发酵,葡萄酒的发酵速率最快。
2.2 L-苹果酸的变化趋势
L-苹果酸是葡萄酒产生强烈辛酸味的重要组分,且L-苹果酸在葡萄酒发酵期间的变化是衡量苹乳发酵是否完成的重要标准[12],应用L-苹果酸试剂盒(Megazyme)检测发酵期间各发酵液中L-苹果酸的含量,结果见图2。

图2 不同接菌时间对葡萄酒中L-苹果酸的影响
Fig.2 Effect of different timing of bacterial inoculation
on the L-malic acid
由图2看出,在葡萄酒发酵过程中,随着接菌时间的延后,L-苹果酸含量下降逐渐变慢,其中于第1天接入植物乳杆菌时,发酵液中L-苹果酸含量降解速率最快(P<0.05),在第15天,即可将发酵液的苹果酸含量由最初的5.40 g/L降到1.30 g/L左右;而在第4天和第5天接入植物乳杆菌时,发酵液的L-苹果酸含量在第30天降到2.35 g/L左右。随着接入植物乳杆菌时间的延后,酵母AF产生的酒精量逐渐增加,残糖量逐渐减少,pH值逐渐降低且酵母此时的发酵活力远远高于植物乳杆菌接入时的活力,这些条件都会对植物乳杆菌的发酵产生抑制,使MLF周期延长,L-苹果酸降解速率变慢。由此可知在葡萄酒发酵第1天加入植物乳杆菌进行发酵,可以更好地发挥MLF的作用,加快发酵速率,缩短发酵周期。
2.3 残糖量和酒精度的测定
按方法1.3测定发酵后各发酵液的残糖、酒精度和pH值,结果如表1。
表1 不同接菌时间发酵性能比较
Table 1 Comparison of fermentation performances of yeast strains

在第1天至第4天接入植物乳杆菌的发酵液与未加植物乳杆菌的发酵液相比残糖量和酒精度含量偏低,其中第1天接菌的酒样残糖量与酒精度最低(P<0.05)。酵母AF主要是一个耗糖的过程,而植物乳杆菌发酵除了降解苹果酸,也会在无氧条件下消耗一部分糖而生成乳酸,在第1天接入植物乳杆菌时,受酵母发酵的影响较小,菌活性较高、发酵能力强,因此消耗的糖分较多,进而使得酵母AF后产生的酒精含量偏低。同时通过测定各发酵液的pH值发现,加入植物乳杆菌发酵与不加植物乳杆菌发酵相比,发酵液的pH值明显提高(P<0.05)。加入植物乳杆菌进行MLF,将酸性尖锐的苹果酸转变为酸味柔和的L-乳酸,该过程1 g的苹果酸生成0.67 g乳酸,发酵液的pH值升高。在第1天至第5天分别加入植物乳杆菌的酒样中,发酵液的pH值由大变小,随着AF的进行,发酵液酒精度逐渐升高,残糖量逐渐变小,此时加入的植物乳杆菌发酵受抑制,使MLF的降酸效果变差。
2.4 有机酸的测定
使葡萄酒具有酸性特征的有机酸类是葡萄酒的主要组分,有机酸类的性质及其浓度调节着发酵液的“酸碱平衡”,影响葡萄酒的口感、色泽及生物稳定性,进而影响葡萄酒的质量。对于红葡萄酒来说,总酸量低,则酒体柔和、圆润,相反总酸量高,则酒体粗糙,酸涩[13-14]。发酵后各发酵液中有机酸的含量测定结果见表2。
表2 不同接菌时间发酵液中有机酸的含量
Table 2 Effect of different timing of bacterial inoculation on the organic acid
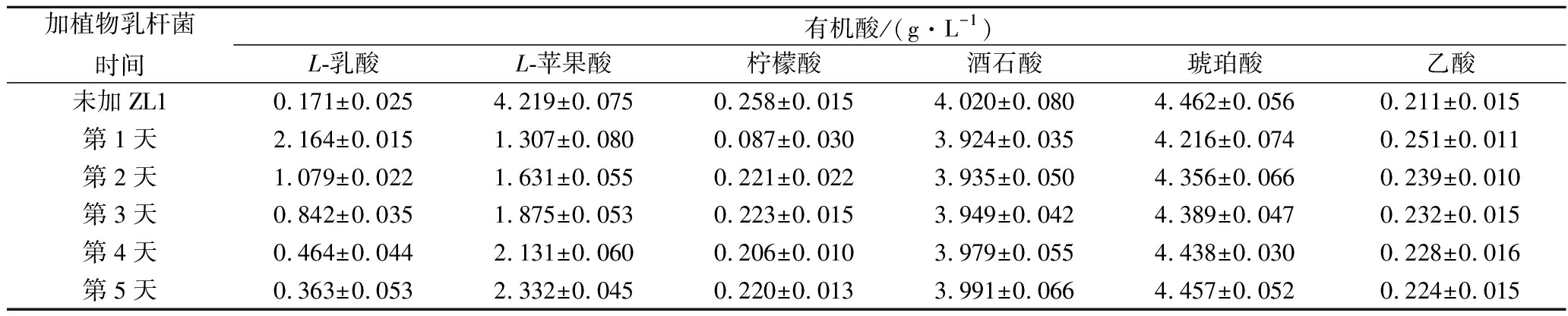
由表2看出,与未加ZL1菌相比,在MLF后:苹果酸、柠檬酸明显下降,其中第1天加入植物乳杆菌,发酵后两者含量下降最多(P<0.05);酒石酸和琥珀酸略有下降,第1天加入植物乳杆菌发酵后发酵液中酒石酸和琥珀酸变化最大(P<0.05);乙酸含量略有增加(P<0.05)。MLF主要是在植物乳杆菌的作用下将具有强烈辛酸味的二羟基酸-苹果酸分解成酸味柔和的单羟基酸-乳酸,使得MLF后L-苹果酸含量下降,L-乳酸含量上升[13]。
对比未加植物乳杆菌的发酵情况(发酵后L-苹果酸含量为4.219 g/L,柠檬酸含量为0.258 g/L,L-乳酸含量为0.171 g/L),加入植物乳杆菌进行MLF,L-苹果酸和柠檬酸含量降低,L-乳酸含量增加:在第3天、第4天和第5天加入植物乳杆菌时,发酵后L-苹果酸含量分别为1.875、2.131和2.332 g/L,柠檬酸含量分别为0.223、0.206和0.220 g/L,L-乳酸含量分别为0.842、0.464和0.363 g/L,而第1天和第2天加入植物乳杆菌,发酵后L-苹果酸和柠檬酸含量明显降低(P<0.05),L-乳酸含量明显增高(P<0.05)。尤其是在第1天加植物乳杆菌后,发酵后发酵液的L-苹果酸含量为1.307 g/L,柠檬酸含量为0.087 g/L,L-乳酸含量为2.164 g/L。而3种有机酸的酸味强弱的排列次序为苹果酸>柠檬酸>乳酸,故发酵第1天接入植物乳杆菌时,酵母和植物乳杆菌同时发酵,植物乳杆菌受到AF的抑制作用较小使得MLF作用更强,从而对葡萄酒的降酸效果更好。
2.5 风味物质含量的测定
发酵后各发酵液中风味物质的含量,结果见图3。

图3 不同接菌时间的发酵液中风味物质含量的测定
Fig.3 Effect of different timing of bacterial inoculation on
the production of higher alcohols (A) and ester (B)
分别在第1天至第5天接植物乳杆菌进行发酵,发酵液中的高级醇含量逐渐增大,酯含量逐渐变小。其中第1天接入植物乳杆菌进行发酵,发酵后高级醇的含量最低(P<0.05),即正丙醇含量为34.016 mg/L、异丁醇为24.431 mg/L、异戊醇为202.018 mg/L和苯乙醇为12.749 mg/L。高级醇是酵母AF的主要副产物,也是葡萄酒主要的风味物质,而过量的高级醇会给葡萄酒带来异味,并易使人头疼和醉酒。在糖发酵时接入植物乳杆菌,酵母和植物乳杆菌相互竞争,酵母可利用的糖分变少,发酵后高级醇的含量变低;因AF尚未完成,植物乳杆菌发酵受到的抑制作用较小,使得MLF比常规的顺序发酵发酵能力更强,较多的苹果酸降解为乳酸,进而生成乳酸乙酯,尤其是在第1天接入植物乳杆菌时,发酵后乳酸乙酯的含量达到24.313 mg/L,同时乙酸异戊酯的含量也略有提高。酯含量是葡萄酒风味物质的重要来源,较高的酯含量对葡萄酒的风味质量起到非常重要的作用。
3 结论
本研究通过在酒精发酵不同时间接入植物乳杆菌,使酵母和乳酸菌混合发酵,平衡酒精发酵和苹乳发酵的作用,研究其对葡萄酒发酵性能的影响。通过比较发现,加入植物乳杆菌进行发酵,能够降低葡萄酒的酸度,使新(生)葡萄酒的粗糙、酸涩等特征消失,使酒变得圆润、柔和。与常规发酵相比,选择在第1天接入植物乳杆菌,使葡萄汁酵母和植物乳杆菌混合发酵,由于酵母和植物乳杆菌相互竞争,酵母可利用的糖分变少,发酵后高级醇的含量变低,且因AF尚未完成,植物乳杆菌发酵受到的抑制作用较小,使得MLF比常规的顺序发酵发酵能力更强,较多的苹果酸降解为乳酸,进而生成更多的乳酸乙酯,起到了更好的降酸效果。故葡萄汁酵母和植物乳杆菌混合发酵在缩短发酵周期的同时,可提高葡萄酒的风味。
参考文献
[1] GONZ LEZ-ARENZANA L, SANTAMAR
LEZ-ARENZANA L, SANTAMAR A P, L
A P, L PEZ R, L
PEZ R, L PEZ-ALFARO I.Indigenous lactic acid bacteria communities in alcoholic and malolactic fermentations of tempranillo wines elaborated in ten wineries of la rioja (Spain) [J]. Food Research International, 2013,50(1), 438-445.
PEZ-ALFARO I.Indigenous lactic acid bacteria communities in alcoholic and malolactic fermentations of tempranillo wines elaborated in ten wineries of la rioja (Spain) [J]. Food Research International, 2013,50(1), 438-445.
[2] LIU S Q. Malolactic fermentation in wine-Beyond deacidification [J]. Journal of Applied Microbiology, 2002, 92(4): 589-601.
[3] BARTOWSKY E J, BORNEMAN A R. Genomic variations of oenococcus oeni strains and the potential to impact on malolactic fermentation and aroma compounds in wine [J]. Applied Microbiology & Biotechnology, 2011,92(3):441-447.
[4] GAGNÉ S, LUCAS P M, PERELLO M C, et al. Variety and variability of glycosidase activities in an Oenococcus oeni strain collection tested with synthetic and natural substrates [J]. Journal of Applied Microbiology, 2011,110(1): 218-228.
[5] LI N, DUAN J, GAO D, LUO J, ZHENG R, BIAN Y, et al. Mutation and selection of Oenococcus oeni for controlling wine malolactic fermentation [J]. European Food Research & Technology, 2015,240(1): 93-100.
[6] 潘海燕. 苹果酒苹果酸乳酸发酵的研究[D]. 无锡:江南大学, 2004.
[7] 邱冬梅. 葡萄酒苹果酸-乳酸发酵的影响因素[J]. 江苏食品与发酵, 1996(3):15-17.
[8] 徐平. 用细菌噬菌体抑制葡萄酒中的细菌生长和苹果酸、乳酸发酵[J]. 微生物学杂志, 1988(1):80.
[9] 卜潇,薛雪,程静,等. 葡萄酒中植物乳杆菌苹果酸-乳酸发酵潜能评价[J]. 中国农业科学, 2017, 50(5):959-968.
[10] FUMI M D, SILVA A, KRIEGERWEBER S, et al. A new generation of malolactic starter cultures for high-ph wine [J]. Contributo, 2010.
[11] 王福荣. 酿酒分析与检测[M].北京:化学工业出版社,2005.
[12] ABRAHAMSE C E, BARTOWSKY E J. Timing of malolactic fermentation inoculation in Shiraz grape must and wine: influence on chemical composition [J]. World Journal of Microbiology & Biotechnology, 2012, 28(1):255-265.
[13] KLAMPFL C W, BUCHBERGER W, HADDAD P R. Determination of organic acids in food samples by capillary zone electrophoresis [J]. Journal of Chromatography A, 2000, 881(1):357-364.
[14] 杨春霞,苟春林,单巧玲. 葡萄酒酿造过程中有机酸变化规律研究[J]. 中国酿造, 2017, 36(4):83-86.