发酵是最早、最传统的加工和保存果蔬的生物手段,利用乳酸菌发酵是其中一种重要的方式。乳酸发酵方式中,从传统的自然(自发)发酵到添加发酵剂(发酵菌种)发酵,都有各自的优势与缺陷。自然发酵制品中的复杂菌群有利于丰富风味,但因微生物安全性等原因难以控制产品品质。而成量的、占优势的发酵菌种的添加,使得乳酸发酵更加高效、可控。因此,研究应用及工业生产上都更偏爱利用发酵剂进行发酵。
而发酵剂的选择可分为内源性和外源性,内源性发酵剂的使用意味着在同一种基质里分离和利用;外源性发酵剂意味着从一种基质中分离但用于其他基质中发酵[1]。目前广泛应用于果蔬的商业发酵剂大多为外源发酵剂,而这往往存在以下几个局限[1]:(1)选择时除了快速酸化外没有考虑其他特性;(2)对发酵基质的感官和功能性质适应性差;(3)不能有效利用生态系统的多样性。
对优良发酵菌种的需求使人们将目光转移至内源性菌种。内源性菌种的分离与运用在奶酪、发酵烘焙食品等产品上的运用已十分成熟,在腌菜制品、酒等产品上亦有运用,但在果蔬汁上的研究较少。DI等[2]研究对比了内源性菌种和外源性菌种在西红柿汁中的发酵表现,内源性菌种的生长和酸化周期都更短,风味更佳,储藏期更长,能维持更好的抗氧化性等功能特性。从黑树莓[3]、奇异果[4]、樱桃[5]等果蔬中分离出的内源性乳酸菌群均能在原本果蔬汁中代谢良好,有益于维持甚至提高果蔬汁的各项品质。然而,并不是所有组成蔬菜和水果的内源性菌种都可以达到期待的发酵效果[1]。
对内源性菌种的选择、培养和利用类似于“老面法”,传统“老面法”制作的食品及其他自然发酵制品中起主要发酵作用的往往是内源性和外源性菌种的混合菌群。内源性菌种和外源性菌种单独或混合发酵时对产品的影响及其规律仍需深入探究。
梨含有丰富的糖、有机酸、维生素、氨基酸等营养物质,具有生津止渴,降低血压,帮助消化等功效[6],将梨汁的营养特性与乳酸菌的益生功能相结合可谓相得益彰。乳酸菌在梨汁中消耗葡萄糖、果糖、氨基酸等增殖代谢,产生乳酸、酯类、醇类等物质从而影响梨汁风味,发酵作用还会影响梨汁中具有抗氧化性的酚类物质。
本文以蜜梨为试材,通过选择性培养从梨中分离出优势乳酸菌,利用16S rDNA全序列测序鉴定为植物乳杆菌,以梨汁为对象,比对内源性植物乳杆菌和外源性市售植物乳杆菌LP-115单一或混合发酵对梨汁品质的影响。
1 材料与方法
1.1 材料与试剂
选择成熟度合适、无明显缺陷的市售蜜梨;直投式植物乳杆菌(Lactobacillus plantarum)菌粉LP-115 400B,杜邦·丹尼斯克公司提供;没食子酸、原儿茶酸、儿茶素、绿原酸、咖啡酸、表儿茶素(纯度>98%),Sigma公司。
1.2 仪器与设备
安捷伦7890B-7000C三重四级杆气质联用仪;手动进样柄 65 μm聚二甲基硅氧烷/二乙基苯(polydimethylsiloxane /divinylbenzene,PDMS/DVB)萃取头,美国Supelco公司;全自动氨基酸分析仪L-8900,日本日立;1260 Infinity高效液相色谱仪,安捷伦公司;LDZX-50KBS立式压力蒸汽灭菌锅,上海申安医疗机械厂;SPX-150D-Z生化(恒温)培养箱,上海博讯实验有限公司医疗设备厂;752N紫外可见分光光度计,上海精密科学仪器有限公司;HR1895榨汁机,飞利浦(中国)投资有限公司;CR-400色差仪,日本美能达公司等。
1.3 方法
1.3.1 内源性乳酸菌分离鉴定
在无菌环境下取50 g梨果肉与50 mL MRS肉汤混合,于37 ℃下培养72 h,并连续稀释培养以筛选出乳酸菌,菌种鉴定交由上海美吉生物医药科技有限公司进行,测序结果分析在美国NCBI数据库和德国DMSZ数据库查询,鉴定结果为植物乳杆菌。
1.3.2 样品处理
梨洗净,榨汁,过100目纱布;每150 mL分装于250 mL洁净锥形瓶中,硅胶塞密封,将果汁迅速加热至80 ℃,水浴保温10 min后迅速冷却至40 ℃,准备接种。分别接种1.3.1所述内源性乳酸菌、植物乳杆菌LP-115 400B以及以上两者按1∶1比例混合的菌种,控制接种量,使得分别接种以上3种不同菌种的梨汁的初始活菌数均为7.0 lg(CFU/mL)左右,于37 ℃恒温箱静置发酵24 h,测定各项指标。取杀菌冷却后的未发酵梨汁为对照梨汁。
1.3.3 指标测定
pH,GB 10468—1989采用电位差法;总酸,GB/T 12456—2008采用酸碱滴定法;总糖,参考文献[7]采用3,5-二硝基水杨酸比色法测定;活菌数,参考GB 478935—2010采用稀释平板计数法进行测定;色差值用L*、a*、b*、ΔE表示,平行测定3次,ΔE计算见公式(1)。
Δ![]()
(1)
式中:L0、a0、b0为梨汁初始色差值,Ln、an、bn为测试样的色差值。
1.3.4 挥发性风味物质测定[8-9]
HS-SPME方法:将初次使用的固相微萃取的萃取头(PDMS/DVB 65 μm)在气相色谱的进样口老化,老化温度为270 ℃,载气体积流量为1.2 mL/min,老化时间为1 h。准确移取10 mL样品于20 mL螺口进样瓶中,加入3.0 g NaCl,促进香气成分的挥发,用聚四氟乙烯隔垫密封,于磁力搅拌器中平衡,平衡温度为45 ℃,平衡时间为20 min。平衡后将SPME萃取头通过隔垫插入进样瓶,插入深度为1 cm,推出纤维头,使纤维头置于样品瓶顶空进行吸附,吸附时间为40 min,随后取出萃取头,并立即将萃取头插入GC仪的进样口,插入深度为2 cm,推出纤维头,解析5 min,同时启动仪器收集数据。
GC条件:DB-5MS毛细管色谱柱(30 m×0.25 mm,0.25 μm);进样口温度 250 ℃,载气为He,流速为 1.93 mL/min。不分流进样。升温程序:起始温度为 40 ℃,保持3 min后以 4 ℃/min的速度升温至 120 ℃,再以 6 ℃/min的速度升温至240 ℃,保持9 min。
MS条件:电子轰击电离(EI),电子能量为70 eV,离子源温度为230 ℃,接口温度为230 ℃,质量扫描范围为m/z 35~500。
定性定量方法[8-9]:由GC-MS中NIST14质谱数据库按匹配度和保留时间对各个物质进行检索。选择匹配度大于85的物质作为有效的香气成分。按峰面积归一化进行相对定量,以未发酵梨汁的挥发性风味物质的总峰面积为100,其他物质以其为基准算出相应比例计算挥发性风味物质的相对百分含量。
1.3.5 游离氨基酸测定方法
参考GB/T 5009.124—2006使用氨基酸自动分析仪进行测定,用10 g/L的三氯乙酸溶液将梨汁浓度稀释到体积分数10%,8 000 r/min离心15 min,取上清液过0.45 μm滤膜上机测定。氨基酸自动分析色谱条件:4.0 m×125 mm C18柱,柱温40 ℃,流速1.0 mL/min,波长Ex 340 nm、Em 450 nm,流动相A:20 mmol/L醋酸钠溶液,流动相B:V(20 mmol/L醋酸钠)∶V(甲醇)∶V(乙腈)=1∶2∶2。
1.3.6 HPLC测定酚类物质
色谱柱:Waters Symmetry C18(4.6 mm×250 mm,5 μm);流动相:A为2%甲酸,B 为乙腈;柱温:40 ℃;梯度洗脱程序:溶剂A在0~30 min为95%,在30~45 min由75%降至60%,在45~50 min维持60%,在50~51 min由60%上升至95%,维持10 min后返回初始状态。流速:0.8 mL/min,检测波长:280,320,360 nm,进样量10 μL。以没食子酸、原儿茶酸、儿茶素、绿原酸、咖啡酸、表儿茶素为标准品,绘制标准曲线,计算样品中各种多酚类化合物含量。
2 结果与讨论
2.1 不同来源植物乳杆菌菌种在梨汁中增殖代谢情况
梨汁在发酵过程中pH和活菌数的变化反映了不同来源植物乳杆菌对发酵基质(梨汁)的适应情况(图1)。与外源性植物乳杆菌相比,内源性植物乳杆菌在梨汁中增长、产酸速率更快,发酵24 h时pH值可降至3.30,活菌数从初始的7.0 lg CFU/mL达到10 lg CFU/mL,能更好地适应梨汁发酵。在对西红柿[2]、胡萝卜[10]、四季豆[10]等的乳酸菌发酵研究中,使用经过选择的内源乳酸菌发酵时也较外源乳酸菌发酵时pH下降更快,推测与乳酸菌中代谢酶系及其适应性的差异有关。对当两者按1∶1复合时,从pH和活菌数的变化来看,内源性和外源性植物乳杆菌复合发酵时,比两者单一发酵时的增长、产酸速率都更快,最终达到的活菌数更高、pH更低,这体现出两者在梨汁中混合发酵时存在一定协同作用。
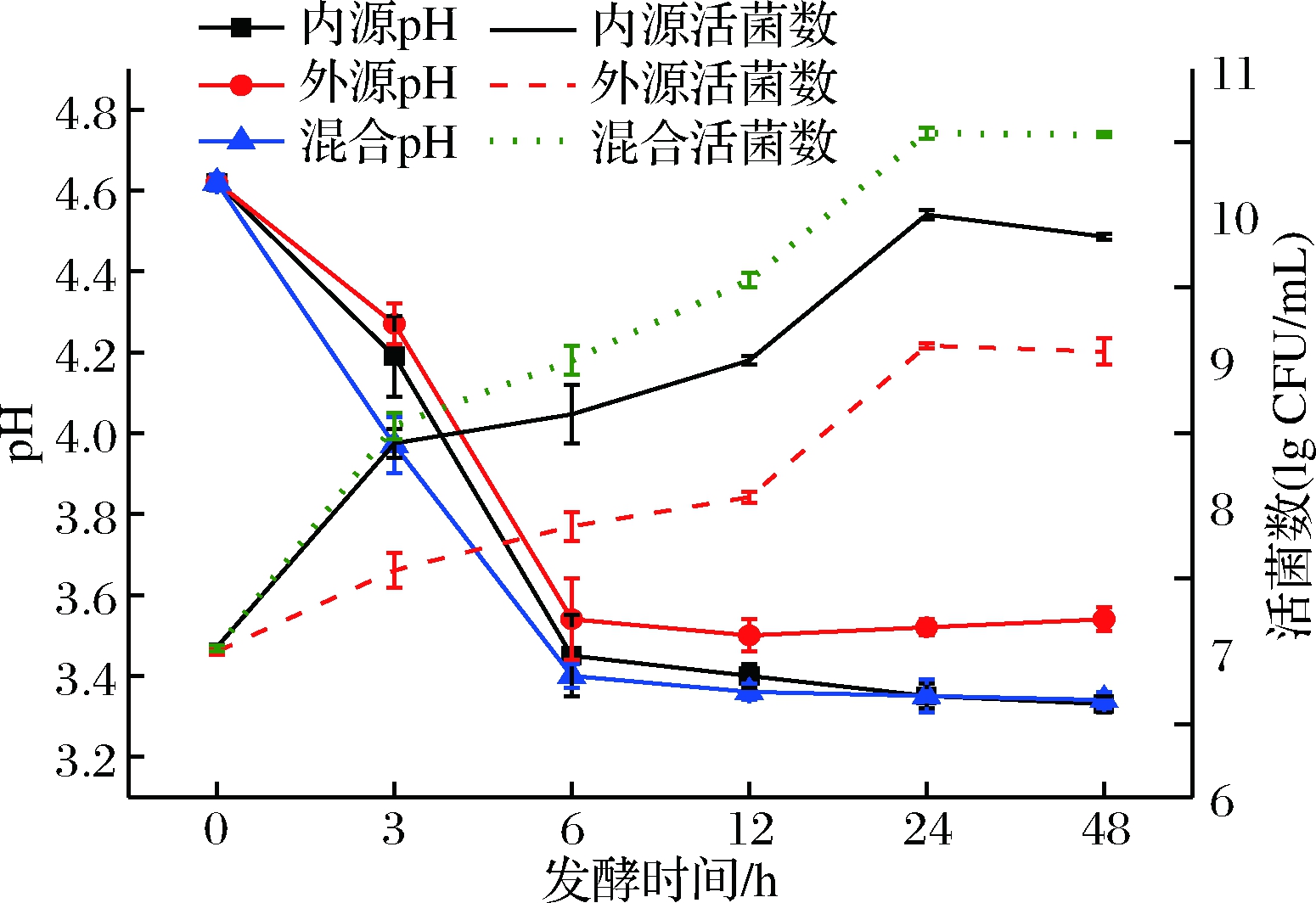
图1 不同来源菌种发酵梨汁pH及活菌数变化
Fig.1 The changes of pH and viable bacteria of pear
juices fermented by different L. plantarum
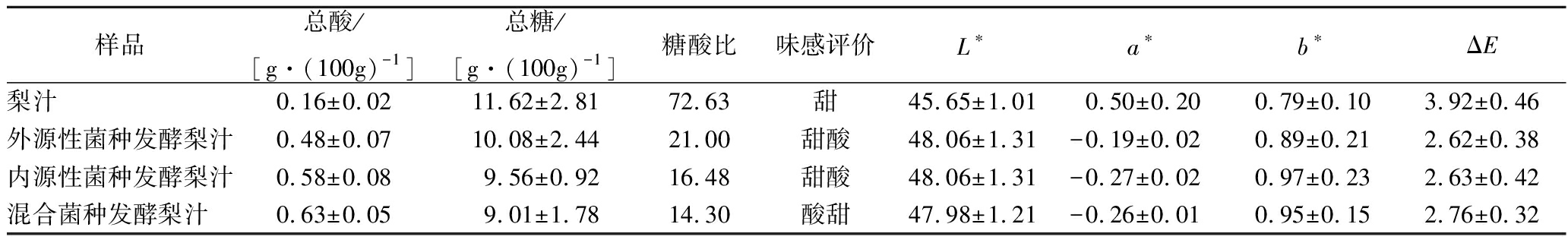
梨汁中主要糖类为葡萄糖和果糖,植物乳杆菌在梨汁中增殖代谢,利用糖、氨基酸等营养物质发酵产生乳酸、苹果酸等,使得果蔬汁中总酸含量增加、总糖含量下降,从而使得糖酸比发生变化,与前文梨汁中pH和活菌数变化情况相呼应,混合菌种在梨汁中消耗糖分产酸最高,表现出酸甜的味感(表1)。内源性和外源性植物乳杆菌单独发酵时,外源性植物乳杆菌产酸更多,都表现为甜酸的味感。梨汁经乳酸发酵后pH降低,有利于抑制多酚氧化酶的活性从而降低梨汁褐变,因此发酵梨汁较未发酵梨汁的L*值(亮度)稍高,a*值较小,总色差值ΔE较小,说明发酵梨汁色差变化较小,但不同菌种发酵的梨汁其色差无显著差异。
表1 不同来源菌种发酵梨汁指标差异
Table 1 The attributes of pear juices fermented by different L. plantarum
2.2 不同来源菌种对挥发性风味物质的影响
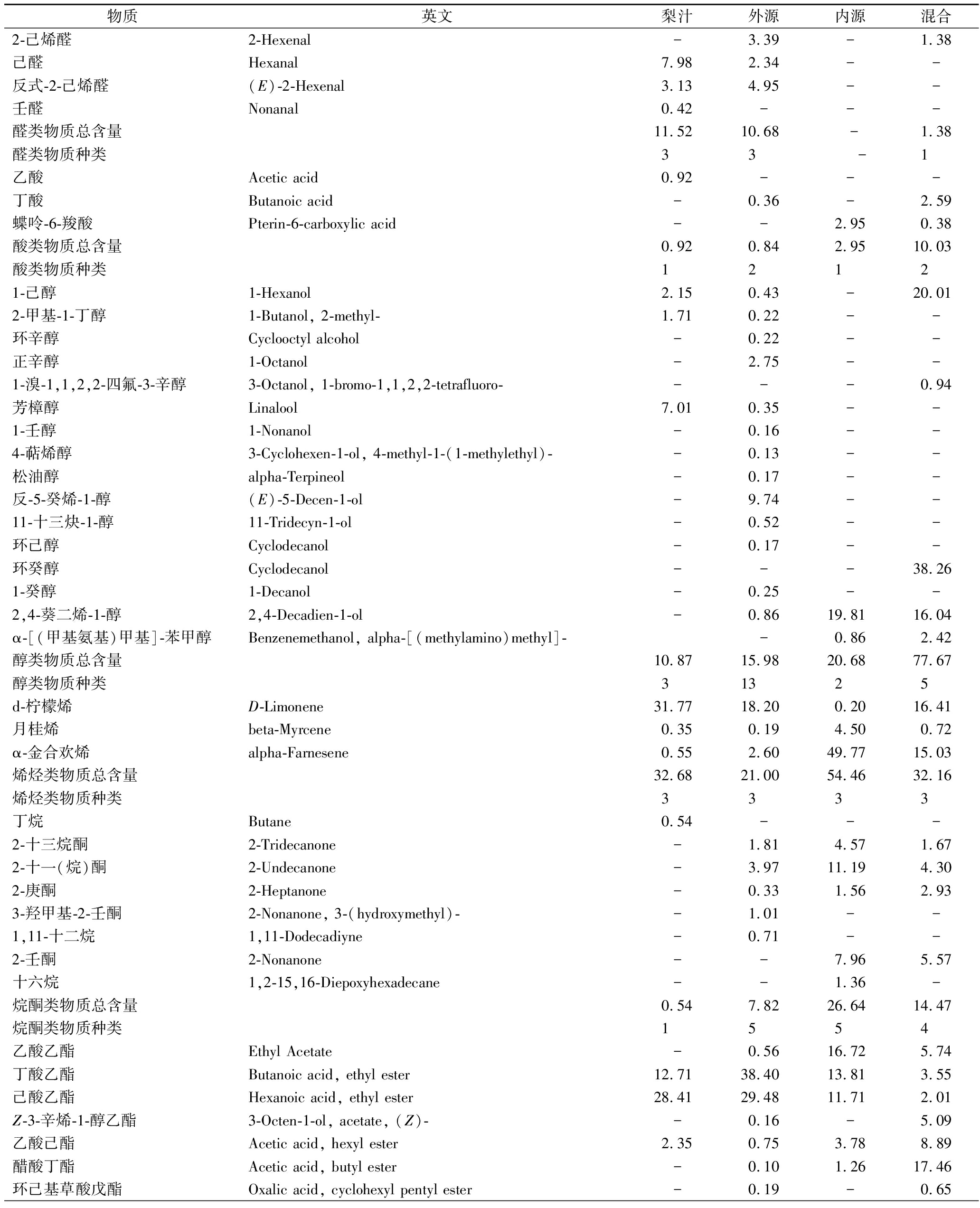
从测得的挥发性风味物质的总峰面积及风味物质种类总数量看,不管是经过何种来源的植物乳杆菌发酵的梨汁的挥发性风味物质的总峰面积和种类数量均高于未发酵梨汁的总峰面积,说明发酵后梨汁中的风味物质含量和种类均显著增加。而其中内源性和外源性植物乳杆菌混合发酵的梨汁的总峰面积和种类数最大,对梨汁风味的改变最显著,内源性植物乳杆菌和外源性植物乳杆菌依次次之。三者在挥发性风味物质总峰面积和种类上的异同都从侧面反应了内源性菌种和外源性菌种的协同作用。
经不同来源植物乳杆菌发酵后,梨汁中醛类物质含量均显著减少,醛类是一种不稳定的化合物,且高浓度的醛类物质会产生异味[11],醛类物质在微生物代谢活动下极易分解为醇或被氧化为酸[2],观察表2中各样品中醇类物质和酸类物质的变化,发现内源性植物乳杆菌倾向于将醛类物质氧化为酸,而外源性植物乳杆菌则倾向于将醛类物质还原成为醇类,这与DI等[2]在西红柿汁中的研究结论亦相吻合,这与不同的菌种在羰基化合物之间的平衡代谢机制有关[2]。而酸类、醇类物质的增加进而会使相应的酯类物质增加[12],而乳酸菌发酵作用更会促使这一过程,例如乙酸乙酯可在乳酸菌柠檬酸发酵作用的促使下生成[13]。
表2 不同菌种发酵梨汁挥发性成分的种类及相对含量 单位:%
Table 2 Categories and proportion of volatile compounds in pear juices fermented by different L. plantarum
续表2

注:本表以未发酵梨汁的挥发性风味物质的总峰面积为100,其他物质以其为基准算出相应比例;“-”表示这种物质和百分比含量为0。
以上都是发酵梨汁中醛类物质减少,而酸类、醇类和酯类物质增多的原因之一。在表2中,检测得到的挥发性酯类物质中,2-丁烯酸乙酯、2-甲基-丁酸乙基酯等是梨果皮中散发香甜的果香的有效香气成分[14],在鲜榨全梨汁中或因含量低未检出,但在内源性植物乳杆菌发酵梨汁和混合菌种发酵梨汁中检出,推测内源性植物乳杆菌不仅能够促进香气物质的合成,还能推进释放梨皮中的香气物质从而使得梨汁发酵后香味更加浓郁。当内源性和外源性植物乳杆菌混合发酵时,各自促使增加的酸和醇使得酯类物质的种类数量进一步增加。挥发性酯类物质是梨中散发成熟梨果香的最重要的物质,赋予了梨“水果的香味”[15]。因此酯类物质浓度和种类的增加有利于梨汁香气的突出。
除了酯类物质外,芳樟醇、1-己醇等醇类物质也是产生浓郁水果香味的重要物质[16]。外源性植物乳杆菌发酵后的梨汁中醇类物质种类增多,但1-己醇、2-甲基-1-丁醇和芳樟醇等在梨汁中原有的醇类物质含量却有减少,内源性发酵的梨汁中则无这些醇类检出,混合菌种发酵的梨汁中的1-己醇含量却显著增加。1-己醇是十分重要的脂肪酸代谢途径的中间体,是在挥发性物质合成过程中比亚油酸和亚麻酸更有效的中间体[17]。1-己醇的显著增加反映了混合菌种发酵梨汁中积极活跃的风味物质代谢。
单一与混合菌种发酵产物比较,个别组分在单菌发酵未能检出(如1-溴-1,1,2,2-四氟-3-辛醇、环癸醇、5-(2-氨基丙基)-2-甲基苯酚),而混合菌发酵中产生,或者在混合菌发酵中未能检出(如己醛、1-壬、醇4-萜烯醇等),而单菌种发酵中检测到,这可能是由于不同来源的两种菌其所含酶系的差异性及其代谢特性存在差别。相比单菌种发酵,混合菌发酵体系中,一种菌的代谢产物可能是另一种菌的代谢底物,同时也存在发酵产物间或发酵底物与产物之间等复杂的反应。相似机理有如保加利亚乳杆菌和嗜热链球菌的互惠共生作用,保加利亚乳杆菌代谢产物氨基酸为后者提供氮源[18],而嗜热乳杆菌为保加利亚乳杆菌提供甲酸、叶酸和CO2等[19]。
2.3 不同来源菌种对梨汁中酚类物质的影响
不同梨汁在加工和储藏过程中酚类物质都有不同程度损失(图2),未发酵梨汁在储藏期间酚类物质一直显著迅速降低,在第30天酚类含量从初始的153.64 mg/L降低至25.16 mg/L,降低了84%。梨汁中不同的酚类物质降解损失程度有所差异,在没食子酸、原儿茶酸、儿茶素、绿原酸、咖啡酸、表儿茶素中,鲜榨梨汁中含量最高的是绿原酸(122.18 mg/L)、没食子酸(14.17 mg/L)和表儿茶素(11.98 mg/L),而各梨汁在储藏过程中降解损失最快的是绿原酸,其他酚类物质则在储藏第14天后开始快速下降。可见在梨汁中,绿原酸是含量最高且最不稳定的酚类物质。

图2 不同来源菌种发酵梨汁酚类物质在储藏期间变化
Fig.2 The changes of polyphenols of pear juices fermented
by different L. plantarum
与未发酵梨汁相比,发酵梨汁酚类物质在储藏期含量和稳定性都表现更优。发酵期间因乳酸菌的应激作用而对酚类物质进行的生物代谢[20]会导致发酵结束后梨汁中酚类物质减少[4]。但在储藏期间,乳酸菌在梨汁中产生的各种有机酸、醇、酮等可抑制PPO活性物质,有利于防止酚类物质的氧化;再者,乳酸菌代谢过程中能产生酚酸酯酶等酶类,这些酶可释放梨汁中的酚类物质[21],而使得梨汁中酚类含量得到补偿。内源性菌种发酵的梨汁在储藏期酚类物质损失最少,其次是混合菌种发酵梨汁和外源菌种发酵梨汁。这从侧面反映了与外源性植物乳杆菌相比,内源性植物乳杆菌对酚类物质的代谢分解程度更低,保存性更优。
2.4 不同来源菌种对梨汁中游离氨基酸的影响
植物乳杆菌具有多种氨基酸营养缺陷性,因此必须依赖外部氨基酸来增长代谢[22],而微生物中酶的作用又会使蛋白质分解产生氨基酸。经乳酸菌发酵后,梨汁中游离氨基酸含量有不同程度的降低(图3),外源植物乳杆菌发酵后游离氨基酸总量从879.48 mg/kg降至510.21 mg/kg,其中组氨酸、半胱氨酸、异亮氨酸和丝氨酸含量降为0。内源性和混合菌种发酵梨汁中游离氨基酸总含量相对较高,分别为715.96 mg/kg和708.85 mg/kg,其中酪氨酸含量从7.70 mg/kg降为0,但梨汁中原本缺陷型的精氨酸、亮氨酸和甘氨酸经植物乳杆菌发酵后均有不同程度增加,有利于提高梨汁中游离氨基酸的多样性。

图3 不同来源菌种发酵梨汁游离氨基酸含量
Fig.3 The content of FAA of pear juices fermented by different L. plantarum
3 结论
内源性植物乳杆菌和外源性植物乳杆菌均能在梨汁中进行良好代谢,与外源性植物乳杆菌相比,内源性植物乳杆菌在梨汁中增长、产酸速率更快,并且最终达到的活菌数更高、pH更低,能更好地适应梨汁进行发酵,除此之外内源性植物乳杆菌发酵梨汁中酚类物质保存性更优,且内源性植物乳杆菌代谢有助于提高梨汁中游离氨基酸的多样性。发酵后梨汁中的风味物质含量和种类均显著增加,对梨汁风味的改变显著,内源性植物乳杆菌倾向于将醛类物质氧化为酸,而外源性植物乳杆菌则倾向于将醛类物质还原成为醇类,内源性植物乳杆菌不仅能够促进香气物质的合成,还能推进释放梨皮中的香气物质从而使得梨汁发酵后香味更加浓郁。将内源性植物乳杆菌和外源性植物乳杆菌混合发酵,两者存在协同作用,在增殖代谢产酸、丰富挥发性风味物质,游离氨基酸、酚类物质保存方面均优于菌种单一发酵。
参考文献
[1] DI C R, CODA R, DE A M, et al. Exploitation of vegetables and fruits through lactic acid fermentation[J]. Food Microbiology, 2013, 33(1): 1-10.
[2] DI C R, SURICO R F, PARADISO A, et al. Effect of autochthonous lactic acid bacteria starters on health-promoting and sensory properties of tomato juices[J]. International Journal of Food Microbiology, 2009, 128(3): 473-483.
[3] KIM J Y, LEE M Y, JI G E, et al. Production of γ-aminobutyric acid in black raspberry juice during fermentation by Lactobacillus brevis GABA100[J]. International Journal of Food Microbiology, 2009, 130(1): 12-16.
[4] DI C R, MINERVINI G, RIZZELLO C G, et al. Effect of lactic acid fermentation on antioxidant, texture, color and sensory properties of red and green smoothies[J]. Food Microbiology, 2011, 28(5): 1 062-1 071.
[5] DI C R, SURICO R F, MINERVINI G, et al. Exploitation of sweet cherry (Prunus avium L.) puree added of stem infusion through fermentation by selected autochthonous lactic acid bacteria[J]. Food Microbiology, 2011, 28(5): 900-909.
[6] 焦媛媛,杜丽平,孙文,等. 优良梨汁发酵乳酸菌的筛选与发酵性能研究[J]. 食品科学,2018:1-9.
[7] PARK E Y, LUH B S. Polyphenol Qxidase of Kiwifruit[J]. Journal of Food Science, 2010, 50(3): 678-684.
[8] 束文秀,吴祖芳,刘连亮,等. 胡柚汁益生菌发酵挥发性风味特征[J]. 食品科学, 2018,39(4): 59-65.
[9] 孔祥琪,施瑞城,张彦军,等. 气相色谱质谱联用技术分析热处理前后番木瓜汁香气[J]. 食品与发酵工业, 2016,42(1):189-194.
[10] DI C R, SURICO R F, SIRAGUSA S, et al. Selection and use of autochthonous mixed starter for lactic acid fermentation of carrots, French beans or marrows[J]. International Journal of Food Microbiology, 2008, 127(3): 220-228.
[11] MOIO L, ADDEO F. Grana Padano cheese aroma[J]. Journal of Dairy Research, 1998, 65(2): 317-333.
[12] SMID E J, KLEEREBEZEM M. Production of aroma Compounds in Lactic Fermentations[J]. Annu Rev Food Sci Technol, 2014, 5(1): 313-326.
[13] KAPRASOB R, KERDCHOECHUEN O, LAOHAKUNJIT N, et al. Fermentation-based biotransformation of bioactive phenolics and volatile compounds from cashew apple juice by select lactic acid bacteria[J]. Process Biochemistry, 2017, 59:141-149.
[14] CHOI J Y, LEE S M, LEE H J, et al. Characterization of aroma-active compounds in Chinese quince (Pseudocydonia sinensis Schneid) by aroma dilution analyses[J]. Food Research International, 2018, 105: 828-835.
[15] WEI Shuwei,QIN Gaihua,Zhang Huping, et al. Calcium treatments promote the aroma volatiles emission of pear (Pyrus ussuriensis ‘Nanguoli’) fruit during post-harvest ripening process[J]. Scientia Horticulturae, 2017, 215: 102-111.
[16] DI C R, SURICO R F, PARADISO A, et al. Effect of autochthonous lactic acid bacteria starters on health-promoting and sensory properties of tomato juices[J]. International Journal of Food Microbiology, 2009, 128(3): 473-483.
[17] QIN Gaihua, TAO Shutian, ZHANG Huping, et al. Evolution of the aroma volatiles of pear fruits supplemented with fatty acid metabolic precursors[J]. Molecules, 2014, 19(12): 20 183-20 196.
[18] HERVE-JIMENEZ L, GUILLOUARD I, GUEDON E, et al. Physiology of Streptococcus thermophilus during the late stage of milk fermentation with special regard to sulfur amino-acid metabolism[J]. Proteomics, 2008, 8(20): 4 273-4 286.
[19] CRITTENDEN R G, MARTINEZ N R, PLAYNE M J. Synthesis and utilisation of folate by yoghurt starter cultures and probiotic bacteria[J]. International Journal of Food Microbiology, 2003, 80(3): 217-222.
[20] FILANNINO P, BAI Y, DI C R, et al. Metabolism of phenolic compounds by Lactobacillus spp. during fermentation of cherry juice and broccoli puree[J]. Food Microbiology, 2015, 46: 272-279.
[21] 赖婷,刘磊,张名位,等. 不同乳酸菌发酵对桂圆肉中酚类物质及抗氧化活性的影响[J]. 中国农业科学, 2016,49(10): 1 979-1 989.
[22] WEGKAMP A, TEUSINK B, DE V W M, et al. Development of a minimal growth medium for Lactobacillus plantarum[J]. Letters in Applied Microbiology, 2010, 50(1): 57-64.