克氏原螯虾(Procambarus clarkia),俗称小龙虾,自1929年由日本引入我国之后,在我国推广养殖。2016年我国小龙虾总产量达到89.91万t,是全世界世界最大的小龙虾生产国[1]。克氏原螯虾味道鲜美,营养丰富,深受人们的喜爱,也带动了我国小龙虾加工业的发展。克氏原螯虾在加工过程中有接近整虾质量50%~ 80%的虾头、虾壳被废弃或者加工成饲料,造成严重的环境污染和资源浪费[2]。据研究,克氏原螯虾虾头中粗蛋白含量为13.13%,同时含有丰富的虾青素、脂类和生物活性物质,可以作为优良的蛋白质来源[3]。如何高效回收利用克氏原螯虾加工副产物中的蛋白,已成为近些年来研究的一个热点。
酶解法具有操作方便、对营养物质破坏小等优点,被广泛应用于动物蛋白的回收。虾头经酶解处理,其产物中含有大量的短肽、氨基酸等鲜味物质,可以开发为虾味海鲜调味品或食品添加剂,具有广阔的市场前景[4-5]。赵利等[6]采用碱性蛋白酶回收克氏原螯虾虾头和虾壳中的蛋白质,其酶解产物中含有丰富的呈味氨基酸和肽类,可以用于制备虾味调味料。钱飞等[7]以克氏原螯虾虾头为原料,通过碱性蛋白酶水解,得到具有浓郁虾风味的呈味基料。汪倩等[8]以碱性蛋白酶水解克氏原螯虾副产物所得蛋白肽为原料,制备得到具有抗氧化性的美拉德反应产物,实现虾头蛋白的高效利用。目前国内外食品界主要使用商业蛋白酶回收虾头蛋白质,存在成本较高的问题,影响食品企业的大规模生产。
克氏原螯虾的大部分消化器官都集中在虾头,因此虾头中含有丰富的内源蛋白酶。有研究学者报道指出,虾头中存在活性很高的类胃蛋白酶和类胰蛋白酶2种主要蛋白酶[9-11]。这些蛋白酶在一定条件下被激活,可以将自身组织的蛋白质分解为短肽、氨基酸,可以实现以较低的成本回收虾头蛋白质[12-13]。本文以克氏原螯虾虾头为原料,采用紫外辐射法激活克氏原螯虾虾头的内源蛋白酶,在此基础上利用内源酶制备虾头酶解液,并研究自溶前后鲜味物质的变化,以期为克氏原螯虾加工副产物的高值化利用奠定基础。
1 材料与方法
1.1 实验材料与仪器
克氏原螯虾虾头:鲜活的克氏原螯虾(Procambarus clarkia),购于四川省成都市青羊区麦德龙超市,洗净沥干水分后取虾头,分装保存于-20 ℃备用(虾头基本营养成分为:水分含量(74.13±0.46)%,粗蛋白含量(13.68±0.23)%,粗脂肪含量(5.49±0.14)%,灰分含量(6.68±0.08)%)。IMP、GMP、ATP、ADP、AMP、HxR、Hx标准品(纯度≥99.0%),购于美国Sigma公司;甲醇、乙腈,均为色谱纯;其他试剂均为国产分析纯。
DK-98-1型恒温水浴锅,天津市泰斯特仪器有限公司;自动凯氏定氮仪,德国Thermo公司;MBL50型高速均质机,上海默格机械有限公司;85-2型恒温磁力搅拌器,北京华人新创科技有限公司;835-50型高速氨基酸自动分析仪,日本Hitachi公司;PB-10型酸度计,德国Sartorius公司;SB-5200型超声波清洗器,上海新芝生物技术研究所;Agilent 1200型半制备高效液相色谱仪,美国Agilent公司;CF16RX型高速冷冻离心机,日本Hitachi公司。
1.2 试验方法
1.2.1 紫外诱导克氏原螯虾虾头自溶工艺优化
1.2.1.1 技术路线
虾头→解冻→粉碎→紫外照射→加水均质→调节pH→恒温搅拌反应→灭酶→离心→酶解液
1.2.1.2 紫外诱导克氏原螯虾虾头自溶酶解产物的制备
虾头自溶工艺参考曹文红等[14]的方法,稍作改动。原料预处理:取冷冻的克氏原螯虾虾头,置于4 ℃解冻,粉碎后置于波长为250 nm、功率为30 W的紫外灯下照射,然后按料液比1∶1(质量比)的比例加入去离子水均质10 min(转速6 000 r/min),用0.1 mol/L醋酸钠溶液调节pH值,恒温搅拌反应,自溶结束后置于90~100 ℃的水浴中加热10 min,使内源蛋白酶失活。将溶液于转速4 500 r/min、温度4 ℃下离心10 min,取上清液即为虾头酶解液。
1.2.1.3 紫外诱导克氏原螯虾虾头自溶单因素实验
紫外诱导克氏原螯虾虾头自溶反应的固定条件为:紫外照射时间30 min,自溶初始pH值8.0,自溶反应温度50 ℃,自溶反应时间3 h。固定其他条件不变,改变其中某个因素条件分别分析对虾头酶解液水解度的影响。设置各因素的梯度分别为:紫外照射时间0、10、20、30、40、50、60 min,自溶初始pH值4.0、5.0、6.0、7.0、8.0、9.0、10.0,自溶温度35、40、45、50、55、60、65 ℃,自溶时间0、1、2、3、4、5、6 h。反应结束后于80 ℃加热20 min终止反应;于4 500 r/min离心10 min,上清液即为样品液。
1.2.1.4 响应面分析试验设计
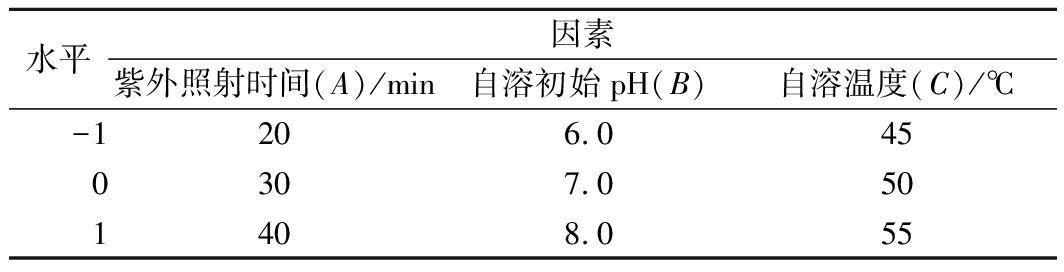
在单因素实验的基础上,选择对虾头水解度影响较大的紫外照射时间、自溶初始pH值、自溶温度3个因素,按照Box-Bohnken设计法每个因素取3个水平,以(-1,0,1)编码进行实验,以水解度为响应值建立二次响应面数学模型,寻找最佳的自溶条件。共有17个试验,其中12个为析因点,5个为零点以估计误差。每个试验重复3次,试验结果为测定结果的平均值±标准偏差。因素与水平见表1。
表1 响应面因素与水平设计
Table 1 Factors and levels of response surface experiment
1.2.2 水解度测定
氨基态氮含量的测定参考NILSANG等[15]的方法。取1 mL的样品溶液和2 mL的去离子水加入250 mL的锥形瓶,再加入10 mL去离子水,用0.05 mol/L的NaOH溶液将pH调到7.0,再加入4 mL 18%(体积分数)的甲醛溶液,混匀后用0.05 mol/L的NaOH溶液将pH滴定至9.5,记录滴定消耗的NaOH溶液体积,计算样品中氨基态氮的含量;原料总氮和非蛋白氮含量采用微量凯氏定氮法测定。
水解度(degree of hydrolysis, DH)的计算公式如下:
DH/%![]() ×100
×100
(1)
式中:A为样品中总氮量;B为样品中的氨基氮量;C为样品中的非蛋白氮量。
1.2.3 感官评价
感官评价采用描述分析法[16]。样品评价前,置于60 ℃恒温水浴加热10 min,然后稀释5倍并用统一的容器盛装,随机取样进行感官评价。根据感官评定标准(表2),选取经过感官评定培训的10人组成感官评价小组,对样品的鲜味、苦味、腥味、醇厚感和后味进行打分,每项总分为10分,逐项评分后取平均值作出风味雷达图。在评价前12 h,禁止评价员吸烟、饮酒,吃刺激性食物。
1.2.4 游离氨基酸测定
样品用酸水解法处理,然后用全自动氨基酸分析仪测定游离氨基酸的含量。
1.2.5 呈味核苷酸测定
样品前处理:取样品溶液10 mL,加入30 mL体积分数8%冷的高氯酸溶液均质2 min(转速6 000 r/min)。在4 ℃条件10 000 r/min离心20 min,取上清液,沉淀重新提取两次,上清液用10 mol/L的KOH调节pH 6.5,在0 ℃保存30 min以沉淀高氯酸钾,过滤取上清液,用8%冷的高氯酸溶液定容至50 mL,4 ℃保存备用。
表2 感官评定标准表
Table 2 Standard of sensory evaluation

HPLC条件:色谱柱为Waters C18 (4.6 mm ×250 mm,5 μm);柱温25 ℃;检测波长254 nm;进样量10 μL;流动相为含有1%甲醇的0.05 mol/L KH2PO4 -K2HPO4缓冲液(pH 6.5);采用等度洗脱方法,流速为0.7 mL/min。
1.2.6 数据处理
实验结果用平均值±标准偏差表示(n=3),使用Origin 8.0和SPSS 22.0 软件进行作图和数据分析。
2 结果与讨论
2.1 紫外诱导克氏原螯虾虾头自溶反应单因素试验
紫外照射时间、自溶初始pH值、自溶温度和自溶时间对克氏原螯虾虾头水解度的影响如图1。

图1 紫外照射时间、自溶初始pH值、自溶温度和自溶时间对克氏原螯虾虾头水解度的影响
Fig.1 Effect of ultraviolet irradiation time, autolysis initial pH, autolysis temperature and autolysis time on
degree of hydrolysis of Procambarus clarkia head
由图1-a可知,随着紫外照射时间的增加,克氏原螯虾虾头水解度先增加后略有降低,在30 min时水解度取得最大值。当照射时间小于30 min时,由于紫外线的诱导作用,激活了虾头的内源蛋白酶,促进蛋白质降解,提高了水解效果;照射时间超过30 min时,由于紫外线过度作用,使得酶分子的结构发生变化,降低了酶的活性,进而减缓虾头蛋白的水解[17]。因此,紫外照射时间选择30 min左右为宜。由图1-b可知,随着pH值增加,克氏原螯虾虾头酶解液水解度先增大后减小,pH值8.0时取得最大值。这一结果与田申等[12]的试验结果相一致。由于pH值为7.0和8.0时,其虾头水解度之间没有显著性差异(P>0.05),考虑到食品工业生产中的效率和能耗等问题,确定自溶初始pH值为7.0为宜。温度是影响酶活力的主要因素,酶在最适温度下活力最高,增加或降低温度均影响酶活力,内源蛋白酶酶解虾头蛋白的最适温度为50 ℃(图1-c),此温度下酶活力最强,最利于虾头蛋白水解。这一结果与曹文红等[14]的试验结论近似,酶解温度50℃为宜。由图1-d可知,随着酶解时间的增长,3 h时虾头蛋白自溶基本完成,达到平衡,随后增加自溶时间对虾头蛋白水解度影响不大。因此,自溶时间选择 3 h较为合适。
2.2 响应面结果分析
2.2.1 响应面结果及方差分析
根据Box-Behnken设计方法得到17组试验结果,其设计方案及结果见表2。利用Design Expert 8.0.5软件对响应面试验结果进行二次多元回归分析,对表2的数据进行方差分析并除去不显著项得到模型的二次多项回归方程为:y=44.17+1.43A+1.44B-1.20AC-5.05A2-4.63B2-1.66C2。
表2 响应面设计方案及结果
Table 2 Design and result of response surface analysis
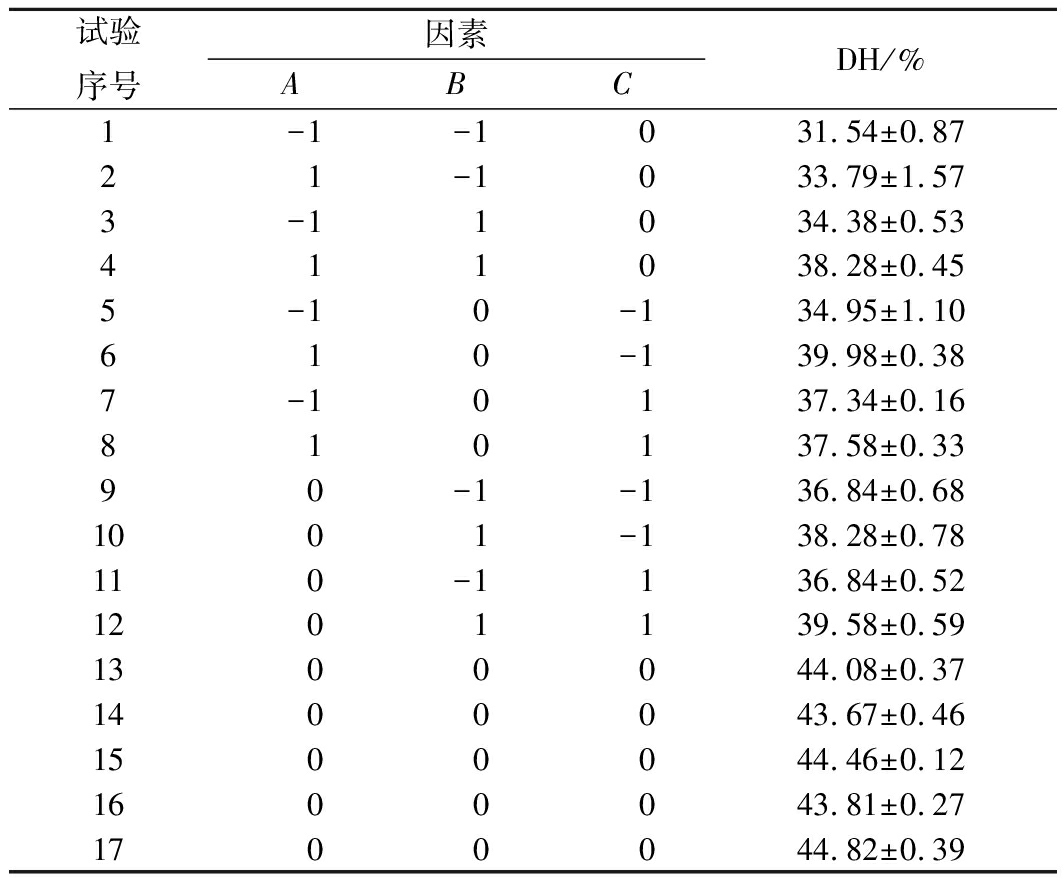
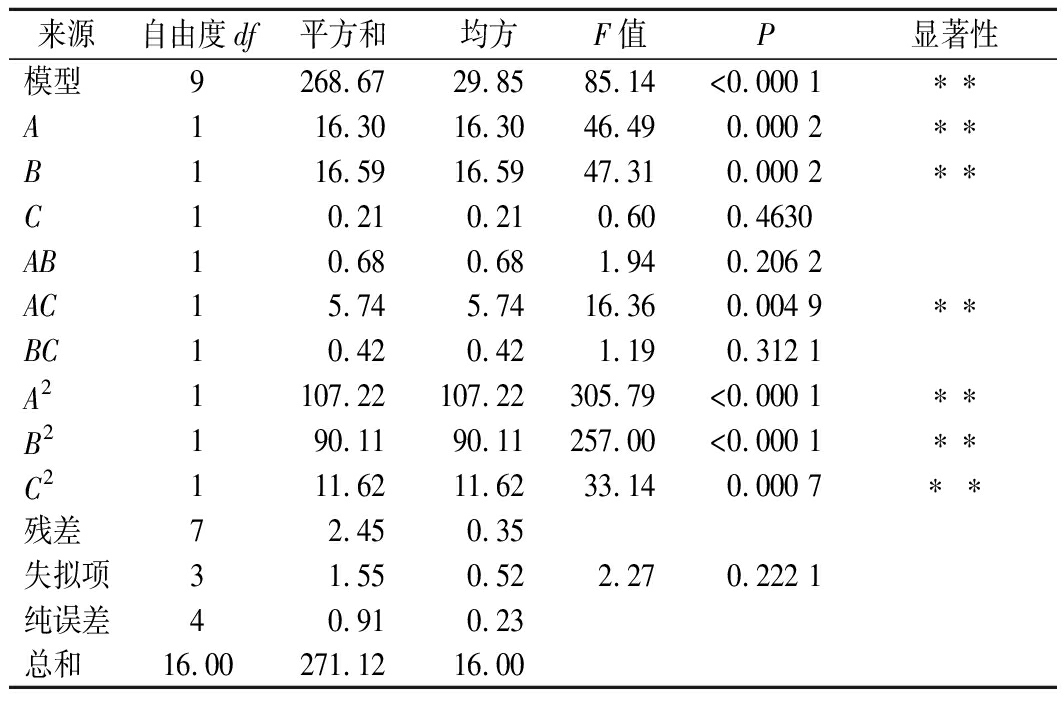
表3 回归模型方差分析
Table 3 Variance analysis of the regression equation
注:*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。
由表3可知,模型的P值小于0.000 1,而失拟项不显著(P=0.222 1>0.05),表明模型是极显著的。另外,因素一次项(A、B)、交互项AC、二次项(A2、B2、C2)对结果影响是极显著(P<0.01),一次项C、交互项AB、BC对结果影响不显著(P>0.05)。同时,软件分析的复相关系数R的RAdj2值为97.93%,表明模型中残差相互独立,拟合程度良好,实验误差小,可用于对紫外诱导克氏原螯虾虾头自溶工艺进行分析和预测。
2.2.2 响应曲面图分析
根据回归方程的分析结果,考察紫外诱导克氏原螯虾虾头自溶工艺中紫外照射时间、自溶初始pH、自溶温度3个因素之间交互作用对水解度的影响如图2~图4所示。
图2显示紫外照射时间为30 min时,自溶初始pH值和自溶温度对克氏原螯虾虾头水解度的交互影响效应。从图2可知,随着自溶温度的升高,水解度的变化较为平缓。曲面的投影图中,等高线变化趋势近似于一条直线,说明自溶温度与自溶初始pH值交互作用对虾头自溶水解度影响不显著。等高图中形成封闭的圆圈,说明在因素变化范围内出现极大值。

图2 自溶初始pH和自溶温度对水解度影响的
三维曲面图
Fig.2 Three-dimensional curved surface for effect of
autolysis initial pH and autolysis temperature on degree
of hydrolysis
图3显示自溶初始pH值为7.0,紫外照射时间和自溶温度对克氏原螯虾虾头水解度的交互影响效应。在测定范围内,随着紫外照射时间的增加,虾头水解度先升高后降低。曲面图的投影图中,等高线变化趋势为一条弧线,这说明紫外照射时间和自溶温度对虾头自溶水解度影响较为显著。另外曲面投影的等值线形成一个封闭的圆圈,说明其在因素变化范围内,出现有最大值。

图3 紫外照射时间和自溶温度对水解度影响的
三维曲面
Fig.3 Three-dimensional curved surface for effect of
ultraviolet irradiation time and autolysis temperature on
degree of hydrolysis
图4显示自溶温度为50 ℃时,自溶初始pH值和紫外照射时间对克氏原螯虾虾头水解度的交互影响效应。根据曲面投影的等高图,在因素变化范围内,等高线变化趋势较为平缓,说明紫外照射时间与自溶初始pH值交互作用对虾头自溶水解度影响不显著。等高图中形成封闭的圆圈,说明在因素变化范围内存在极大值。

图4 自溶初始pH和紫外照射时间对水解度影响的
三维曲面
Fig.4 Three-dimensional curved surface for effect of
autolysis initial pH and ultraviolet irradiation time on degree
of hydrolysis
2.2.3 紫外诱导克氏原螯虾虾头自溶工艺最优方案与验证试验
为了得到最佳工艺方案,对所得回归方程取一阶偏导数,解方程组后可得:A=22.94, B=7.16, C=50.36,即为紫外照射时间22.94 min,自溶初始pH 7.16,温度50.06 ℃,在此条件下克氏原螯虾虾头水解度达44.39%。考虑到实际操作条件,确定紫外诱导克氏原螯虾虾头自溶最佳工艺条件为:紫外照射时间23 min,自溶初始pH 7.2,温度50 ℃,自溶时间3 h。为检验回归方程所预测结果的可靠性,在最优条件下进行3次验证性实验,实际测得的虾头蛋白酶解液水解度为(45.88±1.37)%(P<0.05),所得实际值与理论值的平均误差为3.36%。试验结果充分验证了该模型的正确性,所得到的二次多项回归方程可以较准确预测紫外诱导克氏原螯虾虾头自溶水解度。
2.3 克氏原螯虾虾头自溶前后鲜味物质的变化
2.3.1 克氏原螯虾虾头原液和自溶产物的感官评价
克氏原螯虾虾头原液和自溶产物的感官评定结果见图5。克氏原螯虾虾头经过自溶,蛋白酶解液的腥味和苦味有所减少,同时鲜味和醇厚感味显著增加(P<0.05)。虾头蛋白在自溶过程中,随着内源蛋白酶的作用,虾头蛋白被分解为小分子肽和游离氨基酸。克氏原螯虾虾头自溶后蛋白酶解液中的鲜味,主要来源于酶解过程中产生的鲜味和甜味氨基酸[19]。与氨基酸相比,小分子肽的鲜味较弱,主要赋予食品可口的味觉,能与其他呈味物质相互协调构建令人愉悦的风味,如IMP与Glu-Glu有协同效应[20-21]。自溶后小分子肽含量增加,使得虾头自溶酶解产物的醇厚感和后味得以提升。
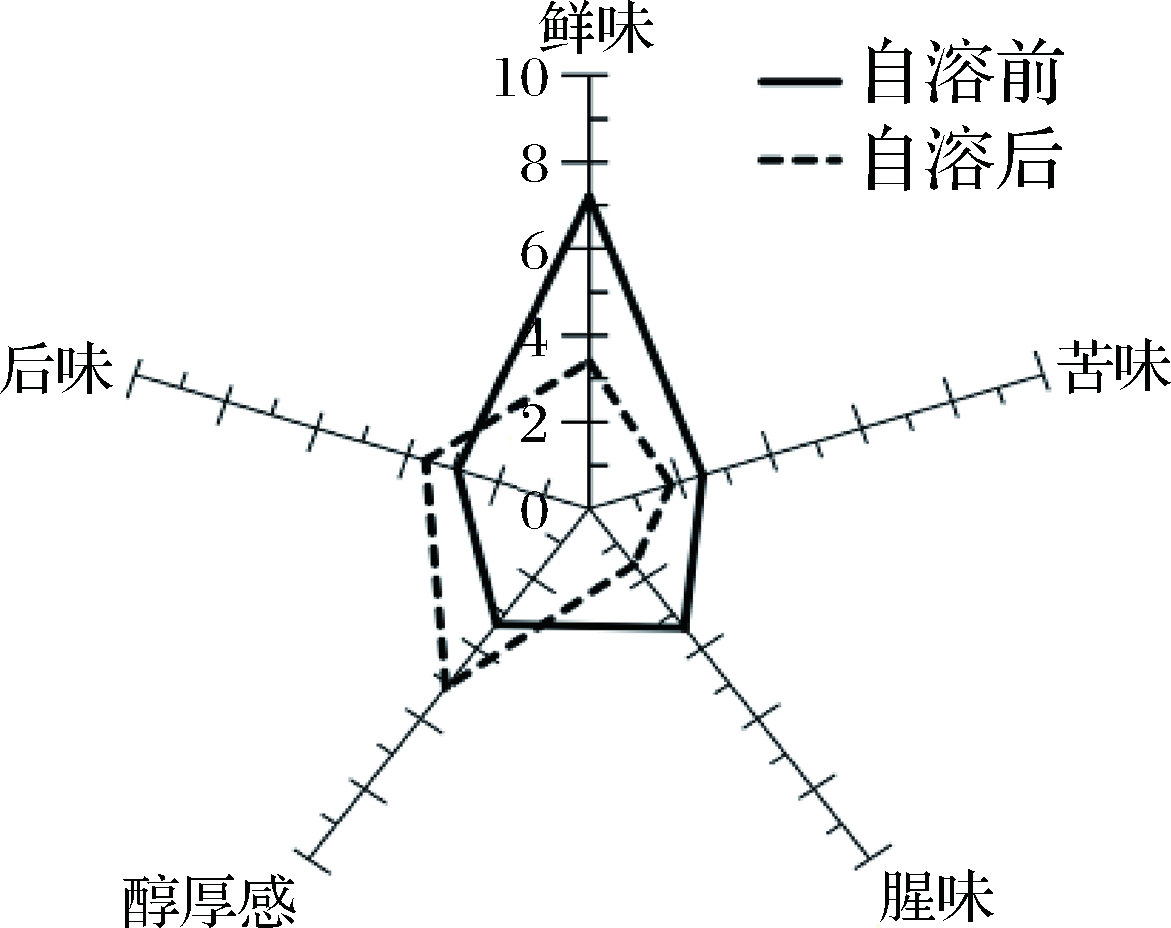
图5 紫外诱导克氏原螯虾虾头原液和自溶产物的
感官评价
Fig.5 Sensory evaluation of procambarus clarkia head
original fluid and autolysis products
2.3.2 克氏原螯虾虾头自溶前后游离氨基酸含量的变化
克氏原螯虾虾头原液和自溶产物中游离氨基酸含量如表4所示。游离氨基酸是克氏原螯虾虾头自溶产物鲜味物质的重要组成成分。鲜味氨基酸主要指一些具有鲜味的L型天然氨基酸,如天冬氨酸(Asp)、谷氨酸(Glu,俗称味精)、甘氨酸(Gly)、丙氨酸(Ala),其中谷氨酸一钠(monosodium glutamate,MSG)是鲜味物质的典型代表[19]。除此之外,苯丙氨酸和酪氨酸具有特殊的鲜甜味,对虾头酶解液的整体鲜味也有重要作用。
虾头经过自溶后,其自溶产物中游离氨基酸总量为8 605.45 mg/kg,与虾头原液相比,增加了1.29倍,其中精氨酸、赖氨酸、亮氨酸、丙氨酸、苯丙氨酸的含量较高,均在700 mg/kg以上,此5种氨基酸即占游离氨基酸总量的51.53%。在所有氨基酸当中,精氨酸含量最高,为1 085.37 mg/kg。精氨酸是略带苦味的甜味氨基酸,与其他氨基酸相互协调,具有增加醇厚感和提高鲜度的作用[22]。与虾头原液相比,克氏原螯虾虾头自溶产物中丙氨酸(Ala)、谷氨酸(Glu)、甘氨酸(Gly)、天冬氨酸(Asp)4种呈鲜味的氨基酸总含量增加1.41倍,达2 150.12 mg/kg,占游离氨基酸总量的24.99%,其中丙氨酸的含量较高为816.33 mg/kg。虾头经过自溶之后,蛋白酶解产生大量氨基酸,使得自溶产物的鲜味大大提升,整体滋味更加醇厚鲜美。虾肉及其酶解产物中游离氨基酸的含量和组成,对其滋味的鲜美程度有着重要的影响作用,特别是丙氨酸、谷氨酸和甘氨酸这3种氨基酸的影响最大,这一发现与田申等[12]、沈月新等[23]的研究结果相一致。
表4 克氏原螯虾虾头原液和自溶产物中游离氨基酸的含量
Table 4 The concent of free amino acids in Procambarus
clarkia head original fluid and autolysis products

注:鲜味氨基酸包括天门冬氨酸、谷氨酸、甘氨酸、丙氨酸。
2.3.3 克氏原螯虾虾头自溶前后呈味核苷酸及其关联化合物含量的变化
核苷酸及其关联化合物是影响克氏原螯虾虾头自溶产物中鲜味的另一关键成分。一般认为,鸟苷酸(GMP)和肌苷酸(IMP)具有突出的鲜味,是食品工业中常用的鲜味剂[19]。AMP具有协调整体滋味的作用,能够压抑苦味增强整体的醇厚感,使食物产生较为柔和的甜味和鲜味。ATP降解得到的一种最终产物——次黄嘌呤会产生苦味,会使产物整体滋味变差[24-25]。据报道,在鱼虾贝等生物体内,核苷酸化合物主要由核苷酸的降解途径以及降解程度来决定的。ATP的降解存在两条途径[26]:(1)ATP→ADP→AMP→ADR→HxR→Hx;(2)ATP→ADP→AMP→IMP→HxR→Hx。由表5结果可知,克氏原螯虾虾头原液和自溶产物中呈味核苷酸及其关联化合物总含量变化不大(P>0.05)。自溶产物中HxR含量最高,为188.43 mg/kg,其次是Hx含量为77.46 mg/kg,而与鲜味有着密切联系的IMP含量分别为8.36 mg/kg,增加了47.18%。自溶前后,虾头中ATP的含量变化最大,从8.08 mg/kg降低到3.12 mg/kg,原因可能为自溶过程中ATP降解为其他物质。
表5 克氏原螯虾虾头原液和自溶产物中ATP以及
关联化合物的含量
Table 5 Contents of ATP related compounds in
Procambarus clarkia head original fluid and autolysis
products

注:*表示反应前后含量差异显著(P<0.05);ND表示未检测出。
3 结论
克氏原螯虾虾头中含有丰富的内源酶,通过紫外线照射可以诱导其发生自溶反应。通过响应面中心组合设计优化紫外诱导克氏原螯虾虾头自溶工艺参数,从而建立以紫外照射时间、自溶初始pH和自溶温度3个因素对克氏原螯虾虾头水解度的回归模型:Y=44.17+1.43A+1.44B-1.20AC-5.05A2-4.63B2-1.66C2。经过验证试验证明,该模型可以预测克氏原螯虾虾头自溶水解度的变化规律,适用于实际生产中的预测。根据回归模型,得到最佳自溶条件为:紫外照射时间22.94 min,自溶初始pH 7.16,温度50.06 ℃,自溶时间3 h。在此条件下克氏原螯虾虾头水解度达44.39%。
通过感官评价和理化指标,对克氏原螯虾虾头原液和自溶产物中的鲜味物质进行分析,结果表明,克氏原螯虾虾头经过自溶后,其腥味和苦味降低的同时,鲜味和醇厚感显著增加(P<0.05);与虾头原液相比,自溶产物中鲜味氨基酸总量(2 150.12 mg/kg)和游离氨基酸总量(8 605.45 mg/kg)均显著增加,分别增加了1.41倍和1.29倍;呈味核苷酸及其关联化合物总量变化不大(P>0.05),与鲜味有着密切联系的肌苷酸(IMP)为8.36 mg/kg,增加了47.18%。本实验结果为虾类加工副产物的高值化利用提供理论基础。
参考文献
[1] 孔一颖,廖静. 我国成为世界最大的小龙虾生产国[J]. 海洋与渔业, 2017(9): 30-31.
[2] 王蕊. 克氏原螯虾的营养保健功能及相关食品的研究与开发[J]. 水产科技情报, 2008, 35(1):24-27.
[3] 陆剑锋,赖年悦,成永旭. 淡水小龙虾资源的综合利用及其开发价值[J]. 农产品加工(学刊), 2006(10): 47-52.
[4] 李松林. 克氏螯虾虾壳Protamex蛋白酶水解物的抗氧化活性[J]. 食品与发酵工业, 2012, 38(12): 83-86.
[5] 李冬梅,李欢,李世伟,等. 虾头蛋白酶解对热反应型虾味香精风味特征的影响[J]. 食品与发酵工业, 2015, 41(6):59-64.
[6] 赵利,李婷,汪清,等. 克氏原螯虾蛋白肽的制备及其抗氧化性的研究[J]. 中国调味品, 2017, 42(6):22-28.
[7] 钱飞,陈焱,刘海英,等. 克氏原螯虾虾头酶解工艺的研究[J]. 食品工业科技, 2009,30(6):271-274.
[8] 汪清,李婷,陈丽丽,等. 克氏原螯虾蛋白肽及其美拉德反应产物抗氧化活性的研究[J]. 江西水产科技, 2017(2):3-8.
[9] MEUNPOL O, HALL M R, KAPOOR V. Partial characterisation and distribution of kynurenine aminotransferase activity in the Black Tiger prawn(Penaeus monodon)[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 1998, 120(1): 139-143.
[10] OSNES K K,MOHR V. On the purification and characterization of three anionic,serine- type peptide hydrolases from Antarctic krill,Euphausia superba[J]. Comparative Biochemistry and Physiology Part B: Comparative Biochemistry, 1985, 82(4):607-619.
[11] 庄志凯,吉宏武. 南美白对虾虾头内源酸性蛋白酶的分离纯化及其酶学特性研究[J]. 食品工业科技, 2012, 33(18):116-120.
[12] 田申,李贻杰,曹文红,等. 利用虾头内源酶模拟胃肠道消化制备短肽的研究[J]. 食品工业科技, 2016, 37(9):92-96.
[13] 朱国萍,曹文红,章超桦,等. 凡纳滨对虾虾头自溶过程中游离氨基酸的释放规律及产物的分子质量分布[J]. 食品与发酵工业, 2010,36(2):66-70.
[14] 曹文红,章超桦,洪鹏志,等. 响应面法优化南美白对虾虾头自溶工艺的研究[J]. 中国食品学报, 2009, 9(1):158-164.
[15] 章雪琴,吉宏武,张迪,等. 南极磷虾微生物复合发酵制备呈味基料的工艺优化[J]. 食品与发酵工业, 2018, 44(3): 107-113.
[16] 杨锡洪,章超桦,解万翠,等. 虾头自溶脱蛋白法制备壳聚糖的新工艺[J]. 现代食品科技, 2008, 24(7): 667-670.
[17] 刘先进,陈胜军,李来好,等. 四种鲍鱼肌肉营养成分分析与品质评价[J]. 食品与发酵工业, 2018, 44(5): 227-231.
[18] 伍彬,章超桦,吉宏武,等. 南美白对虾虾头自溶产物主要呈味成分分析[J]. 食品科学, 2010, 31(10):184-187.
[19] NINOMIYA K. Umami: a universal taste[J]. Food Reviews International, 2002,18(1): 23-28.
[20] FLORES M, ARISTOY M C, SPANIER AM, et al. Non-volatile components effects on luality of“Serrano”dry-cured ham as related to processing time[J]. Food Science,1997, 62(6):1 235-1 239.
[21] 王曜,陈舜胜. 野生与养殖克氏原螯虾游离氨基酸的组成及比较研究[J]. 食品科学, 2014, 35(11):269-273.
[22] 贠三月,邱伟强,蒋晨毓,等. 凡纳滨对虾虾肉和虾头中风味物质的比较[J]. 水产学报, 2017, 41(6):907-918.
[23] 沈月新. 水产食品学[M]. 北京:中国农业出版社, 2001: 100-102.
[24] BREMNER H A, OLLEY J. Nucleotide catabolism: influence on the storage life of tropical species of fish from the north west shelf Australia[J]. Food Science, 1988, 53(1): 6-11.
[25] 王丹妮,邱伟强,陈舜胜,等. 冷藏条件下缢蛏、文蛤ATP关联产物的变化及降解途径的探究[J]. 食品与发酵工业, 2016, 42(9): 230-233.