野木瓜(Stauntonia chinensis)别称皱皮木瓜、铁脚梨等,为我国特有果木之一,属蔷薇科灌木丛植物,享有“百益之果”的美称[1],富含氨基酸、多种维生素、矿物质等营养素,以及黄酮、皂苷类、原花青素、有机酸和酶等生理活性物质。但其糖酸比低,口感酸涩坚硬,不宜作为普通水果食用。野木瓜果酒是以新鲜野木瓜为原料,人工添加酿酒酵母酿制而成,其色泽明亮、酸甜适口、香气醇厚,且保留了野木瓜的营养成分。
香气是评价野木瓜果酒品质的重要指标。目前,果酒香气的研究主要集中在具有挥发性、半挥发性的芳香物质上,而芳香物质的提取是关键环节,果酒香气的定性与定量分析结果与其有直接的关系。国内外大量的基础研究[2-5]丰富了果酒的香气提取方法,但同时采用不同方法对果酒香气进行提取并比较不同方法间的差异鲜见报道。
香气提取方法主要有同时蒸馏法(simultaneous distillation extraction,SDE)、space-solid phase micro法和MMSE法,SDE法是通过同时加热样品与有机溶剂至沸腾实现蒸馏与提取同时进行浓缩香气的方法;SPME法是通过具有吸附挥发性物质能力的纤维头来富集样品的香气物质;MMSE法是利用兼具硅胶、活性炭和十八烷基硅烷键合硅胶(ostade-cylsilane, ODS)基团的复合吸附剂来吸附样品香气物质。因此,本试验采用上述3种方法分别对野木瓜果酒风味物质进行提取,用GC-MS结合保留指数进行定性分析,选出适宜于野木瓜果酒香气物质的提取方法,并初步确定野木瓜果酒的主体香气成分。
1 材料与方法
1.1 材料与试剂
野木瓜:2017年10月份采收于重庆市綦江区安琪SY酿酒酵母:安琪酵母股份有限公司;KHCO3、K2S2O5、NaCl、CH2Cl2、Na2SO4:分析纯,成都科龙化工试剂厂;果胶酶:酶活≥500 000 U/g,成都科龙化工试剂厂;正构烷烃混合标品(C3~C9、C10~C25):色谱纯,百灵威科技有限公司;2-辛醇:色谱纯,sigma公司;无水乙醇:色谱纯,成都科龙化工试剂厂;酵母营养添加物:法国LAFFORT公司;蔗糖:市售。
1.2 仪器与设备
榨汁机(HR-2003),飞利浦中国投资公司;恒温恒湿培养箱(LHS-50SC),上海齐欣科学仪器有限公司;酸度计(PB-10),德国赛多利斯集团;紫外可见分光光度计(UV1000),上海天美科学仪器有限公司;手持式糖度计(WZS-32),上海仪电物理光学仪器有限公司;氮吹仪(JHD-002),上海极恒实业有限公司;固相萃取整体捕集剂(MonoTrap DCC18)、联用仪(QP2010),日本岛津公司;手动进样器、50/30 μm DVB/CAR/PDMS固相微萃取头,美国supelco公司;同时蒸馏萃取装置,北碚区特种玻璃仪器厂。
1.3 试验方法
1.3.1 野木瓜果酒的酿制
挑选成熟无霉变的野木瓜,清洗,去皮籽,切碎,按1∶1(质量比)加水打浆,制成野木瓜汁,加入质量分数为0.02%果胶酶,搅拌均匀,45 ℃酶解3~4 h,再加入偏重亚硫酸钾,1 L酒液中含100 mg SO2。添加蔗糖、KHCO3,调整野木瓜汁外观糖度为22 °Brix,pH值为3.50,准备接种发酵。取上述野木瓜汁800 mL置于1 000 mL发酵锥形瓶中,控制发酵温度为22 ℃,添加质量分数为0.1%的安琪SY活性干酵母粉,同时加入0.3 g/L酵母营养添加物。发酵至外观糖度不变,认为发酵结束。分离酵母,密封阴凉处贮藏酒液。
1.3.2 香气提取方法
1.3.2.1 同时蒸馏法
取200 mL野木瓜果酒置于500 mL平底烧瓶中,连入SDE装置的样品瓶端,用电炉加热至沸。装置另一端接入装有50 mL重蒸二氯甲烷的圆底烧瓶,40 ℃水浴加热。萃取过程中,由于水与二氯甲烷不相混溶,在U型管中形成明显的分界线,且不断流向两侧烧瓶。连续萃取2 h后,将萃取液置于冰箱冷冻室24 h。取出并除去冰块,用无水硫酸钠脱水处理后,氮吹浓缩至1 mL,取0.5 μL浓缩液进样分析。参照袁仲等优化后的方法修改[6]。
1.3.2.2 固相微萃取法
取8 mL酒液放入20 mL萃取瓶中,加入2 g NaCl促进香气的挥发。用聚四氟乙烯隔垫密封,于45 ℃下水浴平衡15 min后,插入活化好了的萃取头,顶空吸附40 min后,插入到GC进样口解析5 min。参照任晓宇等优化后的方法修改[7]。
1.3.2.3 固相萃取整体捕集剂法
取8 mL酒液于20 mL萃取瓶中。将MonoTrap的中间孔套入顶空杆,并穿过瓶盖,使MonoTrap DCC18悬挂于样品上方,60 ℃水浴90 min。取出吸附剂,置于另一萃取小瓶中,加入600 μL重蒸二氯甲烷,超声波提取5 min后,氮气吹扫浓缩至数微升,取1 μL进样。参照高韶婷等优化的方法修改[8]。
1.3.3 GC-MS分析条件
GC条件:DB-5MS石英毛细管柱(30 m×0.25 mm×0.25 μm);进样口温度为230 ℃;升温程序为35 ℃保持4 min,以5 ℃/min升至55 ℃,保持2 min,再以8 ℃/min升至120 ℃,再以10 ℃/min升至230 ℃,保持4 min。载气为氦气,流速1 mL/min,压力47.7 kPa。分流比为5∶1。
MS条件:电离方式EI;电子能量70 eV;离子源温度230 ℃;采集模式;全扫描(Scan);四级杆温度150 ℃;质量扫描范围m/z 40~450;扫描速率769 u/s。参照田亮[9]方法修改。
1.3.4 香气成分定性与定量
由GC-MS分析所得的质谱图经计算机自带的NIST 08谱库检索,并结合保留指数进行定性。
保留指数的测定:将正构烷烃标准品C3~C9、C10~C25溶于甲醇,配制适宜浓度,按条件1.3.2.2进样,得标准谱图。取其保留时间,按照程序升温计算公式计算保留指数,并与谱库自带物质保留指数进行对照。
![]()
(1)
式中:tx、tn和tn+1分别为被分析组分、碳原子数处于n和n+1的正构烷烃(tn<tx<tn+1)的流出峰保留时间[10]。
半定量法确定各香气成分在野木瓜果酒中的含量,具体操作方法如下:取20 μL标准溶液置于8 mL酒液中,标准物质在混合体系中的浓度为1 225.4 μg/L,以峰面积归一化法,按照下列公式计算各香气物质含量:
香气物质含量![]()
(2)
式中,校正因子f计为1。样品重复3次,计算平均值及标准差。
1.3.5 主体香气成分的确定
气味活化值(odor activity value,OAV)是指气味物质浓度与其阈值的比值,它可以反映各香气物质对野木瓜果酒整体香气的贡献情况,计算公式为:
OAV=cx/OTx
式中:cx,化合物X在饮料酒中的含量;OTX,化合物X在饮料酒中的阈值。一般认为,OAV>1的成分为样品主体呈香化合物,OAV值越大,对香气贡献越显著[11]。
2 结果与分析
2.1 三种萃取方法提取野木瓜果酒挥发性成分的比较
质谱结合保留指数对野木瓜果酒中的风味物质进行定性分析,发现3种萃取方法所得风味物质差异明显,检测的具体风味物质及相对含量如表1所示。
3种萃取风味物质的方法共检测出75种风味物质,主要有醇类、酯类、酸类、醛酮类、芳香族类、萜类以及其他化合物。其中,SDE法检测出36种风味物质,SPME法检测出42种风味物质,MMSE法检测出36种风味物质。3种方法共同检出异戊醇、正己醇、苯乙醇、乙酸异戊酯、3-羟基丁酸乙酯、己酸乙酯、辛酸乙酯、癸酸乙酯、棕榈酸乙酯、对甲基苯乙酮、丁香酚等物质。
表1 SDE、SPME、MMSE萃取野木瓜果酒风味物质
Table 1 Aroma components of Stauntonia chinensis wine extracted by SDE、SPME、MMSE
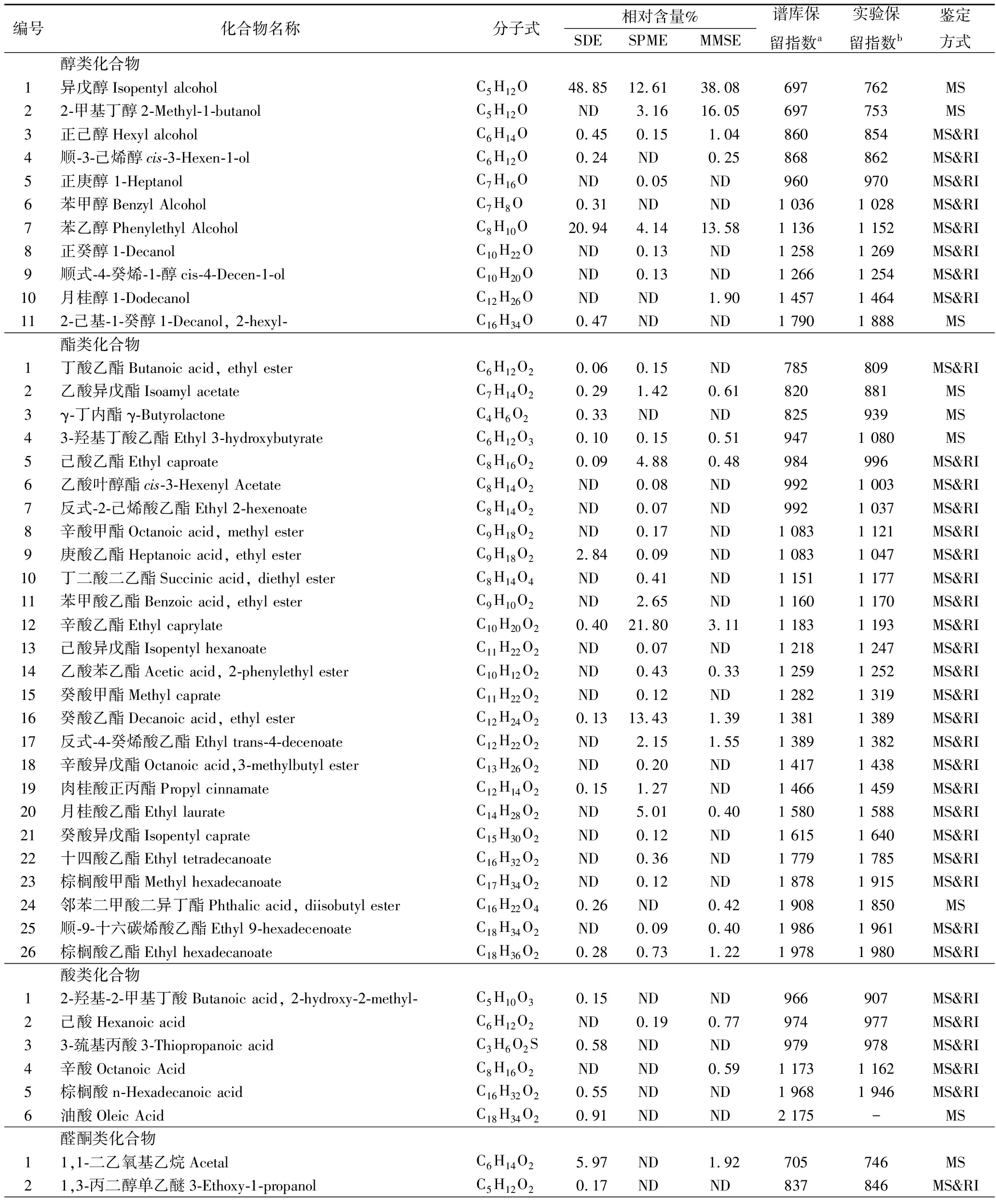
续表1
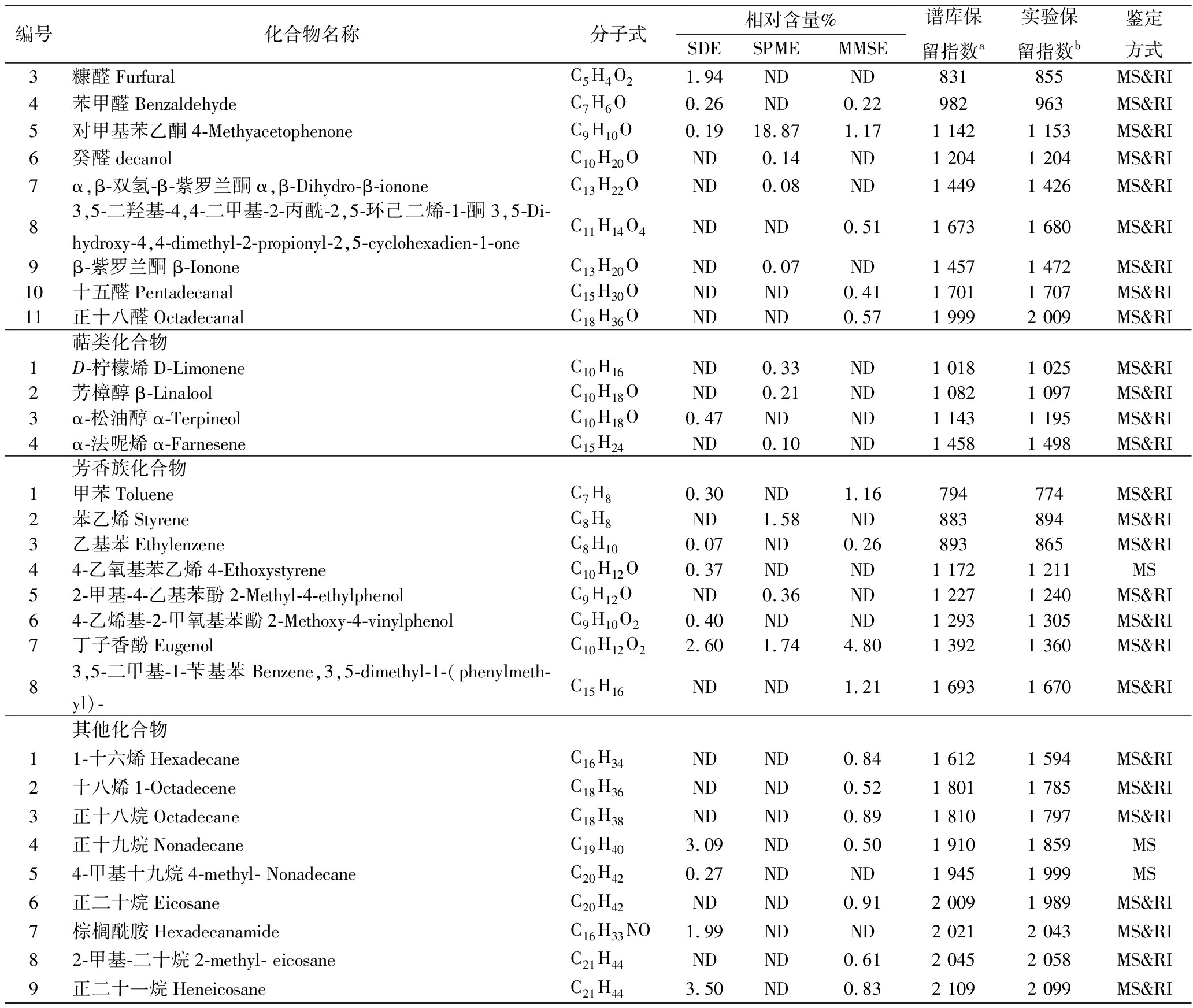
注:a表示NIST 08谱库中各物质的保留指数;b表示各物质流经色谱柱DB-5MS分离计算保留指数;MS表示质谱定性,RI表示保留指数定性;“ND”表示未检出。
为了更直观讨论3种方法提取醇类、酯类、酸类、醛酮类、芳香族类、萜类以及其他化合物的情况,根据表1,作出各类物质种类数量图(图1),各类物质总相对含量图(图2)。

图1 SDE、SPME和MMSE萃取香气物质种类数量比较
Fig.1 The comparation of the quantity of aroma compounds
by SDE,SPME,MMSE
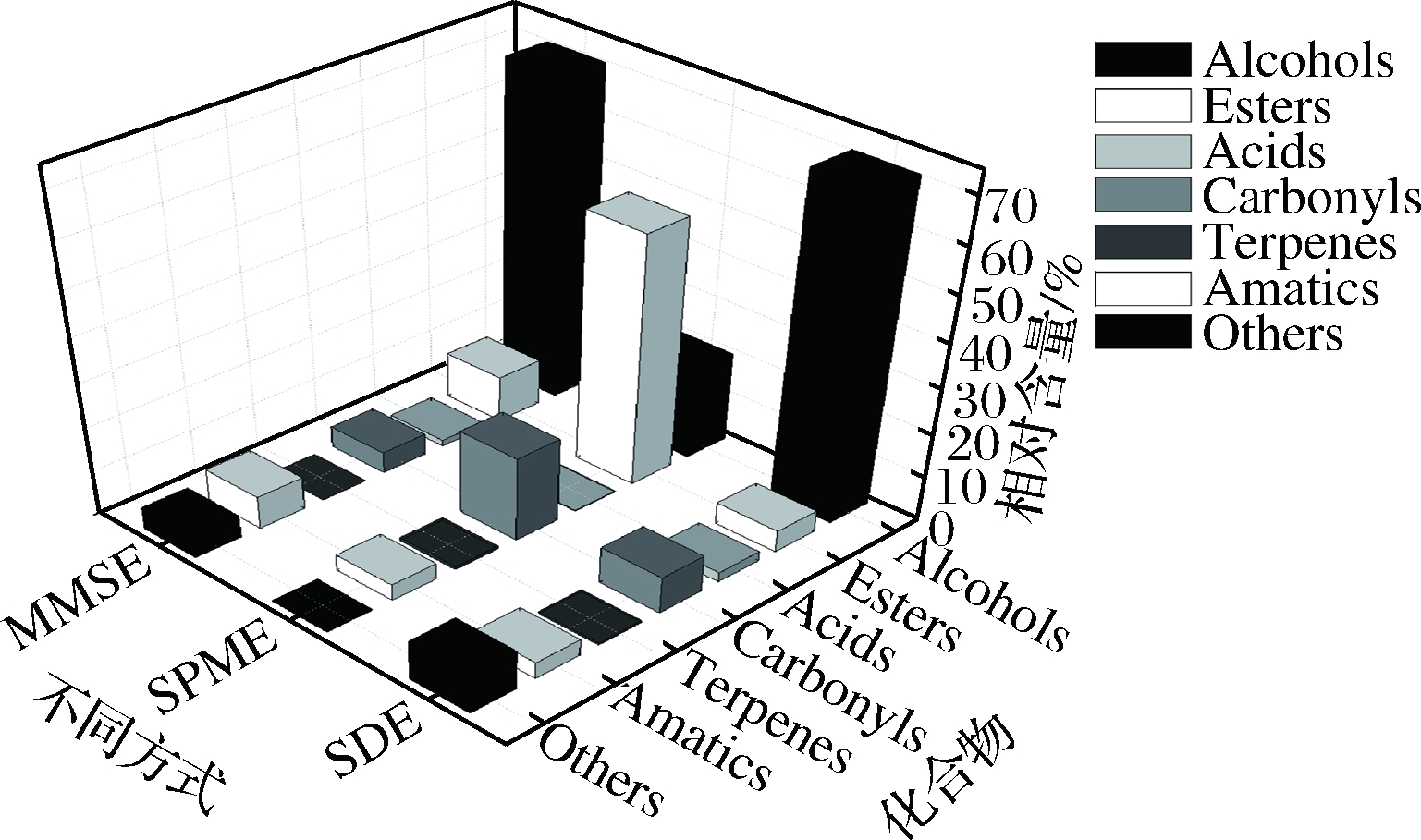
图2 SDE、SPME和MMSE萃取香气物质相对含量比较
Fig.2 The comparation of the relative content of aroma
compounds by SDE,SPME,MMSE
醇类物质是果酒中的主要风味物质,包括乙醇、甘油(由于设置溶剂延迟,未检出)和高级醇,高级醇赋予果酒强烈的溶剂和杂醇油香气[12]。醇类物质提取方面,SDE法与MMSE法提取醇类物质总相对含量较高,分别达到71.27%和70.89%,SPME法提取的醇类物质相对含量为20.37%(图2)。3种方法均能提取异戊醇、正己醇和苯乙醇,其中,异戊醇和苯乙醇相对含量较高,异戊醇普遍存在于果酒中,其具有苦杏仁味;苯乙醇是一种具有玫瑰花香气的化合物,来源于酵母代谢,是果酒主要特征香气成分[13-15]。此外还检出了2-甲基丁醇、正己醇、顺-3-己烯醇、正庚醇、苯甲醇、2-己基-1-癸醇、顺式-4-癸烯-1-醇、正癸醇、月桂醇等。
酯类化合物是酵母进行酒精发酵时的次级代谢产物,根据形成途径的不同分为乙酸酯类化合物和乙酯类化合物。一般而言,果酒中酯类化合物阈值普遍较低,对于果酒整体风味的形成贡献显著。酯类物质提取方面,SPME法具有明显优势,其提取出24种酯类物质,占总挥发性化合物的55.96%。SDE法和MMSE法均提取出11种酯类物质,占比分别为4.94%、10.41%。究其原因,可能是SPME提取香气条件温和,极大地提取了低沸点的酯类化合物。而另外两法提取时间较长,酯类物质可能发生分解或者氮吹过程有损耗,导致酯类物质检出较少。从检出酯类物质相对含量来说,MMSE法优于SDE法。3种方法均检出乙酸异戊酯、3-羟基丁酸乙酯、己酸乙酯、辛酸乙酯、癸酸乙酯、棕榈酸乙酯[16-17]。另外,SPME法检测出的苯甲酸乙酯、反式-4-癸烯酸乙酯、乙酸苯乙酯、月桂酸乙酯占比也较高,它们可能为果酒重要呈香物质。
酸类化合物为发酵副产物,是果酒酸臭气味的主要来源,文中共检出6种酸类物质,包括2-羟基-2-甲基丁酸、己酸、3-巯基丙酸、辛酸、棕榈酸、油酸。SDE法检出酸的碳链较长,如棕榈酸、油酸,而SPME法和MMSE法检测均为短链酸,如己酸和辛酸。SDE法对中等高沸点的成分萃取回收率较高,而SPME法和MMSE法则对低沸点的成分比较敏感[18]。
醛酮类化合物的产生一般源于醇的氧化或是酸的还原,也有部分来源于糖代谢,它们是果酒重要的呈味物质[19]。MMSE法提取醛酮类物质种类最多,为6种,SPME法和SDE法均提取出4种。其中,3种方法均提取出对甲基苯乙酮,SPME法提取该物质占比达到18.87%。对甲基苯乙酮具有山楂子花的芳香,并伴随着紫苜蓿、蜂蜜、草莓香气,果酒香气研究中鲜有报道该物质,可能为野木瓜果酒的特征香气物质。
萜类化合物主要来源于原料本身,为植物体内乙酰辅酶CoA合成的次级代谢产物,一般以游离态和糖苷结合态存在于果实中[20]。果实经酵母发酵之后,萜类化合物占比大大减少,仅为0.47%~0.65%(表1)。本文3种方法共检出4种萜类化合物,分别为D-柠檬烯、芳樟醇、α-松油醇、α-法呢烯。
芳香族化合物的提取方面SDE法和MMSE法检出率较高,可能与这2种方法都使用有机溶剂提取有关。另外,3种方法均检出丁香酚,相对含量检出为1.74%~4.80%,其具有典型丁香香气,且阈值很低,为6 μg/L[21],或为野木瓜果酒重要呈香物质。
3种方法共检出其他化合物共9种,主要为烷烃类化合物,此类物质不是野木瓜果酒的呈香物质,MMSE法提取该类物质最多,可能与其架构含有活性炭有关。综合比较SDE法、SPME法和MMSE法提取野木瓜果酒香气成分的提取特性,发现SDE法对大分子量、高沸点的醇类、酸类提取效果较好,其提取酯类物质能力较差;SPME法提取低沸点的醇类、酯类、醛酮类化合物效果最优。MMSE法对醇类、酯类、醛酮类、芳香族类化合物提取效果优良,但对酯类物质提取效果不及SPME。SDE法由于提取风味物质时,加热温度过高,易产生衍生物,有香气失真的可能。SPME法和MMSE法提取样品均符合简便、安全、溶剂少、效率高等特点,对于果酒风味物质的提取具有一定的互补性。MMSE作为一种新型的香气富集剂,还需进一步研究探讨。
就野木瓜果酒而言,SPME法提取的风味物质较多,且能较大程度地提取果酒香气形成的主要物质——醇酯类物质[22-24]。另外,该法简单、清洁、高效,适宜用来对野木瓜果酒香气进行提取研究。
2.2 野木瓜果酒主体香气成分的确定
为了获得野木瓜果酒的主体香气成分,采用SPME法对野木瓜果酒挥发性、半挥发性成分进行提取,并定性定量分析,计算各香气成分的含量。查询文献中各香气成分在果酒中的阈值,计算活化值,从而确定野木瓜果酒的主体香气成分。
由表2中可知,乙酸异戊酯、己酸乙酯、苯甲酸乙酯、辛酸乙酯、癸酸乙酯、癸醛、芳樟醇、丁香酚的OAV值大于1,可认为它们为野木瓜果酒主体香气成分。另外,对甲基苯乙酮含量较高(2 728.21±218.15 μg/L),具有山楂子花芳香,阈值未知,可能为野木瓜果酒的重要呈香成分。异戊醇、苯乙醇、乙酸苯乙酯、月桂酸乙酯、辛酸、癸酸等OAV值在0.1~1之间,对果酒整体香气形成也有一定影响。
表2 野木瓜果酒主体香气成分的含量、阈值、
香气值及香气描述
Table 2 Concentrtions, odour thresholds, OAV, odor
description of the main compounds in Stauntonia
chinensis wine
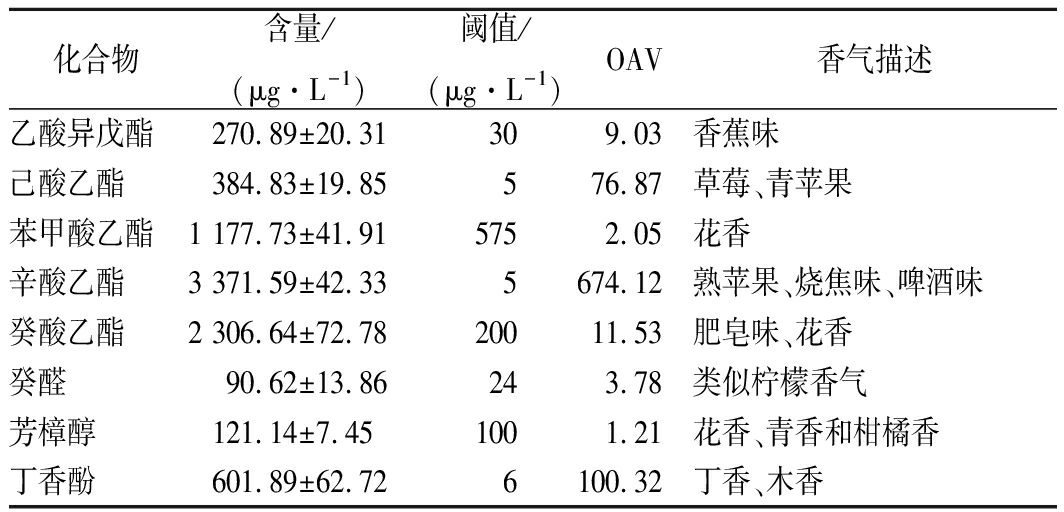
注:表中仅列出OAV>1的香气成分。
3 结论与讨论
本文通过SDE法、SPME法和MMSE法检测出野木瓜果酒风味物质75种,主要有醇类、酯类、酸类、醛酮类、芳香族类、萜类以及其他化合物,认为覆盖了野木瓜果酒的基本风味物质。比较SDE法、SPME法和MMSE法提取野木瓜果酒风味物质的特性,发现SDE法对大分子量、高沸点的醇类、酸类提取效果较好,其提取酯类物质能力较差;SPME法提取低沸点的醇类、酯类、醛酮类效果最优。MMSE法对醇类、酯类、醛酮类、芳香族类化合物提取效果优良,但对酯类物质提取效果不及SPME。就野木瓜果酒而言,选择SPME法即可满足香气提取研究要求。依据香气活化值,确定野木瓜果酒主体风味成分为乙酸异戊酯、己酸乙酯、苯甲酸乙酯、辛酸乙酯、癸酸乙酯、癸醛、芳樟醇、丁香酚。
参考文献
[1] 潘红梅,游敬刚,柏红梅,等. 野木瓜饮料的工艺研究[J]. 食品与发酵科技, 2011, 47(6):92-95.
[2] BOSCH-FUSTÉ J, RIU-AUMATELL M, GUADAYOL J M, et al. Volatile profiles of sparkling wines obtained by three extraction methods and gas chromatography-mass spectrometry (GC-MS) analysis[J]. Food Chemistry, 2007, 105(1): 428-435.
[3] 廖永红,赵爽,张毅斌,等. LLE, SDE, SPME和GC-MS结合保留指数法分析二锅头酒中的风味物质[J]. 中国食品学报, 2014,14(6): 220-228.
[4] BLANCH G P, REGLERO G, HERRAIZ M. Rapid extraction of wine aroma compounds using a new simultaneous distillation-solvent extraction device[J]. Food Chemistry, 1996, 56(4): 439-444.
[5] GAMERO A, WESSELINK W, DE JONG C. Comparison of the sensitivity of different aroma extraction techniques in combination with gas chromatography-mass spectrometry to detect minor aroma compounds in wine[J]. Journal of Chromatography A, 2013, 1 272: 1-7.
[6] 袁仲,马绮云,杨继远. 液液萃取和同时蒸馏萃取与气质联用分析国产食醋香味成分[J]. 食品科学, 2010, 31(4): 226-229.
[7] 任晓宇, 张少云, 裴晓静,等. 红枣白兰地中香气成分的顶空固相微萃取条件优化[J]. 食品工业科技, 2018,39(7):119-122.
[8] 高韶婷, 宋雪, 陈乐,等. 基于固相萃取整体捕集剂-气相色谱-质谱金华火腿挥发性风味物质分析[J]. 食品科学, 2015, 36(22):113-116.
[9] 田亮,王文平,吴国卿,等. 发酵型野木瓜果酒加工工艺研究[J]. 中国酿造, 2010, 29(11): 177-179.
[10] FAN W, QIAN M C. Characterization of aroma compounds of Chinese “Wuliangye” and “Jiannanchun” liquors by aroma extract dilution analysis[J]. Journal of Agricultural and Food Chemistry, 2006, 54(7): 2 695-2 704.
[11] 范文来,徐岩. 酒类风味化学[M]. 北京:中国轻工业出版社,2014.
[12] HAZELWOOD L A, DARAN J M, VAN MARIS A J A, et al. The ehrlich pathway for fusel alcohol production: a century of research on Saccharomyces cerevisiae metabolism [J]. Applied and Environmental Microbiology, 2008, 74(8): 2 259-2 266.
[13] 范文来,徐岩,李记明,等. 应用GC-O和GC-MS研究蛇龙珠葡萄酒游离态挥发性香气成分[J]. 食品与发酵工业, 2011, 37(11): 183-188.
[14] 汪立平,徐岩,赵光鳌,等. 顶空固相微萃取法快速测定苹果酒中的香味物质[J]. 无锡轻工大学学报, 2003, 22(1): 1-6.
[15] 盖禹含,辛秀兰,杨国伟,等. 不同酵母发酵的蓝莓酒香气成分GC-MS分析[J]. 食品科学, 2010,31(4): 171-174.
[16] SUMBY K M, GRBIN P R, JIRANEK V. Microbial modulation of aromatic esters in wine: current knowledge and future prospects[J]. Food Chemistry, 2010, 121(1): 1-16.
[17] FAN W, XU Y, JIANG W, et al. Identification and quantification of impact aroma compounds in 4 nonfloral Vitis vinifera varieties grapes [J]. Journal of Food Science, 2010, 75(1): 81-88.
[18] 党亚丽,王璋,许时婴. 同时蒸馏萃取和固相微萃取与气相色谱/质谱法结合分析巴马火腿的风味成分[J]. 食品与发酵工业, 2007, 33(8): 132-137.
[19] ZAPATA J, MATEO-VIVARACHO L, CACHO J, et al. Comparison of extraction techniques and mass spectrometric ionization modes in the analysis of wine volatile carbonyls[J]. Analytica Chimica Acta, 2010, 660(1): 197-205.
[20] CABRITA M J, FREITAS A M C, LAUREANO O, et al. Glycosidic aroma compounds of some Portuguese grape cultivars [J]. Journal of the Science of Food and Agriculture, 2006, 86(6): 922-931.
[21] FERREIRA V, L PEZ R, CACHO J F. Quantitative determination of the odorants of young red wines from different grape varieties[J]. Journal of the Science of Food and Agriculture, 2000, 80(11): 1 659-1 667.
PEZ R, CACHO J F. Quantitative determination of the odorants of young red wines from different grape varieties[J]. Journal of the Science of Food and Agriculture, 2000, 80(11): 1 659-1 667.
[22] 汪立平. 苹果酒酿造中香气物质的研究[D]. 无锡:江南大学, 2004.
[23] STYGER G, PRIOR B, BAUER F F. Wine flavor and aroma[J]. Journal of Industrial Microbiology & Biotechnology, 2011, 38(9): 1 145-1 159.
[24] RAPP A, MANDERY H. Wine aroma[J]. Experientia, 1986, 42(8): 873-884.